BAB III PENGELOLAAN AIR LIMBAH
PT. UNITED TRACTORS Tbk
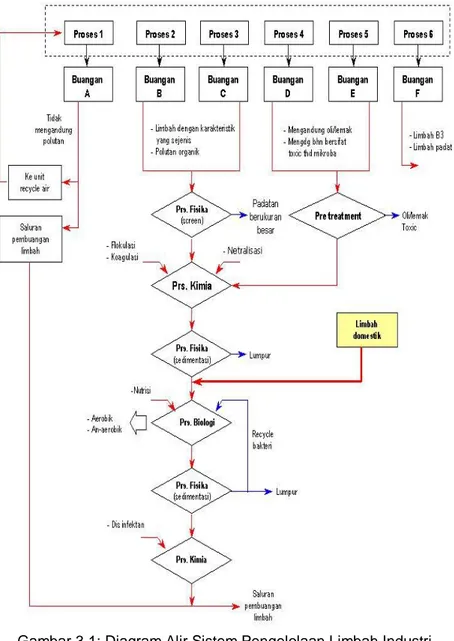
3.1. Pengelolaan Limbah Secara UmumDalam satu jenis limbah dengan karakteristik tertentu terkadang mengandung berbagai macam bahan pencemar di dalamnya, yang mana setiap jenis polutan tersebut mempunyai sifat-sifat yang berlainan. Jika menghadapi limbah seperti ini, maka diperlukan teknik-teknik untuk mengkombinasikan proses maupun sistem yang akan digunakan, yang mana sistem manajemen limbah dari sumbernya memegang peran yang sangat penting. Gambar 3.1 menunjukkan contoh diagram alir sistem pengelolaan limbah dari sumbernya.
Buangan limbah di klasifikasikan menjadi beberapa bagian yaitu limbah yang tidak mengandung polutan, limbah yang mengandung polutan organik, limbah yang mengandung oli/lemak, yang mengandung bahan yang bersifat racun (toxic) terhadap mikroba, limbah B3 (Bahan Berbahaya dan Beracun) dan limbah padat. Masing-masing karakteristik limbah diolah dengan proses-proses tertentu.
Pemilihan proses, sistem dan spesifikasi alat yang tidak tepat atau disain IPAL yang salah akan menimbulkan berbagai persoalan di dalam IPAL itu sendiri, misalnya :
biaya investasi, operasional maupun perawatannya akan menjadi mahal,
sistem tidak dapat bekerja secara optimal, hasil olahan tidak seperti yang diinginkan, sulit dalam pengendalian/operasional,
Peralatan cepat rusak (korosi, panas, tidak awet dll).
Untuk menghindari hal-hal seperti tersebut di atas, maka dalam perencanaan suatu IPAL harus dilakukan tahap demi tahap dan diikuti juga upaya minimalisasi limbah, manajemen pengelolaan limbah, sampai dengan pemilihan teknologi dan sistem.
3.2. Pengelolaan Limbah Produksi PT. United Tractors Tbk
Untuk menghindari terjadinya pencemaran terhadap lingkungan sekitar industri, maka PT. United Tractors Tbk telah membangun satu unit instalasi pengolahan air limbah produksi dan
re-use(IPAL&re-useproduksi). IPAL ini didisain oleh tim Pusat
Teknologi Lingkungan, BPPT. Saat ini IPAL telah selesai dibangun dan siap untuk dioperasikan. Untuk pengoperasian IPAL agar dapat memberikan hasil pengolahan yang optimal, maka perlu kiranya para
operator IPAL diberikan bekal teknik-teknik operasionalnya dan teknik-teknik perawatannya. Untuk pembekalan tersebut maka disusun buku panduan operasional IPAL ini.
Dengan adanya sistem IPAL yang baru ini berarti ada perubahan sistem dalam pengelolaan limbah produki dari sebelumnya. Perbedaan sistem pengelolaan tersebut adalah sebagai berikut:
Pengelolaan Limbah Sebelum Ada IPAL Produksi :
Sebelum ada IPAL produksi air limbah yang berasal dari unit produksi (bengkel) dikelola dengan sarana grease trap. Di grease trap ini berfungsi untuk memisahkan oli secara gravitasi, dan dilakukan secara bertahap. Diagram alir sistem pengelolaan limbah, foto dan denah dan sistem grease trap lama ini dapat dilihat seperti pada Gambar 3.2, 3.3 dan Gambar 3.4.
Gambar 3.2 : Pengelolaan Air Limbah Produksi Sebelum Ada IPAL Produksi
Gambar 3.3 Sarana Oil Trap Yang Lama
Gambar 3.4 : Gambar sarana grease trap lama (Sebelum Ada IPAL Produksi)
Outlet air limbah dari grease trap ini dibuang ke saluran umum, hasil
analisa limbah ini seperti terlihat pada Tabel 2.1, sedangkan secara fisik foto limbah buangan ini seperti terlihat pada Gambar 3.5.
Gambar 3.5 : Foto Air Limbah Buangan Dari Grease Trap
Air limbah yang berasal dari cuci unit dikelola dengan sarana grease
trap yang dilengkapi dengan bak pengendap. Di sini padatan yang ada
diendapkan dan oli yang terbawa dipisahkan di grease trap. Outlet air limbah ini juga langsung dibuang ke saluran umum (Lihat gambar 3.6 dan 3.7).
Gambar 3.7 : Lay Out Area Cuci Unit.
Gambar 3.6 : Foto Bak Pengendap Dan Oil Trap Di Cuci Unit
Pengelolaan Limbah Setelah Ada IPAL Produksi :
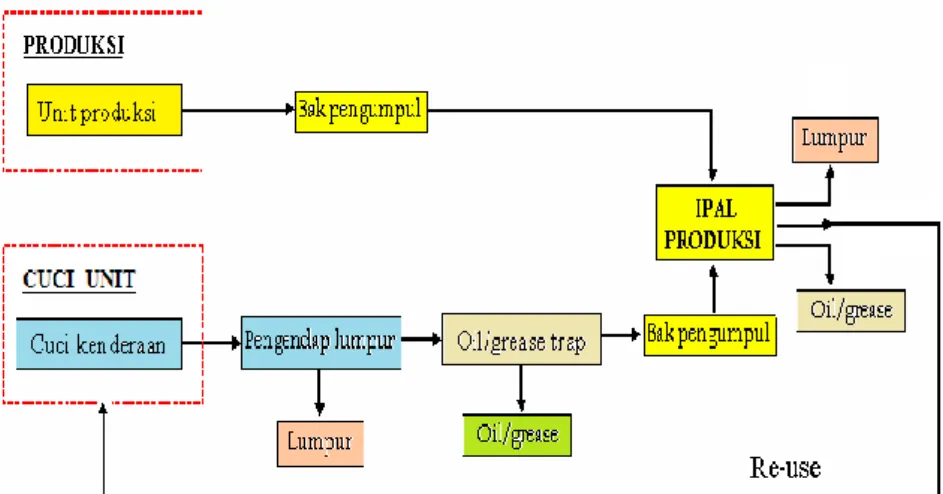
Setelah ada IPAL produksi air limbah yang berasal dari unit produksi (bengkel) dan air limbah yang berasal dari cuci unit diolah bersama di dalam IPAL produksi. Sistem pengelolaan tersebut seperti terlihat pada gambar 3.8, dimana limbah yang berasal dari limbah produksi dikumpulkan di dalam bak pengumpul lalu masuk ke IPAL dengan cara pemompaan. Sedangkan limbah yang berasal dari cuci unit dilewatkan dalam bak pengendap yang berfungsi juga sebagai oil trap lalu dipompa ke IPAL untuk diolah bersama limbah dari ruang produksi. Foto IPAL secara keseluruhan dapat dilihat seperti pada Gambar 3.9
Gambar 3.8 : Pengelolaan Air Limbah Produksi Setelah Ada IPAL Produksi
Gambar 3.9 : Foto IPAL Produksi Secara Keseluruhan.
Gambar 3.10 : Foto Bak Pengendap, Oil Trap Dan Bak Pengumpul Di Area Cuci Unit.
3.3. Teknologi IPAL PT. United Tractors Tbk.
Pengolahan air limbah bertujuan untuk menghilangkan parameter pencemar yang ada di dalam air limbah sampai batas yang diperbolehkan untuk dibuang ke badan air sesuai dengan syarat baku mutu yang diijinkan atau sampai memenuhi kualitas tertentu untuk dimanfaatkan kembali. Pengolahan air limbah secara garis besar merupakan upaya pemisahan padatan tersuspensi (solid–liquid separation), pemisahan senyawa koloid, serta penghilangan senyawa polutan terlarut. Ditinjau dari jenis prosesnya dapat dikelompokkan sebagai : proses pengolahan secara fisika, proses secara kimia, proses secara fisika-kimia serta proses pengolahan secara biologis.
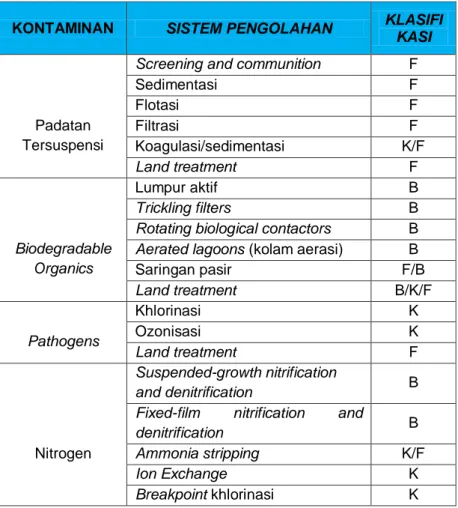
Penerapan masing-masing metode tergantung pada karakteristik limbahnya dan kualitas hasil yang diinginkan. Klasifikasi jenis proses pengolahan untuk menghilangkan senyawa pencemar dalam air limbah dapat dilihat pada Tabel 3.1.
Ditinjau dari urutannya proses pengolahan air limbah dapat dibagi menjadi tiga jenis pengolahan, yakni :
Pengolahan Primer, digunakansebagaipengolahan pendahuluan untuk menghilangkan padatan tersuspensi, koloid, serta penetralan yang umumnya menggunakan proses fisika atau proses kimia.
Pengolahan Sekunder, digunakan untuk menghilangkan senyawa polutan organik terlarut yang umumnya dilakukan secara proses biologis.
Pengolahan Tersier atau Pengolahan Lanjut, digunakan untuk menghasilkan air olahan dengan kualitas yang lebih bagus sesuai dengan yang diharapkan. Prosesnya dapat dilakukan baik secara biologis, secara fisika, kimia atau kombinasi ke tiga proses tersebut.
Tabel 3.1. Klasifikasi Proses Pengolahan Air Limbah Menurut Jenis Kontaminannya
KONTAMINAN SISTEM PENGOLAHAN KLASIFI
KASI
Padatan Tersuspensi
Screening and communition F
Sedimentasi F Flotasi F Filtrasi F Koagulasi/sedimentasi K/F Land treatment F Biodegradable Organics Lumpur aktif B Trickling filters B
Rotating biological contactors B
Aerated lagoons (kolam aerasi) B
Saringan pasir F/B Land treatment B/K/F Pathogens Khlorinasi K Ozonisasi K Land treatment F Nitrogen Suspended-growth nitrification and denitrification B
Fixed-film nitrification and
denitrification B
Ammonia stripping K/F
Ion Exchange K
Land treatment B/K/F Phospor Koagulasi garam logam/sedimentasi K/F Koagulasi kapur/sedimentasi K/F Biological/Chemical phosphorus removal B/K Land treatment K/F Refractory Organics Adsorpsi karbon F Tertiary ozonation K
Sistem land treatment F
Logam Berat Pengendapan kimia K Ion Exchange K Land treatment F Padatan Inorganik Terlarut Ion Exchange K Reverse Osmosis F Elektrodialisis K
Keterangan : B = Biologi, K = Kimia, F = Fisika
3.3.1. Pengolahan Air Limbah Secara Fisika dan Kimia
Proses Penyaringan (Screening )
Di dalam proses pengolahan air limbah, screening atau saringan dilakukan pada tahap paling awal. Saringan untuk penggunaan umum (general purpose screen) dapat digunakan untuk memisahkan bermacam-macam benda padat yang ada di dalam air limbah, misalnya kertas, plastik, kain, kayu dan benda dari metal serta lainnya. Benda-benda tersebut jika tidak dipisahkan dapat menyebabkan kerusakan pada sistem pemompaan dan unit peralatan pemisah lumpur misalnya weir, block valve, nozle, flow
meter, saluran serta sistem perpipaan. Hal tersebut dapat
menimbulkan masalah yang serius terhadap operasional maupun pemeliharaan peralatan. Saringan yang halus kadang-kadang dapat juga digunakan untuk memisahkan padatan tersuspensi.
Unit Pemisah Pasir (Grit Removal)
Di dalam proses pengolahan air limbah, pasir, kerikil halus, dan juga benda-benda lain misalnya kepingan logam, pecahan kaca, tulang, dan lain lain yang mana tidak dapat membusuk, harus dipisahkan terlebih dahulu. Hal ini dilakukan untuk:
Melindungi kerusakan pada peralatan mekanik seperti pompa, flow meter dll agar tidak terjadi abrasi atau kebuntuan.
Untuk menjaga atau mencegah kebuntuan di dalam sistem perpipaan dan terjadinya pengendapan di dalam saluran.
Untuk mencegah pengerakan (cementing) di dasar bak pengendapan awal atau bak pengolah lumpur (sludge digesting). Untuk mengurangi atau menghilangkan akumulasi dari material
inert yang tidak dapat terurai di dalam bak aerasi atau reaktor biologis serta bak pengolah lumpur yang akan mengakibatkan kerugian volume (loss of usable volume).
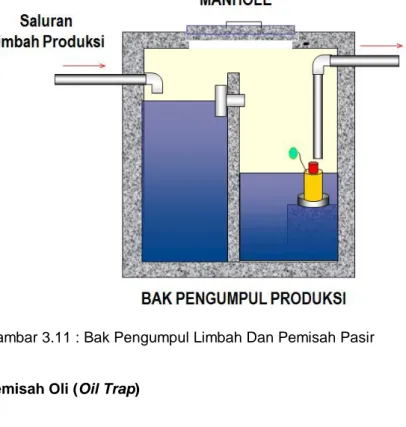
Gambar 3.11 : Bak Pengumpul Limbah Dan Pemisah Pasir
Unit Pemisah Oli (Oil Trap)
Pada tahap awal pengolahan limbah yang dilakukan di IPAL ini adalah unit pemisahan minyak. Pada tahap ini terdiri dari pengolahan awal (primary treatment) yakni proses awal pemisahan minyak dan penghilangan pasir (grit removal) kemudian proses pemisahan minyak dengan cara fisika-kimia (physico-chemical oil
seperation) dilanjutkan dengan pengolahan sekunder menggunakan
proses biologis misalnya biofilter. Proses pemisahan minyak tersebut sangat penting untuk dilakukan karena jika konsentrasi minyak di dalam air limbah masih tinggi maka dapat mengganggu proses
pengolahan air limbah secara biologis serta mengakibatkan biaya pengolahan menjadi mahal.
Pemisahan minyak (preliminary oil separation) atau pemisahan minyak secara gravitasi (gravity oil seperation) ini adalah merupakan proses tahap awal dari seluruh proses pengolahan air limbah industri PT. Uniited Tractors Tbk. Tujuan dari pemisahan oli dan minyak adalah untuk menghilangkan oli dan senyawa hidrocarbon lainnya di dalam proses emulsi mekanik. Air yang dihasilkan harus bebas oli & minyak sehingga dapat dialirkan ke proses pemurnian fisika-kimia yang sederhana sehingga kebutuhan zat kimia yang ditambahkan lebih ekonomis.
Tujuan kedua adalah untuk menghilangkan pasir dan tanah (alluvia) yang tidak dikehendaki dalam proses pemurnian fisika-kimia, yang dapat mempersulit pengumpulan, pengkonsentrasian, serta dapat mengganggu porses tahap akhir pembuangan lumpur minyak atau oli yang mengambang.
Pemisahan oli atau minyak biasanya dilakukan tanpa adanya penambahan bahan kimia. Proses ini dirancang untuk menyamakan konsentrasi sisa hydrocarbon (HC) pada inlet proses pemurnian fisika-kimia dengan cara menurunkan laju aliran puncak HC yang masuk. Konsentrasi HC tak larut di dalam air limbah bervariasi dari 20 mg/l hingga 150-200 mg/l (pada industri petrokimia) tergantung pada seberapa halus emulsi yang terjadi. Secara prinsip konsentrasi HC di dalam air limbah tidak dapat diantisipasi atau dihitung. Pendekatan tertentu dapat dilakukan,
tetapi hanya untuk kasus efluent limbah yang sederhana misalnya limbah dari deballasting atau produced water.
Proses pemisahan oli &minyak ini dilakukan dengan cara gravitasi alami, dimana butiran oli/minyak naik dengan kecepatan keatas yang ada yang dibatasi oleh berat jenisnya (specific
gravity).Ada dua jenis pemisah yang sering ditemukan, yaitu :
Settler separators, minyak langsung dikumpulkan dari permukaan air. Yang termasuk dalam metoda tersebut adalah pemisah minyak API (American Petroleum Institute) longitudinal (longitudinal API separators) dan pemisah minyak API bentuk bulat (circular separators).
Lamella separators atau plate separators, dimana minyak dikumpulkan secara langsung oleh permukaan bagian bawah
plate miring dan kemudian terangkat ke permukaan. Plate
tersebut mempunyai dua fungsi. Dengan adanya plate ini butiran minyak menempuh jalur pendek dan memberikan efek menyatu (coalescence effect). Kedua fungsi ini sangat dipengaruhi oleh jarak antar lamella (plates).
Untuk IPAL PT. United Tractors Tbk ini menggunakan jenis
settler separator, karena oli yang terkandung di dalam limbah relatif
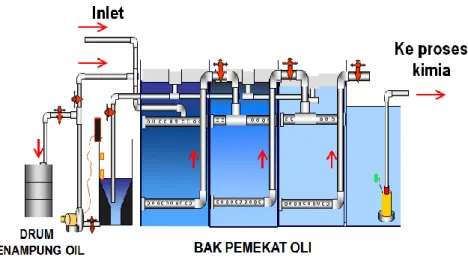
mudah untuk dipisahkan dan teknologinya relatif lebih sederhana namun dapat diterapkan dengan efektif di sini. Secara detail gambar dan foto oil separator IPAL PT. United Tracktor tersebut dapat dilihat seperti pada Gambar 3.12 dan 3.13. Unit oil trap ini juga dilengkapi dengan bak pemekat oli, dan juga pompa untuk pemindahan oli.
Gambar 3.12 : Oil Trap IPAL.
Bak oil trap Sistem pemisahan oli dengan over flow dari oil trap
Bak pemekat oli lengkap dengan pompa oli
Pemindahan oli dari bak pemekat ke drum penampung Gambar 3.13. : Foto Oil Trap IPAL dan Sarana Pengumpul Oli
Proses Netralisasi atau Pengontrolan pH
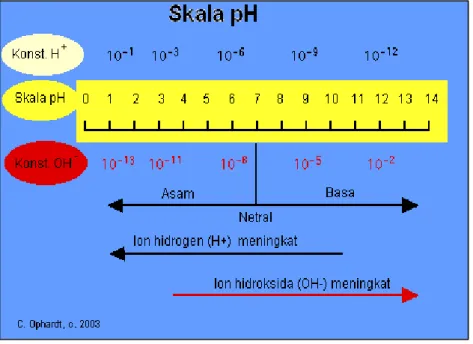
pH adalah derajat keasaman yang digunakan untuk menyatakan tingkat keasaman atau kebasaan yang dimiliki oleh suatu larutan. Ia didefinisikan sebagai kologaritmaaktivitasion hidrogen (H+) yang terlarut. Koefisien aktivitas ion hidrogen tidak dapat diukur secara eksperimental, sehingga nilainya didasarkan pada perhitungan teoritis. Skala pH bukanlah skala absolut. Ia bersifat relatif terhadap sekumpulan larutan standar yang pH-nya ditentukan berdasarkan persetujuan internasional. Salah satu pengukuran yang sangat penting dalam berbagai cairan proses (industri, farmasi, manufaktur, produksi makanan dan sebagainya) adalah pH, yaitu pengukuran ion hidrogen dalam suatu larutan. Larutan dengan harga pH rendah dinamakan ”asam” sedangkan yang harga pH-nya tinggi dinamakan ”basa”. Skala pH terentang dari 0 (asam kuat) sampai 14 (basa kuat) dengan 7 adalah harga tengah
mewakili air murni (netral). Nilai ini menunjukkan konsentrasi ion H+ dan ion OH- di dalam air. Gambar 3.14 menunjukkan hubungan antara nilai pH dengan konsentrasi ion H+ dan OH-. Prinsip dari skala pH adalah :Konsentrasi ion H+ berhubungan terbalik terhadap nilai pH, sedangkan konsentrasi ion OH- berhubungan langsung terhadap nilai pH.
Gambar 3.14 : Hubungan nilai pH Terhadap Konsentrasi H+ dan OH-.
Konsep pH pertama kali diperkenalkan oleh kimiawanDenmarkSøren Peder Lauritz Sørensen pada tahun 1909. Tidaklah diketahui dengan pasti makna singkatan "p" pada "pH". Beberapa rujukan mengisyaratkan bahwa p berasal dari singkatan untuk powerp (pangkat), yang lainnya merujuk kata bahasa
JermanPotenz (yang juga berarti pangkat), dan ada pula yang merujuk pada kata potential. Jens Norby mempublikasikan sebuah karya ilmiah pada tahun 2000 yang berargumen bahwa p adalah sebuah tetapan yang berarti "logaritma negatif".
pH larutan dapat diukur dengan beberapa cara. Secara kualitatif pH dapat diperkirakan dengan kertas Lakmus (Litmus) atau suatu indikator (kertas indikator pH). Seraca kuantitatif pengukuran pH dapat digunakan elektroda potensiometrik.Elektroda ini memonitor perubahan voltase yang disebabkan oleh perubahan aktifitas ion hidrogen (H+) dalam larutan. Elektroda potensiometrik sederhana untuk tipe ini seperti gambar 3.15.
Gambar 3.15 : Pengukuran pH Dengan pH Meter.
Elektroda pH yang paling modern terdiri dari kombinasi tunggal elektroda referensi (reference electrode) dan elektroda
sensor (sensing electrode) yang lebih mudah dan lebih murah daripada elektroda tepisah seperti gambar 4-10. Elektroda kombinasi ini mempunyai fungsi yang sama dengan elektroda pasangan.
Proses netralisasi bertujuan untuk menetralkan pH atau keasaman air limbah sampai menjadi netral. Hal ini dimaksudkan agar proses pengolahan air limbah dapat berjalan dengan baik. Bahan kimia yang umum digunakan adalah asam sulfat (H2SO4) atau
asam khlorida (HCl) untuk menetralkan air limbah yang bersifat alkali. Sedangkan untuk zat alkali yang banyak digunakan antara lain yakni soda ash atau soda abu (NaHCO3), Kapur tohor (CaO),
Ca(OH)2, CaCO3, natrium hidroksida (NaOH).
Air limbah produksi PT. United Tractors Tbk kondisi pH –nya sering berubah, sehingga perlu dilakukan pengontrolan dan proses netralisasi agar proses koagulasi-flokulasi dapat berjalan dengan baik. Untuk melakukan pekerjaan ini, maka di unit bak equalisasi dipasang sensor pH kontrol dan dihubungan dengan alat pH kontrol yang dihubungkan langsung dengan pompa dosing (Gambar 3.16). Jika ada perubahan pH dan nilai pH keluar dari range yang telah disetel (pH 7 – 8), maka pH kontrol akan memerintahkan pompa dosing untuk melakukan pemompaan bahan kimia (asam) agar nilai pH limbah di bak equalisasi turun menuju ke range pH yang telah ditetapkan. Jika pH limbah sudah masuk pada range pH yang telah ditetapkan, maka secara otomatis pompa dosing akan menghentikan pemompaan bahan kimia (asam) sehingga tidak akan terjadi over dosis penambahan bahan kimia yang dapat menyebabkan kegagalan dalam proses koagulasi-flokulasi.
Gambar 3.16. : Foto pH Control Lengkap Dengan Dosing Pump Dan Sensor Elektroda Nya.
Proses Koagulasi – Flokulasi
Koagulasi adalah proses destabilisasi partikel koloid dengan cara penambahan senyawa kimia yang disebut koagulan. Koloid mempunyai ukuran tertentu sehingga gaya tarik menarik antara partikel lebih kecil dari pada gaya tolak menolak akibat muatan listrik. Pada kondisi stabil ini penggumpalan partikel tidak terjadi dan gerakan Brown menyebabkan partikel tetap berada sebagai suspensi. Melalui proses koagulasi terjadi destabilisasi, sehingga partikel-partikel koloid bersatu dan menjadi besar. Dengan demikian partikel-partikel koloid yang pada awalnya sukar dipisahkan dari air, setelah proses koagulasi akan menjadi kumpulan partikel yang lebih besar sehingga mudah dipisahkan dengan cara sedimentasi, filtrasi atau proses pemisahan lainnya yang lebih mudah.
Koagulasi adalah proses destabilisasi koloid dengan penambahan senyawa kimia yang disebut zat koagulan. Flokulasi
adalah proses penggumpalan (agglomeration) dari koloid yang tidak stabil menjadi gumpalan partikel halus (mikro-flok), dan selanjutnya menjadi gumpalan patikel yang lebih besar dan dapat diendapkan dengan cepat. Senyawa kimia lain yang diberikan agar pembentukan flok menjadi lebih cepat atau lebih stabil dinamakan flokulan atau zat pembantu flokulasi (flocculant aid).
Di dalam sistem pengolahan air limbah dengan penambahan bahan kimia proses koagulasi sangat diperlukan untuk proses awal. Partikel-partikel yang sangat halus maupun partikel koloid yang terdapat dalam air limbah sulit sekali mengendap. Oleh karena itu perlu proses koagulasi yaitu penambahan bahan kimia agar partikel-partikel yang sukar mengendap tadi menggumpal menjadi besar dan berat sehingga kecepatan pengendapannya lebih besar.
Bahan Koagulan
Bahan kimia yang sering digunakan untuk proses koagulasi umumnya diklasifikasikan menjadi tiga golongan, yakni Zat Koagulan, Zat Alkali dan Zat Pembantu Koagulan. Zat koagulan digunakan untuk menggumpalkan partikel-partikel padat tersuspensi, zat warna, koloid dan lain-lain agar membentuk gumpalan partikel yang besar (flok). Sedangkan zat alkali dan zat pembantu koagulan berfungsi untuk mengatur pH agar kondisi air baku dapat menunjang proses flokulasi, serta membantu agar pembentukan flok dapat berjalan dengan lebih cepat dan baik.Pemilihan zat koagulan harus berdasarkan pertimbangan antara lain : jumlah dan kualitas air yang
akan diolah, kekeruhan air baku, metode filtrasi serta sistem pembuangan lumpur endapan.
Penentuan Dosis Koagulan
Penentuan dosis koagulan bervariasi sesuai dengan jenis koagulan yang dipakai, kekeruhan air baku, pH, alkalinitas dan juga temperatur operasi. Disamping itu dipengaruhi pula oleh faktor-faktor lainnya misalnya kandungan zat besi dan mangan yang tinggi, mikroorganisme. Perhitungan dosis koagulan dapat dilakukan dengan memakai rumus sebagai berikut:
Vv = Q x Rs x (100/C) x 10
-3dimana :
Vv = Dosis volumetrik koagulan ( lt/jam). Q = Laju alir air baku ( M3).
Rs = Dosis koagulan yang diharapkan (ppm). C = Konsentrasi larutan koagulan ( % ).
Zat Alkali (Alkaline Agent)
Zat alkali dipakai untuk pengolahan air limbah dan air minum dengan tujuan untuk pengaturan pH dan alkalinitas air baku agar proses koagulasi - flokulasi dapat berjalan dengan baik dan efektif. Dosis zat alkali yang dibubuhkan harus ditentukan sesuai laju pembubuhan harus ditentukan berdasarkan alkalinitas air baku dan laju pembubuhan koagulan. Perlu atau tidaknya penambahan zat
alkali tersebut serta dosisnya (rata-rata, minimum dan maksimum) harus ditentukan berdasarkan alkalinitas air baku, laju pembubuhan koagulan serta alkalinitas air olahan yang diharapkan dengan menggunakan jar tes. Untuk menghitung dosis zat alkali yang diperlukan dapat memakai rumus sebagai berikut :
W = [( A2 + K x R ) - A1] x F
Keterangan:
W = Dosis pembubuhan zat alkali ( mg/lt = ppm ) A1 = Alkalinitas air baku (mg/lt = ppm )
A2 = Alkalinitas yang diinginkan (mg/lt = ppm )
K = Harga numerik dari koagulan yang digunakan (dapat dilihat pada tabel 13)
R = Dosis koagulan (ppm).
F = Harga numerik untuk zat alkali yang digunakan Tangki Pencampur
Tangki pencampur dilengkapi dengan alat pengaduk atau agitator agar bahan kimia (koagulan) yang dibubuhkan dapat bercampur dengan air baku secara cepat dan merata.Oleh karena kecepatan hidrolisa koagulan dalam air besar maka diperlukan pembentukan flok-flok halus dari koloid hidroksida yang merata dan secepat mungkin sehingga dapat bereaksi dengan partikel-partikel kotoran membentuk flok yang lebih besar dan stabil. Untuk itu diperlukan pengadukan yang cepat.
Gambar 3.17.: Reaktor Pengolahan Kimia dan Arah Aliran Limbah
Flokulator
Fungsi flokulator adalah untuk pembentukan flok-flok agar menjadi besar dan stabil sehingga dapat diendapkan dengan mudah atau disaring. Untuk proses pengendapan dan penyaringan maka partikel-partikel kotoran halus maupun koloid yang ada dalam air baku harus digumpalkan menjadi flok-flok yang cukup besar dan kuat untuk dapat diendapkan atau disaring.
Flokulator pada hakekatnya adalah kombinasi antara pencampuran dan pengadukan sehingga flok-flok halus yang terbentuk pada bak pencampur cepat akan saling bertumbukan
dengan partikel-partikel kotoran atau flok-flok yang lain sehingga terjadi gumpalan gumpalan flok yang besar dan stabil.
UNIT CHEMICAL TREATMENT
1 (satu) set peralatan proses koagulan
Tangki pengendap
Pompa dosing bahan kimia dan motor pengaduk
Jenis bahan kimia yang dapat dipakai (Zeta ace, PAC, Tawas
Kaporit, Kuriflok)
Gambar 3.18 :Foto-Foto Sarana Proses Koagulasi-Flokulasi Limbah.
Sedimentasi atau Pengendapan
Sedimentasi adalah suatu unit operasi untuk menghilangkan materi tersuspensi atau flok kimia secara gravitasi. Proses sedimentasi pada pengolahan air limbah umumnya untuk
menghilangkan padatan tersuspensi sebelum dilakukan proses pengolahan selanjutnya. Gumpalan padatan yang terbentuk pada proses koagulasi masih berukuran kecil. Gumpalan-gumpalan kecil ini akan terus saling bergabung menjadi gumpalan yang lebih besar dalam proses flokulasi. Dengan terbentuknya gumpalan-gumpalan besar, maka beratnya akan bertambah, sehingga karena gaya beratnya gumpalan-gumpalan tersebut akan bergerak ke bawah dan mengendap pada bagian dasar tangki sedimentasi.
Bak sedimentasi dapat berbentuk segi empat atau lingkaran. Pada bak ini aliran air limbah sangat tenang untuk memberi kesempatan padatan/suspensi untuk mengendap. Kriteria-kriteria yang diperlukan untuk menentukan ukuran bak sedimentasi adalah :
surface loading (beban permukaan), kedalaman bak dan waktu
tinggal. Waktu tinggal mempunyai satuan jam, cara perhitungannya adalah volume tangki dibagi dengan laju alir per hari. Beban permukaan sama dengan laju alir (debit volume) rata-rata per hari dibagi luas permukaan bak, satuannya m3 per meter persegi per hari.
satuannya (m3/m2 hari)
Dimana :
Vo = laju limpahan/beban permukaan
Q = aliran rata-rata harian, m3 per hari A = total luas permukaan (m2)
Gambar 3.19.: Tangki Pengendapan
3.3.2. Pengolahan Air Limbah Dengan Proses Kombinasi Biofilter Anaerob-Aerob Tercelup
Proses pengolahan dengan biofilter anaerob-aerob ini merupakan pengembangan dari proses biofilter anaerob dengan proses aerasi kontak. Pengolahan air limbah dengan proses biofilter anaerob-aerob terdiri dari beberapa bagian yakni bak pengendap awal, biofilter anaerob (anoxic), biofilter aerob, bak pengendap akhir, dan jika perlu dilengkapi dengan bak kontaktor khlor.
Air limbah dialirkan melalui saringan kasar (bar screen) untuk menyaring sampah yang berukuran besar seperti sampah daun, kertas, plastik dll. Setelah melalui screen air limbah dialirkan
ke bak pengendap awal, untuk mengendapkan partikel lumpur, pasir dan kotoran lainnya. Selain sebagai bak pengendapan, juga berfungsi sebagai bak pengontrol aliran, serta bak pengurai senyawa organik yang berbentuk padatan, sludge digestion (pengurai lumpur) dan penampung lumpur.
Air limpasan dari bak pengendap awal selanjutnya dialirkan ke bak kontaktor anaerob dengan arah aliran dari atas ke dan bawah ke atas. Di dalam bak kontaktor anaerob tersebut diisi dengan media dari bahan plastik. Jumlah bak kontaktor anaerob ini bisa dibuat lebih dari satu sesuai dengan kualitas dan jumlah air baku yang akan diolah. Penguraian zat-zat organik yang ada dalam air limbah dilakukan oleh bakteri anaerobik atau fakultatif aerobik. Setelah beberapa hari operasi, pada permukaan media filter akan tumbuh lapisan film mikroorganisme. Mikroorganisme inilah yang akan menguraikan zat organik yang belum sempat terurai pada bak pengendap
Air limpasan dari bak kontaktor anaerob dialirkan ke bak kontaktor aerob. Di dalam bak kontaktor aerob ini diisi dengan media, plastik (polyethylene), sambil diaerasi atau dihembus dengan udara sehingga mikro organisme yang ada akan menguraikan zat organik yang ada dalam air limbah serta tumbuh dan menempel pada permukaan media. Dengan demikian air limbah akan kontak dengan mikroorgainisme yang tersuspensi dalam air maupun yang menempel pada permukaan media yang mana hal tersebut dapat meningkatkan efisiensi penguraian zat organik, deterjen serta mempercepat proses nitrifikasi, sehingga efisiensi penghilangan
ammonia menjadi lebih besar. Proses ini sering di namakan Aerasi Kontak (Contact Aeration).
Dari bak aerasi, air dialirkan ke bak pengendap akhir. Di dalam bak ini lumpur aktif yang mengandung massa mikroorganisme diendapkan dan dipompa kembali ke bagian inlet bak aerasi dengan pompa sirkulasi lumpur. Sedangkan air limpasan (over flow) dialirkan ke bak penampung sementara. Dari sini air olahan dipompa untuk difilter dan diberikan kaporit sebagai disinfektan. Air olahan, yakni air yang keluar setelah proses filter ditampung di penampungan sementara untuk selanjutnya ditransfer ke penampungan di cuci unit untuk digunakan kembali sebagai air cucian. Dengan kombinasi proses anaerob dan aerob tersebut selain dapat menurunkan zat organik (BOD, COD), ammonia, deterjen, padatan tersuspensi (SS), phospat dan lainnya.Skema proses pengolahan air limbah dengan sistem biofilter anaerob-aerob dapat dilihat pada Gambar3.20 berikut.
Gambar 3.20: Diagram Proses Pengolahan di Biofilter Dengan Proses Biofilter Anaerob-Aerob
Proses dengan Biofilter Anaerob-Aerob ini mempunyai beberapa keuntungan yakni :
Adanya air buangan yang melalui media yang terdapat pada biofilter mengakibatkan timbulnya lapisan lendir yang menyelimuti kerikil atau yang disebut juga biological film. Air limbah yang masih mengandung zat organik yang belum teruraikan pada bak pengendap bila melalui lapisan lendir ini akan mengalami proses penguraian secara biologis. Efisiensi biofilter tergantung dari luas kontak antara air limbah dengan mikroorganisme yang menempel pada permukaan media filter tersebut. Makin luas bidang kontaknya maka efisiensi penurunan konsentrasi zat organiknya (BOD) makin besar. Selain menghilangkan atau mengurangi konsentrasi BODdan COD, cara ini dapat juga mengurangi konsentrasi padatan tersuspensi atau suspended
solids (SS) , deterjen (MBAS), ammonium dan posphor.
Biofilter juga berfungsi sebagai media penyaring air limbah yang melalui media ini. Sebagai akibatnya, air limbah yang mengandung suspended solids dan bakteri E.coli setelah melalui filter ini akan berkurang konsentrasinya. Efisiensi penyaringan akan sangat besar karena dengan adanya biofilter up flow yakni penyaringan dengan sistem aliran dari bawah ke atas akan mengurangi kecepatan partikel yang terdapat pada air buangan dan partikel yang tidak terbawa aliran ke atas akan mengendapkan di dasar bak filter. Sistem biofilter anaerob-aerob ini sangat sederhana, operasinya mudah dan tanpa memakai bahan kimia serta tanpa membutuhkan energi. Proses ini cocok
digunakan untuk mengolah air limbah dengan kapasitas yang tidak terlalu besar
Dengan kombinasi proses “Anaerob-Aerob”, efisiensi penghilangan senyawa phospor menjadi lebih besar bila dibandingankan dengan proses anaerob atau proses aerob saja. Fenomena proses penghilangan phosphor oleh mikroorganisne pada proses pengolahan anaerob-aerob dapat diterangkan seperti pada Gambar 3.21. Selama berada pada kondisi anaerob, senyawa phospor anorganik yang ada dalam sel-sel mikrooragnisme akan keluar sebagai akibat hidrolisa senyawa phospor. Sedangkan energi yang dihasilkan digunakan untuk menyerap BOD (senyawa organik) yang ada di dalam air limbah. Efisiensi penghilangan BOD akan berjalan baik apabila perbandingan antara BOD dan phospor (P) lebih besar 10. (Metcalf and Eddy, 1991). Selama berada pada kondisi aerob, senyawa phospor terlarut akan diserap oleh bakteria/mikroorganisme dan akan sintesa menjadi polyphospat dengan menggunakan energi yang dihasilkan oleh proses oksidasi senyawa organik (BOD). Dengan demikian dengan kombinasi proses anaerob-aerob dapat menghilangkan BOD maupun phospor dengan baik. Proses ini dapat digunakan untuk pengolahan air limbah dengan beban organik yang cukup besar.
Gambar 3.21 : Proses Penghilangan Phospor Oleh Mikroorganisme Di Dalam Proses Pengolahan “Anaerob-Aerob”.
Pengolahan air limbah dengan proses biofilm mempunyai beberapa keunggulan antara lain :
a. Pengoperasiannya mudah
Di dalam proses pengolahan air limbah dengan sistem biofilm, tanpa dilakukan sirkulasi lumpur, tidak terjadi masalah “bulking” seperti pada proses lumpur aktif (Activated sludge process). Oleh karena itu pengelolaaanya sangat mudah.
b. Lumpur yang dihasilkan sedikit
Dibandingakan dengan proses lumpur aktif, lumpur yang dihasilkan pada proses biofilm relatif lebih kecil. Di dalam proses lumpur aktif antara 30 – 60 % dari BOD yang dihilangkan (removal BOD) diubah menjadi lumpur aktif (biomasa) sedangkan pada proses biofilm hanya sekitar 10-30 %. Hal ini disebabkan karena pada proses biofilm rantai makanan lebih panjang dan melibatkan aktifitas mikroorganisme dengan orde yang lebih tinggi dibandingkan pada proses lumpur aktif.
c. Dapat digunakan untuk pengolahan air limbah dengan konsentrasi rendah maupun konsentrasi tinggi.
Oleh karena di dalam proses pengolahan air limbah dengan sistem biofilm mikroorganisme atau mikroba melekat pada permukaan medium penyangga maka pengontrolan terhadap mikroorganisme atau mikroba lebih mudah. Proses biofilm tersebut cocok digunakan untuk mengolah air limbah dengan konsentrasi rendah maupun konsentrasi tinggi.
d. Tahan terhadap fluktuasi jumlah air limbah maupun fluktuasi konsentrasi.
Di dalam proses biofilter mikroorganisme melekat pada permukaan unggun media, akibatnya konsentrasi biomassa mikroorganisme per satuan volume relatif besar sehingga relatif tahan terhadap fluktuasi beban organik maupun fluktuasi beban hidrolik.
e. Pengaruh penurunan suhu terhadap efisiensi pengolahan kecil.
Jika suhu air limbah turun maka aktifitas mikroorganisme juga berkurang, tetapi oleh karena di dalam proses biofilm substrat maupun enzim dapat terdifusi sampai ke bagian dalam lapisan biofilm dan juga lapisan biofilm bertambah tebal maka pengaruh penurunan suhu (suhu rendah) tidak begitu besar.
3.3.2.1. Tinjauan Proses Anaerob Dan Aerob
Pengolahan air limbah secara biologis adalah suatu cara pengolahan yang diarahkan untuk menurunkan atau menyisihkan substrat tertentu yang terkandung dalam air buangan dengan memanfaatkan aktivitas mikroorganisme untuk melakukan perombakan substrat tersebut.Proses pengolahan air limbah secara biologis dapat berlangsung dalam tiga lingkungan utama, yaitu :
Lingkungan aerob , yaitu lingkungan dimana oksigen terlarut (DO) di dalam air cukup banyak, sehingga oksigen bukan merupakan faktor pembatas.
Lingkungan anoksik, yaitu lingkungan dimana oksigen terlarut (DO) di dalam air ada dalam konsentrasi rendah.
Lingkungan anaerob, merupakan kebalikan dari lingkungan aerob, yaitu tidak terdapat oksigen terlarut, sehingga oksigen menjadi faktor pembatas berlangsungnya proses metabolisme aerob.
Berdasarkan pada kondisi pertumbuhan mikroorganisme yang bertanggung jawab pada proses penguraian yang terjadi, reaktor dapat dibedakan menjadi 2 bagian, yaitu :
Reaktor pertumbuhan tersuspensi (suspended growth reaktor), yaitu reaktor dimana mikroorganisme yang berperan
pada proses biologis tumbuh dan berkembang biak dalam keadaan tersuspensi.
Reaktor pertumbuhan lekat (attached growth reaktor), yaitu reaktor dimana mikroorganisme yang berperan pada proses penguraian substrat tumbuh dan berkembang di atas suatu media dengan membentuk suatu lapisan lendir (lapisan
biofilm) untuk melekatkan diri di atas permukaan media
tersebut.
3.3.2.2. Proses Pengolahan Biologis Secara Anaerob
a. Mekanisme Proses Anaerob
Polutan-polutan organik komplek seperti lemak, protein dan karbohidrat pada kondisi anaerobic akan dihidrolisa oleh enzim hydrolase yang dihasilkan bakteri pada tahap pertama. Enzim penghidrolisa seperti lipase, protease dan cellulase. Hasil hidrolisa polimer-polimer diatas adalah monomer seperti manosakarida, asam amino, peptida dan gliserin. Selanjutnya monomer-monomer ini akan diuraikan menjadi asam-asam lemak (lower fatty acids) dan gas hidrogen.
Kumpulan mikroorganisme, umumnya bakteri, terlibat dalam transformasi senyawa komplek organik menjadi metan. Lebih jauh lagi, terdapat interaksi sinergis antara bermacam-macam kelompok bakteri yang berperan dalam penguraian limbah. Keseluruhan reaksi dapat digambarkan sebagai berikut (Polprasert,
1989) :
Senyawa Organik CH4 + CO2 + H2 + NH3 + H2S
Meskipun beberapa jamur (fungi) dan protozoa dapat ditemukan dalam penguraian anaerobik, bakteri bakteri tetap merupakan mikroorganisme yang paling dominan bekerja didalam proses penguraian anaerobik. Sejumlah besar bakteri anaerobik dan fakultatif (seperti: Bacteroides, Bifidobacterium, Clostridium, Lactobacillus, Streptococcus) terlibat dalam proses hidrolisis dan
fermentasi senyawa organik. Proses penguraian senyawa organik secara anaerobik secara garis besar ditunjukkan seperti pada Gambar 3.22.
Gambar 3.22: Kelompok Bakteri Metabolik Yang Terlibat Dalam Penguraian Limbah Dalam Sistem Anaerobik.
Ada empat grup bakteri yang terlibat dalam transformasi material komplek menjadi molekul yang sederhana seperti metan dan karbon dioksida. Kelompok bakteri ini bekerja secara sinergis (Archer dan Kirsop, 1991; Barnes dan Fitzgerald, 1987; Sahm, 1984;
1) Kelompok Bakteri Hidrolitik
Kelompok bakteri anaerobik memecah molekul organik komplek (protein, cellulose, lignin, lipids) menjadi molekul monomer yang terlarut seperti asam amino, glukosa, asam lemak, dan gliserol. Molekul monomer ini dapat langsung dimanfaatkan oleh kelompok bakteri berikutnya. Hidrolisis molekul komplek dikatalisasi oleh enzim ekstra seluler seperti sellulase, protease, dan lipase. Walaupun demikian proses penguraian anaerobik sangat lambat dan menjadi terbatas dalam penguraian limbah sellulolitik yang mengandung lignin (Polprasert, 1989; Speece, 1983).
2) Kelompok Bakteri Asidogenik Fermentatif
Bakteri asidogenik (pembentuk asam) seperti Clostridium merubah gula, asam amino, dan asam lemak menjadi asam organik (seperti asam asetat, propionik, formik, lactik, butirik, atau suksinik), alkohol dan keton (seperti etanil, metanol, gliserol, aseton), asetat, CO2 dan H2. Asetat adalah produk utama dalam fermentasi
karbohidrat. Hasil dari fermentasi ini bervariasi tergantung jenis bakteri dan kondisi kultur seperti temperatur, pH, potensial redok.
3) Kelompok Bakteri Asetogenik
Bakteri asetogenik (bakteri yang memproduksi asetat dan H2) seperti Syntrobacter wolinii dan Syntrophomonas wolfei
(McInernay et al., 1981) merubah asam lemak (seperti asam propionat, asam butirat) dan alkohol menjadi asetat, hidrogen, dan karbon dioksida, yang digunakan oleh bakteri pembentuk metan
(metanogen). Kelompok ini membutuhkan ikatan hidrogen rendah untuk merubah asam lemak; dan oleh karenanya diperlukan monitoring hidrogen yang ketat.
Di bawah kondisi tekanan hidrogen (H2) parsial yang relatif
tinggi, pembentukan asetat berkurang dan subtrat dirubah menjadi asam propionat, asam butirat, dan etanol dari pada metan. Ada hubungan simbiotik antara bakteri asetonik dan metanogen. Metanogen membantu menghasilkan ikatan hidrogen rendah yang dibutuhkan oleh bakteri asetogenik. Etanol, asam propionat, dan asam butirat dirubah menjadi asam asetat oleh bakteri asetogenik dengan reaksi sebagai berikut :
CH3CH2OH + CO2 CH3COOH + 2H2
Etanol Asam Asetat
CH3CH2COOH + 2H2O CH3COOH + CO2 + 3H2
Asam Propionat Asam asetat
CH3CH2CH2COOH + 2H2O 2CH3COOH + 2H2
Asam Butirat Asam Asetat
Bakteri asetogenik tumbuh jauh lebih cepat dari pada bakteri metanogenik. Kecepatan pertumbuhan bakteri asetogenik (mak)
mendekati 1 per jam sedangkan bakteri metanogenik 0,04 per jam (Hammer, 1986).
4) Kelompok Bakteri Metanogen
Penguraian senyawa organik oleh bakteri anaerobik dilingkungan alam melepas 500 - 800 juta ton metan ke atmosfir tiap tahun dan ini mewakili 0,5% bahan organik yang dihasilkan oleh proses fotosintesis (Kirsop, 1984; Sahm, 1984). Bakteri metanogen terjadi secara alami didalam sedimen yang dalam atau dalam pencernaan herbivora. Kelompok ini dapat berupa kelompok bakteri gram positif dan gram negatif dengan variasi yang banyak dalam bentuk. Mikroorganime metanogen tumbuh secara lambat dalam air limbah dan waktu tumbuh berkisar 3 hari pada suhu 35oC sampai dengan 50 hari pada suhu 10oC.
Bakteri metanogen dibagi menjadi dua katagori, yaitu :
Bakteri metanogen hidrogenotropik (seperti : chemolitotrof yang menggunakan hidrogen) merubah hidrogen dan karbondioksida menjadi metan.
CO2 + 4H2 CH4 + 2H2O
Metan
Bakteri metanogen yang menggunakan hidrogen membantu memelihara tekanan parsial yang sangat rendah yang dibutuhkan untuk proses konversi asam volatil dan alkohol menjadi asetat (speece, 1983).Bakteri metanogen Asetotropik, atau biasa disebut sebagai bakteri asetoklastik atau bakteri penghilang asetat, merubah asam asetat menjadi metan dan CO2.
CH3COOH CH4 + CO2
Bakteri asetoklastik tumbuh jauh lebih lambat (waktu generasi = beberapa hari) dari pada bakteri pembentuk asam (waktu generasi = beberapa jam). Kelompok ini terdiri dari dua kelompok, yaitu : Metanosarkina (Smith dan Mah, 1978) dan Metanotrik (Huser
et al., 1982). Selama penguraian termofilik (58oC) dari limbah lignosellulosik, Metanosarkina adalah bakteri asetotropik yang ditemukan dalam bioreaktor. Sesudah 4 minggu, Metanosarkina (mak = 0,3 tiap hari; Ks = 200 mg/l) digantikan oleh Metanotrik (mak =
0,1 tiap hari; Ks = 30 mg/l).
Kurang lebih sekitar 2/3 metan dihasilkan dari konversi asetat oleh metanogen asetotropik. Sepertiga sisanya adalah hasil reduksi karbon dioksida oleh hidrogen (Mackie dan Bryant, 1984). Diagram neraca masa pada penguraian zat organik komplek menjadi gas metan secara anaerobik ditujukkan seperti pada Gambar 3.23.
Secara umum klasifikasi bakteri metanogen dapat dilihat pada Tabel 3.4. (Balch et al, 1979). Metanogen dikelompokkan menjadi tiga orde yakni:
Metanobakteriales misalnya Metanobakterium, Metano-breviater,
Metanotermus.
Metanomikrobiales misalnya Metanomikrobium, Metano-genium,
Metanospirilium, Metanosarkina, dan Metanokokoid
Tabel 3.4 : Klasifikasi Metanogen
Order Famili Genus Spesies
Methanobacter iales Methanobact eriaceae Methanobacteriu m Methanobrevibac ter M. formicicum M. bryanti M. thermoautotrophicum M. ruminantium M. arboriphilus M. smithii M. vannielli Methanococcal es Methanococ caceae Methanococcus Methanomicrobiu m M. voltae M. mobile methanomicro biales Methanomicr obiaceae Methanogenium Methanospillum M. cariaci M. marisnigri M. hungatei M. barkeri Methanosarc inaceae Methanosarcina M. mazei
Gambar 3.23 : Neraca Masa Pada Proses Penguraian Anaerobik (Fermentasi Metan)
Paling sedikit ada 49 spesies metanogen yang telah didiskripsi (Vogels et al., 1988; Koster,1988) telah mengkompilasi beberapa bakteri metanogen yang telah diisolasi dan masing-masing substratnya, ditunjukkan seperti pada Tabel 3.5Proses penguraian senyawa hidrokarbon, lemak dan protein secara biologis menjadi metan di kondisi proses anaerobik secara umum ditunjukkan seperti pada Gambar 3.24 dan 3.25.
Gambar 3.24 : Proses Penguraian Senyawa Hidrokarbon Secara Anaerobik Menjadi Metan
Gambar 3.25 : Proses Penguraian Senyawa Protein Secara Anaerobik
Tabel 3.5 : Metanogen Terisolasi Dan Subtratnya
Bakteri Subtrat
Methanobacterium bryantii H2
M. formicicum H2 dan HCOOH
M. thermoautotrophicum H2
M. alcaliphilum H2
Methanobrevibacter arboriphilus H2
M. ruminantium H2 dan HCOOH
M. smithii H2 dan HCOOH
Methanococcus vannielii H2 dan HCOOH
M. voltae H2 dan HCOOH
M. deltae H2 dan HCOOH
M. maripaludis H2 dan HCOOH
M. jannaschii H2
M. thermolithoautotrophicus H2 dan HCOOH
M. frisius
Methanomicrobium mobile H2 dan HCOOH
M. paynteri H2
Methanospirillum hungatei H2 dan HCOOH
Methanoplanus limicola H2 dan HCOOH
M. endosymbiosus H2
Methanogenium cariaci H2 dan HCOOH
M. marisnigri H2 dan HCOOH
M. tatii H2 dan HCOOH
M. olentangyi H2
M. thermophilicum H2 dan HCOOH
M. bourgense H2 dan HCOOH
M. aggregans H2 dan HCOOH
Methanoccoides methylutens CH3NH2 dan CH3OH
Methanotrix soehngenii CH3COOH
M. conilii CH3COOH
Methanolobus tindarius CH3OH, CH3NH2,
(CH3)2NH, dan (CH3)3N
Methanosarcina barkeri CH3OH, CH3COOH,
H2, CH3NH2, (CH3)2NH,
dan (CH3)3N
Methanosarcina themophila CH3OH, CH3COOH,
H2, CH3NH2, (CH3)2NH,
dan (CH3)3N
Sumber : Koster (1988).
b. Faktor-Faktor yang Mempengaruhi Mekanisme Proses Anaerob
Beberapa faktor yang berpengaruh terhadap penguraian secara anaerobik antara lain yakni temperatur, waktu tinggal (rentention time), keasaman (pH), komposisi kimia air limbah, kompetisi antara metanogen dan bakteri racun (toxicants).
1) Temperatur
Produksi metan dapat dihasilkan pada temperatur antara 0oC - 97oC. Walaupun bakteri metan psychrophilic tidak dapat diisolasi, bakteri thermophilik beroperasi secara optimum pada temperatur 50 - 75oC ditemukan di daerah panas. Methanothermus
fervidus ditemukan ditemukan di Iceland dan tumbuh pada
temperatur 63 - 97oC (Sahm, 1984).
Di dalam instalasi pengolahan limbah pemukiman, penguraian anaerobik dilakukan dalam kisaran mesophilik dengan temperatur 25 - 40 oC dengan temperatur optimum mendekati 35oC . Penguraian thermophilik beroperasi pada temperatur 50 - 65oC.
Penguraian ini memungkinkan untuk pengolahan limbah dengan beban berat dan juga efektif untuk mematikan bakteri pathogen. Salah satu kelemahan adalah sensitifitas yang tinggi terhadap zat toksik (Koster, 1988).
Karena pertumbuhan bakteri metan yang lebih lambat dibandingkan bakteri acidogenik, maka bakteri metan sangat sensitif terhadap perubahan kecil temperatur. Karena penggunaan asam volatil oleh bakteri metan, penurunan temperatur cenderung menurunkan laju pertumbuhan bakteri metan. Oleh karena itu penguraian mesophilik harus didisain untuk beroperasi pada temperatur antara 30 - 35oC untuk fungsi optimal.
2) Waktu Tinggal
Waktu tinggal air limbah dalam reaktor anaerob, yang tergantung pada karakteristik air limbah dan kondisi lingkungan, harus cukup lama untuk proses metabolisme oleh bakteri anaerobik dalam reaktor pengurai. Penguraian didasarkan pada bakteri yang tumbuh menempel mempunyai waktu tinggal yang rendah (1-10 hari) dari pada bakteri yang terdispersi dalam air (10-60 hari). Waktu tinggal pengurai mesophilik dan termophilik antara 25 - 35 hari tetapi dapat lebih rendah lagi (Sterritt dan Lester, 1988).
3) Keasaman (pH)
Kebanyakan pertumbuhan bakteri metanogen berada pada kisaran pH antara 6,7 - 7,4, tetapi optimalnya pada kisaran pH antara
7,0 - 7,2 dan proses dapat gagal jika pH mendekati 6,0. Bakteri acidogenik menghasilkan asam organik, yang cenderung menurunkan pH bioreaktor. Pada kondisi normal, penurunan pH ditahan oleh bikarbonat yang dihasilkan oleh bakteri metanogen. Di bawah kondisi lingkungan yang berlawanan kapasitas buffering dari sistem dapat terganggu, dan bahkan produksi metan dapat terhenti. Asiditas lebih berpengaruh terhadap metanogen dari pada bakteri acidogenik. Peningkatan tingkat volatil merupakan indikator awal dari terganggunya sistem. Monitoring ratio asam volatil total (asam asetat) terhadap alkali total (kalsium karbonat) disarankan di bawah 0,1 (Sahm, 1984). Salah satu metode untuk memperbaiki keseimbangan pH adalah meningkatkan alkaliniti dengan menambah bahan kimia seperti lime (kapur), anhydrous ammonia, sodium hidroksida, atau sodium bikarbonat.
4) Komposisi Kimia Air Limbah
Bakteri metanogen dapat menghasilkan metan dari karbohidrat, protein, dan lipida, dan juga dari senyawa komplek aromatik (contoh: ferulik, vanilik, dan asam syringik). Walaupun demikian beberapa senyawa lignin dan n-parafin sulit terurai oleh bakteri anaerobik.Air limbah harus diseimbangkan makanannya (nitrogen, fosfor, sulfur) untuk memelihara pencernaan anaerobik. Rasio C:N:P untuk bakteri anaerobik adalah 700:5:1 (Sahmn, 1984). Beberapa pengamat menilai bahwa ratio C/N yang tepat untuk produksi gas yang optimal sebaiknya sekitar 25-30 :1 (Polprasert,
1989). Metanogen menggunakan ammonia dan sulfida sebagai
terhadap metanogen bakteri pada tingkat 150 - 200 mg/l, unsur ini merupakan sumber sulfur utama untuk bakteri metanogen (Speece, 1983).
5) Kompetisi Metanogen dengan Bakteri Pemakan Sulfat
Bakteri pereduksi sulfat dan metanogen dapat memperebutkan donor elektron yang sama, asetat dan H2. Studi
tentang kinetik pertumbuhan dari dua kelompok bakteria ini menunjukkan bahwa bakteri pemakan sulfat mempunyai afinitas yang lebih tinggi terhadap asetat (Ks= 9,5 mg/l) dari pada metanogen
(Ks = 32,8 mg/l). Ini berarti bahwa bakteri pemakan sulfat akan
memenangkan kompetisi pada kondisi konsentrasi asetat yang rendah (Shonheit et al., 1982; Oremland, 1988; Yoda et al., 1987). Bakteri pemakan sulfat dan metanogen sangat kompetitif pada rasio COD/SO4 berkisar 1,7 - 2,7. Pada rasio yang lebih tinggi baik untuk
metanogen sedangkan bakteri pemakan sulfat lebih baik pada rasio yang lebih kecil.
6) Zat Toksik
Zat toksik kadang-kadang dapat menyebabkan kegagalan pada proses penguraian limbah dalam proses anaerobik. Terhambatnya pertumbuhan bakteri metanogen pada umumnya ditandai dengan penurunan produksi metan dan meningkatnya konsentrasi asam-asam volatil. Berikut ini adalah beberapa zat toksik yang dapat menghambat pembentukan metan.
Oksigen.
Metanogen adalah bakteri anaerob dan dapat terhambat pertumbuhannya oleh oksigen dalam kadar trace level (Oremland, 1988; Roberton dan Wolfe, 1970).
Ammonia.
Ammonia yang tidak terionisasi cukup toksik atau beracun untuk bakteri metanogen. Barangkali karena produksi ammonia bebas tergantung pH (ammonia bebas terbentuk pada pH tinggi), sedikit toksisitas yang dapat diamati pada pH netral. Ammonia sebagai penghambat terhadap pembentukan metanogen pada konsentrasi 1500 - 3000 mg/l. Penambahan ammonia menambah waktu tinggal partikel padat (Bhattacharya dan Parkin, 1989).
Hidrokarbon terklorinasi.
Senyawa khlorin alifatis lebih beracun terhadap metanogen dari pada terhadap mikroorganisma hetrotropik aerobik (Blum dan
Speece, 1992). Kloroform sangat toksik terhadap bakteri
metanogen dan cenderung menghambat secara total, hal ini dapat diukur dari produksi metan dan akumulasi hidrogen pada konsentrasi diatas 1 mg/l (Hickey et al., 1987). Aklimatisasi senyawa ini meningkatkan toleransi metanogen sampai pada konsentrasi kloroform 15 mg/l Pemulihan kehidupan bakteri metanogen tergantung pada konsentrasi biomassa, waktu tinggal partikel padat, dan temperatur (Yang dan Speece, 1986).
Kultur murni dari bakteri metanogen (contoh : Methanothix
concilii, Methanobacterium espanolae, Methanobacterium bryantii) dapat dihambat pertumbuhannya oleh senyawa benzen
(contoh : benzen, toloene, fenol, pentachlorophenol). Pentachlorophenol adalah yang paling toksik (beracun) dari pada seluruh benzen yang diuji (Patel et al., 1991).
Formaldehida.
Proses pembentukan metan (Methanogenesis) terhambat atau terganggu pada konsentrasi formadehida sebesar 100 mg/l tetapi segera pulih kembali pada konsentrasi yang lebih rendah (Hickey
et al., 1988; Parkin dan Speece, 1982).
Asam Volatil.
Jika pH dijaga tetap netral, asam volatil seperti asam asetat atau butirik tidak berpengaruh besar (sedikit toksik) terhadap bakteri metanogen.
Asam Lemak rantai panjang.
Asam lemak rantai panjang (contoh : caprylic, capric, lauric, myristic, dan asam oleic) menghambat asetoklastik metanogen (contoh : Methanothrix spp.) dalam mencerna asetat dalam lumpur limbah (Koster dan Cramer, 1987).
Logam Berat.
Logam berat (contoh : Cu++, Pb++, Cd++, Ni++, Zn++, Cr+6) yang ditemukan dalam air dan lumpur limbah dari industri dapat
menghambat penguraian limbah anaerobik (Lin, 1992; Mueller dan Steiner, 1992). Toksisitas meningkat jika afinitas logam berat pada lumpur limbah (sludge) menurun dan sebaliknya jika afinitas pada lumpur logam berat tinggi menjadi sedikit toksik. Toksisitas logam menghambat reaksi berikutnya dengan hidrogen sulfida, yang cenderung untuk pembentukan pengendapan logam berat yang tidak terlarut. Beberapa logam seperti nikel, kobalt, dan molybdenum pada konsentrasi kecil (trace) dapat merangsang bakteri methanogen (Murray dan Van Den Berg, 1981; Shonheit
et al, 1979; Whiman dan Wolfe, 1980).
Sianida.
Sianida digunakan dalam proses industri seperti pembersihan logam dan elektroplating. Pemulihan bakteri metanogen tergantung pada konsentrasi biomassa, waktu tinggal partikel padat, dan temperatur (Fedorak et al., 1986; Yang dan Speece, 1985).
Sulfida.
Sulfida adalah salah satu penghalang potensial dalam penguraian limbah anaerobik (Anderson et al, 1982). Melalui difusi sel membran lebih cepat untuk hidrogen sulfida yang tidak terionisasi dibandingkan dibandingkan yang terionisasi, toksisitas sulfida sangat tergantung pada pH (Koster et al., 1986). Sulfida sangat toksik untuk bakteri metanogen jika konsentrasinya lebih dari 150-200 mg/l. Bakteri pembentuk asam tidak begitu sensitif terhadap hidrogen sulfida dibandingkan dengan bakteri metanogen.
Tanin.
Tanin adalah senyawa fenolik yang berasal dari anggur, pisang, apel, kopi, kedelai, dan sereal. Senyawa ini umumnya toksik terhadap bakteri metanogen.
Salinitas.
Salinitas adalah jenis marial toksik lain dalam penguraian air limbah dalam sistem anaerobik. Karena potasium dapat menetralkan toksisitas sodium, maka jenis toksisitas ini dapat dihambat dengan menambah garam potasium dalam air limbah.
Efek Balik (Feedback Inhibition).
Sistem anaerobik dapat dihambat oleh beberapa hasil antara (intermediates produced) selama proses. Tingginya konsentrasi hasil antara ini (seperti : H2, asam lemak volatil) toksik.
c. Keunggulan dan Kekurangan Proses Anaerob
Keunggulan proses anaerobik dibandingkan proses aerobik adalah sebagai berikut (Lettingan et al, 1980; Sahm, 1984; Sterritt dan
Lester, 1988; Switzenbaum, 1983) :
Proses anaerobik dapat segera menggunakan CO2 yang ada
sebagai penerima elektron. Proses tersebut tidak membutuhkan oksigen dan pemakaian oksigen dalam proses penguraian limbah akan menambah biaya pengoperasian.
Penguraian anaerobik menghasilkan lebih sedikit lumpur (3-20 kali lebih sedikit dari pada proses aerobik), energi yang dihasilkan
bakteri anaerobik relatif rendah. Sebagian besar energi didapat dari pemecahan substrat yang ditemukan dalam hasil akhir, yaitu CH4. Dibawah kondisi aerobik 50% dari karbon organik dirubah
menjadi biomassa, sedangkan dalam proses anaerobik hanya 5% dari karbon organik yang dirubah menjadi biomassa. Dengan proses anaerobik satu metrik ton COD tinggal 20 - 150 kg biomassa, sedangkan proses aerobik masih tersisa 400 - 600 kg biomassa (Speece, 1983; Switzenbaum, 1983).
Proses anaerobik menghasilkan gas yang bermanfaat, metan. Gas metan mengandung sekitar 90% energi dengan nilai kalori 9.000 kkal/m3, dan dapat dibakar ditempat proses penguraian atau untuk menghasilkan listrik. Sedikit energi terbuang menjadi panas (3-5%). Produksi metan menurunkan BOD dalam Penguraian lumpur limbah.
Energi untuk penguraian limbah kecil.
Penguraian anaerobik cocok untuk limbah industri dengan konsentrasi polutan organik yang tinggi.
Memungkinkan untuk diterapkan pada proses penguraian limbah dalam jumlah besar.
Sistem anaerobik dapat membiodegradasi senyawa xenobiotik (seperti chlorinated aliphatic hydrocarbons seperti
trichlorethylene, trihalo-methanes) dan senyawa alami recalcitrant
seperti lignin.
Beberapa kelemahan Penguraian anaerobik : Lebih Lambat dari proses aerobik Sensitif oleh senyawa toksik
Start up membutuhkan waktu lama Konsentrasi substrat primer tinggi
3.3.2.3. Proses Pengolahan Biologis Secara Aerob
a. Mekanisme Proses Aerob
Di dalam proses pengolahan air limbah organik secara biologis aerobik, senyawa komplek organik akan terurai oleh aktifitas mikroorganisme aerob. Mikroorganisme aerob tersebut di dalam aktifitasnya memerlukan oksigen atau udara untuk memecah senyawa organik yang komplek menjadi CO2 (karbon dioksida) dan
air serta ammonium, selanjutnya ammonium akan dirubah menjadi nitrat dan H2S akan dioksidasi menjadi sulfat. Secara sederhana
reaksi penguraian senyawa organik secara aerobik dapat digambarkan sebagai berikut :
Reaksi Penguraian Organik :
Oksigen (O2)
Senyawa Polutan organik CO2 + H20 + NH4 + Biomasa
Heterotropik Reaksi Nitrifikasi : NH4 + + 1,5 O2---> NO2 - + 2 H+ + H2O NO2 - + 0,5 O2 ---> NO3 -
Reaksi Oksidasi Sulfur : S2 - + ½ O2 + 2 H
+
---> S0 + H2O
Berbeda dengan proses anaerob, beban pengolahan pada proses aerob lebih rendah, sehingga prosesnya ditempatkan sesudah proses anaerob. Pada proses aerob hasil pengolahan dari proses anaerob yang masih mengandung zat organik dan nutrisi diubah menjadi sel bakteri baru, hidrogen maupun karbondioksida oleh sel bakteri dalam kondisi cukup oksigen.
b. Faktor-Faktor Yang Mempengaruhi Mekanisme Proses Aerob
1) Temperatur
Temperatur tidak hanya mempengaruhi aktivitas metabolisme dari populasi mikroorganisme, tetapi juga mempengaruhi beberapa faktor seperti kecepatan transfer gas dan karakteristik pengendapan lumpur. Temperatur optimum untuk mikroorganisme dalam proses aerob tidak berbeda dengan proses anaerob.
2) Keasaman (pH)
Nilai pH merupakan faktor kunci bagi pertumbuhan mikroorganisme. Beberapa bakteri dapat hidup pada pH diatas 9,5 dan di bawah 4,0. Secara umum pH optimum bagi pertumbuhan mikroorganisme adalah sekitar 6,5-7,5.
3) Waktu Tinggal Hidrolis (WTH)
Waktu Tinggal Hidrolis (WTH) adalah waktu perjalanan limbah cair di dalam reaktor, atau lamanya proses pengolahan limbah
cair tersebut. Semakin lama waktu tinggal, maka penyisihan yang terjadi akan semakin besar. Sedangkan waktu tinggal pada reaktor aerob sangat bervariasi dari 1 jam hingga berhari -hari.
4) Nutrien
Di samping kebutuhan karbon dan energi, mikroorganisme juga membutuhkan nutrien untuk sintesa sel dan pertumbuhan. Kebutuhan nutrien tersebut dinyatakan dalam bentuk perbandingan antara karbon dan nitrogen serta phospor yang merupakan nutrien anorganik utama yang diperlukan mikroorganisme dalam bentuk BOD : N : P
3.3.3. Pengolahan Air Limbah Dengan Proses Biofilter 3.3.3.1. Reaktor Biofilter Tercelup
Reaktor biofilter lekat tercelup adalah suatu bioreaktor lekat diam dimana mikroorganisme tumbuh dan berkembang di atas suatu media, yang dapat terbuat dari plastik atau batu, yang di dalam operasinya dapat tercelup sebagian atau seluruhnya, atau hanya dilewati air saja (tidak tercelup sama sekali), dengan membentuk suatu lapisan lendir untuk melekat di atas permukaan media tersebut, sehingga membentuk lapisan biofilm.Biofilm tumbuh pada hampir semua permukaan di dalam suatu lingkungan perairan. Sistem biofilm ini kemudian dimanfaatkan dalam proses pengolahan air buangan untuk menurunkan kandungan senyawa organik. Biofilm merupakan lapisan yang terbentuk dari sel-sel bio solid dan material inorganik
dalam bentuk polimetrik matriks yang menempel pada suatu lapisan penyokong (support media).
Proses pengolahan air limbah dengan sistem biofilm atau biofilter secara garis besar dapat dilakukan dalam kondisi aerobik, anaerobik, atau kombinasi anaerobik dan aerobik. Proses aerobik dilakukan dengan kondisi adanya oksigen terlarut di dalam reaktor air limbah, dan proses anaerobik dilakukan dengan tanpa adanya oksigen di dalam reaktor air limbah. Sedangkan proses kombinasi anaerob-aerob adalah merupakan gabungan proses anaerobik dan proses aerobik. Proses operasi biofilter secara anaerobik digunakan untuk air limbah dengan kandungan zat organik cukup tinggi, dan dari proses ini akan dihasilkan gas methan. Jika kadar COD limbah kurang dari 4000 mg/l seharusnya limbah tersebut diolah pada kondisi aerob, sedangkan COD lebih besar dari 4000 mg/l diolah pada kondisi anaerob.
3.3.3.2.Prinsip Pengolahan Air Limbah Dengan Proses Biofilter Tercelup
Proses pengolahan air limbah dengan sistem biofilm atau biofilter secara garis besar dapat diklasifikasikan seperti pada Gambar 3.26. Proses tersebut dapat dilakukan dalam kondisi aerobik, anaerobik atau kombinasi anaerobi dan aerobik. Proses aerobik dilakukan dengan kondisi adanya oksigen terlarut di dalam reaktor air limbah, dan
proses anaerobik dilakukan dengan tanpa adanya oksigen dalam reaktor air limbah.
Sedangkan proses kombinasi anaerob-aerob adalah merupakan gabungan proses anaerobi dan proses aerobik. Proses ini biasanya digunakan untuk menghilangan kandungan nitrogen di dalam air limbah. Pada kondisi aerobik terjadi proses nitrifikasi yakni nitrogen ammonium diubah menjadi nitrat (NH4
+ NO
3 ) dan pada
kondisi anaerobik terjadi proses denitrifikasi yakni nitrat yang terbentuk diubah menjadi gas nitrogen (NO3 N2 ).
Mekanisme proses metabolisme di dalam sistem biofilm secara aerobik secara sederhana dapat diterangkan seperti pada Gambar 3.27.
Gambar 3.26 : Klasifikasi Cara Pengolahan Air Limbah Dengan Proses Film Mikrobiologis (Proses Biofilm)
Gambar 3.27 : Mekanisme Proses Metabolisme Di Dalam Sistem Biofilm
Gambar tersebut menunjukkan suatu sistem biofilm yang yang terdiri dari medium penyangga, lapisan biofilm yang melekat pada medium, lapisan alir limbah dan lapisan udara yang terletak diluar. Senyawa polutan yang ada di dalam air limbah misalnya senyawa organik (BOD, COD), ammonia, phospor dan lainnya akan terdifusi ke dalam lapisan atau film biologis yang melekat pada permukaan medium. Pada saat yang bersamaan dengan menggunakan oksigen yang terlarut di dalam air limbah senyawa polutan tersebut akan diuraikan oleh mikroorganisme yang ada di dalam lapisan biofilm dan energi yang dihasilkan akan diubah menjadi biomasa. Suplai oksigen pada lapisan biofilm dapat dilakukan dengan beberapa cara misalnya pada sistem RBC yakni dengan cara kontak dengan udara luar, pada sistem “Trickling Filter”
dengan aliran balik udara, sedangkan pada sistem biofilter tercelup dengan menggunakan blower udara atau pompa sirkulasi.
Jika lapisan mikrobiologis cukup tebal, maka pada bagian luar lapisan mikrobiologis akan berada dalam kondisi aerobik sedangkan pada bagian dalam biofilm yang melekat pada medium akan berada dalam kondisi anaerobik. Pada kondisi anaerobik akan terbentuk gas H2S, dan jika konsentrasi oksigen terlarut cukup besar
maka gas H2S yang terbentuk tersebut akan diubah menjadi sulfat
(SO4) oleh bakteri sulfat yang ada di dalam biofilm.Selain itu pada
zona aerobik nitrogen–ammonium akan diubah menjadi nitrit dan nitrat dan selanjutnya pada zona anaerobik nitrat yang terbentuk mengalami proses denitrifikasi menjadi gas nitrogen. Oleh karena di dalam sistem bioflim terjadi kondisi anaerobik dan aerobik pada saat yang bersamaan maka dengan sistem tersebut maka proses penghilangan senyawa nitrogen menjadi lebih mudah. Hal ini secara sederhana ditunjukkan seperti pada Gambar 3.28.
Proses pengolahan air limbah dengan proses biofilm atau biofilter tercelup dilakukan dengan cara mengalirkan air limbah ke dalam reaktor biologis yang di dalamnya diisi dengan media penyangga untuk pengembangbiakan mikroorganisme dengan atau tanpa aerasi. Untuk proses anaerobik dilakukan tanpa pemberian udara atau oksigen. Posisi media biofilter tercelup di bawah permukaan air. Media biofilter yang digunakan secara umum dapat berupa bahan material organik atau bahan material anorganik.
Gambar 3.28 : Mekanisne Penghilangan Ammonia Di Dalam Proses Biofilter
Untuk media biofilter dari bahan organik misalnya dalam bentuk tali, bentuk jaring, bentuk butiran tak teratur (random packing), bentuk papan (plate), bentuk sarang tawon dan lain-lain. Sedangkan untuk media dari bahan anorganik misalnya batu pecah (split), kerikil, batu marmer, batu tembikar, batu bara (kokas) dan lainnya.
Di dalam proses pengolahan air limbah dengan sistem biofilter tercelup aerobik, sistem suplai udara dapat dilakukan dengan berbagai cara, tetapi yang sering digunakan adalah seperti yang tertera pada Gambar 3.29. Beberapa cara yang sering digunakan antara lain aerasi samping, aerasi tengah (pusat), aerasi