TINJAUAN PUSTAKA
Hawar Daun Bakteri (HDB) Penyakit HDB merupakan penyakit utama padi sawah di Indonesia yang disebabkan oleh bakteri Xanthomonas oryzae pv oryzae (Xoo). Menurut Ou (1985) penyakit HDB pertama kali ditemukan di Indonesia pada tahun 1948/1949 pada musim hujan, pada waktu itu penyakit ini disebut sebagai kresek atau hama lodoh dan diamati di Indonesia pertama kali pada tahun 1988 (Mew 1988). Tahun 1999 Nyvall (1999) dalam Liu et al. (2006) melaporkan bahwa kresek merupakan salah satu jenis gejala dari HDB yakni serangan HDB terjadi pada masa pembibitan, yang menyebabkan daun pada tanaman menjadi kuning pucat, layu, dan mati. Kresek merupakan gejala penyakit yang paling destruktif, sedangkan HDB adalah gejala yang lebih umum. Infeksi terjadi pada tanaman padi setelah pembibitan hingga dewasa. Infeksi ditandai dengan water-soaked greyish atau corak keabu-abuan dalam 1 – 2 minggu. Bagian ujung daun padi yang terinfeksi akan meluas hingga pelepah daun (Mew et al. 1993; Ou 1985).Penyakit HDB dapat menurunkan tingkat produksi padi (Zhao et al. 2007) dan berkurangnya bobot dari 1000 biji secara kuantitatif. Bobot 1000 biji merupakan nisbah dari 1000 biji yang dihasilkan dalam produksi padi. Penurunan hasil padi akibat HDB umumnya berkisar 15 – 23 % (Kadir 2009). Tambah lagi menurut Liu et al. (2006) sebelum diterapkannya penggunaan varietas resisten, dan karantina kerusakan akibat HDB mencapai 20 – 30 %. Kerusakan secara kualitatif dapat berupa penurunan kualitas gabah karena gangguan pemasakan (Ou 1985; Kadir 2009). Kerusakan akibat kresek dapat mencapai hingga 60 – 75 % (Ou 1985). Di Indonesia pada tahun 2006, terdapat 519.200 ha tanaman padi yang terserang dengan organisme pengganggu tanaman (OPT) dan yang terserang HDB seluas 74.243 ha dan merupakan serangan terluas dari HDB (Direktorat Perlindungan Tanaman Pangan 2007). Data terbarukan Direktorat Perlindungan Pangan (2011) melaporkan bahwa di tahun 2010 luas lahan yang terserang penyakit HDB sebesar 54.796 ha dan terus meningkat di masa tanam 2010 – 2011 yaitu sebesar 64.123 ha di seluruh Indonesia. Tinggi dan rendahnya data tersebut disebabkan oleh tingkat perubahan strain pada HDB cukup tinggi.
Pengendalian HDB dilakukan melalui kebiasaan, kimiawi, biologis, dan melalui gen resisten HDB. Pengendalian berdasarkan kebiasaan bercocok tanam padi yakni pemberian disinfektan pada benih, drainase yang tepat pada saat pembibitan, pemberian pupuk, penghilangan tanaman pengganggu, serta pembakaran lahan setelah panen, dan adanya penggiliran tanaman. Pengendalian ini tidak begitu efektif, karena bentuk penyebaran HDB juga dipengaruhi oleh angin dan hujan dari tanaman padi yang terinfeksi lainnya (Liu et al. 2006).
Pengendalian secara kimiawi dilakukan dengan cara pemanfaatan senyawa-senyawa seperti L-kloramfenikol, nikel-dimetilditiokarbamat, detianon, dan fentiazon, namun sebagian besar tidak bisa diharapkan, karena selain mahal, adanya variabilitas yang tinggi dari HDB (Gnanamanickam et al. 1999). Pengendalian secara biologis biasanya menggunakan bakteri antagonis dari HDB yakni Pseudomonas flourescens, P. putida, dan beberapa jenis Bacillus. Meskipun secara sistematik respon antara bio-kontrol dan HDB tidak diketahui, akan tetapi penelitian Vasudevan et al. pada tahun 2002 dalam Liu et al. (2006) menunjukkan interaksi tersebut juga dipengaruhi oleh padi yang memiliki gen resisten. Penggunaan padi yang mengandung gen resisten HDB merupakan pengendalian HDB yang efektif karena membawa lebih banyak ketahanan berbeda sehingga mempunyai spektrum ketahanan yang lebih luas dan lebih awet (McCouch & Tanksley 1991 dalam Suwarno et al. 2002). Menurut Liu et al. (2006) telah diketahui 29 gen resisten HDB yakni gen Xa (Tabel 1). Gen Xa5, Xa7, dan Xa21 merupakan gen yang paling efektif untuk strain bakteri di Indonesia (Suwarno et al. 2002).
Tabel 1 Gen-gen resisten terhadap HDB Gen Kromosom Sumber Gen Xa1 Xa2 Xa3 Xa4 xa5 Xa7 xa8 Xa10 Xa11 4 4 11 11 5 6 7 11 Bk Kogyoku Tetep Wase aikoku 3 TKM 6 Aus Boro Lines
DV85 P1231129
Cas209 IR8,IR944
(Lanjutan dari Tabel 1)
Gen Kromosom Sumber Gen Xa12 xa13 Xa14 xa15 Xa16 Xa17 Xa18 xa19 xa20 Xa21 Xa22 Xa23 xa24 Xa25(a) Xa25(b) Xa26 Xa27 xa28 Xa29 4 8 4 Bk Bk Bk Bk Bk Bk 11 11 11 Bk 4 12 11 6 Bk 1 Kogyoku BJ1 (Aus Boro) TN1 M41, Mutant Herebare Tetep Asominori IR24, Tonoyoshiki XM5 XM6 O.longistaminata Zhachanglong O.rufipogon DV86, DV85, Aus295 HX-3,mutant Minghui 63 Minghui 63 Minghui 63 O. minuta Lota Sail O. officinalis Bk: belum diketahui (Liu et al. 2006)
Karakterisasi Xanthomonas oryzae pv. oryzae
Bakteri Xoo pertama kali dikenal dengan nama Xanthomonas campestris, Xanthomonas oryzae, Xanthomonas kresek, Xanthomonas pv. oryzae hingga akhirnya diidentifikasi dengan nama Xanthomonas oryzae pv. oryzae (Xoo). Bakteri ini tergolong bakteri Gram negatif yang menyebabkan penyakit hawar daun pada tanaman padi (Swings et al. 1990). Klasifikasi Xoo menurut Swings et al. (1990) tergolong dalam dunia Bakteria, filum Proteobakteria, kelas Gamma Proteobakteria, ordo Xanthomodales, famili Xanthomonadaceae, genus Xanthomonas, dan spesies Xanthomonas oryzae pv. oryzae.
Bakteri Xoo berbentuk batang (Gambar 1A), memiliki ujung bulat, sel tunggal memiliki panjang 2.0 µm – 7.0 µm, lebar 0.4µm – 0.7 µm. Sel bergerak dengan menggunakan flagella tunggal yang berada di ujung sel (monotrichous). Pada media padat sel Xoo berbentuk cembung, bulat, berlendir, dan berwarna kuning karena menghasilkan pigmen xanthomonadin (Gambar 1B). Xoo merupakan bakteri aerob obligat yakni bakteri yang memerlukan oksigen untuk pertumbuhannya dan tidak membentuk spora. Suhu optimal untuk tumbuh 25 – 30 oC (Liu et al. 2006).
Bakteri Xoo memiliki inang yang cukup beragam dan umumnya berasal dari golongan Poaceae seperti Oryza sativa, Leersia spp., Laptochloa spp., Paspalum scrabiculatum, dan Zizania. Agrawal dan Sinclair (1996) dalam Agustiansyah (2011) menyatakan bahwa Xoo pada benih padi dapat bertahan selama 9 – 16 bulan. Ketahanan bakteri akan turun setelah masa simpan 2 tahun dengan suhu penyimpanan 25 – 35 oC, turunnya ketahanan bakteri tersebut disebabkan adanya bakteriofage yang mengurangi populasi Xoo. Pada daerah beriklim sedang seperti Australia, Xoo dapat hidup di dalam tanah selama 1 – 3 bulan bergantung terhadap kelembaban dan keasaman tanah. Di daerah tropis, pada musim kemarau Xoo dapat bertahan pada rizofer tanaman dan batang gulma (Ou 1985).
Bakteri Xoo akan menginfeksi padi melalui jaringan hidatoda yang berada pada samping dan ujung daun melalui proses gutasi. Bakteri Xoo akan masuk secara pasif pada daun melalui larutan gutasi yang terbentuk. Selain itu juga melalui luka pada tanaman (Ou 1985). Selanjutnya bakteri termultifikasi di dalam ruang interseluler, dan menyebar ke tanaman lainnya melalui xilem (Liu et al. 2006). Setelah beberapa hari sel bakteri mengisi pembuluh xilem, terdapat bintik-bintik seperti benang pada daun. Proses ini menjadi karakteristik utama bahwa tanaman padi telah terinfeksi HDB (Mew et al. 1993). Penyebaran Xoo dari setiap tanaman dipengaruhi melalui angin, hujan, air irigasi, adanya singgungan antar daun padi, petani, dan hama (Nyvall 1999 dalam Liu et al. 2006). Bakteri Xoo diketahui merupakan bakteri yang memiliki patotipe yang tinggi. Telah dilaporkan bahwa terdapat 30 strain Xoo yang berbeda dari beberapa negara (Adhikari et al. 1996; Mew 1988; Noda et al. 2001 dalam Liu et al. 2006). Di Indonesia, yang telah dilaporkan Kadir (2009) dalam Tabel 2 terdapat 8 strain Xoo (II, III, IV, V, VI, VII, VIII, X, XII) di berbagai wilayah. Bakteri Xoo memiliki tingkat perbedaan
Gambar 1 Fisiologi bakteri Xoo. (A) Sel tunggal Xoo dalam SEM. (B) Xoo dalam media yeast extract agar (Liu et al. 2006).
Tabel 2 Perkembangan strain Xoo di daerah penghasil padi di Indonesia.
Tahun Strain Daerah
Penularan 1977 1980 1996/1997 1997 1997/1998 1998 1998/1999 1999/2000 2000 2001 2009
II, III, IV, V
III, IV,V, VI, VIII IV, VII, X III, IV, VII,
VIII VIII, XII
VIII V, VIII, X III, IV, VIII
V, VI, VIII, X III, IV, VIII
X Sulawesi Selatan, Jawa, Bali, Kalimantan Jawa Barat Jawa Barat Jawa Barat Jawa Barat Jawa Barat Jawa Barat Jawa Barat, Jawa Tengah, DIY Jawa Tengah Jawa Barat Jawa Barat Sumber: Kadir (2009)
genetik yang tinggi diantara beda isolat berdasarkan analisis patotipe dari 300 isolat berbeda dari Asia (Adhikari et al. 1995). Tingginya variabilitas tersebut disebabkan adanya interaksi antara inang (Oryza sativa), bakteri Xoo, lingkungan abiotik dan biotik. Perubahan salah satu komponen
mempengaruhi patogenitas Xoo (Kadir 2009). Padi Varietas Galur Isogenik Galur isogenik atau near-isogenic lines (NILs) adalah galur padi yang memiliki susunan genetik yang sama kecuali satu atau beberapa pada gen atau lokus tertentu yang sengaja disisipkan dan telah diketahui fungsinya dengan jelas. Pembuatan padi varietas galur isogenik dilakukan dengan metode silang balik (cross back), hingga didapatkan gen yang diharapkan (Hartini & Kardin 1998). Perakitan galur isogenik pada padi telah berhasil dilakukan oleh Ogawa et al. pada tahun 1991 dalam Hartini dan Kardin (1998) dengan menggunakan padi kultivar IR24 sebagai tetua ulangan dan padi yang diketahui mengandung gen resisten HDB sebagai tetua donor (Tabel 1). Kultivar IR24 dipilih karena kerentanannya terhadap semua jenis strain yang ada di Jepang dan Filipina (Ogawa & Yamamoto, 1987). Padi varietas galur isogenik selanjutnya dimanfaatkan untuk memantau perubahan komposisi patotipe Xoo di suatu daerah karena galur isogenik memiliki latar belakang genetika yang seragam. Hubungan yang mengikuti pola gen ke gen patotipe Xoo dan kultivar padi mempermudah untuk mengetahui jumlah dan komposisi gen virulen pada masing-masing patotipe Xoo (Hartini & Kardin 1998).
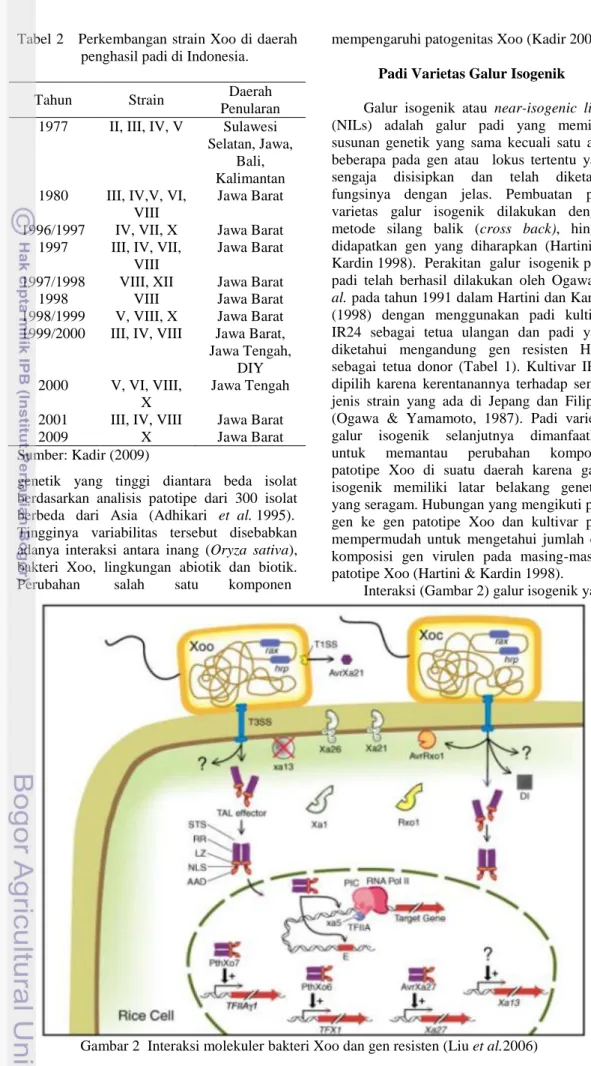
Interaksi (Gambar 2) galur isogenik yang
mengandung gen resisten HDB terhadap virulensi Xoo, secara molekuler akan menghasilkan reaksi berantai sebagai bentuk pertahanan tanaman padi yang sesuai dengan konsep gen ke gen. Virulensi Xoo pada umumnya akan dipengaruhi oleh dua gen yakni gen rax dan hrp (Liu et al 2006). Kedua gen tersebut menyandikan protein yang akan membentuk sistem sekresi. Gen rax akan menyandikan protein sekresi pada sekresi tipe 1 yakni T1SS (type 1 secretion system). Protein virulen Xoo atau disebut dengan elisitor yang melalui sekresi tersebut adalah avrXa21, avrXa26, avrXa1, avrxa5, dan avrxa13 (Burdman et al. 2004). Gen hrp atau singkatan dari hypersensitivity reaction and for pathogenesis yang akan menyandikan sistem sekresi yakni T3SS (Type III secretion system merupakan protein yang bersifat hidrofobik). Elisitor Xoo melalui sekresi tersebut adalah avrXa2, avrXa7, avrXa10 (Schornack et al 2006). Sedangkan elisitor -elisitor tersebut disandikan oleh kelompok gen AvrBs3/ PthA seperti gen PthXo06, PthXo07 yang menyandikan protein serupa transcription activator-like (TAL) yang selanjutnya akan mempengaruhi proses transkripsi (Liu et al. 2006).
Teknik Biomolekuler Polymerase Chain Reaction (PCR) Koloni
Teknik biomolekuler merupakan teknik yang berkaitan dengan analisis makromolekul. Analisis makromolekul dapat dilakukan berdasarkan atas reaksi kimiawi yang ditimbulkan oleh interaksinya dengan molekul lain. Salah satu teknik dasar biomolekuler adalah Polymerase Chain Reaction (PCR) (Yuwono 2006). Teknik PCR ditemukan oleh Kary Mulis dan memperoleh hadiah nobel pada tahun 1993. Teknik tersebut banyak digunakan secara luas dalam biologi molekuler, termasuk dalam pendeteksian patogen tanaman (Sakthivel et al. 2000). Penamaan PCR berasal dari komponen kunci PCR yakni DNA polimerase. DNA polimerase merupakan enzim dalam replikasi
in vitro yang digunakan dalam
mengamplifikasi utas DNA secara eksponensial sejumlah 2n (n adalah jumlah siklus) sehingga terjadi reaksi berantai yang menghasilkan jutaan DNA dari satu utas DNA. Reaksi rantai polimerase merupakan reaksi penggandaan fragmen DNA dengan sensitivitas, selektivitas yang tinggi, dan terjadi pada waktu yang sangat cepat. Sensitivitas dan selektivitas ditentukan oleh
dua fragmen oligonukleotida (umumnya dengan panjang 20 bp) atau disebut dengan primer (Theopillus & Rapley 2002).
Teknik PCR memerlukan DNA sebagai target pengamplifikasi dengan panjang urutan terpendek 50 – 100 bp dan urutan terpanjang 10 kb. Lalu diperlukan primer yang akan menandai bagian tertentu dari DNA sebagai titik awal dan akhir dari sintesis DNA. Proses pemanjangan DNA target pun memerlukan enzim yang stabil dalam panas seperti Taq polimerase yakni enzim yang diisolasi dari bakteri Thermus aquaticus (bakteri golongan termofilik) hidup pada suhu 70 – 80 oC. Taq polimerase akan berfungsi sebagai pengkatalis reaksi polimerisasi DNA maka diperlukan kompleks pembangun DNA yakni deoksinukleotida trifosfat (dNTP) yang mengandung adenin (A), guanin (G), sitosin (C), dan timin (T). Komponen lainnya yang diperlukan dalam PCR yakni larutan bufer yang berfungsi menjaga keoptimuman aktivitas dan stabilitas DNA dari pengaruh lingkungan dan larutan MgCL2 yang berfungsi untuk membantu keefektifan Taq polimerase (Theopillus & Rapley 2002).
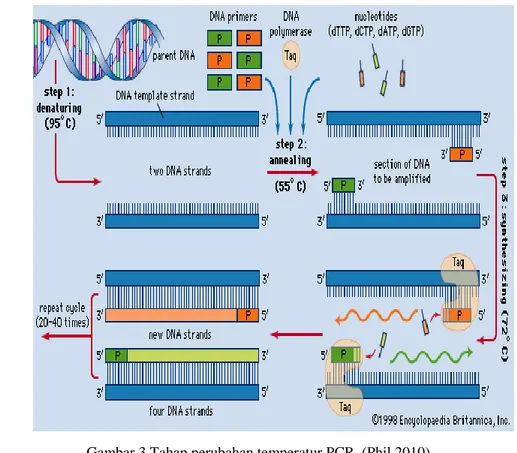
Teknik PCR pun dapat digunakan untuk memayar koloni bakteri menggunakan primer spesifik disebut dengan PCR koloni (Sakthivel et al. 2000). Prinsip kerja PCR koloni pada umumnya berdasarkan perubahan temperatur. Temperatur berguna untuk enzim dalam polimerisasi DNA, pemutusan ikatan hidrogen, dan titik leleh dari primer. PCR koloni juga akan memiliki siklus temperatur amplifikasi pada tiga tahap (Gambar 3) yakni denaturasi, penempelan, dan pemanjangan. Pada tahap denaturasi suhu 94 – 98 oC selama 20 – 30 detik menyebabkan pemutusan ikatan hidrogen sehingga menghasilkan utas tunggal DNA. Selanjutnya tahap penempelan (annealing) suhu 50 – 65 oC selama 20 – 40 detik merupakan tahap penempelan primer terhadap utas DNA yang terbentuk pada tahap sebelumnya. Suhu pada tahap ini akan bergantung pada Tm (temperature melting) dari primer. Biasanya temperatur berada sekitar 3 – 5 oC di bawah Tm primer dan akan menunjukkan reaksi secara spesifik (McPherson & Moller 2006). Pada tahap ini primer tersisipkan dengan DNA target dan akan membentuk komplemen. Tahap akhir
adalah tahap pemanjangan
(elongation/extension) suhu 72 oC selama 45 detik – 3 menit tergantung panjang fragmen DNA. Suhu 72 oC merupakan suhu aktivitas optimum dari Taq polimerase. Pada tahap ini Taq polimerase akan mensintesis
DNA baru melalui penambahan dNTP dengan arah pertumbuhan 5’ – 3’. Siklus akan terus berulang sesuai dengan yang diinginkan (Pestana et al. 2010).
Umumnya tahap kerja PCR koloni didahului dan diakhiri oleh tahapan pra-denaturasi dan final elongasi. Pra-denaturasi dilakukan selama 1 – 3 menit jika komponen GC pada DNA target kurang dari 50% atau akan mencapai 10 menit jika kandungan GC DNA target berlebih. Proses ini memastikan kesempurnaan denaturasi dan mengaktivasi Taq polimerase karena bersifat hot-start atau aktif setelah dipanaskan terlebih dahulu. Disamping itu, pada fase ini terjadi perusakan awal dari sel sehingga primer akan mudah tersisipkan pada DNA target. Final elongasi dilakukan pada suhu optimum enzim (70 – 72 oC) selama 5 – 15 menit untuk memastikan bahwa setiap utas tunggal yang tersisa sudah diperpanjang secara sempurna. Proses ini dilakukan setelah siklus PCR berakhir dan sangat penting ketika fragmen DNA akan diperbanyak ke dalam vektor (Pestana et al. 2010).
Elektroforesis Fragmen DNA Teknik elektroforesis merupakan teknik bioanalitik yang berfungsi untuk memisahkan molekul dalam suatu campuran dengan
pengaruh medan listrik yang dialirkan pada suatu medium yang mengandung sampel yang akan dipisahkan. Teknik ini memanfaatkan muatan listrik yang ada pada makromolekul seperti DNA sehingga terjadi pemisahan fragmen DNA (Yuwono 2006).
Elektroforesis fragmen DNA terjadi dengan adanya peran medium yang memisahkan dua elektroda yakni katoda untuk menunjukkan kutub negatif dan anoda untuk menunjukkan kutub positif. Molekul yang bermuatan negatif akan menuju ke arah anoda dan begitu pula sebaliknya (Mikkelsen & Corton 2004). Fragmen DNA dipisahkan melalui media yakni gel poliakrilamid dan agarosa. Poliakrilamid biasanya digunakan untuk DNA dengan ukuran molekul kurang dari 100 nukleotida, sedangkan agarosa adalah gel yang lebih umum digunakan karena mampu memisahkan fragmen DNA yang lebih panjang (Nelson & Cox 2004).
Gel agarosa adalah suatu bahan semi padat dengan dasar struktur D-galaktosa dan 3,6-anhidro L-galaktosa yang diekstraksi dari rumput laut. Gel agarosa biasanya dilakukan dalam konfiguarsi horizontal dengan kekuatan medan listrik dan arah tetap. Gel agarosa dibuat dengan melarutkannya ke dalam bufer. Agar dapat larut dengan baik, pelarutan tersebut dibantu dengan pemanasan, misalnya menggunakan oven gelombang mikro. Gambar 3 Tahap perubahan temperatur PCR (Phil 2010).