Referat
LESI PRAKANKER SERVIKS
Perceptor : dr. Zulfadli, Sp.OG
Oleh :
Ni Made Shanti Iswari Dewi 1618012036
KEPANITERAAN KLINIK OBSTETRI & GINEKOLOGI FAKULTAS KEDOKTERAN
UNIVERSITAS LAMPUNG RSUD DR. H. ABDUL MOELOEK
i
KATA PENGANTAR
Puji dan syukur saya ucapkan atas kehadirat Tuhan Yang Maha Esa yang telah memberikan rahmat dan karunia-Nya sehingga saya dapat menyusun referat ini yang berjudul “Lesi Prakanker Serviks”.
Penulis sampaikan terima kasih kepada dr. Zulfadli, Sp,OG yang telah membimbing dan membantu penulis dalam penyelesaian referat ini sehingga referat ini, sehingga referat ini dapat selesai dengan baik.
Tidak ada gading yang tak retak. Penulis menyadari bahwa referat ini jauh dari sempurna, oleh karena itu penulis mengharapkan kritik dan saran dari para pembaca. Semoga referat ini bermanfaat dan dapat memperluas wawasan ilmu pengetahuan.
Bandar Lampung, Juli 2017
ii
DAFTAR ISI
KATA PENGANTAR ... i
DAFTAR GAMBAR ... iii
DAFTAR TABEL ... iv
BAB IPENDAHULUAN ... 1
1.1 Latar Belakang ... 1
BAB IITINJAUAN PUSTAKA ... 2
2.1 Definisi ... 2 2.2 Epidemiologi ... 3 2.3 Etiologi ... 3 2.4 Faktor Resiko ... 5 2.5 Patogenesis ... 10 2.6 Gejala Klinis ... 13
2.7 Klasifikasi Lesi Prakanker ... 14
2.8 Staging Kanker Serviks Versi FIGO ... 16
2.9 Skrining lesi prakanker serviks ... 17
2.10 Tatalaksana Lesi Prakanker Serviks ... 25
2.11 Pencegahan ... 28
BAB IIIKESIMPULAN ... 30
iii
DAFTAR GAMBAR
Gambar 1. Virulensi HPV ... 4
Gambar 2. Perjalanan HPV hingga lesi pra kanker... 5
Gambar 3. Perkembangan NIS menjadi karsinoma invasif ... 10
Gambar 4. Ekspresi E6 dan E7 pada kanker serviks ... 12
Gambar 5. Gambaran histopatologi perjalanan kanker serviks ... 15
Gambar 6. Epitel squamous dan kolumnar serviks ... 18
Gambar 7. Gambaran kolposkopi NIS I, II, dan III ... 18
Gambar 8. IVA negatif ... 21
Gambar 9. IVA positif... 21
Gambar 10. Suspek karsinoma serviks ... 21
Gambar 11 Algoritma skrining dan tatalaksana lesi prakanker ... 25
Gambar 12. Krioterapi ... 26
Gambar 13 Biopsi cold knife cone ... 27
iv
DAFTAR TABEL
Tabel 1. Klasifikasi Lesi Prakanker dengan beberapa sistem ... 14
Tabel 2. Staging Kanker Serviks FIGO 2000 ... 16
Tabel 3. Kategori temuan IVA ... 20
1
BAB I PENDAHULUAN
1.1 Latar Belakang
Permasalahan kanker serviks di Indonesia telah berkembang dan bertambah angka mortalitasnya hingga 80%. Di sisi lain, 70% penderita sudah ditemukan dalam kondisi stadium lanjut. Kondisi ini terjadi pula di beberapa negara berkembang dan menurun di negara maju dengan adanya kebijakan kesehatan yang komprehensif.1 Berdasarkan data WHO regional ASEAN, angka kejadian kanker serviks di Singapura sebesar 25,0 pada ras Cina, 17,8, pada ras Melayu dan Thailand sebesar 23,7 per 100.000 penduduk. Sedangkan, di Indonesia diperkirakan ditemukan 40 ribu kasus baru kanker serviks setiap tahunnya. Menurut data kanker berbasis patologi di 13 pusat laboratorium patologi, kanker serviks merupakan penyakit kanker yang memiliki jumlah penderita terbanyak di Indonesia, yaitu lebih kurang 36%.Namun kanker serviks merupakan penyakit yang bisa dicegah.1
Pencegahan kanker serviks dapat diperoleh dengan menemukan stadium dini atau lesi prakanker awal yang dikenal dengan neoplasia intraepitelial serviks (NIS). NIS merupakan perubahan diplastik epitel serviks secara dini yang mendahului sebelum terjadinya kanker invasif. Infeksi oleh Human Papilloma Virus (HPV) terutama HPV risiko tinggi (HR-HPV) tipe 16 atau tipe 18, adalah penyebab utama dari NIS.3 Mendiagnosis lesi pra kanker serviks dinilai dari anamnesis pemeriksaan sitologi dengan tes pap smear masih merupakan pemeriksaan standar untuk deteksi dini keganasan serviks. Selain, metode pap smear WHO juga merekomendasikan cara lain untuk negara berkembang dalam deteksi dini kanker serviks. Konsep ini dimaksudkan untuk deteksi penyakit pada stadium dini, salah satunya dengan cara inspeksi visual dengan asam asetat. Pengolesan asam asetat 3-5% pada serviks pada epitel abnormal akan memberikan gambaran bercak putih yang disebut acetowhite.5
2
BAB II
TINJAUAN PUSTAKA
2.1 Definisi
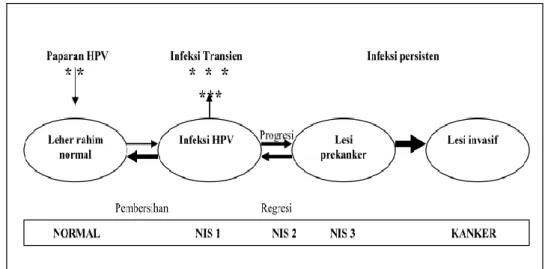
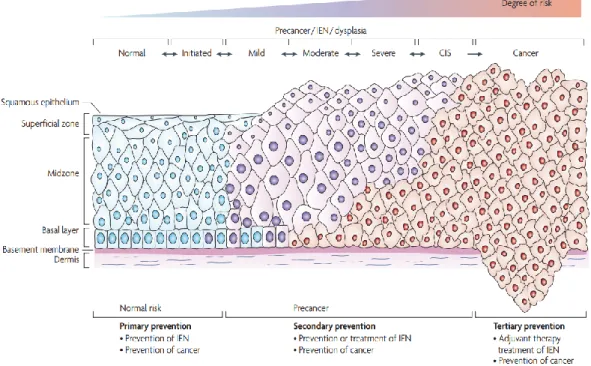
Lesi prakanker atau yang dikenal dengan NIS adalah kelainan pada epitel serviks akibat perubahan sel pada lapisan epitel serviks namun kelainan belum menembus lapisan basal (membran basalis). Perubahan epitel serviks dengan gambaran di antara karsinoma insitu dan epitel normal disebut sebagai displasia.3 Pada dasarnya faktor risiko lesi prakanker dan kanker serviks adalah sama. Serviks secara alami mengalami proses pertumbuhan sel abnormal akibat saling menekan pada kedua lapisan. Dengan masuknya virus, portio yang dalam keadaan erosi (metaplasia skuamosa) yang awalnya fisiologik menjadi berkembang kearah abnormal (displastik-diskariotik) melewati tingkatan NIS I, karsinoma yang secara klasik dinyatakan dapat berkembang menjadi NIS II, dan kemudian menjadi NIS III dan selanjutnya berkembang menjadi karsinoma in-situ.2
Perlu ditekankan bahwa sebagian besar (mungkin semua) karsinoma sel gepeng serviks invasif berasal dari NIS. Terminologi dari lesi preinvasif serviks telah mengalami perubahan beberapa kali. Terminologi NIS dibagi menjadi 3 derajat:
-NIS I - sesuai dengan displasia ringan -NIS II - sesuai dengan displasia sedang -NIS III - meliputi displasia berat dan ca insitu
Terminologi NIS menegaskan kembali konsep bahwa lesi prekursor dari kanker serviks membentuk suatu rangkaian proses yang berkelanjutan. Semua derajat dari lesi ini mempunyai potensi untuk menjadi kanker serviks bila dibiarkan tanpa pengobatan. Karena risiko untuk menjadi progresif dari semua tingkatan lesi prekursor ini tidak dapat diketahui maka ditegaskan bahwa semua lesi NIS sebaiknya diobati.2
3 Sistem Bethesda (1989) mengategorikan NIS I dan infeksi HPV sebagai Low Grade Squamous Intraepithelial Lesions (LSIL) dan NIS II serta NIS III sebagai High Grade Squamous Intraepithelial Lesions (HSIL). Walaupun klasifikasi sistem Bethesda mencoba untuk menyederhanakan pelaporan dan membantu penanganan klinik serta menghindari perbedaan persepsi penilaian patologi, pemahaman perjalanan alamiah dari prekursor kanker serviks belum begitu baik.2
2.2 Epidemiologi
Kanker serviks menduduki urutan ke-7 secara global dalam segi angka kejadian dan urutan ke-8 sebagai penyebab kematian (menyumbangkan 3,2% mortalitas, sama dengan angka mortalitas akibat leukemia). Kanker serviks menduduki urutan tertinggi di negara berkembang, dan urutan ke 10 pada negara maju atau urutan ke 5 secara global. Di Indonesia kanker serviks menduduki urutan kedua dari 10 kanker terbanyak berdasarkan data dari patologi anatomi tahun 2010 dengan insidens sebesar 12,7%. Menurut perkiraan Departemen Kesehatan RI saat ini, jumlah wanita penderita baru kanker serviks berkisar 90-100 kasus per 100.000 penduduk dan setiap tahun terjadi 40 ribu kasus kanker serviks.3
2.3 Etiologi
Berdasarkan beberapa penelitian menunjukkan bahwa HPV sebagai penyebab neoplasia servikal. Karsinogenesis pada kanker serviks sudah dimulai sejak seseorang terinfeksi HPV yang merupakan faktor inisiator dari kanker serviks yang menyebabkan terjadinya gangguan sel serviks. HPV tipe 6 dan 11 berhubungan erat dengan diplasia ringan yang sering regresi. HPV tipe 16 dan 18 dihubungkan dengan diplasia berat yang jarang regresi dan seringkali progresif menjadi karsinoma insitu. Infeksi HPV persisten dapat berkembang menjadi NIS.4
4
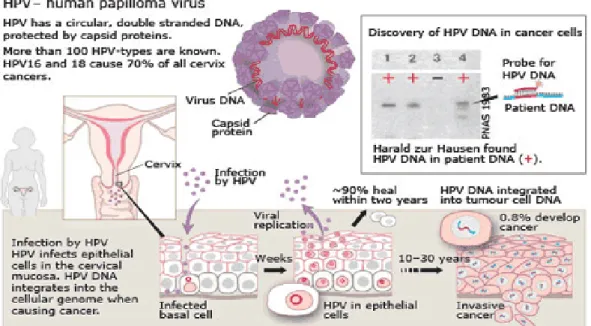
Gambar 1. Virulensi HPV7
Seorang wanita dengan seksual aktif dapat terinfeksi oleh HPV risiko tinggi dan 80% akan menjadi transien dan tidak akan berkembang menjadi NIS. HPV akan hilang dalam waktu 6-8 bulan. Dalam hal ini, respons antibodi terhadap HPV risiko tinggi yang berperan. Dua puluh persen sisanya berkembang menjadi NIS dan sebagian besar, yaitu 80%, virus menghilang, kemudian lesi juga menghilang. Oleh karena itu, yang berperan adalah cytotoxic T-cell. Sebanyak 20% dari yang terinfeksi virus tidak menghilang dan terjadi infeksi yang persisten. NIS akan bertahan atau NIS I akan berkembang menjadi NIS III, dan pada akhirnya sebagiannya lagi menjadi kanker invasif. HPV risiko rendah tidak berkembang menjadi NIS III atau kanker invasif, tetapi menjadi NIS I dan beberapa menjadi NIS II. Infeksi HPV risiko rendah sendiri tidak pernah ditemukan pada NIS III atau karsinoma invasif.5
Berdasarkan hasil program skrining berbasis populasi di Belanda, interval antara NIS I dan kanker invasif diperkirakan 12,7 tahun dan kalau dihitung dari infeksi HPV risiko tinggi sampai terjadinya kanker adalah 15 tahun. Waktu yang panjang ini, di samping terkait dengan infeksi HPV risiko tinggi persisten dan faktor imunologi (respons HPV-specific T-cell dan presentasi antigen), juga diperlukan
5 untuk terjadinya perubahan genom dari sel yang terinfeksi. Dalam hal ini, faktor onkogen E6 dan E7 dari HPV berperan dalam ketidakstabilan genetik sehingga terjadi perubahan fenotipe ganas. Onkoprotein E6 dan E7 yang berasal dari HPV merupakan penyebab terjadinya degenerasi keganasan. Onkoprotein E6 akan mengikat p53 sehingga TSG p53 akan kehilangan fungsinya. Sementara itu, onkoprotein E7 akan mengikat TSG Rb. Ikatan ini menyebabkan terlepasnya E2F yang merupakan faktor transkripsi sehingga siklus sel berjalan tanpa kontrol.5
Gambar 2. Perjalanan HPV hingga lesi pra kanker5
2.4 Faktor Resiko
Ada beberapa faktor yang dapat meningkatkan resiko terjadinya kanker serviks, antara lain adalah :
2.4.1 Hubungan Seksual Usia Dini dan Partner Seksual
Berdasarkan berbagai penelitian, hubungan seks usia dini, dibawah umur 20 tahun memiliki kemungkinan 3 kali lebih besar untuk menderita kanker serviks daripada perempuan saat melakukan hubungan seks diatas umur 20 tahun. Pada penelitian yang dilakukan Suriani di Kecamatan Payangan tahun 2011 didapatkan bahwa umur menikah di bawah 20 tahun dapat meningkatkan risiko terjadinya lesi prakanker serviks sebesar 3 kali dibandingkan menikah umur di atas 20 tahun.6
6 Karsinoma serviks diperkirakan sebagai penyakit yang ditularkan secara seksual. Beberapa bukti menunjukkan adanya hubungan antara riwayat hubungan seksual dan risiko penyakit ini. Sesuai dengan etiologi infeksinya, wanita dengan partner seksual yang banyak dan wanita yang memulai hubungan seksual pada usia muda akan meningkatkan risiko terkena kanker serviks. Karena sel kolumnar serviks lebih peka terhadap metaplasia selama usia dewasa maka wanita yang berhubungan seksual sebelum usia 18 tahun akan berisiko terkena kanker serviks lima kali lipat. Keduanya, baik usia saat pertama berhubungan maupun jumlah partner seksual, adalah faktor risiko kuat untuk terjadinya kanker serviks.8
Selain itu, partner dari pria dengan kanker penis atau partner dari pria yang istrinya meninggal terkena kanker serviks juga akan meningkatkan risiko kanker serviks. Periode rentan ini berhubungan dengan giatnya proses metaplasia pada usia pubertas, sehingga bila ada yang mengganggu proses metaplasia tersebut misalnya infeksi akan memudahkan beralihnya proses menjadi displasia yang lebih berpotensi terjadinya keganasan. Menikah pada usia kurang 20 tahun dianggap terlalu muda untuk melakukan hubungan seksual dan berisiko terkena kanker leher rahim 10-12 kali lebih besar daripada mereka yang menikah pada usia > 20 tahun. Hubungan seks idealnya dilakukan setelah seorang wanita benar-benar matang.8
2.4.2 Usia
Laporan FIGO pada tahun 2015 menyebutkan kelompok usia 30-39 tahun dan 60-69 tahun terbagi sama banyaknya dan beresiko lebih jika ditambah faktor-faktor lainnya. Pada dekade tahun 70-an dilaporkan bahwa umur merupakan faktor risiko kanker serviks. Data dari beberapa rumah sakit pusat pendidikan menyatakan bahwa umur pasien kanker leher rahim terbanyak adalah 55-58 tahun. Pada dekade 90-an umur kasus kanker leher rahim terbanyak antara 43-47 tahun seperti yang dilaporkan oleh rumah sakit Dr. Hasan Sadikin
7 Bandung mendapatkan umur terbanyak 45-59 tahun dan rumah sakit Sanglah Denpasar 41-48 tahun.3
Pada penelitian retrospektif terhadap 2.628 wanita, didapatkan bukti insiden dan derajat keganasan lebih banyak terjadi pada wanita usia tua. Proporsi wanita diatas 35 tahun yang menderita kanker leher rahim meningkat dari 9% menjadi 25%, dan pada tiap penelitian ditemukan bahwa wanita tua mempunyai risiko metastasis limfonodus yang lebih besar. Insidensi metastasis limfonodus pelvis pada wanita tua meningkat dari 23% menjadi 40% selama periode 34 tahun. Wanita yang rentan menderita kanker serviks adalah yang berusia antara 35-50 tahun, terutama yang telah aktif secara seksual sebelum usia 16 tahun. Menurut Benson KL, 2% dari wanita yang berusai 40 tahun akan menderita kanker serviks dalam hidupnya. Hal ini dimungkinkan karena perjalanan penyakit ini memerlukan waktu 7 sampai 10 tahun untuk terjadinya kanker invasif sehingga sebagian besar terjadinya atau diketahuinya setelah berusia lanjut.3
2.4.3 Riwayat Obstetri (Paritas) dan Ginekologi
Walaupun usia menarche atau menopause tidak mempengaruhi risiko kanker serviks, hamil di usia muda dan jumlah kehamilan atau manajemen persalinan yang tidak tepat dapat pula meningkatkan risiko. Berdasarkan penelitian resiko utama dari paritas banyak adanya laserasi jalan lahir sehingga akan mudah terinfeksi HPV dan luka-luka tersebut juga melemahkan sistem pertahanan kulit dimana vagina merupakan lokasi yang tidak steril sehingga infeksi akan lebih mudah masuk.3
Pada wanita dengan paritas 6 atau lebih mempunyai risiko untuk menjadi kanker serviks 2,5 kali lebih besar dibandingkan dengan wanita dengan paritas tiga atau kurang. Eversi epitel kolumner selama kehamilan menyebabkan dinamika baru epitel metaplastic matur sehingga meningkatkan risiko transformasi sel. Middeldorp tahun 2001 membuktikan bahwa pada
8 kehamilan progesteron dapat menginduksi onkogen HPV menjadi stabil sehingga terjadi integrasi DNA virus ke dalam genom penjamu dan menurunnya kekebalan mukosa zona transformasi. Hal ini dapat menjelaskan peningkatan risiko neoplasia serviks pada paritas yang semakin tinggi.3
2.4.4 Kontrasepsi Hormonal
Penggunaan kontrasepsi oral dilaporkan meningkatkan insiden NIS meskipun secara tidak langsung, diduga mempercepat perkembangan progresivitas lesi. Pendapat ini masih kontroversi sebab penelitian lain tidak menemukan hubungan yang jelas antara kontrasepsi oral dengan NIS. Perubahan epitel serviks terlihat setelah pemakaian pil kontrasepsi 5 tahun berturut-turut. Penggunaan kontrasepsi hormonal terutama pil KB kemungkinan mengurangi kadar vitamin C, B12, B6, asam folat B2 dan zinc yang terlibat dalam kekebalan tubuh. Tercatat bahwa 67% wanita dengan kanker leher rahim memiliki sedikitnya 1 kadar vitamin abnormal, 38% terlihat banyak terjadi gangguan penyerapan nutrisi dalam tubuhnya.9
2.4.5 Merokok dan Asap Rokok
Saat ini terdapat data yang mendukung bahwa rokok sebagai penyebab kanker serviks dan hubungan antara merokok dengan kanker sel skuamosa pada serviks (bukan adenoskuamosa atau adenokarsinoma). Mekanisme kerja bisa langsung (aktivitas mutasi mukus serviks telah ditunjukkan pada perokok) atau melalui efek imunosupresif dari merokok. Bahan karsinogenik spesifik dari tembakau dapat dijumpai dalam lendir dari mulut rahim pada wanita perokok. Bahan karsinogenik ini dapat merusak DNA sel epitel skuamosa dan bersama infeksi HPV dapat mencetuskan transformasi keganasan. Zat-zat tersebut akan menurunkan daya tahan serviks di samping merupakan ko-karsinogen infeksi virus. Nikotin, mempermudah semua selaput lendir sel-sel tubuh bereaksi atau menjadi terangsang, baik pada mukosa tenggorokan, paru-paru maupun serviks. Namun tidak diketahui dengan pasti berapa
9 banyak jumlah nikotin yang dikonsumsi yang bisa menyebabkan kanker leher rahim.10
2.4.6 Defisiensi Zat Gizi dan Kondisi Sosio-Ekonomi
Status sosial ekonomi rendah meningkatkan insiden kanker serviks yang berhubungan dengan status gizi. Status gizi berhubungan dengan daya tahan tubuh terhadap infeksi maupun kemampuan melawan keganasan. Status gizi dan peranan mikronutrien seperti kekurangan zink, cuprum, asam folat juga diduga sebagai faktor risiko kanker serviks. Pengolahan makanan dalam suhu tinggi pada makanan yang mengandung protein dan lemak yang tinggi akan membentuk berbagai senyawa mutagenic. Wanita dengan status gizi buruk sangat mudah terinfeksi virus HPV. Seseorang dengan diet ketat akan menimbulkan defisiensi vitamin A, C, dan E dan menurunnya daya imunitas, yang mengarah pada berkembangnya penyakit dengan mudah. Kekurangan yang sangat bermakna dari retinol dapat meningkatkan kemungkinan displasia serviks, dan mempermudah terinfeksi HPV secara independen. Demikian pula pada perempuan dengan kekurangan vitamin C pada makanan dalam jangka waktu lama sehingga kadar vitamin C rendah dalam tubuh, memiliki kemungkinan terjangkit virus HPV yang lebih tinggi.3
2.4.7 Genetik
Bila seorang wanita mempunyai saudara kandung atau ibu yang mempunyai kanker serviks, maka ia mempunyai kemungkinan 2-3 kali lebih besar untuk juga mempunyai kanker serviks dibandingkan dengan orang normal. Beberapa peneliti menduga hal ini berhubungan dengan berkurangnya kemampuan untuk melawan infeksi HPV.11
10
2.5 Patogenesis
Perkembangan NIS bergantung erat pada hasil sitologi untuk mendeteksi NIS jauh sebelum tampak kelainan makroskopik. Kelainan prakanker yang disebut NIS berawal sebagai NIS derajat ringan (low grade) dan berkembang menjadi NIS derajat berat (high grade), atau berawal sudah sebagai NIS derajat berat. Keadaan NIS bergantung pada immunologi pasien dengan dukungan faktor resiko. Setiap kasus infeksi HPV derajat rendah, DNA virus tidak terintegrasi ke genom penjamu, dan tetap berada dalam bentuk episomal bebas. Sebaliknya, HPV tipe 16 dan 18 memiliki gen yang setelah terintegrasi ke genom sel penjamu, mengkode protein yang menghambat atau menginaktifkan gen penekan tumor TP53 dan RB1 di sel epitel sasaran serta mengaktifkan gen terkait siklus sel, seperti siklin E sehingga terjadi proliferasi sel yang tidak terkendali.14
Gambar 3. Perkembangan NIS menjadi karsinoma invasif15
Onkoprotein E6 dan E7 yang berasal dari HPV merupakan penyebab terjadinya degenerasi keganasan. Integrasi DNA virus dengan genom sel tubuh merupakan awal dari proses yang mengarah transformasi. Integrasi DNA virus dimulai pada daerah E1-E2. Integrasi menyebabkan E2 tidak berfungsi, tidak berfungsinya E2
11 menyebabkan rangsangan terhadap E6 dan E7 yang akan menghambat p53 dan pRb.14
Hambatan kedua TSG menyebabkan siklus sel tidak terkontrol, perbaikan DNA tidak terjadi, dan apoptosis tidak terjadi. E6 akan mengikat p53 sehingga Tumor suppressor gene (TSG) p53 akan kehilangan fungsinya, yaitu untuk menghentikan siklus sel pada fase G1. Sedangkan onkoprotein E7 akan mengikat TSG Rb, ikatan ini menyebabkan terlepasnya E2F, yang merupakan faktor transkripsi sehingga siklus sel berjalan tanpa kontrol. Penghentian siklus sel pada fase G1 oleh P53 bertujuan memberi kesempatan kepada sel untuk memperbaiki kerusakan yang timbul. Setelah perbaikan selesai maka sel akan masuk ke fase S. P53 menghentikan siklus sel dengan cara menghambat kompleks cdk-cyclin yang berfungsi merangsang siklus sel untuk memasuki fase selanjutnya. Jika penghentian sel pada fase G1 tidak terjadi, dan perbaikan tidak terjadi, maka sel akan terus masuk ke fase S tanpa ada perbaikan.14
Sel yang abnormal ini akan terus membelah dan berkembang tanpa kontrol. Selain itu p53 juga berfungsi sebagai perangsang apoptosis, yaitu proses kematian sel yang dimulai dari kehancuran gen intrasel. Apoptosis merupakan upaya fisiologis tubuh untuk mematikan sel yang tidak dapat diperbaiki. Hilangnya fungsi p53 menyebabkan proses apoptosis tidak berjalan.14
Penelitian lain tentang Bcl-2 juga mendapatkan penurunan aktivitas Bcl-2 pada karsinoma serviks. Keadaan ini menunjukan bahwa penurunan aktivitas apoptosis pada karsinoma serviks disebabkan peningkatan aktivitas dari antiapoptosis. Peningkatan Bcl- 2 bukan berarti terjadi penurunan aktivitas apoptosis, karena mekanisme apoptosis dikontrol oleh banyak gen. Tetapi indeks apoptosis pada karsinoma sel skuamosa, pada penelitian nampaknya justru menurun, dan ini dibuktikan oleh beberapa penelitian. Pada penelitian juga dijumpai adanya penurunan beberapa keluarga Bcl-2, antara lain Bak, caspase 3 dan caspase 6.14
12
Gambar 4. Ekspresi E6 dan E7 pada kanker serviks16
Protein E7 menghambat proses perbaikan sel melalui mekanisme yang berbeda. Pada proses regulasi siklus sel di fase G0 dan G1 TSG pRb berikatan dengan E2F ikatan ini menyebabkan E2F menjadi tidak aktif E2F merupakan gen yang akan merangsang siklus sel melalui aktivasi proto-onkogen c-myc, dan N-myc. Protein E7 masuk ke dalam sel dan mengikat pRb yang menyebabkan E2F bebas terlepas, lalu merangsang proto-onkogen c-myc dan N-myc sehingga akan terjadi proses transkripsi atau proses siklus sel. Kekuatan ikatan protein E7 dengan pRb berbeda-beda pada beberapa tipe virus HPV, misalnya: ikatan E7 HPV tipe 6 dan 11 kurang kuat dibandingkan dengan HPV tipe 16 ataupun 18.14
Penelitian yang dilakukan pada pasien dengan karsinoma serviks di beberapa rumah sakit di Indonesia menemukan bahwa kejadian infeksi HPV tipe 16 sebesar 44%, tipe 18 sebesar 39% dan tipe 52 sebesar 14%. Sisanya sebesar 14% terdeteksi infeksi HPV multipel. Pada penelitian identifikasi tipe HPV pada adenokarsinoma, didapatkan bahwa prevalensi HPV pada adenokarsinoma jenis musinosum, intestinal, endometrioid adalah 91% dan jenis adenoskuamosa 100%. Sedangkan pada subtipe nonmusinous, clear cell, serous dan mesonefrik tidak dijumpai infeksi HPV. Kejadian HPV tipe 16, 18, 45, 52, dan 35 adalah berturut-turut 50%, 40%, 10%, 2% dan 1%.14
13 HPV tipe 16 dan 18 ditemukan pada sejumlah 70% kanker serviks, sedangkan tipe 16, 18, 33, 45, 31, 58, 52, dan 35 ditemukan pada sejumlah 90% kanker serviks. Tiga belas tipe HPV (16, 18, 31, 58, 33, 52, 35, 51, 56, 45, 39, 66, 6), pada metaanalisis, dijumpai pada HSIL. Pada LSIL ditemukan HPV tipe 16 (26%), 31 (12%), 51 (11%), 53 (10%). 56 (10%), 52 (9%), 18 (9%), 66 (9%), 58 (8%), dan tipe lainnya 5%.14
2.6 Gejala Klinis
Pada stadium dini biasanya asimtomatik dan hanya dapat terdeteksi dengan pemeriksaan sitologi. Jika sudah terjadi kanker akan timbul gejala yang sesuai dengan tingkat penyakitnya, yaitu dapat lokal atau tersebar. Gejala yang timbul dapat berupa perdarahan pasca sanggama atau dapat juga terjadi perdarahan diluar masa haid dan pasca menopause.12
Pada stadium lanjut dimana kanker mulai ex-situ maka dapat terjadi infeksi dan menimbulkan cairan berbau yang mengalir keluar dari vagina. Bila penyakitnya sudah lanjut, akan timbul nyeri panggul, gejala yang berkaitan dengan kandung kemih dan usus besar. Gejala lain yang timbul dapat berupa gangguan organ yang terkena misalnya otak (nyeri kepala, gangguan kesadaran), paru (sesak atau batuk darah), tulang (nyeri atau patah), hati (nyeri perut kanan atas, kuning, atau pembengkakan) dan lain-lain.12
14
2.7 Klasifikasi Lesi Prakanker
Tabel 1. Klasifikasi Lesi Prakanker dengan beberapa sistem5 Keterangan19
ASC-US : atypical squamous cell of undetermined significance
ASC-H : atypical squamous cell: cannot exclude a high grade squamous epithelial lesion
LSIL : Low-grade squamous intraepithelial lesion HSIL : High-grade squamous intraepithelial lesion
1. Normal (Kelas I): hasil apusan negatif tanpa adanya sel abnormal atau tidak dapat terlihat. Hasil apusan bersih dan tidak terdapat sel inflamasi dan tidak memiliki bukti keganasan (kanker).
2. Atipikal (Kelas II): Hal ini lebih lanjut dibagi menjadi dua istilah: sel ASC-H dan ASC-US.
Klasifikasi Sitologi (untuk skrining)
Klasifikasi Histologi (untuk diagnosis)
Pap Sistem Bethesda NIS (Neoplasia Intraepitelial Serviks) Klasifikasi Deskriptif (WHO) WHO
Kelas I Normal Normal Normal
Kelas II ASC-US ASC-H
Atipik Atipik
Kelas III LSIL NIS 1 termasuk kondiloma
Koilositosis
Kelas III HSIL NIS 2 Displasia sedang
Kelas III HSIL NIS 3 Displasia berat
Kelas IV HSIL NIS 3 Karsinoma in situ
Kelas V Karsinoma invasive
15
Gambar 5. Gambaran histopatologi perjalanan kanker serviks6
Kriteria sitologi untuk diagnosis ASC-US termasuk pembesaran inti ukuran 2,5-3 kali lipat dari sel intermediate dengan sedikit peningkatan rasio inti/sitoplasma, terdapat variasi ringan dalam ukuran inti dan kontur, dan sedikit hiperkromasia dengan kromatin. Kriteria sitologi untuk ASC-H yaitu sel skuamosa dengan inti membesar dan kurang sitoplasma dengan kontur inti tidak teratur. Mungkin ada bukti regenerasi sel- sel pada serviks atau perubahan sel yang berhubungan dengan infeksi atau trauma persalinan. Tergantung pada deskripsi lain ahli patologi mungkin diperlukan pengobatan untuk infeksi, pengecekan ulang PAP smear, tes DNA, observasi, atau tes diagnostik dengan kolposkopi.18
Menurut Sistem Bethesda5:
1. LSIL: Low-grade squamous intraepithelial lesion (displasia ringan). Klasifikasi ini untuk sel-sel abnormal, yang dapat dianggap sebagai displasia ringan atau dengan ringan potensial "premaligna". Jika dibiarkan saja, perubahan ini
16 mungkin kembali ke normal, mungkin tetap sama, atau bisa berkembang menjadi keganasan selama periode tahunan. Interval untuk pengembangan keganasan dari displasia adalah dari 3 sampai 10 tahun.
2. HSIL: High-grade squamous intraepithelial lesion (Kelas III, IV). Klasifikasi ini merupakan indikasi dari perubahan tingkat tinggi prakanker. Evaluasi dilakukan dengan menggunakan kolposkopi. Pengobatan dengan pembekuan atau eksisi biasanya diperlukan.
3. Karsinoma invasif (Kelas V): Klasifikasi ini menunjukkan probabilitas tinggi kanker dan diperlukan evaluasi lengkap untuk menentukan sejauh mana lesi kanker. Sebuah rencana perawatan untuk hasil terbaik dapat ditentukan.
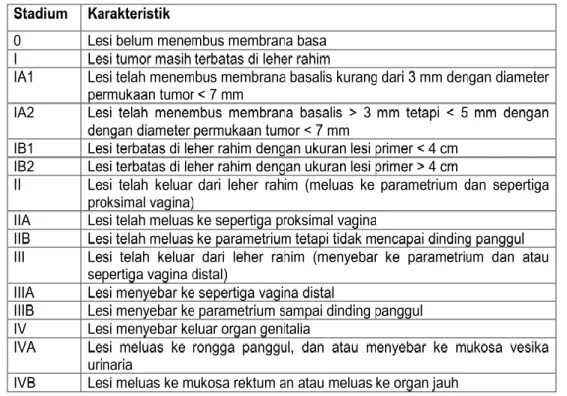
2.8 Staging Kanker Serviks Versi FIGO
International Federation of Gynecologists and Obstetricians Staging System for Cervical Cancer (FIGO) pada tahun 2000 menetapkan suatu sistem stadium kanker sebagai berikut5:
17
2.9 Skrining lesi prakanker serviks
2.9.1 Pemeriksaan Pap smear
Metode skrining sampai saat ini umumnya masih menggunkan pap smear. Gabungan pap smear, kolposkopi, dan biopsi merupakan paket diagnosis yang baik digunakan untuk pelayanan. Sensit ivitas pap smear bila dikerjakan setiap tahun mencapai 90%, setiap tahun 87%, setiap 3 tahun 78% dan bila setiap 5 tahun mencapai 68%. Kualitas dari pap smear ditentukan dari spesimen yang adekuat yaitu meliputi sediaan yang jelas, informasi klinik yang informatif, adanya sel skuamosa dan sel kelenjar endoserviks yang keduanya mewakili spesimen pada sambungan skuamokolumnar serta kriteria jumlah sel pada preparat. Jumlah sel dianggap cukup bila terdapat 8000-12000 sel. Pap smear dianggap tidak adekuat apabila preparat tidak disertai label, preparat yang pecah sehingga sulit diproses ataupun dibaca, terdapat campuran darah, sel radang atau faktor lainnya. Apabila pap smear tidak adekuat maka dianjurkan untuk dilakukan pap semar ulang pada 2-4 bulan, sedangkan bila pap smear yang tidak adekuat pada kehamilan sebaiknya diulang setelah persalinan.14
2.9.2 Kolposkopi
Hasil sitologi negatif atau memiliki hasil yang meragukan pada skrining HPV negatif, maka pemeriksaan dengan kolposkopi perlu dilakukan. Kolposkopi adalah pemeriksaan serviks, vagina dan vulva dengan melihat serviks pada pembesaran 10-20 kali maka dapat terlihat ukuran dan batas dari lesi abnormal pada permukaan serviks. Pada kolposkopi, serviks dioles dengan larutan asam asetat 3-5% atau lugol untuk membersihkan lendir yang meliputi permukaan serviks. Perubahan yang dapat terjadi yaitu adanya bercak putih dan vaskuler yang atipik yang menandakan adanya aktivitas selular yang hebat. Kolposkopi digunakan sebagai alat diagnostik yang memiliki sensitivitas tinggi (sekitar 85%) dan spesifisitas sekitar 70% untuk deteksi prakanker dan kanker. Kolposkopi digunakan untuk mengevaluasi prakanker
18 dan lesi kanker, membantu mengidentifikasi luasnya lesi, memandu biopsi dan membantu pengobatan dengan krioterapi.21
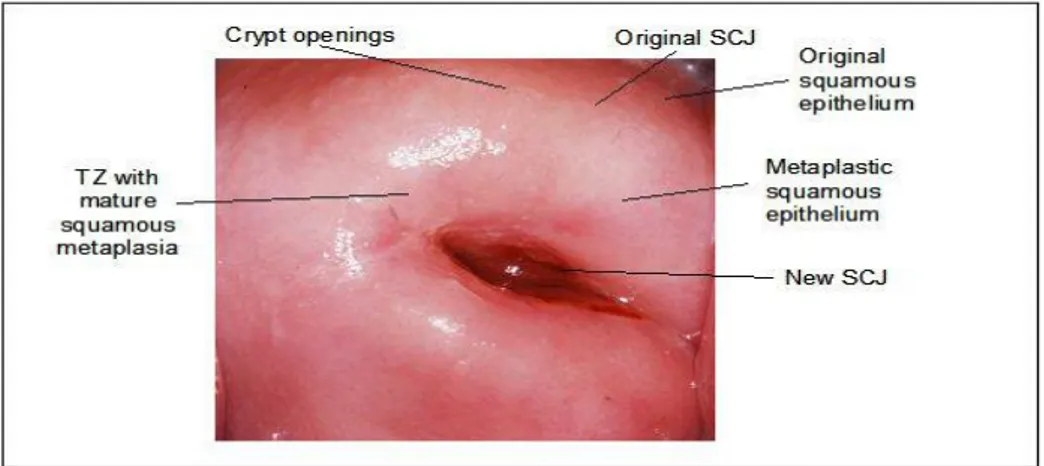
Gambar 6. Epitel squamous dan kolumnar serviks21
19
2.9.3 Inspeksi Visual dengan Asam Asetat (IVA)
Teknik pemeriksaan inspeksi visual dengan asam asetat (IVA) adalah pemeriksaan mudah serta dilakukan oleh seluruh tenakes terlatih dengan mengamati leher rahim yang telah diberi asam asetat/asam cuka 3-5% secara inspekulo dan dilihat dengan penglihatan mata telanjang.Pemeriksaan IVA pertama kali diperkenalkan oleh Hinselman (1925) dengan cara memulas leher rahim dengan kapas yang telah dicelupkan dalam asam asetat 3-5%. Pemberian asam asetat itu akan mempengaruhi epitel abnormal, bahkan juga akan meningkatkan osmolaritas cairan ekstraseluler. Cairan ekstraseluler yang bersifat hipertonik ini akan menarik cairan dari intraseluler sehingga membran akan kolaps dan jarak antar sel akan semakin dekat. Sebagai akibatnya, jika permukaan epitel mendapat sinar, sinar tersebut tidak akan diteruskan ke stroma, tetapi dipantulkan keluar sehingga permukaan epitel abnormal akan berwarna putih, disebut juga epitel putih (acetowhite).5
Daerah metaplasia yang merupakan daerah peralihan akan berwarna putih juga setelah pemulasan dengan asam asetat tetapi dengan intensitas yang kurang dan cepat menghilang. Hal ini membedakannya dengan proses prakanker yang epitel putihnya lebih tajam dan lebih lama menghilang karena asam asetat berpenetrasi lebih dalam sehingga terjadi koagulasi protein lebih banyak. Jika makin putih dan makin jelas, makin tinggi derajat kelainan jaringannya. Dibutuhkan 1-2 menit untuk dapat melihat perubahan- perubahan pada epitel. Leher rahim yang diberi 5% larutan asam asetat akan berespons lebih cepat daripada 3% larutan tersebut. Efek akan menghilang sekitar 50-60 detik sehingga dengan pemberian asam asetat akan didapatkan hasil gambaran leher rahim yang normal (merah homogen) dan bercak putih (mencurigakan displasia). Lesi yang tampak sebelum aplikasi larutan asam asetat bukan merupakan epitel putih, tetapi disebut leukoplakia; biasanya disebabkan oleh proses keratosis.5
20 Prinsip metode IVA adalah melihat perubahan warna menjadi putih pada lesi prakanker jaringan ektoserviks rahim yang diolesi larutan asam asetoasetat (asam cuka). Bila ditemukan lesi makroskopis yang dicurigai kanker, pengolesan asam asetat tidak dilakukan namun segera dirujuk ke sarana yang lebih lengkap. Perempuan yang sudah menopause tidak direkomendasikan menjalani skrining dengan metode IVA karena zona transisional leher rahim pada kelompok ini biasanya berada pada endoserviks rahim dalam kanalis servikalis sehingga tidak bisa dilihat dengan inspeksi spekulum.5
Kategori IVA Temuan klinik
1. Normal Licin, merah muda, bentuk porsio normal
2. Infeksi Servisitis (inflamasi, hiperemis), banyak fluor, ektropion, polip
3. Positif IVA Plak putih, epitel acetowhite (bercak putih)
4. Kanker serviks Pertumbuhan seperti bunga kol, pertumbuhan mudah berdarah
Tabel 3. Kategori temuan IVA5
Kategori IVA Temuan klinik
1. Negatif Tak ada lesi bercak putih (acetowhite lesion). Bercak putih pada polip endoservikal atau kista nabothi. Garis putih mirip lesi acetowhite pada sambungan skuamokolumnar
2. Positif 1 (+) Samar, transparan, tidak jelas, terdapat lesi bercak putih yang ireguler pada serviks. Lesi bercak putih yang tegas, membentuk sudut (angular), geographic acetowhite lessions yang terletak jauh dari sambungan skuamokolumnar
3. Positif 2 (++)
Lesi acetowhite yang buram, padat dan berbatas jelas sampai ke sambungan skuamokolumnar. Lesi acetowhite yang luas, circum orificial, berbatas tegas, tebal dan padat. Pertumbuhan pada leher rahim menjadi acetowhite
21
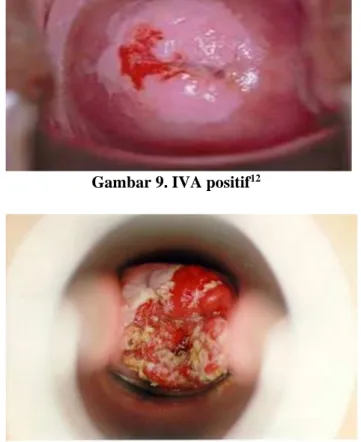
Gambar 8. IVA negatif12
Gambar 9. IVA positif12
Gambar 10. Suspek karsinoma serviks12
2.9.4 Thin-prep
Metode skrining thin-prep atau liquid base cytology (LBC) adalah metode pap smear yang dimodifikasi yaitu pengumpulan sel usapan serviks di dalam cairan, tujuannya adalah menghilangkan kotoran, darah, lendir serta memperbanyak sel serviks yang dikumpulkan sehingga akan meningkatkan
22 sensitivitas. Keuntungan lain dari teknik ini antara lain penebaran sel yang merata pada sediaan dengan meminimalisasi sel yang tumpang tindih pada sediaan, terhindar dari darah, lendir ataupun sel radang, mampu meningkatkan ketajaman diagnosis terhadap kelainan sel. Pengembangan teknologi skrining bertujuan menurunkan pengulangan pemeriksaan karena LSIL, ASC-US, memperpanjang interval pemeriksaan, meningkatkan sensitivitas dan spesifisitas dan menurunkan biaya.14
2.9.5 Hybrid Capture (HC)
Identifikasi terjadinya infeksi HPV risiko tinggi dapat dilakukan dengan HC atau dengan PCR. Pemeriksaan HC dinilai lebih mudah dilakukan dalam program skrining. Pemeriksaan HC untuk mendeteksi LSIL, ASC-US dan HSIL lebih sensitif bila dibandingkan dengan pap smear namun mempunyai spesifisitas yang lebih rendah. Pemeriksaan DNA-HPV dapat digunakan untuk mendeteksi adenokarsinoma in situ pada atypical glandular cell (AGC). Pemeriksaan HC hanya mampu mendeteksi infeksi HPV risiko tinggi tetapi tidak mampu mendeteksi kelainan sel prakanker sehingga spesifisitas HC lebih rendah dibandingkan pap smear.14
25
Gambar 11 Algoritma skrining dan tatalaksana lesi prakanker 13
2.10 Tatalaksana Lesi Prakanker Serviks
Deteksi awal stadium dini lesi prakanker serviks akan memberikan hasil yang baik dan penyembuhan sempurna. Terapi yang dimiliki dalam usaha melakukan pengobatan terhadap NIS. Berbagai pilihan mulai dari laser ablasi dan krioterapi biasa digunakan untuk displasia ringan dan cold knife, konisasi, atau laser konisasi biasa digunakan untuk displasia moderat. Di samping modalitas terapi destruksi, didapatkan terapi eksisi seperti LEEP, LLETZ, konisasi, sampai histerektomi. Penggunaan berlebihan dalam terapi menyebabkan ganguan pada fertilitas di masa reproduktif.
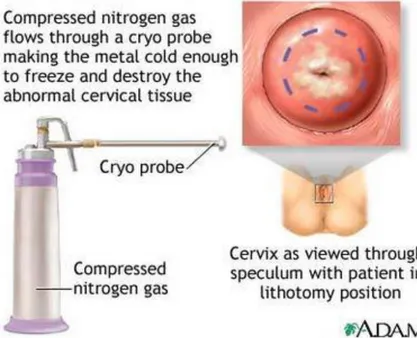
2.10.1 Krioterapi
Krioterapi merupakan prosedur sederhana untuk destruksi area prakanker pada serviks dengan cara pembekuan. Cryoprobe diletakkan pada serviks dan membekukan permukaannya menggunakan gas karbon dioksida (CO2) atau
26 nitrous oxide (N2O). Cryoprobe diterapkan pada serviks dua kali selama tiga menit setiap kali dengan jarak 5 menit (teknik double-freeze). Krioterapi sangat efektif untuk pengobatan lesi kecil, tapi untuk lesi yang lebih besar angka kesembuhan di bawah 80%.18
Penyemprotan NO2 mengakibatkan pendinginan suhu ujung probe -65oC sampai -85oC, jauh di bawah suhu letal -20oC. Dengan penyemprotan tersebut akan terbentuk bunga es setebal 7 mm. 5 mm bagian proksimal bersuhu kurang dari -20oC akan mengalami nekrosis, sedangkan 2 mm tepi bunga es tersebut yang bersuhu 0oC sampai -20oC akan mengalami regenerasi. Dengan kenyataan ini diasumsikan bahwa krioterapi tidak dapat mematikan jaringan lebih dalam dari 5 mm. Pada HSIL sering disertai keterlibatan kripta kelenjar serviks sehingga efektivitas krioterapi pada HSIL tidak memadai dan lebih dianjurkan eksisi daripada krioterapi untuk menangani HSIL.18
27
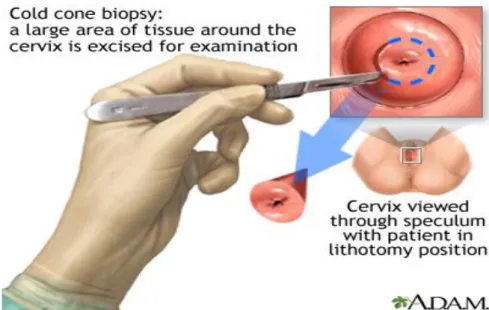
2.10.2 Cold Knife Cone (Konisasi Pisau)
Merupakan cara eksisi pada daerah berbentuk kerucut dari serviks dengan menggunakan cold knife conization termasuk ektoserviks dan endoserviks. Tingkat konisasi akan tergantung pada ukuran lesi dan kemungkinan ditemukan kanker invasif. Konisasi direkomendasikan untuk pengobatan NIS II dan NIS III.17
Gambar 13 Biopsi cold knife cone
2.10.3LEEP (Loop Electrosurgical Excision Procedure)
LEEP atau Large Loop Excision of The Transformation Zone (LLETZ) adalah penghapusan daerah abnormal pada serviks dengan menggunakan kawat panas. Hal ini membutuhkan unit electrosurgical yang menghasilkan tegangan rendah konstan dan transmisi ke perangkat loop kawat, yang digunakan untuk menghilangkan jaringan abnormal. LEEP bertujuan untuk menghapus kedua lesi dan seluruh zona transformasi. Teknik ini berhasil mengeradikasi prakanker sebanyak 90% kasus. LEEP dipergunakan untuk lesi intraepithelial derajat tinggi (HSIL) karena kedalaman pengambilan
28 jaringan dapat lebih besar sehingga seluruh kripta endoserviks dapat terambil yang mungkin luput pada pemakaian krioterapi.2
Gambar 14 Teknik LEEP
2.10.4 Vaporasi Laser
Terapi HSIL dapat dilakukan dengan vaporasi laser. Penggunaan laser di negara maju telah menggantikan tempat terapi kauterisasi, krioterapi atau konisasi pisau. Kelemahan alat ini adalah biaya yang relatif mahal hasil tidak berbeda dengan metoda terapi lainnya. Evaporasi laser pada HSIL memberikan keberhasilan terapi sampai 94% pada lesi kurang dari 2,5 cm dan 92% untuk lesi lebih dari 2,5 cm.14
2.11 Pencegahan
Pemberian vaksin HPV dalam penelitian dapat mencegah 14 tipe HPV, khususnya tipe 16/18 dengan efektivitas 100% untuk mencegah infeksi HPV pada serviks, vulva dan vagina pada follow up sampai 4,9 tahun. Pemberian vaksin sebaiknya dilakukan saat pasien tidak sedang terinfeksi HPV. Sehingga sebelum vaksin
29 dilakukan penapisan dengan pemeriksaan pap smear terdapat 2 jenis vaksin yaitu vaksin bivalent dan quadrivalent. Vaksin quadrivalent menggunakan pelarut AlOH3, yaitu pelarut banyak dipakai pada umumnya. Vaksin bivalent menggunkana pelarut yang mengandung AlO4, ASO4 bertujuan untuk mengakselerasi jumlah limfosit B yang memprduksi antibodi. Pada penelitian fase 2 proteksi NIS II/III karena HPV 16 dan 18 pada yang divaksinasi menggunakan vaksin bivalent mencapai 100% dan proteksi 100% dijumpai sampai 6,4 tahun pengamatan. Vaksin ini paling ideal dilakukan pada wanita yang belum pernah melakukan hubungan seksual atau belum terinfeksi HPV. FDA menyetujui pemberian vaksin mulai usia 9 tahun, sedangkan CDC merekomendasikan mulai usia 11-12 tahun, HOGI-IDAI mulai usia 10 samapai 53 tahun. Vaksinasi pada ibu hamil tidak dianjurkan, sebaiknya vaksinasi diberikan setelah persalinan. Ibu menyusui boleh dierikan vaksin tersebut. Vaksin diberikan sebanyak 3 kali secara IM, diberikan pada bulan ke 0,1 dan 6.14
30
BAB III KESIMPULAN
Lesi prakanker serviks merupakan hal penting dan utama untuk menentukan potensi stadium dini kanker serviks. Setiap lesi prakanker akan berpotensi menjadi karsinoma dan tergantung pada derajat lesi tersebut. Lesi prakanker terbagi atas tiga derajat tergantung dari dysplasia epitel pada serviks dan terbagi atas 3 keadaan grade dimulai dari low grade, high grade hingga karsinoma in-situ.
Keadaan lesi yang asimptomatik kerap menjadi masalah serius untuk deteksi awal pada stadium dini. Lesi akan mulai bergejala ketika memasuki potensi ganas atau menjadi kanker serviks. Gejala utama adalah nyeri, gangguan menstruasi hingga kondisi berat badan kian menurun.
Pencegahan menjadi hal utama dengan memperhatikan setiap faktor resiko dan melakukan pemeriksaan skrining yaitu pap-smear dan IVA. Keberhasilan deteksi dini pada lesi prakanker akan memberikan penyembuhan hingga 100% dan pengobatan minimal. Jika deteksi pada stadium lanjut maka angka kesembuhan akan menurun hingga 70-80% .
Terdapat berbagai macam modalitas terapi pada lesi prakanker serviks dan sesuiakan dengan derajat dysplasia dengan tingkat keberhasilan mencapai 95% yaitu sebagai berikut: Krioterapi, Knife cone biopsy, LEEP hingga histerektomi.
31
DAFTAR PUSTAKA
1. WHO. 2006. Comprehensive Cervical Cancer Control. A Guide to Essential Practice. Geneva 2. Iskandar TM. 2009. Pengelolaan Lesi Prakanker Serviks. Indonesian Journal of Cancer Vol. III:
97-102.
3. Rasjidi, I. 2009. Epidemiologi Kanker Serviks, III(3), 103–108.
4. Massad L. Stewart, Einstein Mark H., Huh Warner K., et.all. 2013. 2012 Updated Consensus Guidelines for the Management of Abnormal Cervical Cancer Screening Tests and Cancer Precursors. American Society for Colposcopy and Cervical Pathology. Journal of Lower Genital Tract Disease, Volume 17, Number 5: S1-S27
5. Nuranna Laila, Purwoto Gatot, Madjid Omo A, dkk. 2008. Skrining Kanker Leher Rahim dengan Metode Inspeksi Visual dengan Asam Asetat (IVA). Departemen Kesehatan Republik Indonesia: 24-33
6. Djaranjoera JY. 2015. Referat Lesi Prakanker. Bagian Obstetri dan Ginekologi Universitas Nusa Cendana. Kupang
7. Globocan. 2012. Cancer Fact Street. Estimated Incidence, Mortality and Prevalence Worldwide in 2012 IARC. (Diakses pada 8 Juli 2017). Tersedia dari:
http://www.globocan.iarc.fr/old/FactSheets/cancers/cervix-
8. Rahmadhany R. 2014. Deteksi Dini Lesi Prakanker Serviks Dengan Perangkat Optoelektrik. Tesis. Fakultas Kedokteran Universitas Indonesia Program Pendidikan Dokter Spesialis Obtetri dan Ginekologi
9. International Collaboration of Epidemiological Studies of Cervical Cancer, Appleby P, Beral
V, et al. 2007. Cervical cancer and hormonal contraceptives: collaborative reanalysis of individual data for 16,573 women with cervical cancer and 35,509 women without cervical cancer from 24 epidemiological studies. Lancet. 370(9599):1609–1621.
10. Vaccarella S, Herrero R, Snijders PJF, et al. 2008. Smoking and human papillomavirus infection: pooled analysis of the International Agency for Research on Cancer HPV prevalence surveys. International Journal of Epidemiology. 37(3):536–546.
11. Magnusson PK, Lichtenstein P, Gyllensten UB. 2000. Heritability of cervical tumours. Int J Cancer. 88:698-701.
12. Adekunle OO. 2012. Cervical Intraepithelial Neoplasia (CIN) (Squamous Dysplasia),Intraepithelial Neoplasia. (Diakses tanggal 8 Juli 2017). Tersedia dari:
http://www.intechopen.com/books/intraepithelial-neoplasia/cervical-intraepithelial-neoplasia-
cin-squamous-dysplasia-13. Pundir J, Coomarasamy A. 2016. Gynaecology Evidence Based Algorithms. Cambridge University Press. Columbia University Libraries. 164-167
14. Andrijono. 2012. Kanker Serviks. Divisi Onkologi Departemen Obstetri-Ginekologi Fakultas Kedokteran Universitas Indonesia Ed 4
32
15. Eurocytology. 2014. Pathogenesis of cervical cancer CIN and squamous cell cervical carcinoma. Dikutip dari : http://www.eurocytology.eu/en/course/969. Diakses tanggal 28 Juli 2017.
16. Yim EK, Park JS. 2005. The Role of HPV E6 and E7 Oncoproteins in HPV-associated Cervical Carcinogenesis. Departement of Obstetrics and Gynecology, The Catholic University of Korea College of Medicine. Cancer Res Treat. 37(6): 319-324
17. Cheng X, Feng Y, Wang X, et al. 2012. The effectiveness of conization treatment for post- menopausal women with high-grade cervical intraepithelial neoplasia: 185-188.
18. WHO. 2014. WHO guidelines for screening and treatment of precancerous lesions for cervical cancer prevention.
19. Pfenninger J. 2011. Pap Smear Information. (Diakses tanggal 19 Juli 2017). Tersedia dari: http://www.mpcenter.net/patient_ed/pap_smear_info.html
20. Sherris, Jacqueline, Castro Wendy, Levin Carol et all. 2004. The Case for Investing in Cervical Cancer Prevention. Cervical Cancer Prevention Issues in Depth. Alliance for Cervical Cancer Prevention (ASCCP):15-16
21. Sellors JW, Sankaranarayanan R. 2003. Colposcopic Appearance of the Normal Cervix. Colposcopy and Treatment of Cervical Intraepithelial Neoplasia: A Beginner's Manual. International Agency for Research on Cancer Screening group.