ANTAGONISME ANTAR MIKROBA LAPORAN PRAKTIKUM
Disusun untuk memenuhi tugas matakuliah Mikrobiologi yang dibina oleh Prof. Dra. Utami Sri Hastuti, M.Pd
Offering H Kelompok 6
1 Ainul Fitria Mahmudah 150342603333 2 Monica Feby Zelvia 150342604927 3 Rendhika Farah A.P 150342605471 4 Zauhara F.W 150342605971
UNIVERSITAS NEGERI MALANG
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM JURUSAN BIOLOGI
MEI 2017
ANTAGONISME ANTAR MIKROBA A. Tujuan
B. Waktu pelaksanaan Selasa, 25 April 2017 C. Dasar Teori
Interaksi antar mikroorganisme yang menempati suatu habitat yang sama akan memberikan pengaruh positif, saling menguntungkan dan pengaruh negatif, saling merugikan dan netral, tidak ada pengaruh yang berarti (Kusnadi, 2003). Beberapa macam hubungan antar spesies bakteri di alam antara lain komensalisme, mutualisme serta antagonisme atau amensalisme. Komensalisme merupakan suatu interaksi antara mikroorganisme dengan organisme lain dimana satu jenis dapat diuntungkan namun jenis lain tidak dirugikan. Sedangkan interaksi antar mikroorganisme yang dapat saling menguntungkan disebut dengan simbiosis mutualisme dan hubungan mikroorganisme yang dengan organisme lain yang saling menekan pertumbuhannya disebut dengan antagonisme (Kusnadi, 2003).
Mikroba antagonis yang memiliki kemampuan antimikroba tersebut dapat menghasilkan senyawa antimikroba. Senyawa antimikroba yang dihasilkan oleh mikroba pada umumnya merupakan metabolit sekunder yang tidak digunakan untuk proses pertumbuhan (Schlegel, 1993), tetapi untuk pertahanan diri dan kompetisi dengan mikroba lain dalam mendap atkan nutrisi, habitat, oksigen, cahaya dan lain-lain (Baker dan Cook, 1974).
Antagonis adalah peristiwa yang menyebabkan tertekannya aktivitas suat mikroorganisme jika dua mikroorganisme atau lebih berada pada tempat yang berdekatan jadi Uji antagonis merupakan uji yang digunakan membuktikan bahwa mikroorganisme yang bersifat antagonis dapat menghambat aktivitas mikrooganisme lain yang berada ditempat yang berdekatan. Mikroorganisme yang bersifat antagonis ini memiliki pertumbuhan yang cepat sehingga dapat menutupi mikroorganisme yang berdekatan dengannya (Tuju, 2004). Selain itu, secara garis besar interaksi microbial (interaksi antar mikroba) terbagi menjadi interaksi simbiotik dan non-simbiotik. Dikatakan simbiotik apabila spesies yang satu dengan yang lain saling berkaitan dan membutuhkan.Biasanya, interaksi ini terjadi di lingkungan tanah, dimana pada lingkungan tersebut banyak terdapat nutrisi dan koloni-koloni microbial. Namun
Diinokulasikan satu ose penuh spora biakan murni Penicillium chrysogenum ke medium Skim Milk Agar
Diinkubasikan pada suhu kamar dengan cawan dalam keadaan terbalik selam 6-7x24 jam pada suhu 25oC sampai terdapat bintik-bintik cairan
kekuning-kuningan disekitar koloni kapang
Pada saat praktikum berikutnya, dicairkan medium nutrien agar, lalu didinginkan sampai suhu kira-kira 50oC
Diinkulasikan segera 2 ose biakan murni Staphyllococcus aureus, digoyangkan diantara kedua telapak tangan supaya bakteri tersebar merata, lalu dituangkan
secara aseptis kedalam cawan petri steril.
begitu, interaksi antagonisme juga terdapat di dalam tubuh manusia, semisal pada sistem respiratori, di usus besar, maupun di sistem reproduksi (Cowan, 2012).
D. Alat Bahan Alat:
1. Jarum inokulasi berkolong 2. Kompor gas
3. Inkubator
4. Laminar Air Flow
E. Cara Kerja
Bahan:
1. Medium lempeng Skim Milk Agar steril 2. Medium tegak Nutrien Agar steril 3. Cawan petri steril
4. Biakan murni Penicillium chrysogenum dan Staphyllococcus aureus
Setelah menjadi padat diletakkan pada permukaan Nutrien Agar potongan koloni Penicillium chrysogenum berbentuk lingkaran dengan diameter + 5 mm dan disertakan cairan yang berwarna kekuning-kuningan yang terdapat pada medium.
Dibuat 2 atau 3 kali perlakuan yang sama dalam satu cawan petri tersebut.
Dinkubasikan pada suhu 37oC (jangan dibalik) selama 1x24jam
Diamati dan digambar adanya zone-zone penghambat pertumbuhan bakteri pada medium tersebut
2
1
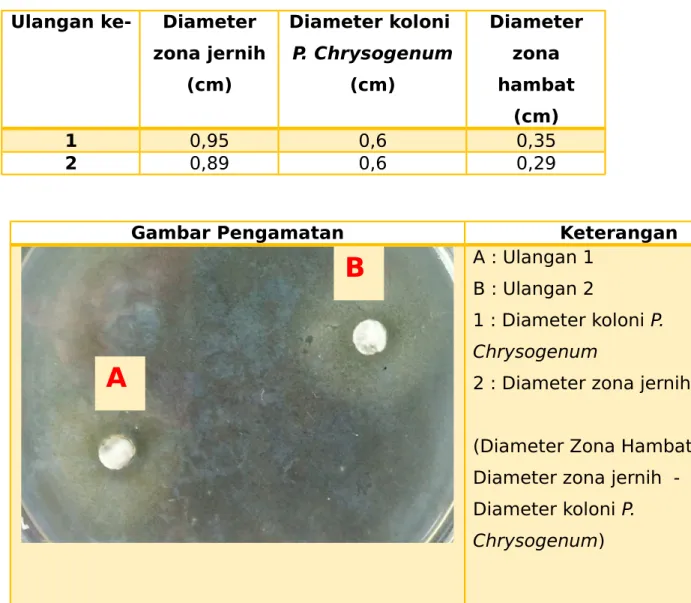
F. DataData yang kami peroleh adalah sebagai berikut : Ulangan ke- Diameter
zona jernih (cm) Diameter koloni P. Chrysogenum (cm) Diameter zona hambat (cm) 1 0,95 0,6 0,35 2 0,89 0,6 0,29
Gambar Pengamatan Keterangan
A : Ulangan 1 B : Ulangan 2
1 : Diameter koloni P.
Chrysogenum
2 : Diameter zona jernih (Diameter Zona Hambat= Diameter zona jernih -
Diameter koloni P.
Chrysogenum)
Hasil pengamatan dalam praktikum ini sebagai berikut :
G. Analisa Data
Praktikum ini yaitu tentang antagonisme atau amensalisme antar bkapang dengan bakteri, langkah pertama yang dilakukan adalah menginokulasikan satu ose penuh spora biakan murni
Penicillium chrysogenum ke medium Skim Milk Agar steril, kemudian menginkubasikan pada suhu kamar dengan cawan dalam keadaan terbalik selama 6-7 x 24 jam pada suhu 25 C
B
sampai terdapat bintik cairan kekuningan di sekitar koloni kapang, setelah itu langkah selanjutnya adalah mencairkan medium nutrien agar lalu didinginkan sampai suhu kira-kira 50˚C, kemudian Menginokulasikan segera 2 ose biakan murni
Staphylococcus aureus, goyangkan diantara kedua tangan lalu dituangkan secara aseptis ke dalam cawan petri steril, Setelah agar menjadi padat pada permukaan nutrien agar diletakkan
potongan koloni Penicillium chrysogenum berbentuk lingkran
dengan diameter 5 mm atau 0,5 cm, langkah terakhir adalah menginkubasikan pada suhu 37˚C selama 1 x 24 jam dengan peletakan tidak terbalik, kemudian diamati adanya zone-zone penghambat pertumhuhan bakeri pada medium tersebut.
Dari hasil data pengamatan diatas dapat diketahui
perhitungan diameter zona hambat bakteri S. aureus yang
diperoleh dari diameter zona jernih dikurangi diameter koloni P.
Chrysogenum yang dilakukan sebanyak 2 kali ulangan. Pada dua ulangan tersebut diameter zona hambat yang didapatkan berbeda hal tersebut dikarenakan ukuran dan bentuk zona hambat berbeda. Oleh karenanya perlu diukur jarak antara sisi
terluar dari zona jernih terhadap pusat koloni P. Chrysogenum
pada dua tempat yang berbeda. Berdasarkan hasil perhitungan
tersebut dapat diketahui bahwa terdapat perbedaan antara ulangan 1 dan ulangan 2. Diameter zona jernih pada ulangan 1 adalah 0,95 cm, sedangkan pada ulangan 2 adalah 0,89 cm.
Kemudian Diameter koloni P. Chrysogenum pada ulangan 1 dan 2
adalah 0,6 cm, selanjutnya Diameter zona hambat P.
Chrysogenum terhadap bakteri S. aureus yang ditunjukkan pada ulangan 1 yaitu 0,35 cm dan ulangan 2 yaitu 0,29 cm. Dengan adanya perbedaan ini, maka pengamat mengambil kesimpulan
sementara bahwa zona hambat P. Chrysogenum terhadap bakteri
H. Pembahasan
Mikroorganisme, seperti fungi (kapang dan khamir) dan bakteri yang menempati habitat sama dapat saling berinteraksi satu sama lain. Menurut Batzing (2002) salah satu bentuk interaksi antar mikroorganisme adalah antagonisme yaitu, interaksi yang menimbulkan efek merugikan pada pertumbuhan salah satu mikroorganisme, sedangkan mikroorganisme lain diuntungkan. Menurut Lima dkk. (1999) kemampuan mikroorganisme dalam menghambat atau membunuh mikroorganisme lain disebut sebagai kemampuan antagonistik. Mikroorganisme yang memiliki kemampuan antagonistik disebut sebagai mikroorganisme antagonis.
Praktikum kali ini mempelajari sifat antagonisme antara kapang dengan bakteri. Pada praktikum ini digunakan koloni Penicillium chrysogenum yang sebelumnya dikembangbiakan di dalam medium SMA (Skim Milk Agar), koloni ini menghasilkan cairan berwarna kekuning-kuningan. Digunakan medium Skim Milk Agar karena medium ini kaya akan nutrisi sehingga pertumbuhan Penicillium chrysogenum akan optimal. Menurut Rathnayaka, (2013) skim milk merupakan agensia cryprotenctant paling baik. Skim milk 10% sebagai cryprotectant sel mikroba dikatakan lebih unggul dalam mempertahankan daya hidup sel dibandingkan gliserol 15%, hal ini di dimungkinkan karena adanya efek dari skim milk terhadap kandungan asam lemak yang terdapat pada membran sel sehingga mengubah fluiditas membran mungkin juga di sebabkan adanya kalsium (Ca) pada skim milk yang berkontribusi terhadap enzim selular (Cody et al., 2008). Langkah kedua yaitu menginkubasikan pada suhu kamar dengan cawan dalam keadaan terbalik selama 6-7 x 24 jam pada suhu 25˚C sampai terdapat bintik cairan kekuningan di sekitar koloni kapang, penerapan rentang waktu tersebut dikarenakan dalam kisaran waktu 6-7 x 24 jam Penicillium chrysogenum telah menghasilkan penisillin. Menurut Volk dan Wheeler, (1993) menyatakan bahwa penisilin merupakan senyawa metabolit sekunder yang disintesis oleh mikrobia pada fase stasioner. Selanjutnya ditambahkan oleh Crueger dan Crueger (1990), fase pertumbuhan stasioner Penicillium terjadi pada inkubasi jam ke-140. Walau demikian waktu terjadinya fase stasioner dipengaruhi oleh komposisi medium dan
faktor lingkungan. Sedangkan digunakan suhu 25 ˚C pada inkubasi
Penicillium chrysogenum dikarenakan suhu tersebut merupakan suhu optimun kapang jenis ini tumbuh. Menurut Pitt dan Hocking (1979), koloni Penicillium chrysogenum tumbuh secara cepat di atas medium standar pada suhu 25˚C.
Kemudian digunakan bakteri Staphyllococcus aureus yang sudah diinokulasikan kedalam cawan steril dari medium NA. Menurut Baird-Parker, (2000) menyatakan bahwa Staphyllococcus aureus merupakan suatu bakteri yang dapat memproduksi toksin, Gram positif, dan termasuk bakteri aerob. Langkah selanjutnya adalah memotong Penicillium chrysogenum berbentuk lingkaran dengan diameter 0,6 cm. Pada potongan tersebut disertakan juga cairan kekuning-kuningan yang merupakan senyawa antibiotik yang dihasilkan oleh kapang Penicillium chrysogenum. Setelah itu meletakkan potongan kapang diatas medium NA yang telah diinokulasikan bakteri Staphyllococcus aureus. Langkah selanjutnya yaitu menginkubasikan pada suhu 37˚C selama 1 x 24 jam dengan posisi tidak terbalik, suhu tersebut merupakan suhu
pertumbuhan maksimal dari Staphyllococcus aureus, menurut
Baird-Parker, (2000) menyatakan bahwa suhu pertumbuhan paling baik bakteri Staphyllococcus aureus yaitu 37 ˚C, faktor-faktor pemicu pertumbuhan
Staphyllococcus aureus dapat dilihat pada tabel dibawah ini.
Selanjutnya setelah menunggu 1 x 24 jam diamati pertumbuhannya, ternyata terbentuk zona penghambat berada disekitar kapang Penicillium chrysogenum. Zona penghambat ini berwarna lebih jernih (putih) daripada daerah disekitarnya. Berdasarkan praktikum zona penghambat ulangan 1 adalah 0,35 cm
dan pada ulangan 2 adalah 0,29 cm. Hal ini menunjukkan bahwa Penicillium chrysogenum menghambat pertumbuhan dari bakteri Staphyllococcus aureus sehingga dapat diketahui hubungan di antara kedua mikroorganisme tersebut bersifat antagonis. Menurut Semangun (2006) mengemukakan bahwa mekanisme antagonis pada mikroba dapat terjadi melalui 3 cara yaitu parasitasi secara langsung, karena adanya metabolik sekunder yang bersifat toksin dan adanya kompetisi dalam hal ruang dan kebutuhan nutrisi. Berdasarkan pernyataan tersebut dapat diketahui bahwa interaksi antara kapang Penicillium chrysogenum dan bakteri Staphyllococcus aureus merupakan mekanisme antagonis pada mikroba karena adanya metabolik sekunder yang bersifat toksin, yang mana daerah bening sekitar koloni jamur menunjukkan bahwa jamur memproduksi suatu senyawa yang mematikan bakteri atau tidak mengijinkannya tumbuh.
Menurut teori menyatakan Penisilin merupakan antibiotik yang memiliki daya antimikrobia yang berspektrum luas. Penisilin mampu menghambat pertumbuhan bakteri Gram positif seperti Staphylococcuc, Bacillus, dan Clostridium, serta beberapa jenis penisilin mampu menghambat pertumbuhan bakteri Gram negatif seperti Escherichia coli, Haemophilus influenzae, Shigella sp., dan Proteus sp (Suharni et al., 2001). Pernyataan tersebut diperkuat Pelczar dan Chan (1988), yang menyatakan bahwa beberapa contoh jamur yang berguna sebagai penghasil penisilin adalah jenis Penicillium notatum dan Penicillium chrysogenum. Kelebihan Penicillium chrysogenum mampu menghasilkan antibiotik terbaik dibandingkan spesies Penicillium lainnya.
Hasil akhir dalam praktikum ini dapat diketahui mikroba antagonis adalah dari jamur yaitu Penicillium chrysogenum. Pertumbuhan Staphylococcus aureus yang terhambat terbatas pada daerah tertentu saja yaitu pada daerah yang terjangkau oleh sekret yang terbatas pada daerah di sekitar cetakan P. chrysogenum saja. Dwidjoseputro (2010) menggunakan istilah amensalisme untuk hubungan antagonisme tersebut. Spesies yang terhambat pertumbuhannya disebut amensal, sedang spesies yang menghambat pertumbuhan disebut antagonis. Pada praktikum ini, Staphylococcus aureus berperan sebagai amensal dan kapang Penicillium chrysogenum berperan sebagai antagonis.
Menurut Volk dan Wheeler (1993), efek bakteriosida dari penisilin yaitu mengganggu sintesis peptidoglikan dinding sel sehingga membran sel merekah dan menghamburkan isi sel. Menurut teori lain menguatkan bahwa penisilin menghambat pembentukkan dinding sel dengan cara mencegah digabungkannya asam N-asetilmuramat, yang dibentuk di dalam sel, yang biasanya memberi bentuk kaku pada dinding sel bakteri. Mekanisme kerja ini konsisten dengan kenyataan bahwa penisilin hanya bekerja pada bakteri yang sedang tumbuh aktif (Pelczar dan Chan, 1988).
Penisilin merupakan kelompok antibiotik yang ditandai oleh adanya cicin β-laktam dan diproduksi oleh berbagai jenis jamur (eukariot) yaitu dari jenis Penicillium, Aspergillus, serta oleh beberapa prokariot tertentu (Madigan el al., 2000). Sifat unik pada masing-masing penisilin ditentukan oleh adanya rantai samping yang berbeda-beda. Secara kimia penisilin digolongkan ke dalam antibiotik β-laktam (Pelczar dan Chan, 1988). Menurut Demain (1996) menyatakan bahwa kira-kira 10.000 metabolit sekunder telah ditemukan struktur kimianya yang tersusun oleh cincin β-laktam, peptida siklik yang terdiri dari asam amino dan senyawa nonprotein, gula dan nukleosida, ikatan tidak jenuh dari poliasetilen dan polien, serta cincin makrolida besar.
I. Diskusi
1 Adakah daerah jernih pada medium yang tidak dapat ditumbuhi oleh bakteri ? bila ada, mengapa hal ini dapat terjadi?
Jawab: Ada, terjadi karena P. chrysogenum menghasilkan zat kimia berupa penicillium sehingga hal tersebut menyebabkan Staphilococcus aureus tidak bisa tumbuh di daerah pada medium tersebut (sehingga nampak daerah bening)
2 Mengapa digunakan medium Skim Milk Agar untuk membiakkan P. chrysogenum?
Jawab: Digunakan medium Skim Milk Agar karena medium ini kaya akan nutrisi terutama protein sehingga pertumbuhan Penicillium chrysogenum akan optimal sehingga dapat membentuk Penicilin.
J. Kesimpulan
Dari hasil praktikum ini dapat diketahui bahwa ada hubungan antagonisme antara koloni kapang Penicillium chrysogenum dan bakteri Staphylococcus aureus yang ditunjukkan adanya zona hambat bakteri. Zona hambat bakteri disebabkan oleh adanya antibiotik penisilin (adanya cicin β-laktam) yang dihasilkan oleh Penicillium chrysogenum yang dapat menghambat sintesis dinding sel bakteri Staphylococcus aureus.
Baird-Parker, T.C. 2000. Staphylococcus aureus. p1317-1335. In The Microbiological Safety and Quality of Food. Volume II. Lund, B.M., Baird-Parker, T.C. and Gould, G.W. eds. Published by Aspen Publishers. Batzing, B.L., 2002. Microbiology: An introduction. Brooks/Cole Thomson
Learning, Inc., London: xx + 780 hlm.
Cody WL, Wilson JW, Hendrixson DR, Mclver KS, Hagman KE, Ott CM, Nickerson CA and Schurr MJ. 2008. Skim milk enhances the preservation of thawed -80°C bacterial stocks. Journal Microbiol Methods. Vol 75(1): 135–138.
Cowan, Marjerie Kelly. 2012. Microbiology, a system approach 3rd edition. USA: McGraw-Hill companies.
Crueger, W., dan Crueger, A., 1990, Biotechnology : A texbook of Industrial Microbiology, Sinauer Associates Inc., Sunderland, p. 239-240.
Demain, A.L., 1996, Fungal Secondary Metabolism: Regulation and Function in a Century of Micology, Edited by B.C. Sutton, Cambridge University Press, Cambridge, p. 233,240-242.
Dwidjoseputro, 2010.Dasar-Dasar Mikrobiologi. Jakarta: Penerbit Djembatan. Kusnadi et al. 2003. Mikrobiologi. Bandung: JICA-IMSTEP
Lima, G., S. Arru, F. De Curtis & G. Arras. 1999. Influence of antagonist, host fruit and pathogen on the biological control of postharvest fungal diseases by yeasts. J.l of Ind. Microbiol. Biotechnol. 23: 223--229.
Madigan, M.T., Martinko, J.M., dan Parker, J., 2000, Brock Biology of Microorganisme, Ninth edition, Prentice-Hall, Inc., NewJersey.
Pelczar, M.J., dan Chan, E.C.S., 1988, Dasar-Dasar Mikrobiologi, Jilid 1. Jakarta: UI Press.
Pitt, J.I., dan Hocking,A.D., 1979, Fungi dan Food Spoilage, Secon edition, Blackie Academic and Professional an imprint of Chapman & Hall, London, p. 289,762-789.
Rathnayaka K. 2013. Effect of freeze-drying on viability and probiotic properties of a mixture of probiotic bacteria. Journal of Science and Technology. Vol 3(11): 1074.
Schegel, G.H. 1993. General Microbiologi seventh edition. USA: Cambrige University Press
Semangun, H., 2006. Pengantar Ilmu Penyakit Tumbuhan. Yogyakarta: Universitas Gadjah Mada.
Suharni, T.T., Nastiti, S.J., dan Soetarto, E.S., 2001, Mikrobiologi Umum, Yogyakarta: Fakultas Biologi UGM.
Talaro, Kathleen Park & Arthur Talaro. 2001. Foundations in Microbiology 4th edition. USA: McGraw-Hill companies
Tuju MJ .2004. Antagonisme Trichoderma spp, to Raistonia solanacearum Cause of Wilt Bacteria ini Potato Plant. Eugenia. Vol 10, no 2, pp 143-155
Volk, A.W., dan Wheeler, M.F., 1993, Mikrobiologi Dasar, Jilid 1, Jakarta: Penerbit Erlangga.