BAHAN DAN METODE
Galur-galur bakteri dan plasmid
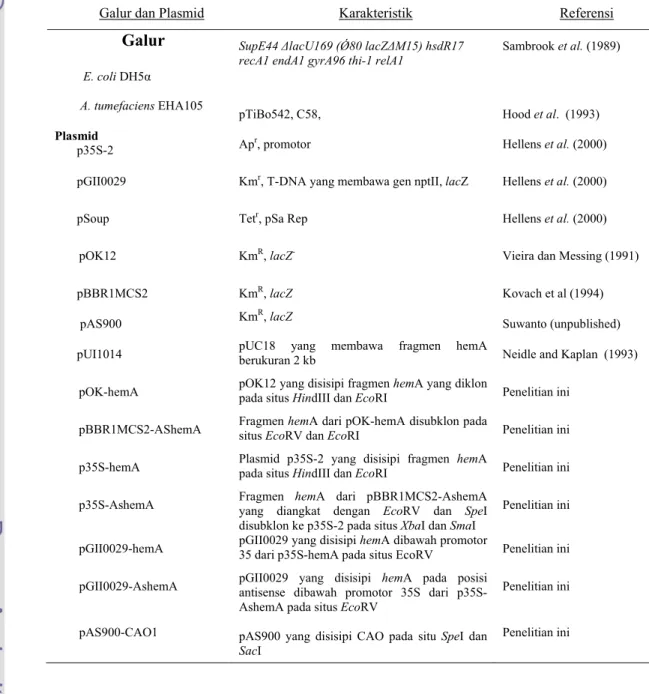
Bakteri dan plasmid yang digunakan pada penelitian ini tercantum pada Tabel1.
Tabel 1. Galur-galur Bakteri dan Plasmid yang Digunakan
Galur dan Plasmid Karakteristik Referensi Galur
E. coli DH5α
SupE44 ∆lacU169 (Ǿ80 lacZ∆M15) hsdR17
recA1 endA1 gyrA96 thi-1 relA1 Sambrook et al. (1989)
A. tumefaciens EHA105
pTiBo542, C58, Hood et al. (1993)
Plasmid
p35S-2 Apr, promotor Hellens et al. (2000)
pGII0029 Kmr, T-DNA yang membawa gen nptII, lacZ Hellens et al. (2000)
pSoup Tetr, pSa Rep Hellens et al. (2000)
pOK12 KmR, lacZ- Vieira dan Messing (1991)
pBBR1MCS2 pAS900 KmR, lacZ KmR, lacZ Kovach et al (1994) Suwanto (unpublished) pUI1014 pUC18 yang membawa fragmen hemA berukuran 2 kb Neidle and Kaplan (1993)
pOK-hemA pOK12 yang disisipi fragmen hemA yang diklon pada situs HindIII dan EcoRI Penelitian ini pBBR1MCS2-AShemA Fragmen hemA dari pOK-hemA disubklon pada situs EcoRV dan EcoRI Penelitian ini p35S-hemA Plasmid p35S-2 yang disisipi fragmen hemA pada situs HindIII dan EcoRI Penelitian ini p35S-AshemA Fragmen hemA dari pBBR1MCS2-AshemA yang diangkat dengan EcoRV dan SpeI
disubklon ke p35S-2 pada situs XbaI dan SmaI
Penelitian ini pGII0029-hemA pGII0029 yang disisipi hemA dibawah promotor 35 dari p35S-hemA pada situs EcoRV Penelitian ini pGII0029-AshemA
pAS900-CAO1
pGII0029 yang disisipi hemA pada posisi antisense dibawah promotor 35S dari p35S-AshemA pada situs EcoRV
pAS900 yang disisipi CAO pada situ SpeI dan
SacI
Penelitian ini Penelitian ini
Pembuatan E. coli kompeten
E. coli strain DH5α ditumbuhkan dalam botol kultur berisi 25 ml medium LB selama 16 jam dengan pengocokan 150 rpm pada suhu 37°C. Keesokkan harinya sebanyak 250 µl inokulum diinokulasikan ke dalam 25 ml medium LB segar dan diinkubasi pada suhu 37°C dengan pengocokan 150 rpm selama 3 jam atau sampai mencapai OD600 nm = 0.4. Kultur selanjutnya diinkubasikan diatas es selama 30 menit dan sebanyak 3 ml dipanen dalam tabung eppendorf dengan sentrifugasi pada kecepatan 5000 rpm selama 2 menit. Sel kemudian dicuci dengan 1 ml larutan NaCl (0.1M NaCl, 5 mM Tris-Cl, 5 mM MgCl2, pH 7). Sel
yang telah dicuci ini kemudian diresuspensi dalam 1 ml larutan CaCl2 (0.1M CaCl2, 5 mM Tris-Cl, 5 mM MgCl2, pH 7) selanjutnya diinkubasi selama 20
menit diatas es. Selasai inkubasi, sel diendapkan dengan sentrifugasi pada kecepatan 5000 rpm 2 menit dan diresuspensikan kembali dalam 200 µl larutan CaCl2 dan diinkubasi kembali selama 1 jam.
Transformasi E. coli
Sel kompeten yang telah dibuat dengan cara di atas kemudian ditambahkan dengan 10µl hasil ligasi dan diinkubasi selama 45 menit diatas es. Selanjutnya dilakukan kejutan pada suhu 42ºC selama 1 menit dan diinkubasikan kembali diatas es selama 2 menit. Untuk recovery ditambahkan sebanyak 250 µl LB dan diinkubasi selama 1 jam dengan digoyang pada kecepatan 170 rpm. Setelah itu sel hasil transformasi disebar di atas media dengan antibiotik yang sesuai dan diinkubasi selama semalam. Keesokan harinya transforman yang tumbuh digores di atas media baru.
Purifikasi DNA dari gel agarose
Fragmen DNA yang didapat dari hasil digesti dipisahkan dengan elektroforesis gel agarose dan fragmen yang diinginkan dipotong keluar dari gel menggunakan pisau scalpel bersih. DNA kemudian dipurifikasi menggunakan QiaQuick spin columns (Qiagen, Studio City, CA) mengikuti protocol yang disarankan oleh pembuatnya. Volume bufer elusi yang digunakan adalah 30µl dan sebanyak 1 µl hasil elusi diukur konsentrasinya dengan spektrofotometer.
Isolasi DNA plasmid
Koloni bakteri yang didapat dari hasil transformasi ditumbuhkan di medium LB dengan antibiotik yang sesuai selama semalam pada suhu 37°C. Sebanyak 3 ml kultur dipelet dalam tabung eppendorf dengan sentrifugasi pada kecepatan 13.000 rpm selama 2 menit. Supernatan kemudian dibuang dan diresuspensikan dalam 200 µl bufer P1 (50 mM Tris-Cl pH 8, 10 mM EDTA pH 8, 10 mg/ml RNAse). Selanjutnya ditambahkan 200µl bufer P2 (0.2 N NaOH, 1% SDS) dan dibolak-balik beberapa kali sampai lisis sempurna. Kemudian ditambahkan 200 µl bufer P3 (3 M Kalium asetat bufer pH 5) dan divortex selama 10 detik. Selanjutnya sentrifugasi pada kecepatan 10.000 rpm selama 10 menit. Supernatan kemudian pindahkan pada tabung baru dan diekstrak dengan 350µl fenol:kloroform:isoamilalkohol (25:24:1) dan divortex selama 20 detik dan disentrifugasi pada kecepatan 10.000 rpm selama 10 menit. Fase air yang terbentuk dipindahkan ke tabung baru dan dipresipitasi dengan 0.7 volume isopropanol dingin dan diinkubasi di -20°C selama 10 menit. Setelah itu disentrifugasi pada kecepatan 10.000 rpm selama 1 menit. Pelet yang terbentuk kemudian dicuci dengan 1 ml 80% etanol dan dikeringkan dengan vakum. DNA
kemudian dilarutkan dengan 50 µl dH2O. Sebanyak 5µl DNA digunakan untuk
analisis restriksi.
Konstruksi vektor ekspresi ALAS
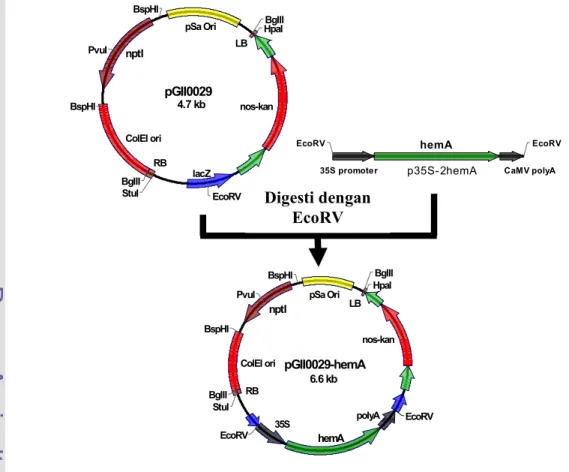
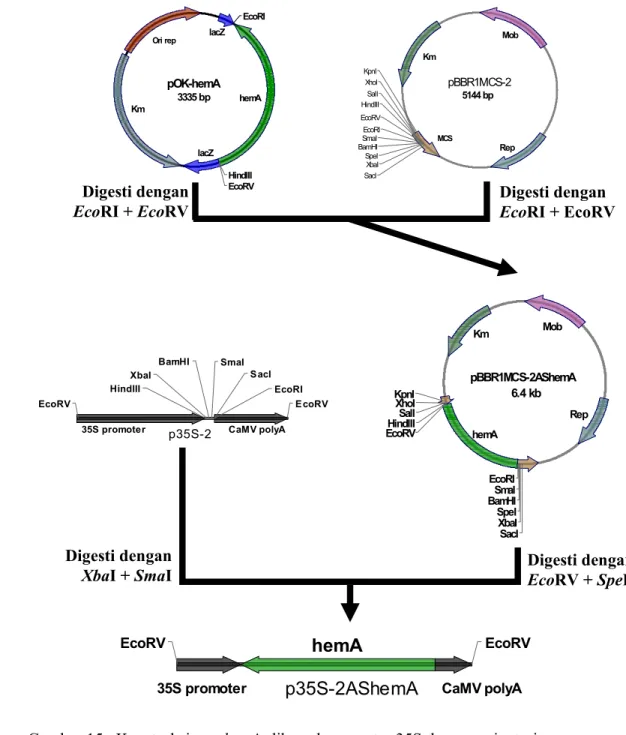
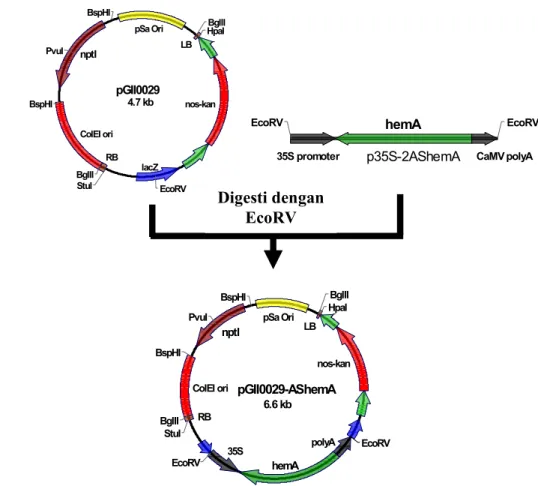
Gen hemA diamplifikasi dari plasmid pUI1014 (Neidle and Kaplan 1993) menggunakan primer IrawanHF (5’-CCCAAGCTTATGGACTACAATCTG-3’) IrawanER (5’-ACCGGAATTCTCAGGCAACGACCTC) yang telah diberi tambahan situs restriksi HindIII dan EcoRI menggunakan enzim DyNAzymeTM EXT DNA Polymerase (FinnZymes, Singapore), kemudian diklon ke dalam plasmid pOK12 (Vieira and Messing 1991) untuk menghasilkan plasmid rekombinan pOK-hemA (Gambar 12). Fragmen hemA ini lalu disisipkan dibawah promoter 35S pada plasmid p35S-2 (Hellens et al. 2000) yang telah didigesti dengan enzim HindIII dan EcoRI (Gambar 13). Gen hemA yang telah diletakkan dibawah promoter 35S dengan orientasi sense ini kemudian diklon ke dalam plasmid pGII0029 (Hellens et al. 2000) pada situs EcoRV menghasilkan plasmid rekombinan pGII0029-hemA (Gambar 14). Untuk mengkonstruksi gen hemA dengan orientasi antisense, gen hemA yang telah diklon ke plasmid pOK12 (Vieira and Messing 1991) diangkat lagi menggunakan enzim EcoRI dan EcoRV untuk disubklon ke plasmid pBBR1MCS2 (Kovach et al 1994) menghasilkan plasmid rekombinan pBBR1MCS2-AShemA (Gambar 15). Kemudian fragmen hemA diangkat kembali dengan enzim EcoRV dan SpeI untuk selanjutnya disubklon ke plasmid p35S-2 yang telah didigesti dengan enzim XbaI dan SmaI menghasilkan plasmid rekombinan p35S-AShemA (Gambar 16). Selanjutnya diklon ke plasmid pGII0029 (Hellens et al. 2000) yang telah didigesti dengan enzim yang sama (Gambar 17).
Gambar 12. Kloning hemA ke plasmid pOK12 menghasilkan rekombinan plasmid pOK-hemA PCR lacZ Ap hemA Ori pUI1014 3910 bp lacZ EcoRI HindIII Km Ori rep
pOK12
2135 bp lacZ EcoRI HindIII Km Ori rep lacZ hemApOK-hemA
3335 bp HindIII hemA EcoRI1.2 kb
Digesti dengan HindIII + EcoRI
Gambar 13. Konstruksi gen hemA dibawah promoter 35S dengan orientasi sense
Gambar 14. Konstruksi binary vektor yang membawa gen hemA dibawah promoter 35S dengan orientasi sense
BglII BglII BspHI BspHI EcoRV HpaI PvuI StuI LB RB ColEI ori nptI pSa Ori nos-kan 35S polyA hemA EcoRV pGII0029-hemA 6.6 kb
35S promoter CaMV polyA
EcoRV hemA EcoRV
p35S-2hemA BglII BglII BspHI BspHI EcoRV HpaI PvuI StuI LB RB ColEI ori nptI pSa Ori lacZ nos-kan pGII0029 4.7 kb Digesti dengan HindIII + EcoRI lacZ EcoRI HindIII Km Ori rep lacZ hemA pOK-hemA 3335 bp BamHI EcoRI HindIII SacI SmaI XbaI
35S promoter CaMV polyA
EcoRV EcoRV
p35S-2
35S promoter CaMV polyA
EcoRV hemA EcoRV
p35S-2hemA
Digesti dengan EcoRV
Gambar 15. Konstruksi gen hemA dibawah promoter 35S dengan orientasi antisense lacZ EcoRI HindIII Km Ori rep lacZ hemA EcoRV pOK-hemA 3335 bp Mob Rep MCS Km BamHI EcoRI EcoRV HindIII KpnI SacI SalI SmaI SpeI XbaI XhoI pBBR1MCS-2 5144 bp Mob Rep Km BamHI EcoRI EcoRVHindIII KpnI SacI SalI SmaI SpeI XbaI XhoI hemA pBBR1MCS-2AShemA 6.4 kb BamHI EcoRI HindIII SacI SmaI XbaI
35S promoter CaMV polyA
EcoRV EcoRV
p35S-2
35S promoter CaMV polyA
EcoRV
hemA
EcoRVp35S-2AShemA
Digesti denganXbaI + SmaI Digesti dengan EcoRV + SpeI
Digesti dengan EcoRI + EcoRV Digesti dengan
Gambar 16. Konstruksi binary vektor yang membawa gen hemA dibawah promoter 35S dengan orientasi antisense
Gambar 17. Peta plasmid pSOUP BglII BglII BspHI BspHI EcoRV HpaI PvuI StuI LB RB ColEI ori nptI pSa Ori lacZ nos-kan pGII0029 4.7 kb
35S promoter CaMV polyA
EcoRV hemA EcoRV
p35S-2AShemA BglII BglII BspHI BspHI EcoRV HpaI PvuI StuI LB RB ColEI ori nptI pSa Ori nos-kan 35S polyA hemA EcoRV pGII0029-AShemA 6.6 kb Digesti dengan EcoRV
Transformasi plasmid rekombinan ke Agrobacterium tumefaciens EHA 105
Transformasi plasmid dilakukan menggunakan metode freeze-thaw (An et al. 1988) ke dalam Agrobacterium tumefaciens EHA 105 (Hood et al. 1993). Plasmid rekombinan ditransformasi secara bersamaan dengan plasmid pSOUP (Gambar 17) (Hellens et al. 2000). Agrobacterium thumefaciens EHA105 (pGII0029-hemA/AShemA) ditumbuhkan selama semalam pada suhu 28°C dalam 25 ml medium TYNG (10g/l Tripton, 5g/l ekstrak khamir, 5g/l NaCl, 1g/l glukosa, 0.2 g/l MgSO4, pH 7.5). Keesokkan harinya dilakukan subkultur sebanyak 1% ke medium yang baru dan diinkubasikan pada kondisi yang sama selama semalam. Selanjutnya kultur didiamkan diatas es selama 10 menit kemudian di panen dengan disentrifugasi pada kecepatan 5000 rpm 4°C selama 10 menit. Setelah supernatant dibuang, sel dicuci dengan 1 ml 20mM CaCl dingin dan disentrifugasi kembali dengan kondisi yang sama. Sel kembali diresuspensi dalam 1 ml 20 mM CaCl2 dingin. Kedalam 150 µl sel
Agrobacterium ditambahkan sebanyak 1µg plasmid dan dicampur rata kemudian dibekukan dengan nitrogen cair selama 5 menit. Setelah itu dicairkan kembali dengan meletakkannya diatas meja pada suhu ruang dan ditambahkan 1 ml LB (10g/l Tripton, 5g/l ekstrak khamir, 5g/l NaCl) untuk kemudian diinkubasi selama semalam pada suhu 28°C dengan kecepatan 200 rpm. Setelah kurang lebih 16 jam, kultur kemudian disebar diatas medium TYNG yang diberi antibiotic kanamisin 50µg/ml dan tetrasiklin 2µg/ml diinkubasikan kembali sampai ada koloni yang tumbuh (sekitar 3-4 hari)
Transformasi rekombinan binary vector ke Arabidopsis thaliana
Transformasi dilakukan dengan mencelupkan bunga tanaman Arabidopsis thaliana ecotype Columbia ke dalam suspensi Agrobacterium tumefaciens EHA105 (pGII0029-hemA) (Floral dip transformation) (Clough and Bent 1998) sedangkan seleksi transforman dilakukan secara in solium (Xiang et al. 1999). Arabidopsis thaliana ditumbuhkan sampai fase pembungaan di dalam walk-in incubator dengan suhu 22°C dan penyinaran ~ 80 µE.m-2.s-1 selama 24 jam. Tanaman ditanam pada tabung PVC yang berdiameter 4.5 cm dengan tanah (Trubus) yang dipasteurisasi. Untuk mencegah terjatuhnya tanah pada saat infeksi bakteri, tabung ditutupi dengan kain kassa yang diikat dengan karet gelang (Gambar 18a).
Tanaman ditumbuhkan selama 32-34 hari atau sampai tangkai bunga mencapai panjang 2-9 cm dengan beberapa bunga yang telah mekar (Gambar 18b). Agrobacterium tumefaciens strain EHA105 (pGII029hemA) ditumbuhkan selama semalam (~ 18 jam) pada medium cair YEP (10 g/l yeast extract, 10 g/l peptone, 5 g/l NaCl) yang diberi antibiotik kanamisin (50 mg/l) dan diinkubasi pada suhu 28°C dengan kecepatan 180 rpm. Sel bakteri kemudian dipanen dengan sentrifugasi pada kecepatan 6000 g pada suhu 4°C selama 10 menit dan diresuspensikan pada medium infeksi (5% sukrosa + 0.05% Agristick® (Bayer
CropScience, Jakarta) sehingga mencapai OD600 sekitar 0.80 (Clough and Bent
A B
Gambar 18. Tanaman Arabidopsis thaliana yang ditumbuhkan pada tabung PVC (A) dan siap diinfeksi (B)
Tanaman dicelupkan kedalam suspensi bakteri selama 3-5 detik dengan digoyang secara perlahan (Gambar 19a) dan selanjutnya diberi selubung dengan ujung yang ditutup untuk menjaga kelembaban dan mencegah perkawinan silang (Gambar 19b). Tanaman yang telah diinfeksi diinkubasi di ruang gelap selama semalam sebelum dikembalikan ke kondisi lingkungan yang telah disiapkan. Plastik penutup pada ujung selubung dibuka setelah 24 jam pasca infeksi. Tanaman ditumbuhkan sampai menghasilkan biji untuk selanjutnya dilakukan seleksi untuk mendapatkan kandidat tanaman yang tertransformasi.
A B
Gambar 19. Tahapan infeksi dengan suspensi Agrobacterium (A) dan pasca infeksi (B)
Seleksi kandidat tanaman transgenik dilakukan secara In-solium mengikuti metode yang dikembangkan oleh Xiang et al. (1999). Biji yang telah dikeringkan dikecambahkan secara langsung ditanah (1,000-3,000 biji pada wadah plastik berdiameter 18). Setelah melewati tahap stratifikasi selama 3 hari pada suhu 4°C, wadah dipindahkan ke walk-in incubator dengan penyinaran ~ 80 µE.m-2.s-1 selama 24 jam dan suhu 22°C. Setelah kecambah tumbuh dan dua daun pertamanya telah muncul, dilakukan penyemprotan dengan kanamisin yang telah dicampur dengan 0.1% Agristick® (Bayer CropScience, Jakarta).
Penyemprotan kanamisin dilakukan setiap hari dengan jumlah yang cukup untuk membasahi seluruh permukaan daun. Tanaman disemprot dengan 100 mg/l kanamisin selama 2 hari, dilanjutkan dengan 200 mg/l kanamisin selama 2 hari, dan akhirnya dengan 500 mg/l kanamisin (Xiang et al. 1999). Selama tahap seleksi kecambah ditutupi dengan plastic untuk mencegah efek terbakarnya daun dan dehidrasi yang berlebihan akibat kombinasi perlakuan dengan antibiotik dan surfaktan.
Analisis kandidat tanaman transgenik dengan PCR
Kandidat tanaman transgenik diisolasi total DNA genomnya menggunakan metode dari Lassner et al. (1989): Sebanyak 0.2 g bahan tanaman segar digerus dengan menggunakan nitrogen cair dan dimasukkan ke tabung 1.5 ml. Sebanyak 0.5 ml bufer isolasi (2% (w/v) CTAB, 1.4 M NaCl, 20 mM EDTA, 100 mM Tris-HCl, pH 8.0, 0.2% ß-merkaptoetanol) ditambahkan kedalam tabung dan dicampur dengan cara dibolak-balik sampai homogen. Selanjutnya dilakukan inkubasi pada suhu 65˚C selama satu jam dengan setiap 10 menit dibolak-balik agar homogen. Sebanyak satu kali volume kloroform-isoamil alkohol (24:1 v/v) ditambahkan
sample dengan dibolak-balik sampai homogen selama 10 menit. Selanjutnya dilakukan sentrifugasi pada kecepatan 8000 rpm selama 15 menit. Fase cair yang terbentuk kemudian dipindahkan ke tabung baru dan ditambahkan 1 µl RNase A (10 mg/ml dalam 10 mM Tris-HCl, 15 mM NaCl, pH 7.5) dan diinkubasi pada suhu 37ºC selama 1 jam. Presipitasi DNA dilakukan dengan penambahan 1/30 volume 3 M sodium asetat (pH 5.2) dan 0.6 volume isopropanol dingin dan dicampur dengan membolak-balikkan tabung beberapa kali. Pelet DNA didapat setelah dilakukan sentrifugasi pada kecepatan 6.500 rpm selama 10 menit. Setelah supernatan dibuang, pelet dicuci dengan penambahan 0.5 ml 80% ethanol dan disentrifus kembali dengan kecepatan 8.000 rpm selama 3 menit di suhu ruang. Pelet selanjutnya dikering-udarakan dan dilarutkan dibufer TE. DNA kandidat tanaman transgenik kemudian di PCR menggunakan GeneAmp PCR System 2400 (Perkin Elmer) untuk mengetahui keberadaan gen hemA dan kanamisin menggunakan primer NewhemAF (CTACAATCTGGCACTCGATA C) dan NewhemAR (GTCCGAGATCATCTTGCAGT) dan kanF (GTT CTTTTT
GTCAAGACCGACCT) dan kanR (GCTCAGAAGAACTCGTCAAGAAG)
dengan kondisi PCR (sama untuk keduanya) : 94°C, 30”; 50°C, 1’; 72°C, 1’ sebanyak 25 siklus. .
Analisis transkrip dengan Reverse Transcriptase (RT)-PCR
Analisa transkrip dilakukan dengan mengisolasi total RNA dan pembuatan cDNA menggunakan Trizol® Reagent (Invitrogen, California) dan ProtoScriptTM
First strand cDNA Synthesis Kit (New England Biolab, Singapore).
Sebanyak 100 mg sample daun dihancurkan 1 ml TRIzol Reagent menggunakan batang pengerus sampai homogen. Material tanaman yang tidak
larut dipisahkan dengan sentrifugasi 12.000x g selama 10 menit pada suhu 4°C. Homogenat kemudian dipindahkan ke tabung yang baru dan diinkubasi selama 4 menit pada suhu ruang dan selanjutnya ditambahkan 0.2 ml kloroform. Tabung dikocok dengan tangan selama 15 menit dan diinkubasi kembali selama 2-3 menit pada suhu ruang. Setelah itu dilakukan sentrifugasi pada kecepatan 12.000 x g selama 15 menit pada suhu 4°C. Fase cair yang dihasilkan kemudian dipindahkan ke tabung yang baru dan RNA dipresipitasi dengan penambahan 0.5 ml isopropanol. Inkubasi pada suhu ruang selama 10 menit dan disentrifugasi kembali pada kecepatan 12.000 x g selama 10 menit pada suhu 4°C. Pelet RNA kemudian dicuci dengan penambahan 1 ml etanol 75% dan divortex dan kemudian disentrifus kembali pada kecepatan 7.500 x g selama 5 menit pada suhu 4°C. Pelet RNA kemudian dikering udarakan dan selanjutnnya dilarutkan dengan RNase-free water.
Sebanyak 5µl ekstrak RNA ditambahkan dengan 2 µl primer d(T)23 VN
(50 µM) dan 4 µl dNTP (10 mM) serta air bebas nuklease sampai mencapai volume 16 µl. Kemudian dipanaskan pada suhu 70°C selama 5 menit dan disentrifugasi secara cepat dan diletakkan diatas es. Selanjutnya ditambahkan 2
µl 10X bufer RT, 1 µl inhibitor RNase dan 1 µl M-MuLV Reverse Transcriptase(New England Biolab, Singapore) untuk kemudian diinkubasi pada suhu 42°C selama satu jam. Inaktivasi enzim dilakukan dengan pemanasan pada suhu 95°C selama 5 menit. Untuk menghilangkan RNA ditambahkan 1µl RNase H (2 unit) dan diinkubasi pada 37°C selama 20 menit dan diinaktivasi kembali dengan pemanasan pada 95°C selama 5 menit. Hasilnya kemudian diencerkan
menjadi 50µl dengan dH2O untuk selanjutnya sebanyak 5 µl digunakan untuk
reaksi PCR.
Pengukuran kandungan klorofil
Kandungan klorofil diukur menggunakan metode Arnon (1959). Potongan daun segar digerus dalam nitrogen cair kemudian ditambahkan aseton 80% dan diaduk sampai homogen. Ekstrak klorofil disaring dengan kertas saring Whatman no 42 dan dimasukkan ke dalam labu ukur 100 ml. Sisa jaringan diekstrak sekali lagi dengan aseton 80% dan hasilnya dicampur dengan ekstrak yang pertama kemudian ditambahkan aseton sampai mencapai volume 100 ml. Sebanyak 5 ml larutan dimasukkan ke dalam labu ukur 50 ml dan diencerkan dengan aseton 80% sampai mencapai volume 50 ml. Ekstrak klorofil selanjutnya diukur pada panjang gelombang 663, 645 dan 652 nm. Jumlah tanaman yang digunakan untuk analisis klorofil adalah 3 untuk tanaman kontrol dan 8 untuk tanaman trangenik.
Esei aktivitas ALA sintase dan total kandungan ALA
Sebanyak satu gram potongan daun digerus dalam nitrogen cair kemudian ditambahkan 1 ml bufer (50 mM Tris-Cl pH 7.6, 5 mM EDTA pH 8, 0.2% ß-mercaptoethanol). Sebanyak 100 µl ekstrak dicampurkan dengan 100µl bufer esei yang mengandung : Tris-Cl pH 7.6 (100 mM); Glisin (200 mM), Piridoksal fosfat (0.2 mM); Suksinil-CoA (0.32 mM); DTT (2 mM) dan Asam levulinat (20 mM). Campuran esei ini kemudian diinkubasi selama 4 jam pada suhu 37°C. Setelah diinkubasi dilakukan pengukuran kandungan ALA menggunakan reagen Ehrlich (Urata dan Granick 1963) sebagai berikut: sebanyak 100 µl 10% TCA ditambahkan kedalam campuran esei kemudian disentrifugasi pada kecepatan 13.000 rpm selama 5 menit. Sebanyak 300 µl supernatant ditambahkan dengan
400µl 1 M Sodium asetat pH 4.6 dan 35 µl asetilaseton dan selanjutnya dididihkan selama 20 menit. Setelah didinginkan sampai suhu ruang, sebanyak 700 µl reagen Ehrlich ditambahkan dan didiamkan selama 20 menit sebelum diukur absorbansinya pada panjang gelombang 556.
Pengukuran berat basah dan berat kering
Arabidopsis thaliana ditumbuhkan sampai berumur 6 minggu kemudian ditimbang berat basahnya. Berat kering ditimbang setelah dikeringkan dalam oven selama 2 hari pada suhu 60°C
Pengujian ketahanan terhadap salinitas
Tanaman Arabidopsis yang berumur 3 minggu didalam pot yang berisi tanah disiram dengan larutan yang mengandung 0, 200 mM dan 400 mM NaCl setiap hari selama 2 minggu. Setelah 2 minggu dilakukan dokumentasi terhadap efek perlakuan NaCl.
Kloning gen Chlorophyll A Oxygenase dari Arabidopsis thaliana
Kloning gen Chlorophyll A Oxygenase dari Arabidopsis thaliana dilakukan dengan menggunakan teknik PCR berdasarkan sekuen yang ada di GeneBank dengan accession number NM-103548.
Total RNA diekstrak menggunakan Trizol® Reagent (Invitrogen,
California) dan cDNA disintensis menggunakan ProtoScriptTM First strand cDNA
Synthesis Kit (New England Biolab, Singapore). Setelah itu dilakukan amplifikasi menggunakan primer CAOF (5’-TTTCCGGACTAGTCATGAACGC-3’) dan CAOR (5’-AGATTTCTTTGAGCTCAGTTAGCC-3’) yang membawa situs restriksi bagi enzim SpeI dan SacI menggunakan enzim DeepVentR Polymerase (New England Biolab, Singapore) dengan kondisi PCR : 94°C, 30”; 50°C, 1’;
72°C, 1’ . Hasil amplifikasi kemudian elektroforesis dan pita DNA berukuran sekitar 1.6 kb dipotong dan dipurifikasi menggunakan QiaQuick spin columns (Qiagen, Studio City, CA). Fragmen yang diduga gen CAO ini kemudian didigesti dengan enzim SpeI + SacI dan sisipkan ke plasmid pAS900 pada situs restriksi yang sama. Fragmen yang telah menyisip diplasmid pAS900 (Suwanto, unpublished) ini kemudian ditentukan urutan nukleotidanya menggunakan automatic DNA Sequencer ABI3100 untuk menentukan apakah memang benar gen ini adalah gen Chlorophyll A Oxygenase dan tidak mengalami mutasi selama proses PCR.
Tempat dan waktu penelitian
Penelitian ini dilakukan di laboratorium Biologi Molekuler SEAMEO-BIOTROP, Bogor, Scottish Agricultural College, Scotland dan Research Center for Microbial Diversity IPB, Bogor dari bulan Januari 2002 sampai Desember 2004.