BAB III
KONDUKTOMETRI
Bab ini akan membicarakan sifat-sifat larutan yang keraitan dan kelistrikan yang tidak dipengaruhi oleh reaksi elektrodanya. Pembicaraan mengenai masalah tersebut pada bab ini, yaitu: konduktivitas materi, konduktivitas larutan elektrolit, elektroda sel imersi dan titrasi konduktometri.
3.1 Konduktivitas Materi
Materi yang terdapat di alam jika ditinjau dari ukuran konduktivitasnya dapat dibagi menjadi tiga kelompok:
1) Konduktor. Tembaga dan besi merupakan unsur logam yang mempunyai konduktivitas listrik yang sangat besar. Dalam hal ini, konduktivitas tembaga kira-kira 5 -6 kali lebih baik dari pada besi. Tingginya konduktivitas logam ditentukan oleh ikatan logam, yang dicirikan dengan adanya elektron bebas yang tinggal pada atom tertentu tetapi dapat bergerak secara leluasa diantara atom-atom logam.
2) Semi-konduktor. Pada suhu kamar, semi konduktor mempunyai konduktivitas listrik yang sangat kecil karena sangat sedikit elektron yang dapat melepaskan diri dari inti atom.
3) Non-konduktor. Unsur yang termasuk dalam kelompok ini tidak memiliki elektron bebas sama sekali. Sehingga pemindahan arus tridak mungkin terjadi.
Lebih lanjut, konduktor dapat dibedakan atas kedua macam yaitu konduktor elektronik dan konduktor elektrolitik. Pada konduktor elektronik muatan listrik dibawa oleh elektron yang bebas bergerak atau lubang elektron (“hole”) pada semi konduktor. Sedangkan penghantar elektrolitik, muatan dibawa oleh ion-ion baik ion positif (pembawa muatan positif) dan ion negatif (membawa muatan negatif).
Berkaitan uraian diatas saudara perlu mengingat kembali tentang hukum ohm yang berbunyi: kuat arus I (ampere) yang mengalir didalam suatu konduktor berbanding lurus dengan GGL (E, volt) dan berbanding terbalik dengan tahanan R (ohm) dari konduktor:
I =
Tahanan suatu materi homogen dengan panjang l, dan luas permukaan, a, dinyatakan dalam hubungan:
R=
Kebalikan dari tahanan disebut konduktivitas, G, G=
Dimana ρ adalah sifat khas dari suatu materi yang disebut resistivitas yang dulu disebut resistansi spesifik. Kebalikan dari resistivitas adalah konduktivitas (к), yang mana dalam satuan SI adalah daya hantar satu meter kubik suatu zat dan mempunyai satuan ohm-1m-1 (atau S m-1), tetapi resistivitas diukur dalam S cm-1, dimana S adalah singkatan dari siemen.
3.2 Konduktivitas Larutan Elektrolit
Konduktivitas suatu larutan elektrolit pada setiap suhu hanya ditentukan oleh ion-ion yang ada didalam larutan, dan konsentrasinya. Apabila larutan elektrolit diencerkan, konduktivitasnya akan menurun,karena jumlah ion-ion yang berfungsi untuk membawa arus per cm3larutan menjadi lebih kecil. Jika seandainya semua larutan dapat ditempatkan di antara dua buah elektroda yang dipisahkan dengan jarak 1 cm dan cukup besar untuk menampung semua larutan, maka konduktivitas akan bertambah besar jika larutan diencerkan. Hal ini lebih
disebabkan oleh berkurangnya pengaruh inter-ionik untuk elektrolit kuat dan olh karena derajat dissosiasi elektrolit lemah bertambah besar.
Kondiktivitas molar (Λ) suatu elektrolit didefenisikan sebagai konduktivitas yang ditentukan oleh satu mol dan dinyatakan dengan rumus:
Λ = 1000 = к. 1000 V
Dimana C adalah konsentrasi larutan dalam mol/dm3, dan V pengenceran dalam dm3 (yakni jumlah dm3 atau liter yang mengandung satu mol). Dengan demikian, jika к mempunayai dimensi S cm-1, maka satuan Λ adalah S cm mol-1, atau dalam sistem SI, S m2 mol-1.
Untuk elektrolit kuat konduktivitas molar bertambah dengan bertambahnya pengenceran, tetapi nampaknya sampai mencapai suatu nilai batas tertinggi yang disebut konduktivitas molar pada pengenceran tak terhingga, Λ˜, jumlah ini ditulis sebagai Λo apabila konsentrasi yang menjadi perhatian utama dari pada pengenceran. Kuantitas Λo dapat ditentukan melalui ekstrapolasi untuk larutan encer dari elektrolit kuat. Untuk elektrolit lemah metoda ekstrapolasi tidak dapat dipakai menentukan Λo tetapi dihitung dari konduktivitas molar pada pengenceran tak terhingga masing-masing ion, dapat dilakukan dengan memakai hukum migrasi bebas ion-ion. Pada pengenceran tak terhingga ion-ion saling bebas satu sama lainnya, dan masing-masing mengambil bagian dalam menentukan konduktivitas total, jadi:
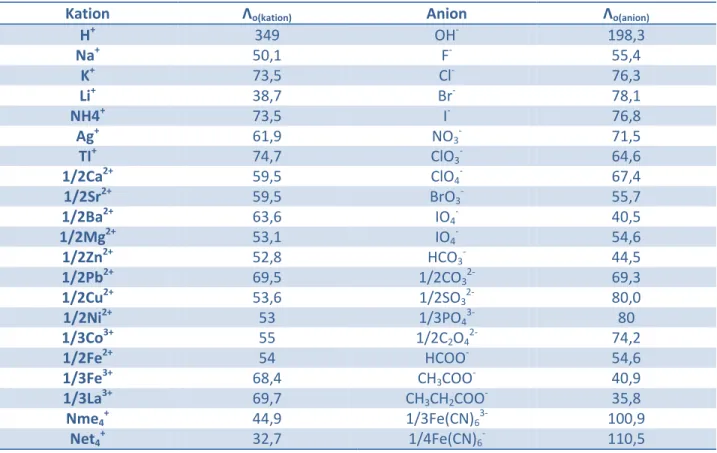
Λo = Λo (kation) + Λo(anion)
Dimana Λo (kation) dan Λo (anion) adalah konduktivitan molar ionik pada pengenceran tak terhingga dari kation dan anion. Nilai batas konduktivitas molar ionik untuk beberapa ion dapat dilihat pada tabel 3.1.
Untuk mengukur konduktivitas suatu larutan maka larutan dimasukkan ke dalam suatu sel dimana tetapa sel tersebut telah ditentukan melalui kalibrasi dengan suatu larutan yang konduktivitasnya diketahui dengan pasti, misalnya:
Tabel 3.1 Nilai Batas Konduktivitas Molar pada Suhu 25oC
Kation Λo(kation) Anion Λo(anion)
H+ 349 OH- 198,3 Na+ 50,1 F- 55,4 K+ 73,5 Cl- 76,3 Li+ 38,7 Br- 78,1 NH4+ 73,5 I- 76,8 Ag+ 61,9 NO3- 71,5 TI+ 74,7 ClO3- 64,6 1/2Ca2+ 59,5 ClO4- 67,4 1/2Sr2+ 59,5 BrO3- 55,7 1/2Ba2+ 63,6 IO4- 40,5 1/2Mg2+ 53,1 IO4- 54,6 1/2Zn2+ 52,8 HCO3- 44,5 1/2Pb2+ 69,5 1/2CO32- 69,3 1/2Cu2+ 53,6 1/2SO 32- 80,0 1/2Ni2+ 53 1/3PO43- 80 1/3Co3+ 55 1/2C2O42- 74,2 1/2Fe2+ 54 HCOO- 54,6 1/3Fe3+ 68,4 CH3COO- 40,9 1/3La3+ 69,7 CH3CH2COO- 35,8 Nme4+ 44,9 1/3Fe(CN)63- 100,9 Net4+ 32,7 1/4Fe(CN)6- 110,5
Pada konduktometri digunakan arus bolak-balik untuk mencegah polarisasi dan elektrolisis. Sumber arus bolak-balik dapat berupa listrik langsung dari sumber utama dengan frekuensi 50 – 60 hertz, atau oscillator byang dapat memberikan arus dengan frekuensi sampai lebih dari 3000 Hz.
Jika frekuensi arus listrik bertambah sangat besar sampai 106 - 108 Hz, maka pengaruh kapasitas dan induktif menjadi sangat penting, maka peralatan harus dapat dimodifikasi untuk mampu mengatasi pengaruh tersebut. Maka titrasi konduktometri dibedakan atas dua maam, yakni: titrasi konduktometri frekuensi rendah (sampai 3000 Hz) dan titrasi konduktometri yang dilakukan pada frekuensi tinggi.
3.3 Elektoda Sel Imersi
Sel konduktivitas sangat menentukan tingkat ketelitian pengukuran. Oleh karena itu diperlukan sel dengan konstanta sel tertentu seara optimal dan sesuai dengan masalah yang di hadapi. Prinsip pemilihan konstanta sel harus memperhatikan konduktivitas elektrolit yang akan diukur,
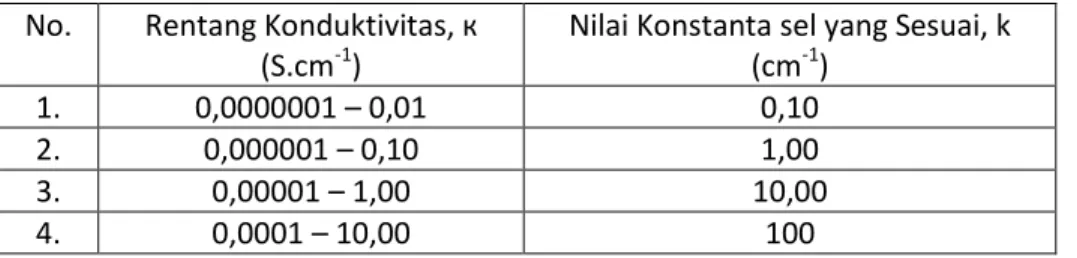
untuk konduktivitas rendah diperlukan sel dengan konstanta rendah, tetapi untuk konduktivitas tinggi diperlukan sel dengan konstanta tinggi. Daerah pengukuran untuk beberapa konstanta sel yang berbeda dapat dilihat pada Tabel 3.1.
METROHM menyediakan 5 macam sel pengukuran dengan konstanta dan kategori penggunaan masing-masing, lihat Tabel 3.2.
Tabel 3.1 Nilai Konstanta Sel yang Sesuai untuk Rentang Konduktivitas No. Rentang Konduktivitas, к
(S.cm-1)
Nilai Konstanta sel yang Sesuai, k (cm-1)
1. 0,0000001 – 0,01 0,10
2. 0,000001 – 0,10 1,00
3. 0,00001 – 1,00 10,00
4. 0,0001 – 10,00 100
Tabel 3.2 Spesifikasi sel Pengukuran yang Disediakan oleh Metrohm
No. Jenis Sel Konstanta Sel
(cm-1)
Penggunaan
1. Immersion Sel 0,1 - 20 Dipakai secara universal
2. Immersion sel dengan Sensor Suhu Pt 100
0,8 Dipakai secara universal
3. Peppete cells 0,1 – 100 Untuk sampel yang jumlah
sedikit dan yang mengalir.
4. Sel Titrasi 0,5 – 25 Dipakai untuk proses titrasi
5. Joness cells 0,1 - 200 Pengukurannya sangat teliti, pengukuran dilakukan dalam
termostat. Seluruh sel pengukuran yang tersedia di pasaran telah dilapisi dengan platina. Untuk pengukuran yang sangat rendah, platinisasi dapat menimbulkan pengaruh mengurangi keakuratan pengukuran karena adanyapenyerapan pada spons platina. Oleh karena itu, untuk pengukuran pada konduktivitas sangat rendah, lapisan platina harus dilarutkan terlebih dahulu. Prosedur Platinisasi Elektroda:
Larutkan lapisan platina dengan aqua regia panas (HCl : HNO3 = 3 : 1 )
Bilas dengan aquades
Sediakan larutan yang mengandung 3 g H2PtCl6. 6H2O dan 30 g Pb(OOCCH3)2 dalam 100 ml larutan (disebut larutan Lummer-Karl), digunakan untuk platinisasi
Sel pengukuran dicelupkan ke dalam larutan Lummer-karl
Hubungkan dengan sumber arus D.C.
Aliri dengan arus kira-kira 15 mA selama 5 menit
Balikkan polaritas dan ulangi prosedur no. 6
Ulangi elektrolisis dengan cara yang sama tetapi dengan menggunakan elektrolit H2SO4 2%, kemudian bilas dengan air suling (aquadest).
3.4 Titrasi Konduktometri pada Frekuensi Rendah
Penambahan suatu elektrolit ke dalam larutan elektrolit yang lain tanpa mengakibatkan perubahan volume akan mempengaruhi daya hantar larutan tergantung pada apakah terjadi reaksi ionik atau tidak. Jika tidak ada reaksi ionik, seperti pada saat penambahan suatu garam sederhana ke dalam garam sederhana lainnya (misalkan KCl ditambahkan ke dalam NaNO3), maka daya hantar akan tentu naik. Tetapi apabila terjadi reaksi ionik, maka daya hantar mungkin naik tetapi mungkin juga turun; pada penambahan suatu basa ke dalam asam kuat, daya hantar akan turun karena terjadi penggantian ion hidrogen yang mempunyai daya hantar tinggi dengan kation lain yang mempunyai daya hantar lebih rendah. Inilah yang mendasari titrasi konduktometri, yakni penggantian ion yang mempunyai daya hantar tertentu dengan ion-ion lain dengan daya hantar lain.
Mari kita perhatikan bagaimana daya hantar suatu larutan dari suatu elektrolit kuat A+B- akan berubah setelah penambahan pereaksi C+D-, dianggap bahwa kation A+ (ion yang akan digantikan) bereaksi dengan anion D- dari pereaksi. Jika hasil reaksi AD kelarutannya sangat kecil atau sangat sedikit yang terionisasi, reaksinya dapat ditulis seperti berikut:
A+B- + C+D- AD + C+B
-Jadi pada saat terjadi reaksi antara ion A+ dan ion D-, ion A+ digantikan oleh ion C+ pada saat titrasi berlangsung. Apakah daya hantar bertambah besar ataukah berkurang pada saat titrasi berlangsung, tergantung pada apakah konduktivitas ion C+ lebih besar atau lebih kecil dari pada ion A+.
Selama proses netralisasi, pengendapan, dan lain-lain, perubahan konduktivitas dapat diperkirakan secara umum, dan oleh karena itu penentuan titik akhir titrasi dapat dilakukan dengan baik pada saat reaksi berlangsung. Konduktivitas dapat diukur setelah setiap penambahan sejumlah kecil volume pereaksi, dan titik-titik yang diperoleh dialurkan untuk membuat grafik yang terdiri atas dua buah garis lurus yang berpotongan pada titik ekivalen. Ketelitian dan ketepatan metode sangat ditentukan oleh ketajaman sudut perpotongan antara kedua kurva dan kedekatan titik-titik kurva pada garis lurus. Dalam titrasi konduktometri konsentrasi larutan penetrasi harus jauh lebih tinggi dari pada larutan yang akan dititrasi, biasanya larutan penitrasi mempunyai konsentrasi 20 – 100 kali lebih pekat. Koreksi akibat pengeneran dapat dilakukan dengan mengalihkan nilai konduktivitas dengan faktor (V + v)/V, dimana V adalah volume larutan mula-mula dan v adalah volume pereaksi yang ditambahkan.
Titrasi konduktometri dapat diterapkan untuk titrasi-titrasi sebagai berikut ini:
Asam kuat dengan basa kuat (Gambar 3.4 (a))
Asam kuat dengan basa lemah (Gambar 3.4 (b))
Asam lemah dengan basa kuat (Gambar 3.4 (c, d dan e))
Asam lemah dengan basa kuat (Gambar 3.4 (f))
Campuran asam kuat dan asam lemah dengan basa kuat (Gambar 3.4 (h))
Titrasi penggantian atau pengusiran
Reaksi pengendapan dan pembentukan kompleks
Titrasi redoks.
Bentuk kurva dari titrasi tersebut di atas dapat dilihat pada Gambar 3.4. Daya hantar
(a) (b)
Volume ekivalen NaOH ekivalen NH
₃
(c) (d)
0,1 M
0,01 M
0,001 M ekivalen NaOH ekivalen alkali
(e) (f)
0,01 M
0,1 M
NH OH NaOH
(g) (h)
asam kuat NaOH
NH4OH
asam lemah
Ekivalen NH₃
ml basa
Gambar 3.4 Bentuk-bentuk Kurva Titrasi Konduktometri (a-h)
3.5 Titrasi Konduktometri pada Frekwensi Tinggi
Pemakaian arus bolak-balik (AC) dapat menghindarkan pengendapan elektrokimia,karena
setiap arus berubah arahnya. Ion yang sudah terendapkan akan larut kembali. Kecepatan ion
terendapkan atau terlarutkan kembali dapat diatur dengan mengatur frekwensi arus
bolak-balik. Dengan frekwensi tinggi diharapkan ion-ion tidak mempunyai waktu yang cukup untuk
mencapai kecepatan maksimumnya. Pada keadaan tersebut terbentuk fenomena polarisasi
molekuler.
Jika pada suatu molekul diberikan medan listrik dari luar,maka elektron dalam molekul
mempunyai kecenderungan bergerak ke arah elektroda bermuatan positif, sedangkan inti
molekul cenderung kea rah negatif. Akibatnya terjadi distorsi pada molekul tersebut. Fenomena
ini bersifat temporer dan hilang bila medan dari luar dihilangkan.
Ada beberapa molekul yang memiliki dipole listrik permanen (yaitu pusat muatan negatif
dan positif terpisah pada jarak tertentu), antara lain: H
2O, CH
3COCH
3(aseton), CHCl
3(kloroform), dan nitrobenzene. Sementara molekul-molekul seperti CH
4,CCl
4, benzene, dan
p-nitrobenzena tidak mempunyai momen dipole. Jika molekul polar berada dalam pengaruh
medan listrik,maka molekul tersebut akan mengorientasikan dirinya sedemikian rupa ke arah
kutub-kutub yang berlawanan. Jadi selain distorsi akibat polarisasi secara temporer pada
molekul tersebut, terdapat pula polarisasi orientasi.
Kedua tipe polarisasi tersebut di atas menghasilkan aliran arus listrik dalam waktu yang
sangat singkat bila diberi medan listrik. Apabila medan listrik yang diberikan sangat besar
frekwensinya yaitu suatu frekwensi radio, maka polarisasi menjadi jauh lebih berarti sehingga
arus hantaran menjadi cukup besar untuk dapat dihitung.
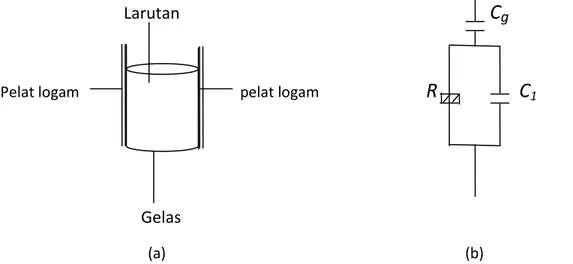
Biasanya sample diletakkan di antara dua pelat kapasitoryang frekwensinya sedemikian rupa
sehingga sample dapat beresonansi dengan medan tersebut yang dinyatakan dalam bentuk
absorbsi energi (Gambar 3.5).
Larutan
C
gPelat logam pelat logam
R
C
1Gelas
(a) (b)
Gambar 3.5 (a). Sel frekwensi tinggi sederhana, (b). Rangkaian listrik yang ekivalen dengan gambar (a),
dimana Cg = kapasitansi yang menembus dinding gelas, C1 = kapasitansi larutan dan R = resistansi larutan.
Pertanyaan:
1. Jelaskan apa yang mendasari titrasi konduktometri!
2. Apa yang membedakan analisis konduktometri dengan analisis potensiometri? 3. Bagaimana mengatasi pengaruh polarisasi pada pengukuran konduktivitas?
4. Apa perbedaan mendasar antara konduktometri frekwensi rendah dengan frekwensi tinggi?