VARIASI SEROTIPE ISOLAT VIRUS INFECTIOUS BRONCHITIS
YANG BERASAL DARI BEBERAPA DAERAH DI PULAU JAWA
RISA INDRIANI danDARMINTO
Balai Penelitian Veteriner
Jalan R.E. Martadinata 30, P.O. Box 151 Bogor 16114, Indonesia
(Diterima dewan redaksi 19 Juni 2000) ABSTRACT
INDRIANI, RISA and DARMINTO. 2000. Serotype variation among infectious bronchitis viral isolates taken from several areas of Java. Jurnal Ilmu Ternak dan Veteriner 5 (4): 234-240.
Infectious bronchitis (IB) is an acute highly contagious viral respiratory disease of poultry caused by virus belongs to the family of Coronaviridae. The virus consist of many serotypes with low level of cross-protectivity among serotypes. Field data showed that the outbreaks of IB were frequently reported in chicken flocks, although vaccinations against the disease have been practiced. Hence, the study on serotype relationship among isolates of the viruses is essentially required. The aim of this study was to isolate and characterize IB viruses from chicken flocks in some areas of Java. Isolation of the virus was carried out in nine-day old embrionated chicken eggs and identified by means of agar gel precipitation (AGP) tests against standard antisera to IB virus. The serotypes of the IB viral isolates were determined by cross-neutralization tests in nine day old embryonated chicken eggs using r value derived from homologous and heterologous serum titres as criteria. This study obtained 12 IB viral isolates which were identified on the basis of the ability to cause lesions in chicken embryos and positive to agar gel presipitation test against standard positive antiserum to the virus. Based on the cross-neutralization tests in embryonated chicken eggs, isolate I.9 was formed to have relationship closed to Mass-41 serotype, while I.2, I. 3, and I.7 isolates were closely to the serotype of Con-46. Virus isolates (I.5, I.14, I.24, and I.25) were decided to have no serotype relationships to either Mass-41 or Con-46 serotype. Since the I.5, I.14, I.24 and I.25 isolates were not neutralized by antisera against the previous identified local infectious bronchitis viral isolates, and that were considered to be distinct serotype to the previously identified local IB viral isolates. Key words: Infectious bronchitis, virus, embryonated egg, cross neutralization test.
ABSTRAK
INDRIANI, RISA dan DARMINTO. 2000. Variasi serotipe isolat-isolat virus Infectiuos bronchitis yang berasal dari beberapa daerah
di pulau Jawa. Jurnal Ilmu Ternak dan Veteriner 5 (4): 234-240.
Infectious bronchitis (IB) merupakan penyakit pernafasan yang bersifat akut dan sangat menular pada ayam, disebabkan oleh virus yang termasuk ke dalam famili Coronaviridae dan mempunyai banyak serotipe dengan tingkat proteksi silang yang rendah. Kasus penyakit IB di lapangan hingga saat ini sering di laporan pada peternakan ayam, meskipun telah rutin dilakukan vaksinasi. Variasi serotipe virus IB di lapangan yang menyebabkan kasus belum diketahui dan penting untuk dilakukan penelitian. Penelitian ini bertujuan mengisolasi virus IB dari beberapa daerah di pulau Jawa dan mempelajari variasi serotipenya. Isolasi virus IB dilakukan pada telur ayam berembrio umur 9 hari dan diidentifikasi dengan serum standar anti-virus IB dalam uji presipitasi agar (agar gel precipitation test, AGP). Variasi serotipe dari isolat-isolat tersebut dipelajari secara uji serum netralisasi silang pada telur ayam berembrio umur 9 hari. Data hasil pemeriksaan titer reaksi netralisasi terhadap serum homolog dan heterolog dipakai sebagai dasar penentuan serotipe dianalisa menggunakan nilai r (r value). Dalam studi ini, diperoleh 12 isolat virus IB yang diidentifikasi berdasarkan kemampuannya menyebabkan lesi pada embrio ayam dan positif terhadap uji AGP. Hasil penentuan serotipe dari isolat-isolat tersebut dengan menggunakan uji netralisasi silang pada telur ayam berembrio diketahui isolat I.9 termasuk dalam serotipe Mass-41 dan isolat I.2, I.3 dan I.7 termasuk dalam serotipe Con-46. Isolat I.5, I.14, I.24, dan I.25 tidak termasuk dalam serotipe Mass-41 maupun Con-46. Karena Isolat-isolat I.5, I.14, I.24, dan I.25 tidak dinetralisasi dengan antiserum terhadap virus IB isolat lokal yang telah ada berarti serotipenya berbeda dengan virus IB isolat sebelumnya.
Kata kunci: Infectious bronchitis, virus, telur berembrio, uji netralisasi silang PENDAHULUAN
Infectious bronchitis (IB) merupakan penyakit
saluran pemafasan pada ayam yang bersifat akut, sangat menular dan disebabkan oleh virus Corona yang
tergolong ke dalam famili Coronaviridae (MURPHY dan KINGSBURY, 1990). Serangan penyakit ini sangat merugikan, bagi petemak, dapat menyebabkan kematian anak-anak ayam umur kurang dari 3 minggu sampai 30% (HOFSTAD, 1984). Infeksi pada ayam
petelur dapat menurunkan produksi telur hingga mencapai 60% dalam kurun waktu 6-7 minggu dan selalu disertai dengan penurunan mutu telur berupa bentuk telur tidak teratur, kerabang telur lunak dan albumin telur cair (HOFSTAD, 1984; DAVELAAR et al., 1986; MUNEER et aI., 1986; CHUBB, 1988). Serangan IB yang bersifat nephropathogenic dapat mengakibatkan kematian pada ayam petelur dan ayam potong muda (BROWN et al., 1987). Ayam yang terserang IB ditandai dengan gejala pernafasan parah seperti sesak nafas, bersin-bersin dan ngorok. Perubahan patologis anotomi pada ayam yang diduga terserang virus IB berupa adanya cairan agak encer hingga kental di dalam trakhea, saluran hidung dan sinus hidung, sedangkan kantong udara berwama keruh atau mengandung eksudat berwama kuning dan sedikit peradangan di sekitar bronkhi (HOFSTAD, 1984). Pada ayam yang terserang virus IB yang bersifat nephropathogenic terlihat ginjalnya bengkak dan berwama pucat dengan tubulus dan ureter berisi asam urat (CUMMING, 1972).
Di Indonesia, tingkat prevalensi IB pada beberapa peterakan ayam di Jawa Barat mencapai 40
-
60% (DARMINTO et al., 1988). Kasus IB di lapangan sering dilaporkan, meskipun peternakan ayam tersebut telah rutin melakukan program vaksinasi. Vaksin IB yang beredar di pasaran Indonesia pada umumnya berisi virus IB serotipe Massachusetts (Mass) dan sebagian kecil berisi serotipe Connecticut (Conn), yang kurang cukup memiliki proteksi silang melawan virus IB galur lapangan (DARMINTO, 1999).Isolasi dan karakterisasi virus IB lapangan pemah dilakukan oleh DARMINTO (1992) dan ditemukan 6 isolat lokal dari daerah Jawa Barat, yang termasuk ke dalam serotipe Mass, Conn dan sedikit mengarah pada N2/62 asal Australia. Dari daerah lain di Pulau Jawa, terutama daerah yang padat populasi ayamnya perlu dilakukan penelitian untuk mempelajari karakteristik dan variasi serotipe dari isolat virus IB yang sangat bermanfaat dalam menentukan jenis vaksin IB yang sesuai dengan virus IB di lapangan. Tujuan dari penelitian ini ialah untuk mengisolasi dan meng-identifikasi virus penyebab IB di beberapa Kabupaten di pulau Jawa dan mempelajari variasi serotipenya.
MATERI DAN METODE Koleksi Sampel
Sampel untuk pemeriksaan dikoleksi antara bulan September sampai dengan November 1998 dari ayam sakit yang diduga menderita IB dan berasal dari beberapa Kabupaten di pulau Jawa, yaitu Kabupaten Semarang, Magelang, Banyumas, Bogor, Cianjur, Sukabumi, Malang, Blitar dan Kediri. Organ tubuh
ayam terdiri atas trakhea, paru-paru, ginjal dan ovarium dikoleksi secara aseptik dan disimpan dalam medium transport 50% gliserin yang mengandung 1.000 IV penisilin dan 1.000 µg streptomisin untuk dibawa ke laboratorium Balai Penelitian Veteriner.
Isolasi dan identifikasi virus
Di laboratorium, organ trakhea, paru-paru, ginjal dan ovarium dicuci dengan phosphate-buffered saline (PBS) yang mengandung 5.000 IV penisilin dan 10 µlg streptomisin sebanyak 3 kali, kemudian digerus dan disentrifugasi selama 5 menit dengan 3.000 rpm pada 4°C. Selanjutnya dibuat suspensi 10% dalam PBS yang mengandung 1.000 IV penisilin dan 1.000 µg streptomisin, dengan proses sentrifugasi dan supernatan dipisahkan untuk isolasi virus. Tiap inokulum dibutuhkan 5 butir telur tertunas umur 9 hari. Sebanyak 0,1 ml inokulum disuntikkan kedalam ruang alantois telur ayam berembrio umur 9 hari. Setelah inokulasi diinkubasikan pada suhu 37°C. Setelah 48 jam pascainfeksi, cairan alantois telur dipanen kemudian diuji secara hemaglutinasi (HA) cepat untuk mendeteksi adanya kontaminasi dengan virus Newcastle Disease (ND), yaitu dengan cara diteteskan pada permukaan plat kramik dan ditambah satu tetes butir darah merah ayam bebas ND 10% dalam PES, kemudian dicampur dengan menggunakan tusuk gigi. Cairan alantois negatif virus ND tidak teraglutinasi, selanjutnya disuntikkan pada telur ayam berembrio seperti di atas, demikian seterusnya hingga pasase ketujuh. Sebagian telur diinkubasikan selama 120 jam paska infeksi untuk melihat perkembangan lesi embrio. Inokulum yang menimbulkan lesi embrio yang menciri terhadap infeksi virus IB (kerdil, melingkar, perdarahan dan penimbunan asam urat) pada beberapa pasase terakhir diproses untuk diidentifikasi menggunakan uji agar gel presipitation (AGP) dengan anti-serum terhadap virus IB.
Uji agar gel presipitasi (AGP)
Membran khorionalantois (chorioallantoic
membrane, CAM) dari telur yang positif terinfeksi
virus IB diproses menjadi antigen. CAM dicairbekukan pad a suhu -20°C, kemudian digerus clan dibuat suspensi dengan kepekatan konsentrasi 40%. Suspensi CAM disentrifugasi pada kecepatan 3.000 rpm selama 20 menit pada suhu 4°C. Supernatan ditambahkan khoroform dengan perbandingan 1:5 dari volume suspensi, clan disentrifugasi padas kecepatan 10.000 rpm selama 20 menit pacta suhu 4°C. Supematan dipisahkan clan ditambah amonium sulfat jenuh, kemudian disentrifugasi pacta kecepatan 10.000 rpm selama 20 menit pada suhu 4°C. Pellet dari CAM disuspensikan dengan air suling steril dan digunakan
sebagai antigen dalam uji AGP.
Dalam uji AGP, agar (agar Nobel 1% dalam NaCl 0,85% pada pH 7,4) disiapkan pada cawan petri dilubangi dengan alat pelubang khusus. Antigen yang akan diuji diteteskan ke dalam lubang-Iubang pada agar yang posisinya melingkar sedangkan serum positif standar anti-virus IB yang diperoleh dengan menginfeksi virus IB Mass-41 asal America culture
collection (ATCC) pada ayam spesific pathogen-free
(SPF) umur 5 minggu (DARMINTO, 1992) dimasukkan ke dalam lubang yang terletak di tengah. Selanjutnya cawan agar tersebut ditaruh dalam kotak plastik berkelembaban dan diinkubasikan pada suhu 37°C. Suspensi antigen yang positif akan memperlihatkan garis presipitasi terhadap serum standar anti-virus IB.
Uji hemaglutinasi
Virus dari sample yang positif dalam uji AGP diperbanyak dalam telur ayam berembrio umur 9 hari untuk pembuatan antigen hemaglutinasi menurut metode LASHGARI DAN NEWMAN (1981). Secara singkat sebagai berikut, cairan alantois dari basil perbanyakan disentrifugasi pada kecepatan 2.000 rpm selama 15 menit. Selanjutnya disentrifugasi dengan ultrasentrifuse pada kecepatan 11.000 rpm selama 60 menit. Supernatan dibuang, pellet yang terbentuk dilarutkan menjadi 1% dari volume awal dalam larutan penyangga 0,01 M tris-hydrochloride pH 6,5 yang mengandung 5 unit enzim fosfolipase C tipe-I (Sigma Chern. Co) per ml dan diinkubasikan pada suhu 37°C selama 2 jam. Antigen kemudian dititrasi dengan uji HA. Isolat virus IB yang memiliki titer virus ≥ 26 HA/0,025 ml digunakan untuk membuat antiserum terhadap virus IB pada ayam yang bebas dari kuman patogen tertentu
(spesific pathogen-free, SPF) umur 6 minggu (diperoleh
dari PT Vaksindo Satwa Nusantara).
Studi variasi serotipe
Anti-serum dari isolat-isolat IB (1.7, 1.9, 1.3, 1.25, 1.24, 1.5, 1.2) clan anti-serum dari virus IB referensi Mass-41 dan Con-46 (Tabel 3) dipersiapkan menurut prosedur GOUGH et al. (1992). Sebanyak 0,1 ml dari setiap virus IB yang berisi 100 EID50 diinfeksikan secara
tetes mata dan tetes hidung. Setiap isolat diinfeksikan ke dalam 5 ekor ayam SPF. Setelah 2 minggu pascainfeksi pertama dilakukan infeksi ulang. Darahnya diambil pada 2 minggu pascainfeksi kedua, serum dipisahkan clan disimpan pada -20°C. Titer antibody dalam serum diperiksa dengan uji hemaglutinasi inhibisi (HI) (ALEXANDER dan CHETTLE, 1977).
Uji netralisasi silang dilakukan dengan mengguna-kan anti-serum terhadap isolat IB lapang (1.7, 1.9, 1.3, 1.25, 1.24, 1.5, 1.2) dan anti-serum IB referensi Mass-41 dlan Con-46 yang telah diinaktitkan pada suhu 56° C
selama 30 menit. Untuk uji tersebut, tiap anti-serum IB dibuat pengenceran serial berkelipatan 4 dalam PBS yang mengandung 200 IU penisilin dan 200 µg streptomisin per ml. Titer setiap isolat IB untuk uji netralisasi silang ini adalah 100 EID50/0,5 ml cairan
virus. Sebanyak 0,5 ml dari setiap pengenceran anti-serum isolat IB dan anti-anti-serum virus referensi dicampur dengan larutan virus (100 EID50/0,5 ml virus
IB) di dalam botol Bijou. Campuran anti-serum dan virus IB diinkubasi selama 30 menit pada suhu kamar. Setiap set anti-serum dan virus diinokulasikan ke dalam 5 butir telur berembrio umur 9 hari dan diinkubasikan selama 9 hari pada suhu 37°C serta diamati setiap hari. Titer serum neutralization (SN) dikalkulasi dengan metode REED dan MUNCH (1938) dan diekspresikan kedalam bilangan log2.
Neutralisasi isolat dengan anti-serum virus IB isolat lokal
Terhadap isolat-isolat virus IB yang diperoleh dalam penelitian ini, dilakukan uji serum neutralisasi dengan anti-serum terhadap virus IB isolat local I.37, I.269, dan PTS III (DARMINTO, 1999). Untuk uji tersebut, antiserum terhadap isolat lokal di atas dibuat pengeceran seri berkelipatan 4 dalam PBS yang mengandung 200 IU penisilin dan 200 µg streptomisin per ml. Sebanyak 0,5 ml dari setiap pengenceran kemudian dicampur dengan larutan isolat virus IB (100 EID50/0,5 ml virus IB) di dalam botol Bijou.
Campuran anti-serum dan virus IB diinkubasi selama 30 menit pada suhu kamar. Setiap set campuran isolat virus IB dan anti-serum diinokulasikan ke dalam 5 butir telur ayam berembrio umur 9 hari dan diinkubasikan selama 9 hari pada suhu 37°C serta diamati setiap hari. Isolat virus IB yang dinetralisasi oleh anti-serum tidak menyebabkan lesi pada embrio. Titer serum netralisasi (SN) dikalkulasi menggunakan metode REED dan MUNCH (1938) dan diekspresikan kedalam bilangan log2.
Analisis data
Analisis variasi serotipe diantara isolat-isolat lokal virus IB dilakukan dengan menggunakan rumus r
values berdasarkan titer serum SN dari pasangan virus
IB dan anti-serum IB homolog dan heterolog. Rumus R = 100 √(r1x r2), yang dalam hal ini r1 atau r2
merupakan titer serum heterolog dibagi titer serum homolog (ARCHETTI dan HORSFAL, 1950), kemudian dimodifikasi menurut LASHGARI dan NEWMAN (1983). Dua virus IB dinyatakan sebagai serotipe yang berbeda jika memiliki nilai R <20, dinyatakan termasuk ke dalam serotipe yang sarna jika memiliki nilai R ≥50 dan dikelompokkan doubius jika memiliki nilai R antara 20-50.
HASIL DAN PEMBAHASAN
Lesi embrio yang diakibatkan oleh isolat virus IB yang terdapat pada inokulum (organ sample lapang) berupa kekerdilan (dwafing dan curling), perdarahan dan pertumbuhan bulu yang gagal (dubbing dawn
feather). Lesi embrio terjadi pada pasase pertama,
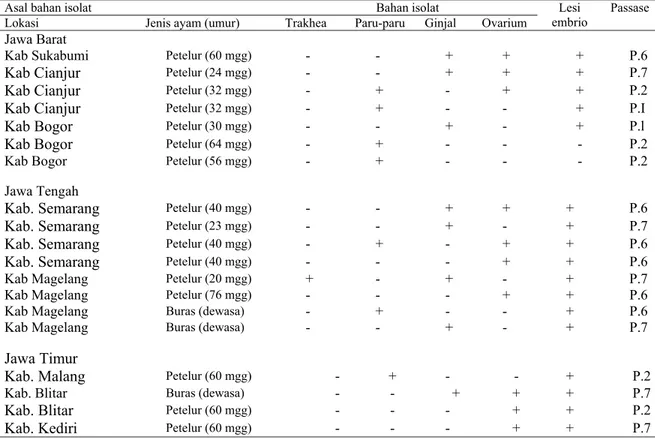
kedua, keenam dan ketujuh. Tujuh inokulum positif lesi embrio berasal dari kabupaten Cianjur, Bogor, Malang, dan Blitar pada pasase pertama dan kedua serta dua belas inokulum positif lesi embrio berasal dadi beberapa Kabupaten seperti Sukabumi, Cianjur, Semarang, Magelang, Blitar dan Kediri pada pasase enam dan tujuh (Tabel 1). Dari basil pengamatan tersebut terdapat inokulum yang diambil dari sampel mengakibatkan lesi embrio kekerdilan, perdarahan dan pertumbuhan bulu yang gagal pada pasase satu dan dua. Pada pasase tersebut kemungkinan disebabkan oleh virus vaksin, karena virus tersebut sudah beradaptasi pada telur berembrio. Hal serupa pernah dilaporkan oleh peneliti sebelumnya (GLEB, 1989, KING dan CAVANAGH, 1991). Dengan demikian terdapat 12 sampel lapang yang positif infeksi virus IB lapang.
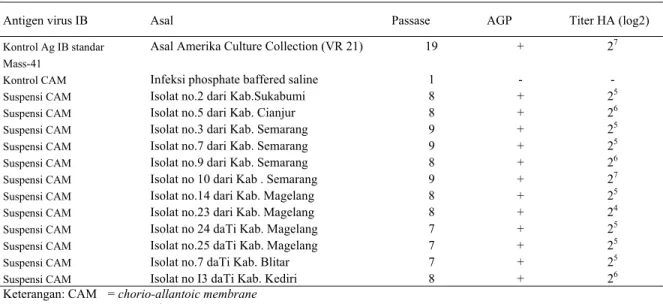
Identifikasi 12 isolat IB lapangan pada inokulum yang menyebabkan lesi embrio pada pasase lima atau lebih, pada pemeriksaan secara AGP yang memperlihatkan garis presipitasi terhadap anti-serum IB yang berasal dari beberapa kabupaten (Sukabumi, Cianjur, Semarang, Magelang, Blitar, dan Kediri), kemudian secara uji HA diketahui kandungan titer virus IB 24 hingga 27 (Tabel 2). Pada pasase tujuh dan
lebih tinggi, delapan dari duabelas isolat virus IB yang dibuat anti-serumnya di dalam ayam SPF umur 6 minggu memberikan titer HI yang cukup tinggi 26
-
27(TabeI3) titer HI tersebut mampu menetralisasi virus IB bersifat di dalam embrio ayam (Box et al., 1988). Dari delapan isolat dan anti-serum tersebut diuji serotipenya secara serum netralisasi silang pada telur ayam, berembrio umur 9 hari bukan SPF menurut CUMMING (1988) masih cukup sensitive (Tabel 4). Hasil ini mendukung penelitian sebelumnya bahwa efek antibodi maternal akibat infeksi virus terhadap embrio dapat dihindari dengan melakukan inokulasi ke dalam ruang alantois telur berembrio sebelum embrio mencapai umur 12 hari (CUMMING, 1988).
Tabel 1. Lesi embrio dari sampel ayam yang diduga terinfeksi virus IB dari beberapa Kabupaten di Pulau Jawa
Asal bahan isolat Bahan isolat
Lokasi Jenis ayam (umur) Trakhea Paru-paru Ginjal Ovarium
Lesi embrio
Passase Jawa Barat
Kab Sukabumi Petelur (60 mgg) - - + + + P.6
Kab Cianjur Petelur (24 mgg) - - + + + P.7
Kab Cianjur Petelur (32 mgg) - + - + + P.2
Kab Cianjur Petelur (32 mgg) - + - - + P.I
Kab Bogor Petelur (30 mgg) - - + - + P.l
Kab Bogor Petelur (64 mgg) - + - - - P.2
Kab Bogor Petelur (56 mgg) - + - - - P.2
Jawa Tengah
Kab. Semarang Petelur (40 mgg) - - + + + P.6
Kab. Semarang Petelur (23 mgg) - - + - + P.7
Kab. Semarang Petelur (40 mgg) - + - + + P.6
Kab. Semarang Petelur (40 mgg) - - - + + P.6
Kab Magelang Petelur (20 mgg) + - + - + P.7
Kab Magelang Petelur (76 mgg) - - - + + P.6
Kab Magelang Buras (dewasa) - + - - + P.6
Kab Magelang Buras (dewasa) - - + - + P.7
Jawa Timur
Kab. Malang Petelur (60 mgg) - + - - + P.2
Kab. Blitar Buras (dewasa) - - + + + P.7
Kab. Blitar Petelur (60 mgg) - - - + + P.2
Kab. Kediri Petelur (60 mgg) - - - + + P.7
Keterangan: P = Jumlah pasase pada telur berembrio yang menimbulkan lesi + = Organ yang menimbulkan lesi embrio
Tabel 2. Hasil identifikasi isolat virus IB dengan uji AGP terhadap anti-serum IB Mass-41 dan kandungan virus IB pada isolat
Antigen virus IB Asal Passase AGP Titer HA (log2)
Kontrol Ag IB standar Asal Amerika Culture Collection (VR 21) 19 + 27
Mass-41
Kontrol CAM Infeksi phosphate baffered saline 1 - -
Suspensi CAM Isolat no.2 dari Kab.Sukabumi 8 + 25
Suspensi CAM Isolat no.5 dari Kab. Cianjur 8 + 26
Suspensi CAM Isolat no.3 dari Kab. Semarang 9 + 25
Suspensi CAM Isolat no.7 dari Kab. Semarang 9 + 25
Suspensi CAM Isolat no.9 dari Kab. Semarang 8 + 26
Suspensi CAM Isolat no 10 dari Kab . Semarang 9 + 27
Suspensi CAM Isolat no.14 dari Kab. Magelang 8 + 25
Suspensi CAM Isolat no.23 dari Kab. Magelang 8 + 24
Suspensi CAM Isolat no 24 daTi Kab. Magelang 7 + 25
Suspensi CAM Isolat no.25 daTi Kab. Magelang 7 + 25
Suspensi CAM Isolat no.7 daTi Kab. Blitar 7 + 25
Suspensi CAM Isolat no I3 daTi Kab. Kediri 8 + 26
Keterangan: CAM = chorio-allantoic membrane AGP = agar gel pricipitation
HA = hemaglutinasi
Tabel 3. Asal dan pasase virus IB yang diuji netralisasi silang pada telur ayam berembrio dan titer antiserum HI terhadap virus IB Virus IB Passase Titer HI dari anti-serum virus IB (log2) Asal I. 7 9 26 Kab. Semarang I. 9 9 26 Kab. Semarang
I.3 11 27 Kab. Semarang
I. 25 12 26 Kab. Magelang
I. 24 12 26 Kab. Magelang
I. 14 9 26 Kab Magelang
I. 5 11 27 Kab Cianjur
I. 2 11 26 Kab Sukabumi
Mass-41 19 27 The ATCC (VR-21)
Conn-46 8 26 The ATCC
(VR-817) Keterangan: HI = uji hambatan hemaglutinasi
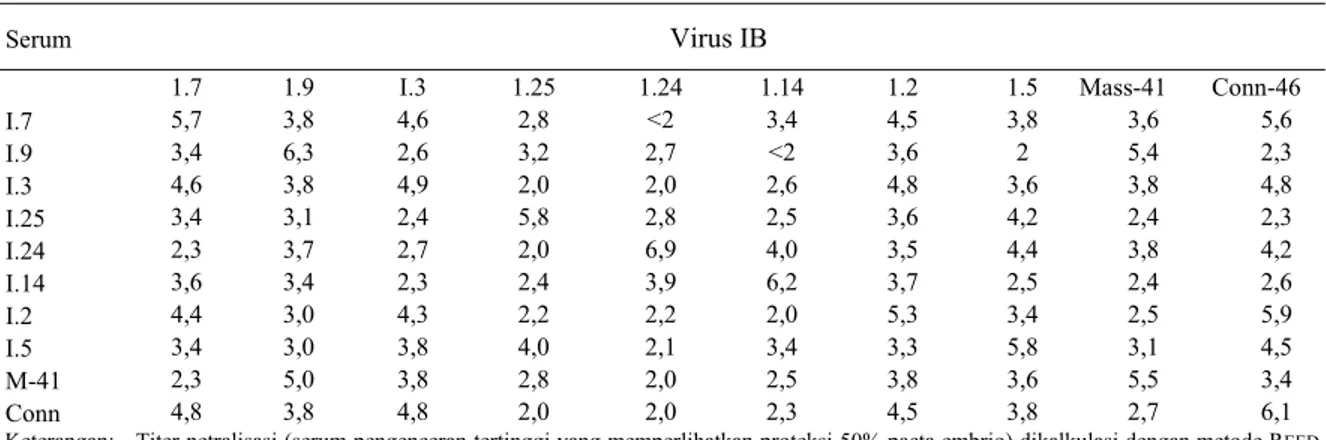
ATCC = American Type Culture Collection Titer SN dari setiap kombinasi serum dan virus yang homolog dan heterolog disajikan pada Tabel 4. Pada kondisi dalam serum yang homolog titer cukup tinggi (4
-
6,9 log2). Isolat 1.7 memperlihatkan reaksi yang cukup kuat dengan Conn-46, 1.3 daD 1.2 yang memiliki titer SN antara 4,5 - 5,6. Isolat 1.9 memperlihatkan reaksi hanya dengan Mass-41 (dengan titer SN 5,4), tidak dengan yang lain. Isolat 1.3 memperlihatkan reaksi kuat dengan Conn-46, 1.2 dan 1.7 dengan titer SN 4,6 - 4,8. Isolat 1.25 memperlihatkan reaksi hanya dengan 1.5 dengan titer SN 4,2. Isolat 1.24 memperlihatkan reaksi dengan I.I4 dengan titer SN 4. Isolat 1.2 memperlihatkan reaksi dengan 1.7,1.3 dan Conn-46 dengan titer SN 4.3 - 5,9, sedangkan 1.5 memperlihatkan reaksi dengan 1.25 dengan titer SN 4,2. Dengan demikian dari delapan isolat IB lapang yang memperlihatkan adanya reaksi yang kuat dengan virus IB refrensi adalah isolat 1.7, 1.3, 1.2 dan 1.9, sedangkan 1.25, 1.24, I. 14 dan 1.5 memperlihatkan reaksi yang lemah dengan virus IB refrensi Mass-41 maupun Con46 dengan titer SN 2 - 2,8. Dalam uji netralisasi antiserum basil vaksinasi IB inaktif isolat lokal (DARMINTO, 1999) terhadap delapan isolat IB lapangan, antiserum tersebut dapat menetralisasi isolat 1.9, 1.3, 1.2, dan 1.7 dengan titer SN antara 4,5 log2 – 6 log2. Isolat lainnya tidak ternetralisasi oleh antiserum tersebut, sehingga dalam penelitian ini virus-virus (1.25, 1.24, I.I4 dan 1.5) dapat dinyatakan sebagai virus IB serotipe berbeda.
Analisis variasi serotipe delapan isolat virus IB yang diuji secara neutralisasi silang pada telur berembrio dan diekspresikan sebagai r value terlihat pada Tabel 5. Pasangan virus homolog mempunyai r
value bervariasi dari 50-67, sedangkan virus
heterolog bervariasi antara 5-19. Isolat 1.7, 1.3 dan 1.2 mempunyai hubungan serotipe yang dekat dengan Conn-46 dengan nilai r value 50 - 61. Isolat virus 1.9 mempunyai hubungan serotipe yang dekat dengan Mass-41 dengan nilai r value 50, sedangkan isolat 1.25, 1.24, 1.14 dan 1.5 tidak mempunyai hubungan serotipe baik dengan Mass-41 maupun dengan Conn-46 dengan nilai r value <20. Temuan ini memperkuat hasil penelitian sebelumnya bahwa pasangan virus homolog mempunyai r value bervariasi ≥ 50, sedangkan virus heterolog < 20 (WADEY and FARAGHER, 1981).
Tabel 4. Titer antibodi serum isolat IB yang bersifat homolog dan heterolog hasil uji netralisasi silang pada telur ayam berembrio umur 9 hari
Serum Virus IB
1.7 1.9 I.3 1.25 1.24 1.14 1.2 1.5 Mass-41 Conn-46
I.7 5,7 3,8 4,6 2,8 <2 3,4 4,5 3,8 3,6 5,6 I.9 3,4 6,3 2,6 3,2 2,7 <2 3,6 2 5,4 2,3 I.3 4,6 3,8 4,9 2,0 2,0 2,6 4,8 3,6 3,8 4,8 I.25 3,4 3,1 2,4 5,8 2,8 2,5 3,6 4,2 2,4 2,3 I.24 2,3 3,7 2,7 2,0 6,9 4,0 3,5 4,4 3,8 4,2 I.14 3,6 3,4 2,3 2,4 3,9 6,2 3,7 2,5 2,4 2,6 I.2 4,4 3,0 4,3 2,2 2,2 2,0 5,3 3,4 2,5 5,9 I.5 3,4 3,0 3,8 4,0 2,1 3,4 3,3 5,8 3,1 4,5 M-41 2,3 5,0 3,8 2,8 2,0 2,5 3,8 3,6 5,5 3,4 Conn 4,8 3,8 4,8 2,0 2,0 2,3 4,5 3,8 2,7 6,1
Keterangan: - Titer netralisasi (serum pengenceran tertinggi yang memperlihatkan proteksi 50% pacta embrio) dikalkulasi dengan metode REED
dan MUENCH (1938) daD diekspresikan sebagai log2 - Angka yang tercetak tebal menunjukkan titer serum homolog
Tabel 5. Hubungan reaksi serologik antara isolat VIrus IB (okal dan virus IB referensi (Mass-41 dan Con-46) yang diekspresikan sebagai nilai r (r values)
Virus IB
Serum 1.7 1.9 I.3 1.25 1.24 1.14 1.2 1.5 Mass-41 Conn-46
I.7 100 19 61 16 5 30 48 22 20 61 I.9 100 19 13 9 8 9 8 50 11 I.3 100 11 8 11 67 31 37 61 I.25 100 20 30 29 14 12 3 I.24 100 14 32 33 10 9 I.14 100 21 24 16 7 I.2 100 21 20 50 I.5 100 20 28 M-41 100 14 Conn 100
Keterangan: - Nilai r merupakan hasil kalkulasi titer neutralisasi pada Tabel 4 dengan metode ARCHETTI dan HORSFAL. (1950). - Titer neutralisasi <2 (log2) dijadikan 2 (log2)
Nilai r tercetak tebal menunjukkan virus IB yang mempunyai hubungan antigenik Tabel 6. Hasil netralisasi antiserum IB vaksin isolat lokal
dengan virus IB varian yang diekspresikan dengan titer (Iog2)
Virus IB Titer SN anti-serum hasil vaksinasi IB inaktif isolat lokal (I.37, I.269 dan
PTSIII I.7 4.5 ♠ I.9 6 ♠ I.3 5.8 ♠ I.25 <2 I.24 2 I.14 <2 I.2 5 ♠ I.5 2.7 Mass-41 (ATCC) 6 ♠ Conn-46 (ATCC) 6 ♠ Keterangan : SN = netralisasi
♠ = titer serum hasil vaksinasi 1B isolat local yang dapat menetralisasi virus IB varian
dan virus IB referensi
KESIMPULAN DAN SARAN
Dari penelitian ini dapat disimpulkan adanya variasai serotipe virus IB lapangan di beberapa Kabupaten di pulau Jawa. Isolat I. 9 termasuk dalam serotipe Mass-41, sedangkan isolat 1.2, 1.3, dan 1.7 termasuk dalam serotipe Conn-46. Isolat 1.5, 1.14, 1.24, dan 1.25 secara serologik berbeda dengan serotipe Mass-41, Conn-46 atau serotipe virus IB isolat lokal yang sudah diperoleh dalam penelitian sebelumnya. Berdasarkan basil temuan variasi virus IB pada ayam dalam penelitian ini disarankan untuk mengembangkan dan menggunakan vaksin IB isolat lokal dalam pengendalian penyakit IB di pulau Jawa agar diperoleh basil yang efektif.
UCAPAN TERIMA KASIH
Pada kesempatan ini, penulis mengucapkan terima kasih kepada Nana Suryana dan Heri Hoerudin teknisi litkayasa . pada kelompok peneliti virologi yang telah membantu pelaksanaan penelitian ini hingga tulisan ini dapat terwujud. Ucapan terima kasih juga penulis sampaikan kepada semua pihak yang telah membantu baik dalam penelitian maupun dalam penulisan makalah ini.
DAFTAR PUSTAKA
ALEXANDER, DJ. and NJ. CHETILE. 1977. Prosedure for the haemagglutination and the haemaggalutination inhibition tests for avian infectious bronchitis virus. AvianPathol. 6: 9-17.
ARCHETTI, I. and F. L HORSFAL. 1950. Presistent antigenic variation of influenza A viruses after incomplete neutralization in ovo with heterologus immune serum. 1. Exp. Med. 92: 441-462.
BROWN, T.P., 1.R. GALISSON, G. ROSALES, P. VILLAGAS, and
R.B. DAVIS. 1987. Studies of avian urolithiosis associated with an infectious bronchitis virus. Avian Dis. 31: 629-636.
CHUBB, R.C. 1988. The strategy defence of the bird against IB
nephritis. In:Poultry Diseases Proceeding no 112, Second Asia Pasific Poultry Health Conference. Surfers Paradise, Australia: 337-348.
CUMMING, R.B. 1972. Infectious bronchitis. In:Poultry and
Disease Research no 2. Animal Quarantine. Departement of Health. Australia: 16-17.
CUMMING, R. B. 1988. The value of non-SPF eggs in poultry disease work. In Poultry Diseases. Proceeding no 112, Second Asia Pasific Poultry Health Conference. Surfers Paradise, Australia. : 319-320.
DARMINTO, P. YOUNG, P. RONOHARDJO, and P.W. DANIELS. 1988. Study on avian infectious bronchitis in Indonesia. Isolation of the virus and serological investigation. In: Poultry Diseases. Proceeding no.112. Second Asian Pasific Poultry Health Confrence. Surfers Paradise, Australia:58 1-591.
DARMINTO. 1992. Serotyping of infectious bronchitis viral isolates. Penyakit Hewan. 24.(44):76-81
DARMINTO. 1999. Pengembangan vaksin infectious bronchitis
inaktif isolat loka!. 1. Ilmu Ternak Vet. 4 (2):113-120. ENDO-MUNOZ, LB. and J.T. FARAGHER. 1989. Avian
infectious bronchitis. Cross-protection studies using different Australia subtypes. Aust. Vet. J. 66:345-348.
DAVELAAR, F.G., B. KOUWENHOVEN, and A.G. BURGER.
1986. The diagnosis and control of IB varian infection. In:Acute Virus Infection of Poultry (eds. J.B. McFrran and M.S.Nulty). Martinis, Njhoff Publishers, Lancaster. : 103-121.
GLEB, J. Jr. 1989. Infectious Bronchitis. In: H.G. Purchase, LH. Arp, C.H. Domermuth, and 1.E. PERSON (eds) A Laboratory Manual for the Isolation and Identification of Avian Pathogen. 3rd ed.. American Assosiation of Avian Pathologists, KendalllHunt Publishing Co., Dubuque, IA:124-127.
GOUGH, R. E., CJ. RANDALL, M. DAGLESS, D.1. ALEXANDER, WJ. COX, and D. PERSON. 1992. A new strain of
infectious bronchitis virus infecting domestic fowl in Great Britain. Vet. Rec.130: 493-494.
HOFSTAD, M.S. 1984. Avian infectious bronchitis. In: M. S. Hofstad, H. J. Barnes. B.W. Calnek, W.M. Reid, and H.W. Yoder Jr, (eds) Diseases of Poultry. 8th edition,. Iowa State University Press. Ames, Iowa USA.: 429-443.
KING, D. 1. and D. CAVANAGH. 1991. Infectious
bronchitis. In: B.W. Calnek, H.J. Barnes, C.W. Beard, W.M. Reid, and H.W. Yoder, (cds) Disease of Poultry, 9th ed.. Iowa State Univerity Press, Ames, Iowa. USA: 471-484.
LASHGARI, M.S. and J.A. NEWMAN. 1981. Preparing hamagglutinating antigen from isolates of IBV. Avian Dis. 26: 508-519.
LASHGARI, M.S. and J.A. NEWMAN. 1983. Serological comparison and antigenic relationship of seven serotypes of infectious bronchitis virus using the hemagglutination-inhibition test. Avian Dis. 28: 435-443.
MUNEER, M.A., D. A. HAEVORSON, V. SIVANANDAN, J. A.
NEWMAN, and C. N. COON. 1986. Effect of infectious bronchitis virus (Arkansas strain) on laying chickens. Avian Dis. 30(4): 644-647.
MURPHY, F.A. AND D.W. KINGSBURY. 1990. Virus taxonomy.
In: B N. Fields, DM. Knipe, R.B.Chanock, MS. Hirsch, JLMelnick, TP.Monath, B. Roizman. (eds) Fields Virology, 2nd ed., vo!.1. Raven Press, New York. USA: 19-35.
REED, LV. AND H. MUENCH. 1938. A simple method of estimating fifty per cent endpoints. Am. 1. Hyg. 27: 493497.
WADEY, C. N. AND J.T. FARAGHER. 1981. Australian
infectious bronchitis viruses: Identification of nine subtype by a neutralization test. Res. Vet. Sci. 30: 66-69.