KINETIKA SORPSI ION ZINK (II) PADA PARTIKEL GAMBUT
1Munawar
1
Jurusan Teknik Kimia Politeknik Negeri Lhokseumawe, Jl. B. Aceh - Medan Km. 280, Buketrata Lhokseumawe 24301
e-mail: [email protected]
Abstrak. Zink merupakan salah satu jenis logam berat yang relatif sering dijumpai
sebagai pencemar air tanah dan air permukaan. Dalam konsentrasi rendah, ion zink(II) merupakan elemen esensial bagi kesehatan, namun dalam konsentrasi tinggi zink merupakan polutan berbahaya yang dapat menyebabkan berbagai masalah kesehatan serius bagi manusia. Karena itu, keberadaan ion zink(II) dalam air minum harus dibatasi pada jumlah maksimum sekitar 3 mg/L. Penelitian ini bertujuan mempelajari penggunaan gambut untuk mereduksi ion zink(II) dari larutan. Eksprimen dilakukan secara batch pada kondisi temperatur ruang (26 ± 3 o
C), menggunakan sejumlah reaktor batch yang dipasang pada rotary shaker. Di dalam setiap reaktor, larutan zink dengan beberapa variasi konsentrasi awal (50 mg/L, 100 mg/L, 150 mg/L, 200 mg/L, dan 250 mg/L) dikontakkan dengan gambut tropis kering (dosis 60 g/L) pada pH 6 selama 3 jam. Sebagai variabel respon, diperiksa konsentrasi residual ion zink(II) dalam larutan dengan metode standar (Zincon Method). Hasil analisis data menunjukkan bahwa efisiensi sorpsi optimum ion zink mencapai 90,68%, yang terjadi pada konsentrasi awal 50 mg/L. Kinetika sorpsi ion zink(II) pada partikel gambut tropis Indonesia sangat cocok dengan
model pseudo-orde dua (R2 = 0,997-1,0). Nilai konstanta kinetika sorpsi, k adalah
0,47-0,155 g.menit/mg, sedangkan kapasitas sorpsi kesetimbangan, qe adalah 0,8-3,01 mg/g.
Kata kunci: gambut, kinetika sorpsi, zink.
1. Pendahuluan
Pencemaran oleh logam berat merupakan salah satu masalah global lingkungan dewasa ini. Bertambahnya jumlah polutan yang terus dibuang ke lingkungan telah membawa dampak yang kian mengkhawatirkan terhadap kehidupan. Zink merupakan salah satu jenis logam berat berbahaya yang relatif sering dijumpai sebagai pencemar air tanah dan air permukaan. Pada konsentrasi rendah, ion zink(II) merupakan elemen esensial bagi kesehatan Tetapi, paparan logam zink(II) pada tingkat konsentrasi tinggi dapat menyebabkan berbagai gangguan kesehatan serius seperti iritasi kulit, batuk, anemia, kerusakan pankreas, gangguan metabolisme protein, arteriosclerosis, hingga rusaknya sistem pernafasan. Dengan sederet resiko terhadap kesehatan tersebut, zink(II) digolongkan sebagai salah satu polutan utama yang ada di alam.
Studi penyisihan logam zink (II) dipandang cukup urgen untuk dilakukan mengingat logam tersebut tergolong berbahaya bagi kehidupan. Metode penyisihan yang dapat dipilih antara lain adalah chemical treatment, proses elektrolisis, proses adsorpsi, proses bioremoval dan proses membran. Secara umum, proses-proses tersebut tergolong proses berbiaya mahal (high cost process) terutama dari aspek biaya material. Karena itu, salah satu aspek penting yang menarik untuk diteliti adalah mengenai penggunaan material berbiaya murah (low cost material) untuk menekan biaya operasi.
Gambut adalah salah satu material yang layak dipilih sebagai adsorben alternatif untuk penyisihan ion zink (Munawar, 2009). Disamping tersedia cukup melimpah di Indonesia, gambut diketahui memiliki daya serap yang relatif tinggi terhadap bahan-bahan terlarut seperti logam dan senyawa organik polar (Brown dkk, 2000; Akinbiyi, 2000). Sekalipun sudah banyak diteliti, namun gambut Indonesia termasuk jenis gambut yang belum banyak diteliti penggunaannya untuk kegiatan pengendalian pencemaran.
Penelitian ini bertujuan mempelajari kinetika dan kapasitas sorpsi ion zink(II) pada partikel gambut tropis Indonesia. Ruang lingkup penelitian meliputi: 1) studi efisiensi dan kapasitas sorpsi ion zink(II); serta 2) studi model kinetika sorpsi ion zink(II) pada partikel gambut.
2. Metode Penelitian 2.1 Adsorben
Gambut yang digunakan sebagai adsorben dalam penelitian ini diambil dari Desa Sungai Raya Dalam Kecamatan Sungai Raya, Kabupaten Pontianak, Propinsi Kalimantan Barat. Sebelum digunakan sebagai adsorben, gambut terlebih dahulu dikeringkan pada temperatur 105 oC selama 8 jam (Ho dan McKay, 2004), dilanjutkan dengan penyeragaman ukuran partikel gambut menggunakan MBT-ASTM standar test sieve hingga diperoleh adsorben dengan ukuran partikel 70/200 mesh. Karakteristik adsorben yang digunakan ditunjukkan pada Tabel 1.
Tabel 1. Karakteristik Adsorben
Parameter Nilai
Warna Coklat tua
pH 3,25 - 3,36 Bahan organik, % 71,93 - 77,35 Karbon organik, % 40,8 - 46,92 Kadar air, % 48,8 - 54,18 N total, % 1,05 - 1,13 KTK, cmol/kg 36,6 - 39,2 Bulk density, g/cm3 0,3436 - 0,4986 Porositas total, % 63,0 – 85,0
Sumber: Hasil karakterisasi gambut
2.2 Limbah Artifisial
Limbah artifisial zink(II) yang digunakan dipersiapkan dari senyawa hidrat zink(II) sulfat. Mula-mula dipersiapkan larutan stock zink dengan cara melarutkan 4,3965 g kristal ZnSO4.7H2O (Merck) di dalam 10 ml asam nitrat (1+1), lalu
dipanaskan beberapa menit untuk menghilangkan oksida nitrogen, dan dilarutkan dengan aquades hingga volume 1 liter. Dengan cara ini diperoleh larutan stok dengan konsentrasi zink sebesar 1000 ppm, di mana 1 ml larutan stok setara dengan 1 mg zink. Keseluruhan limbah artifisial zink dibuat dengan cara mengencerkan larutan stok tersebut.
2.3 Sorpsi Ion Zink(II)
Percobaan sorpsi dilakukan di dalam sejumlah labu erlenmeyer volume 125 mL, pada temperatur ruang (26 ± 3 oC). Ke dalam setiap erlenmeyer, dimasukkan sebanyak 50 mL larutan zink (pHo = 6) dan 3,0 g gambut, dan diaduk dengan rotary shaker
selama 3 jam. Setiap erlenmeyer mewakili satu variabel konsentrasi awal (50-200 mg/L) dan waktu (5-180 menit). Pada setiap titik dalam range waktu tersebut, satu reaktor dipisahkan, lalu diambil 15 ml supernatan, disentrifugasi dengan centrifuge pada 5000 rpm selama 10 menit (Raji dan Anirudhan, 1998; Sakadevan dan Bavor, 1998) dan diperiksa konsentrasi residual zink(II) dengan spektrofotometer pada panjang gelombang 620 nm (APHA, 1998). Sisa campuran dipisahkan dengan kertas saring Whattman No. 40, dan diperiksa pH akhir larutan dengan pH meter.
2.4 Analisis Model Kinetika Sorpsi
Analisis model kinetika sorpsi dilakukan dengan model-model kinetika yang cukup aplikatif untuk sistem liquid-solid yaitu model kinetika pseudo-orde 1 (model Lagergren) dan model pseudo-orde 2 (model Ho dan McKay). Pemilihan kedua model tersebut didasarkan pada fakta bahwa kedua model tersebut telah dipakai secara luas untuk sistem liquid-solid. Model pseudo-orde 2 bahkan dapat dikatakan sangat spesifik untuk sistem logam-gambut, karena dikembangkan berdasarkan reaksi kompleksasi antara logam dengan gambut.
Model pseudo-orde 1 (model Lagergren) adalah model kinetika mekanistik pertama untuk sistem liquid-solid yang berbasis kepada kapasitas solid. Model kinetika tersebut adalah salah satu persamaan kinetika yang telah diaplikasikan secara luas untuk mendiskripsikan sorpsi suatu zat terlarut dari larutan. Bentuk umum pseudo-orde 1 adalah (Ho dan McKay 1999) :
) ( e t t q q k dt dq
Dengan qe adalah kapasitas sorpsi pada kesetimbangan (mg/g), qt kapasitas sorpsi pada waktu tertentu (mg/g), k kontanta kinetika. Integrasi persamaan untuk kondisi batas t = 0 hingga t = t dan qt = 0 hingga qt = qt memberikan hasil :
kt q q q t e e ln
Dalam bentuk linier:
kt q q
qe t)ln e
ln( ... (1)
Plot log(qe - qt) terhadap t atau plot ln(qe - qt) terhadap t, merupakan kurva linier dengan slope = k, dan intersep = ln qe.
Model pseudo-orde 2 (model Ho dan Mckay) adalah salah satu model mekanistik terbaru yang belakangan sudah digunakan secara luas untuk menjelaskan dinamika proses sorpsi. Model kinetika ini dikembangkan oleh Ho dan McKay (1999) berdasarkan reaksi kompleksasi permukaan antara ion tembaga(II) dengan gambut. Ekspresi laju reaksi pseudo-orde 2 adalah:
2 ) ( e t t q q k dt dq
Dimana k adalah konstanta kinetika sorpsi (g/mg.menit). Integrasi persamaan tersebut untuk kondisi batas t = 0 hingga t = t dan qt = 0 hingga qt = qt memberikan hasil:
kt q q qe t e 1 ) ( 1 Atau: t q kq q t e e t 1 1 2 ... (2)
Plot t/qt terhadap t, merupakan kurva linier dengan slope = 1/qe dan intersep = 1/kqe2. Analisis model kinetika sorpsi pada penelitian ini dilakukan dengan metode regresi linier menggunakan persamaan (1) untuk model pseudo-orde 1, persamaan (2) untuk model pseudo-orde 2, dan persamaan (3) untuk model orde 2.
3. Hasil dan Pembahasan 3.1 Efisiensi dan kapasitas sorpsi
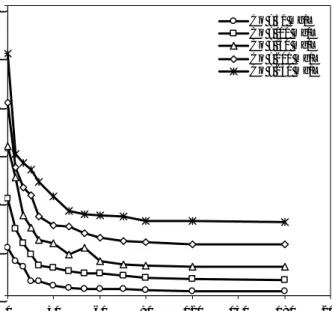
Percobaan kinetika sorpsi dilakukan pada kondisi optimum proses batch, yaitu pH awal 6, dosis adsorben 60 g/L, ukuran partikel adsorben 70/200 mesh (Munawar, 2009), dengan variasi konsentrasi awal zink(II) 50-250 mg/L. Data percobaan memperlihatkan bahwa proses sorpsi berlangsung dalam tiga fase, yaitu fase cepat, fase moderat, dan fase lambat (Gambar 1). Fase cepat terjadi dalam 5 menit pertama, di mana konsentrasi residual zink turun secara signifikan dengan efisiensi sorpsi antara 20,5-41,51 %. Kemudian sorpsi fase moderat dalam 35 menit berikutnya. Dalam fase ini, efisiensi sorpsi meningkat antara 23,65-43,03 % menjadi 64,45-84,62 %. Selanjutnya sorpsi memasuki fase lambat hingga tercapai kesetimbangan. Pada fase ini, hanya terjadi sedikit kenaikan efisiensi sorpsi, yaitu 4,09 - 6,06 %. Secara keseluruhan, proses sorpsi telah mencapai kesetimbangan dalam waktu kontak sekitar 60 menit. Efisiensi sorpsi optimum adalah sebesar 90,68 %, yang dicapai pada konsentrasi awal terendah ion zink (50 mg/L).
Gambar 1. Profil konsentrasi residual zink(II) terhadap waktu
0 50 100 150 200 250 300 0 30 60 90 120 150 180 210 w aktu, menit k on s en tr a s i s en g, m g /L Co = 50 mg/L Co = 100 mg/L Co = 150 mg/L Co = 200 mg/L Co = 250 mg/L
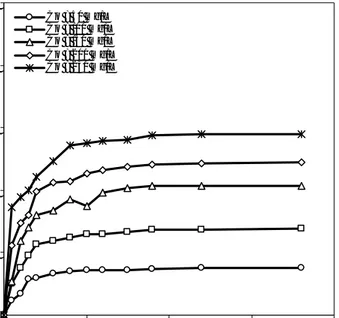
Sekalipun memperlihatkan pola yang seragam dengan profil efisiensi sorpsi, kapasitas sorpsi justru meningkat dengan makin besarnya konsentrasi awal zink (Gambar 2). Hal tersebut diperkirakan terjadi karena meningkatnya gaya dorong (driving force) proses sorpsi dengan makin besarnya konsentrasi zink di dalam larutan, sehingga kuantitas ion zink yang terikat pada site aktif gambut meningkat. Namun demikian, kenaikan ini jauh lebih kecil dibandingkan selisih konsentrasi awal zink di dalam larutan, sehingga efisiensi sorpsi justru makin berkurang dengan makin besarnya konsentrasi awal ion zink. Untuk konsentrasi awal 50 mg/L, kapasitas sorpsi pada akhir proses sorpsi adalah 0,75 mg/g, dan secara konsisten meningkat pada konsentrasi awal zink yang lebih tinggi. Untuk konsentrasi awal 250 mg/L kapasitas sorpsi mencapai 2,89 mg/g.
Para peneliti sebelumnya menemukan fakta yang berbeda-beda tentang efisiensi sorpsi ion zink dengan gambut. Faktor perbedaan jenis gambut nampaknya menjadi alasan utama perbedaan tersebut. Zhipei dkk (1984) yang menggunakan gambut Cina melaporkan efisiensi sorpsi antara 17-96,9 %. Sementara Leslie (1974), yang memakai gambut lumut melaporkan efisiensi sorpsi sebesar 98,9 %. Sedangkan Gosset dkk (1986) yang menggunakan jenis gambut oligotropik melaporkan efisiensi sorpsi sebesar 90 % (Brown dkk, 2000), yang cukup dekat dengan hasil penelitian ini.
3.2 Model kinetika sorpsi
Salah satu tujuan utama percobaan kinetika sorpsi adalah mendapatkan model kinetika sorpsi yang sesuai untuk sistem yang dianalisis, serta mendapatkan nilai-nilai parameter kinetika sorpsi. Dalam studi ini, data-data percobaan kinetika batch akan evaluasi dengan model-model kinetika yang cukup aplikatif untuk sistem liquid-solid
Gambar 2. Kapasitas sorpsi terhadap waktu 0.0 1.0 2.0 3.0 4.0 5.0 0 50 100 150 200 w aktu, menit k a p a s it a s s o rp s i, m g /g Co = 50 mg/L Co = 100 mg/L Co = 150 mg/L Co = 200 mg/L Co = 250 mg/L
yaitu model kinetika pseudo-orde 1, dan model pseudo-orde 2 Kedua model ini telah terbukti sangat aplikatif untuk mendiskripsikan kinetika sorpsi untuk berbagai sistem liquid-solid. Untuk sistem logam-gambut, model pseudo-orde 2 merupakan model yang sangat spesifik, karena model tersebut dikembangkan berdasarkan mekanisme sorpsi logam pada permukaan gambut.
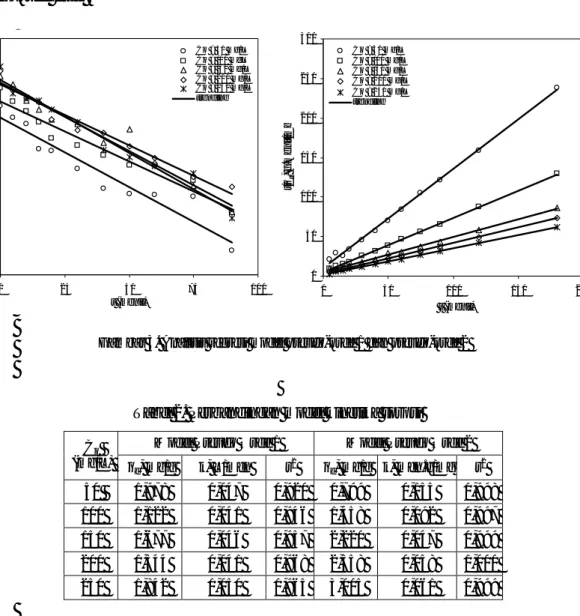
Analisis regresi linier untuk penentuan model kinetika serta nilai-nilai parameter kinetika sorpsi untuk kedua model tersebut ditampilkan pada Gambar 3. Model-model kinetika sorpsi menunjukkan perbedaan koefisien determinasi yang cukup signifikan. Koefisien determinasi model Pseudo Orde 1 adalah 0,92-0,968, suatu nilai yang cukup rendah apabila dibandingkan dengan koefisien determinasi model Pseudo Orde 2 yang berkisar antara 0,997-1,00 (Tabel 2). Sehingga dapat dikatakan bahwa kinetika sorpsi ion logam zink(II) pada partikel gambut merupakan model kinetika pseudo-orde dua.
Tabel 2. Perbandingan model kinetika sorpsi
Co
(mg/L)
Model Pseudo Orde 1 Model Pseudo Orde 2
qe, mg/g k, L/men r2 qe, mg/g k, men.g/mg r2
50 1,978 0,047 0,920 0,799 0,155 0,998 100 1,122 0,041 0,946 1,458 0,092 0,997 150 1,677 0,046 0,957 2,220 0,047 0,999 200 1,544 0,041 0,968 2,558 0,058 1,000 250 1,842 0,050 0,965 3,005 0,061 0,999
Penelitian terdahulu oleh Gosset dkk (1986), menunjukkan bahwa kinetika sorpsi seng dengan gambut merupakan model orde 2 (Ho dan McKay, 1999). Namun, sejauh ini data Gosset dkk (1989) belum pernah divalidasi dengan model-model kinetika terbaru termasuk dengan model pseudo-orde dua. Fakta menarik dilaporkan
Gambar 3. Analisis regresi model pseudo-orde 1 dan pseudo-orde 2
-6.0 -4.0 -2.0 0.0 2.0 0 25 50 75 100 t (menit) ln ( qe qt ) Co = 50 mg/L Co = 100 mgL Co = 150 mg/L Co = 200 mg/L Co = 250 mg/L trendline 0 50 100 150 200 250 300 0 50 100 150 200 t (menit) t/ qt , g .m e n it/ m g Co = 50 m g/L Co = 100 mg/L Co = 150 mg/L Co = 200 mg/L Co = 250 mg/L trendline
oleh Ho dan McKay (1999), yang melakukan validasi model kinetika sorpsi untuk berbagai jenis sorbat dan sorben yang pernah dilaporkan oleh peneliti sebelumnya. Semua sistem yang divalidasi tersebut ternyata lebih tepat direpresentasikan sebagai model pseudo-orde dua. Untuk sistem logam-gambut, temuan Ho dan McKay ini dikuatkan oleh beberapa penelitian terakhir, yang semuanya melaporkan kecocokan model pseudo-orde dua (Tabel 3).
Tabel 3. Model kinetika sorpsi untuk sistem logam-gambut
Sorbat Model kinetika (literatur)
Model kinetika
terbaru Referensi
Pb(II) Orde 2 (Ho & McKay, 1999) Pseudo-orde 2 Akinbiyi (2000); Ho & McKay (2000) Cu(II) Orde 2 (Ho & McKay, 1994; Pseudo-orde 2 Ho & McKay (2000)
Gosset dkk, 1986) Elovich Ho & McKay (2004)
Ni(II) Orde 2 (Ho dkk, 1995; Gosset dkk, 1986) Pseudo-orde 2 Ho dan McKay (2000) Zn(II) Orde 2 (Gosset dkk, 1986) Pseudo-orde 2 Studi ini (2012)
3. Kesimpulan
Dari hasil penelitian yang telah dilakukan dapat disimpulkan bahwa gambut tropis Indonesia memiliki kinerja yang cukup baik sebagai adsorben untuk penyisihan ion zink(II) dari larutan. Efisiensi sorpsi optimum mencapai 90,68 %, diperoleh pada konsentrasi awal 50 mg/L ion zink. Kapasitas sorpsi ion zink meningkat sesuai dengan besar konsentrasi awal zink(II), dengan kuantitas antara 0,75-2,89 mg/g. Kinetika sorpsi ion zink(II) pada partikel gambut sangat cocok dengan model pseudo-orde dua, dengan koefisien determinasi (R2) antara 0,997-1,0. Nilai konstanta kinetika sorpsi, k adalah 0,47-0,155 g.menit/mg, dan kapasitas sorpsi kesetimbangan, qe adalah 0,8-3,01 mg/g.
4. Daftar Pustaka
Akinbiyi, A. (2000), Removal of Lead from Aqueous Solutions by Adsorption Using Peat Moss, Thesis, University of Regina, Canada, 26-63.
APHA (1998), Standard Methods for Examination of Water and Waste Water, 4th edition, American Public Health Association, Washington DC.
Brown, P.A, Gill, S.A, dan Allen, S.J. (2000), Metal removal from wastewater using peat, Water
Research, 34(16), 3907-3916.
Gosset, T, Trancart, J.L, dan Thevenot D.R, (1986), Batch metal removal by peat kinetics ad thermodynamics, Water Research, 20(1), 21-26.
Ho, Y.S, John Wase, D.A, Forster, C.F. (1995), Batch nickel removal from aqueous solution by sphagnum moss peat, Water Research, 29(5), 1327-1332.
Ho, Y.S, McKay, G. (2004), Sorption of copper(II) from aqueous solution by peat, Water, Air, and Soil
Pollution, 158, 77-97.
Ho, Y.S., McKay, G. (1999), Pseudo-second order model for sorption process, Process Biochemistry, 34, 451-465.
Leslie, M.D. (1974), Peat: New medium for treating dye house effluent, American Dyestuff Reporter, 63(8), pp. 15-18.
Munawar, (2009), Penggunaan gambut oligotropik sebagai adsorben untuk penyisihan ion zink(II), Jurnal
Teknologi, Vol. 9, No. 2, Oktober 2009, hal. 57-63.
Raji, C., Anirudhan, T.S. (1998), Batch Cr(VI) removal by polyacrylamide-grafted sawdust, Water
Research, 32(12), 3772-3780.
Sakadevan, K., Bavor, H.J. (1998), Phospate adsorption characteristics of soils, slags and zeolite to be used as substrate in constructed wetland systems, Water Research, 32(2), 393-399.
Zhipei, Z, Junlu, Y, Zenghui, W, Piya, C. (1984), A Preliminary Study of The Removal of Pb2+, Cd2+,Zn2+, Ni2+, Cr2+from Wastewater with Several Chinesse Peat, Proceeding of The Seventh