Uji Klinik Kegunaan dan Keamanan terapi
EXOSOME-MSC (EKSOSOM yang diproses dari SEL PUNCA MESENKIMAL) untuk meredakan hiperinflamasi pada pasien covid-19
ABSTRAK
Pada infeksi COVID-19 yang disebabkan oleh virus SARS-CoV2 terjadi Disregulasi respons sistem imun yang menyebabkan sindrom badai sitokin. SARS-CoV2 bekerja seperti pembajak (hackers), mensabotase komunikasi antar sel sehingga sistem imun seperti sel-T, membunuh bukan hanya sel terinfeksi tetapi juga sel-sel yang sehat. Disregulasi respons ini mengakibatkan hiperinflamasi yang mengakibatkan kerusakan organ tubuh, bukan hanya paru. Hal ini merupakan penyebab tingkat kematian yang tinggi pada pasien COVID-19.
Exosomes yang diusulkan sebagai pengobatan COVID-19 merupakan vesikel dengan ukuran 30-100 nanometer yang berasal dari dalam sel berfungsi untuk berkomunikasi dengan sel lainnya. Exosomes adalah kontainer transportasi yang berisi kargo bioaktif: seperti protein, material genetik, dan berbagai molekul lainnya. Kontainer ini bergerak dari sel asal, mengalir lewat pembuluh darah atau cairan tubuh lainnya menuju sel di jaringan tujuan. Begitu tiba, exosomes menembus membran sel dan bekerja pada berbagai organel di dalam sel target. Semua jenis sel dapat menghasilkan exosomes, yang membedakan satu dengan lainnya adalah jenis kargo yang terkandung di dalamnya. Exosome yang dihasilkan sel-punca mesenkimal (MSC) berisi kargo bioaktif yang berasal dari sel punca mesenkimal, seperti anti-inflamatory cytokine, growth factors, messengerRNA (mRNA) dan microRNA (miRNA). Sel yang menjadi target Exosomes-MSC adalah sel sistem imun, sel terinfeksi dan sel progenitor dari organ terinfeksi. Pada target sel imun anti-inflamatory cytokine dari Exosomes-MSC bekerja sebagai imunomodulator untuk meredakan hiperinflamasi. Pada sel terinfeksi, miRNA dari exosomes-MSC bekerja mencegah replikasi virus dengan cara menghambat (inhibit) ekspresi RNA virus SARS-COV-2 (viral mRNA silencing and degrading). Pada sel progenitor paru dan organ terinfeksi lainnya, growth factors dari exosomes-MSC bekerja menstimulasi proses sintesis protein yang berfungsi untuk regenerasi organ.
Penatalaksanaan terapi, adalah dengan melarutkan 150 mikrogram (+/- 0.1 ml) Exosomes-MSC yang telah diproses di laboratorium, dengan 5 ml NaCl setiap 1 eppendorf (kemasan Exosomes-MSC) dan disuntikkan ke pembuluh darah vena. Terapi Exosomes-MSC yang kaya growth factors dan miRNA lebih aman dibandingkan terapi sel punca. Ini karena Exosomes-MSC bukanlah sel walau dihasilkan oleh sel punca (cell-free), dan juga bukan merupakan bahan kimia. Ini menjelaskan mengapa Exosomes-MSC tidak memiliki efek samping berupa dosis toxis dan lethal; dan juga tidak menyebabkan reaksi penolakan, pembentukan tumor, maupun pembentukan emboli yang masih menjadi kendala dalam terapi sel punca. (Willis et al, 2017; Al-Sowayan, 2017; Mendt et al, 2019)
Hal ini memberi harapan bahwa terapi Exosomes-MSC berguna dan aman bukan hanya meredakan badai sitokin tetapi juga melakukan regenerasi jaringan sel paru dan organ lain yang rusak akibat infeksi COVID-19.
Kata kunci: Exosomes, Mesenchymal Stem Cells, SARS-COV-2, COVID-19, Hiperinflamasi, Badai Sitokin
BAB 1. PENDAHULUAN 1.1. Latar Belakang
Pandemi COVID-19 yang berasal dari Wuhan, Cina dengan cepat dan terus-menerus menyebar secara global dan mengakibatkan morbiditas dan mortalitas gangguan pernapasan yang serius. Agen yang bertanggung jawab adalah SARS-CoV-2 yang merupakan virus RNA yang berasal dari keluarga virus coronaviridae. Penularan dari manusia ke manusia terjadi melalui droplet dan permukaan yang terkontaminasi. Masa inkubasi rata-rata adalah 5 hari, tetapi berkisar 1-14 hari. Sebagian besar pasien datang dengan infeksi saluran pernapasan ringan, umumnya ditandai dengan demam (82%) dan batuk (81%). Pneumonia berat dan acute respiratory distress syndrome (ARDS) terdapat pada 14% dari kasus yang dilaporkan dengan mortalitas keseluruhan sekitar 2%. Namun angka-angka dapat berkembang dan berubah seiring penyebaran pandemi (Zhu N., 2019).
Beberapa penelitian pada penderita COVID-19 di Wuhan menunjukkan bahwa sebagian besar pasien mengalami ARDS (Acute respiratory distress syndrome). Kondisi yang
parah ini umumnya dikaitkan dengan adanya hiperinflamasi berat, suatu sindroma badai sitokin atau Cytokines Storm Syndrome (CSS) mungkin menjadi alasan terjadinya hiperinflamasi ini pada penyakit SARS-CoV-2 yang parah (Huang dkk. 2020; Mehta dkk., 2020). Cytokine storm syndrome (CSS) akan memicu kerusakan pada sistem kekebalan tubuh, menyebabkan ARDS dan kegagalan banyak organ, dan akhirnya bisa menyebabkan kematian (Xu Z., 2020). Huang dkk menyebutkan bahwa setelah memasuki sel virus dapat merangsang CSS yang mengerikan di paru-paru ditandai dengan peningkatan kadar interleukin (IL) -2, IL-6, IL-7, granulocyte colony stimulating factor (GSCF), interferon γ-induced protein 10 (IP10), monocyte chemoattractant protein-1 (MCP1), macrophage inflammatory protein (MIP1A) dan tumor necrosis factor-alpha (TNF-α) (Huang C., 2020). Terjadinya CSS telah dibuktikan pada banyak pasien dengan pneumonia COVID-19. Data patologis pada pneumonia yang disebabkan oleh COVID-19 yang dikumpulkan dari otopsi atau biopsi tampaknya mengkonfirmasi hipotesis ini (Wuang D.,2020; Tian S.,2020).
Hingga saat ini tidak ada pengobatan anti-virus khusus yang direkomendasikan untuk COVID-19. Penggunaan vaksin saat ini belum tersedia, pemberian antibakteri juga tidak efektif. Strategi pengobatan hanya bersifat supportif dan pemberian terapi oksigen merupakan intervensi pengobatan utama untuk pasien dengan pneumonia berat. Ventilasi mekanis diperlukan dalam kasus-kasus kegagalan pernapasan (Bari.,2019). FDA baru-baru ini menyetujui penggunaan hydroxychloroquine pada pasien COVID-19 tetapi kemanjurannya masih harus ditentukan. Informasi yang berkembang juga menunjukkan bahwa badai sitokin yang diinduksi oleh virus di paru-paru dapat mendorong inflamasi yang parah dan memberikan target terapi yang potensial, misalnya pendekatan anti-IL6 atau anti-IL-1 (Mehta P.,2020). Kunci untuk menyelamatkan pasien dengan pneumonia COVID-19 yang parah selain menghambat replikasi virus adalah mencegah dan membalikkan badai sitokin. Penggunaan kortikosteroid sistemik tampaknya efektif tetapi dapat mengurangi aktivitas sistem kekebalan tubuh dan mengurangi kemampuannya untuk melawan infeksi. Baru-baru ini Badan Obat Italia atau Agenzia Italiana del Farmaco (AIFA) meluncurkan uji klinis penggunaan tocilizumab, antibody monoklonal terhadap IL-6 untuk pasien covid-19. Namun kapasitas imunomodulator mungkin tidak cukup kuat karena hanya beberapa faktor kekebalan yang digunakan (Bari.,2019).
Akhir-akhir ini semakin banyak penelitian klinis terapi berbasis sel terutama yang melibatkan sel punca mesenkimal (MSC) baik yang memanfaatkan media terkondisi yang dihasilkan (MSC-CM) atau vesikel ekstraseluler (VE) dan beberapa jenis sel lainnya yang telah
diinisiasi di Tiongkok untuk penyakit pernapasan COVID-19. Data pra-klinis baru-baru ini dalam model infeksi virus pernapasan dan studi klinis terkait yang relevan dari pemberian MSC pada pasien dengan ARDS dapat berkontribusi baik (Khouri M dkk.,2020). Penggunaan MSC sendiri menarik perhatian khusus karena efek farmakologisnya yang luas, termasuk sifat anti-inflamasi, imunomodulator, regeneratif, pro-angiogenik, dan anti-fibrotik (Coutinho.,2011; Bari.,2019).
Penelitian yang dilakukan Liang dkk menunjukkan MSC yang berasal dari tali pusar manusia secara efektif memodulasi respon imun dan memperbaiki jaringan yang terluka dari pasien COVID-19 wanita 65 tahun yang sakit kritis dengan keamanan yang sangat baik. Peneliti menggunakan MSC secara intravena sebanyak tiga kali (5 × 107 sel setiap kali pemberian) setiap tiga hari. Setelah pemberian kedua, terdapat perbaikan tanda-tanda vital dan penurunan serum bilirubin, C-reactive protein (CRP) dan kadar alanine transaminase/aspartate transaminase (ALT/AST) secara bertahap (Bing,L., 2020). Penelitian lain oleh Leng dkk menunjukkan bahwa transplantasi MSC secara signifikan memperbaiki gejala dan fungsi paru pada tujuh pasien yang terdaftar dengan COVID-19 pneumonia dalam waktu dua hari. Pada penelitian tersebut mereka menggunakan 1 × 106 sel per kilogram berat badan diberikan hanya satu kali. Leng dkk menunjukkan bahwa efektifitas terapeutik MSC diperantarai oleh fungsi imunomodulasinya (Leng.,2020).
Biakan sel punca mesenkim (MSC) akan mensekresi faktor parakrin seperti growth factor, kemokin, dan sitokin dalam jumlah yang tidak banyak. Penelitian terkini menyebutkan bahwa sel punca juga mampu mensekresikan vesikel ekstraseluler berukuran nano yang memiliki aktivitas biologis sama dengan sel punca. Vesikel ekstraseluler terdiri atas tiga tipe utama yaitu eksosom, shedding microvesicles, dan badan apoptosis (Yu dkk., 2014; Tan dkk., 2014). Eksosom telah berhasil diisolasi dari supernatan beberapa tipe sel kultur seperti sel punca mesenkimal, sel dendritik, dan sel punca hematopoietik. Eksosom yang diproduksi oleh sel tunggal dapat memiliki vesikel heterogen dengan berbagai marker dan potensi biologis. (Koniusz dkk., 2016; Marote dkk., 2016). Setelah dilepaskan vesikel ekstraseluler dan protein larut berinteraksi dengan sel target (melalui interaksi reseptor ligan atau dengan internalisasi) dan memodulasi respons seluler (Di rocco.,2016).
Eksosom sel punca mesenkimal sebagai material bioaktif yang dibentuk oleh sel punca dilaporkan memiliki kemampuan imunomodulasi yang sama dengan sel punca itu sendiri. Berbagai studi melaporkan bahwa eksosom berperan penting dalam modulasi respon imun. Berbagai studi pada hewan model hiperinflamasi telah dilakukan untuk menganalisis efek
imunomodulator eksosom sel punca mesenkimal (Yanez-Mo dkk., 2015). Dari berbagai studi tersebut dapat dirangkum bahwa eksosom sel punca mesenkimal mampu menurunkan regulasi IL-7, tumor necrosis factor (TNF-α), sel T sitotoksik, meningkatkan regulasi sitokin anti-inflamasi IL-10, Il-4, TGF-β, dan sel Treg, serta mengatur polarisasi fenotip sel makrofag menjadi sel makrofag anti-inflamasi (M2) (Goodwin et al., dkk; Zhu dkk., 2017, Wang dkk., 2016). Leng dkk melaporkan bahwa transplantasi eksosom sel punca mesenkimal melalui miRNA mampu meningkatkan keberhasilan terapi pada pasien pneumonia akibat corona virus melalui efek penghambatan transkripsi virus dan immunomodulasi dengan menurunkan TNF-α, C-reactive protein (CRP), sel T CXCR3+CD4+, sel TCXCR3+CD8+, dan CXCR3+NK, serta peningkatan IL-10 (Leng dkk., 2019).
Penelitian ini merupakan uji klinis yang dirancang untuk menguji kegunaan dan keamanan terapi eksosom intravena pada pasien COVID-19 dengan kondisi hiperinflamasi. Pada penelitian ini akan dilakukan evaluasi profil-profil penanda hiperinflamasi sebelum dan sesudah pemberian injeksi eksosom intravena.
1.1.1. Rumusan masalah pada penelitian ini adalah:
1. Apakah ada kegunaan terapi injeksi eksosom intravena pada pasien COVID-19 dengan kondisi hiperinflamasi?
1.2. Tujuan penelitian
Mengacu pada Skema Program Riset dan Pengembangan (TKT1-6) Konsorsium COVID-19 Kemenristek BRIN.
1.2.1. Tujuan umum:
1. Menganalisis kegunaan pemberian injeksi eksosom intravena pada pasien COVID-19 dengan kondisi hiperinflamasi
1.2.2. Tujuan khusus:
1. Menganalisis pengaruh pemberian injeksi eksosom intravena terhadap profil CRP pada pasien COVID-19 dengan kondisi hiperinflamasi
2. Menganalisis pengaruh pemberian injeksi eksosom intravena terhadap profil procalcitonin pada pasien COVID-19 dengan kondisi hiperinflamasi
3. Menganalisis pengaruh pemberian injeksi eksosom intravena terhadap profil ferritin pada pasien COVID-19 dengan kondisi hiperinflamasi
4. Menganalisis pengaruh pemberian injeksi eksosom intravena terhadap SOFA score pada pasien COVID-19 dengan kondisi hiperinflamasi
5. Menganalisis pengaruh pemberian injeksi eksosom intravena terhadap kadar LDH pada pasien COVID-19 dengan kondisi hiperinflamasi
6. Menganalisis pengaruh pemberian injeksi eksosom intravena terhadap kadar D-dimer pada pasien COVID-19 dengan kondisi hiperinflamasi
7. Menganalisis pengaruh pemberian injeksi eksosom intravena terhadap kadar fibrinogen pada pasien COVID-19 dengan kondisi hiperinflamasi
8. Menganalisis pengaruh pemberian injeksi eksosom intravena terhadap rasio limfosit netrofil pada pasien COVID-19 dengan kondisi hiperinflamasi
9. Menganalisis pengaruh pemberian injeksi eksosom intravena terhadap gambaran CT scan paru pada pasien COVID-19 dengan kondisi hiperinflamasi
1.3. Manfaat penelitian
Berdasarkan Skema Program Riset dan Pengembangan (TKT1-6), penelitian ini diharapkan dapat menjadi dasar pengembangan produk biologis, yaitu eksosome, yang diproses dari mesenchymal stem cell yang dapat menjadi alternative terapi untuk mengatasi kondisi hiperinflamasi akibat COVID-19. Apabila lulus uji klinis, produk eksosom ini diharapkan dapat diproduksi dalam skala besar farmasi. Aplikasi produk eksosom ini diharapkan bermanfaat meningkatkan survival rate pasien COVID-19 dengan hiperinflamasi. Apabila hasil dari penelitian ini sesuai dengan hipotesis, maka pemberian Exosomes-MSC secara injeksi intravena dapat diusulkan untuk terapi standar pada penderita COVID-19 di semua rumah sakit di Indonesia.
BAB 2. LANDASAN TEORI 2.1. TINJAUAN PUSTAKA
2.1.1. Patogenesis COVID-19
Sindrom pernafasan akut parah - Coronavirus-2 (SARS-CoV-2) yang menyebabkan penyakit coronavirus-2019 (COVID-19) pertama kali dilaporkan sebagai gejala yang menyerupai pneumonia di kota Wuhan Cina pada akhir 2019 (Zhou et al., 2020a). Penyebaran awal virus dari manusia ke manusia dicatat dalam penyelidikan epidemiologis pada 20 Januari 2020, di mana dua pasien terdeteksi COVID-19 positif di provinsi Guangdong dan tidak memiliki riwayat kunjungan pribadi ke Wuhan sbelumnya (Chan et al., 2020a). Selanjutnya asumsi penularan dari manusia ke manusia diperkuat oleh laporan COVID-19 pada 14 staf rumah sakit dari pasien (Wang et al., 2020a). Sejak itu SARS-CoV-2 telah mempengaruhi 287.239 orang dan menjangkiti lebih dari 11.921 pasien manusia. Meskipun saat ini case fatality rate (CFR) dalam wabah COVID-19 dibawah wabah SARS dan MERS (Mahase., 2020a), peningkatan tajam dalam CFR telah diamati selama beberapa minggu terakhir yang mencapai 4 % hingga akibatnya COVID-19 dikatakan memasuki tahap pandemi (Dhama et al., 2020a; WHO, 2020a; Yang et al., 2020).
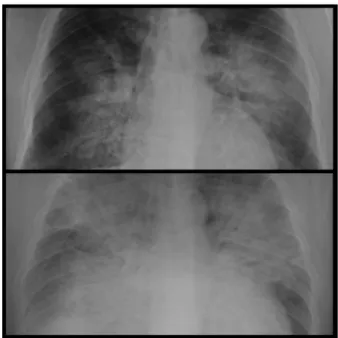
Patogenesis COVID-19 melibatkan gejala dari saluran pernafasan dari ringan hingga berat (Chan et Al. 2020a; Zhu et al. 2020a) dengan masa inkubasi (Guan et al. 2020) mulai dari 1 hingga 14 hari (Kritas et al., 2020). Pneumonia berat sebagian besar bilateral kadang-kadang unilateral, sehingga gagal nafas adalah penyebab utama kematian pada infeksi SARS-CoV-2 (Sun et al., 2020). Gagal nafas pada COVID-19 yang parah umumnya dikaitkan dengan hiperinflamasi. Suatu sindrom CSS atau Cytokines Storm Syndrome (CSS) mungkin menjadi alasan terjadinya hiperinflamasi pada penyakit SARS-CoV-2 yang parah (Huang et al. 2020; Mehta et al., 2020). Pada gambaran foto thoraks tampak gross lessions berupa bintik-bintik dalam jumlah banyak di lapangan paru, ground-glass opacity, pneumotoraks, konsolidasi lobular dan subsegmental bilateral dan kegagalan organ multipel seperti yang telah dilaporkan pada pasien COVID-19 (Chan et al.2020a; Chen et al. 2020a; Huang et al. 2020).
Laporan menunjukkan ARDS adalah penyebab utama kematian COVID-19. Dari 41 pasien yang terinfeksi SARS-CoV-2 yang dirawat di tahap awal wabah, enam meninggal karena ARDS (Huang C., 2020). ARDS adalah peristiwa imunopatologis yang umum untuk infeksi SARS-CoV-2, SARS-CoV, dan MERS-CoV (Xu Z., 2020). Salah satu mekanisme utama ARDS adalah badai sitokin atau CSS, respons inflamasi sistemik mematikan yang tidak
terkendali yang dihasilkan dari pelepasan sejumlah besar sitokin pro-inflamasi (IFN-a, IFN-g, IL-1b, IL-6, IL-12 , IL-18 IL-33, TNF-a, TGFb, dll.) dan kemokin (CCL2, CCL3, CCL5, CXCL8, CXCL9, CXCL10, dll.) Oleh sel-sel efektor imun pada infeksi SARS-CoV (Huang C., 2020).
Gambar 2. Gambaran pneumonia berat pada COVID-19.
Mirip dengan orang-orang dengan SARS-CoV, orang-orang dengan infeksi MERS-CoV yang parah menunjukkan peningkatan kadar IL-6, IFN-a, dan CCL5, CXCL8, CXCL-10 dalam serum dibandingkan dengan mereka dengan penyakit mildmoderate (Min CK., 2016I. Cytokine storm syndrome akan memicu kerusakan pada sistem kekebalan tubuh, menyebabkan ARDS dan kegagalan banyak organ, dan akhirnya menyebabkan kematian pada kasus infeksi SARS-CoV-2 yang parah, seperti yang terjadi pada SARS-CoV dan MERS- Infeksi CoV (Xu Z., 2020).
Pada tingkat molekuler, baik mekanisme imun seluler maupun humoral diyakini bertanggung jawab atas patogenesis ini (Ahmed et al. 2020; Tetro 2020). Selain respon langsung dari makrofag dan stimulasi limfosit, mekanisme imunologis yang diperantarai sel T dan B juga diprakarsai untuk melawan SARS-CoV-2 (Ahmed et al. 2020; Tetro 2020; Walls et al. 2020). Hal itu termasuk deteksi dan presentasi antigen dan aktivasi sel B (Ahmed et al. 2020; Liu et al. 2020a; Tetro 2020; Walls et al. 2020). Keterlibatan sel helper dan T-sitotoksik juga mungkin berpengaruh pada mekanisme ini. Namun, peran respon seluler ini perlu dievaluasi lebih lanjut, sel T sitotoksik dapat membunuh virus secara langsung, sedangkan sel T-helper menyajikannya ke sel B untuk produksi dan netralisasi imunoglobulin
(Ahmed et al. 2020; Huang et al. 2020). SARS-CoV-2 menyerang sel epitel mukosa saluran pernapasan dan menyebar ke sel lain, menginfeksi sel darah putih perifer dan sel imun, terutama limfosit T (Chen et al. 2020a).
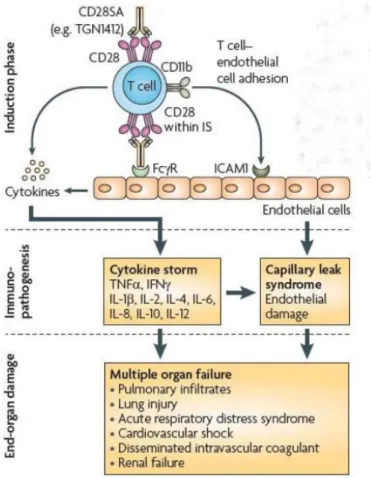
Gambar 3. Reseptor permukaan pada sel T dapat menyebabkan CSS ketika diaktifkan. Pengikatan silang CD28 manusia dapat berkontribusi pada pembentukan sinaps imunologis teraktivasi (IS) pada permukaan sel T, dan pengikatan CD28SA ke reseptor Fc (FcR) pada sel endotel dan leukosit lainnya dapat menyebabkan pelepasan sitokin lebih lanjut. Aktivasi CD28 juga dapat menyebabkan regulasi molekul adhesi seperti CD11b pada permukaan sel T atau sel lain dari sistem kekebalan tubuh bawaan, yang kemudian dapat mengikat molekul adhesi intraseluler 1 (ICAM1) pada sel endotel. Kompleks sel-endotel T memiliki kapasitas untuk menyebabkan produksi sitokin yang diperkuat dan kerusakan endotel lokal. Oleh karena itu, CSS dan infiltrasi neutrofil dapat memediasi sindrom kebocoran kapiler dengan kegagalan organ multipel.
Peningkatan kadar sitokin proinflamasi dan penurunan sitokin antiinflamasi mengindikasikan respons yang dimediasi sel T terhadap SARS-CoV-2 dan menghasilkan CSS
yang menyebabkan peradangan berlebihan yang mengarah ke pneumonia berat pada COVID-19 (Chen et Al. 2020a; Huang et al. 2020; Liu et al. 2020a). Satu set sel B dan epitop sel T telah diidentifikasi dalam protein struktural imunogenik dari SARS-CoV-2 yang lebih lanjut menunjukkan respons seluler terhadap patogen (Ahmed et al. 2020).
Respons imun humoral juga mungkin berperan dalam patogenesis COVID-19 (Ahmed et al. 2020; Giwa dan Desai, 2020). Adanya penurunan kadar imunoglobulin pada COVID-19 dapat menunjukkan efek pada sel limfosit B yang memproduksi antibodi (Chen et al.2020a). Meskipun antigen dari SARS-CoV-2 telah menunjukkan potensi untuk merangsang produksi antibodi, efek dari limfopenia keseluruhan mungkin telah menyebabkan deplesi immunoglobulin (Chen et al. 2020a; Wrapp et al. 2020). Antibodi yang dikembangkan terhadap SARS-CoV-2, khususnya antibodi anti-spike protein, mungkin bertanggung jawab atas infeksi sel-sel kekebalan tubuh (Tetro 2020). Antibody-dependent enhancement (ADE) yang membutuhkan pra-paparan epitop antigenik serupa coronavirus, mungkin bertanggung jawab atas keparahan penyakit yang menyebabkan cedera pernapasan akut, sindrom gangguan pernapasan akut, dan gejala sekuele lain termasuk defisiensi imun seluler, aktivasi koagulasi, cedera miokardium, cedera hati dan ginjal, dan infeksi bakteri sekunder (Tetro 2020).
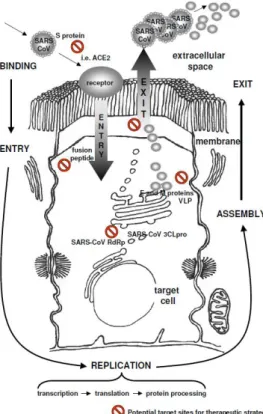
Gambar 4. Area potensial target untuk terapi SARS-COV mulai dari virus masuk, berkembang biak. Dari siklus hidup virus tersebut, ada beberapa target potensial untuk pengembangan terapi antivirus. Mulai dari pengikatan virus ke sel target, protein spike atau reseptor seperti
angiotension-converting enzyme 2 (ACE2), entri sel atau langkah replikasi yang berbeda dapat ditargetkan.
Sebagian besar mekanisme molekuler dari patogenesis infeksi SARS-CoV-2 dijelaskan dengan langkah yang cepat untuk memahami penyakit dan mengembangkan tindakan pencegahan (Giwa dan Desai, 2020; Tetro 2020; Walls et al. 2020; Wrapps et al. 2020). Padahal kemajuan mengenai patogenesis SARS-CoV-2 ini terbatas dan sebagian besar kesimpulan diambil dari coronavirus yang lain, terutama SARS-CoV dan MERS-CoV (Chen 2020; Chenet al. 2020b). Antibody-dependent enhancement (ADE) SARS-CoV-2 diasumsikan sebagai mekanisme patogenesis yang signifikan mengakibatkan peradangan berkelanjutan, limfopenia, dan CSS pada kasus yang parah (Tetro 2020).
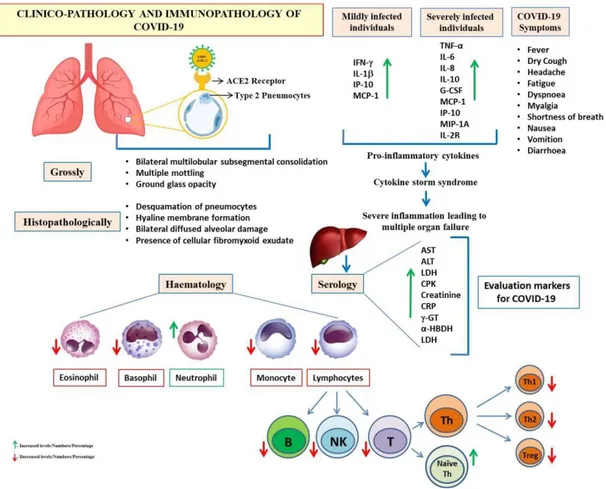
Gambar 5. Imunopatologi dan patologi klinis coronavirus-2019 (COVID-19)
Struktur protein SARS-CoV-2 'S' secara keseluruhan menyerupai struktur SARS-CoV 'S', dengan akar kuadrat deviasi (RMSD) 3,8 Å lebih dari 959 atom Cα (Wrapp et al. 2020). Protein spike (S) membantu SARS-CoV-2 dalam mengikat dan masuk ke dalam sel (Letko dan
Munster, 2020; Lu et al. 2020;Walls et al. 2020). Subunit S1 dari glikoprotein S memungkinkan ikatan yang kuat dengan reseptor ACE2 sedangkan Subunit S2 memastikan fusi dengan sel inang (Coutard et al. 2020; Hoffmann et al. 2020; Wan et al.2020). Saluran pernapasan sel inang dan sel-sel epitel saluran pencernaan dapat terkena (Liu et al. 2020a; Rothan dan Byylvdy 2020). Secara umum, sel-sel epitel pernapasan (pneumosit) dan sel-sel enterik (enterosit) yang terinfeksi oleh CoV menyebabkan perubahan sitopatik (Habibzadeh dan Stoneman 2020). Pneumosit tipe 2 dan sel-sel epitel bronkial tidak bersilia adalah target utama dari virus ini (Habibzadeh dan Stoneman 2020; Walls et al. 2020). Virus ini menyebakan efek sitopatik pada sel epitel pernapasan dan penghentian mekanisme cilium beating dari sel (Liu et al. 2020a; Zhu et al. 2020a). Padahal CSS diyakini bertanggung jawab atas patogenesis ini meskipun sebenarnya mekanisme patogenik belum dapat dijelaskan.
2.1.2. Sekretom sel punca mesenkimal
Selama beberapa tahun terakhir, sel punca telah muncul sebagai salah satu terapi yang manjur untuk meningkatkan penyembuhan luka (Hu et al., 2018). Sel punca mesenkimal merupakan populasi sel progenitor dari garis keturunan mesoderm yang telah terbukti menjadi mediator yang signifikan dalam lingkungan inflamasi. Studi praklinis sel punca mesenkimal dalam berbagai model penyembuhan luka hewan menunjukkan terapi putatif. Sel punca menawarkan potensi besar untuk meningkatkan perbaikan jaringan dan regenerasi setelah cedera. Bidang biologi sel punca yang berkembang pesat dan rekayasa jaringan kulit telah menciptakan peluang translasi untuk pengembangan terapi penyembuhan luka berbasis sel punca yang menunjukkan hasil yang menjanjikan dalam uji klinis dan praklinis untuk pengobatan luka kronis (Isakson et al., 2015).
Sel punca mesenkimal/mesenchymal stem cell (MSC) memainkan beberapa peran yang berkesinambungan, antara lain: membatasi peradangan melalui pelepasan sitokin; membantu penyembuhan dengan mengekspresikan faktor pertumbuhan; mengubah respon imun pejamu dengan mensekresikan protein immunomodulator; meningkatkan respons dari sel-sel perbaikan endogen dan berfungsi dalam pematangan sel-sel fungsional di beberapa jaringan seperti tulang Mekanisme ini tidak berdiri sendiri dan karena itu telah diketahui bahwa efek terapi MSC tergantung patofisiologi penyakit (Scripps and Jolla, 2017).
Sel punca mesenkimal mensekresikan faktor proangiogenik dan faktor yang mendorong penyembuhan luka seperti TGF-β, VEGF, PDGF, IGF-1 dan interleukin IL-6 and IL-8 (Choi et al. 2013). Efek parakrin ini tampaknya bertanggung jawab atas efek
penyembuhan luka dari sel punca mesenkimal (Shohara et al. 2012). Dalam kondisi in-vitro, molekul-molekul ini dapat ditelusuri dalam medium terkondisi atau media yang digunakan untuk memanen sel. Saat ini, media terkondisi ini berfungsi sebagai modalitas pengobatan baru dalam pengobatan regeneratif dan telah menunjukkan hasil yang sukses dalam beberapa penyakit. Hal ini telah mendorong para ilmuwan untuk menggunakan media terkondisi dalam penyembuhan luka dengan memodulasi perbaikan luka tanpa sel-sel induk yang ada di dalam luka (Bich et al. 2016).
Gambar 6. Mesenchymal stem cell memainkan banyak peran. Mereka dapat berdiferensiasi menjadi beberapa garis keturunan dan dapat berpartisipasi dalam terapi penggantian sel terorganisir tetapi terapi engraftment pada in vivo tetap rendah. Namun, MSC menghasilkan banyak sitokin dan faktor pertumbuhan yang memengaruhi sel-sel lain yang menghasilkan penurunan peradangan, peningkatan proliferasi sel progenitor, peningkatan perbaikan jaringan dan penurunan infeksi. MSC juga telah terbukti menyumbangkan mitokondria melalui tunneling nanotube ke sel-sel yang rusak. MSC membrane bound packets — mikrovesikel (> 200 mm) dan eksosom (50–200 mm) —yang mengandung sitokin/faktor pertumbuhan/RNA/miRNA dalam berbagai kombinasi. Vesikel ini telah menunjukkan hasil yang sangat mirip dengan transplantasi MSC dalam banyak kasus, sehingga dapat menghindari banyak risiko yang terkait dengan transplantasi sel. Namun, masih ada banyak tugas penting sebelum terapi vesikel turunan MSC dapat digunakan secara klinis antara lain produksi terstandarisasi, karakterisasi vesikel, meningkatkan isolasi dan optimalisasi hasil, reproduksibilitas, pengujian potensi, menentukan dosis untuk indikasi klinis tertentu dan
produksi terstandar — semua mirip dengan parameter yang dibutuhkan dalam terapi menggunakan sel MSC.
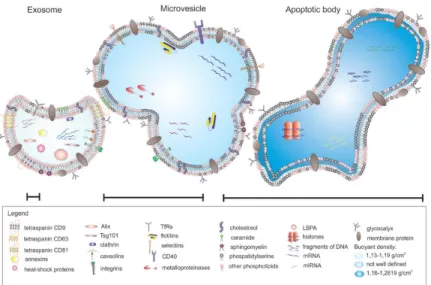
Medium terkondisi/sekretom merupakan kumpulan molekul yang disekresikan ke ruang ekstraseluler, yang terdiri dari protein larut, asam nukleat bebas, lipid dan vesikel ekstraseluler. Vesikel ekstraseluler ini terdiri dari badan-badan apoptosis, mikropartikel dan eksosom, yang dapat dibedakan berdasarkan ukuran, komposisi dan asal dalam sel (Gyo¨rgy et al. 2011; Lotvall 2014; Beer et al. 2017).
Media terkondisi merupakan media dimana sel punca dikultur. Media terkondisi memiliki beberapa keuntungan dibandingkan sel punca sendiri, yakni media tersebut lebih mudah diproduksi, dikemas dan dibawa, serta media tidak mengandung sel sehingga tidak perlu mencocokkan donor dengan resipien untuk mencegah penolakan. Terdapat berbagai faktor pertumbuhan yang terkandung dalam media terkondisi seperti: VEGF, PDGF, HGF, bFGF, EGF, IGF-I, IGF-II, keratinocyte growth factor (KGF). Sebagian besar faktor pertumbuhan tersebut meningkat dalam keadaan hipoksia, sehingga media kultur sel punca tersebut dikondisikan dalam kondisi konsentrasi oksigen rendah (Pawitan 2014).
2.1.3. Eksosom (vesikel ekstraseluler) sel punca mesenkimal
Uji klinis sel punca telah banyak dilakukan pada beberapa kelainan seperti infark myocard, neoplasma, kelainan kongenital, penyakit autoimun, dan penyembuhan luka. Fase awal uji klinis sel punca menunjukkan bahwa terapi ini bersifat aman, dapat dijangkau, dan memiliki efikasi yang tinggi terutama pada infark myocard, stroke iskemia, iskemia perifer, dan kanker. Terapi berbasis sel punca memiliki beberapa kelemahan diantaranya instabilitas genetik berkaitan dengan cell senescence, rejeksi, tingkat survival sel yang rendah, dan sel yang tidak fungsional. Permasalahan utama dalam transplantasi sel punca adalah potensi transformasi keganasan sel punca. Manipulasi genetik sel punca selama pembiakkan di laboratorium meningkatkan potensi onkogenik sel. Berbagai uji klinis menunjukkan bahwa potensi sel punca dalam meregenerasi jaringan jangka panjang tidak dimediasi oleh survival dan atau diferensiasi sel punca, melainkan oleh faktor parakrin yang disekresikan oleh sel punca.
Biakan sel punca akan mensekresi faktor parakrin seperti growth factor, kemokin, dan sitokin dalam jumlah yang tidak banyak. Penelitian terkini menyebutkan bahwa sel punca juga mampu mensekresikan vesikel ekstraseluler yang memiliki aktivitas biologis sama dengan sel
punca. Vesikel ekstraseluler terdiri atas tiga tipe utama yaitu eksosom, shedding microvesicles, dan badan apoptosis. Eksosom terbentuk melalui jalur endositik dan disekresikan oleh mekanisme eksositosis yang dipengaruhi oleh aktivitas sitoskeleton. Eksosom diproduksi oleh badan mikrovesikel melalui invaginasi membrane endosomal. Fusi antara membran endosomal dengan membran plasma selanjutnya akan melepaskan vesikel intraluminal berupa eksosom menuju lingkungan ekstraseluler. Eksosom memiliki diameter 40-100nm dengan densitas 1.13 – 1.19 g/mL dalam cairan sukrosa dan dapat mengalami sedimentasi melalui sentrifugasi pada kecepatan 100,000g. Membran eksosom tersusun atas elemen lipid seperti GM1 gangliosides, reseptor transferrin, annexins, tetraspanins (CD63, CD81, dan CD9), serta heat shock proteins (Hsp60, Hsp70, Hsp90). Eksosom mengandung kolesterol, lipid, ceramide, sphingomyelin, phosphatidilserin, dan asam nukleat seperti mRNA dan miRNA (Yu et al., 2014; Tan et al., 2014)
Gambar 7. Tipe vesikel ekstraseluler: eksosom, mikrovesikel, badan apoptotic (Koniusz et al., 2016).
Mikrovesikel memiliki ukuran 100nm hingga 1um. Pelepasan mikrovesikel diinisiasi oleh pelepasan vesikel dari membran plasma yang dipengaruhi oleh reorganisasi sitoskeleton dan influx kalsium. Pelepasan mikrovesikel dapat terjadi pada semua tipe sel dalam fase quiescent maupun fase teraktivasi oleh faktor stress oksidatif, dan hipoksia. Mikrovesikel berperan dalam memfasilitasi interaksi antara sel target dan informasi genetik sepersi mRNA. Mikrovesikel mempengaruhi sel target melalui perubahan ekspresi gen. Mikrovesikel tidak mengekspresikan protein yang dihasilkan melalui jalur endositik. Badan apoptosis merupakan salah satu jenis vesikel ekstraseluler yang dilepaskan oleh sel yang mengalami apoptosis.
Badan apoptosis ini berbentuk ireguler dan mengandung material nukleus, organella seluler, dan membran (Yu et al., 2014; Koniusz et al., 2016).
2.1.3.1. Eksosom sel punca mesenkimal
Eksosom telah berhasil diisolasi dari supernatant beberapa tipe sel kultur seperti sel punca mesenkimal, sel dendritik, dan sel punca hematopoietik. Eksosom yang diproduksi oleh sel tunggal dapat memiliki vesikel heterogen dengan berbagai marker dan potensi biologis. Eksosom dapat menjadi material nano alamiah untuk strategi terapi berkaitan dengan sifat heterogenisitas dan stabilitas sifat fisik dan kimiawi eksosom. Eksosom dilepaskan ke lingkungan ekstraseluler akan berinteraksi dengan sel target melalui interaksi reseptor lipid-ligand. Adhesi akan diikuti dengan internalisasi eksosom melalui mekanisme endositik atau fusi vesikel dan membran secara langsung yang akan menyebabkan pelepasan isi eksosom ke dalam sel target. Interaksi antara eksosom-sel target mengakibatkan modulasi fisiologi sel target yang diinduksi melalui beberapa jalur. Interaksi ini melibatkan proses fisiologi seperti presentasi antigen, transfer RNA, dan perbaikan jaringan. Membran berlapis ganda pada eksosom berperan dalam menjaga dan mengendalikan lingkungan mikro internal, sehingga memfasilitasi eksosom untuk dialirkan pada jaringan yang jauh tanpa mengalami degradasi (Koniusz et al., 2016; Marote et al., 2016).
Gambar 8. Skema mekanisme komunikasi interseluler yang dimediasi eksosom. Stimulasi sel punca mesenkimal secara fisik / mekanik akan memicu sekresi eksosom. (a) eksosom
dilepaskan oleh sel menuju sel target, (b) eksosom menstimulasi sel target secara langsung melalui reseptor membran, (c) eksosom mempengaruhi informasi genetic melalui transfer DNA, mRNA, miRNA, atau faktor transkripsi untuk menginduksi perubahan fungsional sel target (Tan et al., 2014).
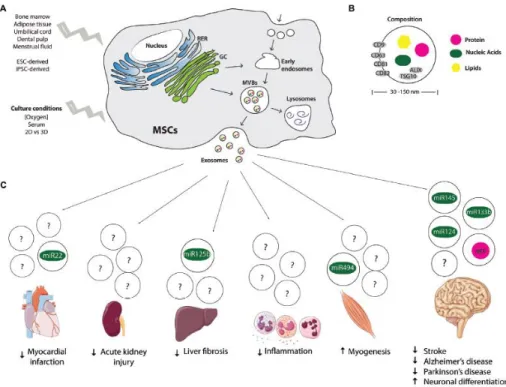
Penelitian menyebutkan bahwa sel punca mesenkimal mampu memproduksi eksosom dalam jumlah lebih banyak dibandingkan dengan sel myoblast dan embryonic kidney cell line. Eksosom tersusun atas berbagai molekul seperti protein, lipid, dan asam nukleat. Protein tersekresi berperan dalam komunikasi interseluler, sinyal sel, diferensiasi, adhesi sel, angiogenesis, dan apoptosis. Sitokin, kemokin, growth factors, dan matriks ekstraseluler didapatkan dalam sekretom sel punca mesenkimal. Eksosom sel punca mesenkimal mengekspresikan penanda permukaan seperti CD9, CD81, CD29, CD44, CD73, CD109, CD151, CD248, CD276, dan reseptor permukaan PDGF-RB, serta EGFR yang berperan dalam regulasi proliferasi dan diferensiasi sel punca mesenkimal (Tan et al., 2014).
Gambar 9. Sel punca sumber eksosom dan potensi aplikasi (Marote et al., 2016).
Kim et al (2012) berhasil melakukan identifikasi 730 protein dari eksosom sel punca mesenkimal sumsum tulang melalui analisis proteomik menggunakan mass spectrometry. Lai et al (2012) berhasil mengidentifikasi 857 protein dari eksosom sel punca embrionik. Sebanyak 350 protein yang sama diidentifikasi dari penelitian Kim et al (2012) dan Liu et al (2012). Eksosom yang diisolasi dari media terkondisi sel punca mesenkimal tidak konstan berkaitan
dengan heterogenesitas sel punca mesenkimal. Variasi dalam preparasi sel berpengaruh terhadap eksosom yang diproduksi oleh sel punca mesenkimal. Penelitian menyebutkan bahwa eksosom yang diisolasi dari media terkondisi kultur sel bersifat lebih homogen dibandingkan dengan eksosom dari sumber lain. Kapasitas fungsional eksosom ditentukan oleh sumber sel mesenkimal. Studi invitro menunjukkan eksosom sel punca mesenkimal yang berasal dari darah menstruasi dan sumsum tulang mampu meningkatkan proliferasi sel saraf kortikal dan akson. Di lain pihak, eksosom sel punca mesenkimal yang berasal dari chorion menyebabkan penurunan jumlah sel neuron (Vishnubhatla et al., 2014).
Fungsi eksosom terutama diperankan oleh protein dan RNA. Sebagian besar miRNA yang terdapat dalam eksosom sel punca mesenkimal berupa perkusor. Sel punca mesenkimal mampu mengubah aktivitas biologi sel target melalui sekresi miRNA dalam eksosom. Pemberian eksosom sel punca mesenkimal pada sel neuron dan astrosit menunjukkan peningkatan miR-133b pada sel target yang memicu perbaikan fungsional pada Parkinson dan cedera spinal cord. Penelitian tersebut menunjukkan bahwa eksosom sel punca mesenkimal mampu mengatur regulasi pertumbuhan sel neurit melalui pelepasan miRNA dalam eksosom pada sel neuron dan astrosit (Vishnubhatla et al., 2014; Marote et al., 2016).
2.1.3.2. Komposisi eksosom
Eksosom tersusun atas membran, lapisan lipid, protein, dan komponen kargo. Membran eksosom berperan penting dalam menginduksi jalur molekuler yang akan diinisiasi oleh eksosom pada sel target. Lapisan lipid berperan dalam endositosis, adhesi sel, dan internalisasi membran. Lapisan lipid eksosom bersifat lebih rigid dibandingkan dengan sel penghasil eksosom yang terdiri atas sphingomyeline dan ceramide. Eksosom terdiri atas protein membran dan fusi seperti annexin, GTPases, flotillin, tetraspanins (CD9, CD63, CD81, CD82) heat shock protein (Hsp70, Hsp90), Alix, TSG101, dan phospholipase. Protein yang diekspresikan pada membran eksosom digunakan sebagai penanda permukaan eksosom. Komponen kargo eksosom mengandung berbagai asam nukleat sitoplasmik,lipid, dan protein. Analisis mass spectrometry berhasil mengidentifikasi 700 komponen kargo eksosom sel punca mesenkimal yang terdiri atas protein penanda sel spesifik, protein yang berperan dalam proliferasi dan diferensiasi sel, serta protein yang memiliki potensi terapi (Vishnubhatla et al.,2014; Tan et al., 2014).
Penelitian melaporkan bahwa DNA mitokondria, mRNA, dan non-coding RNAs seperti miRNA terdapat di dalam eksosom dan dapat dilepaskan ke dalam sel target. Eksosom
sel punca dapat melepaskan mRNA pada sel kultur dan menyebabkan translasiprotein spesifik in vitro. miRNA merupakan non-coding RNA yang tersusun atas 19-24 nukleotida dengan berbagai komponen seluler dan berkaitan dengan aktivitas fisiologis maupun patologis. miRNA berperan dalam homeostais, modifikasi ekspresi gen post translasional, supresi tumor, dan melindungi RNA dan protein dari degradasi enzimatik. miRNA dalam eksosom berperan sebagai regulator post transkripsional dan induksi perubahan epigeneik sel target. Selain itu, eksosom melepaskan regulator transkripsi yang dapat menginduksi perupahan ekspresi gen pada sel target seperti penurunan gen CASP1 (caspase1), CASP8 (caspase8), dan lymphotoxin a yang berperan dalam eksekusi apoptosis sel. Tabel 1 merangkum berbagai komponen eksosom beserta aktivitas biologis yang diinduksi (Vishnubhatla et al., 2014).
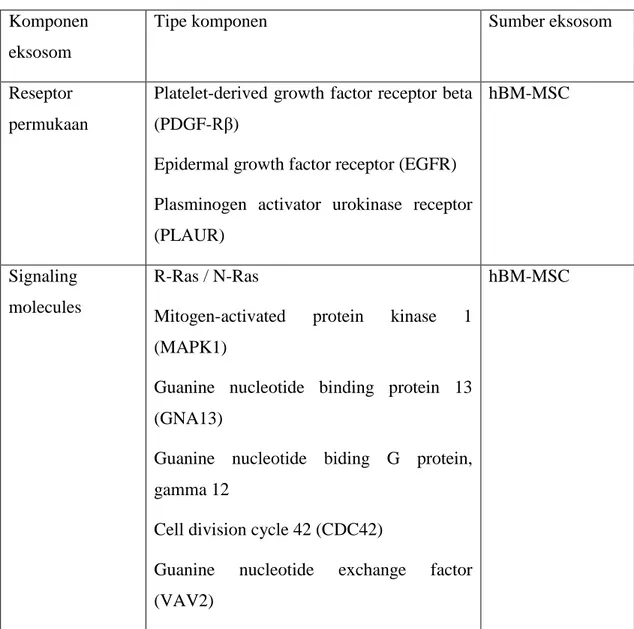
Tabel 2. Komponen dan aktivitas biologi eksosom (Vishnubhatla et al., 2014 Komponen
eksosom
Tipe komponen Sumber eksosom
Reseptor permukaan
Platelet-derived growth factor receptor beta (PDGF-Rβ)
Epidermal growth factor receptor (EGFR) Plasminogen activator urokinase receptor (PLAUR)
hBM-MSC
Signaling molecules
R-Ras / N-Ras
Mitogen-activated protein kinase 1 (MAPK1)
Guanine nucleotide binding protein 13 (GNA13)
Guanine nucleotide biding G protein, gamma 12
Cell division cycle 42 (CDC42)
Guanine nucleotide exchange factor (VAV2)
Ras-related Rab proteins Laminin-R
14-3-3 proteins Cell adhesion Fibronectin 1
Ras GTPase-activating-like protein 1 CD47
EZR Integrins
Lectin, galactose binding soluble Lectin, galactose binding soluble 3 CD34 hBM-MSC hCD34 dan MNC MSC associated antigen CD63 CD109, CD151 CD248, CD44, CD73, CD90 dan CD105 CD9, CD81 hBM-MSC, hCD34, MNC hBM-MSC hBM-MSC, hESC-MSC, MNC, hCD34 Raft associated proteins Transluminal protein Annexin V
Alix / actin interacting protein Heat shock protein
Transferrin protein hCD34, MNC, hESC-MSC hCD34, MNC hESC-MSC hNSC Raft associated lipids GM 1 gangliosides Sphingomyelin hESC-MSC
Ceramide Novel protein cargo Prostaglandin G/H synthase Catepsin F precursor 20S proteasome hESC-MSC Functional genetic cargo
miRNA 126 dan miRNA 130a (angiogenesis)
miRNA 133b (stroke recovery)
miRNA 96, miRNA 124, miRNA 199a (diferensiasi)
miRNA 451 (maintenance, diferensiasi) miRNA 223 (regulator siklus sel) miRNA 335 (marker BM-MSC)
miRNA 564 (ekspresi selektif eksosom MSC) miRNA 142-3p, miRNA 501 hCD34, MNC MSC tikus hBM-MSC hBM-MSC
2.1.3.3. Isolasi, Penyimpanan, dan Identifikasi eksosom
Eksosom disekresikan oleh sel dalam bentuk fenotip yang stabil. Modifikasi fenotip eksosom dapat menjadi dasar strategi terapi eksosom dalam cell-free regenerative medicine. Modifikasi fenotip eksosom dapat dilakukan dengan membiakkan sel dalam komposisi media spesifik untuk menghasilkan respon tertentu yang menyerupai kondisi invivo. Teknik modifikasi ini memungkinkan aplikasi eksosom secara spesifik untuk kelainan tertentu (Moreto et al., 2016).
Gambar 10. Gambaran skematis alur kerja pembuatan eksosom dari laboratorium hingga aplikasi invivo (Vishnubhatla et al., 2014).
Teknik ultrasentrifugasi yang dikombinasikan dengan sucrose density gradients merupakan metode isolasi eksosom yang banyak dikerjakan. Sel dan partikel yang lebih besar dieliminasi dengan peningkatan kecepatan sentrifugasi, selanjutnya presipitasi eksosom dilakukan dengan sentrifugasi pada kecepatan >100.000g selama minimal 2 jam. Metode ini mampu menghasilkan eksosom dalam jumlah banyak, tetapi membutuhkan peralatan khusus. High performance liquid chromatrography (HPLC), ultrasentrifugasi, dan volume-excluding polymer merupakan metode lain untuk isolasi eksosom. Isolasi eksosom menggunakan metode HPLC melibatkan prekonsentrasi eksosom dengan filter 100kDa molecular weight cut-off
yang dilanjutkan dengan sentrifugasipada kecepatan >100,000g. Isolasi menggunakan ultrafiltrasi dilakukan dengan nano-membrane concentrator yang disentrifugasi pada kecepatan 3000g selama 10-30 menit. Metode ini relatif sederhana dan lebih efisien (Sarvar et al., 2016; Tan et el., 2014; Vishnubhatla et al., 2014).
Ukuran eksosom mengalami penurunan 60% dalam penyimpanan pada suhu 37° C selama 2 hari dan tidak mengalami perubahan pada penyimpanan suhu 4° C. Penyimpanan pada suhu -20° C dapat menjaga stabilitas ukuran eksosom dalam jangka waktu yang lama, sehingga kondisi ini direkomendasikan untuk penyimpanan eksosom. Selain itu, siklus freezing dan thawing berulang tidak mempengaruhi ukuran eksosom. Identifikasi eksosom dapat dilakukan dengan teknik scanning electron microscopy, atomic force microscopy, nanoparticle tracking analysis, transmission electron microscopy, flowcytometry, wetern blot, dan enzyme-linked immunosorbent assay (ELISA) (Vishnubhatla et al., 2014, Tan et al., 2014) 2.1.3.4. Aplikasi terapi eksosom sel punca
Lai et al (2010) melaporkan bahwa pemberian eksosom sel punca mesenkimal mampu meningkatkan proliferasi sel kardiomiosit pada tikus model iskemia reperfusi miokard. Penelitian ini membuktikan bahwa faktor bioaktif di dalam eksosom sel punca mesenkimal berperan utama pada regenerasi sel kardiomiosit. Eksosom sel punca mesenkimal mampu memediasi komunikasi interseluler dan menginduksi regenerasi pada hewan model dengan gagal ginjal kronik non toksik. Eksosom juga menstimulasi proliferasi dan menginhibisi apoptosis sel tubuler epitel ginjal in vitro. Eksosom sel punca mesenkimal dapat menjadi salah satu alternatif dalam menungkatkan perbaikan morfologi dan fungsional pada kasus gagal ginjal akut. Karakterisasi biokimia dan fenotip eksosom diperlukan sebelum melakukan translasi klinis. Analisis genomik dan proteomik kandungan eksosom dapat meningkatkan keamanan dan ketepatan aplikasi eksosom secara klinis. Uji klinis eksosom yang telah dilakukan saat ini adalah aplikasi eksosom sel punca mesenkimal sumsum tulang pada kasus severe therapy-refractory cutaneus and intestinal graft versus host disease. Uji klinis ini menunjukkan kemampuan eksosom dalam menurunkan gejala dan memperbaiki tanda klinis pada kasus tersebut. Tabel berikut ini merangkum beberapa studi aplikasi eksosom (Tan et al., 2014; Yu et al., 2014).
Artikel Metode isolasi Metode identifikasi Sumber Cara transplantasi Fungsi biologis Lai (2010) Ultrasentrifugasi (100,000g, 1 jam), HPLC flowsitometri HESC-MSC Injeksi intravena Menurunkan iskemia / reperfusi miokard Reis (2012) Ultrasentrifugasi (100,000g, 1 jam) Mikroskop elektron BMSC tikus Injeksi intravena Gagal ginjal akut yang diinduksi gentamisin Zhang (2013) Ultrafiltrasi HPLC - HESC-MSC Injeksi subkutan Meningkatkan survival skin graft alogenik Xin (2013) ultrasentrifugasi - BMSC tikus injeksi intravena Meningkatkan neovaskularisasi dan perbaikan fungsional setelah stroke
2.1.3.5. Peran Eksosom sebagai imunomodulator
Sel punca mesenkimal memiliki kemampuan untuk meregulasi fungsi sel imun baik imunitas adaptif maupun innate. Dalam hal ini, sel punca mesenkimal mampu menekan proliferasi, diferensiasi, dan aktivasi sel T, sel B, makrofag, sel dendritic, dan sel natural killer (NK) terutama pada konsisi respon sel imun yang berlebih (Kim et al., 2013; Su et al., 2011). Kemampuan imunomodulasi sel punca mesenkimal dimediasi oleh sekresi factor bioaktik seperti prostaglandin E2 (PGE2), indoleamine 2,3-dioxygenase-1 (IDO-1), nitric oxide (NO), transforming growth factor β1 (TGF-β1), hepatocyte growth factor (HGF), dan interleukin-10 (IL-10) (Kim et al., 2015). Sel punca mesenkimal sebagai imunomodulator telah banyak diaplikasikan pada berbagai kasus seperti inflammatory bowel disease, collagen induced arthritis, sepsis, graft versus host disease, multiple sclerosis, dan diabetes mellitus tipe I (kay et al., 2017; Seo et al., 2019). Leng et al (2019) melaporkan bahwa transplantasi ACE-sel punca
mesenkimal mampu meningkatkan keberhasilan terapi pada pasien pneumonia COVID-19 melalui efek immunomodulasi dengan menurunkan TNF-α, C-reactive protein (CRP), sel T CXCR3+CD4+, sel TCXCR3+CD8+, dan CXCR3+NK, serta peningkatan IL-10 (Leng et al., 2019).
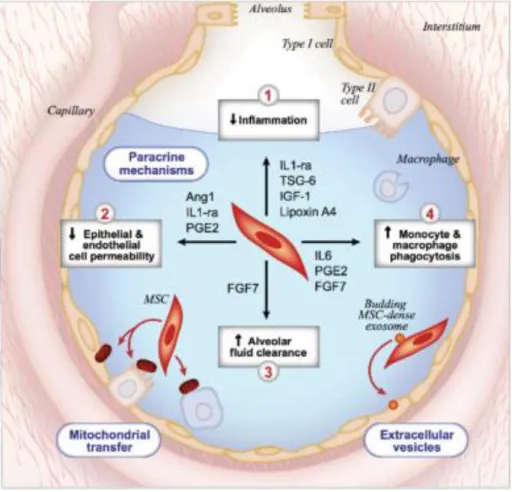
Gambar 11. Mekanisme potensial untuk efek terapeutik MSC dalam ARDS. Sampai saat ini, beberapa studi praklinis telah menunjukkan manfaat terapeutik MSC dalam pengobatan ARDS, dan diagram ini menggambarkan pemahaman mekanistik kami saat ini tentang efek terapi ini. Pertama, MSC mengeluarkan faktor parakrin yang memodulasi perbaikan jaringan melalui empat mekanisme: (1) efek antiinflamasi pada sel inang, (2) pengurangan permeabilitas epitel alveolar di paru-paru, (3) peningkatan laju pembersihan cairan alveolar, dan (4) peningkatan aktivitas fagositik sel mononuklear inang. Kedua, data menunjukkan bahwa MSC secara langsung mentransfer DNA mitokondria ke sel inang, yang juga berkontribusi pada perbaikan dan pemulihan jaringan. Ketiga, MSCs secretemicrovesicles yang memberikan RNA mikro, RNA, protein, dan lipid ke sel inang. ARDS, sindrom gangguan pernapasan akut; MSC, sel stroma mesenchymal
Berkaitan dengan berbagai keterbatasan aplikasi sel punca, eksosom sel punca mesenkimal sebagai material bioaktif yang dibentuk oleh sel punca dilaporkan memiliki
kemampuan imunomodulasi yang sama dengan sel punca itu sendiri. Berbagai studi melaporkan bahwa eksosom berperan penting dalam modulasi respon imun. Berbagai studi pada hewan model hiperinflamasi telah dilakukan untuk menganalisis efek imunomodulator eksosom sel punca mesenkimal (Yanez-Mo et al., 2015). Thomi et al (2019) melaporkan bahwa eksosom yang diisolasi dari sel punca mesenkimal Wharton jelly mampu menurunkan neuroinflamasi pada uji invitro model inflamasi sel glia dan hewan model cedera otak melalui modulasi TLR-4 dan pencegahan degradasi iκBα sebagai inhibitor NF-κB (Thomi et al., 2019). Dari berbagai studi tersebut dapat dirangkum bahwa eksosom sel punca mesenkimal mampu menurunkan regulasi IL-7, tumor necrosis factor (TNF-α), sel T sitotoksisk, meningkatkan regulasi sitokin anti-inflamasi IL-10, Il-4, TGF-β, dan sel Treg, serta mengatur polarisasi fenotip sel makrofag menjadi sel makrofag anti-inflamasi (M2) (Goodwin et al., 2011; Zhu et al., 2017, Wang et al., 2016). Beberapa studi melaporkan bahwa eksosom sel punca mesenkimal mengandung miR-146a yang dikenal sebagai miRNA anti-inflamasi. Mekanisme eksosom sel punca mesenkimal dalam meregulasi respon imun melalui polarisasi makrofag dirangkum pada tabel (Seo et al., 2019).
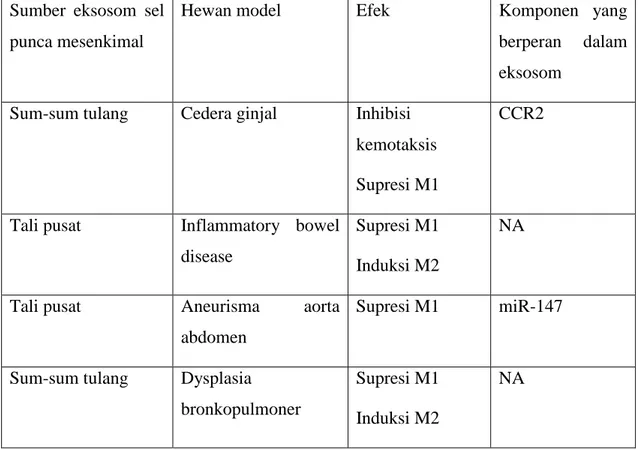
Tabel 4. Mekanisme eksosom sel punca mesenkimal dalam regulasi polarisasi makrofag (Seo et al. 2019)
Sumber eksosom sel punca mesenkimal
Hewan model Efek Komponen yang
berperan dalam eksosom
Sum-sum tulang Cedera ginjal Inhibisi kemotaksis Supresi M1
CCR2
Tali pusat Inflammatory bowel disease
Supresi M1 Induksi M2
NA
Tali pusat Aneurisma aorta
abdomen
Supresi M1 miR-147
Sum-sum tulang Dysplasia bronkopulmoner
Supresi M1 Induksi M2
Adiposa Obesity induced inflammation
Induksi M2 STAT-3 teraktivasi Tali pusat Diabetic cutaneous
wound
Induksi M2 Let-7b
Adiposa Cedera otot Induksi M2 miR-223,
miR-146, miR-126, miR-1991
Adiposa Cedera otak iskemik Induksi M2 mikroglia
miR-30d-5p
2.1.3.6. Kelebihan dan kekurangan eksosom
Penelitian menunjukkan potensi terapi eksosom sel punca mesenkimal yang signifikan. Aplikasi eksosom merupakan suatu cell free therapy yang lebih mudah diproduksi dan bersifat aman karena tidak mentransplantasikan sel viable dan tidak berpotensi membentuk tumor berkaitan dengan risiko aneuploidi yang rendah. Eksosom memiliki kemampuan yang sama dengan sel punca dalam meregenerasi jaringan. Eksosom memiliki potensi imunogenisitas lebih rendah dibandingkan dengan sel punca berkaitan dengan kandungan protein membran seperti kompleks MHC yang rendah. Eksosom dikenal sebagai produk ‘off-the-shelf’ yang dapat diaplikasikan tanpa mempertimbangkan aloimunogenisitas. Produk bebas sel ini merupakan suatu produk biofarmakologi yang stabil, dapat distandardisasi dalam dosis dan aktivitas biologis. Eksosom dapat disimpan dalam suhu -200C tanpa perubahan aktivitas biokimiawi. Eksosom dapat diproduksi secara massal sebagai suatu terapi universal, sehingga dapat diproduksi dalam skala besar dan komersial. Eksosom juga dapat dimodifikasi dalam bentuk enkapsulisasi untuk meningkatkan stabilitas dan mencegah degradasi faktor biologis seperti sitokin, growth factors, transcription factors, dan RNAs. Eksosom mengandung berbagai komponen small molecules yang memiliki aktivitas biologis bervariasi, sehingga karakterisasi genomik dan proteomik penting dilakukan untuk dapat memprediksi sinyal molekuler yang diaktivasi eksosom (Vishnubathla et al., 2014, Yu et al., 2014).
Beberapa penelitian saat ini menunjukkan bahwa penerapan eksosom memiliki sebagian besar karakteristik sel punca mesenkim (MSC). Dengan demikian mengapa harus transplantasi eksosom jika MSC memiliki efek terapi yang serupa? Hal ini disebabkan eksosom memiliki
beberapa keuntungan dalam terapi klinis dibandingkan dengan MSC, seperti yang tercantum dibawah berikut:
1. Eksosom memiliki bilayer fosfolipidnya, sehingga dapat dengan mudah disimpan dan mereka lebih stabil ketika beku dan mencair, dapat melindungi isinya dari degradasi in vivo, sehingga mencegah masalah yang terkait dengan pemecahan cepat molekul-molekul yang larut. Akibat adanya bilayer fosfolipid, eksosom tidak dapat diubah oleh lingkungan mikro inflamasi, sehingga menghindari efek polarisasi dari lingkungan imun dibandingkan dengan MSC (Li X.,2016).
2. Sebagai struktur nano, Eksosom dapat dengan mudah melakukan perjalanan melalui sirkulasi paru-paru atau penghalang darah-otak dengan injeksi intravena dan kemudian secara bebas beredar untuk mencapai situs yang rusak lebih jauh dan lebih dalam untuk menghasilkan efek terapi (Long., 2017).
3. Dibandingkan dengan produk seluler, eksosom tidak mereplikasi diri sendiri dan dengan demikian tidak memiliki potensi pembentukan tumor endogen. Sebagai sel yang bereplikasi sendiri, meskipun terapi MSC tampaknya aman, masih memiliki risiko berkembang menjadi sarkoma (kanker jaringan lunak yang berasal dari sel asal mesenkimal). Sebuah penelitian telah menunjukkan bahwa penerapan entitas sel punca somatik lainnya, seperti sel mukosa penciuman dapat membentuk tumor di tempat injeksi setelah transplantasi pada pasien dengan cedera medulla spinalis (Dlouhy.,2014).
4. Sebagai kargo, eksosom dapat dengan mudah dimodifikasi sehingga mereka berperan sebagai pembawa pengiriman yang ideal dengan membungkus molekul. Selain itu karena ukurannya yang kecil dan ekspresi molekul histokompatibilitas membran yang lebih rendah, eksosom memiliki kemungkinan penolakan kekebalan yang lebih rendah (Reis., 2016).
Selain itu eksosom dapat disiapkan secara seragam dan terstandarisasi di mana prosedur produksinya akan menjadi lebih mudah karena lebih banyak sumber sel tersedia ketika garis MSC yang diabadikan digunakan untuk pembuatan. Dengan demikian, eksosom dapat diproduksi lebih mudah dalam skala yang lebih besar daripada terapi seluler. Mengingat faktor-faktor ini, menggunakan eksosom sebagai aplikasi terapi adalah pilihan yang menarik (lener.,2015; Giebel.,2017)
2.1.3.7. Potensi mekanisme sel punca mesenkimal pada kelainan paru yang dipicu oleh virus
Setelah pemberian MSC secara sistemik, sebagian besar MSC akan menetap di dalam pembuluh darah paru melalui interaksi dengan sel endotel kapiler. Ketika menetap di paru-paru MSC mampu melepaskan berbagai mediator terlarut termasuk sitokin anti-inflamasi, peptide antimikroba, faktor pertumbuhan angiogenik, dan vesikel ekstraseluler (EV) (Gambar 1) (HU S.,2018; Khoury M.,2020).
Gambar 1. Potensial terapi dari MSC pada cedera paru-paru pernapasan dimediasi oleh berbagai mekanisme yang berbeda seperti faktor parakrin yang disekresikan, vesikel ekstraseluler (EV), dan kemungkinan transfer mitokondria, mempromosikan perlindungan jaringan, imunomodulasi, dan kemungkinan resistensi virus (Khoury.,2020).
Berbagai literatur menunjukkan mediator antiinflamasi spesifik dilepaskan untuk lingkungan inflamasi paru dan dimediasi melalui aktivasi diferensial dari kerusakan dan reseptor patogen molekuler terkait yang diekspresikan pada permukaan sel MSC. Termasuk toll-like receptors (TLRs) yang diaktivasi oleh RNA virus (TLR3) (seperti pada COVID-19) yang memicu jalur pensinyalan sel menghasilkan aktivasi MSC. Angiopoietin-1 (Ang-1) dan keratinocyte growth factor (KGF) yang dikeluarkan MSC juga berkontribusi terhadap
pemulihan hambatan alveolar-kapiler yang terganggu sebagai bagian dari mekanisme ARDS, sementara specific inhibitory mRNAs (miRNAs) dalam EV juga memberikan efek perlindungan MSC pada model pra-klinis dari cedera paru-paru akut akibat bakteri. Namun, mediator yang bertanggung jawab untuk memperbaiki cedera paru-paru yang disebabkan oleh virus masih belum jelas (Monsel.,2015; Khoury.,2020).
Percobaan pada hewan, infeksi virus H9N2 meningkatkan kemokin serum dan bertanggung jawab atas infiltrasi leukosit pada paru, termasuk granulocyte-macrophage colony-stimulating factor (GMCSF), monocyte chemoattractant protein-1 (MCP-1), macrophage inflammatory protein-1 alpha (MIP-1α) dan lainnya yang jumlahnya sangat berkurang dengan pemberian MSC intravena. Peningkatan level interferon-gamma (IFN-γ) sebagai respon imun anti-virus, dan peningkatan sitokin proinflamasi lainnya memicu aktivasi MSC termasuk pelepasan mediator antiinflamasi (Li Y.,2016).
Tabel 1. Berbagai uji klinis berbasis MSC pada COVID-19
2.2. KEBARUAN RISET DAN INOVASI
Kebaruan riset dan inovasi yang diusulkan di dalam proposal ini adalah terapi pengobatan menggunakan injeksi eksosom yang diproses dari sel punca mensenkimal (EXO-MSC). Selama ini terapi ini digunakan sebagai pengobatan regenerative untuk penyakit-penyakit degenerative. Tesis bahwa kandungan bio-aktif di dalam EXO-MSC dapat meredamkan hiperinflamasi akibat infeksi virus adalah sebuah kebaruan.
DAFTAR PUSTAKA
1. Ahmed SF, Quadeer AA, McKay MR. Preliminary Identification of Potential Vaccine Targets for the COVID-19 Coronavirus (SARS-CoV-2) Based on SARS-CoV Immunological Studies. Viruses. 2020;12(3):E254. doi: 10.3390/v12030254.
2. Bari, E.; Ferrarotti, I.; Torre, M.L.; Corsico, A.G.; Perteghella, S. Mesenchymal stem/stromal cell secretome for lung regeneration: The long way through "pharmaceuticalization" for the best formulation. J. Control. Release 2019, 309, 11–24, doi:10.1016/j.jconrel.2019.07.022.
3. Beer, L., Mildner, M. & Ankersmit, H.J., Cell secretome based drug substances in regenerative medicine: when regulatory affairs meet basic science. Annals of Translational Medicine, 2017. 5(7), pp.170–170.
4. Bing, L.; Junhui, C.; Tao, L.; Haiying, W.; Wenjie, Y.; Yanjiao, L.; Jianchun, L.; Congtao, Y.; Fangang, N.; Zhaoxia, M.; et al. Clinical remission of a critically ill COVID-19 patient treated by human umbilical cord mesenchymal stem cells. ChinaXiv 2020, 02.00084v1.
5. Bich, N.T. et al.c Isolation of Mesenchymal Stem Cell from Wharton ’ s Jelly of Human Umbilical Cord for Application in Wound Healing. Journal of Science: Natural Sciences and Technology, 2016., 32(1):153–160.
6. Chan JF, Yuan S, Kok KH, To KK, Chu H, Yang J, Xing F, Liu J, Yip CC, Poon RW, Tsoi HW, Lo SK, Chan KH, Poon VK, Chan WM, Ip JD, Cai JP, Cheng VC, Chen H, Hui CK, Yuen KY. A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to-person transmission: a study of a family cluster. Lancet. 2020a;395(10223):514-523. doi: 10.1016/S0140-6736(20)30154-9.
7. Chen J. Pathogenicity and transmissibility of 2019-nCoV-A quick overview and comparison with other emerging viruses. Microbes Infect. 2020;22(2):69-71. doi: 10.1016/j.micinf.2020.01.004.
8. Chen N, Zhou M, Dong X, Qu J, Gong F, Han Y, Qiu Y, Wang J, Liu Y, Wei Y, Xia J, Yu T, Zhang X, Zhang L. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet. 2020a;395(10223):507- 513. doi: 10.1016/S0140-6736(20)30211-7.
9. Choi, M. et al., 2013. Proangiogenic features of Wharton’s jelly-derived mesenchymal stromal/stem cells and their ability to form functional vessels. International Journal of Biochemistry and Cell Biology, 45(3):560–570.
10. Coutinho, A.E.; Chapman, K.E. The anti-inflammatory and immunosuppressive effects of glucocorticoids, recent developments and mechanistic insights. Mol. Cell. Endocrinol. 2011, 335, 2–13, doi:10.1016/j.mce.2010.04.005.
11. Coutard B, Valle C, de Lamballerie X, Canard B, Seidah NG, Decroly E. 2020. The spike glycoprotein of the new coronavirus 2019-nCoV contains a furin-like cleavage site absent in CoV of the same clade. Antiviral Res. 176:104742. doi:10.1016/j.antiviral.2020.104742.
12. Di Rocco, G.; Baldari, S.; Toietta, G. Towards Therapeutic Delivery of Extracellular Vesicles: Strategies for In Vivo Tracking and Biodistribution Analysis. Stem Cells Int. 2016, 2016, 5029619, doi:10.1155/2016/5029619.
13. Dhama K, Sharun K, Tiwari R, Sircar S, Bhat S, Malik YS, Singh KP, Chaicumpa W, Bonilla- Aldana DK, Rodriguez-Morales, AJ. Coronavirus disease 2019 – COVID-19. Preprints. 2020a. 2020030001. doi: 10.20944/preprints202003.0001.v1.
14. Dlouhy BJ, Awe O, Rao RC, Kirby PA, Hitchon PW. Autograft-derived spinal cord mass following olfactory mucosal cell transplantation in a spinal cord injury patient: case report. J Neurosurg Spine. 2014;21(4):618–22.
15. Giebel B, Kordelas L, Borger V. Clinical potential of mesenchymal stem/ stromal cell-derived extracellular vesicles. Stem Cell Investig. 2017;4:84.
16. Giwa A, Desai A. Novel coronavirus COVID-19: an overview for emergency clinicians. Emerg Med Pract. 2020;22(2 Suppl 2):1-21.
17. Guan WJ, Ni ZY, Hu Y, Liang WH, Ou CQ, He JX, Liu L, Shan H, Lei CL, Hui DSC, Du B, Li LJ, Zeng G, Yuen KY, Chen RC, Tang CL, Wang T, Chen PY, Xiang J, Li SY, Wang JL, Liang ZJ, Peng YX, Wei L, Liu Y, Hu YH, Peng P, Wang JM, Liu JY, Chen Z, Li G, Zheng ZJ, Qiu SQ, Luo J, Ye CJ, Zhu SY, Zhong NS; China Medical Treatment Expert Group for Covid- 19. Clinical Characteristics of Coronavirus Disease 2019 in China. N Engl J Med. 2020:10.1056/NEJMoa2002032. doi: 10.1056/NEJMoa2002032.
18. Gyo¨rgy, B. et al., Membrane vesicles , current state-of-the-art : emerging role of extracellular vesicles. Cell. Mol. 2011. Life Sci:2667–2688.
19. Habibzadeh P, Stoneman EK. The Novel Coronavirus: A Bird's Eye View. Int J Occup Environ Med. 2020;11(2):65-71. doi: 10.15171/ijoem.2020.1921.
20. Hoffmann M, Kleine-Weber H Kruger N, Muller M, Drosten C, Pohlmann S. The novel coronavirus 2019 (2019-nCoV) uses the SARS-coronavirus receptor ACE2 and the cellular proteases TMPRSS2 for entry into target cells. bioRxiv. 2020. 10.1101/2020.01.31.929042.
21. Hu, Y. et al., 2018. Exosomes from human umbilical cord blood accelerate cutaneous wound healing through miR-21-3p-mediated promotion of angiogenesis and fibroblast function. Theranostics, 8(1).
22. Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y, Zhang L, Fan G, Xu J, Gu X, Cheng Z, Yu T, Xia J, Wei Y, Wu W, Xie X, Yin W, Li H, Liu M, Xiao Y, Gao H, Guo L, Xie J, Wang G, Jiang R, Gao Z, Jin Q, Wang J, Cao B. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020;395(10223):497-506. doi: 10.1016/S0140- 6736(20)30183-5.
23. Isakson, M. et al., 2015. Mesenchymal Stem Cells and Cutaneous Wound Healing: Current Evidence and Future Potential. Stem Cells International, 2015.
24. Kay AG, Long G, Tyler G, et al. Mesenchymal stem cell-conditioned medium reduces disease severity and immune responses in inflammatory arthritis. Scientific Reports. 2017, 7(1): 18019.
25.Kim B, Kang OY, Kim DS, Choi J, Lee SR, Kim G, Go YJ, Yoon JH, Kim SC. Vpedia: an integrated database of high-throughput data for systemic analyses of extracellular vesicles. J Extracell. Vesicles. 2013, 2 : 20384
26. Kim HS, Shin TH, Lee BC, et al. Human umbilical cord blood mesenchymal stem cells reduce colitis in mice by activating NOD2 signaling to COX2. Gastroenterology. 2013, 145(6): 1392–1403.
27. Kim HS, Yun JW, Shin TH, et al. Human umbilical cord blood mesenchymal stem cell-derived PGE2 and TGF-β1 alleviate atopic dermatitis by reducing mast cell degranulation. Stem Cells. 2015, 33(4): 1254–1266.
28. Kritas SK, Ronconi G, Caraffa A, Gallenga CE, Ross R, Conti P. Mast cells contribute to coronavirus-induced inflammation: new anti-inflammatory strategy. J Biol Regul Homeost Agents. 2020;34(1):Editorial-Kritas. doi: 10.23812/20-Editorial-Kritas.
29. Koniusz S, Andrzejewska A, Muraca M, Srivastava AK, Janowski M, Lukomska B. Extracellular vesicles in physiology, pathology, and therapy of the immune and central nervous system, with focus on extracellular vesicles derived from mesenchymal stem cells as therapeutic tools. Frontiers in cellular neuroscience. 2016, 10: 109.
30. Lai RC, Tan SS, The BJ, Sze SK, Arslan F, de Klejin DP, Choo A, Lim SK. Proteolytic potential of the exosome proteome for an exosome-mediated delivery therapeutic proteasome. Int J Proteomics. 2012: 971907.
31. Lener T, Gimona M, Aigner L, Borger V, Buzas E, Camussi G, et al. Applying extracellular vesicles based therapeutics in clinical trials - an ISEV position paper. J Extracell Vesicles. 2015;4:30087.
32. Leng, Z.; Zhu, R.; Hou, W.; Feng, Y.; Yang, Y.; Han, Q.; Shan, G.; Meng, F.; Du, D.; Wang, S.; et al. Transplantation of ACE2 Mesenchymal Stem Cells Improves the Outcome of Patients with COVID Pneumonia. Aging Dis. 2020, 216–228, doi:10.14336/AD.2020.0228.
33. Letko M, Munster V. Functional assessment of cell entry and receptor usage for lineage B β- coronaviruses, including 2019-nCoV. bioRxiv. 2020. 2020.01.22.915660. doi: 10.1101/2020.01.22.915660.
34. Liu K, Chen Y, Lin R, Han K. Clinical feature of COVID-19 in elderly patients: a comparison with young and middle-aged patients. J Infect. 2020a:S0163-4453(20)30116-X. doi: 10.1016/j.jinf.2020.03.005.
35. Liu F J, Lim K Y, Kaur P, Sepramaniam S, Armugam A, Wong P T, et al. microRNAs involved in regulating spontaneous recovery in embolic stroke model. PLoS ONE. 2012, 8:e66393.
36. Li X, Wang S, Zhu R, Li H, Han Q. Lung tumor exosomes induce a proinflammatory phenotype in mesenchymal stem cells via NF kappaB-TLR signaling pathway. J Hematol Oncol. 2016;9:42.
37. Lu R, Zhao X, Li J, Niu P, Yang B, Wu H, Wang W, Song H, Huang B, Zhu N, Bi Y, Ma X, Zhan F, Wang L, Hu T, Zhou H, Hu Z, Zhou W, Zhao L, Chen J, Meng Y, Wang J, Lin Y, Yuan J, Xie Z, Ma J, Liu WJ, Wang D, Xu W, Holmes EC, Gao GF, Wu G, Chen W, Shi W, Tan W. Genomic characterisation and epidemiology of 2019 novel coronavirus: