II.MATERI DAN METODE PENELITIAN
A. Materi, Lokasi dan Waktu Penelitian
1. Materi
1.1. Alat
Alat-alat yang digunakan dalam penelitian ini antara lain: perahu untuk mengambil sampel air dan plankton; ember, plankton-net No. 25, botol sampel, mikroskop cahaya untuk alat pengambilan sampel dan pengamatan plankton; jerigen,coolbox, pipet tetes, alat destilasi, kondensor, batang pengaduk, statif, sendok, batu didih, hot plate, spektrometer untuk alat pengukuran TN dan TP; thermometer untuk mengukur suhu, depth sounder untuk mengukur kedalaman, keping secchi untuk mengukur penetrasi cahaya, kertas saring Whatman No. 41 untuk pengukuran TSS dan TDS, mangkok porselin untuk tempat sampel air TDS, oven mengeringkan kertas Whatman dan mangkok porselin, vacum pump untuk membantu penyaringan agar lebih cepat terhisap, desikator kabinet untuk mendinginkan bahan atau wadah sebelum penimbangan, timbangan digital untuk menimbang berat kering dan basah kertas Whatman juga cawan porselin, kertas pH, mikropipet dan tip ukuran 1 ml, BOD inkubator, GPS (Global Positioning System), kertas label, dan alat-alat gelas adalah objec glass, cover glass, biuret, gelas ukur, labu Erlenmeyer, botol Winkler 250 ml gelap dan terang, gelas beker.
1.2. Bahan
formalin 40% dan lugol; bahan untuk pengukuran TN dan TP (akuades, hidroxythiosulfate, H3BO3, H2SO4 0,02N, akuades, sudip kalsium perodoksulfat, asam sulfat perak, NaOH, H2SO4 5N, kalium antimotil, ammonium molybdat, asam asorfic); bahan untuk pengukuran parameter fisik-kimia air meliputi: larutan MnSO4, KOH-KI, H2SO4 pekat, indikator amilum, Na2S2O3 0,025N, idikator phenolpthalein (PP), Na2CO3 0,01 N, bufer fosfat, magnesium sulfat, kalsium klorida feriklorida, bubuk inhibitor nitrifikasi, HCl 1 N.
2. Lokasi dan Waktu Penelitian
Penelitian dilakukan di perairan Waduk Panglima Besar Soedirman, Banjarnegara dan analisis plankton dilakukan di Laboratorium Biologi Akuatik, sedangkan analisis beberapa parameter fisika-kimia dilakukan di Laboratorium Lingkungan Fakultas Biologi Universitas Jenderal Soedirman, Purwokerto. Penelitian di lapangan ini dilaksanakan Mei-September 2012.
B. Metode Penelitian
1. Teknik Pengambilan Sampel
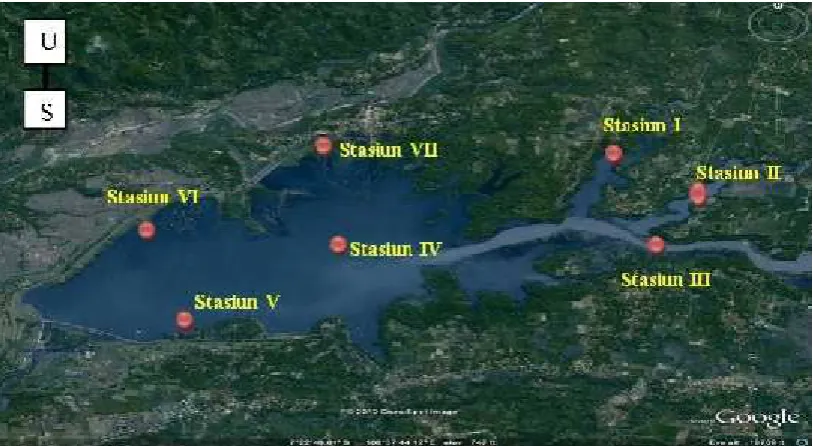
Gambar 2.1. Lokasi stasiun pengambilan sampel Waduk P. B Soedirman (Sumber : maps.google.com)
U = utara S = selatan
Stasiun I = inlet waduk dari Sungai Lumajang (07022’ 42,2”LS dan 109038’ 58,6”BT)
Stasiun II = inlet waduk dari Sungai Kandangwangi (07022’ 30”LS dan 109039’ 34,3”BT)
Stasiun III = inlet waduk dari Sungai Serayu (07022’ 51”LS dan 109038’ 10,6”BT)
Stasiun IV = wilayah tengah Waduk (07023’ 7,4”LS dan 109036’ 58,2”BT)
Stasiun V = wilayah Darmaga (07023’ 24,8”LS dan 109037’ 1,3”BT)
Stasiun VI = outlet waduk dari Wilayah Irigasi (07023’ 18,6”LS dan 109030’ 10,5”BT)
Stasiun VII = KJA Karangjambe (07022’ 42,9”LS dan 109036’ 50,8”BT)
2. Variabel dan Parameter Penelitian
3. Cara Kerja
3.1. Pengambilan sampel air untuk analisis fisik dan kimia air
Pengambilan sampel air waduk untuk pengukuran total nitrogen, total fosfor, TSS dan TDS menggunakan 2 l air permukaan yang diambil menggunakan jerigen dan kemudian dimasukkan ke dalam coolbox. Sampel air kemudian dibawa ke laboratorium untuk dianalisis kandungan nitrogen, fosfor, TSS dan TDS. Sedangkan untuk pengukuran O2terlarut, CO2bebas dan BOD dengan mengambil air permukaan pada tiap stasiun menggunakan botol Winkler dan diisi sampai penuh. Pengukuran kandungan O2 terlarut dan CO2 bebas dilakukan secara insitu sedangkan untuk pengukuran BOD botol Winkler dimasukkan kedalam coolbox yang sudah diisi dengan es batu dan diamati di laboratorium.
3.2. Pengukuran N total (MetodeMikrokjeldahldari APHA, 1992)
tersisa. Pengukuran N total di analisakan di Laboratorium Wahana Semarang. Penentuan N total dilakukan dengan rumus :
N total = x mg/l
Keterangan:
A : ml 0,02 H2SO4untuk titrasi sampel
B : ml 0,02 untuk H2SO4titrasi blanko
N : normalitas H2SO4
S : ml destilasi yang diperlukan untuk titrasi C : ml destilasi awal yang diperlukan untuk titrasi D : ml destilasi akhir yang disesuaikan
3.3. Pengukuran P total (Metode Asam Askorbat dari APHA, 1992)
Sampel air sebanyak 50 ml dituang ke dalam Erlenmeyer, diberi 1 sendok sudip kalsium perodoksulfat (K2S2O6), ditambahkan asam sulfat perak kemudian dihomogenkan, lalu dipanaskan sampai sisa sampel hingga 30 ml, dinginkan kemudian tambahkan indikator phenolphthalein dan NaOH sampai berwarna merah muda. Ditambahkan reagen campuran (50 ml H2SO4 5 N, 5 ml kalium antimotil, 15 ml ammonium molybdat, 30 ml asam asorfic, 100 ml aquades), tunggu maksimal 5 menit kemudian diukur dengan Spektrofotometer pada panjang gelombang 880 nm. Nilai yang ditunjukkan pada spektrofotometer adalah hasil dari total fosfor (mg/l) yang diperoleh.
3.4. Mengukur suhu air dan suhu udara (Metode Pemuaian dari APHA, 1992)
Suhu air menurut APHA (1992), diukur dengan menggunakan termometer Celcius yang dicelupkan ke dalam perairan. Dilakukan pencatatan setelah skala menunjukkan angka yang konstan
beberapa saat dan tidak boleh terkena sinar matahari langsung. Dilakukan pencatatan setelah skala menunjukkan angka yang konstan.
3.5. Mengukur kedalaman
Pengukuran kedalaman dilakukan menggunakan depth sounder. Ujung depth sounder ditempelkan ke permukaan air, lalu tekan tombol maka kedalaman air akan nampak pada layar.
3.6. Mengukur penetrasi cahaya
Kecerahan atau penetrasi cahaya diukur menurut Wetzel dan Likens (1992), yaitu dengan menggunakan Secchi disk dengan diameter 20 cm. Secchi disk dimasukkan ke dalam air dengan menggunakan tali. Secchi disk diturunkan ke dalam badan air hingga tidak nampak oleh mata, dan diukur jaraknya dengan meteran sebagai nilai x. Secchi disk diturunkan kembali, kemudian diangkat perlahan hingga tepat terlihat oleh mata, dan jaraknya diukur sebagai nilai y. Pengukuran penetrasi cahaya dengan rumus :
Penetrasi cahaya = cm
3.7. Mengukur Total Suspended Solids (TSS) dan Total Disolved Solids
(TDS) (Metode pengeringan dari APHA, 1985)
mangkok porselin sampai kering (24 jam) untuk TDS, dinginkan dalam desikator 15 menit lalu ditimbang (berat akhir). TSS dan TDS ditentukan dengan rumus sebagai berikut:
Perhitungan : TSS (total suspended solid)
Keterangan :
Y = berat kertas saring + residu X = berat kertas saring
Perhitungan : TDS (total disolved solid)
Keterangan :
Y = berat cawan porselin + residu X = berat cawan porselin
3.8. Derajat keasaman (metode Kolorometri dari Alaerts dan Santika, 1987)
Nilai pH diukur menggunakan kertas indikator pH universal. Kertas indikator pH dicelupkan ke dalam sampel air. Kertas indikator pH itu dibiarkan selama 1 menit hingga perubahan warna konstan. Perubahan warna pada kertas indikator pH dicocokkan dengan warna standar yang terdapat pada wadah lembaran kertas indikator pH universal. Kesesuaian warna pada kertas indikator pH dan warna standar yang menunjukkan nilai pH.
3.9. Oksigen terlarut (metode Winkler dari Alaerts dan Santika, 1987)
ditambahkn 1 ml larutan H2SO4 pekat sampai endapan larut kembali. Selanjutnya diambil sebanyak 100 ml larutan dari botol Winkler dengan menggunakan gelas ukur dan dimasukkan ke dalam labu Erlenmeyer, kemudian ditambahkan indikator amilum sebanyak 3 tetes, sehingga larutan berubah menjadi biru tua. Sampel hasil kerja tersebut dititrasi dengan larutan Na2S2O3 0,025 N hingga warna biru tepat hilang. Banyaknya titrasi yang dibutuhkn dicatat, kemudian dihitung kandungan oksigen terlarut dengan menggunakan rumus :
Oksigen terlarut (DO) = 8
1000 = volume air dalam 1l 100 = volume air sampel (ml)
3.10. Karbondioksida bebas (metode Titrimetri dari Wetzel dan Likens, 1992)
Sampel air diambil menggunakan botol Winkler 250 ml secara hati-hati agar tidak terdapat gelembung udara di dalam botol sampel. Sampel air diambil sebanyak 100 ml dengan menggunakan gelas ukur dan dimasukkan ke dalam labu Erlenmeyer, kemudian ditambahkan indikator pp (phenolphthalein) sebanyak 5 tetes. Dititrasi dengan larutan Na2CO3 0,01 N sampai larutan berwarna merah muda kemudian dicatat banyaknya larutan Na2CO3yang habis digunakan.
CO2bebas = 22
3.11. PengukuranBiological Oxygen Demand(BOD)
BOD diukur dengan menggunakan metode titrimetri (APHA, 1992). 250 ml air sampel tiap stasiun diencerkan sampai volume 500 ml atau perbandingan 1:1. Air pengencer dibuat dari akuades dengan volume 1 liter dituang dalam wadah bersih ditambah larutan bufer fosfat, magnesium sulfat, kalsium klorida feriklorida masing- masing 1 ml dan bubuk inhibitor nitrifikasi kira-kira 10 mg nilai pH disesuaikan pada pH 7,0±0,1. Air sampel yang telah diencerkan dimasukkan ke dalam dua botol BOD untuk masing-masing pengukuran DO nol hari dan DO sampel lima hari. Larutan blanko dibuat dari akuades yang diperlakukan sama dengan air sampel. Kemudian dimasukkan ke dalam dua botol BOD untuk masing-masing pengukuran DO blanko nol hari dan DO blanko lima hari. DO sampel dan DO blanko langsung diukur oksigen terlarutnya (sebagai X0 dan B0) dan DO sampel dan blanko lima hari diinkubasi selama lima hari pada suhu 20oC. Setelah lima hari diukur kandungan oksigen terlarutnya (sebagai X5 dan B5).
BOD = mg/l
Keterangan :
X0 = oksigen terlarut sampel saat t = 0 (mg O2/l) X5 = oksigen terlarut sampel saat t = 5 (mg O2/l) B0 = oksigen terlarut blanko saat t = 0 (mg O2/l) B5 = oksigen terlarut blanko saat t = 5 (mg O2/l) P = faktor pengenceran
3.12. Pengukuran konsentrasi silika
menggunakan spektrofotometer dengan panjang gelombang 410 nm, kemudian hasil yang diperoleh dicatat.
3.13. Penghitungan kelimpahan Chrysophyta
Pengambilan sampel plankton dilakukan dengan cara mengambil air dari lokasi penelitian menggunakan ember (volume 10 l) sebanyak 10 kali, kemudian disaring menggunakan plankton-net no 25.
Sampel air dalam botol penampung plankton net dipindahkan ke dalam botol sampel lalu diberi larutan formalin 40% hingga konsentrasinya menjadi 4% dan diberi larutan lugol sebanyak 3 tetes (APHA, 1992). Jumlah formalin 40% yang dibutuhkan untuk memperoleh konsentrasi formalin 4% pada sampel plankton dengan menggunakan rumus :
N1.V1= N2.V2
Keterangan :
N1 = Konsentrasi formalin yang dikehendaki (4%) N2 = Konsentrasi formalin yang tersedia (40%)
V1 = Volume air yang terkonsentrasi dalam botol sampel V2 = Volume formalin yang dibutuhkan
F =
Rumus Kelimpahan (ind/l) = F x N
Keterangan :
F = jumlah individu per liter
Q1 = luas gelas penutup 18x18 mm (324 mm2)
Q2 = luas lapang pandang (1,11279 mm2)
V1 = volume air dalam botol penampung (145 ml) V2 = volume air di bawah gelas penutup (0,05 ml) P = jumlah lapang pandang yang diamati (25 kali) W = volume air yang disaring (100 liter)
N = jumlah plankton rata-rata pada setiap preparat
C. Metode Analisis
Kelimpahan Chrysophyta dianalisis menggunakan metode deskriptif. Metode deskriptif adalah metode yang berfungsi untuk mendiskripsikan atau memberi gambaran terhadap objek yang diteliti melalui data sampel atau populasi, tanpa melakukan analisis dan membuat kesimpulan yang berlaku untuk umum (Sugiyono, 2004).
Hubungan total nitrogen,total fosfor, perbandingan total nitrogen dan total fosfor, dengan kelimpahan Chrysophyta dianalisis menggunakan koefesien korelasi (r). Menurut Schefler (1987), koefisien korelasi dapat dijelaskan dengan rumus sebagai berikut:
terhadap koefisien korelasi yang ditemukan, maka dapat berpedoman pada ketentuan yang tertera pada tabel berikut:
Tabel 1. Pedoman untuk memberikan interpretasi terhadap koefisien korelasi Interval Koefisien Hubungan kelimpahan Chrysophyta ditentukan oleh koefisien determinasi (R2) (Gomez dan Gomez, 1995). Menurut Sugiyono (2004), rumus untuk mencari koefesien determinasi (R2) :
R2= (r2) 100%
Keterangan :
R2 : Koefisien determinasi
r : Koefisien korelasi
Hubungan kedua variabel koefesien korelasi dapat dilanjutkan ke analisis regresi jika nilai koefesien korelasi yang didapatkan kuat atau sangat kuat. Regresi merupakan sebuah alat statistik yang memberikan penjelasan tentang pola besarnya hubungan antara dua variabel atau lebih. Besarnya hubungan antara total nitrogen, total fosfor, rasio total nitrogen dan total fosfor dengan kelimpahan Chrysophyta dinyatakan dengan analisis regresi sederhana. Menurut Sudjana (2002), bentuk umum analisis regresi sederhana yaitu:
Y = a + bx
Keterangan:
Y = Subjek variabel dependen (kelimpahan chrysophyta)
X = Subyek variabel independen dengan nilai tertentu (perbandingan konsentrasi total nitrogen dan total fosfor)
a = harga Y bila x = 0
Besarnya hubungan total nitrogen, total fosfor, perbandingan total nitrogen dan total fosfor dengan kelimpahan Chrysophyta ditentukan menggunakan analisis regresi berganda. Menurut Sudjana (2002), analisis regresi berganda dapat dijelaskan melalui persamaan :
Y = a + b. X1 + b. X2+ b. X3
Keterangan :
Y = subyek variabel dependen dalam hal ini yaitu kelimpahan Chrysophyta.
X = subyek variabel independen dengan nilai tertentu dalam hal ini yaitu kandungan total nitrogen (X1), total fosfor (X2) dan rasio total nitrogen dan total fosfor (X3).
a = harga Y bila X = 0
b =angka arah atau koefisien regresi yang menunjukan angka peningkatan atau penurunan variabel dependen yang didasarkan pada variabel independen.
Nilai a dan b dapat diperoleh dengan rumus sebagai barikut:
b =
a = - b , sehingga a = –b
Keterangan:
n = banyak pasangan data y1= nilai peubah takbebas Y ke-i
x1= nilai peubah bebas X ke-i