ABSTRAK
Peranan promoter sangat penting dalam upaya pengembangan teknologi transgenik pada ikan mas Majalaya karena merupakan elemen pengatur aktivitas transkripsi untuk ekspresi transgen. Promoter β-actin memiliki aktivitas ekspresi tinggi pada hampir semua sel ikan. Amplifikasi sekuen promoter β-actin mas Majalaya dengan PCR menghasilkan ukuran fragmen DNA sebesar 1.126 bp menggunakan primer F (5’ – GATGAAACTCGAGTAGCCCTTGCTCTTC– 3’) dan primer R (5’ –CGTTCGAATTGATATATGCGAGCTG– 3’). Purifikasi produk PCR tersebut juga menghasilkan ukuran fragmen DNA yang sama. Hasil insersi fragmen promoter β-actin mas Majalaya dapat berintegrasi dengan plasmid pGEM-T, yang menunjukkan terbentuknya plasmid rekombinan, dengan ditandai tumbuhnya koloni transforman berwarna putih, dan koloni berwarna biru tidak mengandung DNA sisipan. Elektroforegram hasil isolasi plasmid rekombinan untuk transforman koloni putih menunjukkan adanya DNA sisipan (fragmen promoter β-actin mas Majalaya) dan koloni biru tidak mengandung DNA sisipan (tidak ada fragmen DNA β-actin mas Majalaya). Ukuran fragmen DNA insert dari hasil isolasi plasmid pada sel transforman koloni putih sebesar 1.126 bp dan tidak jauh berbeda dengan ukuran fragmen promoter β-actin Cyprinus carpio sebesar 1.123 bp, mud carp sebesar 1.127 bp dan pada Silver carp sebesar 1.123 bp.
KATA KUNCI: cloning, promoter βββββ-actin mas Majalaya, Escherichia coli
PENDAHULUAN
Indonesia merupakan salah satu negara penghasil ikan mas nomor dua di dunia yang menggambarkan besarnya masyarakat pembudidaya ikan tersebut. Khususnya di wilayah Jawa Barat, jenis ikan mas yang umum dibudidayakan adalah ikan mas Majalaya yang berasal dari daerah Majalaya. Ikan mas Majalaya merupakan strain ikan mas lokal yang memiliki ciri morfologis berbeda dari jenis ikan mas lainnya. Perbedaan morfologis utama dari strain ikan mas Majalaya terletak pada bentuk punggung yang lebih tinggi (ikan berpunuk) dibanding strain ikan mas lain yang ada di Indonesia. Sekurang-kurangnya terdapat 10 strain ikan mas di Indonesia antara lain Majalaya, Punten, Sinyonya, Cangkringan, Kaca (mirror), Kancra Domas, Kumpay, Taiwan carp, Domas, dan Koi. Ikan mas Punten merupakan hasil seleksi yang dilakukan Balai benih Ikan (BBI) Punten Batu Malang, sedangkan Majalaya merupakan hasil seleksi massal yang dilakukan petani ikan di Majalaya (Faizal et al., 1999).
Dalam upaya pengembangan teknologi transgenik pada ikan mas Majalaya, melalui perakitan konstruksi gen yang melibatkan promoter, DNA yang disisipkan dan gen reporter (pelacak gen yang disisipkan), idealnya promoter yang digunakan berasal dari ikan yang bersangkutan untuk keberhasilan transfer gen tersebut (Alimuddin et al., 2007). Peran promoter sangat penting dalam mengekspresikan DNA sisipan (insert), oleh karena merupakan elemen pengatur aktivitas transkripsi untuk ekspresi transgen (Moav et al., 1993; Kato et al., 2007). Ekspresi dari GFP (Green Flourescent Protein) sebagai gen reporter juga diatur oleh daerah regulatorik dari gen promoter β-actin, yang menyiratkan bahwa promoter β-actin merupakan enhancer (penguat) pilihan untuk mendorong ekspresi transgen pada sel ikan (Liu et al., 1990). Promoter β-actin memiliki aktivitas ekspresi tinggi pada hampir semua jaringan germ cell, jaringan otot, mata, dan otot rangka (Kinoshita, 2004; Alimuddin et al., 2007).
Isolasi promoter β-actin telah dilakukan pada Cyprinus carpio (Liu et al., 1990), nila/tilapia (Hwang et al., 2003), medaka, Oryzias latipes (Takagi et al., 1994), dan kerapu bebek, Cromileptes altivelis (Alimuddin et al., 2007). Isolasi dan sekuensing gen β-actin dari Cyprinus carpio (carp) dan grass carp (Ctenopharyngodon idella) menunjukkan bahwa sekuen dari dua gen β-actin dari kedua jenis carp tersebut
KLONING PROMOTER βββββ-ACTIN IKAN MAS MAJALAYA DALAM
Escherichia coli
Ibnu Dwi Buwono dan Yuniar Mulyani
Fakultas Perikanan dan Ilmu Kelautan Universitas Padjadjaran Kampus Jatinangor, Bandung 40600
memiliki sekuen identik dalam pengaturan ekspresi gen β-actin (Liu et al., 1990). Sebagai implikasi dari hasil penelitian tersebut, dapat digunakan sekuen primer dari promoter β-actin carp untuk mengkopi urutan nukleotida promoter β-actin mas Majalaya. Perbanyakan atau penggandaan sekuen β-actin mas Majalaya secara in vivo sebagai promoter untuk ekspresi transgen dilakukan melalui kloning gen tersebut dalam Escherichia coli melalui proses transformasi. Sekuen gen β-actin disisipkan dalam pGEM-T (vektor kloning) sebelum ditransformasikan.
Keberadaan sekuen gen β-actin mas Majalaya dalam vektor kloning (plasmid rekombinan) yang terkandung pada sel E. coli dapat dideteksi dengan elektroforesis setelah dilakukan isolasi plasmid rekombinan menggunakan enzim restriksi yang sesuai.
BAHAN DAN METODE
Isolasi DNA Genom Ikan Mas Majalaya dan Amplifikasi PCR (Polymerase Chain Reaction)
DNA genom ikan mas Majalaya diekstraksi dari sirip ekor menggunakan kit Wizard Genomic DNA Purification (Promega, 2007) sesuai dengan protokol kit. Hasil isolasi ini kemudian dicek dengan elektroforesis gen agarosa 1%. Hasil isolat DNA genom yang diperoleh digunakan sebagai DNA cetakan (template DNA) untuk mengamplifikasi urutan nukleotida promoter β-actin ikan dalam mesin PCR.
Primer yang digunakan untuk amplifikasi sekuen promoter β-actin mas majalaya yaitu primer F (5’ –GATGAAACTCGAGTAGCCCTTGCTCTTC– 3’) dan primer R (5’ –CGTTCGAATTGATATATGCGAGCTG– 3’) (Morales et al., 2001). Reaksi polimerisasi (PCR) untuk amplifikasi promoter tersebut dilakukan dalam volume total 50 μL dengan campuran reaksi: 4 μL MgCl2 (2 mM); 5 μL bufer PCR 10 x, 1 μL Dntp; 2 μL primer F; 2 μL primer R; 0,25 μL Taq DNA Polymerase; 2 μL DNA template; dan 33,75 μL nuclease free water.
Kondisi tahapan reaksi siklus PCR untuk amplifikasi sebagai berikut: pra denaturasi (94°C) selama 2 menit, denaturasi (94°C) selama 1 menit, annealing (48°C) selama 1 menit, ekstensi (72°C) selama 1 menit, ekstensi akhir (72°C) selama 1 menit, dan ekstensi akhir (72°C) selama 7 menit. Jumlah siklus PCR sebanyak 30 kali, dan kemudian dilanjutkan dengan elektroforesis pada gel agarosa 1%.
Purifikasi Produk PCR
Produk PCR berupa amplikon promoter β-actin mas Majalaya perlu dimurnikan (diprufikasi) terlebih dahulu sebelum digunakan untuk kloning amplikon tersebut pada sel E. coli. Purifikasi produk tersebut menggunakan kit Wizard SV Gel and PCR Clean up system dengan prosedur sesuai petunjuk protokol kit (Promega, 2007). Hasil prurifikasi ini, selanjutnya diisolasi dari gen agarosa untuk mendapatkan fragmen DNA amplikon promoter β-actin mas Majalaya yang murni.
DNA diekstraksi dari gel agarosa dengan buffer TBE (Tris Borate-EDTA). Sebelum dilakukan pengirisan gel, mikrotube 1,5 mL kosong ditimbang dahulu untuk setiap calon fragmen DNA yang telah diisolasi dan dicatat beratnya. Pemotongan fragmen DNA dilakukan dengan bantuan UV Lamp dengan scalpel steril, kemudian irisan gel dipindah ke mikrotube tersebut dan ditimbang beratnya.
Tahap berikutnya menambahkan MBS (Membran Binding Solution) dengan rasio 10 μL MBS per 10 mg irisan gel agarosa. Campuran tersebut kemudian divorteks dan diinkubasikan pada 50°C–65°C selama 10 menit atau sampai irisan gel larut sempurna. Mikrotube segera disentrifugasi pada suhu ruang untuk mengumpulkan kandungan DNA pada dasar tube. Isolasi fragmen DNA (promoter β-actin mas Majalaya) dicek kembali dengan elektroforesis gel agarosa 1% sebelum digunakan untuk insert ke vektor pGEM-T.
Kloning Promoter βββββ-actin Mas Majalaya dalam E. coli
Produk PCR (promoter β-actin mas Majalaya) selanjutnya digunakan sebagai sisipan ke dalam vektor kloning (pGEM-T) sehingga menjadi plasmid rekombinan. Reaksi ligasi untuk menghasilkan plasmid rekombinan mengikuti protokol kit pGEM-T (Promega, 2007). Komposisi reaksi ligasi meliputi: 3 μL DNA hasil purifikasi, 1 μL pGEM-T (50 ng), 1 μL T4 DNA ligase (3 U/μL), 5 μL 2x rappid buffer ligasi, dan campuran ini diinkubasi 1 jam pada suhu ruang dan dilanjutkan dengan suhu 4°C dalam waterbath semalam.
Sebelum dilakukan transformasi, dilakukan pembuatan plate Luria Bertani (LB)/ IPTG (Isopropyl- β-D-thiogalactopyranoside) / X-Gal (5-bromo-4 chloro-3 – indoly- β-D-galactopyranoside). Untuk pembuatan plate-plate LB dengan ampicillin, ditambahkan 15 g agar ke dalam 1 liter medium LB dan kemudian disterilisasi. Selanjutnya medium didinginkan hingga 50°C sebelum penambahan ampicillin (100 μg/mL). Dituangkan 30–35 mL medium ke dalam petridish sampai ketebalan 85 mm. Petridish ditutup dengan parafilm, dan segera disimpan pada 4°C hingga batas 1 minggu. Media kultur bakteri tersebut kemudian disuplementasi dengan 0.5 mM IPTG dan 80 μg/mL X-Gal yang dituangkan dalam plate.
Tahap berikutnya melakukan transformasi hasil reaksi ligasi ke dalam sel kompeten E. coli DH-5α. Sel-sel kompeten dicairkan di atas permukaan es. Sebanyak 2 μL hasil reaksi ligasi dipindahkan ke mikrotube steril 1,5 mL di atas es dan ditambahkan 50 μL sel-sel kompeten pada 2 μL reaksi ligasi tersebut. Selanjutnya diinkubasikan di atas es selama 20 menit. Untuk proses transformasi, diberikan perlakuan kejutan panas (heat shock) agar plasmid rekombinan dapat masuk ke dalam sel bakteri selama 45–50 detik pada suhu 42°C. Setelah itu, mikrotube dikembalikan di atas permukaan es selama 2 menit.
Ditambahkan 950 μL larutan SOC (1,2 g polypeptone; 0,3 g yeast ectract; 0,35 g NaCl; 0.011 g KCl; 600 μL MgCl2 1 M; 600 μL MgSO4 1 M, dan 60 μL glucose 2 M dalam 60 mL nuclease free water) ke dalam mikrotube transformasi tersebut. Selanjutnya diinkubasi pada suhu 37°C dalam shaker incuba-tor (kecepatan 210 rpm) selama 2 jam. Hasil transformasi ini kemudian dituangkan merata sebanyak 100 μL ke dalam plate petridish yang telah mengandung LB/ampicillin/IPTG/X-Gal. Plate agarosa yang berisi bakteri diinkubasi pada suhu 37°C selama 12–14 jam.
Skrining koloni putih biru dilakukan untuk menyeleksi transforman yang membawa plasmid rekombinan (mengandung promoter β-actin mas Majalaya). Plasmid rekombinan terdapat pada koloni bakteri berwarna putih karena gen lac Z yang terdapat pada plasmid dan sel-sel tranforman tidak mampu memetabolisme X-Gal menjadi produk berwarna biru sehingga pada akhirnya koloni yang terbentuk berwarna putih.
Koloni transforman yang membawa promoter β-actin mas Majalaya diseleksi menggunakan metode cracking (Alimuddin et al., 2007). Koloni tunggal yang berwarna putih diambil menggunakan tusuk gigi steril dan dioleskan ke dasar tabung reaksi untuk ditumbuhkan dalam 4 mL medium Terrific Broth (1,2% tryptone; 2,4% yeast extract; 0,4% glycerol; 0,23% KH2PO4; 1,25% K2HPO4) dengan penambahan 100 ìg/mL ampicillin serta diinkubasi pada 37°C semalam. Setelah itu, kultur suspensi dimasukkan ke dalam tabung mikrosentrifuga 1,5 mL; disentrifugasi pada kecepatan 14.000 rpm selama 20 detik dan setelah itu supernatan dibuang. Cara ini diulangi sampai semua suspensi habis disentrifugasi dan terbentuk pelet. Kemudian pelet dilarutkan dalam 200 μL GTE (50 mM glukosa; 25 mM Tris-Cl pH 8,0; 10 mM EDTA pH 8,0) dan dikocok dengan menggunakan vorteks hingga terbentuk suspensi yang homogen.
Selanjutnya suspensi ditambah dengan 400 μL “buffer” lisis (0,2 M NaOH; 1% SDS) secara cepat dan dicampur dengan cara membalik-balik tabung beberapa kali. Sebanyak 300 μL 5M potasium asetat ditambahkan ke dalam suspensi dan dikocok. Tabung disentrifugasi pada kecepatan 13.000 rpm selama 2 menit dan endapan yang terbentuk dibuang dengan menggunakan tusuk gigi steril. Kemudian tabung disentrifugasi kembali (13 000 rpm, 2 menit) dan supernatan dipindah ke tabung mikrosentrifuga 1,5 mL baru. Supernatan ditambah 2x volume etanol absolut dingin, dibalik-balik dan dipresipitasi di –80°C selama 2 jam.
Kemudian tabung disentrifugasi (13 000 rpm; 2 menit) dan pelet yang terbentuk dicuci dengan alkohol 70%, setelah itu, pelet dikeringkan dengan cara divakum sekitar 1 jam. Pelet yang sudah kering dilarutkan dalam 100 μL TE steril yang mengandung RNase 10 μg/mL (Sambrook et al., 1989) dan disimpan pada suhu –20°C.
Untuk menguji ada-tidaknya sisipan pada plasmid yang telah diisolasi tersebut, sebanyak 3 μL plasmid dipotong dengan menggunakan enzim EcoRI. Komponen reaksi pemotongan meliputi 3 μL plasmid; 1 μL buffer Eco RI; 0,1 μL BSA (Bovine Serum Albumin); 0,2 μL Eco RI (12 U/μL); dan 5,7 μL nuclease free water.
HASIL DAN BAHASAN
DNA Genom Ikan Mas Majalaya dan Hasil Purifikasi
Keberadaan hasil isolasi DNA genom ikan mas Majalaya dapat ditunjukkan dari hasil elektroforesis gel agarosa 1%. Hasil elektroforegram pada Gambar 1 memberikan visualisasi keberadaan molekul DNA genom hasil isolasi, dengan pita DNA yang tebal (Gambar 1).
Ketebalan pita DNA dari sampel sirip mas Majalaya 1-4 (sumur gel ke-5 sampai ke-8) yang terpapar pada Gambar 1 mengindikasikan kualitas sampel DNA yang digunakan sebagai cetakan untuk mengamplifikasi sekuen promoter β-actin mas Majalaya relatif cukup baik. Menurut Qiagen (2007), kualitas DNA yang baik memiliki berat molek∝Λ tinggi dengan konsentrasi antara 1–10 μg/μL.
Hasil pengukuran konsentrasi DNA genom ikan mas Majalaya dengan spektrofometer UV Vis berkisar antara 2,8–13 μg/μL. Dengan demikian isolat DNA yang diperoleh memenuhi syarat untuk dijadikan sebagai template.
Amplifikasi Sekuen Promoter b-actin mas Majalaya
Elektroforegram hasil amplifikasi sekuen promoter β-actin mas Majalaya menggunakan primer F (5’ –GATGAAACTCGAGTAGCCCTTGCTCTTC- 3’) dan primer R (5’ –CGTTCGAATTGATATATGCGAGCTG” 3’) dan formulasi campuran reaksi PCR seperti di atas memberikan pita DNA sekuen promoter β-actin mas Majalaya cukup tebal (Gambar 2).
1 2 3+4 5 6+7 8 9+10 11 12
Gambar 1. Elektroforegram isolasi DNA genom ikan mas Majalaya
Keterangan:
Sumur 3 = Loading dye sebagai kontrol negatif (-) Sumur 4 = Marker λ DNA / Eco RI + Hind III Sumur 5 = Sirip mas Majalaya 1
Sumur 6 = Sirip mas Majalaya 2 Sumur 7 = Sirip mas Majalaya 3 Sumur 8 = Sirip mas Majalaya 4
Gambar 2. Produk PCR berukuran 1.126 bp (amplikon promoter β-actin mas Majalaya)
Keterangan:
Sumur ke-2 : marker λ DNA /Eco RI + Hind III
Sumur ke-3 & 4 : promoter promoter β-actin mas Majalaya Sumur ke-6 dan 7 : template mas Majalaya 3
Sumur ke-9 & 10 : template mas Majalaya 4 Sumur ke-12 : template mas majalaya 2
Hasil amplifikasi keberadaan sekuen promoter β-actin mas Majalaya (1.126 bp) ini memberi petunjuk bahwa suhu annealing 48°C dan konsentrasi MgCl2 sebesar 2,0 mM merupakan suhu dan konsentrasi MgCl2 yang sesuai untuk penempelan primer primer F (5’ –GATGAAACTCGAGTAGCCCTTGCTCTTC– 3’) dan primer R (5’ –CGTTCGAATTGATATATGCGAGCTG– 3’) pada template, sehingga dapat mengkopi sekuen tersebut (Gambar 2).
Pemurnian produk PCR berupa sekuen promoter β-actin mas Majalaya dari gel agarosa dengan kit Wizard SV Gel & PCR Clean up system memberikan hasil pita DNA sekuen promoter β-actin mas Majalaya cukup tebal (Gambar 3) dengan ukuran 1.126 bp. Produk PCR yang kembali terdeteksi berdasar elektroforegram pada ukuran 1.126 bp ini (sumur ke-4 dan ke-6), menunjukkan bahwa produk tersebut telah murni dan dapat digunakan untuk proses kloning (Sambrook et al., 1989; Promega, 2007).
Ligasi Fragmen DNA dan Transformasi Plasmid Rekombinan
Hasil insersi fragmen promoter b-actin mas Majalaya dapat berintegrasi dengan plasmid pGEM-T, yang menunjukkan terbentuknya plasmid rekombinan, dengan ditandai tumbuhnya koloni bakteri berwarna putih. Sebagai ciri penggabungan (integrasi) gen asing ke dalam plasmid, dapat terlihat dari koloni warna putih yang membawa DNA sisipan (fragmen promoter β-actin mas Majalaya). Integrasi ini menyebabkan gangguan (inaktivasi) gen lacZ yang terdapat pada plasmid dan sel transforman (E. coli) sehingga tidak mampu memetabolisme X-Gal menjadi produk biru dan akhirnya koloni yang terbentuk berwarna putih (Sambrook et al., 1989).
Sebaliknya pada koloni sel transforman berwarna biru tidak mengandung DNA sisipan, oleh karena tidak ada integrasi DNA asing ke dalam plasmid, sehingga tidak ada gangguan pada gen lacZ untuk memetabolisme X-Gal menjadi produk berwarna biru.
Transformasi produk ligasi ke dalam sel-sel kompeten dalam upaya peng-kloning-an insert (gen promoter β-actin mas Majalaya) telah dapat memberikan warna plate koloni putih pada setiap plate yang berisi sel kompeten mengandung insert promoter β-actin mas Majalaya dengan jumlah koloni putih cukup banyak (Gambar 4).
Blue white colony assay merupakan teknik untuk men-skrining transformans-transformans yang membawa plsamid rekombinan yang berisi DNA insert. Dalam assay tersebut, plasmid dilinierkan dengan modifikasi enzim restriksi yang cocok sebelum ligasi. Plasmid kemudian ditransformasikan ke dalam sel kompeten dan di-plating di atas plate-plate yang mengandung IPTG dan X-Gal.
Setiap kerusakan plasmid-plasmid seperti misalnya disebabkan oleh nuklease akan mengganggu gen lac Z yang terdapat dalam plasmid dan sel-sel transforman tidak mampu memetabolisme X-Gal menjadi produk berwarna biru, sehingga pada akhirnya koloni-koloni yang terbentuk berwarna putih
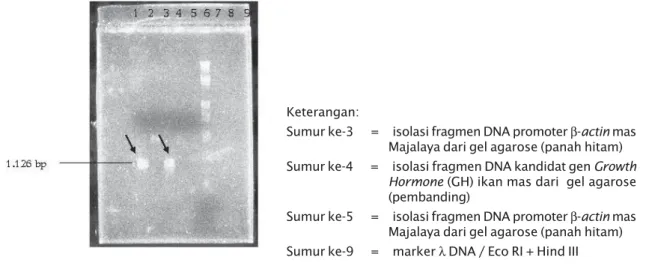
Gambar 3. Cek hasil isolasi promoter β-actin mas Majalaya dari gel agarosa
Keterangan:
Sumur ke-3 = isolasi fragmen DNA promoter β-actin mas Majalaya dari gel agarose (panah hitam) Sumur ke-4 = isolasi fragmen DNA kandidat gen Growth
Hormone (GH) ikan mas dari gel agarose
(pembanding)
Sumur ke-5 = isolasi fragmen DNA promoter β-actin mas Majalaya dari gel agarose (panah hitam) Sumur ke-9 = marker λ DNA / Eco RI + Hind III
(Weaver, 2003; Artama, 1992). Koloni berwarna putih umumnya mengandung sisipan DNA (sekuen promoter β-actin mas Majalaya) seperti yang ditunjukkan pada Gambar 4.
Isolasi Plasmid Rekombinan
Hasil pemotongan plasmid rekombinan dengan enzim restriksi Eco RI untuk melepaskan sisipan sekuen promoter β-actin mas Majalaya dari pGEM-T menunjukkan hasil sisipan yang telah terpotong oleh enzim tersebut (Gambar 5).
Elektroforegram hasil isolasi plasmid rekombinan untuk transforman koloni putih dan biru (Gambar 5), menunjukkan adanya DNA sisipan (fragmen promoter β-actin mas Majalaya) pada koloni putih setelah pemotongan dengan Eco RI (sumur 2 dan 10). Koloni biru (sumur 3 sampai 9 dan ke-12) tidak mengandung DNA sisipan (tidak ada fragmen DNA β-actin mas Majalaya).
Ukuran fragmen promoter b-actin mas Majalaya dari hasil isolasi plasmid pada sel transforman koloni putih sebesar 1.126 bp yang tidak jauh berbeda ukurannya dengan fragmen promoter β-actin Cyprinus carpio 1.123 bp pada mud carp berukuran 1.127 bp dan pada Silver carp (berukuran 1.123 bp (Hwang et al., 2002; Liu et al., 1990; Zhang et al., 2005).
KESIMPULAN
Berdasarkan hasil visualisasi elektroforesis untuk kloning promoter β-actin mas Majalaya dapat disimpulkan :
Gambar 4. Hasil transformasi untuk produk ligasi yang mengandung insert promoter β-actin mas Majalaya (pada koloni putih)
Tanda panah : koloni putih - biru
Keterangan :
Sumur 2 = sampel sel transforman koloni putih (sisipan promoter β-actin mas Majalaya) Sumur 10 = sampel sel transforman koloni putih
(sisipan promoter β-actin mas Majalaya) Sumur 3–9= sampel sel transforman koloni biru Sumur 11 = marker λ DNA/EcoRI + Hind III Sumur 12 = sampel sel transforman koloni biru
1. Amplifikasi dan purifikasi fragmen promoter β-actin mas Majalaya yang diperoleh berukuran 1.126 bp.
2. Penyisipan fragmen promoter β-actin mas Majalaya dengan plasmid pGEM-T dapat berintegrasi yang menunjukkan terbentuknya plasmid rekombinan, ditandai tumbuhnya koloni transforman berwarna putih.
3. Isolasi plasmid rekombinan dengan Eco RI memberikan produk fragmen DNA sisipan berukuran 1.126 bp yang membuktikan keberhasilan kloning promoter β-actin mas Majalaya.
Saran
Agar diperoleh urutan nukleotida DNA yang merepresentasikan sekuen promoter β-actin mas Majalaya diperlukan pengerjaan sekuensing dan analisis fragmen DNA tersebut.
UCAPAN TERIMA KASIH
Atas terlaksananya kegiatan penelitian kloning promoter β-actin mas Majalaya dalam Escherichia coli dari program Insentif Kementerian Negara Riset dan Teknologi tahun anggaran 2007/2008 beserta pihak lain yang membantu, kami mengucapkan terima kasih sebesarnya.
DAFTAR ACUAN
Alimuddin, Nugrahani, W., Aliah, R.S., Sumantadinata, K., Faizal, I., Carman, O., & Yoshizaki, G. 2007. Isolasi dan karakterisasi promoter β-actin dari ikan kerapu bebek (Cromileptes altivelis). J. Ris. Akuakultur, 2(2): 199–209.
Artama, W.T. 1992. Rekayasa genetik. Pusat Antar Universitas (PAU)-Bioteknologi. UGM. Yogyakarta. hlm. 43–50.
Faizal, I., Irawan, D., Aliah, R.S., & Amarullah, M.H. 1999. Studi pendahuluan pengamatan polimorfisme DNA ikan mas menggunakan teknik RAPD-PCR. Prosiding Seminar Hasil Penelitian Genetika Ikan. Indonesian Network on Fish Genetic Research and Development bekerja sama dengan Pusat Penelitian dan Pengembangan Perikanan Direktorat Jenderal Perikanan, Departemen Pertanian, hlm. 40–44.
Hwang, G-L., Han, M.S., Kim, C.T., Lie, Y.S., Aoki, Y., & Lee, J.S. 2002. Cloning and sequences of β-actin genes from Rhodeus notatus and the Silver carp ,Hypothalmicthys molitrix (Cyprinidae) and the phy-logeny of Cyprinid from β-actin genes. J. DNA Seq., 13(3): 153–159.
___________, Rahman, M.A., Razak, S.A., Sohm, F., Farahmand, H., Smith, A., Brooks, C., & Maclean, N. 2003. Isolation and characterization of tilapia β-actin promoter and comparison of its activity with carp β-actin promoter. Biochemica et Biophysica Acta, 1625: 11–18.
Kato, K., Takagi, M., Tamaru, Y., Akiyama, S.I., Konishi, T., Murata, O., & Kumai, H. 2007. Construction of an expression vector containing a β-actin promoter region for gene transfer by microinjenction in red sea bream Pagrus major. Fisheries Science, 73: 440–445.
Kinoshita, M. 2004. Transgenic medaka with briliant flourescence in skeletal muscle under normal light. J. Fisheries Science, p. 645–649.
Liu, Z., Moav, B., Faraz, A.J., Guise, K.S., Kapuscinski, A.R., & Hackett, P.B. 1990. Isolation and charac-terization of β-actin gene of carp (Cyprinus carpio). J. DNA Seq., 1(2): 125–136.
Moav, B., Liu, Z., Caldovic, L.D., Gross, M.L., Faraz, A.J., & Hackett, P.B. 1993. Regulation of expres-sion of transgenes in developing fish. Transgenic Res., 2: 153–161.
Morales, R., Herrera, M.T., Arenal, A., Martinez, R., & Estrada, M.P. 2001. Tilapia chromosomal growth hormone gene expression accelerates growth in transgenic zebrafish (Danio rerio). J. of Biotech., 4(2) : 52–57.
Promega Corporation. 2007. Wizard Genomic DNA Purification Kit Protocol. Qiagen. 2007. Qiagen Product Guide 2007 (www.qiagen.com).
Slambrook, J., Fritsch, E.F., & Maniatis, T. 1989. Molecular cloning, A laboratory manual. 2nd ed. Cold
Spring Harbour Laboratory Press, Cold Spring Harbour, NY.
efficient expression vector for transgenic medaka construction. Mol. Mar. Biol. Biotechnol., 3: 192– 99.
Weaver, R.F. 2003. Molecular biology. Second edition. McGraw-Hill Companies, Singapore, Ltd. Zhang, D.C., Jiang, S.G., & Shao, Y.Q. 2005. Molecular cloning and characterization of mud carp
beta-actin. Aquaculture and Biotechnology Laboratory, Shouth China Sea Fisheries Research Institute, Chinese Academy of Fisheries Sciences, Xin-gong, Western Road, Guangzhou, Guangdong, China.