i
SUDUT KONTAK DAN AKTIVITAS ANTIBAKTERI KAIN NYLON 6,6 DENGAN MODIFIKASI PENAMBAHAN NANOPARTIKEL PERAK DAN
SENYAWA SILAN
SKRIPSI
Diajukan kepada Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Negeri Yogyakarta untuk Memenuhi Sebagian
Persyaratan guna Memperoleh Gelar Sarjana Sains Kimia
OLEH:
RENITA PURNANINGRUM NIM 13307141025
PROGRAM STUDI KIMIA JURUSAN PENDIDIKAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS NEGERI YOGYAKARTA
v
MOTTO
Sesungguhnya bersama kesulitan ada kemudahan. Maka apabila
engkau telah selesai (dari satu urusan), tetaplah bekerja keras (untuk
urusan yang lain). Dan hanya kepada Tuhanmulah engkau berharap
(QS. Al-Insyirah, 6-8).
Orang-orang yang sukses telah belajar membuat diri mereka
melakukan hal yang harus dikerjakan ketika hal itu memang harus
dikerjakan, entah mereka menyukainya atau tidak (Aldus Huxley).
Jangan khawatirkan hal yang tak pasti, persoalan besok khawatirkan
saja besok. Hadapi masalahnya bila sudah di hadapanmu (The Heirs).
Tidak semua yang kita harapkan akan terwujud, tidak semua yang kita
takutkan akan terjadi (Ngenest).
vi
PERSEMBAHAN
Bismillahirrohmanirrohim
Alhamdulillahi robbil’ aalamiin, sembah sujud serta rasa syukur kepada Allah SWT.
Taburan cinta dan kasih sayang-Mu telah memberikanku kekuatan serta membekaliku dengan ilmu. Atas karunia serta kemudahan yang Engkau berikan akhirnya karya sederhana ini dapat terselesaikan. Shalawat serta salam selalu tercurahkan kepada junjungan Nabi Muhammad SAW.
Karya sederhana ini saya persembahkan kepada :
(Alm) Ayahanda tercinta Bapak Amin Sulitno, terimakasih atas limpahan kasih sayang semasa hidupnya. Semoga beliau bangga dengan perjuangan anaknya. Ibunda tercinta Ibu Sukarti, terimakasih atas limpahan doa, kasih sayang, dukungan, serta cinta kasih yang tak terhingga dan selalu memberikan yang terbaik padaku. Semoga ibu selalu sehat dan dalam lindungan Allah SWT. Kakak-kakaku yang selalu membantu dan menyemangatiku terimakasih untuk
semuanya.
The SWAG (Anugrah & Butet) terimakasih kalian selalu memberikan semangat, hiburan, serta canda dan tawa padaku.
Sahabatku Ziya dan Novia, terimakasih atas bantuan, nasehat, hiburan, dan semangat yang kalian berikan selama aku kuliah. Aku takkan melupakan semua yang kalian berikan selama ini.
Sahabat seperjuangan skripsi ini Nanda dan Ihda, terimakasih atas bantuan dan kerjasama kalian selama ini.
Semua teman-teman Kimia B 2013, semoga sukses selalu kawan. The squad KKN 22ND, semoga kita selalu kompak.
vii
SUDUT KONTAK DAN AKTIVITAS ANTIBAKTERI KAIN NYLON 6,6 DENGAN MODIFIKASI PENAMBAHAN NANOPARTIKEL PERAK DAN
SENYAWA SILAN menggunakan nanopartikel perak (Ag) dan heksadesiltrimetoksisilan (HDTMS). Kain Nylon 6,6 yang dikarakterisasi berupa N, N-Ag, N-HDTMS, N-Ag-HDTMS, dan N-HDTMS-Ag.
Nanopartikel perak dipreparasi dengan metode reduksi menggunakan ekstrak daun ketapang (Terminalia catappa) sebagai bioreduktor dan dikarakterisasi menggunakan spektrofotometer UV-Vis. Pengukuran sudut kontak bertujuan untuk mengetahui sifat permukaan kain Nylon 6,6 dengan metode sesille drop dan ditentukan sudut kontaknya menggunakan program Corel Draw. Uji aktivitas antibakteri kain Nylon 6,6 melalui metode difusi dengan mengukur diameter zona bening di sekitar sampel kain, selanjutnya diuji signifikansi dengan ANOVA, LSD, serta uji t-Independent.
Kain N-HDTMS mempunyai nilai sudut kontak terbesar yaitu 120,75º. Adapun kain Nylon 6,6 (N) mempunyai nilai sudut kontak sebesar 90º. Hasil uji aktivitas antibakteri terhadap bakteri Eschericia coli ATCC 35218 dan
Staphylococcus aureus ATCC 25923 menunjukkan bahwa setiap sampel
mempunyai kemampuan sama dalam menghambat pertumbuhan bakteri Staphylococcus aureus dan Eschericia coli.
viii
CONTACT ANGLE AND ANTIBACTERIAL ACTIVITY OF NYLON 6,6 BY MODIFICATION WITH THE ADDITION OF SILVER
NANOPARTICLES AND SILAN COMPOUND
This research aimed to determine the contact angle and antibacterial activity of Nylon 6,6 without modification (N) and modification with silver nanoparticles (Ag) and hexadecylrimethoxysilane (HDTMS). Nylon 6,6 fabrics are characterized by N, N-Ag, N-HDTMS, N-Ag-HDTMS, and N-HDTMS-Ag.
Silver nanoparticles were prepared with reduction method using the extract of leaves of catappa (Terminalia catappa) as bioreductor and characterized by using UV-Vis spectrophotometer. Measurement of the contact angle aim to determine the surface properties of the Nylon 6,6 fabrics by using sesille drop and the contact angle of theirs using Corel Draw program. The antibacterial activity test of Nylon 6,6 was conducted with diffusion method by measuring the diameter clear zone around the fabric sample, then tested for significance using ANOVA, LSD, and t-Independent test.
The N-HDTMS fabric has the largest contact angle value of 120,75º. The Nylon 6,6 (N) fabric has a contact angle value 90º. The results of antibacterial activity test against Eschericia coli ATCC 35218 and Staphylococcus aureus ATCC 25923 showed that each sample had the same ability to inhibit the growth of bacteria Staphylococcus aureus and Escherichia coli.
ix
KATA PENGANTAR
Puji syukur penulis panjatkan kehadirat Allah SWT yang telah melimpahkan karunia, rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan tugas akhir skripsi yang berjudul “Sudut Kontak dan Aktivitas Antibakteri Kain Nylon 6,6 dengan Modifikasi Penambahan Nanopartikel Perak dan Senyawa Silan”.
Shalawat serta salam tak henti-hentinya penulis panjatkan kepada Rasulullah SAW yang telah mengajarkan kebaikan kepada umat manusia, membawa ke alam yang penuh dengan cahaya ilmu.
Penyusunan skripsi ini dapat terselesaikan dengan baik karena bimbingan, dukungan, saran, motivasi, dan bantuan dari berbagai pihak. Oleh karena itu, penulis ingin menyampaikan ungkapan terimakasih dengan kerendahan dan ketulusan hati kepada:
1. Bapak Dr. Hartono selaku Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Negeri Yogyakarta yang telah memberikan kesempatan kepada penulis untuk menyelesaikan studi di FMIPA UNY.
2. Bapak Drs. Jaslin Ikhsan, M.App.Sc.,Ph.D selaku Ketua Jurusan Pendidikan Kimia dan Koordinator Program Studi Kimia serta Koordinator Tugas Akhir Skripsi Kimia FMIPA Universitas Negeri Yogyakarta yang telah memberikan ijin penelitian dan memberikan nasihat serta saran-saran.
x
4. Ibu Prof. Dr. Endang Widjajanti LFX selaku Penasehat Akademik serta penguji utama, terimakasih atas bimbingannya selama 4 tahun dan terimakasih untuk pertanyaan, kritik, saran dan arahannya.
5. Bapak Dr. Crys Fajar Partana, M.Si selaku penguji pendamping, terimakasih untuk pertanyaan, kritik, saran dan arahannya.
6. Seluruh Dosen, Staf, dan Laboran Jurusan Pendidikan Kimia FMIPA UNY yang telah banyak membatu selama perkuliahan dan penelitian.
7. Semua pihak yang telah membantu dalam pelaksanaan dan penyusunan skripsi ini yang tidak dapat penulis sebutkan satu per satu.
Penulis menyadari bahwa skripsi ini jauh dari kesempurnaan karena keterbatasan kemampuan, pengetahuan, dan pengalaman penulis. Oleh karena itu penulis mengharapkan kritik dan saran yang membangun dari berbagai pihak demi kesempurnaan skripsi ini. Semoga skripsi ini dapat bermanfaat bagi pembaca. Aamiin.
Yogyakarta, Mei 2017
xi
DAFTAR ISI
Halaman
HALAMAN JUDUL ...i
HALAMAN PERSETUJUAN ... ii
xii
8. Bakteri Uji ... 24
a. Escherichia coli ... 25
b. Staphylococcus aureus ... 27
9. Aktivitas Antibakteri ... 28
B. Penelitian yang Relevan ... 31
C. Kerangka Berpikir ... 32
BAB III. METODE PENELITIAN... 35
A. Subjek dan Objek Penelitian ... 35
B. Variabel Penelitian ... 35
C. Instrumen Penelitian ... 36
D. Prosedur Penelitian ... 37
E. Teknik Analisis Data ... 42
1. Spektrofotometri UV-Vis ... 42
2. Sudut Kontak ... 43
3. Uji Antibakteri ... 43
BAB IV. HASIL DAN PEMBAHASAN ... 45
A. Hasil Penelitian ... 45
1. Sintesis dan Karakterisasi Nanopartikel Perak ... 45
2. Hasil Modifikasi Kain Nylon 6,6 dengan Penambahan Nanopartikel Perak dan Senyawa HDTMS ... 48
3. Hasil Uji Sudut Kontak Kain Nylon 6,6 ... 49
4. Hasil Pengujian Aktivitas Antibakteri Kain Nylon 6,6 ... 50
a. Hasil Pengukuran Diameter Zona Bening Sampel terhadap Bakteri
1. Hasil Sintesis dan Karakterisasi Nanopartikel Perak ... 58
xiii
3. Hasil Uji Sudut Kontak Kain Nylon 6,6 ... 63
4. Hasil Pengujian Aktivitas Antibakteri Kain Nylon 6,6 terhadap Bakteri Escherichia coli ATCC 35218 dan Staphylococcus aureus ATCC 25923 ... 66
BAB V. KESIMPULAN DAN SARAN ... 75
DAFTAR PUSTAKA ... 77
xiv
DAFTAR TABEL
Halaman
Tabel 1. Klasifikasi Tanaman Ketapang (Terminalia catappa) ... 13
Tabel2. Ukuran Partikel Koloid Nanopartikel Perak ... 21
Tabel 3. Klasifikasi Bakteri Escherichia coli ... 26
Tabel 4. Klasifikasi Bakteri Staphylococcus aureus ... 28
Tabel 5. Variasi Kain Nylon 6,6 ... 39
Tabel 6. Hasil Pengukuran Sudut Kontak Kain Nylon 6,6 ... 50
Tabel 7. Hasil Pengamatan Diameter Zona Bening Sampel Kain terhadap Bakteri Escherichia coli ATCC 35218 ... 51
Tabel 8. Hasil Pengamatan Diameter Zona Bening Sampel Kain terhadap Bakteri Staphylococcus aureus ATCC 25923 ... 53
Tabel 9. Hasil Uji Anova terhadap Diameter Zona Bening (a) Escherichia coli ATCC 35218 dan (b) Staphylococcus aureus ATCC 25923 ... 55
Tabel 10. Interpretasi Hasil Uji Lanjut LSD antara Jenis Sampel terhadap Diameter Zona Bening Bakteri Escherichia coli ATCC 35218 dan Staphylococcus aureus ATCC 25923 ... 56
xv
DAFTAR GAMBAR
Halaman
Gambar 1. Reaksi Pembentukan Serat Nylon 6,6 ... 10
Gambar 2. Daun Ketapang ... 13
Gambar 3. Struktur Molekul Tanin ... 14
Gambar 4. Analisis Morfologi Nanopartikel Perak Menggunakan SEM dengan Pembesaran 2000 Kali (Skala 20 µm) ... 18
Gambar 5. Struktur Senyawa HDTMS ... 19
Gambar 6. Besar Sudut Kontak pada Permukaan Superhidrofilik, Hidrofilik, Hidrofobik dan Superhidrofobik ... 22
Gambar 7. Ilustrasi Skematik Metode (a) Sessile Drop,(b) Captive Bubble, dan (c) Wilhelmy untuk Mengukur Sudut Kontak ... 22
Gambar 8. Profil Tetesan Air ... 23
Gambar 9. Dinding Sel Bakteri Gram Positif dan Bakteri Gram Negatif ... 25
Gambar 10. Ekstrak Daun Ketapang (Terminalia catappa) ... 45
Gambar 11. Larutan Ekstrak Daun Ketapang (Terminalia catappa) + Larutan AgNO3 1 x 10-3 M + PVA (a) Awal Pembuatan (b) 2 Jam (c) 1 Hari (d) 3 Hari ... 46
Gambar 12. Spektrum UV-Vis (a) Larutan AgNO3 1x10-3 M dan (b) Koloid Nanopartikel Perak Hasil Sintesis ... 47
Gambar 13. Karakeristik Fisik Kain (a) N0 (b) N1 (c) N2 (d) N3 (e) N4 ... 49
Gambar 14. Uji Sudut Kontak yang Terbentuk (a) N0 (b) N1 (c) N2 (d) N3 (e) N4 ... 49
Gambar 15. Diameter Zona Bening Sampel Kain terhadap Bakteri Escherichia coli ATCC 35218 ... 51
Gambar 16. Grafik Diameter Zona Bening Bakteri Escherichia coli ATCC 35218 ... 52
Gambar 17. Diameter Zona Bening Sampel Kain terhadap Bakteri Staphylococcus aureus ATCC 25923 ... 53
xvi
Gambar 19. Struktur Molekul (a)Tanin, (b) Struktur Sederhana dari Tanin,
(c) Mekanisme Reaksi KemungkinanPembentukan AgNP ... 58
Gambar 20. Distribusi Nanopartikel Perak pada Serat Poliamida (Nylon) ... 62
Gambar 21. Mekanisme Pelapisan Permukaan Kain Nylon oleh HDTMS ... 65
xvii
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Spektrum UV-Vis Larutan AgNO3 ... 82
Lampiran 2. Spektrum UV-Vis Nanopartikel Perak ... 83
Lampiran 3. Perhitungan Nilai Sudut Kontak ... 84
Lampiran 4. Hasil Pengukuran Diameter Zona Hambat pada Uji Antibakteri terhadap Bakteri E.coli ... 86
Lampiran 5. Hasil Pengukuran Diameter Zona Hambat pada Uji Antibakteri terhadap Bakteri S.aureus ... 87
Lampiran 6. Tabel Uji ANOVA Dua Faktor terhadap Bakteri E.coli ... 88
Lampiran 7. Tabel Uji ANOVA Dua Faktor terhadap Bakteri S.aureus ... 94
Lampiran 8. Uji t-independent N0 terhadap Bakteri E.coli dan S.aureus... 100
Lampiran 9. Uji t-independent N1 terhadap Bakteri E.coli dan S.aureus... 101
Lampiran 10. Uji t-independent N2 terhadap Bakteri E.coli dan S.aureus... 102
Lampiran 11. Uji t-independent N3 terhadap Bakteri E.coli dan S.aureus... 103
Lampiran 12. Uji t-independent N4 terhadap Bakteri E.coli dan S.aureus... 104
1
BAB I PENDAHULUAN
A. Latar Belakang Masalah
Industri Tekstil dan Produk Tekstil (TPT) merupakan salah satu industri penting di Indonesia, menurut Kementrian Perindustrian Republik Indonesia pada tahun 2016 tercatat industri TPT mampu memenuhi 70% kebutuhan sandang dalam negeri. Namun industri tekstil dalam negeri masih kurang mampu bersaing dengan industri tekstil negara lain seperti India, Vietnam dan Bangladesh untuk produk eksport. Nilai eksport TPT pada tahun 2016 tercatat turun 9% dari tahun sebelumnya (Aziliya, 2017). Berdasarkan data tersebut dapat diketahui bahwa pasar tekstil internasional merupakan pasar yang sangat kompetitif sehingga pengembangan produk tekstil dalam negeri sangat dianjurkan untuk menaikkan kualitas produk agar dapat bersaing dengan industri tekstil lainnya.
Mengembangkan tekstil menjadi produk dengan sifat antikotor dan antibakteri merupakan salah satu alternatif yang dapat dilakukan. Tekstil dengan sifat tersebut sangat bermanfaat dalam bidang medis yaitu sebagai baju pelindung dokter, pasien, para medis serta sebagai bahan dasar penutup luka, selain itu dalam bidang militer dapat digunakan untuk bahan seragam para tentara (El-Khatib, 2012). Beberapa bahan tekstil yang dapat dikembangkan menjadi produk dengan sifat antikotor dan antibakteri adalah poliester, Nylon, spandex, dan katun.
2
spandex berasal dari polimer poliuretan dengan gugus fungsi uretan adalah – NHCOO, adapun katun dihasilkan dari serat alam dan mengandung gugus selulosa (Noerati et al., 2013).
Nylon atau poliamida merupakan salah satu bahan tekstil yang dihasilkan dari reaksi senyawa diamina dan dikarboksilat. Serat poliamida secara alami bersifat hidrofob, mempunyai kekuatan cukup tinggi dan ketahanan kimia cukup baik sehingga penggunaannya cukup luas. Penggunaan serat poliamida dalam tekstil pakaian misalnya kaos kaki, pakaian dalam dan baju olahraga (Noerati et al., 2013: 19). Jenis pakaian tersebut memerlukan tekstil yang berkualitas antibakteri sehingga nyaman untuk digunakan. Untuk itu perlu dikembangkan Nylon dengan sifat antibakteri sehingga menjadi tekstil berkualitas yang siap bersaing dengan produk tekstil lainnya.
Menurut Wahyudi & Rismayani (2008) produk self-cleaning textile atau bahan tekstil yang mempunyai sifat antikotor dapat diperoleh dengan meniru permukaan daun Lotus (nelumbo nucifera) yaitu mempunyai tekstur permukaan yang berstruktur kompleks antara skala mikro hingga nano atau bersifat hidrofob. Sifat hidrofob tersebut membuat kotoran yang menempel pada bahan tekstil akan mudah terlepas ketika disiram air namun kain tetap kering. Bahan tekstil yang mempunyai sifat hidrofob dapat diperoleh dengan cara memodifikasi bahan tekstil dengan menambahkan suatu senyawa silan.
3
senyawa silan telah digunakan untuk memodifikasi tekstil adalah octyltrithoxysilane (OTES) (Khalilabad & Yazdanshenas, 2010), polimetilhidroksilosan (PMHS) dan Tetraethoxysilane (TEOS) (Guo et al., 2015), metiltrimetoksisilan (MTMS) (Simovich & Lamb 2014) serta heksadesiltrimetoksisilan (HDTMS) (Xue et al., 2012). Hidrofobisitas dari suatu bahan tekstil dapat diketahui melalui pengukuran nilai sudut kontak permukaan bahan tekstil tersebut. Beberapa metode untuk mengukur sudut kontak meliputi metode sessile drop, metode captive bubble, dan metode Wilhelmy (Wenten et al., 2015).
Sifat antibakteri dari bahan tekstil dapat diperoleh dengan memanfaatkan nanoteknologi, yaitu dengan cara mendepositkan partikel berukuran nanometer terhadap suatu bahan tekstil. Perkembangan nanoteknologi saat ini cukup pesat, dan diharapkan penerapan nanoteknologi dapat meningkatkan daya saing industri tekstil nasional (Haryono & Harmami, 2010). Ilmu dan rekayasa dalam penciptaan suatu material, struktur fungsional, maupun alat dalam skala nanometer merupakan pengertian dari nanoteknologi (Willems & Wildenberg, 2005).
4
mikroba yang tidak patogen. Beberapa literatur mengungkapkan bahwa pelapisan nanopartikel perak pada bahan tekstil seperti serat polimer berupa serat katun dan Nylon dapat menjadikan bahan tekstil tersebut bersifat antibakteri (Haryono & Harmami, 2010).
Bakteri Staphylococcus aureus, Eschericia coli dan Bacillus subtilis merupakan bakteri penyebab infeksi yang paling umum dijumpai, ketiga bakteri tersebut penghasil toksin berbahaya bagi manusia dan kebal terhadap antibiotik (Ariyanta et al., 2014). Serat tekstil yang dilapisi nanopartikel diharapkan mempunyai sifat antibakteri terhadap beberapa bekteri tersebut. Pengukuran aktivitas antibakteri dapat dilakukan dengan metode difusi atau metode pengenceran (Kusmiyati & Agustini, 2007).
Nanopartikel perak dapat diperoleh dengan beberapa metode, seperti metode reduksi kimia, elektrokimia, fotokimia, dan sonokimia. Metode yang paling sering digunakan yaitu metode reduksi. Beberapa faktor yang membuat metode tersebut populer adalah karena faktor kemudahan, biaya yang relatif murah serta dimungkinkan untuk dapat diproduksi dalam skala besar (Lu & Chou, 2008). Metode reduksi kimia untuk memperoleh nanopartikel perak pernah dilakukan oleh Guzman et al. (2009) menggunakan garam perak oleh natrium sitrat atau natrium borohidrida.
Sekarang telah muncul suatu metode preparasi nanopartikel dengan memanfatkan makhluk hidup seperti mikroorganisme dan tumbuhan sebagai pereduksi, sintesis nanopartikel tersebut dikenal sebagai biosintesis nanopartikel
5
semakin berkembang dan banyak digunakan saat ini dikarenakan proses reduksi secara kimia dikhawatirkan akan menghasilkan sifat toksik yang tinggi jika diaplikasikan dalam bidang medis. Tujuan metode tersebut adalah untuk menggantikan bahan yang bersifat toksik pada proses reduksi secara kimia (Duran et al., 2007).
Dalam penelitian ini kain Nylon 6,6 dikembangkan menjadi produk self-cleaning textile (antikotor) dan antibakteri. Produk self-self-cleaning textile (antikotor)
dapat dilakukan dengan cara membuat bahan tekstil agar bersifat hidrofob dengan menambahkan suatu senyawa silan, yaitu HDTMS. Adapun tekstil yang bersifat antibakteri dilakukan dengan penambahan nanopartikel perak. Nanopartikel perak diperoleh dengan metode biosintesis menggunakan ekstrak daun ketapang. Terbentuknya nanopartikel perak dikarakterisasi menggunakan spektrofotometer UV-Vis. Setelah dilakukan modifikasi terhadap kain Nylon 6,6 dengan penambahan nanopartikel perak dan senyawa HDTMS kain dikarakterisasi sudut kontak dan sifat antibakteri.
B. Identifikasi Masalah
Berdasarkan latar belakang yang telah diuraikan di atas, pokok permasalahan yang dapat diidentifikasi dalam penelitian ini adalah:
1. Jenis kain yang berbeda mempunyai gugus fungsi yang berbeda.
2. Terdapat beberapa jenis senyawa silan untuk meningkatkan sifat antikotor. 3. Metode analisis sudut kontak.
6
C. Pembatasan Masalah
Berdasarkan identifikasi masalah, pembatasan masalah penelitian ini adalah : 1. Kain yang digunakan dalam penelitian ini adalah kain Nylon 6,6.
2. Senyawa silan yang digunakan dalam penelitian adalah senyawa HDTMS. 3. Metode yang digunakan untuk menentukan sudut kontak adalah metode sessile
drop.
4. Mikroorganisme yang digunakan untuk uji aktivitas antibakteri adalah Staphylococcus aureus ATCC 25923 dan Eschericia coli ATCC 35218.
5. Metode yang digunakan untuk menguji sifat antibakteri adalah metode difusi.
D. Perumusan Masalah
Berdasarkan latar belakang, permasalahan dalam penelitian ini dapat dirumuskan:
1. Bagaimana karakteristik nanopartikel perak (Ag) yang dipreparasi dengan ekstrak daun ketapang (Terminalia catappa) ?
2. Bagaimana nilai sudut kontak antara kain Nylon 6,6 tanpa modifikasi dan kain Nylon 6,6 dengan modifikasi ?
3. Apakah terdapat perbedaan yang signifikan antara kain Nylon 6,6 tanpa modifikasi dan kain Nylon 6,6 dengan modifikasi dalam menghambat pertumbuhan bakteri Eschericia coli ?
7
5. Apakah terdapat perbedaan yang signifikan dalam hal aktivitas antibakteri kain Nylon 6,6 tanpa modifikasi dan kain Nylon 6,6 dengan modifikasi terhadap pertumbuhan bakteri Staphylococcus aureus dan Eschericia coli ?
E. Tujuan Penelitian
Penelitian ini bertujuan untuk :
1. Mengetahui karakteristik nanopartikel perak (Ag) yang dipreparasi dengan ekstrak daun ketapang (Terminalia catappa).
2. Mengetahui nilai sudut kontak kain Nylon 6,6 tanpa modifikasi dan kain Nylon 6,6 dengan modifikasi.
3. Mengetahui adanya perbedaan yang signifikan antara kain Nylon 6,6 tanpa modifikasi dan kain Nylon 6,6 dengan modifikasi dalam menghambat pertumbuhan bakteri Eschericia coli.
4. Mengetahui adanya perbedaan yang signifikan antara kain Nylon 6,6 tanpa modifikasi dan kain Nylon 6,6 dengan modifikasi dalam menghambat pertumbuhan bakteri Staphylococcus aureus.
8
F. Manfaat Penelitian
Penelitian ini dilaksanakan dengan harapan dapat memberi nilai guna antara lain:
1. Menambah ilmu pengetahuan baru khususnya dalam mengembangkan bidang kimia tekstil.
2. Memberikan informasi tentang bahan alam asli Indonesia yang dapat digunakan sebagai bioreduktor.
3. Memberikan informasi mengenai sudut kontak kain Nylon 6,6 tanpa modifikasi, dan dengan modifikasi penambahan nanopartikel perak, senyawa HDTMS maupun campuran keduanya.
4. Memberikan informasi mengenai aktivitas antibakteri kain Nylon 6,6 tanpa modifikasi, dan dengan modifikasi penambahan nanopartikel perak, senyawa HDTMS maupun campuran keduanya.
9
BAB II
KAJIAN PUSTAKA A. Deskripsi Teori
1. Kain Nylon
Serat tekstil dapat digolongkan berdasarkan sumbernya maupun berdasarkan struktur molekul bahan penyusunnya. Berdasarkan sumbernya serat tekstil dibagi menjadi dua golongan, yaitu serat buatan dan serat alam. Adapun berdasarkan struktur molekul bahan penyusunnya dikenal istilah serat selulosa contohnya kapas dan rami, serat protein yaitu sutera dan wol, serat polimer alam seperti rayon viscosa, dan serat polimer buatan yaitu poliamida dan polyester (Noraeti et al., 2013: 1).
10
Gambar 1.Reaksi Pembentukan Serat Nylon 6,6
Serat Nylon mempunyai karakterisasi seperti berikut (Istinharoh, 2013: 44-46):
a. Pada penampang membujur serat Nylon seperti silinder yang rata dan pada penampang melintang serat Nylon hampir bulat.
b. Serat Nylon mempunyai kemuluran 22% dan keelastisannya 91%, mempunyai berat jenis 1,14.
c. Mempunyai titik leleh 263°C, di atas 230°C Nylon akan rusak. Dalam pemanasan di udara pada suhu 150°C selama lima jam akan berubah kekuning-kuningan.
d. Serat Nylon tahan terhadap asam encer, tetapi akan terurai menjadi asam adipat dan heksametilena diamonium hidroksida apabila dilarutkan dalam asam klorida pekat mendidih selama beberapa jam. Nylon sangat tahan terhadap basa.
11
f. Nylon merupakan isolator yang baik sehingga dapat menimbulkan listrik statis.
2. Nanopartikel Perak
Perkembangan teknologi yang semakin pesat dalam beberapa tahun terakhir ini telah membawa pengaruh yang luas pada berbagai bidang, salah satunya adalah bidang ilmu sains. Teknologi berbasis nano, atau yang disebut dengan nanoteknologi merupakan salah satu contohnya. Secara umum nanoteknologi dapat didefinisikan sebagai teknologi perancangan atau pembuatan serta aplikasi dari struktur/material yang berdimensi nanometer. Mengetahui bagaimana cara memproduksi serta mengetahui kegunaan sifat baru yang muncul dari material nano yang telah dibuat merupakan pengertian yang lebih luas tentang nanoteknologi, dan tidak hanya sebatas mengetahui cara menghasilkan material atau partikel berukuran nanometer saja (Ariyanta et al., 2014).
Nanopartikel merupakan partikel yang sangat halus dengan ukuran 1-100 nm. Pada skala ukuran ini, sifat fisika, kimia, dan biologi dari nanopartikel berbeda sifatnya sebagai atom/molekul tunggal. Nanopartikel logam, oksida logam, semikonduktor, polimer, dan material karbon merupakan beberapa jenis nanopartikel. Nanopartikel memiliki banyak kegunaan dalam berbagai bidang, diantaranya bidang biomedis dan kesehatan, pangan, energi listrik, elektronik, dan lingkungan (Nagarajan, 2008).
12
patogen dan belum dilaporkan adanya mikroba yang resisten terhadap perak. Nanopartikel perak memiliki sifat stabil dan aplikasi yang potensial dalam berbagai bidang antara lain sebagai katalis, detektor sensor optik, dan sebagian pemanfaatannya adalah agen antimikroba. Semakin kecil ukuran partikel perak maka rasio luas permukaan terhadap volume juga meningkat, sehingga kemampuan sebagai agen antimikroba juga akan semakin kuat (Haryono et al., 2008).
Dispersi sejumlah kecil nanopartikel perak pada serat terbukti efektif untuk
meningkatkan kinerja sifat serat terhadap mikroba, oleh karena itu pengaplikasian
nanopartikel perak pada serat tekstil sekarang ini semakin banyak dipelajari
(Haryono & Harmami, 2010). Beberapa peneliti pernah melakukan penelitian
tersebut sebelumnya, yaitu dengan mendepositkan nanopartikel perak pada suatu
serat tekstil. Haryono & Harmami (2010) pada serat katun serta Montazer & Nia
(2015) pada serat Nylon.
3. Tanaman Ketapang (Terminalia catappa L)
13
Tabel 1. Klasifikasi Tanaman Ketapang (Terminalia catappa)
Kerajaan Plantae
Divisi Magnoliophyta Kelas Magnoliopsida
Ordo Myrtales
Famili Combretaceae
Genus Terminalia
Spesies Terminalia catappa
Daun ketapang mempunyai berbagai macam senyawa kimia, beberapa penelitian telah menguji kandungan fitokimia dari daun ketapang. Menurut Restasari et al. (2008), ekstrak kloroform daun ketapang mengandung senyawa golongan alkaloid, triterpenoid, steroid dan terpenoid. Asam palmitat, asam linolenat, dan asam stearat merupakan senyawa yang terkandung dari ekstrak n-heksana daun ketapang (Jaziroh, 2008). Menurut Zakir et al. (2014) ekstrak air rebusan dari daun ketapang mengandung senyawa fenolik, flavonoid, dan steroid. Senyawa fenolik yang diperkirakan adalah jenis tanin. Tanin yang terkandung dalam daun ketapang sebanyak 10,57 mg/g (Annegowda et al., 2010). Daun ketapang ditunjukkan pada Gambar 2.
14
Tanin merupakan senyawa polifenolik kompleks yang dihasilkan oleh polimerisasi fenol sederhana (Rangari, 2007). Menurut Hagerman (2002) tanin mempunyai sifat kimia antara lain merupakan senyawa kompleks dalam bentuk campuran polifenol yang sulit dipisahkan, gugus fenol yang terkandung dalam tanin mempunyai aksi antiseptik, adstrigensia dan pemberi warna. Tanin merupakan senyawa yang dapat diidentifikasi dengan kromatografi. Adapun sifat fisika tanin antara lain apabila dilarutkan ke dalam air akan membentuk koloid, memiliki rasa asam dan sepat serta akan mengendap apabila dicampur dengan alkaloid dan gelatin.
Tanin terhidrolisis (hydrolysable tannins) dan tanin terkondensasi (condensed tannins) merupakan dua golongan tanin berdasarkan reaksi hidrolitik yang terlibat dalam strukturnya dan sifat inti fenolik yang terlibat dalam struktur tanin. Tanin terkondensasi biasanya berisi inti fenolik yang berhubungan dengan flavonoid, dan secara biosintesis dikaitkan dengan flavonoid. Adapun tanin terhidrolisis dapat terurai oleh asam mineral atau enzim seperti tanase. Jenis tanin tersebut biasanya mempunyai struktur yang melibatkan beberapa molekul dari asam polifenolik seperti asam galat dan asam heksahidrodifenat yang terikat oleh ikatan ester pada molekul glukosa pusat (Rangari, 2007).
15
Gambar 3. Struktur Molekul Tanin (Zakir et al., 2014)
4. Biosintesis Nanopartikel Perak
Secara garis besar sintesis nanopartikel perak dapat dilakukan dengan 2 metode yaitu metode down (fisika) dan metode bottom-up (kimia). Metode top-down merupakan metode yang dilakukan secara mekanik, yaitu dimulai dari bentuk
padatan logam perak kemudian dilakukan proses penghancuran dan penggilingan sehingga dihasilkan dimensi bahan dengan ukuran nanometer. Adapun metode bottom-up merupakan metode yang melalui proses reduksi kimia, yaitu dengan mereaksikan garam perak, agen pereduksi serta penstabil (Wahyudi & Rismayani, 2008).
16
mengembangkan suatu metode sintesis yang lebih aman dan ramah lingkungan, dikenal dengan green synthesis.
Green synthesis atau biosintesis memanfaatkan mikroorganisme dan ekstrak tanaman untuk sintesis, prinsip ini sejenis dengan metode bottom-up dan akan terjadi reaksi reduksi. Fitokimia tanaman dengan antioksidan merupakan senyawa yang bertanggung jawab sebagai pereduksi logam menjadi nanopartikel. Adapun pada mikroba, enzim dalam mikroba tertentu yang dapat menjadi agen pereduksi (Prathna et al., 2010).
Salah satu tanaman yang dapat digunakan untuk preparasi nanopartikel perak adalah daun ketapang (Terminalia catappa) (Lembang et al., 2013). Sintesis nanopartikel perak yang dilakukan dengan metode reduksi menggunakan daun ketapang (Terminalia catappa) yang berfungsi sebagai agen pereduksi adalah daun ketapang (Terminalia catappa) dan prekursor yang biasanya digunakan adalah AgNO3.
17
Proses yang mungkin terjadi pada pembentukan nanopartikel perak adalah terbentuknya polimer Ag kemudian terhidrolisis sehingga terbentuk inti Ag seperti pada skema berikut:
Ag+ Ag-Ag Inti Ag AgNP Koloid
Pembentukan koloid berhubungan dengan munculnya inti dalam kondisi yang jenuh. Setelah itu terbentuk nanopartikel Ag yang akan tumbuh menjadi koloid (Zakir et al., 2005). Kemampuan suatu tanaman dalam mereduksi ion logam mempunyai ketebatasan, efisiensi dari sintesis nanopartikel logam tergantung pada potensial elektrokimia dari ion yang direduksi. Ekstrak tanaman secara efektif mereduksi ion logam lebih signifikan pada ion yang mempunyai potensial elektrokimia positif yang tinggi seperti Ag+ (Haverkamp & Marshall dalam Makarov et al., 2014).
18
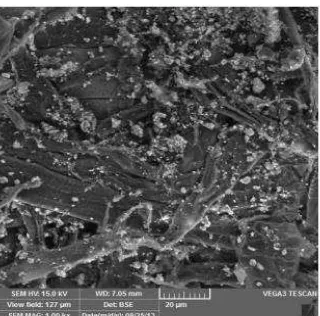
Gambar 4. Analisis Morfologi Nanopartikel Perak Menggunakan SEM dengan Pembesaran 2000 Kali (Skala 20 µm)
Morfologi nanopartikel perak dianalisis dengan SEM berwarna putih yang berada di antara serat kertas.
Nanopartikel perak seringkali mengalami agregasi dan membentuk ukuran yang besar. Ketika akan dikarakterisasi dan diaplikasikan ke dalam sebuah sampel stabilitas nanopartikel perak merupakan hal yang sangat penting. Pencegahan yang dapat dilakukan agar tidak terjadi agregasi adalah dengan penambahan stabilizer (Haryono et al., 2008). Polimer merupakan stabilizer yang paling efektif, hal tersebut dikarenakan polimer dapat mencegah terjadinya aglomerasi. Polivinilalkohol (PVA) merupakan salah satu senyawa polimer yang dapat menstabilkan nanopartikel perak (Bakir, 2011).
5. Senyawa HDTMS
19
“OR” dapat berupa metoksi atau etoksi. Gugus substituen “R” dapat berikatan dengan senyawa anorganik, dan pada gugus Si(OR)3 dapat mengikat senyawa organik secara bersamaan. Senyawa silan dapat diaplikasikan sebagai adhesi promoters, coupling agent, crosslinking agent, dispersing agents, dan surface modifiers (Goyal, 2006). Menurut Khalilabad & Yazdanshenas (2013) senyawa silan juga mempunyai kemampuan untuk menurunkan energi permukaan pada suatu material. Penurunan energi permukaan akan mengakibatkan permukaan material mempunyai sudut kontak yang semakin besar.
Senyawa heksadesiltrimetoksisilan (HDTMS) merupakan salah satu senyawa turunan silan yang mengandung gugus alkoksida dan rantai panjang alkil dengan jumlah karbon 16 (–C16). Senyawa HDTMS merupakan “amphiphilic molecule” dengan bagian kepala bersifat hidrofilik yang terdiri atas atom pusat silikon mengikat tiga gugus (-OCH3), serta bagian ekor bersifat hidrofobik yang berupa rantai lurus gugus alkil yang terdiri dari 15 gugus (-CH2) dan 1 gugus (-CH3) pada bagian ujung rantai (Dhotel, 2010). Struktur senyawa HDTMS ditunjukkan pada Gambar 5.
Gambar 5. Struktur Senyawa HDTMS
6. Spektrofotometer UV Vis
20
daerah ultraviolet dan daerah tampak menyebabkan eksitasi elektron ikatan (Khopkar, 2003). Absorbansi material dianalisis sebagai fungsi panjang gelombang. Spektrofotometer UV-Vis dapat menganalisis pada rentang panjang gelombang 200-900 nm (Gullapalli & Barron, 2010).
Menurut Solomon (2007) spektrofotometer UV-Vis dapat digunakan untuk mengetahui karakteristik unik dari suatu nanopartikel. Saat terbentuk nanopartikel perak, spektrum serapan UV-Vis akan menunjukkan puncak absorbansi pada kisaran panjang gelombang antara 400–500 nm. Nilai absorbansi hasil dari spektrofotometer akan menunjukkan secara kualitatif jumlah dari nanopartikel perak yang terbentuk, sedangkan panjang gelombang dari absorbansi maksimal (nm) dapat menunjukkan ukuran dari suatu nanopartikel perak yang dihasilkan. Semakin besar panjang gelombang maksimum maka ukuran nanopartikel perak yang dihasilkan juga akan semakin besar seperti yang ditampilkan pada Tabel 2.
21
menggunakan ekstrak daun ketapang dengan penambahan larutan PAA 1% sekitar 436,5 - 440,5 nm. Adapun absorbansi maksimum larutan AgNO3 1 x 10-3 M terjadi pada panjang gelombang 218 nm.
7. Sudut Kontak
Sudut kontak merupakan sudut yang dibentuk antara permukaan material uji dengan cairan yang diteteskan ke permukaan material uji tersebut. Sudut kontak berkaitan dengan karakteristik permukaan suatu bahan yaitu sifat menyerap air (hydrophilic) atau sifat tolak air (hydrophobic) (Darmawan et al., 20011). Karakteristik pengukuran sudut kontak bersifat tidak merusak bahan uji dan tidak banyak merubah karakteristik kimia dan fisika bahan. Pengukuran sudut kontak juga merupakan salah satu metode yang tepat jika digunakan untuk mempelajari atau mengembangkan fenomena pembasahan (ASTM Committee, 2004).
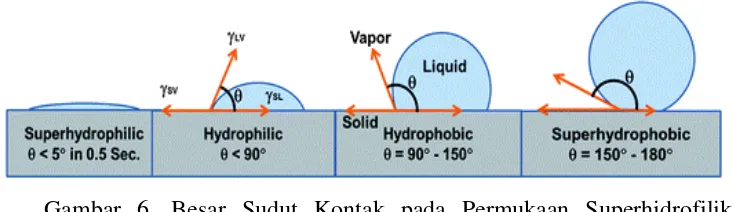
Pengukuran sudut kontak dari suatu permukaan material uji akan memberikan informasi mengenai sifat permukaan material tersebut, apakah bersifat hidrofobik, hidrofilik atau bahkan superhidrofobik, superhidrofilik. Seperti yang ditunjukkan pada Gambar 6, suatu material yang permukaannya mempunyai sudut kontak kurang dari 90o maka material tersebut bersifat hidrofilik, dan apabila sudut kontaknya kurang dari 5o dapat dikatakan bahwa material tersebut bersifat superhidrofilik. Material dikatakan bersifat hidrofobik apabila permukaannya mempunyai sudut kontak lebih besar dari 90o. Secara teoritis sudut kontak maksimal untuk permukaan yang halus adalah 120o, namun permukaan dengan micro-texture atau micro-patterned yang bersifat hidrofobik dapat mempunyai
22
150o tersebut dikatakan bersifat superhidrofobik yang mirip dengan “lotus effect” (Barry, 2006).
Gambar 6. Besar Sudut Kontak pada Permukaan Superhidrofilik, Hidrofilik, Hidrofobik dan Superhidrofobik
Sudut kontak dapat diperoleh melalui pengukuran menggunakan suatu alat yaitu teleskop Goniometer. Alat tersebut mempunyai kelebihan yaitu pengukuran dapat dilakukan secara sederhana, bahan sampel cairan (mikroliter) dan padatan (millimeter persegi) dibutuhkan dalam skala kecil. Selain dengan menggunakan alat terdapat dua metode untuk mengukur sudut kontak, yaitu metode pengukuran sudut kontak statis dan metode pengukuran sudut kontak dinamis. Metode sessile drop dan metode captive bubble merupakan metode pengukuran sudut kontak statis. Adapun pengukuran sudut kontak dinamis dapat dilakukan dengan menggunakan metode Wilhelmy plate yang ilustrasinya ditunjukkan pada Gambar 7 (Wenten et al., 2015).
23
Metode sessile drop, sebuah tetes cairan ditempatkan pada permukaan membran uji, kemudian sudut kontak (θ) antara permukaan padat dan tangen terhadap permukaan cairan pada titik kontak diukur. Membran uji harus dikeringkan terlebih dahulu karena kehadiran air dalam strukur mengubah harga sudut kontak (Wenten et al., 2015).
Pengukuran sudut kontak menggunakan metode sessile drop, pernah dilakukan Darmawan et al. (2011) yaitu dengan meneteskan sejumlah tertentu air ke permukaan bahan uji, selanjutnya tetesan yang telah berada pada permukaan difoto untuk menentukan sudut kontaknya pada kedua bagian tepi. Besarnya sudut kontak permukaan bahan terhadap tetesan air diukur menggunakan busur derajat seperti pada Gambar 8.
Gambar 8. Profil Tetesan Air
Besarnya sudut kontaknya dapat dihitung menggunakan persamaan (1).
sudut kontak =sudut kontak kiri + sudut kontak kanan… … … … .
24
senyawa metiltrimetoksisilan (MTMS) dan dihasilkan nilai sudut kontaknya sebesar 95°. Wang et al. (2010) menambahkan senyawa TEOS/HETMS pada serat poliester, katun dan woll, menghasilkan nilai sudut kontak secara bertutut-turut pada ketiga serat tersebut sebesar 174°, 172° dan 172,6º. Khalilabad & Yazdanshenas (2010) menambahkan senyawa octyltriethoxysilane pada serat katun, nilai sudut kontak yang dihasilkan sebesar 151°.
8. Bakteri Uji
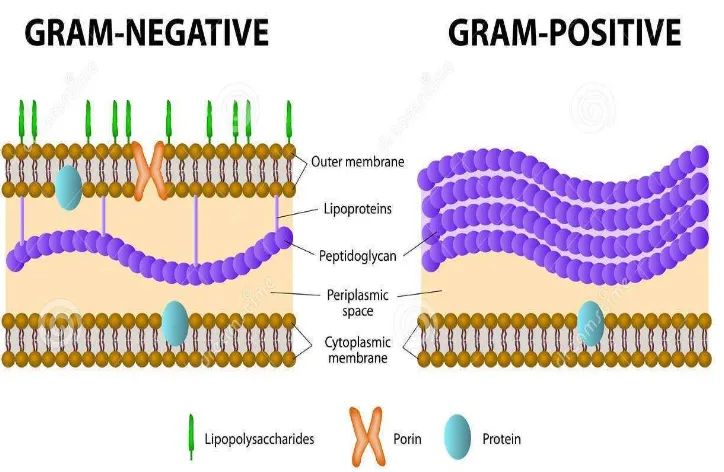
Berdasarkan perbedaan dalam hal menyerap warna bakteri dapat dibagi menjadi dua golongan, yaitu bakteri gram positif dan bakteri gram negatif. Kristal violet yang menyebabkan warna ungu merupakan zat warna pertama yang terserap oleh bakteri gram positif, sedangkan safranin yang menyebabkan warna merah merupakan zat warna kedua yang terserap oleh bakteri gram negatif (Dwidjoseputro, 1998: 17).
25
Gambar 9. Dinding Sel Bakteri Gram Positif dan Bakteri Gram Negatif (https://thumbs.dreamstime.com)
a. Escherichia coli
Bakteri Escherichia coli merupakan salah satu jenis spesies utama bakteri gram negatif yang berbentuk batang pendek, selnya berukuran 1,1-1,5µ m x 2,0-6,0µm, bakteri ini dapat tumbuh dengan mudah pada medium nutrien sederhana. E. coli mempunyai motil dengan flagellum peritrikus atau nonmotil (Pelczar &
Chan, 1988 : 949).Klasifikasi dari bakteri Escherichia coli disajikan pada Tabel 3. Tabel 3. Klasifikasi Bakteri Escherichia coli
Kingdom Bacteria
Phylum Proteobacteria
Class Gamma Proteobacteria
Ordo Enterobacteriales
Falimy Enterobacteriaceae
Genus Escherichia
26
Menurut Melliawati (2009) Escherichia coli merupakan bakteri yang dapat tumbuh baik pada temperatur antara 8° - 46°C dan temperatur optimumnya 37°C. Bakeri ini tidak akan segera mati melainkan akan berada pada keadaan tidur atau dormancy apabila berada di bawah temperatur minimum atau sedikit di atas temperatur maksimumnya. E coli biasanya dijumpai secara sendiri sendiri, berpasang-pasangan dan rangkaian pendek. Bakteri ini bergerak ataupun tidak bergerak dengan menggunakan flagella peritrik.
Escherichia coli merupakan salah satu penghuni tubuh, yaitu selalu ada dalam saluran pencernaan (usus besar) hewan dan manusia secara alamiah. Di dalam saluran pencernaan E coli mempunyai peranan cukup penting menghasilkan kolisin yang dapat melindungi saluran pencernaan dari bakteri patogen. Akan tetapi bakteri tersebut juga dapat membahayakan kesehatan, yaitu galur-galur tertentu dari bakteri tersebut dapat menyebabkan gastroenteritis taraf sedang sampai parah pada manusia dan hewan. Selain itu apabila bakteri E coli berpindah dari habitatnya yang normal ke bagian lain dalam inang, bakteri ini akan menjadi sangat patogen, misalnya masuk ke dalam saluran kandung kemih kelamin maka akan menyebabkan sintitis yaitu suatu peradangan pada selaput lendir organ tersebut (Melliawati, 2009).
27
dan lapisan luar merupakan lipopolisakarida. Adapun membran sel terdiri dari dua lapis fosfolipid (Purwoko, 2007: 21).
b. Staphylococcus aureus
Bakteri Staphylococcus aureus merupakan salah satu bakteri gram positif, bakteri ini berbentuk spheris dengan susunan bergerombol atau berpasangan seperti buah anggur dan kadang membentuk rantai yang pendek. Sel dari bakteri ini mempunyai diameter sekitar 0,8-1µm. Staphylococcus aureus bersifat fakultatif aerobik yaitu dapat tumbuh dengan baik dengan adanya oksigen, tetapi dapat pula tumbuh tanpa adanya oksigen. Bakteri ini dapat tumbuh pada rentang suhu yang luas serta dalam media yang mengandung garam 10% atau lebih. Sekitar 40% orang dewasa normal mempunyai S. Aureus, bakteri ini sering dijumpai pada selaput hidung dan tenggorokan (Budiharta & Drastini, 1988). Klasifikasi dari bakteri Staphylococcus aureus disajikan pada Tabel 4.
Tabel 4. Klasifikasi Bakteri Staphylococcus aureus
Domain Bacteria
Phylum Firmicutes
Class Bacilli
Ordo Bacillales
Falimy Staphylococcaceae
Genus Staphylococcus
Species Staphylococcus aureus
28
adalah 35º - 40ºC. Staphylococcus aureus akan berasosiasi dengan kulit, kelenjar kulit dan selaput lendir hewan berdarah panas. Kisaran inangnya luas serta banyak galur dari S aureus yang merupakan patogen potensial.
Bakteri gram positif dinding selnya mengandung peptidoglikan dan komponen khusus yang utama adalah asam teikoat yang menempati 50% berat kering dinding sel dan 10% berat kering seluruh sel. Selain dua komponen tersebut beberapa bakteri gram positif mengandung polisakarida. Asam teikoat merupakan suatu polimer yang larut dalam air dan merupakan penyusun utama antigen permukaan dari spesies bakteri gram positif (Brooks et al., 2005).
6. Aktivitas Antibakteri
Logam perak telah lama diketahui mempunyai aktivitas antibakteri. Perak dalam bentuk ionnya mempunyai kemampuan menghambat pertumbuhan bakteri semakin kuat, dan dengan adanya nanoteknologi partikel perak dapat dibuat menjadi partikel berukuran nano. Nanopartikel perak secara kimia lebih reaktif dan lebih mudah terionisasi serta luas permukaan terhadap volume semakin meningkat sehingga kemampuan antibakteri dari nanopartikel perak menjadi lebih kuat (Haryono et al., 2008).
Menurut Davidson & Taylor (2007) mekanisme dari suatu senyawa yang bersifat antibakteri dalam menghambat atau menghentikan pertumbuhan suatu bakteri berbeda-beda, secara umum penghambatan mikroba oleh suatu senyawa antibakteri dapat disebabkan oleh beberapa hal antara lain :
29
b. Reaksi dengan membran sel yang dapat mengakibatkan perubahan permeabilitas dan kehilangan komponen penyusun sel.
c. Penghambatan terhadap sintesis protein. d. Gangguan fungsi material genetik.
Mekanisme yang tepat dari senyawa perak dalam menghambat pertumbuhan bakteri belum sepenuhnya dipahami. Menurut Feng et al. (2000) mekanisme antibakteri dari nanopartikel perak adalah sebagai berikut :
a. Nanopartikel perak melepaskan ion Ag+.
b. Ion perak (Ag+)berinteraksi dengan gugus tiol sulfidril (-SH) pada protein permukaan.
c. Ion Ag+ akan menggantikan kation hidrogen (H+) dari gugus tiol sulfidril menghasilkan gugus S-Ag yang lebih stabil pada permukaan sel bakteri, hal ini akan menonaktifkan protein, dan menurunkan permeabilitas membran.
d. Selanjutnya, senyawa perak akan memasuki sel dan mengubah struktur DNA sehingga pada akhirnya menyebabkan kematian sel.
30
Pengukuran diameter zona hambat atau zona bening digunakan sebagai indikator keefektifan zat antibakteri dalam menghambat aktivitas bakteri. Terbentuknya zona bening di sekitar sampel dikarenakan tidak adanya aktivitas bakteri atau bakteri tidak tumbuh pada daerah tersebut. Semakin besar zona bening maka semakin efektif aktivitas zat antibakteri dalam menghambat pertumbuhan bekteri. Diameter zona bening yang semakin besar menunjukkan bahwa semakin banyak bakteri yang rusak dan mati akibat berinteraksi dengan nanopartikel perak (Khalilabad & Yahdanshenas, 2010).
Sensitifitas antibakteri terhadap senyawa mikroba dipengaruhi oleh fase pertumbuhan dari bakteri itu sendiri. Bakteri yang memasuki fase stasioner akan lebih sensitif terhadap zat antibakteri (Thompson, 1996). Fase mildog yaitu pertengahan fase logaritmik (eksponensial) merupakan saat yang tepat pengujian antibakteri dilakukan. Pada fase tersebut bakteri sedang aktif membelah diri, sehingga senyawa antibakteri dapat dilihat dengan adanya kematian atau hambatan pada pertumbuhan bakteri (Ningtyas, 2010).
31
B. Penelitian yang Relevan
Pembuatan nanopartikel perak yang dilakukan olah Lembang et al. (2013) dengan metode reduksi menggunakan bioreduktor ekstrak daun ketapang (Terminalia catappa) untuk prekursor AgNO3 menunjukkan serapan maksimum UV-Vis pada panjang gelombang 421 - 431 nm dengan ukuran nanopartikel perak yang terbentuk 62,61 nm untuk nanopatikel perak hasil biosintesis tanpa pengadukan. Adapun hasil biosintesis nanopartikel perak dengan pengadukan dan biosintesis dengan penambahan PAA 1% menghasilkan serapan maksimum pada panjang gelombang 425 - 431 nm dan 440,5 - 436,5 nm, ukuran nanopartikel peraknya 71,56 nm dan 55,77 nm. Pengukuran dilakukan setelah tujuh hari penyimpanan, dan ukuran nanopartikel perak diketahui dengan analisis menggunakan PSA (Particle Size Analyzer).
Nursyamsi et al. (2014) melakukan penelitian tentang pemanfaatan fraksi etil asetat daun ketapang (terminalia catappa) sebagai bioreduktor dalam sintesis nanopartikel perak dan analisis sifat antibakterinya. Hasilnya nanopartikel perak dapat disintesis dengan metode reduksi menggunakan fraksi etil asetat daun ketapang (Terminalia catappa) dan nanopartikel perak dapat menghambat aktivitas bakteri Staphylococcus aureus, Eschericia coli, dan Bacillus Subtilis dengan diameter zona hambat masing-masing adalah 7,2 mm, 6,9 mm dan 6,6 mm pada
inkubasi selama 48 jam.
Haryano et al. (2010) melakukan penelitian mengenai efek antimikroba dari
32
berbeda, 30 detik, 10 menit, dan 24 jam. Serat yang dihasilkan semuanya mempunyai kemampuan antimikroba terhadap bakteri uji Staphylococcus aureus. Penelitian yang hampir serupa juga dilakukan oleh Montazer (2012) mengenai stabilisasi nanopartikel perak pada serat Nylon menggunakan dua bakteri uji yaitu Escherichia coli dan Staphylococcus aureus. Pada penelitian tersebut juga terbukti
bahwa serat Nylon yang terdeposit nanopartikel perak bersifat antimikroba dan mampu menghambat pertumbuhan kedua mikroba tersebut.
Penelitian yang dilakukan oleh Xue et al. (2012) untuk memperoleh tekstil dengan sifat permukaan yang superhidrofobik dan antibakteri berhasil dilakukan.
Xue et al. menggunakan serat katun dan dimodifikasi dengan penambahan
nanopartikel perak dan senyawa HDTMS, hasilnya adalah permukaan serat katun bersifat superhidrofobik dengan sudut kontak 151,5o±1,4o dan juga bersifat antibakteri terhadap bakteri Escherichia coli.
C. Kerangka Berpikir
33
adapun untuk membuat kain bersifat hidrofob dapat ditambahkan suatu senyawa silan pada kain.
Nanopartikel yang digunakan dalam penelitian ini adalah nanopartikel perak, sedangkan senyawa silan yang digunakan adalah senyawa heksadesiltrimetoksisilan (HDTMS). Beberapa penelitian telah mengungkapkan bahwa nanopartikel perak mempunyai kemampuan sebagai agen antimikroba. Nanopartikel perak dapat diperoleh dengan beberapa metode, salah satunya adalah metode reduksi kimia. Pada penelitian ini nanopartikel perak diperoleh dari proses reduksi kimia tetapi menggunakan prinsip biosintesis, jadi zat pereduksi yang digunakan bukan dari zat kimia tetapi berasal dari tanaman. Daun ketapang (Terminalia catappa) merupakan tanaman yang digunakan sebagai zat pereduksi pada penelitian ini, karena adanya suatu senyawa pereduksi yang terkandung dalam daun ketapang (Terminalia catappa). Keberhasilan nanopartikel perak yang terbentuk dikarakterisasi menggunakan spektrofotometer UV-Vis.
34
35
BAB III
METODE PENELITIAN
A. Subjek dan Objek Penelitian
1. Subjek
Subjek dalam penelitian ini adalah kain Nylon 6,6 tanpa dimodifikasi, kain Nylon 6,6 dengan penambahan nanopartikel perak, kain Nylon 6,6 dengan penambahan HDTMS, kain Nylon 6,6 dengan penambahan nanopartikel perak dilanjutkan penambahan HDTMS, dan kain Nylon 6,6 dengan penambahan HDTMS dilanjutkan penambahan nanopartikel perak.
2. Objek
Objek dalam penelitian ini adalah karakteristik nanopartikel perak, aktivitas antibakteri, dan sudut kontak.
B. Variabel Penelitian
1. Variabel bebas
36 2. Variabel terikat
Variabel terikat dalam penelitian ini adalah aktivitas antibakteri, dan sudut kontak kain.
3. Variabel kontrol
Variabel terkontrol pada penelitian ini adalah temperatur reduksi, konsentrasi AgNO3 yang digunakan, jenis tanaman pereduksi AgNO3, dan media pertumbuhan bakteri.
37
h. Escherisia coli ATCC 35218
i. Staphylococcus aureus ATCC
25923 j. Etanol
k. Polivinil Alkohol (PVA) l. Aseton
2) Memindahkan larutan ke dalam labu takar 250 mL, tambahkan akuades hingga batas dan homogenkan.
b. Pembuatan Larutan PVA 1%
Larutan PVA 1% dibuat dengan cara melarutkan 1 gram padatan PVA dalam 100 mL akuades, campuran diaduk hingga semua PVA larut.
c. Ekstraksi Daun Ketapang (Terminalia catappa)
38
2) Masukkan daun ketapang (Terminalia catappa) segar tersebut ke dalam gelas beker 500 mL kemudian tambahkan 100 mL akuades dan merebusnya. Angkat setelah mendidih dan diamkan sampai suhu kamar.
3) Menyaring air rebusan daun ketapang (Terminalia catappa) yang sudah dingin menggunakan kertas saring Whatman No. 42.
d. Sintesis Nanopartikel Perak
1) Memasukkan 1 mL ekstrak daun ketapang (Terminalia catappa) ke dalam Erlenmeyer, tambahkan 40 mL larutan perak nitrat 1x10-3 M. Larutan didiamkan selama 2 jam agar bereaksi.
2) Menambahkan 12 mL larutan PVA 1% ke dalam campuran ekstrak daun ketapang (Terminalia catappa) + larutan AgNO3 1x10-3 M, selanjutnya larutan diaduk selama 2 jam.
3) Mendiamkan larutan yang sudah diaduk selama 3 hari agar terbentuk koloid nanopartikel perak, setelah 3 hari koloid dikarakterisasi menggunakan spektrofotometer UV-Vis.
2. Deposit Nanopartikel Perak pada Kain Nylon 6,6
39
Erlenmeyer 100 mL kemudian digoyang menggunakan shaker dengan kecepatan 155 rpm selama 24 jam, selanjutnya kain dikeringkan pada suhu ruang sehingga diperoleh kain N-Ag atau N1.
3. Hidrofobisasi atau Modifikasi Permukaan Kain Nylon 6,6 dengan HDTMS Membuat larutan etanol HDTMS 4% dengan cara memasukkan 10 mL larutan HDTMS dalam labu takar 250 mL kemudian menambahkan etanol hingga batas dan homogenkan, selanjutnya larutan diaduk selama 6 jam. Hidrofobisasi permukaan kain Nylon 6,6 dilakukan dengan cara merendam kain dalam larutan etanol HDTMS 4% dalam Erlenmeyer 100 mL kemudian digoyang menggunakan shaker dengan kecepatan 155 rpm selama 1 jam, selanjutnya kain dikeringkan pada suhu ruang.
Secara keseluruhan terdapat lima variasi kain Nylon 6,6 pada penelitian ini yang disajikan pada Tabel 5.
40
menggunakan kamera dengan pengaturan kontras, cahaya dan fokus yang disesuaikan. Selanjutnya hasil foto diolah menggunakan Corel Draw versi X4 dengan Angular Dimension Tool dapat diketahui sudut kontaknya secara otomatis.
5. Uji Aktivitas Antibakteri
a. Sterilkan semua alat yang akan digunakan. b. Pembuatan media padat Nutrient Agar (NA)
1) Menimbang 14 gram Nutrient Agar (NA) dan masukkan ke dalam gelas beker 1000 mL.
2) Masukkan 500 mL aquades ke dalam gelas beker yang berisi Nutrient Agar (NA) kemudian panaskan hingga mendidih dan larutan menjadi bening.
3) Memindahkan Nutrient Agar (NA) kedalam erlenmeyer, tutup menggunakan kapas dan kertas payung kemudian autoklaf media padat tersebut.
c. Pembuatan media cair Nutrient Broth (NB)
Menimbang 1,3 gram Nutrient Broth (NB) dan masukkan ke dalam Erlenmeyer 250 mL. Menambahkan 100 mL aquades ke dalam Erlenmeyer tersebut, tutup menggunakan kapas dan kertas payung kemudian sterilisasi dengan autoklaf.
d. Membuat media padat Nutrient Agar (NA) miring
41
menggunakan kapas dan miringkan tabung reaksi tersebut. Biarkan 24 jam pada suhu ruang.
e. Meremajakan bakteri Escherichia coli ATCC 35218 dan Staphylococcus aureus ATCC 25923 pada media padat Nutrient Agar (NA) miring
Mengambil satu ose kolong bakteri dari isolat induk kemudian dipindahkan ke media padat Nutrient Agar (NA) miring yang telah dibuat dengan cara menyayat tipis rapat secara zig zag dari bawah sampai atas pada media miring. Selanjutnya bakteri diinkubasi selama 24 jam pada suhu ruang. Proses pengambilan bakteri dilakukan dalam LAF (Laminar Air Flow) untuk menghindari kontaminan.
f. Menginokulasi bakteri Escherichia coli ATCC 35218 dan Staphylococcus aureus ATCC 25923 pada media cair Nutrient Broth (NB)
Mengambil bakteri Escherichia coli ATCC 35218 dan Staphylococcus aureus ATCC 25923 yang telah diremajakan pada media padat Nutrient Agar
(NA) miring menggunakan ose kolong. Sebanyak 3 ose penuh diinokulasi ke dalam media cair Nutrient Broth (NB) yang telah dibuat sebelumnya, proses ini dilakukan di dalam LAF (Laminar Air Flow). Selanjutnya inkubasi pada suhu ruang sambil digoyang dengan shaker pada kecepatan ±130 rpm selama 24 jam. g. Membuat Media Padat Nutrient Agar (NA) dalam Cawan Petri
42
h. Menginokulasi Bakteri Escherichia coli ATCC 35218 dan Staphylococcus aureus ATCC 25923 pada Media Padat Nutrient Agar (NA)
Inokulasi mikroba dalam media padat NA menggunakan metode spread plate. Mengambil sebanyak 100 L biakan dalam media cair Nutrient Broth
(NB) kemudian dipindahkan dalam cawan petri menggunakan tip pipet secara aseptik dan ratakan menggunakan drygalsky.
i. Sampel kain Nylon, yaitu N, Ag, HDTMS, Ag-HDTMS, dan N-HDTMS-Ag dipotong bulat menggunakan pelubang kertas (diameter ±0,6 cm) dan diletakkan di atas biakan mikroba dalam cawan petri, selanjutnya diinkubasi pada suhu ruang selama 24 jam. Pengukuran zona bening dilakukan setelah 24 jam inkubasi menggunakan jangka sorong.
E. TEKNIK ANALISIS DATA
Data yang diperoleh dari penelitian ini berupa hasil analisis menggunakan Spektroskopi UV-Vis, uji sudut kontak, dan uji antibakteri.
1. Spektrofotometri UV-Vis
Spektofotometri UV-Vis digunakan untuk mengetahui keberhasilan pembentukan nanopartikel perak. Koloid nanopartikel perak yang terbentuk dikarakterisasi menggunakan spektrofotometer UV-Vis dilakukan pada rentang panjang gelombang 200-600 nm. Menurut literatur reduksi ion perak dengan
menggunakan ekstrak daun ketapang terlihat secara fisik dari perubahan warna
larutan yaitu dari tidak berwarna menjadi coklat sampai coklat kehitaman dan pada
43
memberikan puncak pada panjang gelombang di sekitar 400-500 nm yang
merupakan puncak serapan khas nanopartikel perak. 2. Sudut Kontak
Sudut kontak digunakan untuk penentuan sifat hidrofob suatu permukaan. Hasil uji sudut kontak menggunakan metode sesille drop diperoleh garis dasar tetesan air pada permukaan kain.
Adapun besar sudut kontak ditentukan dengan perhitungan sudut kontak rata-rata menggunakan persamaan (1).
sudut kontak =sudut kontak kiri + sudut kontak kanan… … … … .
Suatu material dikatakan memiliki permukaan hidrofob bila sudut kontaknya lebih dari 90o dan bila sudut kontaknya lebih dari 150o maka permukaan material tersebut disebut superhidrofob.
3. Uji Antibakteri
Proses pengujian aktivitas antibakteri S. aureus dan E. coli pada sampel kain
N, N-Ag, N-HDTMS, N-Ag-HDTMS dan N-HDTMS-Ag dilakukan dengan
mengukur diameter zona bening yang terlihat sekitar kain Nylon 6,6. Terbentuknya
zona bening pada kain Nylon 6,6 diakibatkan karena adanya aktivitas antibakteri
pada daerah tersebut, sehingga dapat dikatakan bahwa bakteri S. aureus dan E. coli
tidak tumbuh pada daerah zona bening. Semakin efektif penghambatan bakteri pada
44
Setelah dilakukan pengukuran diameter zona bening terhadap kelima sampel,
hasil pengukuran dianalisis menggunakan uji statistik Anova, dilanjutkan dengan
uji Least Significant Different (LSD) dan uji t-independent menggunakan program
45 BAB IV
HASIL DAN PEMBAHASAN
A. Hasil Penelitian
1. Sintesis dan Karakterisasi Nanopartikel Perak
Sintesis nanopartikel perak dilakukan menggunakan metode reduksi dengan
prinsip biosintesis menggunakan ekstrak daun ketapang (Terminalia catappa). Daun ketapang (Terminalia catappa) digunakan sebagai agen pereduksi untuk
mereduksi larutan perak nitrat (AgNO3) 1 x 10-3 M serta ditambahkan larutan PVA 1% yang berfungsi sebagai penstabil. Ekstrak daun ketapang (Terminalia catappa) dihasilkan melalui perebusan, selanjutnya disaring menggunakan kertas saring Whatman No. 42 yang ditunjukkan pada Gambar 10.
Gambar 10. Ekstrak Daun Ketapang (Terminalia catappa)
46
Hal tersebut menunjukkan telah terjadinya proses reduksi perak nitrat dan telah terbentuk koloid nanopartikel perak yang ditunjukkan pada Gambar 11.
(a) (b)
(c) (d)
Gambar 11. Larutan Ekstrak Daun Ketapang (Terminalia catappa) + Larutan AgNO3 1 x 10-3 M + PVA (a) Awal Pembuatan (b) 2 Jam (c) 1 Hari (d) 3 Hari
47 (a)
(b)
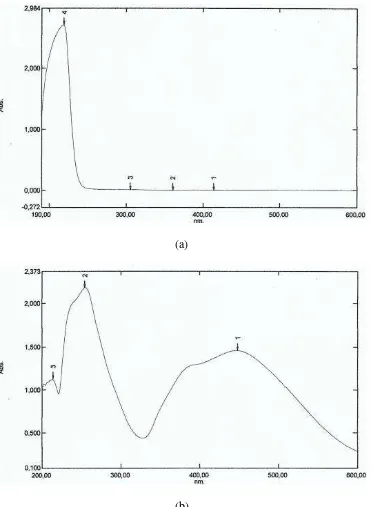
Gambar 12. Spektrum UV-Vis (a) Larutan AgNO3 1x10-3 M dan (b) Koloid Nanopartikel Perak Hasil Sintesis
48
koloid nanopartikel perak, pada gambar tersebut muncul tiga puncak. Puncak pertama muncul pada panjang gelombang 448,50 nm dengan nilai absorbansi 1,456. Puncak tersebut menunjukkan bahwa Ag+ telah berhasil direduksi menjadi Ag0 oleh ekstrak daun ketapang (Terminalia catappa), hal ini dikarenakan puncak tersebut berada pada panjang gelombang khas dari nanopartikel perak. Adapun puncak kedua yang muncul pada panjang gelombang 254 nm dengan nilai absorbansi 2,184 dan puncak ketiga pada panjang gelombang 214 nm dengan nilai absorbansi 1,127 menunjukkan bahwa masih terdapat ion Ag+ yang belum bisa tereduksi oleh ekstrak daun ketapang (Terminalia catappa) menjadi Ag0.
2. Hasil Modifikasi Kain Nylon 6,6 dengan Penambahan Nanopartikel Perak
dan Senyawa HDTMS
Penelitian ini menghasilkan lima variasi kain Nylon 6,6 yaitu N (N0), N-Ag (N1), N-HDTMS (N2), N-Ag-HDTMS (N3), dan N-HDTMS-Ag (N4). Dari kelima kain tersebut terdapat perbedaan fisik antar satu kain dengan kain lainnya.
Hasil perbedaan fisik kelima kain Nylon 6,6 hasil modifikasi ditunjukkan pada Gambar 13.
49
(d) (e)
Gambar 13. Karakeristik Fisik Kain (a) N0 (b) N1 (c) N2 (d) N3 (e) N4
3. Hasil Uji Sudut Kontak Kain Nylon 6,6
(a) (b)
(c)
(d) (e)
Gambar 14. Uji Sudut Kontak yang Terbentuk (a) N0 (b) N1 (c) N2 (d) N3 (e) N4
N-50
HDTMS (N2), N-Ag-HDTMS (N3) dan N-HDTMS-Ag (N4). Pengukuran dilakukan menggunakan metode sesille drop yang selanjutnya dianalisis menggunakan program Corel Draw. Dihasilkan nilai sudut kontak dari kain Nylon 6,6 seperti pada Gambar 14.
Sudut kontak yang terbentuk dari sisi kanan dan kiri kemudian dirata-rata sehingga menghasilkan sudut kontak dari kain, hasilnya disajikan pada Tabel 6.
Tabel 6. Hasil Pengukuran Sudut Kontak Kain Nylon 6,6 Sampel
Sudut N0 N1 N2 N3 N4
Sudut Kanan 90º 105,7º 119,2º 108,1º 105,3º Sudut Kiri
90º 108,9º 122,3º 104,9º 107,4º Sudut Kontak
(rata-rata) 90º 107,3º 120,75º 106,5º 106,35º
4. Hasil Pengujian Aktivitas Antibakteri Kain Nylon 6,6
a. Hasil Pengukuran Diameter Zona Bening Sampel terhadap
Bakteri Escherichia coli ATCC 35218
51
Gambar 15. Diameter Zona Bening Sampel Kain terhadap Bakteri Escherichia coli ATCC 35218
Pengukuran zona bening dilakukan setelah 24 jam waktu penanaman bakteri. Pengukuran tersebut dilakukan selama 72 jam inkubasi. Data hasil pengamatan zona bening pada sampel N0, N1, N2, N3, dan N4 disajikan pada Tabel 7.
Tabel 7. Hasil Pengamatan Diameter Zona Bening Sampel Kain terhadap Bakteri Escherichia coli ATCC 35218
Berdasarkan hasil pengamatan diameter zona bening sampel kain Nylon 6,6 terhadap bakteri Escherichia coli ATCC 35218 yang disajikan pada Tabel 7 maka
Waktu N0 N1 N2 N3 N4
24 0 0 0 0 0
30 0 0 0 0 0
52
dapat dibuat grafik hubungan antara waktu dengan diameter zona bening yang ditunjukkan pada Gambar 16.
Gambar 16. Grafik Diameter Zona Bening Bakteri Escherichia coli ATCC 35218
b. Hasil Pengukuran Diameter Zona Bening Sampel terhadap Bakteri
Staphylococcus aureus ATCC 25923
53
Gambar 17. Diameter Zona Bening Sampel Kain terhadap Bakteri Staphylococcus aureus ATCC 25923
Pengukuran zona bening dilakukan setelah 24 jam waktu penanaman bakteri. Pengukuran tersebut dilakukan selama 72 jam inkubasi. Data hasil pengamatan zona bening pada sampel N0, N1, N2, N3, dan N4 disajikan pada Tabel 8.
Tabel 8.Hasil Pengamatan Diameter Zona Bening Sampel Kain terhadap Bakteri Staphylococcus aureus ATCC 25923
Waktu N0 N1 N2 N3 N4
24 0 0 0 0 0
30 0 0 0 0 0
42 0,112 0,222 0,192 0,253 0,128 48 0,131 0,244 0,223 0,305 0,215 54 0,147 0,241 0,234 0,282 0,177 60 0,14 0,237 0,189 0,125 0,161 66 0,138 0,217 0,178 0,107 0,156 72 0,172 0,167 0,145 0,067 0,123
54
Tabel 8 maka dapat dibuat grafik hubungan antara waktu dengan diameter zona bening yang ditunjukkan pada Gambar 18.
Gambar 18. Grafik Diameter Zona Bening Bakteri Staphylococcus aureus ATCC 25923
c. Uji Statistika
Data pengukuran diameter zona bening pada sampel kain Nylon 6,6 terhadap bakteri Escherichia coli dan Staphylococcus aureus yang diperoleh dari penelitian ini selanjutnya dilakukan uji statistika menggunakan program SPSS versi 15, uji yang dilakukan meliputi Anova, uji lanjut LSD, dan uji t-Independent. Uji Anova digunakan untuk mengetahui adanya pengaruh jenis sampel, waktu inkubasi, serta interaksi antara sampel dan waktu inkubasi terhadap aktivitas antibakteri, uji lanjut LSD digunakan untuk menentukan signifikasi antara sampel satu dengan sampel lain, sementara uji t-Independent digunakan untuk menentukan adakah perbedaan yang signifikan dalam hal aktivitas antibakteri terhadap bakteri Escherisia coli
55
(gram negatif) dan Staphylococcus aureus (gram positif). Uji statistika yang diperoleh disajikan pada Tabel 9, 10, dan 11.
Tabel 9.Hasil Uji Anova terhadap Diameter Zona Bening (a) Escherichia coli ATCC 35218 dan (b) Staphylococcus aureus ATCC 25923
56
interpretasi nilai p > 0,05 adalah tidak ada pengaruh jenis sampel terhadap aktvitas antibakteri.
Hasil uji Anova terhadap bakteri S. aureus disajikan pada Tabel 9(b). Nilai signifikansi dari uji interaksi antara waktu inkubasi dan jenis sampel adalah 0,174 (p > 0,05), interpretasi nilai p > 0,05 adalah tidak ada pengaruh interaksi antara waktu inkubasi dan jenis sampel terhadap aktivitas antibakteri. Nilai signifikansi dari uji efek waktu inkubasi terhadap aktivitas antibakteri adalah 0,000 (p < 0,05) interpretasi nilai p < 0,05 adalah ada pengaruh waktu inkubasi terhadap aktvitas antibakteri. Sedangkan nilai signifikansi dari uji efek jenis sampel terhadap aktivitas antibakteri adalah 0,009 (p < 0,05) interpretasi nilai p < 0,05 adalah ada pengaruh jenis sampel terhadap aktvitas antibakteri.
Tabel 10. Interpretasi Hasil Uji Lanjut LSD antara Jenis Sampel terhadap Diameter Zona Bening Bakteri Escherichia coli ATCC 35218 dan Staphylococcus aureus ATCC 25923
Variabel (Jenis Sampel) Kesimpulan pada