MAKALAH KOSMETOLOGI
“REGULASI KOSMETIK DI NEGARA MAJU”
OLEH
KELOMPOK VI MUSDAHYANTI NI’MA NURMAGFIRAH
RADIAH ZAINUDDIN RAHMAT RUSMAN
SITTI HARTINA
JURUSAN FARMASI FAKULTAS ILMU KESEHATAN
UNIVERSITAS ISLAM NEGERI ALAUDDIN MAKASSAR 2014
PENDAHULUAN
Negara maju adalah sebutan untuk negara yang menikmati standar hidup yang relatif tinggi melalui teknologi tinggi dan ekonomi yang merata. Kebanyakan negara dengan GDP per kapita tinggi dianggap negara berkembang. Namun beberapa negara telah mencapai GDP tinggi melalui eksploitasi tanpa mengembangkan industri yang beragam, dan ekonomi berdasarkan-jasa tidak dianggap memiliki status 'negara maju.
Organisasi seperti Bank Dunia, IMF, dan CIA, biasanya setuju bahwa sekelompok negara maju termasuk: anggota Uni Eropa (Austria, Belgia, Denmark, Finlandia, Perancis, Jerman, Yunani, Irlandia, Italia, Luxemburg, Belanda, Portugal, Spanyol, Swedia, Britania Raya), negara non-EU (Andorra, Hogaria, Islandia, Liechtenstein, Monako, Norwegia, San Marino, Swiss, Vatikan), negara bukan Eropa (Australia, Kanada, Korea Selatan, Hongkong, Bruneu Darussalam, Israel, Jepang, Kuwait, Selandia Baru, Singapura, Taiwan Amerika Serikat, Uni Emirat Arab, Qatar).
Perkembangan ilmu kosmetik serta industrinya baru dimulai secara besar-besaran pada abad ke-20. Kosmetik menjadi salah satu bagian dunia usaha. Bahkan sekarang tekhologi kosmetik begitu maju dan merupakan paduan antara kosmetik dan obat (pharmaceutical) atau yang disebut kosmetik medik (cosmeceuticals).
berkembang dalam sistem penghantaran obat yang dapat menunjukan efek sistemik. Bahkan sejak lebih kurang 70 tahun lalu sudah diketahui bahwa pekerja di industri kimia zat warna yang kurang memperhatikan aspek perlindungan kerja dapat menderita kanker ginjal. Hal inilah yang pada awalnya menjadi titik pemacu pengembangan sediaan transdermal. Terapi hormon melalui transdermal untuk wanita yang sudah mengalami menopause sudah luas digunakan, dan terapi hormon ini juga untuk tujuan kosmetik (kecantikan dan perawatan kulit). Lalu apa beda kosmetik dengan obat? Perbedaan antara kosmetik dengan obat sangat komplek, kabur karena pengaruh persepsi kosumen, kepentingan perdagangan dan interpretasi status oleh instansi yang mengatur.
Produk kosmetik tunduk pada peraturan perundang-undangan persyaratan di hampir setiap negara industri. Sebuah kosmetik secara umum dapat didefinisikan sebagai “apapun bahan atau persiapan untuk digunakan manusia untuk tujuan membersihkan, mempercantik atau mengubah penampilan umum untuk memasukkan produk perlengkapan mandi pribadi (seperti sampo dan lotion), produk kecantikan dan wewangian”, produk kosmetik tertentu (misalnya shampoo anti ketombe) diklasifikasikan sebagai kosmetik di beberapa negara (misalnya seperti di Uni Eropa, Cina), di negara-negara lain dapat diatur sebagai obat Over-The-Counter (seperti misalnya di Amerika Serikat) atau Quasi-obat (seperti di Jepang).
TINJAUAN PUSTAKA
A. Defenisi Regulasi dan Kosmetik
Regulasi adalah pengendaliaan dengan aturan atau pembatasan. Regulasi dapat dilakukan dengan berbagai bentuk, misalnya: pembatasan hukum diumumkan oleh otoritas pemerintah, regulasi pengaturan diri oleh suatu industri seperti melalui asosiasi perdagangan, co-regulasi dan pasar. Regulasi diamanatkan oleh upaya negara untuk menghasilkan hasil yang tidak mungkin sebaliknya terjadi, memproduksi atau mencegah hasil di tempat yang berbeda dengan apa yang dinyatakan mungkin terjadi, atau memproduksi atau mencegah hasil dalam rentang waktu yang berbeda daripada yang akan terjadi. Dengan cara ini, Regulasi dapat dilihat sebagai artefak laporan pelaksanaan kebijakan.
Kosmetik berasal dari kata Yunani “Kosmetikos” yang berarti keterampilan mengatur dan menghias. Sedangkan menurut Peraturan Menteri Kesehatan RI No. 445/MenKes/Permenkes/1998 adalah sediaan atau paduan bahan yang siap untuk digunakan pada bagian luar badan.
Jadi, dapat disimpulkan bahwa regulasi kosmetik adalah peraturan dan batasan hokum terhadap sediaan kosmetik yang beredar di pasaran oleh pemerintah antara lain batasan tentang bahan baku dan tambahan, proses produksi, packaging atau pengemasan hingga ke tangan konsumen
B. Regulasi Kosmetik Negara Maju
bahan, tapi tentu saja tidak bahan yang sama. Hingga saat ini ada model regulasi tunggal dianggap sebagai terbaik.
dan obat-obatan. Menurut USFDA definisi kosmetik, dan obat rapi dan sederhana. Namun ada satu parameter hukum lebih lanjut yang benar-benar mengacaukan masalah ini, kosmetik yang harus "tidak mempengaruhi struktur dan fungsi kulit." Diferensiasi hukum ini obat dari kosmetik mungkin sesuai untuk keadaan pengetahuan ketika aturan USFDA ditulis, lebih dari setengah abad yang lalu. Sejak itu peningkatan besar dalam pengetahuan tentang fisiologi kulit telah membawa hukum dan biologi ke dalam konflik. Yang benar adalah bahwa semua zat topikal, baik yang sederhana seperti air atau serumit melembabkan multi-bahan, pasti akan mempengaruhi struktur dan fungsi kulit. Tidak ada produk topikal benar-benar lembam. Sekarang semuanya yang diterapkan kulit bisa menjadi obat yang membutuhkan lebih dari satu miliar USD untuk menempatkan produk di pasar. Pada tahun 1938, ide-ide tentang fisiologi kulit yang primitif. Sekarang diketahui bahwa kulit terkena air selama 48 jam menunjukkan pelepasan sitokin, menghasilkan kondisi yang dikenal sebagai dermatitis hidrasi. Di bawah mikroskop elektron, air dapat menghasilkan perubahan dalam Langerhans "sel dan fungsi sel mast. Dermatitis Hidrasi adalah penyakit, tapi air tidak obat. Air adalah lingkungan hidup, tetapi bukan zat berbahaya. Ini mengarah pada perdebatan bahwa setiap formulasi topikal yang membeli di supermarket adalah, oleh hukum, obat. Sejak segala sesuatu yang dioleskan ke kulit menghasilkan perubahan, sehingga ada kebutuhan dari kategori ketiga produk yang dikenal sebagai kosmetikal. Di sebagian besar negara, kategori peraturan cocok untuk hybrid ini Produk tidak ada dan karena itu sebagian besar komplikasi dalam pengembangan pasar muncul dari kurangnya definisi yang jelas dan kerangka hukum konsekuen untuk kosmetikal.
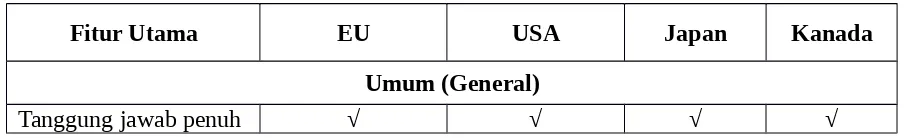
Tabel 1. Perbandingan regulasi kosmetik di pasaran besar
Fitur Utama EU USA Japan Kanada
Umum (General)
pabrik terhadap keamanan produk Otoritas dalam
penguasaan pasar √ √ √ √
Kebebasan distribusi √ √ √ √
Persyaratan pra-pasar
Pemberitahuan produk Tidak diperlukan Sukarela Wajib
Wajib dengan
daftar bahan Pemberitahuan Awal
Produsen Wajib Sukarela Wajib Wajib
Kontrol atas bahan Daftar positif: :
Pewarna, pengawet, UV filter
√ √ √ √
Daftar Negatif : Bahan terlarang dan terbatasi √ √ √ √ Badan penanggungjawab ilmiah Komite ahli yang ditunjuk oleh saran komisi Uni Eropa untuk keamanan bahan Sukarela komite ahli yang diselenggaraka n oleh saran industri pada keamanan bahan Pemerintah pejabat dan ahli (The kosmetik laporan panitia) Pemerinta h pejabat Pemberitahuan bahan
untuk pusat racun √ x x x
Persyaratan Pelabelan
INCI Pelabelan Bahan √ √ √ x
Jumlah Pelabelan Wajib (Metric pelabelan) Wajib (Metric dan non-metrik pelabelan) Wajib (Metrik saja) Wajib (Metric) Tambahan (Non-metric)
produsen/importer pada label
Tanggal kadaluarsa
Tanggal minimum daya tahan < 30
bulan setelah pembukaan daya
tahan > 30 bulan
x
Tanggal kadaluwars
a < 3 tahun x
Pengujian dan keamanan
Pengujian Persyaratan
SCCNFP menerbitkan
pedoman
Tidak ada tes khusus diperlukan. (Industri pedoman) Tidak ada tes khusus diperlukan. (Industri pedoman) Tidak ada tes khusus wajib
GMP kosmetik direktifAcuan dalam
Sukarela (Industri pedoman) Industri pedoman Sukarela (Industri pedoman
Kategori produk Obat, kosmetikdan obat OTC Obat, kosmetikdan obat OTC
Obat, kosmetik dan obat Quassi Obat, Kosmetik dan non-obat resep
1. Produsen yang bertanggung jawab
Produk kosmetik di Uni Eropa, AS, Jepang dan Kanada dapat ditempatkan di pasar tanpa persetujuan terlebih dahulu dari otoritas. Sebaliknya, produsen yang bertanggung jawab untuk memastikan bahwa produk mereka aman. Namun, Jepang dan Kanada membutuhkan pemberitahuan nama produk sebelum mereka ditempatkan di pasar (untuk Kanada, pemberitahuan bahan diperlukan). Beberapa negara anggota Uni Eropa juga memerlukan pemberitahuan produk.
Uni Eropa dan Jepang keduanya mempertahankan daftar zat terlarang dan terbatas, bersama-sama dengan daftar positif untuk zat pewarna, pengawet dan filter UV. Daftar negatif dan dibatasi daftar diperbarui secara teratur, atas saran dari komite penasehat ilmiah atau setara. AS dan Kanada tidak memiliki daftar positif untuk bahan kosmetik. Hal ini sebagian karena produk yang mengandung bahan-bahan tunduk pada daftar positif di Uni Eropa dan Jepang, untuk filter UV contoh, diatur sebagai obat bebas di AS dan Kanada. Ini berarti bahwa mereka diwajibkan untuk menjalani persetujuan pra-pasar untuk meluncurkan produk
3. Pelabelan Bahan
Pemberian label bahan yang diperlukan dalam Uni Eropa, Amerika Serikat, Jepang dan Kanada menggunakan istilah INCI (Diterjemahkan untuk Jepang). Semua pasar membutuhkan kuantitas pelabelan menggunakan satuan metrik, namun, pelabelan non-metrik juga wajib di Amerika Serikat dan diperbolehkan di Kanada dan di Uni Eropa (Sampai tahun 2009) sebagai suplemen untuk pelabelan metrik. Semua pasar membutuhkan produsen/importer identitas untuk diberi label, meskipun di Jepang hanya alamat Jepang dapat diterima.
4. Uji keamanan
Tidak ada tes khusus yang diperlukan untuk menentukan keamanan produk dan kemanjuran. Produsen yang bertanggung jawab untuk memastikan bahwa pengujian yang memadai dilakukan untuk menjamin keamanan mereka produk. Di Uni Eropa, pedoman pengujian yang dikeluarkan oleh komite penasihat ilmiah, SCCNFP. Di AS dan Jepang, pedoman pengujian telah dikembangkan oleh industri.
5. Data keamanan produk dan kemanjuran
produk tersebut diperlukan di bawah peraturan di pasar utama lainnya, meskipun di Jepang dan Kanada produsen harus dapat membuktikan keamanan produk (dan, di Jepang, kemanjurannya) berdasarkan permintaan. Dalam Amerika Serikat, produsen dapat menempatkan produk di pasar tanpa data keamanan tetapi seperti produk harus membawa peringatan khusus pada kemasan.
6. Kategorisasi Kosmetikal di beberapa pasar utama
Pendekatan mengambil oleh beberapa jurdications, untuk menciptakan kategori ekstra untuk mengakomodasi kategori kosmetikal atau produk borderline, dibahas di bawah ini :
a) Jepang
Jepang mengakomodasi kosmetikal dengan menyebut "quasi-obat". Ini adalah produk yang mengerahkan tindakan ringan pada tubuh manusia. Bahan-bahan yang termasuk dalam quassi-obat harus pra- disetujui sebelum dipasarkan di Jepang. Semua produk yang mengaku sebagai kosmetikal yang dianggap kuasi-obat dan memerlukan pra-persetujuan sebelum dijual di pasar
b) Selandia Baru
Hukum Selandia Baru menyediakan kategori ketiga yang disebut "produk-produk terkait". Terkait produk mereka yang memiliki penggunaan terapi sebagai tujuan sekunder untuk penggunaan utama. Terkait produk harus diberi label dengan sebutan dan perdagangan nama yang tepat, bahan aktif untuk menjadi diungkapkan secara kuantitatif, produk "sifat sejati, tanggal kadaluwarsa dan nomor batch, dosis dan frekuensi, petunjuk penggunaan, dan nama dan alamat pembuatan
c) Korea
kulit. KFDA bertanggung jawab untuk mengevaluasi dan meningkatkan keselamatan kosmetik fungsional.
d) Australia
Di Australia kategorisasi barang didasarkan pada dua faktor. 1) Klaim yang dibuat tentang produk
2) Komposisi produk. Produk-produk yang berada di garis perbatasan diklasifikasikan sebagai barang terapeutik. Barang-barang ini harus menggunakan bahan-bahan yang telah disetujui. Itu barang harus disertakan dalam Daftar Australia Therapeutic Goods. Keselamatan dan efikasi dan Good Manufacturing Practices data harus diserahkan ke otoritas. Komite Koordinasi Nasional Therapeutic Goods (NCCTG) memberikan panduan klaim kosmetik yang dapat diterima dan tidak dapat diterima
e) Kanada
Kanada kosmetikal juga disebut sebagai "dermo-kosmetik". Otoritas kesehatan di Kanada tidak secara resmi mengakui kosmetikal sebagai kategori kosmetik independen. Seperti beberapa produk jatuh ke dalam kedua kategori kosmetik dan obat, kesehatan Kanada telah mengidentifikasi kategori IV untuk mengakomodasi produk ini. Produk ini memiliki persyaratan kurang peraturan karena mereka memiliki risiko rendah. Dua faktor utama yang dipertimbangkan dalam klasifikasi kosmetik dibandingkan obat adalah: komposisi produk dan penggunaan yang diusulkan dari produk. Advertising Standards Kanada, kosmetik Kanada, perlengkapan mandi dan Fragrance Asosiasi dan pembagian kosmetik Kesehatan Kanada bersama-sama telah membentuk pedoman untuk iklan kosmetik dan klaim pelabelan. Pedoman ini membantu kosmetik produsen untuk menggunakan kata-kata dari klaim pada produk kosmetik.
f)Uni Eropa (UE)
bukti klaim yang dibuat oleh produk. Produk sebagai batas sudah diklasifikasikan sebagai kosmetik, Uni Eropa tidak perlu kategori ketiga yang disebut kosmetikal.
g) Amerika Serikat
Menurut USFDA tidak ada definisi hukum produk kosmetikal. Di AS ada tiga kategori seperti obat-obatan, kosmetik dan obat bebas. USFDA menyatakan bahwa produk dapat menjadi obat dan kosmetik. USFDA mengklasifikasikan produk tergantung pada produk klaim. Di AS klasifikasi produk rapi dan sederhana. Beberapa contoh adalah:
1) Produk berjemur adalah kosmetik tapi produk tabir surya adalah obat 2) Deodoran adalah kosmetik tetapi antiperspirant adalah obat
3) Exfoliant kulit kosmetik tapi kulit mengelupas adalah obat
4) Produk kulit untuk menyembunyikan jerawat adalah kosmetik tapi produk antijerawat adalah obat
5) Pelembab kulit kosmetik tapi remover kerut adalah obat
6) Sabun deodoran antibakteri adalah kosmetik tetapi sabun anti infeksi antibakteri adalah Obat
7) Pelembut bibir adalah kosmetik tetapi produk untuk bibir pecahpecah adalah obat
8) Sampo adalah kosmetik tapi sampo anti ketombe adalah obat
9) Pasta gigi kosmetik tapi pasta gigi antikaries adalah obat Sebuah obat kumur adalah kosmetik tapi mencuci antigingivitis mulut adalah obat
Tabel 2. Kategorisasi produk borderline atau mirip dibahas dengan beberapa contoh di pasar utama.
Produk Zealand Antiprespirant Kosmetik Obat OTC Obat
Semu Teraupetik baik Kosmetik Obat Non-resep Sampo Antidandruff Kosmetik Obat dan kosmetik Obat semu Teraupetik
baik Kosmetik Obat Pelembab dan
Sunscreen Kosmetik
Obat dan
kosmetik Kosmetik
Teraupetik
baik Kosmetik Obat
Antibakteria Kulit Kosmetik Dapat diklaim sebagai kosmetik dan obat Obat semu Teraupetik
baik Kosmetik Kosmetik
Lotion anti jerawat
Produk
obat Obat OTCC
Obat semu Teraupetik baik Kosmetik Obat Non-resep Pembersih jerawat Kosmetik Kosmetik (Pembersih) Obat (Pengontrol jerawat) Obat semu Teraupetik baik Kosmetik (Pembersih) Obat (Pengontrol jerawat) Obat atau Kosmetik
Mouthwash Kosmetik Obat dan Kosmetik Obat Semu Terapeutik Baik atau Kosmetik Terkait produk atau Kosmetik Kosmetik atau OTC Pasta gigi (Fluoride) Kosmetik Obat dan Kosmetik Obat Semu Terapeutik Baik atau Kosmetik Terkait produk Kosmetik atau Obat
Produk borderline kosmetik di salah satu pasar. Produk yang sama adalah obat OTC, obat non-resep atau produk obat di pasar lain. Setelah menganalisa undang-undang di atas, peraturan, pedoman dan praktek akuntansi yang berlaku untuk produk borderline atau kosmetikal di negara-negara besar.
7. Kategori kosmetikal
mendekati normal. Produk ini harus memiliki manfaat pasti untuk gangguan kulit kecil (Cosmetic indikasi). Sebagai kelainan kulit ringan produk harus memiliki profil risiko yang sangat rendah. Kosmetikal harus dikategorikan sebagai subclass dari kosmetik atau obat.
8. Persyaratan Dokumen
Persyaratan peraturan untuk persetujuan dan pemasaran produk kosmetikal harus berisi informasi berdasarkan komposisi kualitatif dan kuantitatif dari produk. Berkas harus dalam empat judul utama ;
1. Berkas administrasi
sesuai dengan peraturan. Selanjutnya sebagai tindakan korektif produk gagal harus ditarik dari pasar atau ingat, sebagai kasus mungkin.
2. Berkas bahan
Kosmetikal menurut definisi mengandung bahan yang memiliki farmasi dimaksudkan efek, jadi harus mungkin bagi produsen dan pemasok bahan untuk membuktikan ini. Sebuah berkas bahan harus berisi informasi rinci tentang identitas bahan pemasok dan komposisi bahan-bahan yang disediakan. Namun, prosedur untuk pendaftaran bahan baru harus relatif sederhana. Pendaftaran dari kombinasi bahan-bahan serta bahan individu dianjurkan. Berkas harus memiliki fisio-kimia dan mikrobiologi dari bahan-bahan termasuk fisiko-kimia dan mikrobiologi inspeksi. Selanjutnya, data toksisitas termasuk oral, dermal dan inhalasi toksisitas, toksisitas lokal, seperti iritasi kulit, sensitisasi, alergi foto dan foto-iritasi harus dimasukkan dalam berkas bila relevan. Berkas harus berisi data toksisitas dosis, Data toxisitas tambahan yang relevan. Selain itu, berkas yang harus menyebutkan daftar tes hewan dilakukan dengan bahan-bahan.
3. Berkas produk jadi
BAP produk jadi harus berisi rincian manufaktur, keamanan, kemanjuran, klaim dan pelabelan produk kosmetikal.
kualifikasi dan pengalaman staf teknis di bawah pengawasan yang yang produk kosmetikal akan diproduksi, salinan ISO atau sertifikasi lainnya, jika apapun, yang diperoleh oleh perusahaan untuk fasilitas manufaktur. Keselamatan kosmetikal: Satu pertimbangan penting dalam
pembangunan kosmetikal adalah keselamatan. Adalah penting untuk menyadari bahwa ada peraturan untuk keselamatan kosmetikal di tempat saat ini. kosmetikal harus memiliki persyaratan pengujian premarket. Evaluasi keselamatan kosmetikal mungkin karena itu, mirip dengan evaluasi keselamatan produk lainnya OTC. Itu kebutuhan jam adalah untuk menentukan standar yang wajar untuk pengujian keamanan untuk memungkinkan peraturan lembaga untuk mengevaluasi secara menyeluruh kosmetikal tetapi dalam waktu yang tepat. Sebelum menempatkan produk kosmetikal di pasar orang yang bertanggung jawab harus menyerahkan, melalui elektronik berarti, berikut informasi kepada pihak yang berwenang. Laporan keamanan produk kosmetikal harus berisi informasi berikut:
Nama dagang dari produk, alamat produsen atau distributor. File informasi produk harus menyatakan kategori produk
Nama dan alamat orang yang bertanggung jawab di mana file informasi produk dibuat mudah diakses
Negara asal dalam kasus impor
Negara anggota dimana produk ditempatkan di pasar
Rincian kontak seseorang untuk komunikasi jika diperlukan Komposisi kuantitatif dan kualitatif dari produk
Identitas dan rincian pemasok dan produsen bahan Fisik / Karakteristik Data kimia dan stabilitas Mikrobiologi tes Data
Daftar hewan Pengujian dilakukan dengan produk jadi Kotoran, jejak bahan dan informasi tentang bahan kemasan
Notifikasi produk dapat dibuat untuk otoritas melalui aplikasi online. Aplikasi akan diproses lebih cepat dan waktu harus ditetapkan. Waktu tambahan diberikan menjawab pertanyaan / keberatan, jika ada, yang diajukan oleh otoritas yang relevan. Penyampaian
Detail produk (Keamanan, Mutu, dan Kepatuhan terhadap Biro Standar) pada saat itu pemberitahuan harus terus sebagai praktek saat ini dan data tambahan dapat disimpan sebagai produk informasi file' dengan rincian dipertahankan pada lokasi manufaktur yang bersangkutan untuk regulator ulasan.
Produk informasi file harus berisi keamanan produk laporan kosmetikal yang harus tetap up-to-date dan harus jelas menyebutkan tanggung jawab produsen dan penilai keamanan.
Efikasi kosmetikal. Saat ini tidak ada peraturan untuk keselamatan kosmetikal, bahkan ada peraturan untuk keberhasilan kosmetikal. Biasanya, pengujian klinis pada manusia harus dilakukan di bawah bimbingan laboratorium penelitian atau dokter kulit dengan parameter yang ditetapkan untuk mendukung khasiat. Untuk mengevaluasi produk kosmetikal baru yang mengklaim fisiologis menguntungkan Akibatnya, sangat penting untuk mengatasi tiga issue,
Dapatkah bahan aktif menembus stratum korneum dan disampaikan dalam cukup konsentrasi ke target yang dimaksudkan di kulit selama kursus waktu sesuai dengan mekanisme aksi.
Apakah bahan aktif memiliki mekanisme biokimia spesifik tindakan dalam sel target atau jaringan pada kulit manusia.
Uji klinis yang signifikan untuk mendukung klaim keberhasilan Laboratorium dan data klinis harus tersedia untuk ditinjau oleh
Klaim pedoman untuk kosmetikal.Dalam konteks pedoman klaim kosmetikal negara berkembang, contohnya India, tidak pada catatan dibandingkan dengan Uni Eropa dan negara-negara ASEAN. Hal ini dapat difasilitasi oleh pengenalan diperbolehkan dan non-halal pedoman klaim untuk kosmetikal. Kosmetikal didefinisikan saat ini dengan klaim yang dibuat tentang digunakan. Klaim kosmetikal publik setiap informasi terutama disediakan untuk tujuan pemasaran pada konten, alam, efek, sifat, atau efektivitas produk. Sebelum mengklaim penggunaan yang dimaksudkan atau indikasi, manufaktur harus memegang bukti yang memadai untuk mendukung semua klaim yang dibuat tentang suatu produk.
Klaim pada produk kosmetikal harus didukung oleh informasi mengenai selesai produk itu sendiri. Klaim harus didukung oleh bukti ilmiah, relevan dan jelas seperti studi eksperimental. Klaim harus benar, valid dan tidak menyesatkan. Klaim harus tidak mengarah untuk penggunaan yang tidak aman atau tidak suatu produk. Iklan itu harus dilakukan mengingat rata-rata konsumen. Klaim terapeutik berlebihan harus dihindari. Contoh produk anti-penuaan diberikan di bawah ini. Klaim dapat diterima untuk anti-penuaan produk kosmetikal harus: efektif memperbaiki tanda-tanda kulit dan penuaan, mengurangi garis halus, meminimalkan garis-garis halus, mengurangi tanda-tanda penuaan, memperlambat penampilan/ tampilan penuaan/penuaan dini, memperlambat tanda-tanda/tampilan penuaan/penuaan dini, melindungi melawan tanda-tanda penuaan, memudar bintik-bintik gelap, menutupi noda penuaan.
membedakan bahan aktif dan bahan lainnya, tanggal daya tahan minimal jika kurang dari 30 bulan, periode setelah pembukaan jika daya tahan melebihi 30 bulan. Pencegahan dan petunjuk penggunaan: Semua peringatan keamanan yang terkait dengan penggunaan produk harus ditempatkan secara mencolok pada label fungsi Produk, ingredient label dalam nomenklatur internasional bahan kosmetik (INCI)
4. Berkas pasca pasar
Surveilans pasca Market: Dengan penyederhanaan prosedur perizinan produk, Otoritas FDA bisa fokus pada mengendalikan pasar keamanan kosmetikal dan setiap praktek yang tidak bermoral dengan tanggung jawab bersama menurut Industri. Dalam kontrol pasar dapat didukung melalui berkala (tahunan) penyerahan data audit pasar kosmetikal produk. Fitur utama dari sistem kontrol di pasar meliputi:
(1) Menghindari memakan waktu dan mahal pra-pasar lisensi/registrasi produk.
(2) Perusahaan bertanggung jawab untuk menempatkan kosmetikal di pasar juga bertanggung jawab atas kepatuhan terhadap peraturan, untuk keamanan dan kemanjuran produk, dan harus dapat membenarkan ini pada penyelidikan otoritas.
(3) Efektif dalam pasar kontrol otoritas nasional yang kompeten memantau pasar untuk memeriksa kepatuhan terhadap peraturan. Pengawasan pasar dilakukan melalui random kontrol pada pasar (di toko-toko retail), dengan kepatuhan pemeriksaan rutin dengan peraturan atau dengan pengendalian sistematis diberikan kategori produk, jika ada masalah yang timbul, seperti konsumen keluhan. (4) Dalam kasus ketidakpatuhan bisa ada hukuman dari berbagai
kekuatan dan jika produsen gagal untuk membuktikan bahwa produk kosmetikal aman untuk digunakan, produk akan ditarik atau ditarik dari pasar.
perlindungan. Standar keamanan yang seragam bagi konsumen. Hal ini meningkatkan daya saing pasar.
(6) Hal ini memastikan bahwa produk baru akan tersedia untuk konsumen dengan lebih cepat. Ini menjamin perlakuan yang sama terhadap semua perusahaan
8. Pengenalan kewaspadaan pasca-pemasaran untuk produk kosmetikal
Sistem kewaspadaan pasca-pemasaran biasanya fokus pada reaksi merugikan dari obat, baru-baru ini banyak pertimbangan diberikan untuk peralatan medis, produk darah, biologis, khusus produk nutrisi dan alami, sedangkan kurang perhatian telah ditujukan kepada yang merugikan. Reaksi yang berkaitan dengan produk kosmetik atau kosmetikal. Jerman dan Swedia adalah dua negara-negara yang memiliki sistem cosmetovigilance formal. Sistem cosmetovigilance terstruktur dengan baik tidak hanya untuk menyelidiki tetapi juga untuk mencegah risiko reaksi yang merugikan melalui kerjasama dan koordinasi di antara berbagai ahli ilmiah, otoritas kesehatan, industri / produsen dan organisasi konsumen. Hal ini dapat memberikan kontribusi untuk peningkatan keamanan penggunaan kosmetikal yang penting bagi perlindungan kesehatan masyarakat.
9. Informasi dapat diakses oleh publik
Perusahaan-perusahaan kosmetik harus bekerja sama masyarakat dengan memberikan informasi tentang produk yang mereka gunakan. Informasi harus dibuat kepada publik atas permintaan tetapi seharusnya tidak untuk dipublikasikan. Bahkan masyarakat dapat mengakses informasi dengan menulis ke perusahaan, melalui telepon dan dengan mengunjungi website perusahaan. Informasi terkait dengan kualitatif dan kuantitatif dari komposisi produk, data yang ada pada efek yang tidak diinginkan terhadap kesehatan manusia yang disebabkan dari penggunaan produk kosmetikal harus diakses oleh publik. Perusahaan harus menjawab semua pertanyaan dan permintaan di sederhana bahasa dan harus menjaga catatan semua keluhan, permintaan dan jawaban yang diberikan oleh
10. Badan penasehat: (Kosmetikal Komite Konsultatif)
Kosmetikal Komite Konsultatif harus dibentuk oleh Pemerintah Pusat kepada menyarankan pemerintah pusat dan negara bagian mengenai hal-hal teknis yang timbul dari administrasi. Komite Konsultatif Kosmetik harus dibentuk terdiri dari anggota dari industri, aktivis konsumen, profesi medis, akademisi dan pihak berwenang. Para anggota yang dapat dimasukkan dalam Kosmetikal Permusyawaratan Komite tercantum di bawah ini:
1. Anggota dari industri kosmetik 2. Anggota dari industri farmasi
3. Ahli peraturan dari Industri Farmasi India
4. Ahli dari lembaga akademis yang terlibat dalam penelitian dasar kosmetikal. 5. Dermatolog
6. Sebuah kecantikan 7. Pekerja sosial
BAB III
PENUTUP
Setiap produsen kosmetik yang akan memasarkan produknya harus menotifikasi produk terlebih dahulu dengan menyimpan data mutu dan keamanan produk (Product Information File) yang siap diperiksa oleh petugas berwenang. Hal-hal tersebutlah yang melatarbelakangi regulasi kosmetik sehingga tiap Negara memiliki regulasi kosmetik yang berbeda begitu pun lembaga yang berwenang atas penanganan keamanan kosmetik.
Estrin, Norman F. 1984. The Cosmetics Industry Scienstific and Regulation Foundation. Cosmetic Science and Technology Series 2nd Volume. United States.
http://id.shvoong.com/law-and-politics/politics/2094305-pengertian-regulasi/#ixzz2wYyYUzxe diakses 20 maret 2014