1 Pengaruh Penggunaan Amnion Freeze-Drying Untuk Mencegah Terjadinya Adesi Pada
Penyembuhan Luka Tendon Achilles Kelinci (Studi Eksperimental)
Franky Prilyanda, M. Sjaifuddin Noer
Departemen / SMF Bedah Plastik Rekonstruksi & Estetik
Fakultas Kedokteran Universitas Airlangga, RSUD Dr. Soetomo Surabaya
Abstrak
Pendahulauan : Tujuan utama dari operasi tendon adalah untuk mengembalikan kemampuan tendon gliding.
Pembentukan adhesi peritendinous sekitar lokasi perbaikan adalah salah satu dari beberapa kejadian buruk yang dapat mencegah tercapainya tujuan tersebut. Amnion freeze-drying berasal dari selaput janin/ fetal membranes yang terdiri dari dua lapisan yang memiliki fungsi sebagai penghambat dalam pembentukan adhesi peritendinous, kaya collagen, mempercepat epitelialisasi dan mencegah pembentukan jaringan fibrosis. Kandungan membran amnion tersebut dapat mencegah pembentukan adhesi peritendinous dalam penyembuhan tendon. Peran dari amnion freeze-drying diteliti pada kelinci dalam perannya pada pencegahan pembentukan adhesi setelah perbaikan tendon Achilles.
Tujuan : Tujuan dari penelitian ini adalah untuk menyelidiki penggunaan membran amnion freeze-drying
sebagai bioprosthesis jangka panjang dalam hand surgery.
Desain Penelitian : Penelitian eksperimental.
Metode : Penelitian eksperimental menggunakan 32 kelinci New Zealand, dibagi menjadi dua kelompok. Pada
semua kelompok, salah satu tendon Achilles dipotong secara tajam, kelompok I dilakukan pemberian membran amnion freeze-drying, dan kelompok II tidak dilakukan pemberian membran amnion freeze-drying (kontrol). Setelah sepuluh hari, hewan coba di bunuh, dan dilakukan pemeriksaan patologi anatomi pada daerah perlakukan. Adhesi dinilai di bawah mikroskop cahaya dengan melihat jumlah fibroblast.
Hasil : Pemeriksaan histologis menunjukkan bahwa penggunaan membran amnion freeze-drying secara
signifikan mengurangi jumlah adhesi dibandingkan dengan kelompok lain. 10 hari setelah implantasi tidak ada sisa-sisa membran amnion freeze-drying yang dapat diidentifikasi pada daerah perbaikan tendon.
Kesimpulan : Membran amnion freeze-drying yang mudah dipersiapkan, dan memiliki efektivitas biaya, dapat
digunakan dalam pencegahan dan treatment adhesi.
THE EFFECT OF AMNION FREEZE – DRYING TO PREVENT ADHESION IN RABBIT TENDON ACHILLES HEALING
2
(Experimental Study)
Franky Prilyanda, M. Sjaifuddin Noer
Department of Plastic Reconstructive and Esthetic Surgery of Airlangga University School of Medicine / Dr. Soetomo General Hospital Surabaya
Abstract
Background: The main aim of tendon surgery is to restore preserves tendon gliding. The formation of
peritendinous adhesion around the repair site is one of several adverse event that may prevent achievement of this aim. The freeze - drying amniotic derives from the fetal membranes which consist of two layers that may have a function as a barrier in the formation of peritendinous adhesion, rich of collagent, accelerate the epitelization and preventing fibrotic tissue formation. Those content of the amniotic membrane could prevent the formation of peritendinous adhesion in tendon healing. The role of freeze – drying amniotic membrane was investigated in rabbit with regard to the prevention of adhesion formation following Achilles tendon repair.
Objective: The objective of this study was to investigate the use of freeze - drying amniotic membrane as a
long-term bioprosthesis in hand surgery
Design: Experimental research
Methods: The experimental research use 32 New Zealand rabbits, devided into two groups. On all group, one
of the Achilles tendon was sharply devided, group I was treated by Freeze-drying amniotic, and group II was not treated Freeze-drying amniotic (control). After ten days, the animal were killed, and phatology anatomy examination was done on therepair site. The adhesion was assessed under light microscope with see the number of fibroblast.
Results: Histologic examination demonstrated that use of the freeze – drying amniotic membrane significantly reduced the amount of adhesion compared with the other groups . 10 day after implantation no remnants of freeze – drying amniotic membrane could be identified at the tendon repair site.
Conclusions: Freeze–drying amniotic membrane is easily prepared, and because of its cost effectiveness, its use
in the prevention and treatment of adhesions should always be kept in mind.
3 1. Pendahuluan
Tendon merupakan struktur penghubung antara otot dengan tulang dan merupakan komponen muskuloskeletal yang sangat penting. Tendon juga dibutuhkan untuk mentransferkan gaya dari otot ke tulang sehingga timbul gerakan. Kerusakan pada tendon karena trauma atau penyebab lain dapat mengganggu fungsi gerakan halus dan koordinasi. Morbiditas disebabkan karena kerusakan tendon dapat menyebabkan kecacatan baik sementara maupun permanen [1]. Pada awalnya cidera pada tendon dianggap hanya sebagai defek pada jaringan tendon yang dapat sembuh setelah dilakukan reparasi. Pada kenyataannya tidaklah sesederhana itu. Dalam proses penyembuhan tendon sering kali dijumpai
penyulit, dengan berkembangnya
biomolekuler menunjukkan bahwa
penyembuhan luka pada tendon
merupakan suatu proses yang kompleks. Hal tersebut menyebabkan makin
berkembangnya berbagai macam
modalitas terapi untuk mengoptimalkan hasil penanganan.
Dari data yang diambil di Instalasi Rawat Jalan (IRJ) Bedah Plastik RSUD dr Soetomo Surabaya pada bulan Januari – Desember 2009 didapatkan 34 kasus cedera trauma tajam mengakibatkan ruptur tendon pada tangan khususnya bagian jari baik itu ruptur tendon sebagian ataupun ruptur tendon total, pada pemantauan selanjutnya didapatkan 16 pasien yang mengalami keterbatasan gerakan pasca penyembuhan, diduga ini karena terjadi suatu adesi atau perlekatan pada tendon. Harison dkk (2003) mengatakan Salah satu komplikasi yang paling banyak timbul pada penyembuhan tendon adalah terbentuknya adesi di sekitar tendon yang dilakukan penjahitan [2]. Setiap trauma pada tendon akan mempengaruhi aktivitas pada sistem pergerakan, pada penderita dengan pekerjaan pemain gitar, piano dan pelukis efek dari trauma harus lebih dievaluasi implikasinya. Secara anatomi
jaringan tendon memiliki vaskularisasi dan jumlah sel yang sedikit dibandingkan jaringan yang lainnya. Metabolisme yang terjadi lebih rendah pada jaringan tendon, sehingga perbaikan jaringan pada tendon lebih lambat dan kurang baik [1]. Pada penyembuhan tendon akibat trauma akan terbentuk jaringan parut dengan struktur jaringan yang lebih lemah serta kemampuan mekanis yang kurang baik dibandingkan dengan tendon normal [3,4] (Recklies A D et al, 1999; Woo et al, 1987). Harison dkk (2003) [5].
mengungkapkan bahwa terjadinya
komplikasi adesi tendon diakibatkan karena terbentuknya jaringan parut yang
padat antara tendon dengan
pembungkusnya, sehingga mekanisme
gliding tendon yang normal akan
tergangggu oleh adesi ini yang akhirnya akan mengakibatkan fungsi pergerakan sendi terganggu.
Adesi tendon terjadi karena adanya faktor penumpukan fibroblas yang banyak pada daerah penyembuhan tendon dan juga faktor sel inflamasi dari perifer yang menginvasi ke daerah penyembuhan tersebut. Dominasi dari kedua faktor tersebut dapat mempengaruhi maturitas deposisi serat kolagen serta kandungan material jaringan tendon yang mengalami perbaikan, hal ini akan mengakibatkan terjadi jaringan parut yang berlebih pada daerah penyembuhan tendon yang pada akhirnya dapat menyebabkan adesi pada tendon dengan selubungnya [6].
Berbagai metode telah
dikembangkan oleh banyak peneliti untuk menghambat terjadinya adesi tendon, baik secara mekanik maupun secara biologi. Kebanyakan metode yang dikembangkan adalah dengan menggunakan barier mekanik yang menyelubungi tendon sehingga dapat menghambat adesi tendon secara fisik dengan jaringan sekitarnya. Barier mekanik tersebut antara lain : Alumina sheath, polyethylene membrane, cellophane, sterispon wrapping, stainless steel sheeting, silicone sheeting, silicone
4
rubber envelope, polytetra fluoroethylene surgical membrane, dan bahan lainnya. Beberapa metode telah terbukti gagal
menghambat terbentuknya adesi,
sebaliknya akan menstimulasi inflamasi yang mengakibatkan semakin banyaknya adesi. Penelitian lainnya banyak memusatkan kepada upaya menghambat terbentuknya adesi dengan proses biokomia seperti pemberian kortison, dekstran, kolagen inhibitor, antihistamin, indometasin, hyaluronic acid, 5-fluorourasil dan bahan terapeutik lainnya dengan berbagai tingkat keberhasilan. Saat ini mulai dikembangkan berbagai metode baru seperti penyuntikan stem cell, growth factor, terapi genetik dan nitric oxide synthase [7] (Watson T, 2003)
Ozgenel dkk (2001) [8] telah melakukan penelitian untuk upaya pencegahan terjadinya adesi pada tendon dengan menggunakan bahan amnion segar
(fresh amnion). Penggunaan amnion
adalah modalitas terapi untuk mencegah terjadinya adesi pada penyembuhan tendon yang banyak dikembangkan beberapa dekade terakhir. Penggunaan amnion ini sangat bervariasi, mulai dari amnion segar yaitu amnion yang didapat langsung dari plasenta manusia dalam keadaan segar yang belum diawetkan dan telah memenuhi syarat yakni plasenta normal tidak berwarna mekonium dan sudah melalui tahapan standar oleh Bank Jaringan yaitu dengan pencucian larutan Na Hipoklorit 0,05% dan NaCl 0,9% serta disimpan dalam suhu 4°C, amnion kering
(freeze-drying) yaitu amnion yang
diproduksi oleh Pusat Biomaterial / Bank Jaringan yang berasal dari placenta manusia yang telah memenuhi syarat dan dipreservasi secara freeze-drying dan teknik sterilisasi dengan sinar γ menurut standar yang ditetapkan oleh American Association of Tissue Bank (AATB).
Peneliti disini akan mencoba menggunakan amnion kering (freeze-drying) untuk mencegah terjadinya adesi pada tendon, hal ini dikarenakan amnion
kering (freeze-drying) mempunyai beberapa cara kerja untuk mencegah terjadinya adesi yaitu sebagai penghambat pertumbuhan fibroblas sehingga dapat mencegah terjadinya jaringan parut yang berlebih pada penyembuhan tendon, sebagai efek anti inflamasi dan juga sebagai pembatas atau barrier antara tendon dengan selubungnya. Pertimbangan lain penelitian ini menggunakan amnion kering (freeze-drying) adalah karena harga yang terjangkau, persediaan yang mudah didapat di RSU Dr. Soetomo Surabaya serta dapat diperoleh sewaktu-waktu sehingga dapat di aplikasikan untuk operasi penyambungan tendon secara emergensi.
2. Metode Penelitian
Penelitian dilakukan di
Laboratorium Biokimia Universitas Airlangga. Dengan rancangan penelitian eksperimental pada hewan kelinci. Dalam penelitian ini dilakukan pemotongan secara tajam pada tendon achilles kelinci, kemudian dilakukan repair tendon dengan cara penjahitan dengan teknik modifikasi kessler. Hewan coba ini dibagi menjadi 2 kelompok. Masing-masing kelompok perlakuan, tendon achilles kanan dipotong secara tajam pada pertengahan dari tendon lalu dijahit secara primer dengan satu jahitan matras horisontal. Kelompok pertama sebagai kontrol tidak dilakukan terapi tambahan, kelompok kedua diberikan adjuvant terapi berupa pemberian amnion kering (freeze-drying) yang dibungkuskan diatas jahitan dari tendon tersebut.
Populasi pada penelitian ini menggunakan hewan coba kelinci yang memenuhi kriteria sebagai berikut:
kelinci albino New Zealand
(Oryctolaguscuniculus), jenis kelamin jantan, umur 8 minggu, berat badan 2500 - 4000 gram, sehat ditandai dengan gerakan aktif. Besar sampel dihitung dengan rumus Federer, didapatkan 16 kelinci untuk
5
kelompok perlakuan dan 16 kelinci untuk kelompok kontrol.
Seluruh hewan coba dibius menggunakan ketamin (150 mg/kg IM) lalu rambut disekitar tempat pemotongan tendon Achilles dicukur dan dilakukan pemberian antiseptik.
Dengan menggunakan mesh no 15 akan dilakukan insisi kulit longitudinal sepanjang kurang lebih 3 cm diatas tendon achilles, lalu digunakan mesh cembung untuk melakukan pemisahan jaringan diatas tendon sehingga tendon Achilles dan selubungnya (paratenon) akan terlihat. Selubung tendon (paratenon) di insisi dengan mesh no 15 sampai tendon Achiles terpapar.
Dengan menggunakan mesh no 11 akan dilakukan pemutusan pada tendon secara tajam, kelinci percobaan dibagi atas 2 kelompok. Kelompok I merupakan kelompok perlakuan dimana tendon yang telah diputus akan dilakukan penjahitan secara primer menggunakan benang non absorbable nylon (monofilamen) 5/0 dengan tehnik modifikasi kessler lalu diatas jahitan tersebut akan dibungkuskan dengan amnion kering (hari ke-0) berukuran 2X2 cm. Selubung tendon (paratenon) dikembalikan kemudian kulit dijahit lapis demi lapis menggunakan jahitan interupted satu-satu. Dilakukan perawatan luka jahitan dan ditutup menggunakan kasa steril. Tidak dilakukan immobilisasi pada ekstremitas yang dilakukan prosedur bedah.
Kelompok II merupakan kelompok kontrol dimana tendon yang telah dilakukan pemutusan secara tajam dengan mesh 11 hanya dilakukan penjahitan menggunakan benang non absorbable nylon (monofilamen) 5/0 dengan tehnik jahitan modifikasi kessler. Selubung tendon (paratenon) dikembalikan kemudian kulit dijahit lapis demi lapis menggunakan jahitan interupted satu-satu. Dilakukan perawatan luka jahitan dan ditutup menggunakan kasa steril. Tidak dilakukan immobilisasi pada ekstremitas yang dilakukan prosedur bedah.
Hewan coba akan dipelihara di tempat pemeliharaan hewan dengan perlakuan sesuai dengan etika perlakuan terhadap hewan coba.
Setelah hari ke-10 hewan coba dikorbankan dengan memberikan suntikan Phenobarbital (100 mg/kg IV) lalu diambil jaringan pada luka sejajar dengan ujung pertemuan stump dari tendon secara en-block dari bawah kulit, tendon dan jaringan sekitarnya, jaringan tersebut kemudian dimasukkan ke dalam tabung dan difiksasi dengan cairan formalin 10% yang kemudian dilakukan pemeriksaan secara histopatologis dengan pewarnaan haemotoxylin-eosin dan diperiksa di bawah mikroskop cahaya dengan pembesaran 20X, 100X, 200X dan 400X oleh ahli Patologi
Hewan coba dilakukan evaluasi terhadap kualitas penyembuhan tendon dengan menilai pemeriksaan histologi tendon dengan menghitung jumlah sel fibroblas dan sel radang sebagai parameternya. Rancangan penelitian dengan Post Test Only Control Group Design, dan perbedaan dianalisa dengan menggunakan uji statistik simple effect untuk menilai jumlah fibroblas.
Data yang dikumpulkan akan dianalisis menggunakan metode analisis multi varian yakni ANOVA ( Analysis of Variants)
3. Hasil
Secara histologi didapatkan beberapa contoh gambar dibawah ini yaitu: jaringan ikat tendon dan fibroblas pada tendon kelinci yang diambil pada hari ke-10, disini rata-rata didapatkan gambaran fibroblas yang lebih sedikit dan lebih teratur pada permukaan tendon yang diberikan amnion kering atau kelompok perlakuan (p) dibandingkan dengan tendon yang tidak diberikan terapi amnion kering atau kelompok kontrol (k). Jumlah
6
penampakan fibroblas yang didapat pada gambar dibawah adalah contoh fibroblas yang didapat perlapangan pandang yang nantinya akan dihitung per-10 lapang pandang pada satu tendon Achilles kelinci.
Gambar 1. Perbandingan fibroblas pada pemeriksaan mikroskop pembesaran 20X dengan pewarnaan HE (A) Jaringan ikat tendon (B) fibroblas.
Pada gambar 1 diatas didapatkan gambaran dari jaringan tendon dan fibroblas hari ke-10 dengan pembesaran mikroskop 20X, disini secara tampak mata dapat dilihat adanya sel fibroblas yang banyak dan tidak teratur pada kelompok kontrol (k) dibandingkan dengan kelompok perlakuan (p).
Gambar 2. Perbandingan fibroblas pada pemeriksaan mikroskop pembesaran 100X dengan pewarnaan HE (A) fibroblas.
Pada gambar 2 diatas dengan pembesaran mikroskop 100X dapat dilihat susunan fibroblas hari ke-10 yang tidak teratur pada kelompok kontrol (k) dibandingkan dengan kelompok perlakuan (p). Disini membuktikan bahwa pemberian amnion kering pada tendon Achilles kelinci yang diperiksa hari ke-10 dapat membuat susunan fibroblas lebih teratur
disebabkan amnion kering juga
mengandung kolagen tipe I dan II yang disekresikan oleh sel-sel masenkim dari lapisan fibroblas yang akan menjaga bentuk dari pembentukan jaringan ikat tendon yang baru.
Gambar 3. Perbandingan fibroblas (A) pada pemeriksaan mikroskop pembesaran 200X dengan pewarnaan HE.
Pada gambar 3. diatas dengan pembesaran mikroskop 200X, disini terlihat dengan jelas fibroblas hari ke-10 yang terjadi jumlahnya lebih sedikit dan lebih teratur pada kelompok perlakuan (p) dibandingkan dengan kelompok kontrol (k). Disini membuktikan bahwa pemberian amnion kering pada tendon Achilles kelinci yang diperiksa hari ke-10 dapat mengurangi pembentukan fibroblas yang berlebih pada tendon perlakuan (p).
Gambar 4. Perbandingan permukaan tendon pada pemeriksaan mikroskop pembesaran 20X dengan pewarnaan HE, (A) permukaan tendon kontrol (B) permukaan tendon perlakuan.
Pada gambar 4 diatas didapatkan gambaran histologi dengan pengecatan HE, dimana didapatkan jaringan ikat tendon hari ke-10 yang lebih padat dan teratur pada permukaan tendon perlakuan (p) dibandingkan dengan permukaan tendon kontrol (k), disini tampak pembentukan jaringan ikat yang lebih longgar. Pada gambar ini juga dibuktikan
7
bahwa lapisan amnion yang mengandung kolagen tipe V dan VI dapat membentuk hubungan filamentosa antara kolagen interstisial dengan kolagen membran basal sehingga dapat membentuk permukaan tendon yang lebih padat.
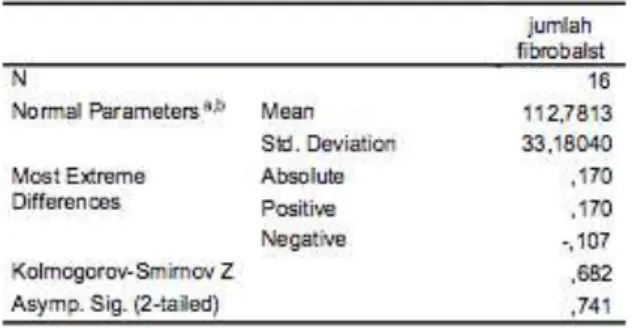
Dari hasil perhitugan jumlah fibroblas dari 16 tendon Achilles kelinci perlakuan (p) dan 16 tendon Achilles kelinci kontrol (k) pada hari ke-10 melalui mikroskop dengan cara melihat jumlah fibroblas yang didapat per 10 lapangan pandang, data dianalisis dengan menggunakan One-Sample Kolmogorov-Smirnov Test, didapatkan hasil sebagai berikut :
Tabel 1. NPar Tests jumlah fibroblas pada kelompok perlakuan
Pada tabel 1 diatas menerangkan bahwa jumlah fibroblas hari ke-10 pada tendon Achilles kelinci kelompok perlakuan yang di dapat dari per-10 lapangan pandang dihitung dengan
menggunakan metode One-sample
Kolmogorov-Smirnov Test pada total 16 tendon achilles kelinci didapatkan jumlah total fibroblas 112.7813.
Tabel 2. NPar Tests jumlah fibroblas pada kelompok kontrol
Pada tabel 2 diatas menerangkan bahwa jumlah fibroblas hari ke-10 pada tendon Achilles kelinci kelompok kontrol yang di dapat per-10 lapangan pandang dihitung dengan menggunakan metode One-sample Kolmogorov-Smirnov Test pada total 16 tendon achilles kelinci didapatkan jumlah total 145,8875.
Tabel 3. Korelasi pemerikasaan
Jumlah fibroblas Jumlah fibroblast Pearson Correlation
Sig. (2-tailed) N
1 32
Tabel 3 diatas menerangkan bahwa hasil seluruh sampel (N) yang berjumlah 32 diperiksa dan dihitung hanya dengan 1 orang.
Tabel 4. T-Test jumlah perbandingan fibroblas antara kelompok perlakuan dan kontrol
Pada tabel 4 diatas menerangkan perbandingan hasil jumlah fibroblas hari ke-10 pada total 16 tendon achilles kelinci antara kelompok perlakuan (p) dan total 16 tendon Achilles kelinci pada kelompok kontrol (k), disini didapatkan jumlah perbandingan fibroblas yang cukup
8
signifikan yaitu kelompok perlakuan (p) didapatkan jumlah total 112,7813 sedangkan kelompok kontrol (k) didapatkan jumlah total 145,8875. Selisih yang didapatkan kurang lebih 33,1062.
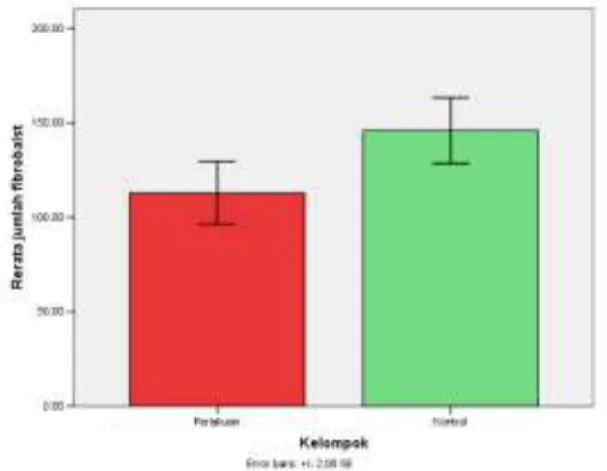
Gambar 5. Grafik perbandingan jumlah fibroblas.
Gambar 5. diatas menunjukkan jumlah perbandingan fibroblas hari ke-10 antara tendon perlakuan Achilles kelinci yang mendapat terapi amnion kering (merah) dengan jumlah 112,7813 dibandingkan dengan tendon kontrol Achilles kelinci yang tidak mendapat pemberian terapi amnion kering (hijau) yaitu dengan jumlah 145,8875.
4. Pembahasan
Pada tendon yang mengalami luka, proses penyembuhannya secara garis besar melalui 3 fase yaitu [8]:
Fase inflammasi (3-7 hari pertama) Fase proliferasi (hari ke-7 sampai
21)
Fase remodelling dan maturasi (hari ke-21 sampai 1 tahun)
penyembuhan tendon sendiri disebabkan oleh respon seluler karena peneterasi kapiler pada tendon dan jaringan sekitarnya yang mengalami trauma, hal ini dapat menimbulkan adesi sehingga perlu
upaya pencegahan dalam proses
penyembuhan tendon agar hasil
penyambungan tendon dapat berfungsi dengan baik [8]. Secara histologi tendon yang terputus dan dilakukan perbaikan
dengan melakukan penjahitan
memperlihatkan peningkatan proliferasi fibroblas pada hari ke 3 yang berasal dari luka tendon tersebut dan yang berasal dari jaringan sekitar yang mengalami cedera serta fibroblas yang berasal dari penjahitan. Pemberian amnion kering akan diharapkan bekerja pada saat proses inflamasi hari ke-3, tujuannya adalah selain sebagai anti inflamasi, pemberian amnion kering juga dapat menghambat pembentukan hormon TGF- β yang berlebih sehingga diharapkan dapat mengurangi pembentukan fibroblas.
Pemberian amnion kering pada tendon Achilles kelinci diharapkan dapat mengurangi jumlah fibroblas yang terbentuk dibandingkan dengan tendon Achilles kelinci jika tidak diberikan amnion kering, sehingga jaringan parut yang terbentuk akan minimal dan dapat menghambat terjadinya adesi pada tendon dan selubungnya.
Uji normalitas dilakukan untuk mengetahui bahwa data yang diperoleh pada hasil penelitian terdistribusi normal. Hal ini dilakukan untuk memenuhi salah satu persyaratan pengujian parametrik yaitu normalitas data. Uji normalitas dilakukan terhadap variable tergantung yaitu : jumlah fibroblas per-10 lapangan pandang yang diperiksa secara histologi pada hari ke-10. Uji normalitas dilakukan pada kelompok dengan pemberian amnion kering freeze-drying dan tanpa pemberian amnion kering freeze-drying.
Hasil studi terkini mengindikasikan bahwa amnion kering freeze-drying yang diaplikasikan pada cedera tendon mempunyai berbagai fungsi antara lain sebagai pembungkus biologis dikarenakan kaya akan kandungan collagen, anti scarring dengan cara menurunkan hormon TGF- β transdifferentiation. Amnion kering juga mengandung mesenkimal stem
9
cell dan growth factor yang dapat mempercepat penyembuhan suatu luka menjadi lebih cepat pada periode penyembuhan awal pada hewan coba kelinci [8].
Pada penelitian ini efek biologis amnion kering sebagai pembungkus tendon Achilles kelinci sangat berperan untuk mencegah terjadinya adesi tendon dengan selubungnya, hal ini dapat dilihat secara histologi dengan menghitung jumlah fibroblas per-10 lapangan pandang pada hari ke-10 dengan kelompok pertama perlakuan (p) menunjukkan jumlah fibroblas dari total 16 tendon Achilles kelinci yang dilakukan pemberian amnion kering dan dihitung menggunakan metode One-sample Kolmogorov-Smirnov Test didapat jumlah 112,7813, hasil ini lebih sedikit dibandingkan dengan kelompok kontrol (k) yaitu dengan total 16 tendon Achilles kelinci tanpa pemberian amnion kering yang dihitung juga menggunakan metode One-sample Kolmogorov-Smirnov Test didapat jumlah 145,8875 dengan pewarnaan hematoxylin-eosin. Dengan selisih jumlah fibroblas 33,1062, hasil ini dianggap cukup signifikan untuk membuktikan bahwa pemberian terapi amnion kering dapat mencegah terjadinya adesi pada penyembuhan tendon.
Pada beberapa contoh gambaran pemeriksaan secara histologi didapatkan juga hasil permukaan tendon yang lebih padat dan teratur pada tendon perlakuan (p) dibandingkan dengan permukaan tendon kontrol (k), disini membuktikan bahwa amnion juga mempunyai lapisan kompakta yang mengandung kolagen tipe I dan II yang disekresikan oleh sel-sel masenkim dari lapisan fibroblas yang akan menjaga intergritas mekanik dari amnion. Kolagen tipe V dan VI akan membentuk hubungan filamentosa antara kolagen interstisial dengan kolagen membran basal [9].
Efek amnion kering freeze-drying yang digunakan pada penelitian ini terbukti bahwa fungsinya dapat
menghambat pembentukan hormon TGF- β yang berlebih dimana TGF- β ini akan berperan sebagai reseptor timbulnya fibroblas, sehingga amnion kering dapat mengurangi pembentukan fibroblas berlebih yang berasal dari luka tendon, cedera jaringan sekitar tendon serta luka dari penjahitan tendon sendiri. Semakin banyak fibroblas yang terbentuk maka akan terjadi penumpukan fibroblas pada celah luka yang akhirnya pembentukan kolagen yang akan terjadi semakin banyak juga. Kolagen tersebut nantinya akan berubah menjadi hipertopik scar, jika scar yang terjadi melebihi dari permukaan tendon maka akan terjadi perlekatan antara scar pada permukaan tendon dengan selubungnya (paratenon) [8].
Pada studi ini, penurunan jumlah fibroblas pada saat hari ke-10 di kelompok perlakuan (p) mendukung kebenaran efek anti jaringan parut dengan cara
menurunkan hormon TGF- β
transdifferentiation yang nantinya dapat mencegah terjadinya adesi pada tendon.
5. Kesimpulan
Pada pemeriksan histopatologi
dengan pengecatan menggunakan
haemotoxilyn-eosyn (HE) yang dihitung per-10 lapangan pandang terlihat bahwa jumlah fibroblas pada kelompok perlakuan (p) lebih sedikit dibandingkan kelompok kontrol (k). Pada analisa statistik didapatkan jumlah reseptor fibroblas pada kelompok perlakuan (p) lebih rendah signifikan dibandingkan kelompok kontrol (k) pada fase proliferasi penyembuhan luka hari ke-10. Penelitian ini menunjukkan bahwa amnion kering freeze-drying mempunyai pengaruh yang besar terhadap terjadinya adesi pada tendon dengan menurunkan jumlah fibroblas melalui fungsi biologis-nya dikarenakan kaya akan kandungan collagen, anti scarring dengan cara menurunkan hormon TGF- β transdifferentiation. Lapisan dari amnion kering freeze-drying ini juga dapat
10
membantu menjadikan permukaan tendon menjadi lebih padat dan teratur. Amnion kering juga mengandung mesenkimal stem cell dan growth factor yang dapat mempercepat penyembuhan suatu luka menjadi lebih cepat dan sempurna secara fungsinya.
Tinjauan Pustaka
1. Archauer, M.B. 1995. Tendon, in Plastic Surgery Indication Operation and Outcomes. Vol. Mosby. Toronto. p : 368-83.
2. Harrison R. Hand Surgery-Tendon Healing Project. RAFT The Research. A UK Registered Charity No.299811; 2003 : 105-14.
3. (Recklies A D et al, 1999; Woo et al, 1987).
4. Sharma BR, Singh VP, Bangar S, Gupta N 2005, ‘Septicemia: The Principal Killer of Burns Patients’, American Journal of Infectious Diseases, vol. 1, no. 3, pp. 132-138. 5. Bloemsma G C, Dokter J, Boxma H,
Oen H 2008, ‘Mortality and causes
of death in a burn centre’, Burns, vol. 34, pp. 1103 – 1107.
6. Hatano I, Suga T, Diao E, Peimer CA, Howard C, 2000. Adhesion from flexor tendon injury: an animal study comparing surgical techniques. J Hand Surgery vol 25A. p : 252-60.
7. (Watson T, 2003)
8. Ozgenet GY, Samli B, Ozcan M. Effect of Human Amniotic Fluid on Peritendinous Adhesion Formation and Tendon Healing After Flexor Tendon Surgery in Rabbits. J Hand Surgery 2001; 26A:2
9. Colocho G, Graham WP,
1974Placental Physiology: Structure and Function of Fetomaternal Exchange. New York, Raven Press, 1983