PERCOBAAN INISIASI KALUS DARI BEBERAPA DIOSCOREA SP.
SKRIPSI
DIBUAT UNTUK MEMENUHI TUGAS AKHIR MENCAPAI GELAR SARJANA FARMASI
PADA FAKULTAS FARMASI ^ r UNIVERSITAS AIRLANGGA /,
oleh
Retno Sari 058210491
Disetujui oleh Pembimbing
M I L I t
' I T BR P U S T AE AA*
1-W N IT E R S 1 T A S / l K L A N O « A ’
, S U R A H A V A
KATA PENGANTAR
Penelitian dengan judul " PERCOBAAN INISIASI KALUS DARI BEBSRAPA DIOSCOREA SP. " setelah waktu yang cukup panjang, akhirnya dapat diselesaikan. Meskipun hasil yang
dicapai belum cukup memadai, diharapkan dapat memberikan sumbangan bagi perkerabangan dan kemajuan penelitian di bi dang bioteknologi terutama teknik kultur jaringan tanaman obat.
Dengan memanjatkan puji syukur ke hadirat Tuhan Yang Maha Esa, kami persembahkan apa yang telah dicapai bagi kemaduan ilmu pengetahuan.
Ucapan terima kasih yang setulusnya kami sampaikan kepada :
Bapak Dr, Gunawan Indrayanto dan Bapak Drs. Charaad Ahmad Sahid selaku dosen pembimbing,- yang telah banyak mera- berikan bimbingan dan saran serta dorongan moril.
Bapak Ir. F. Kasijadi KS selaku Kepala Sub Balai Pe nelitian Hortikultura Malang yang telah memberikan kesem- patan dan fasilitas untuk melaukan penelitian di laborato ry um Fisiologi.
Kepala Kebun /?aya Purv/odadi -Pasuruan beserta staf yang telah banyak membantu dalam mendapatkan bahan peneli tian.
Para dosen Fakultas Farraasi Universitas Airiangga yang telah memberikan saran dan dorongan moril
Para staf Laboratorium Fisiologi Sub Balai Peneliti- an Hortikultura Malang yang banyak memberikan bantuan se- lama penelitian.
Tak lupa terima kasih yang sebesarnya kepada kedua orang tua dan saudara-saudara kami yang banyak memberikan bantuan moril materiil.
DAFTAR ISI
Halaraan
KATA PENGANTAR iii
DAFTAR ISI . . . - . . . . v
DAFTAR TABEL. ... - . viii
DAFTAR GAMBAR ... . . . x
DAFTAR L A M P I R A N ...
xii-DAFTAR ISTILAH DAN SINGKATAN ...
xiii-BAB I. PENDAHULUAN 1. Latar belakang ... ...1
2. Tujuan Penelitian . . . k II. TINJAUAN PUSTAKA 1. Kultur jaringan . . . 5
2. Media kultur jaringan ...7
3. Kondisi lingkungan kultur jaringan. 11 4. Kultur kalus dan karakteristiknya . 12 5. Kultur jaringan sebagai sumber metabolit sekunder . . . 15
6. Produksi diosgenin dari kultur jaring an Dioscorea sp... 18
7. Tinjauan uraum tanaman Dioscorea sp. 19 7.-1 Sistematika tanaman Dioscorea sp. 19 7.2 Sifat-sifat tanaman Dioscorea sp. 20 7.3 Kandungan Dioscorea sp. . . . 21
Halaman
3*2 Pembuatan media 23 3*3 Penanaman eksplan. .. * . ... 23
3.4 Pemindahan kultur kalus. .- » .. 26
3.5 Pengamatan hasil .. .. . . . ... 26
3.-5.1 Pemeriksaan makroskopis kalus . 26 3*5.2 Pengamatan pertumbuhan kalus . 26 3-5.3 Pengolahan data . . . 27
IV- HASIL PENELITIAN 1. Sterilisasi • $Q 2. Pembentukan kalus • ...31
3. Pemeriksaan makroskopis kalus . 32 if. Hasil perhitungan...- . 36
V.. P E M E A H A S A N ... .... if 6 VI. KESIMPULAN ... . . . .- 50
Halajoan
VII. SARAN ... 52
RINGKASAN... .... 53.
DAFTAR PUSTAKA . . . ... 54
LAMP I R A N ... .. . - 5?
DAFTAR TABEL
1.. Komposisi kimiawi media Murashige
-Skoog •• *■ » ». - *. 28 2. Rancangan kombinasi zat pengatur tumbuh
untuk pembentukan kalus Dioscorea sp. . 29 3* Cara sterilisasi yang digunakan
terha-dap eksplan Dioscorea sp. . . . . 30 if. Pembentukan kalus dari eksplan
Dioscorea sp. pada media MS dengan pe-
nambahan zat pengatur tumbuh .. .. .. «. 3 1
5. Waktu tumbuh kalus dari eksplan
Dioscorea pentaphvlla L. . . . . 32
6. Waktu tumbuh kalus dari eksplan
Dioscorea batatas Decne. . . . 32 7. Pemeriksaan makroskopis kalus
Dioscorea pentaphylla L. • . .. .. 33
8. Pemeriksaan makroskopis kalus
Dioscorea batatas Decne. 3k
9. Indeks Pertumbuhan (IP) kalus
Dioscorea •pentaphylla L. . .. .. . .. 36 10. Contoh perhitungan persamaan regresi dari
data Indeks Pertumbuhan rata-rata dan v/aktu (kalus Dioscorea pentaph.ylla L.
pada media KD^) . ... 38
11. Indeks Pertumbuhan (IP) kalus
Dioscorea batatas Decne... /+1 12. Waktu duplikasi (td) kalus
Dioscorea pentaphylla L. . . . . 45 13* Waktu duplikasi (t^) kalus
Dioscorea batatas Decne. . . . 45
DAFTAR GAMBAR
1. Kurva pertumbuhan kalus .. «. .. - » l*f
2. Terjadinya organogenesis pada kalus ^ Dioscorea pentaphvlla L.. pada media
(A) KD1# (B) KD3 . ... 3 k 3. Kalus Dioscorea batatas Decne yang di-
tanam pada media (A) KD^; (B) KD^ pada
minggu X V . . ... .. . 33 if. Sel-sel kalus Dioscorea pentaphvlla L..
( pembesaran 50 X - 35
5. Grafik log Indeks Pertumbuhan rata-rata terhadap waktu (hari) dari kalus
Dioscorea pentaphvlla L. . . . . 37
6a. Persamaan regresi dari grafik log Indeks Pertumbuhaa rata-rata terhadap waktu dari kalus Dioscorea pentaphvlla L* pada media
(A) KD^ (B) kd7 . . . . . . . 39 6b. Persamaan regresi dari grafik log Indeks
Pertumbuhan rata-rata terhadap waktu dari kalus Dioscorea pentaphvlla L. pada media
(C) KDg (D) . * . ■ » • .- .• • z^o 7.. Grafik log Indeks Pertumbuhan rata-rata
terhadap waktu (hari) dari kalus
Dioscorea bat at as Decne.. .. .. .. .. *. 1+2.
8a. Persamaan regresi dari grafik log Indeks Pertumbuhan rata-rata terhadap waktu dari kalus Dioscorea batatas Decne pada media
(A) KDej (B) KDrj Zj-3
8b. No,
Persamaan regresi dari grafik log Indeks Pertumbuhan rata-rata terhadap waktu dari kalus Dioscorea batatas Decne pada media
(C) KDg (D) k dx0. . . . * . ,
DAFTAR LAMPI RAN
DISKRIPSI TAKSONOMI
1. Dioscorea hispida Dennst . . . 57
2. Dioscorea esculenta (Lour) Burk . .. .. .. 57
3* Dioscorea pentaphvlla L. .. . . . .
4- Dioscorea batatas Decne . . . 59
Gambar
1. Dioscorea h i Dennst .. .. .. .. ., £0 2. Dioscorea esculenta (Lour) Burk. . . . . 61 3* Dioscorea pentaphvlla L.- . . . 62 4* Dioscorea batatas Decne. •• .. .. - .. .• 63
Tabel
Hasil penimbangan bobot basah. kalus
Dioscorea pentaphvlla L. dalsun gram . . 64
Hasil penimbangan bobot basah kalus
Dioscorea batatas Decne dalam gram . 65
DAFTAR ISTILAH DAN SINGKATAN
BA benzylaminopurine; BAP
2,4 D 2,4 - dichlorophenoxyacetic acid
Eksplan potongan jaringan; organ yang diguna-kan untuk memulai kultur jaringan Friable rapuh
IP Indeks Pertumbuhan
IAA indole-3-acetic acid
Kalus suatu massa meristematik yang tak ter deferensisi dari sel tanaman yang ter bentuk pada kondisi in vitro
MS Murashige and Skoog
NAA -naphthaleneacetic acid
Subkultur pemindahan aseptik dari bagian suatu kultur pada media
t, waktu duplikasi
DAFTAR ISTILAH DAN SINGKATAN
b enzylaminopurine; BAP
2,if - dichlorophenoxyacetic acid
potongan jaringan; organ yang diguna- kan untuk memulai kultur jaringan rapuh
Indeks Pertumbuhan indole-3-a.cetic acid
suatu massa meristematik yang tak ter deferensisi dari sel tanaman yang ter bentuk pada kondisi in vitro
Murashige and Skoog
ck -naphthaleneacetic acid
pemindahan aseptik dari bagian suatu kultur pada media
BAB I
PENDAHULUAN
1.1 Latar belakang
Situasi kependudukan di Indonesia yang kurang menguntungkan. merupakan sebab dilaksanakannya Program Keluarga Berencana Nasional. Salah satu sasaran. Pro
gram Keluarga Berencana yakni sasaran langsung merupa- kan usaha menurunkan tingkat kelahiran melalui pema- kaian kontrasepsi. Hasil yang dicapai pada pelaksana-
an Program Keluarga Berencana cenderung mengalami pe- ningkatan (1). Pencapaian peserta Keluarga Berencana
aktif secara nasional hingga tahun 1985/1986 sebesar
5 0 ,4 % dari jumlah pasangan usia subur dengan. penggu-
naan obat kontrasepsi mencapai lebih dari 60 % (2)* Obat kontrasepsi banyak digunakan karena. pemakaiannya mudah, praktis, efektif dan aman. untuk jangka lama.
ta-hun kemungkinan. akan kekurangan bahan untuk sumber
bahan baku hormon steroid, Oleh karenanya perlu di-
kembangkan metode untuk mendapatkan bahan .-baku hor-
mon steroid disamping pemanfaatan. dan pengembangan
sumber daya alam (3)..
Dari hasil pertemuan ilmiah di Meksiko tahun 1975
diketahui sebagai sumber bahan baku steroid yang; pa
ling banyak diproduksi adalah diosgenin (3)* Dios-
genin merupakan metabolit sekunder yang diteraukan
pada jenis tanaman Dioscorea. Tanaman Dioscorea di
Indonesia terdapat lebih dari 1+0 jenis, baik yang sengaja ditanam majipun yang tumbuh liar.
Untuk mendapatkan senyawa/metabolit sekunder
dari tanaman pada umumnya dapat dilakukan dengan bu-
didaya tanaman. Kesulitan dalam produksi metabolit
sekunder disebabkan oleh semakin berkurangnya sumber
bahan alam yang tersedia, biaya produksi yang mahal,
kesulitan ekonomis dan teknis penanaman ( k) * Kemaju-
an bidang bioteknologi membuka kemungkinan-kemung-
kinan baru dalam produksi metabolit sekunder yaitt
dengan teknik kultur jaringan. Dengan t-eknik kultur
jaringan diperoleh keuntungan antara lain: senyawa
berguna diproduksi pada kondisi terkontrol, bebas
dari pengaruh mikroba dan insekta, tidak tergantung
iklim dan letak geografis (5).
menunjukkan produksi diosgenin mencapai 7 ,8 % dari
kultur jaringan Dioscorea deltoidea. Sejumlah jenis
lain dari Dioscorea seperti Dioscorea composita.
Dioscorea floribunda. Dioscorea glandulosa telah di-
teliti kemampuannya untuk memproduksi diosgenin jika
ditanara pada kultur suspensi sel (6)* Dari peneliti
an yang dilakukan Tjondronegoro dkk., beberapa jenis
Dioscorea yaitu Dioscorea bulbifera.
Dioscorea hispida. Dioscorea esculenta diketahui ke
mampuannya memproduksi diosgenin jika ditanam pada
media kultur jaringan (?)•
Dengan dasar penelitian yang telah dilakukan ma-
ka dapat dikembangkan produksi diosgenin dengan tek-
nik kultur jaringan guna mencukupi kebutuhan bahan
baku pembuatan hormon steroid. Dengan teknik kultur
jaringan tahap awal yang harus -dilakukan adalah pena-
naman eksplan (potongan jaringan) pada media yang
sesuai dimana akan dihasilkan suatu massa yang tak
terdeferensiasi disebut kalus* Kultur kalus diketa
hui mampu memproduksi metabolit sekunder. Untuk men-
dapatkan hasil yang optimal dalam produksi metabolit
sekunder menurut Keinstein diperlukan cara induksi
kalus dari tanaman antara lain dengan pembuatan kul
tur dari tanaman, optimasi media untuk pertumbuhan
kultur yang haik, tanpa memperhatikan kemampuannya
Dari kultur kalus, kalus yang terbentuk dapat di-
subkulturkan dengan memindahkan ke.'dalam media;, baru
atau untuk produksi dalam jumlah besar dipindahkan ke-
dalam kultur suspensi atau kultur fermentor* Kultur
kalus untuk produksi dalam jumlah besar kurang meng-
untungkan karena tumbuhnya relatif lambat. Tetapi, se-
bagai tahap awal untuk mencapai kultur suspensi atau
kultur fermentor, harus diketahui terlebih dahulu ke-
mampuan pembentukan kalus dari suatu tanaman dan media
yang sesuai untuk pertumbuhan kalus sebagaimana dike-
mukakan Heinstein (5,9>10), Dengan demikian dapat di-
lakukan penelitian lebih lanjut mengenai kandungannya
dan keuntungannya untuk dikembangkan dengan teknik
kultur jaringan.
1.2 Tujuan penelitian
Penelitian yang dilakukan bertujuan:
1. Menumbuhkan kalus dari tanaman Dioscorea s p.
pada media buatan Murashige - Skoog dengan penam- bahan zat pengatur tumbuh tertentu.
2. Mengetahui gambaran pertumbuhan kalus Dioscorea s p
«-dalam bentuk grafik log Indeks Pertumbuhan rata- rata terhadap waktu, pada beberapa kombinasi kon-
sentrasi zat pengatur tumbuh*
3. Mengetahui waktu duplikasi kalus Dioscorea s p.
TINJAUAN PUSTAKA
11*1 Kultur jaringan
Kultur jaringan dapat didefinisikan sebagi ba- gian atau jaringan yang telah dipindahkan dari tanam- an. asalnya dan ditumbuhkan dalam keadaan steril pada suatu media buatan, dan sel-selnya mampu tumbuh dan mengadakan pembelahan (5).
Kultur jaringan didasari oleh teori sel Schwann dan Schleiden yang menyatakan bahwa sel hewan dan sel tumbuhan merupakan satuan biologis terkecil yang mampu melakukan aktivitas hidup seperti metabolisme, reproduksi dan tumbuh. T.H. Morgan mengemukakan sifat totipotensi dari suatu sel dimana sel mampu berkem**. bang menjadi organisme. Pendapat tersebut menjadi salah satu dasar berkembangnya teknik kultur jaring an (8,9). Teknologi kultur jaringan tanaman dapat di- bagi dalam lima kelas berdasarkan bahan yang diguna- kan (9) :
a. Kultur kalus b. Kultur sel c. Kultur organ
d. Kultur meristem dan morfogenesis e. Kultur protoplast
turkan secara aseptik pada media nutrisi. Kultur
dimulai dengan penanaman eksplan yang telah diste-
rilkan pada media agar.. Dalam dua sampai empat ming-
gu, tergantung dari jenis tanaman, suatu massa sel
tak terorganisasi terbentuk yang disebut kalus.
Kalus dapat disubkulturkan tak terbatas dengan me-
mindahkan ke dalam media baru. Waktu yang diperlu-
kan untuk mendapatkan jaringan kalus sangat berva-
riasi tergantung jenis tanaman, asal eksplan dan
komposisi nutrisi media (9).
Keuntungan teknik kultur jaringan dibandingkan
teknik konvensional antara lain (6,9) :
1. Kondisi dapat dikontrol, sehingga dapat dihasil-
kan produksi tertentu yang diinginkan.
2.. Bebas pengaruh mikroba dan insekta.
3- Dapat ditanam dimana saja, 'tidak tergantung pada
letak geografis dan iklim,.
Dengan keuntungan teknik kultur jaringan, maka
dapat dikeaibangkan imtuk-tiijuan. (4*5')‘
1- Produksi senyawa-senyawa tertentu yang berguna
dalam bidang farmasi/medis.
2. Eiotransforaasi senyav/a-senyav/a tertentu menja- di senyav;a yang dapat digunakan dalam bidang f annasi/me di s.
3.. Produksi senyawa-senyawa spesifik.
a-kai pada bidang pertanian dan hortikultura.
5. Multiplikasi tanaman secara cepat dan seragam.
XI*2 Media kultur jaringan
Komposisi dari media kultur memegang peranan
penting dalam keberhasilan kultur jaringan. Ada be
berapa macam media kultur jaringan antara lain : me
dia Murashige - Skoog, B^, White, Heller, Gamborg et.
al., Gautheret, Hildebrandt et. al. yang pada dasar-
nya sama, dengan modifikasi pada komposisi dan jum
lah komponennya dimafta disesuaikan dengan tujuan
penelitian (1 1)*.
Media standar kultur jaringan terdiri dari
komposisi yang seimbang antara makroelemen dan mi-
kroelemen, vitamin, sumber karbon dan energi, se-
nyawa organik, sumber nitrogen dan zat pengatur
tumbuh* Penambahan bahan organik seperti air kela* pa, sari buah (tomat, semangka, jeruk), ekstrak tanaman (ekstrak ragi dan gandum) dan protein hi- drolisat dapat merangsang terjadinya pembelahan sel (9,11,12)..
Komponen media kultur jaringan pada dasarnya terdiri dari:
menunjukkan pertumbuhan optimal*. Sukrosa biasa
ditambahkan pada konsentrasi 20.000 - 45.000
mg/1 (5,12,13).
2* Makroelemen anorganik
Nutrisi makroelemen anorganik yang terutama di-
butuhkan untuk pertumbuhan meliputi : 'IT, P, Mg, S, K, Ca, Cl*. Nitrogen dibutuhkan dalam jumlah besar, diberikan dalam bentuk ion nitrat dan atau amonium,. Magnesium dan Sulfur diberikan da lam bentuk MgSO^. 7 1^0.. Kalium dibutuhkan dalam jumlah besar pula, diberikan dalam bentuk KC1, KNO^, atau KH^PO^.. Penambahan CaCl^,. 2 H^O dan Ca(N0^)2^ 4 ^ 0 atau bentuk garam lainnya untuk memenuhi kebutuhan kalsium. Sedangkan klorida berada dalam bentuk KC1 atau CaC^. Fosfor ber- ada dalam bentuk Nal^PO^. H20 atau KI^PO^ (9). 3.- Mikroelemen
Dibutuhkan oleh sel tanaman dalam jumlah kecil. Nutrisi mikroelemen yang diperlukan sel tanaman
tihggi adalah Cu, Zn, Mn, Fe, Bo, dan Mo. Bebe rapa media juga mengandung Co dan I (9)*'
4- Vitamin
piridoksin merangsang pertumbuhan, Mio - inositol
ditambahkan pada beberapa media dengan konsentra-
si 10 0 mg/1, dimaksudkan sebagai faktor pertum
buhan. Vitamin lain yang biasa digunakan adalah
asam para aminobensoat, asam askorbat, biotin,
kholin, sianokobalamin, as§m folat dan riboflavin
(9,13).
5. Zat pengatur tumbuh
Zat pengatur tumbuh yang digunakan untuk kebanyak-
an kultur jaringan terutama kultur kalus adalah
auksin dan sitokinin. Auksin mempunyai peranan
antara lain terhadap pengembangan sel, penbentuk-
an kalus dan pertumbuhan akar. Sitokinin mempunyai
peranan dalam proses pembelahan sel (14). Termasuk
dalam kelompok auksin yang sering digunakan untuk
keperluan kultur jaringan adalah IAA, 2,/+ D, NAA,
sedangkan sitokinin adalah kinetin, BA dan zea-
tin.
V/eier et. al. meneliti pertumbuhan tobacco
pith tissue culture dengan menggunakan auksin dan
sitokinin dalam berbagai perbandingan. Pada kon- sentrasi sitokinin lebih besar dari auksin memper- lihatkan stimulasi pertumbuhan tunas dan daun. Sebalikr.ya jika konsentrasi sitokinin lebih kecil
-nya berimbang maka pertumbuhan tunas, daun dan
akar berimbang juga. Pada konsen.trasi sitokinin sedang (intermediet) dan auksin rendah akan ter- bentuk kalus (14)« 2,4 D lebih potensial daripa- da IAA dan NAA. Kalus dapat terbentuk dari bebe- rapa eksplan pada konsentrasi 2,4 D kurang dari
0 , 1 mg/1., meski beberapa jaringan membutuhkan
5 - 1 0 mg/1 untuk merangsang pembelahan sel. Un tuk pembentukan kalus penambahan 2,4 D 0,2 - 2 mg/ 1 cukup eSektif untuk semua jaringan. tanaman. Sitokinin ditambahkan dengan konsentrasi 0,5 -
2 mg/ 1 (9).
6. Asam amino dan bahan organik konrpleks
Asam amino jarang ditambahkan dalam media kultur jaringan kecuali glisin* Jika diperlukan media diperkaya dengan kasein hidrolisat atau asam ca- samino* Penggunaan ekstrak alam seperti ekstrak ragi, ekstrak gandum dan sari buah dapat memban- tu. Sebagai contoh pertumbuhan in vitro dari eksplan beberapa jenis Citrus sangat dirangsang dengan penambahan sari jeruk pada media (9)-
tersebut. Beberapa penelitian terhadap kultur ja*
ringan Dioscorea sn. menggunakan media dasar Mura-
shige - Skoog (6,,..7,9).
II.3 Kondisi lingkungan kultur jaringan (13)
1.- Temperatur
Menuru'UDe Capite, temperatur optimum beberapa
kultur jaringan lebih tinggi dibandingkan tanam
an. asalnya tetapi menurut Riker dan Hildebrandt
sama dengan tanaman. asalnya. Secara umum kultur
jaringan tanaman akan tumbuh baik pada tempera
tur 20 - 28°C dengan temperatur optimal 26 -
27°C. Tetapi beberapa kultur jaringan. tanaman
tidak mengalami kerusakan pada temperatur 5 -
10°C.
2. Cahaya
Kultur suspensi tanaman umumnya tumbuh dengan
pencahayaan. redup, meskipun Torrey dan Reinert
melaporkan bahwa kecepatan tumbuh dalam keadaan
gelap maupun terang untuk jaringan tanaman ada-
lah sama. Blakerly dan Stewart melaporkan penca
hayaan pada kultur jaringan Haplopannus gravilis
menghasilkan kultur yang kompak dan kultur yang
tumbuh dalam gelap bersifat rapuh. Untuk merang-
sang pertumbuhan kalus yang optimum, kultur seba-
3- pH
Pada umumnya pH yang menguntungkan untuk pertum buhan kultur jaringan antara 5>0 - 6,5. White menyatakan. pH optimal adalah Beberapa media kultur ditambah dengan buffer phosphat karena
selama sterilisasi dan selama waktu pertumbuhan pH dapat berubah. Namun penambahannya sangat ter-
batas karena pada konsentrasi tinggi akan meng- hambat pertumbuhan. kultur.
4. Aerasi dan agitasi
Aerasi merupakan faktor penting untuk kekuatan pertumbuhan dari kebanyakan kultur suspensi ta naman. Aerasi dan agitasi yang memuaskan dicapai pada kultur yang tumbuh dalam carboys dengan me- lewatkan udara melalui fritted tube atau open ended glass tubing* Pengaduk magnjetik digunakan untuk menambah agitasi pada banyak tipe wadah kultur.
II.4 Kultur kalus dan karakteristiknya
Kultur jaringan tanaman yang paling umum adalah kultur kalus, dimana merupakan suatu massa yang tak
terdeferensiasi dari sel tanaman (13). Pada mulanya kalus diketahui terbentuk akibat adanya luka pada
Gautheret dan Nobecourt di tahun 1930' an membukti-
kan bahwa kalus dapat terbentuk dari jaringan ta
naman yang diisolasi.. Kalus dapat dihasilkan dari
semua bagian tanaman (15). Cara yang umum' adalah
dengan menanam bagian tanaman yang steril pada me-..,
dia kultur yang sesuai. Pemberian zat pengatur turn- buh pada konsentrasi tertentu akan merangsang pem- bentukan kalus. Kultur kalus dapat ditumbuhkan pada media padat dan media cair (13)*
Kalus dari jenis tanaman yarig berbeda bervari- asi dalam tekstur, kerapuhan dan warna.. Kultur ja ringan batang Citrus grandis mempunyai kalus berv/ar- na putih, kompak dan bernodul dengan pertumbuhan yang lambat, sedang kalus yang rapuh pertumbuhannya
cepat. Pada kultur jaringan batang Plumbago, Heble et. al. mengamati adanya pemisahan dari beberapa lini sel yang mempunyai perbedaan kemampuan tumbuh, morfologi dan pigmentasi. Kalus berpigmen hijau tum- buh lebih baik dibawah cahaya daripada pada keadaan gelap. Pigmentasi dipengaruhi konsentrasi gula, ada nya amiliuiii terlarut, defisiensi nitrogen, temperatur,
cahaya dan auksin eksogen (1 1)*
dari tipe sel yang berv.ariasi ukuran danbentuk, isi
sel dan ketebalan dinding selnya (1 1).
Kalus tumbuh selama periode waktu tertentu, bi-
asanya selama dua minggu sampai kira-kira tiga bulan.
Pada akhirnya akan dicapai ukuran optimum dan per tumbuhan akan menurun, Hal tersebut disebabkan makin
j*
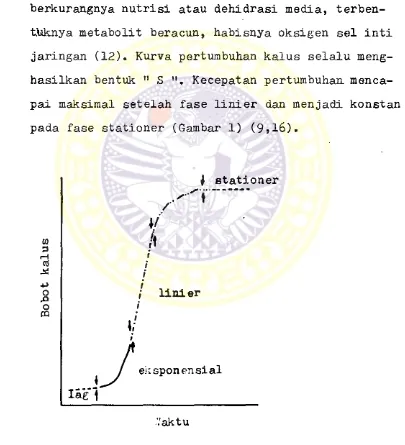
berkurangnya nutrisi atau dehidrasi media, terben- ttiknya metabolit beracun, habisnya oksigen sel inti jaringan (12). Kurva pertumbuhan kalus selalu meng- hasilkan bentuk n S Kecepatan pertumbuhan menca- pai maksimal setelah fase linier dan menjadi konstan pada fase stationer (Gambar 1) (9,16).
Produksi metabolit sekunder dalam kultur sel berkait- an erat dengan kurva pertumbuhan kalus, karena
(17) :
1. Pembentukan metabolit paralel dengan pertumbuhan sel.
2* Pembentukan metabolit diperlambat sampai pertum buhan berhenti.
3* Pembentukan metabolit terjadi setelah lag phase. II.5 Kultur jaringan sebagai sumber metabolit sekunder
Dengan keberhasilan pertumbuhan in vitro dari jaringan tanaman pada tahun 19 30 an maka studi ter hadap kultur jaringan berkembang pesat. Teknik kul tur jaringan tanaman membuka kemungkinan baru dalam usaha menemukan produk-produk berguna dari tanaman obat untuk keperluan industri (18,19)»
Produk yang telah diidentifikasi terdapat pada kultur jaringan tanaman. antara lain steroid, terpe noid, sapogenin, alkaloid, karbohidrat, ensim, fla-
da-ri tanaman asalnya. Beberapa kegagalan pembentukan
senyawa tersebut dikarenakan (2 0) :
1. Kurang atau tidak adanya prekursor yang diperlu
kan*
2. Tidak adanya ensim yang terlibat dalam lintasan
biokomia yang diperlukan*
3.- Pembentukan struktur sel tertentu.
4- Perubahan lokalisasi substrat dan ensim.
Dengan adanya perbedaan kondisi dan lingkungan denganrtanaman asalnya maka ada kemungkinan kultur jaringan mempunyai profil metabolit sekunder yang berbeda sekali dengan tanaman asalnya baik kuanti- tatif maupun kualitatif. Beberapa kultur suspensi yang mempunyai kandungan senyawa alam lebih tinggi dibandingkan tanaman asalnya adalah Coleus blumei
( 12 % asam rosmarinat ), Catharanthus roseus
( 0,8 % serpentin ), Dioscorea deltoidea ( 7,8 % di- osgenin ), Solanum aviculare ( 3 % asam betulinat ). Senyawa-senyawa yang diproduksi pada kultur jaringan tetapi tidak pada tanaman asalnya atau sedikit seka li antara lain : eduline dari Ruta graveolens. luci- dine dari Morinda citrifolia, paniculidis dari
Andrographis paniculata* 3-metilpurpurin dari
Lithospermum erythrorhlson, Demikian juga
ubikinon-10 yang diisolasi dari kultur jaringan tambakau
(5,21) .
Cara untuk meningkatkan produksi metabolit se
kunder adalah dengan optimasi media kultur jaringan,
optimasi kondisi dari bioreaktor/fermentor, penam-
bahan prekursor atau elisitor pada media, biotrans-
formasi dan seleksi strain.yang berproduktivi'tas
tinggi. Untuk mencari strain-strain yang mampu mem
produksi metabolit sekunder tertentu dalam jumlah
besar dilakukan seleksi strain. Cara seleksi yang
dikemukakan Heinstein merupakan perbaikan cara-cara
terdahulu, Secara ringkas cara Heinstein antara la
in (2 2) :
1. Pembuatan kultur tanaman.
2* Optimasi media untuk pertumbuhan kultur yang ba-ik tanpa memperhatba-ikan kemaunpuannya.
3. Mengembangkan metoda untuk menginduksi pemben tukan metabolit sekunder.
Dalam hal mendapatkan metabolit sekunder dengan teknik kultur jaringan agar mempunyai nilai ekonomis, maka diperlukan beberapa kriteria yang harus dipe- nuhi (2 1) :
1. Konsentrasi produk harus lebih besar dari tanam- asalnya.
su-kar diperoleh.
3* Produk biotransformasi dari bahan dasar yang mu- rah dan proses biotransformasi tidak dapat lewat
cara kimia atau mikroorganisme.
4* Untuk produksi senyawa kimia yang sukar sekali diperoleh pada tanaman asalnya seperti interme- diet biosintesa, ensim-ensim tertentu.
II. 6 Produksi diosgenin dari kultur jaringan Dioscorea Pada umumnya tanaman jenis Dioscorea mengandung diosgenin 4 - 3 % bo bothering (22). Kaul dan Staba pada tahun 19 68 pertama kali mengisolasi diosgenin dari kultur kalus Dioscorea deltoidea. Dihasilkan diosgenin dengan konsentrasi mendekati 1 % bobot ke- ring. Dari penelitian lebih lanjut, kultur secara normal tumbuh dalam kultur suspensi dengan adanya 2,4 D 1 mg/1. Sedang tanpa 2,4 D setelah 11 minggu kandungan diosgenin berkurang sampai sepertiga jum-
lah normal* Dengan penambahan kolesterol produksi diosgenin meningkat menjadi 2 ,3 % bobot kering (18, 19). Dari hasil penelitian Rokem et. el. mengenai kultur jaringan Dioscorea deltoidea dicapai kadar diosgenin 7,8 % bobot kering (6). Kultur jaringan Dioscorea s.ylvatica mengandung diosgenin 1,2 % bobot kering (11), Diosgenin juga telah diisolasi dari kul
Dari kultur jaringan D. deltoidea dilaporkan
biosintesa diosgenin berlabel jika jaringan diberi
4 C1^ dan 26 kolesterol. Juga telah diisolasi
diosgenin radioaktif, yonogenin dan tokorogenin da
ri kultur kalus D. tokoro dengan pemberian sikloar-
tenol radioaktif, kolest-5-en,3 £,16 ,2 6 triol dan
kolest-5-en,3 J5,16,2 2 ,2 6 tetrol (18)..
Penelitian yang dilakukan Tjondronegoro dkk. terhadap beberapa jenis Dioscorea. menunjukkan adanya diosgenin dari ekstrak kalus D. bulbifera. D. hispida dan D. esculenta. Analisa kuantitatif dari ekstrak kalus D. bulbifera pada media dengan penambahan NAA dan BAP mempunyai kandungan diosgenin lebih tinggi (0 , 4 %) daripada dengan 2 ,4 D (0,2.%)
(7). Tal dan Golberg melaporkan bahwa amonium dan sitrat dibutuhkan untuk pertumbuhan dan pembentukan diosgenin. Produksi diosgenin maksimum pada N yang tinggi. Pada konsentrasi NH^NO-^ 2,2 g/1 diperoleh 12,7 g. sel kering/liter. Jenis dan konsentrasi gula juga menentukan kandungan diosgenin. Dengan penambah an sukrosa 15 g/ 1 diperoleh 3 ,8 % diosgenin sesudah 21 hari dalam batch culture. Galaktosa pada konsen trasi 10 mg/ 1 menghasilkan diosgenin yang lebih tinggi dari penggunaan 30 rog/ 1 sukrosa (23)*
II.7 Tinjauan umun tanaman Dioscorea sp.
II.7
Divisi : Spermatophyta
Anak divisi : Angiospermae
Suku Dioscoreaceae dikenal sebagai jenis
ubi-ubian. Terdiri dari 10 marga yang terdi
ri dari lebih kurang 650 jenis, Tersebar lu-
as di daerah tropik dan subtropik. Tanaman
Dioscorea di Indonesia terdapat lebih dari
40 jenis, baik yang sengaja ditanam atau
tumbuh liar*
,2 Sifat-sifat tanaman Dioscorea (24»25j26,27)
Habitus : herba tahunan, tumbuh menjalar
atau membelit. Didalam tanah mem-
bentuk tubera, satu atau banyak,
adakalanya tumbuh tubera di ke-
tiak.
Batang : tumbuh dari tubera, membelit,
kadang bersayap atau berduri.
D a u n : tunggal kadang-kadang majemuk,
berhadapan, berseling atau ter
Bunga : beraturan* selalu berkelamin
satu, berumah satu. Daun +.-■
tenda bunga 6, dalam lingkar-
an masing-masing 3 pada pang-
kal kerapkali melekat. Bunga
jantan: benang sari 6, semua
fertil atau berkurang 3 men-
jadi staminodia* Bunga beti-
na: bakal buah tenggelam,
kerapkali beruang 3> bakal
biji 2 per ruang, tangkai pu-
tik 1 bercabang 3*
B a a h : buah kotak atau buah buni de
ngan 3 lobus, bersayap, mem-
buka pada waktu masak, biji
1 samjxai 2 tiap sel datar pa
da bagian atas atau meling-
kar, beralbumin.
11.7*3 Kandungan Dioscorea sp.
Kandungan tanaman Dioscorea sp. sangat ber-
variasi tergantung jenisnya. Tubera terutama
mengandung air 60 - 80 %, disamping karbohi-
drat 23 protein 2 %, sejumlah kecil vita
min B, C, dan karoten. Selain itu tubera
mengandung senyawa glikosida saponin, sterol,
asam fenolat. Diosgenin pada umumnya terda-
pat pada tan am an Dioscorea. Kandungan dios
genin berbeda pada tiap organ tanaman. Pa- iLittg-'banyak terdapat pada umbi, menyusul ba-
METODOLOGI PENELITIAN
111,1 Bahan
III..1..1 Eksplan
Eksplan berasal dari daun Dioscorea hispida Dennst., Dioscorea esculenta (Lour) Burk., Dioscorea batatas Decne yang diperoleh dari Kebun Raya Purwodadi dan telah diketahui identitasnya, dan Dioscorea pentaphvlla L..
yang diperoleh dari daerah Surabaya, yang determinasinya telah dilakukan sesuai dengan buku Flora of Java
(25).-111.1.2 Bahan kimia
Bahan kimia yang digunakan adalah produksi E. Merck Darmstadt dengan derajat " pro
analisa M kecuali disebutkan lain. Bahan pen- steril yang digunakan adalah Regular Klorox mengandung 5*25 % Natrium hipoklorit, pro duksi The Clorox Company, Oakland..
111.1.3 Agar
Agar yang digunakan adalah agar batangan me- rek " AA " yang diperoleh dari pasar Klojen, Malang.
111.1.4 Media
Murashige-Skoog (Tabel 1) dengan penambah
an zat pengatur tumbuh pada berbagai
kom-binasi konsentrasi (Tabel 2),
III-2 Alat
Alat yang digunakan pada penelitian :
- Laminar air flow cabinet Pharmeq Lab..''
- Otoklaf 25 liter (American Portable Autoclave WAF Co Inc.)
- pH meter Fisher - Monopan balance - Gelas beker - Cawan petri - Erlenmeyer - Gelas ukur - Pipet volum - Pinset
- Pisau scalpel - Lampu spiritus
- Botol bermulut lebar (diameter 3*5 cm, tinggi 7 cm. )
III.3 Cara kerja
III.3-1 Sterilisasi alat
III.3.1.1 Alat gelas, alat logam dan alumi nium foil.
alumi-nium f o i l ke m u d i a n d i s t e r i l i s a s i
di dalam oven 160°C selama empat
jam (9)..
111.3,1,2 Air suling
Sterilisasi dilakukan di dalam
otoklaf 121°c selama 15 menit.
III.3.2 Pembuatan media
Pembuatan media dilakukan sesuai dengan meto- de Kurashige , Masing-masing komponen media dibuat larutan stok dan dengan mencampur la- rutan-larutan stok diperoleh larutan MS. pH media diatur + 5>7 dengan penambahan la rutan NaOH 0,1 N atau HCl 0,1 N. Setelah di- tambah 1 % agar, larutan dituqng ke dalam botol bermulut lebar sebanyak 25 ml. Botol ditutup rapat dengan aluminium foil dan di- sterilkan dalam otoklaf 121°C, tekanan 20 psi selama 15 menit.
III.3-3 Penanaman eksplan
Daun Dioscorea sp. dicuci bersih dengan air suling. Direndam dalam alkohol 90 % selama 2 menit, kemudian disterilkan dalam larutan Klorox 30 % (mengandung Natrium hipoklorit 1*575 %) selama 10 menit. Setelah dibilas
dekat pangkal helai daun + 5 mm, kemudian
ditanam pada media. Semua pekerjaan dilakukan
dalam laminar air flow cabinet.
III.3.4 Pemindahan kultur kalus
Botol kultur yang berisi kalus dibuka tutup- nya kemudian mulut botol dibakar. Dengan meng- gunakan scalpel steril, kalus dipindahkan ke dalam media baru. Mulut botol dan tutup alu minium masing-masing dibakar, kemudian botol ditutup rapat.
III.3*5 Pengamatan hasil
III.-3*-3*l Pemeriksaan makroskopis kalus
Pemeriksaan makroskopis kalus me- liputi :
- warna - tekstur
- organogenesis
111.3.5.2 Pengamatan pertumbuhan kalus
Parameter pertumbuhan kalus dihya^-takan dengan Indeks Pertumbuhan (IP). Indeks Pertumbuhan didefini-sikan sebagai :
Bobot basah kalus akhir
IP = --- x 100 Bobot basah kalus awal
di-keluarkan dari botol kultur kemudi-
an ditimbang. Bobot awal kalus di
peroleh dengan cara:
B ~ B — B
av/ ” media + kalus “ media
111.3.5*3 Pengolahan data
Dari data yang diperoleh d^'buat gra fik log IP rata-rata terhadap waktu. Dengan menghitung persamaan regresi yang dilakukan pada minggu I sampai dengan minggu II, dapat diketahui waktu duplikasi (t^) dari kalus ya-
= specific growth rate 0,693
t , =
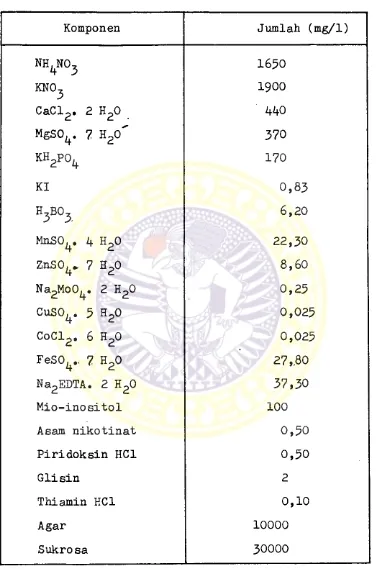
Tabel i. Komposisi kimiawi media Murashige & Skoog
Komponen Jumlah (mg/1)
NH.NO,
4 3 1650
KNO^ 190 0
CaCl2. 2 H20 440
Mgso^. 7 h2o" 370
KH2P0if 170
KI 0,83
H,BO,
3 3 6,20
MnSO^. 4 H20 22,30
ZnSO^* 7 H20 8,60
Na2MoO^# 2 H20 0,25
CuSO^. 5 h2o 0,025
CoC12. 6 H20 0,025
FeSO^.. 7 H20 27 ,,80
Na2EDTA. 2 H20 37,30
Mio-inositol 100
Asam nikotinat 0,50
Piridoksin HC1 0,50
Glisin 2
Thiamin KC1 0,10
Agar 10000
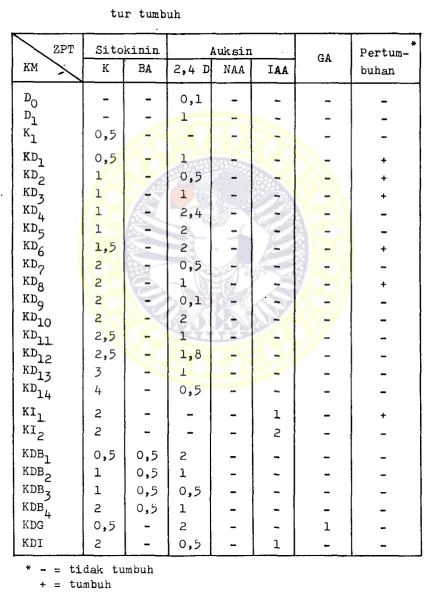
Tab.el 2. Rancangan kombinasi zat pengatur tumbuh
untuk pembentukan kalus Dioscorea sp
Ket: ZPT= Zat pengatur tumbuh ; KM= Kode media
BAB IV
HASIL PENELITIAN
IV.1 Sterilisasi
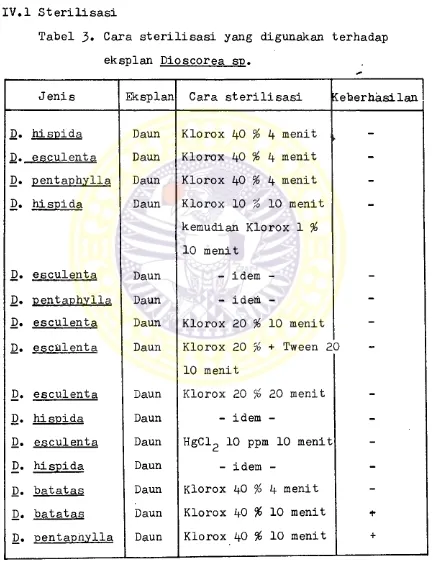
Tabel 3* Cara sterilisasi yang digunakan terhadap eksplan Dioscorea s p.
Jenis Eksplan Cara sterilisasi {eberhasilan
D. hispida Daun Klorox 40 % 4 menit ► -D. esculenta Daun Klorox 40 % 4 menit -D. pentaphylla Daun Klorox 40 % 4 menit -D. hispida Daun Klorox 10 % 10 menit
kemudian Klorox 1 % 10 menit
D. esculenta Daun - idem -
-D. pentaphvlla Daun - idem -
-D. esculenta Daun Klorox 20 % 10 menit -D. esculenta Daun Klorox 20 % + Tween 2
10 menit
3
D. esculenta Daun Klorox 20 % 20 menit
-D. hispida Daun - idem -
-D. esculenta Daun HgCl2 10 ppm 10 menit
-D. hispida Daun - idem -
IV.2 Pembentukan kalus
Tabel 4* Pembentukan kalus dari eksplan Dioscorea s p.
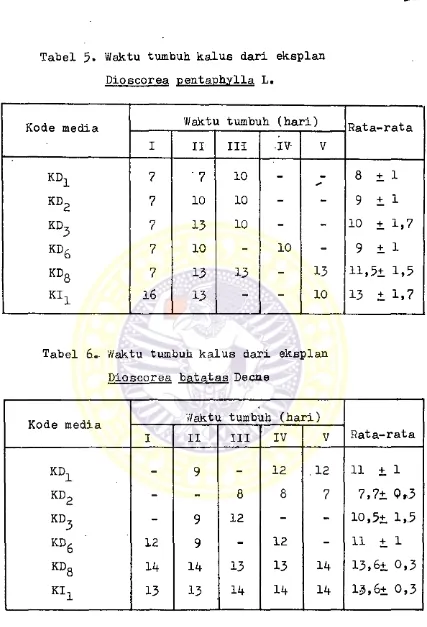
Tabel 5. Waktu tumbuh kalus dari eksplan
Dioscorea nentanhylla L.
Kode media Waktu tumbuh (hari) Rata-rata
I II III -IV- V
KD1 7 7 10 - 8 + 1
k d2 7 10 10 - - 9 + 1
KD^ 7 13 10 - - 10 + 1,7
k d6 7 10 - 10 - 9 + 1
KDg 7 13 13 - 13 11,5+ 1,5
KI1 16 13 - - 10 13 + 1,7
Tabel Waktu tumbuh kalus dari eksplan
Dioscorea batatas Decne
Kode media Waktu tumbuh (hari)
Rata-rata
I II III IV V
KD^ - 9 - 12 .12 1 1 + 1
k d2 - - 8 8 7 7,7+ 9*3
KD^ - 9 12 - - 10,5+ 1,.5
KD6 ■ 12 9 - 12 - 1 1 + 1
KDa 14 14 13 13 14 13,6+ 0,3
IV»3 Pemeriksaan makroskopis
Tabel 7. Pemeriksaan makroskopis kalus Dioscorea pentaphvlla L.
Kode media Warna Tekstur Organogenesis
KDr coklat muda kompak terbentuk dan daun
tunas
k d2 coklat muda kompak terbentuk dan daun
tunas
KD3 coklat muda kompak terbentuk dan daun
tunas
k d6 coklat tua keputihan
kompak
-KDa coklat ke putihan
kompak
-KIL coklat ke putihan
W i * -- >
“““ / V
1] * "
^ a
Gambar 2. Terjadinya organogenesis pada kalus
Dioscorea pentaphvlla L«. pada media
(A) KDlf (B) KD3
Tabel 8. Pemeriksaan makroskopis kalus Dioscorea batatas Decne
Kode media Warna Tekstur Organogenesis
KD1 putih — ► coklat rapuh
-k d2 putih — ► coklat rapuh
-KD^ putih — ► coklat rapuh
-k d6 putih — ► coklat rapuh
-k d8 putih — * coklat rapuh
-* k'
L .
M
Gambar:3«- Kalus Dioscorea batatas J)ecae yang dita- nam pada media (A) KDcj (B) KD« pada
minggu ke IV ^ '
\ N ' c ; ! s v
-7 Jfc - „ V ' *' ■ ■ '
* _______ S v ^ ' ^
-’ ^ A ^ i‘^'r ^ ;
^ £■
' 1 * - V v \ '
* . 'V " V ' ' V fv' ,
^ i* , v' \ - s
, - * A' 1~ -v - ^ > - r , ' / p . f ;
: Y
m s.
IV*4 Hasil perhitungan
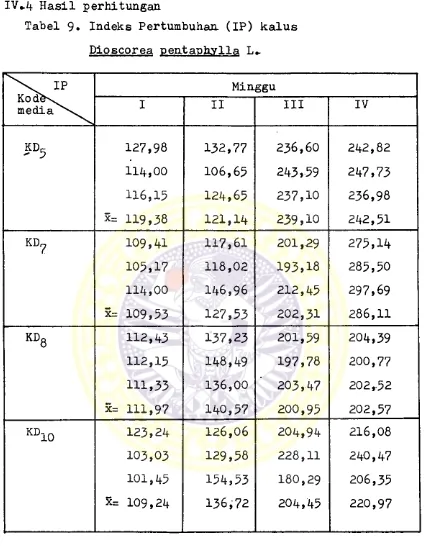
Tabel 9* Indeks Pertumbuhan (IP) kalus
lo
g
I
n
d
e
k
s
Pe
rt
u
m
b
u
h
a
n
Waktu (hari)
Tabel 10.. Contoh perhitungan persamaan jregresi dari
data Indeks Pertumbuhan rata-rata dan wak
tu (kalus Dioscorea pentaphvlla L. pada media KD^)
n
iVaktu IP log IP
x2 y2 xy ^hit.
X y
1. 7 119,38 2,0769 49 4,3133 14,3383 2,0284 2. 14 121,14 2,0833 196 4,3401 29,1662 2,1796 3. 21 239,10 2,3786 441 3,6377 49,9506 2,3308
lu
g
I
n
d
e
k
s
Pe
rt
umb
uha
n
Waktu (hari)
Tabel 12. Waktu duplikasi (t^) kalus
Dioscorea pentaphvlla L*.
Kode media Slope
(hari)
KD^ 0,0216 13,94
kd7 0 ,0 19 0 15 , 8 2
kd8 0,0181 16., 62
KD10 0,0205 16 ,6 2
14 , 68
Tabel 1>. Vfaktu duplikasi (t^) kalus
Dioscorea batatas Decne
Kode media Slope
** (hari)
k d^ 0,0159 18,93
kd7 0 ,0 14 6 20,62
KDg 0,0142 21,19
PEMBAHASAN
Proses sterilisasi pada jenis tanaman Dioscorea di- pengaruhi beberapa faktor antara lain lokasi pengambilan
bahan dan morfologi dari bagian yang digunakan. Bahan yang diperoleh dari lapang ternyata mempunyai tingkat kontami- nasi yang cukup tinggi. Adanya bulu-bulu halus pada daun menyulitkan penetrasi bahan pensteril seperti yang terja-
di pada Dioscorea hispida Dennst dan Dioscorea esculenta (Lour) Burk. Pada daun Dioscorea batatas Dedne tidak terda- pat bulu sedangkan Dioscorea pentaphylla L. berbulu kaku dan jarang, sehingga proses sterilisasi lebih mudah. Meski- pun demikian diperlukan konsentrasi yang cukup tinggi dari
bahan pensteril (Klorox) yaitu 40 % dimana mengandung
2,1 % Natrium hipoklorit. Seperti yang dilakukan Tjondro- negoro dkk. ternyata tingkat kontaminasi dari bahan yang diperoleh dari lapang mencapai 80 - 9 0 dari kultur umbi. Oleh kareaanya penyimpanan tanaman dalam rumah kaca di- anjurkan. untuk memperkecil terjadinya kontaminasi (?) atau penggunaan biji sebagai bahan untuk inisiasi pembentukan kalus akan mempermudah proses sterilisasi (29)*
Selanjutnya untuk pembentukan kalus digunakan eksplan daun Dioscorea batatas Decne dan Dioscorea pentaphvlla L. Pembentukan kalus pada kedua jenis Dioscorea ini cukup su^v; lit. Dari 25 macam kombinasi zat pengatur tumbuh pada media
MS hanya 6 macam kombinasi yang berhasil yaitu :
Keberhasilan pembentukan kalus disamping dipengaruhi
adanya zat pengatur tumbuh juga dipengaruhi oleh asal
eksplan (organ yang digunakan), umur organ dan ukuran
eksplan. Pada Dioscorea pentaphylla L. potongan helai da un lebih mudah membentuk kalus daripada tangkai daun. Se- dang pada Dioscorea batatas Decne terbentuknya kalus dari helai dan tangkai daun sama lambatnya. Kalus mulai tumbuh 7 - 1 4 hari setelah penanaman, tetapi proses pertumbuhan selanjutnya sangat lambat. Pembentukan kalus pada eksplan Dioscorea pentaphylla L.. diawali dengan terjadinya pem- besaran massa, daun menggelembung dan menggulung. Kalus berwarna coklat - coklat keputihan dan kompak. Pada
Dioscorea batatas Decne kalus tumbuh pada bagian yang ter- potong dari eksplan, berwarna putih yang kemudian menjadi
coklat dan friable. Untuk mengatasi pertumbuhan kalus yang lambat, perlu dilakukan optimasi media pertumbuhan untuk mendapatkan pertumbuhan kalus yang optimal.
Browning terjadi pada kultur kalus
Media yang ditanami berwarna coklat, kadang ungu kebiru-
an. Browning terjadi karena oksidasi senyawa-senyawa fe-
nolik akibat adanya pelukaan karena pemotongan. Terben-
tuknya senyawa ini kemudian menyebar dan menurapuk dida-
lam media sehingga warna media menjadi coklat. Pada ke- adaan ini sukar•terbentuk kalus karena senyawa fenolik yang menyebabkan browning menghambat pertumbuhan, mau- pun proses pemhelahan dan perpanjangan sel. Untuk menga- tasi gejala browning jnaka disarankan penaigbahan anti
ok-si-dan antara-lain as'an* askorbat, sistein.
Adanya variasi konsentrasi zat pengatur tumbuh dan asal eksplan mempengaruhi pertumbuhan kalus dan terjadi- nya organogenesis. Pada media dengan konsentrasi zat pe ngatur tumbuh (1) 0,5 ppm kinetin + 1 ppm 2,4 D, (2) 1 ppm kinetin + 1 ppm 2,4 D, (3) 1 ppm kinetin + 0,5 ppm. 2,4 D
terbentuk tunas dan daun dari kalus 'Dioscorea pentaphvlla.- L. setelah + 3 bulan (84 hari). Jumlah tunas mencapai 7 -11 buah.
Kalus yang terbentuk setelah cukup besar baru disub- kulturkan. Pengamatan terhadap pertumbuhan kalus dilaku kan dengan penimbangan bobot basah kalus. Dari hasil per- hitungan Indeks Pertumbuhan dibuat grafik log Indeks Per
sampai minggu keempat belum mencapai fase stationer,
de-mikian juga Dioscorea batatas Decne pada media KDr,.. De -
ngan deraikian subkultur sebaiknya dilakukan antara ming
gu kedua dan ketiga karena pada masa tersebut kecepatan
pembentukan kalus meningkat.
Dari perhitungan waktu duplikasi diketahui waktu du- ^
plikasi kalus dalam penelitian ini untuk
Dioscorea pentaphvlla L. paling cepat 13s94 hari pada me
dia KD^ (MS + 1 ppm kinetin + 2 ppm. 2,4 D). Pada
Dioscorea batatas Decne waktu duplikasi paling cepat pada media KD^q (MS + 2 ppm kinetin + 2 ppm. 2*4 D) yaitu
BAB VI
KESIMPULAN
Dari penelitian ini dapat disimpulkan: 1* Eksplan Dioscorea esculenta (Lour) Burk, dan
Dioscorea hispida Dennst,. pada penelitian ini tidak ^ berhasil disterilkan, sedang eksplan
Dioscorea batatas Decne dan Dioscorea pentaphylla L. dengan penggunaan Klorox 40 % (mengandung 2,1 V> Natrium hipoklorit) diperoleh eksplan steril.
2. Media yang rc&npu menumbuhkan kalus dari eksplan
Dioscorea batatas Decne dan Dioscorea pentaphylla L. adalah:
- MS + 0,5 ppni kinetin + 1 ppm 2,4 D - MS + 1 ppm kinetin + 0,5 ppm 2,4 D - MS + 1 ppm kinetin + 1 ppm 2,4 D - MS + 2 ppm kinetin + 1 ppm 2,4 D - MS + 1,5 ppm kinetin + 2 ppm 2,4 D - KS + 2 ppm kinetin + 1 ppm IAA
3. Adanya variasi konsentrasi zat pengatur tuvabuh, asal eksplan dan ukuran eksplan mempengaruhi terjadinya or ganogenesis dan pertumbuhan kalus.
4.- Waktu duplikasi (t<j) paling cepat pada penelitian ini:
- Kalus Dioscorea pentaphvlla L. pada media KS + 1 ppm
kinetin + 2 ppm 2,4 D yaitu 13,94 hari,
- Kalus Dioscorea batatas Decne pada media MS + 2 ppm
BAB VII
SARAN
Dengan mengetahui kemampuan pembentukan dan pertum
buhan kalus dari Dioscorea pentaphvlla L. dan
Dioscorea batatas Decne pada penelitian yang telah
dilakukan perlu diadakan penelitian optimasi media
untuk mendapatkan pertumbuhan kalus yang optimal
RINGKASAN
Dilakukan percobaan inisiasi kalus terhadap 4 jenis
Dioscorea. Pada proses sterilisasi daun Dioscorea hispida Dennst dan Dioscorea esculenta (Lour) Burk dipengaruhi adanya bulu-bulu halus sehingga menyuiitkan penetrasi dari bahan pensteril, disamping dipengaruhi juga oleh faktor lokasi pengambilan tanaman. Untuk percobaan selanjutnya di gunakan 2 jenis Dioscorea yang berhasil disterilkan yaitu Dioscorea pentaphylla L. dan Dioscorea batatas Decne.
Pembentukan kalus dari kedua jenis Dioscorea yang digunakan terjadi rata-rata 7 - 1 4 hari setelah penanaman eksplan pada media Murashige - Skoog dengan penambahan zat pengatur tumbuh kinetin, 2,4 D dan IAA. Pertumbuhannya lambat dan pada Dioscorea pentaphylla L. terjadi browning pada media. Organogenesis terjadi pada kalus
Dioscorea pentaphylla L. + 3 bulan setelah penanaman dengan terbentuknya tunas dan daun.
1. Laporan Analisa Data. Program Keluarga Berencana Nasi onal Triwulan I Tahun 1985/1986* Badan Koordinasi Ke luarga Berencana Nasional. p. 20.
2. Panjaitan, Sahala. dan Gandung Sujiantov 1986. Dampak Praktek Peraakaian Kontrasepsi pada Tingkat Kelahiran.; Badan Koordinasi Keluarga Berencana Nasional, Biro Ana lisa Pelaksanaan Program: Jakarta, pp. 1,2.
3*- Hakim, A. dan S. Tatang, 1975* Prospek Alkaloid Solanum sebagai Sumber Bahan Baku Kormon Steroid di Indonesia.; Simposium Tanaman Obat ke 1. Bogor. pp. 105, 106.
4. Isnaeni. 1986. Optimasi Pembentukan Kalus dan Identi- fikasi Steroid dari Solanum mammosum L. Tesis. Univer sitas Airlangga. Surabaya, pp. 33-37*
5* Indrayanto, Gunawan. 1986. Prospek Kultur Jaringan Ta naman pada Bidang Farraasi. Buletin ISFI Jatinu 1 7, 12-13...
6. Rokem, J.S., B. Tal dan I. Goldberg. 1985* Methods for Increasing Diosgenin Production by Dioscorea Cells in Suspension Culture. Journal of Natural Products. 4 8.
2 1 0
-
2 1 2,
2 2 0. .
.
7* Tjondronegoro, P.D. et. al. 19 8 6. Usaha Peningkatan Kadar Diosgenin pada Dioscorea spp. dengan Cara Kultur In Vitro. Institut Pertanian Bogor. pp. 42-47.
8. Heinstein, P. 1985* Journal of Natural Products. 48
1-10.
9* Dodds, J*H. and L.7/. Roberts. 1982. Experiments in Plant Tissue Culture..; Cambridge University Press: Cambridge, pp- 1-56
10. Thorpe, T .A. 1961. Plant Tissue Culture, Kethods ang Application in Agriculture.; Academic Press; New York,
11.. Narayanaswamy, S. 1977. Regeneration of Plants from
Tissue Culture.. In: Plant Cell,- Tissue, and Organ Culture, Chapter I..; Springer - Verlag: Berlin, pp. 180-186.
12. Thomas, E. and M.R. Davey.. 1975- From Single Celle to Plants.; Wykeham Publication Ltd: London, pp. 19-21, 56.
13* Puhan, Z. anc[ Martin S.M. 1975. The Industrial Poten- sial of Plant Cell Culture.. Nat.. Res. Counc. of
Canada 11595. pp. 15-19,
23,24-14. Abidin, Zainal. 1985. Tentang Zat Pengatur Tumbuh.; Penerbit Angkasa: Bandung, pp.. 14, 57-59*
15. Audus, L.J. 1953. Plant Growth Subtances.; Neill and Co. Ltd: Edinburgh, p. 325.
16. Bhojwani, S.S. and M.K. Razdan. 1980. Plant Tissue Culture Theory and Practise.; Elsevier, pp. 25-53. 17. Stohs, S.J. 1977. Metsbolisra of Steroid in Plant
Tissue Culture. In: Plant Tissue Culture and Its Biotechnological Application..; Springer - Verlag: Berlin, pp.
7—11-18. Khanha, Puspha. 1977. Tissue Culture and Useful Drug, A Review on Twenty Plant Species Grown In Vitro. In: Cultivation and Utilisation of Medicinal and Aromatic Plants.; Regional Research Laboratory; Jammu-Tawi. pp. 495-499.
19. Stohs, S.J. and H. Rosenberg. 1975. Steroid and Steroid Metabolism in Plant Tissue Culture. Lloydia. .3fi, 181-188.
21. Indrayanto, Gunawan. 1987. Produksi Metabolit Sekun der dengan Teknik Kultur Jaringan Tanaman. Seminar Nasional Metabolit Sekunder. PAU Teknologi - Univer-
sitas Gajah Mada.- pp. 4-6.
22. Staba, E.J. 1977* Tissue Culture and Pharmacy. In: Plant Cell, Tissue, and Organ Culture, Chapter VI.; Springer - Verlag: Berlin, pp. 700-701.
23. Tal, B. and I. Goldberg. 1982. Growth and Diosgenin* Production by Dioscorea deltoidea Cells in Batch and Continuous Cultures. Planta Medica. 107--H0.*.' 24.- Heyne, K. 1950. De Nuttige Planten van Indonesia I,
3e Druk.; N.V. Vitgeverij van Hoeve’s Gravenhage: Bandung, pp. if5^-Zf61.
25. Backer, WSc5. C.A. and R.C. Bhakhuizen van den Brink Jr. 1968. Flora of Java, Vol. III.; Wolter Noordhoff N.V.: Groningen, pp. 154-155.
26. Claus, E.P. 1961. Pharmacognosy, 4th Edition.; Lea & Febiger: Philadelphia, pp. 129-131> 134*
27. Van Steenis, C.G.G.J. et. al. 1975* Flora untuk Seko- lah di Indonesia.; Penerbit Pradnya Paramita: Jakarta, pp. 160.161.
28. Mantell, S.H., J.A. Matthews and R. A. McKee. 1985. Principles of Plant Biotechnology.; Blackwell
Scientific. Publications: Oxford, pp. 102-104.
LAMPIRAN
DISKRIPSI TAKSONOMI
1* Dioscorea hispida Dennst* (Gambar lampiran 1)
Tanaman ini di Jawa dikenal dengan nama Gadung. Merupakan tanaman yang banyak dikenal, tumbuh dengan baik secara liar maupun sengaja ditanam. Biasanya terdi- ri dari 20 - 30 tuber yang besar dengan disekitarnya ter- dapat tuber yang kecil, sehingga tanah akan membengkak. Sebagai makanan, sukar pengolahannya. Harus direndam dan dicuci berulang-ulang.
: perdu memanjat, tinggi mencapai 3 - 1 0 meter,
: berbentuk bulat, berbulu dan berduri, berwarna hijau kekuningan dengan diame ter 9 mm. atau lebih.
: majemuk terdiri dari 3 anak daun, berbu lu.
: berbentuk bulat, kadang memanjang. Berat mencapai 35 kg. kadang lebih. Kulitnya berwarna kekuning-kuningan sampai kelabu terang. Dagingnya berwarna putih sampai kuning jeruk.
2. Dioscorea esculenta (Lour) Burk. (Gambar lampiran 2) Tanaman ini dikenal dengan narna Gembili (Melayu, Jawa), !luv:i butul (Sunda). Terraasuk jenis yang banyak Habitus
Batang
Daun
ditanam karena tubernya enak dimakan.
Habitus
latang
Daun
Tubera
perdu meman.jat yang dapat mencapai
tinggi 3 - 5 m.
berbentuk bulat, berbulu halus dan ber*
duri tersebar diseluruh batang,
tunggal, berbentuk jantung, berbulu
dan kadang terdapat duri pada bulu-bu-
lunya.
berbentuk bulat sampai bulat panjang,
berjumlah banyak. Kulitnya berwarna
coklat muda atau coklat kelabu dan ti
pis sehingga mudah terobek. Dagingnya
berwarna putih, berasa sedikit pahit
pada bagian luar tetapi keseluruhannya
mempunyai rasa manis. Tuber dilindungi
batang kecil berduri.
3. Dioscorea pentaphylla L. (Gambar lampiran 3)
Tanaman ini dimasukkan golongan setengah liar, ka
rena banyak ditemukan di hutan. Tubera dimakan dengan
cara direbus atau dibakar.
r. abitus
Terdapat banyak bulbil.
: majemuk palmatus dengan anak daun
3, 5 atau 7, berbulu.
menjari, diliputi akar yang berbulu.
Dagingnya berwarna putih atau kuning
jeruk kadang terdapat bintik-bintik
ungu.
k* Dioscorea batatas Decne (Gambar lampiran 4).
Disebut juga Chinese yam, Chinese po.tato, Cinnamon
vine.
Habitus : tanaman memanjat, tinggi mencapai 3 - 8 m,
Batang : bulat, tidak berbulu.
Daun : tunggal, dengan 7 - 9 tulang daun, berben
tuk jantung membulat dan bercangap, li-
cin*
Tubera :
-Identitas tanaman ini tidak banyak diketahui. Bia-
sanya tumbuh di daerah tropis, umbinya dapat dimakan.
Tanaman ini sangat tahan terhadap cuaca.
Burkill, I.H. 1951. Dioscoreaceae. In: Flora Malesiana.
Series I. Volume 4- Noordhoff - Kolff N.V. Djakarta*
PP. 293 - 335.