INDUKSI MUTASI KROMOSOM DENGAN KOLKISIN PADA
ANTHURIUM WAVE OF LOVE (Anthurium plowmanii Croat.)
SECARA IN VITRO
LINA NURWANTI
A24051681
DEPARTEMEN AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
2010
RINGKASAN
LINA NURWANTI. Induksi Mutasi Kromosom dengan Kolkisin pada Anthurium Wave of Love (Anthurium plowmanii Croat.) secara In Vitro. (Dibimbing oleh NI MADE ARMINI WIENDI).
Mutasi genetik merupakan cara untuk mendapatkan keragaman genetik tanaman. Induksi mutasi genetik secara in vitro dapat memperoleh keragaman genetik dengan keragaman fenotipe tanaman lebih cepat dan lebih banyak. Penelitian ini menginduksi terjadinya mutasi kromosom pada tunas
A. plowmanii Croat. dengan menggunakan kolkisin. Tujuan dari penelitian ini
untuk mengetahui konsentrasi kolkisin dan lama perendaman yang tepat untuk menginduksi penggandaan kromosom pada tunas A. plowmanii Croat. secara
in vitro. Penelitian ini diharapkan diperoleh galur A. plowmanii Croat. yang
unggul.
Bahan tanaman A.plowmanii Croat. berasal dari kultur in vitro yang diperbanyak pada media MS + 1 mg/l BAP + 0.1 mg/l IBA + 30 g/l gula + 5 g/l agar dengan pH 5.9, selama 15 minggu. Perlakuan perendaman tunas dilakukan secara bersamaan dan selanjutnya tunas ditanam pada pada media MS + 2 mg/l BAP + 0.5 mg/l NAA + 30 g/l gula + 5 g/l agar, dengan pH 5.9.
Penelitian ini disusun dengan menggunakan metode Rancangan Kelompok Lengkap Teracak (RKLT) dengan dua faktor yang disusun secara faktorial. Faktor pertama adalah konsentrasi kolkisin dengan taraf 0% (C0), 0.02% (C1), 0.04% (C2), dan 0.06% (C3). Lamanya perendaman merupakan faktor kedua, yaitu 24 jam (T1), 48 jam (T2), dan 72 jam (T3). Setiap perlakuan diulang 3 kali, setiap ulangan terdiri dari 10 tunas yang menjadi unit percobaan terkecil yang diamati.
Hasil penelitian menunjukkan bahwa interaksi antara konsentrasi kolkisin dan lama perendaman berpengaruh nyata terhadap jumlah tunas, jumlah daun, jumlah akar, dan panjang akar. Pengaruh perendaman dengan kolkisin tidak berpengaruh nyata terhadap tinggi tunas.
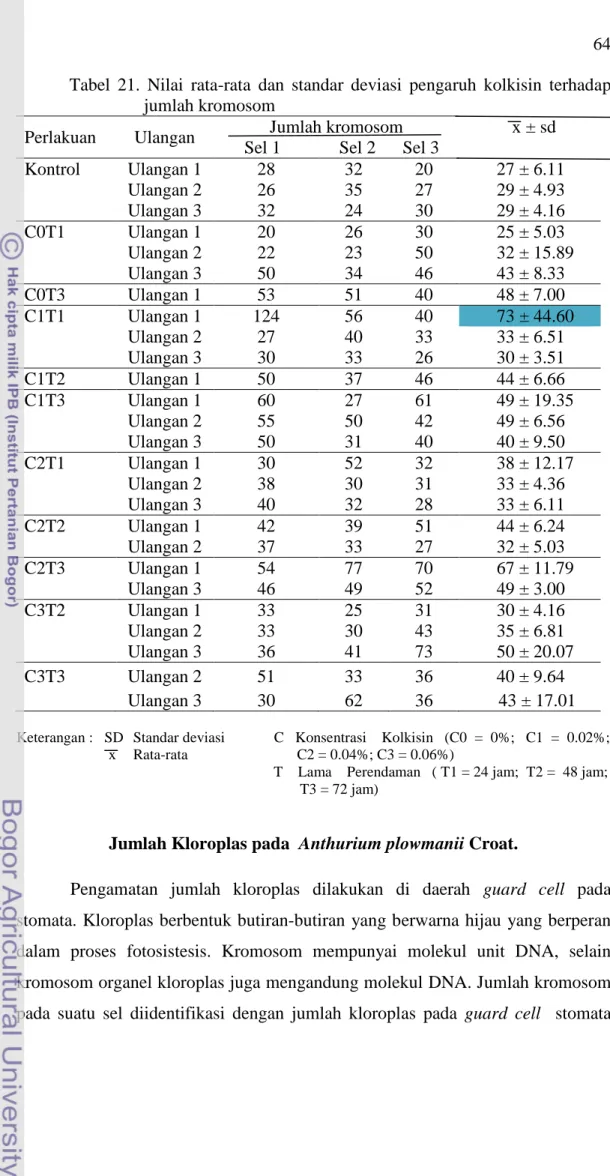
Interaksi antara konsentrasi dan lama perendaman dengan kolkisin menghasilkan jumlah kromosom yang beragam. Jumlah planlet hidup sebanyak 173 individu yang potensial. Planlet yang diuji sitologi sebanyak 19,
ternyata 18 planlet memiliki jumlah kromosom yang berbeda dari kontrolnya dan satu planlet memliki jumlah kromosom sama dengan planlet kontrol. Perlakuan C1T1 menghasilkan planlet yang mempunyai jumlah kromosom terbanyak antara 30-73 kromosom. Jumlah kloroplas terbanyak ditemukan pada planlet dari perlakuan C2T3 dengan jumlah 38-46 kloroplas pada sel stomata dan terkecil pada perlakuan C2T1 dengan 30-35 kloroplas. Kolkisin mempengaruhi kerapatan stomata A. plowmanii Croat. dengan kerapatan stomata tertinggi pada perlakuan C2T3 yaitu 86 stomata/mm2 dan terendah pada perlakuan C2T1 dengan kerapatan stomata 14 stomata/mm2. Ukuran stomata terbesar ditemukan pada planlet yang tumbuh pada perlakuan C2T3, yaitu panjang stomata 15.33-19.00 µm, lebar sel penjaga 16.00-18.67 µm, sedangkan terkecil pada planlet yang tumbuh pada perlakuan C1T3 dengan panjang stomata berkisar 12.00-16.33 µm, lebar sel penjaga 11.33-14.00 µ m.
Pemberian kolkisin memberikan keragaman fenotipe planlet in vitro. Fenotipe organ daun berwarna kuning yang berbeda dengan warna daun normal. Kombinasi kolkisin dan lama perendaman menyebabkan mutan pada organ daun, seperti seperti daun yang berbentuk hati; bentuk kipas; bentuk mangkok; dalam satu bonggol, tunas memiliki daun yang tumbuh melengkung dalam; pada satu bonggol, planlet tumbuh dengan daun yang berujung runcing atau menjarum; dalam satu pangkal batang, daun membelah dua sehingga memiliki dua daun; bentuk daun tebal dan kekar seperti pangkal batang. Kisaran kromosom dari planlet yang dihasilkan 30-73 kromosom, jumlah kloroplas pada sel stomata berkisar antara 28-46 kloroplas, kisaran kerapatan stomata antara 14-86 stomata/mm2, dan kisaran ukuran stomata 11.33-19.00 µm. Jumlah mutan yang berpotensi sebanyak 173 planlet. Penelitian perlu dilanjutkan untuk mempelajari fenotipe di lapangan dari planlet-planlet yang telah dihasilkan.
INDUKSI MUTASI KROMOSOM DENGAN KOLKISIN PADA
ANTHURIUM WAVE OF LOVE (Anthurium plowmanii Croat.)
SECARA IN VITRO
Skripsi sebagai salah satu syarat
untuk memperoleh gelar Sarjana Pertanian
pada Fakultas Pertanian Institut Pertanian Bogor
LINA NURWANTI
A24051681
DEPARTEMEN AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
2010
Nama : Lina Nurwanti NIM : A24051681
Menyetujui, Dosen Pembimbing
Dr. Ir. Ni Made Armini Wiendi, MS NIP : 1961 0412 1987 03 2003
Mengetahui :
Ketua Departemen Agronomi dan Hortikultura Fakultas Pertanian IPB
Dr. Ir. Agus Purwito, M.Sc Agr NIP : 1961 1101 1987 03 1003
Tanggal Lulus :
Judul : INDUKSI MUTASI KROMOSOM DENGAN KOLKISIN
PADA ANTHURIUM WAVE OF LOVE (Anthurium plowmanii Croat.) SECARA IN VITRO
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 11 Oktober 1986 di Kecamatan Gunung Kidul, Provinsi Yogyakarta. Penulis adalah anak pertama dari pasangan Bapak Rudiyana dan Ibu Su’ini. Masa pendidikan sekolah Dasar (SD) di Kebagusan, Pasar Minggu, Jakarta Selatan yaitu SD Negeri 01 Pagi, Sekolah Menengah Pertama (SMP) di Jeruk Purut, Cilandak, Jakarta Selatan yaitu SMP Negeri 212 dan Sekolah Menengah Atas (SMA) di Jagakarsa, Pasar Minggu, Jakarta Selatan, yaitu SMA Negeri 49.
Tahun 2005 penulis diterima sebagai mahasiswa program sarjana IPB melalui jalur USMI (Undangan Sekolah Masuk IPB). Tahun 2006 penulis diterima sebagai mahasiswa di Departemen Agronomi dan Hortikultura. Selama kuliah penulis berkesempatan menjadi asisten praktikum Pembiakan Tanaman di Program Keahlian Perkebunan Kelapa Sawit, Program Diploma IPB (2009) dan Bioteknologi Tanaman untuk program sarjana (tahun ajaran 2009-2010).
KATA PENGANTAR
Puji dan syukur penulis panjatkan ke hadirat Allah SWT yang telah melimpahkan rahmat, hidayah, serta pertolongan-Nya, sehingga dapat menyelesaikan laporan penelitian ini.
Skripsi yang berjudul Induksi Mutasi Kromosom dengan Kolkisin pada Anthurium Wave of Love (Anthurium plowmanii Croat.) secara In Vitro disusun dalam rangka penyelesaian tugas akhir penulis sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian di Fakultas Pertanian, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada Dr. Ir. Ni Made Armini Wiendi, MS yang telah memberi fasilitas, bimbingan, dan arahan selama pelaksanaan penelitian ini. Ucapan terima kasih juga disampaikan kepada keluarga, teman-teman yang membantu selama penelitian, serta teman-teman sekelas di Departemen Agronomi dan Hortikultura yang selalu mendukung.
Semoga laporan penelitian ini berguna sebagai informasi mengenai pengaruh manipulasi kromosom tanaman dengan kolkisin secara in vitro terutama pada tanaman Anthurium plowmanii Croat. secara in vitro.
Bogor, Agustus 2010
DAFTAR ISI
Halaman
DAFTAR TABEL ... x
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... ixv
PENDAHULUAN Latar belakang ... 16
Tujuan ... 18
Hipotesis ... 18
TINJAUAN PUSTAKA Botani A. plowmanii Croat. ... 19
Lingkungan tumbuh ... 21
Kultur jaringan ... 22
Induksi mutasi dengan mutagen kimia ... 23
Mitosis sel somatik ... 24
Pengamatan kromosom ... 27
BAHAN DAN METODE Waktu dan tempat ... 30
Bahan ... 30
Alat ... 30
Metode penelitian ... 31
Pelaksanaan penelitian ... 33
Sterilisasi botol, alat tanam dan laminar air flow cabinet ... 33
Pembuatan media ... 33
Pembuatan larutan kolkisin ... 34
Perendaman planlet dalam larutan kolkisin dan penanaman ... 35
Uji sitologi ... 35
Analisis kloroplas dan stomata ... 37
Pengamatan ... 37
HASIL DAN PEMBAHASAN Kondisi umum percobaan ... 40
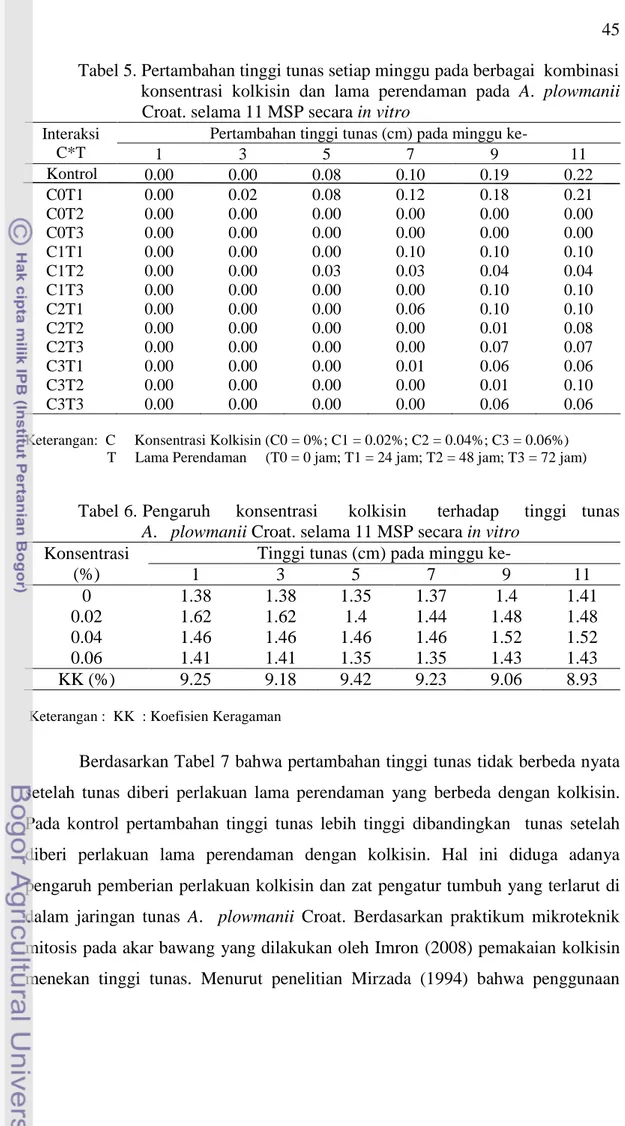
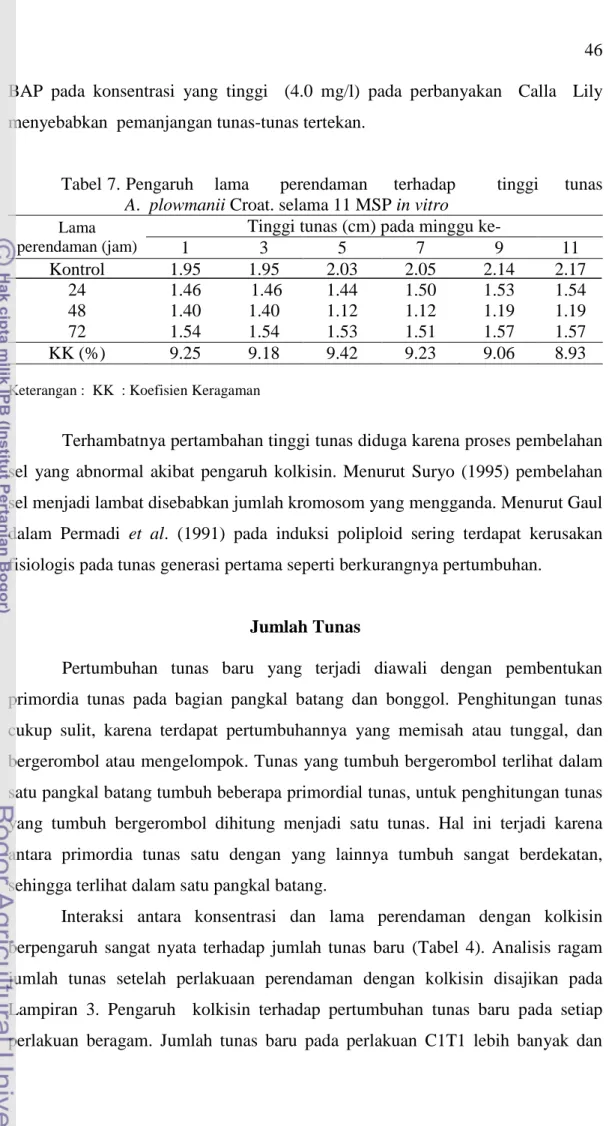
Tinggi tunas ... 44
Jumlah tunas ... 46
Jumlah daun ... 49
Jumlah akar ... 54
Panjang akar ... 56
Jumlah kloroplas pada A. plowmanii Croat. ... 64
Kerapatan stomata pada A. plowmanii Croat. ... 66
Ukuran stomata pada A. plowmanii Croat. ... 66
Korelasi antara jumlah kromosom, jumlah kloroplas, dan kerapatan stomata terhadap peubah ... 71
KESIMPULAN DAN SARAN Kesimpulan ... 72
Saran ... 73
DAFTAR PUSTAKA ... 74
LAMPIRAN ... 79
DAFTAR TABEL
Nomor Halaman
1. Kesalahan yang banyak terjadi dalam pengamatan mitosis sel
dan penyebabnya (Jurčák, 1999) ... 29
2. Kombinasi perlakuan antara konsenrasi kolkisin dan lama
perendaman ... 32
3. Persentase tingkat kontaminasi kultur A. plowmanii Croat.
selama 11 MSP ... 40
4. Rekapitalusi hasil uji F pengaruh perendaman larutan kolkisin terhadap eksplan tunas A. plowmanii Croat. secara
in vitro ... 43
5. Pertambahan tinggi tunas setiap minggu pada berbagai kombinasi konsentrasi kolkisin dan lama perendaman pada
A. plowmanii Croat. selama 11 MSP secara in vitro ... 45
6. Pengaruh konsentrasi kokisin terhadap tinggi tunas
A. plowmanii selama Croat. 11 MSP secara in vitro ... 45
7. Pengaruh lama perendaman terhadap tinggi tunas
A. plowmanii Croat. selama 11 MSP in vitro ... 46
8. Interaksi antara tingkat konsentrasi kolkisin dan lama perendaman terhadap jumlah tunas A. plowmanii Croat.
selama 11 MSP secara in vitro ... 48
9. Jumlah tunas per eksplan A. plowmanii Croat. selama 11 MSP pada perlakuan perendaman kolkisin pada berbagai
konsentrasi kolkisin secara in vitro ... 48
10. Pengaruh lama perendaman dengan kolkisin terhadap jumlah
tunas A. plowmanii Croat. selama 11 MSP secara in vitro ... 49
11. Interaksi antara tingkat konsentrasi kolkisin dan lama perendaman terhadap jumlah daun pada A. plowmanii Croat. selama 11 MSP
12. Pengaruh konsentrasi kolkisin terhadap jumlah daun
A. plowmanii Croat. selama 11 MSP secara in vitro ... 51
13. Pengaruh lama perendaman terhadap jumlah daun
A. plowmanii Croat.selama 11 MSP secara in vitro ... 52
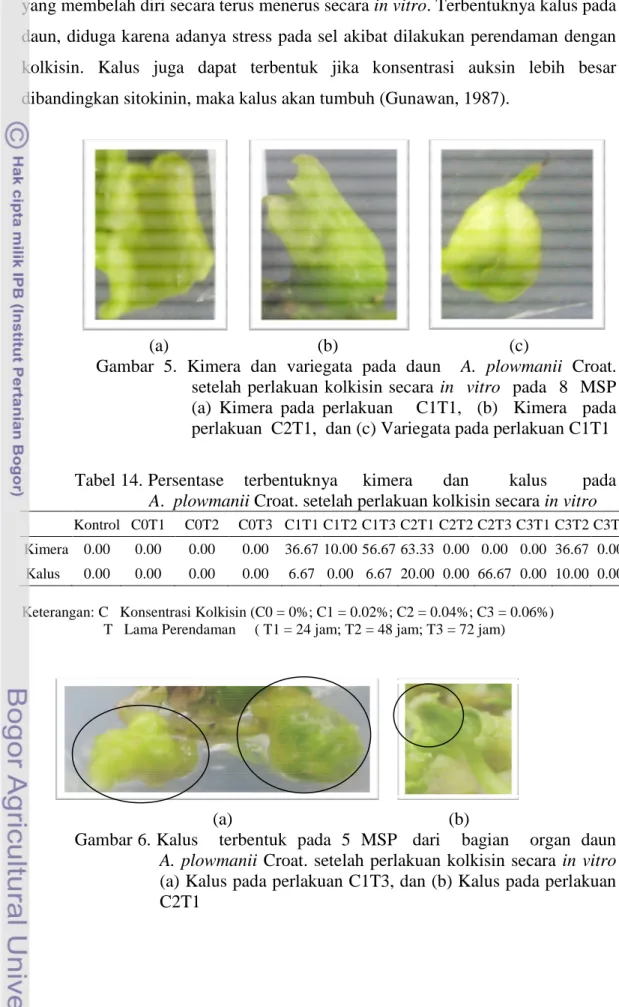
14. Persentase terbentuknya kimera dan kalus pada A. plowmanii
Croat. setelah perlakuan kolkisin secara in vitro ... 53
15. Interaksi konsentrasi kolkisin dan lama perendaman terhadap jumlah akar A. plowmanii Croat. selama 11 MSP
secara in vitro ... 54
16. Pengaruh konsentrasi kolkisin terhadap jumlah akar
A. plowmanii Croat.selama 11 MSP secara in vitro ... 55
17. Pengaruh lama perendaman terhadap jumlah akar A. plowmanii
Croat. selama 11 MSP secara in vitro ... 55
18. Interaksi konsentrasi kolkisin dan lama perendaman terhadap jumlah akar A. plowmanii Croat. selama 11 MSP
secara in vitro ... 57
19. Pengaruh konsentrasi kolkisin terhadap panjang akar
A. plowmanii Croat. selama 11 MSP secara in vitro ... 57
20. Pengaruh lama perendaman terhadap panjang akar
A. plowmanii Croat. selama 11 MSP secara in vitro ... 58
21. Nilai rata-rata dan standar deviasi pengaruh kolkisin terhadap
jumlah kromosom ... 64
22. Nilai rata-rata dan standar deviasi pengaruh kolkisin terhadap
jumlah kloroplas ... 66
23. Korelasi antara rata-rata jumlah kromosom dan kloroplas ... 66
24. Pengaruh kolkisin terhadap nilai rata-rata pengaruh kolkisin
25. Pengaruh kolkisin terhadap nilai rata-rata dan standar deviasi
ukuran stomata pada A. plowmanii Croat. ... 69
26. Hasil analisis korelasi peubah tunas dengan jumlah kromosom,
DAFTAR GAMBAR
Nomor Halaman
1. Rumus bangun senyawa kolkisin ... 24
2. Cara pengukuran panjang stomata dan lebar sel penjaga stomata .... 39
3. Kontaminasi pada kultur A. plowmanii Croat. setelah perlakuan
kolkisin ... 41
4. Kondisi tunas in vitro A. plowmanii Croat. setelah diberi
perlakuan kolkisin ... 42
5. Kimera dan variegata pada daun A. plowmanii Croat. setelah
perlakuan kolkisin secara in vitro ... 53
6. Kalus terbentuk pada 5 MSP dari bagian organ daun
A. plowmanii Croat. setelah perlakuan kolkisin secara in vitro ... 53
7. Tahapan mitosis pada A. plowmanii Croat. ... 60
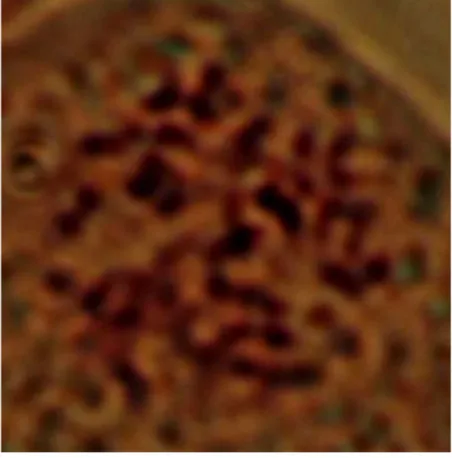
8. Kromosom dari planlet kontrol ... 61
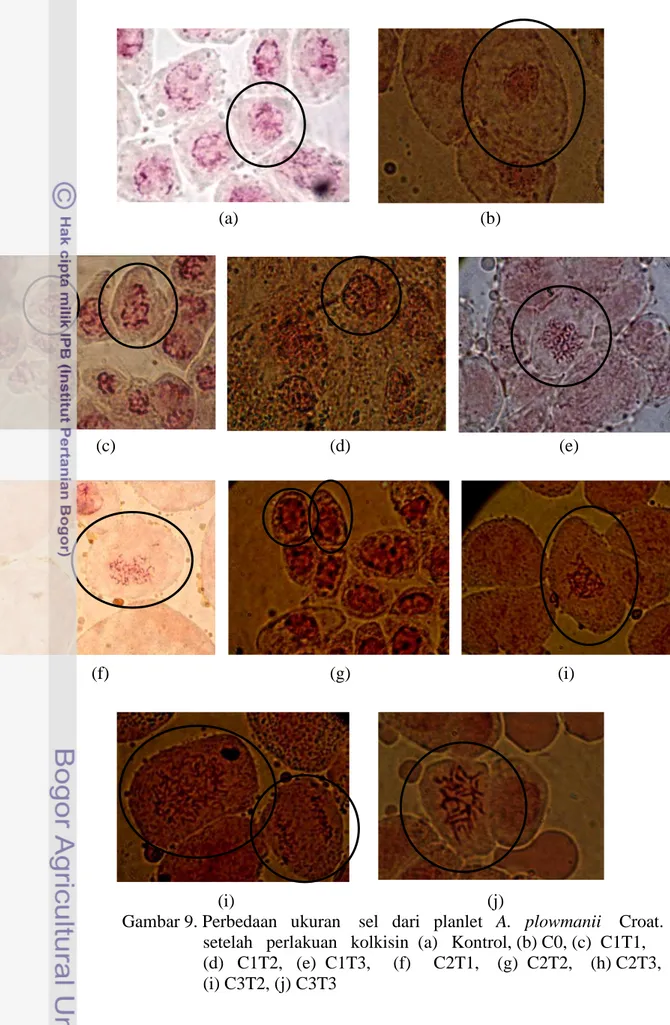
9. Perbedaan ukuran sel dari planlet A. plowmanii Croat. setelah
perlakuan kolkisin ... 63
10. Perbedaan ukuran stomata daun dari planlet A. plowmanii Croat.
setelah perlakuan kolkisin ... 70
DAFTAR LAMPIRAN
Nomor Halaman
1. Komposisi media MS (Murashige and Skoog) ... 80
2. Analisis ragam tinggi tunas pada A. plowmanii Croat. in vitro
pada 1-5 MSP ... 81
Lanjutan analisis ragam tinggi tunas pada A. plowmanii Croat.
in vitro pada 6-10 MSP ... 82
Lanjutan analisis ragam tinggi tunas pada A. plowmanii Croat.
in vitro pada 11 MSP ... 83
3. Analisis ragam jumlah tuna s pada A. plowmanii Croat. in vitro
pada 1-5 MSP ... 84
Lanjutan analisis ragam jumlah tunas pada A. plowmanii Croat.
in vitro pada 6-10 MSP ... 85
Lanjutan analisis ragam jumlah tunas pada A. plowmanii Croat.
in vitro pada 11 MSP ... 86
4. Analisis ragam jumlah daun pada A. plowmanii Croat. in vitro
pada 1-5 MSP ... 87
Lanjutan analisis ragam jumlah daun pada A. plowmanii Croat.
in vitro pada 6-10 MSP ... 88
Lanjutan analisis ragam jumlah daun pada A. plowmanii Croat.
in vitro pada 11 MSP ... 89
5. Analisis ragam jumlah akar pada A. plowmanii Croat. in vitro
pada 1-5 MSP ... 90
Lanjutan analisis ragam jumlah akar pada A. plowmanii Croat.
in vitro pada 6-10 MSP ... 91
Lanjutan analisis ragam jumlah akar pada A. plowmanii Croat.
6. Analisis ragam panjang akar pada A. plowmanii Croat. in vitro
pada 1-5 MSP ... 93
Lanjutan analisis ragam panjang akar pada A. plowmanii Croat.
in vitro pada 6-10 MSP ... 94
Lanjutan analisis ragam panjang akar pada A. plowmanii Croat.
in vitro pada 11 MSP ... 95
7. Analisis ragam jumlah kromosom pada A. plowmanii Croat.
in vitro ... 95
8. Analisis ragam jumlah kloroplas pada A. plowmanii Croat.
in vitro ... 95
9. Analisis ragam jumlah kloroplas pada A. plowmanii Croat.
in vitro ... 96
10. Analisis ragam ukuran stomata pada A. plowmanii Croat.
in vitro ... 96
11. Diagram perbandingan rata-rata jumlah kromosom dan
kloroplas dari palnlet A. plowmanii Croat. ... 97
PENDAHULUAN
Latar Belakang
Tanaman hias anturium lebih dikenal dengan nama kuping gajah karena daunnya yang lebar dan berukuran besar seperti telinga gajah. Tanaman anturium merupakan salah satu keluarga keladi-keladian (Araceae). Ciri dari family Araceae adalah memiliki bunga yang terdiri atas seludang (spathe) dan tongkol (spadix).
Anturium merupakan salah satu tanaman hias yang banyak diminati oleh masyarakat. Permintaannya pernah mengalami peningkatan, sehingga menyebabkan harga jual tanaman anturium menjadi tinggi. Pada tahun 2007 terjadi ketidakseimbangan antara penawaran dan permintaan tanaman anturium, karena adanya kelangkaan memperoleh tanaman anturium yang diinginkan konsumen. Menurut Sulyo (2008) selain tanaman anturium mengalami kelangkaan yang menyebabkan harga yang ditawarkan sangat tinggi adalah keunikan dari daunnya. Salah satu anturium daun yang memiliki keunikan daun dan bernilai jual tinggi adalah Anthurium Wave of Love (Anturium Gelombang Cinta) atau Anthurium plowmanii Croat.
Perbanyakan tanaman anturium dapat dilakukan secara generatif dengan biji dan vegetatif dengan cara pemisahan anakan. Perbanyakan secara in vivo memiliki kelemahan, yaitu pertumbuhan putik dan benang sari tanaman anturium yang lama dan tingkat keberhasilan rendah, karena biji yang dihasilkan dari hasil persilangan. Tanaman anturium merupakan tanaman monocious atau tanaman berumah satu, yaitu organ jantan (benang sari) dan organ betina (putik) terletak pada satu tanaman. Penyerbukan sendiri pada tanaman anturium jarang terjadi, sebab waktu masaknya tepung sari pada bunga jantan tidak bersamaan dengan putik pada bunga betina (dichogamaous) (Prihmantoro, 1992), yaitu putik lebih cepat masak dibandingkan benang sari. Lamanya pertumbuhan benang sari dan putik merupakan salah satu kendala perbanyakan tanaman anturium.
Setiap spesies anturium daun memiliki keunikan bentuk daun yang bervariasi. Keragaman genetik pada tanaman ini rendah, terutama keragaman didalam bentuk dan warna daun. Perbanyakan secara alami melalui persilangan
sulit dihasilkan keragaman genetik. Perlu dilakukan usaha untuk meningkatkan keragaman fenotipe yang lebih baik dan memiliki nilai ekonomi yang lebih tinggi.
Induksi mutasi merupakan cara untuk meningkatkan keragaman genetik tanaman. Keragaman genetik dapat terjadi melalui proses mutasi alami atau mutasi buatan. Mutasi alami terjadi secara spontan dialam akibat adanya sinar kosmos, radio aktif alam, dan sinar ultraviolet. Mutasi buatan salah satunya dengan menggunakan zat mutagen kimiawi yang pada umumnya menggunakan senyawa kolkisin. Kolkisin dapat menyebabkan terjadinya duplikasi pada kromosom yang mengakibatkan perubahan genetik.
Pada A. plowmanii Croat. telah dilakukan penginduksian mutasi dengan kolkisin secara in vivo dengan konsentrasi kolkisin antara rata-rata 0.4-0.6% dan waktu perendaman 12-32 jam. Tanaman bermutasi yang berhasil diperoleh sekitar 30% (Kanisius, 2007). Kultur jaringan merupakan metode untuk memperoleh keberhasilan keragaman genetik yang lebih tinggi dan tanaman yang bebas patogen. Kultur jaringan adalah suatu metode untuk menginisiasi bagian tunas seperti protoplasma, sel, jaringan, dan organ serta menumbuhkannya dalam kondisi aspetik, sehingga bagian-bagian tersebut dapat memperbanyak diri dan beregenerasi menjadi tunas lengkap (Gunawan, 1992).
Melalui kultur in vitro akan lebih terlihat hasil penggandaan kromosom karena kolkisin bisa berpenetrasi ke bagian nukleus dan sitoplasma (Husni et al., 1995). Spesies A. plowmanii Croat. termasuk pada kelompok Pachyneurium yang umumnya memiliki jumlah kromosom 2n=30. Perendaman dengan kolkisin dilakukan agar terjadi kontak antara sel tanaman dengan larutan kolkisin antara 24-96 jam (Eigsti and Dustin, 1957). Percobaan secara in vitro pada tanaman Alocasia x amazonica hort. yang memiliki jumlah kromosom 2n=2x=28, setelah mendapat perlakuan perendaman dengan kolkisin dapat menghasilkan tanaman tetraploid (2n=4x=56) sebanyak 53 tanaman dari 654 tanaman yang diperoleh. Terjadinya poliploidisasi tersebut dengan pemberian kolkisin berkonsentrasi 0.05% selama 72 jam, diperoleh penggandaan kromosom sebesar 20% (Thao et al., 2004).
Penelitian ini melakukan induksi mutasi kromosom sel dengan menggunakan bahan kimia kolkisin pada tingkat organ. Faktor yang
mempengaruhi tingkat penggandaan kromosom dalam satu sel adalah lamanya waktu perendaman dan konsentrasi kolkisin. Kolkisin bekerja dengan cara mencegah terbentuknya benang-benang pengikat kromosom (spindle) sehingga kromosom yang sudah mengalami pembelahan tidak berpisah pada tahap anafase, maka terjadi penggandaan kromosom pada sel yang terbentuk. Pengaruh kolkisin yang dapat menghasilkan penggandaan kromosom sel juga akan dipelajari pengaruhnya pada jumlah kloroplas di daerah guard cell stomata, kerapatan stomata, dan ukuran stomata dari tanaman yang mengalami penggandaan kromosom. Menurut Dolezel et al. (1998) bahwa analisis tingkat ploidi dapat dilakukan melalui penghitungan jumlah kromosom. Menurut Qin dan Rotino (1995) bahwa analisis tingkat ploidi dapat dilakukan juga melalui jumlah kloroplas sel penjaga pada stomata. Jumlah kromosom yang bertambah diharapkan menghasilkan tanaman dengan fenotipe yang lebih menarik dan unggul.
Tujuan
Penelitian ini bertujuan untuk mempelajari pengaruh perendaman tunas
A. plowmanii Croat. dengan kolkisin pada berbagai konsentrasi dan lama
perendaman terhadap mutasi kromosom sel dan fenotipe planlet in vitro. Penelitian ini juga diharapkan memperoleh galur baru dengan fenotipe yang unggul.
Hipotesis
1. Terdapat interaksi antara konsentrasi dan lamanya waktu perendaman dengan kolkisin terhadap poliploidisasi kromosom pada planlet A. plowmanii Croat.
in vitro.
2. Konsentrasi kolkisin berpengaruh terhadap poliploidisasi kromosom pada planlet A. plowmanii Croat. in vitro.
3. Lamanya waktu perendaman dengan kolkisin berpengaruh terhadap poliploidisasi kromosom pada planlet A. plowmanii Croat. in vitro.
TINJAUAN PUSTAKA
Botani Anthurium plowmanii Croat.
Anturium digolongkan menjadi dua, yaitu anturium bunga dan anturium daun. Anturium daun lebih diminati oleh konsumen karena setiap spesiesnya menunjukkan keunikan bentuk daun. Pada anturium bunga lebih menonjolkan keragaman bunga baik hasil persilangan maupun spesies. Kelompok anturium bunga terbagi lagi atas dua tipe, yaitu tipe potong dan tipe bunga pot1). Setiap spesies anturium daun memiliki bentuk dan ukuran daun yang berbeda-beda. Salah satu anturium daun yang banyak diminati oleh konsumen adalah Anthurium
Wave of Love atau Anturium Gelombang Cinta.
Nama Anthurium Wave of Love (Anturium Gelombang Cinta) dalam klasifikasinya disebut Anthurium plowmanii Croat. Nama tersebut diambil dari nama seorang ahli botani. Penemu spesies tanaman hias ini adalah Timothy Plowman2). Tanaman hias ini ditemukan di daerah dekat Amazonas Manaus, Brazil, tepatnya di Chacaras de Taruma2). Berikut klasifikasi tanaman anturium, yaitu3):
Kingdom : Plantae (tumbuhan)
Subkingdom : Tracheobionta (berpembuluh) Superdivisi : Spermatophyta (menghasilkan biji) Divisi : Magnoliophyta (berbunga)
Kelas : Liliopsida (berkeping satu / monokotil) Subkelas : Arecidae
Ordo : Arales Famili : Araceae Genus : Anturium
Spesies : Anthurium plowmanii Croat.
Menurut Lingga (2007) penemu spesies anturium pada tahun 1869 yaitu Schott ahli botani yang membagi anturium menjadi 183 spesies dan
1)
http://www.kebonkembang.com. [25 Maret 2009].
2) http://www.anthuriumplowmaniicroat.com. [11 Januari 2009]. 3) http://www.plantamor.com. [25 Maret 2009].
28 kelompok besar. Pada tahun 1905, ahli botani lain bernama Engler menyederhanakan pembagian itu menjadi 18 kelompok. Pengelompokan dari Croat dan Sheffer (1983), yaitu Belolonchium, Calomystrium, Cardiolonchium, Chamaerepium, Cordatopunctatu, Dactylophyllium, Decucrentium, Digitinervium, Gymnopodium, Leptanthurium, Pachyneurium, Polyphyllium, Porphyrochitonium, Scizoplacium, Semacophyllum, Tetraperonium, Urospadix, dan Xyalophyllum. Ciri dari spesies-spesies yang mempunyai ciri morfologi yang sama dimasukan ke dalam kelompok tersebut.
Anthurium plowmanii Croat. termasuk kedalam kelompok Pachyneurium,
karena susunan daunnya seperti bentuk sarang burung (bird’s nest) dan dikedua sisi daun menggulung ke arah dalam tulang daun (involute leaf vernation).
Anthurium plowmanii Croat. mempunyai petiol (tangkai daun) yang pendek.
Ukuran daun A. plowmanii Croat. besar dengan panjang daun 100 cm dan lebar daun mencapai 20-30 cm. Bentuk daun yang meruncing pada bagian ujung dan melebar pada pangkal daunnya. Warna dasar daun A. plowmanii Croat. hijau pekat dengan urat daun yang hijau lebih muda dan terlihat lebih kokoh dengan tulang daun yang tegas. Permukaan daun bagian atas licin dan mengkilap. Keindahannya semakin menarik dengan pertumbuhan susunan daun yang teratur, simetris, dan kompak4).
Anturium merupakan tanaman yang berumah satu (monoceous), yaitu dalam satu tanaman terdapat dua organ reproduksi (bunga betina dan bunga jantan). Pada bagian bunga dari tanaman anturium terdiri dari seludang (spathe), tongkol (spadix), dan tangkai bunga (peduncle). Spathe merupakan modifikasi dari daun.
Spathe yang berubah warna selaras dengan proses pematangan tongkol, dari
seludang ini akan tumbuh tongkol yang menghasilkan biji. Peduncle bertekstur lunak. Biji anturium memiliki panjang berukuran ± 1 cm, jumlah biji dalam satu tongkol antara 500-2000 biji5). Batang yang tumbuh membesar dan lunak
(herbacious) mampu menopang daun. Akar tunjang tumbuh memanjang dapat mencapai 40-60 cm yang tumbuh dari pangkal batang. Akar anturium berbentuk serabut, semakin banyak rambut akar maka pertumbuhan tunas semakin cepat5)
.
4)
http://www.duniaflora.com. [1 Maret 2009].
Lingkungan Tumbuh
Sekitar 800 spesies anturium telah ditemukan dan berhasil dideterminasi dari habitat asalnya. Para ahli botani memperkirakan bahwa di dunia ini terdapat lebih dari 1.000 spesies anturium yang tersebar. Daerah sebarannya yang merupakan habitat aslinya yaitu di negara tropis basah Amerika Tengah dan Amerika Selatan, serta wilayah tropis kering (semi arid area) di Meksiko dan Panama (Lingga, 2007). Tanaman A. plowmanii Croat. merupakan family Araceae yang mudah beradaptasi dengan lingkungan. Tanaman ini dapat tumbuh baik pada iklim tropis seperti di Indonesia dan bersifat epifit. Lingkungan tumbuh yang ideal untuk tunas anturium mulai dari dataran menengah sampai dataran tinggi, yaitu antara 600-1.400 m dpl. Tanaman yang berasal dari hutan hujan tropis dengan pemberian cahaya langsung kurang baik untuk tanaman karena menyebabkan daun kering akibat dehidrasi, jika tanaman kurang cahaya menyebabkan pertumbuhannya terganggu karena tanaman menjadi layu. Tanaman ini akan tumbuh dengan baik jika tidak terkena sinar matahari secara langsung, kelembaban media tanam tinggi, dan mengandung banyak bahan organik6).
Sulyo (2008) melaporkan bahwa suhu optimum untuk pertumbuhan
A. plowmanii Croat. antara 20-24°C dengan suhu udara minimum sebesar 15°C
dan maksimum 30°C. Anturium cocok pada cuaca yang teduh dan lembab. Tanaman anturium tumbuh dengan optimal pada intensitas cahaya 1.000-2.000 fc (foot candle) atau sama dengan menggunakan naungan paranet 75-85%. Tanaman yang semi naungan ini harus menjaga sirkulasi udaranya untuk menjaga kestabilan suhu dan kelembaban sehingga tunas tidak mudah terserang patogen. Pada perkecambahan biji, suhu optimal adalah 26-30°C karena dalam kondisi lembab dan basah, biji tersebut akan mudah tumbuh tunas dan rawan membusuk akibat serangan cendawan. Kadar air dalam biji tidak boleh lebih dari 10% saat perkecambahan (Kurniawan, 2008).
Kultur Jaringan
Kultur jaringan adalah suatu metode untuk mengisolasi bagian tunas seperti protoplasma, sel, jaringan, dan organ serta menumbuhkannya dalam kondisi aspetik sehingga bagian-bagian tersebut dapat memperbanyak diri dan beregenerasi menjadi tunas lengkap (Gunawan, 1992). Teknik kultur jaringan dengan cara perbanyakan mikro merupakan cara alternatif, terutama tunas yang diperbanyak secara vegetatif. Perbanyakan mikro merupakan usaha menumbuhkan bagian tunas dalam media aseptik sehingga menghasilkan tanaman lengkap.
Pada prinsipnya kultur jaringan memerlukan tiga tahap utama. Tahap pertama meliputi yaitu menjaga agar kultur yang ditumbuhkan dapat berkembang dengan baik dalam kondisi aseptik. Tahap kedua adalah melakukan usaha agar dapat terjadi multiplikasi (penggandaan) propagula dengan cepat sehingga diperoleh tunas dalam jumlah besar. Tahap ketiga merupakan persiapan pemindahan planlet ke media tanam dalam pot atau tanah. Perkembangan teknik perbanyakan klon melalui kultur in vitro mengarah kepada optimasi beberapa aspek penting, yaitu sifat eksplan awal, komposisi media, kondisi fisik media, dan lingkungan kultur (Murashige, 1974).
Subkultur adalah pemindahan kultur ke media yang baru, baik yang sama maupun berbeda komposisi kimianya. Subkultur merupakan kebutuhan untuk memperbanyak tunas dan mempertahankan kultur (George and Sherrington, 1984). Pierik (1987) melaporkan bahwa subkultur diperlukan bila unsur hara dan hormon dalam media telah berkurang atau habis, untuk merubah pola pertumbuhan dan perkembangan kultur, dan bila kultur telah memenuhi wadah atau botol.
Pertumbuhan dan perkembangan tunas secara in vitro bergantung pada beberapa faktor yaitu genotipe tunas, nutrisi (elemen makro dan mikro) dan faktor eksternal pertumbuhan seperti cahaya, suhu, pH, konsentrasi O2 dan CO2 serta
beberapa faktor substansi (hormon, vitamin) (Pierik, 1987). Nutrisi merupakan faktor penting untuk pertumbuhan dan perkembangan organ tanaman.
Salah satu hambatan dalam kultur jaringan adalah kontaminasi. Kontaminasi dapat berasal dari eksplan, organisme kecil yang masuk dalam kultur, alat tanam yang kurang steril, lingkungan kerja yang kurang higienis, dan kecerobohan dalam pelaksanaan.
Induksi Mutasi Kromosom dengan Mutagen Kimia
Perkembangan cabang-cabang ilmu biologi dan teknologi semakin maju, kini telah banyak digunakan untuk merakit varietas baru untuk mendukung pertanian. Berbagai teknik digunakan untuk mendapatkan tanaman yang lebih unggul, salah satunya melalui cara mutasi. Mutasi adalah salah satu teknik yang digunakan untuk mengubah susunan basa nukleotida atau DNA. Berdasarkan proses terjadinya perubahan genetik mutasi terbagi menjadi mutasi alami dan mutasi buatan (Agusrial, 2009). Mutasi alami adalah perubahan materi genetik secara spontan di alam, sedangkan mutasi buatan terjadi akibat diberi mutagen secara sengaja untuk tujuan pemuliaan tanaman. Bahan mutagen dapat secara kimia dan fisik. Mutasi fisik bersifat sebagai radiasi pengion (ionizing radiation) yang dapat melepas energi (ionisasi), begitu melewati atau menembus materi. Mutagen fisika termasuk diantaranya sinar-X, radiasi gamma, radiasi beta, neutrons, dan partikel dari akselerator sudah umum digunakan dalam pemuliaan tanaman. Mutagen kimia pada umumnya berasal dari senyawa alkyl (alkylating
agents) misalnya seperti ethyl methane sulphonate (EMS), diethyl sulphate
(DES), methyl methane sulphonate (MMS), hydroxylamine, nitrous acids, acridines, dan sebagainya (IAEA, 1977 dalam Agusrial, 2009). Beberapa mutagen kimia penting lainnya ialah gas metan, asam nitrat, kolkisin, digitonin, hidroksil amin, akridin, etiletan sulfonat (EES), 5-bromo urasil, 2-aminopurin7).
Anthuriuim plowmanii Croat. merupakan bagian dari Pachyneurium yang
pada umumnya mempunyai jumlah kromosom 2n=30. Melalui perlakuan pemberian kolkisin diharapkan terjadi ploidisasi kromosom untuk meningkatkan variasi genetik. Kolkisin adalah suatu alkaloid yang dihasilkan oleh tanaman
krokus (Colchicum autumnale, L.) yang banyak ditanam di Eropa, India, dan Afrika Utara (Snustad et al., 1997). Penggunaan kolkisin bisa dengan berbagai cara misalnya imersi biji, imersi jaringan, imersi meristem, imersi akar, penetesan, pengolesan pasta, dan emulsi (Gunarso, 1989). Menurut Gunarso (1989) untuk menginduksi poliploidi pada tanaman, kolkisin efektif digunakan pada konsentrasi 0.01–1.00%. Lamanya waktu perendaman dan konsentrasi kolkisin akan mempengaruhi terjadinya poliploidi. Poliploidi adalah keadaan suatu individu yang memiliki lebih dari dua set kromosom (Welsh, 1991; Snustad et al., 1997; Griffiths et al., 1999). Rumus kimia kolkisin adalah C22H25O6N dan
merupakan senyawa alkaloid yang mudah larut dalam air dan digunakan dalam konsentrasi rendah (Gambar 1).
OCH3
OCH3
H3C C HN OCH3
O
OCH3
Gambar 1. Rumus bangun senyawa kolkisin (http://www.wikipedia.com, 2009)
Mitosis Sel Somatik
Mitosis merupakan pembelahan sel somatik. Setiap sel yang membelah secara mitosis akan menghasilkan dua sel baru yang jumlah kromosom dan kandungan genetiknya identik dengan sel asal (Sastrosumarjo et al., 2006). Mutasi induksi dilakukan untuk meningkatkan mutan yang menghasilkan perubahan karakter yang diinginkan. Pola keragaman yang terdapat pada makhluk hidup disebabkan oleh mutasi. Salah satu mutagen kimia yang sering dipergunakan untuk mendapatkan mutan adalah kolkisin. Kolkisin merupakan inhibitor mitosis karena dapat mengikat tubulin (suatu protein), konstituen utama mikrotubula. Mikrotubula mempunyai fungsi dalam pembentukan benang spindle pada mitosis.
Menurut Addink (2002) bahwa kolkisin dapat digunakan untuk penggandaan jumlah kromosom atau poliploidisasi. Kolkisin dapat menghambat pembentukan dan aktivitas benang-benang pembelahan pada saat mitosis, dimana pada tahap metafase kromosom tidak bergerak ke arah dua kutubnya tetapi tetap berada di daerah ekuator bahkan dapat kembali mengganda (Strickberger, 1985). Pemberian kolkisin pada titik tumbuh dari tunas dapat mencegah pembentukan serabut-serabut benang-benang pengikat kromosom dan pemisahan kromosom pada anafase dari mitosis menyebabkan ploidisasi kromosom, tanpa pembentukan dinding sel. Perlakuan ini menyebabkan penambahan jumlah kromosom per sel (Crowder, 1997).
Kolkisin efektif dalam penggunaannya karena menghasilkan persentase poliploid yang lebih tinggi dibandingkan senyawa lain, pada konsentrasi nontoksik untuk tanaman (Allard, 1988). Kolkisin dapat menyebabkan jumlah ploidi yang dihasilkan sel berbeda dengan normalnya karena adanya perubahan jumlah kromosom. Perubahan tersebut dapat karena komposisi molekul DNA suatu gen atau pada benang kromatinnya. Perlakuan kolkisin dalam waktu yang makin lama bisa menghasilkan pertambahan genom sebagai suatu deret ukur seperti 4x, 8x, 16x dan seterusnya (Brewbaker, 1983). Ciri-ciri fisik tunas poliploid yang umum adalah meningkatnya ukuran sel, laju pertumbuhan sel lambat, daun lebih tebal, bunga lebih besar dan sedikit, buah lebih besar, serta menurunnya fertilitas pada berbagai tingkat dibandingkan dengan tunas diploid (Griffith et al., 1999; Ramirez, 1991). Proses terjadinya penggandaan kromosom dilaporkan oleh Albert et al. (1991) dalam Anggaito (2004) bahwa benang pengikat kromosom (spindle) yang tersusun dari mikrotubula berada dalam bentuk dublet ganda. Mikrotubula ganda tersusun dari dua buah mikrotubula tunggal, sedangkan mikrotubula tunggal tersusun dari protofilamen, yaitu suatu polimer dari dimer protein tubulin a dan b. Kerja kolkisin pada dasarnya adalah menghambat pembentukan mikrotubula. Kolkisin akan berikatan dengan dimer tubulin a dan b, sehingga tidak terbentuk protofilamen. Tidak terbentuknya protofilamen maka tidak terbentuk mikrotubula singlet dan mikrotubula dublet, yang berakibat tidak terbentuknya spindle. Terhambatnya pembentukan spindel menyebabkan kromosom yang sudah dalam keadaan mengganda tidak dibagi ke
arah berlawanan. Menurut Brewbaker (1983) tanaman poliploid seringkali menunjukkan keunggulan sifat dibandingkan diploidnya. Pada tanaman ryegrass kultivar tetraploid menghasilkan bobot segar tanaman yang lebih tinggi dibandingkan kultivar diploid, lebih tahan terhadap penyakit, lebih banyak karbohidrat yang terstruktur dan rendah kandungan serat kasar (Thomas, 1993).
Kemampuan penyerapan tanaman terhadap larutan kolkisin berpengaruh pada terjadinya poliploidisasi terhadap suatu tanaman. Penggunaan kolkisin dapat secara in vivo atau in vitro. Berdasarkan sumber dari Kanisius (2007) yang telah melakukan penggandaaan kromosom dengan menggunakan senyawa kolkisin secara in vivo pada A. plowmanii Croat. dengan konsentrasi kolkisin antara 0.4-0.6% dan waktu perendaman 12-32 jam. Tanaman bermutasi yang berhasil diperoleh sekitar 30%. Melalui kultur in vitro akan lebih terlihat hasil penggandaan kromosom karena kolkisin bisa berpenetrasi ke bagian nukleus dan sitoplasma (Husni et al., 1995). Perendaman dengan kolkisin dilakukan agar terjadi kontak antara sel tanaman dengan larutan kolkisin antara 24-96 jam (Eigsti and Dustin, 1957). Percobaan secara in vitro pada tanaman Alocasia x amazonica hort. yang memiliki jumlah kromosom 2n=2x=28, setelah mendapat perlakuan perendaman dengan kolkisin dapat menghasilkan tanaman tetraploid (2n=4x=56) sebanyak 53 tanaman dari 654 tanaman yang diperoleh. Terjadinya poliploidisasi tersebut dengan pemberian kolkisin berkonsentrasi 0.05% selama 72 jam, diperoleh penggandaan kromosom sebesar 20% (Thao et al., 2004).
Kolkisin adalah senyawa antimitotik. Setiap organisme mempunyai respons yang berbeda terhadap pemberian perlakuan kolkisin. Jika konsentrasi larutan kolkisin dan lamanya waktu perlakuan kurang mencapai keadaan yang tepat, maka poliploidi belum dapat diperoleh. Konsentrasi terlalu tinggi atau waktu perendaman terlalu lama dengan kolkisin, maka akan memperlihatkan pengaruh negatif yakni banyak sel yang mati (Melky, 2006). Menurut Welsh (1991) bahwa setiap tanaman memiliki ambang batas maksimum untuk tingkat ploidinya, apabila melebihi batas tersebut umumnya tanaman tidak normal, lemah atau tidak dapat hidup. Toleransi setiap sel tanaman terhadap perlakuan kolkisin berbeda-beda.
Pengamatan Kromosom
Tujuan utama analisis kromosom adalah mengetahui karakteristik dan morfologi dari kromosom, seperti jumlah kromosom, struktur dan aktivitas kromosom selama pembelahan sel berlangsung. Terdapat prosedur atau metode yang berbeda untuk setiap spesies sehingga diperoleh ciri-ciri dari kromosom tersebut. Pengamatan kromosom dilakukan dengan memfiksasi sel tanaman. Fiksasi adalah proses awal dalam menyiapkan materi segar untuk pengamatan mikroskopis. Tujuan dari fiksasi ialah untuk mematikan sel tanpa merusak organel-organel yang menyusun sel yaitu kromosom, mengawetkan organel-organel sel, dan memudahkan jaringan untuk diwarnai. Metode yang dipergunakan dalam menganalisis kromosom adalah metode squash atau sediaan tekan. Squash adalah metode yang digunakan untuk mengetahui komponen sel yang diambil dari jaringan segar8).
Menurut Jurčák (1999) pengamatan kromosom memerlukan waktu dan teknik yang tepat untuk mendapatkan hasil yang baik. Metode untuk pengamatan kromosom dapat menggunakan teknik pewarnaan yang dikenal dengan metode
squashing. Metode tersebut menggunakan aceto carmine sebagai pewarna.
Larutan jenuh aceto carmine dibuat dengan memanaskan 100 ml asam asetat 45%, setelah mencapai suhu 90-95oC ditambahkan 1-2 gram serbuk carmine dan digoyang-goyangkan selama 10 menit dan disaring untuk mendapatkan larutan tanpa penggumpalan serbuk carmine. Larutan pewarna aceto orcein dengan mengganti serbuk carmine dengan serbuk orcein dengan prosedur yang sama dengan pembuatan larutan aceto carmine. Pewarnaan terhadap preparat kromosom bertujuan menciptakan perbedaan optikal diantara kromosom dengan struktur sel lainnya sehingga dapat dibedakan di bawah mikroskop.
Menurut Melky (2006) yang bekerja pada tiram (Pinctada maxima) melaporkan bahwa perlakuan fiksasi bertujuan menstabilkan struktur sel. Fiksasi yang dilakukan tepat pada jaringan yang akan dibuat preparat. Sel organisme dimatikan terlebih dahulu untuk mengambil jaringan epitel seperti pada insang tiram. Selama proses fiksasi akan terjadi penetrasi bahan-bahan fiksasi ke dalam
dalam sel atau jaringan, dimana fiksasi dilakukan sebagai preservasi sel dan strukturnya pada kondisi yang memungkinkan. Pada prinsipnya, bahan fiksasi yang diserap oleh sel atau jaringan menyebabkan sel-sel berhenti membelah pada tahap tersebut, tanpa mengakibatkan kerusakan, pembengkakan atau penyusutan kromosom, dan tanpa mengubah unsur pokok dalam struktur sel. Dua hal utama yang diperoleh dari proses ini yakni struktur sel yang semula tidak jelas menjadi lebih jelas, serta struktur sel yang semula rapuh menjadi stabil dan cukup kuat. Faktor-faktor yang mempengaruhi fiksasi antara lain temperatur, pH, tekanan osmotik, kecepatan penetrasi, laju perubahan kimia dan fisika, serta lamanya fiksasi. Fiksasi yang terlalu cepat dapat mengakibatkan hasil yang diperoleh tidak baik.
Menurut Melky (2006) bahwa beberapa hal yang perlu diperhatikan dalam fiksasi antara lain pemilihan bahan fiksasi yang tepat, besar kecilnya organisme (menentukan cepat dan seragamnya penetrasi bahan fiksasi), rasio volume bahan fiksasi dengan jaringan yang difiksasi (umumnya 10-12 kali), serta karakter jaringan yang difiksasi. Beberapa jaringan tertentu lambat dalam penetrasi. Misalnya pada tumbuhan, epidermis yang dilapisi dengan lapisan kutikula yang bersifat hidrofobik. Perlakuan fiksasi dibedakan atas perlakuan fisik dan kimiawi. Perlakuan secara fisik seperti pendinginan jaringan dalam nitrogen cair telah banyak digunakan untuk sel atau jaringan hewan. Perlakuan ini efektif untuk menjaga struktur sel karena proses difusi yang sangat kecil dan tidak terjadi perubahan enzim secara signifikan. Kelemahan perlakuan secara fisik yakni dapat menyebabkan terputusnya kromosom karena adanya kristal es dalam sel atau jaringan. Perlakuan secara kimiawi dengan menggunakan bahan kimia seperti larutan carnoy. Perlakuan secara kimiawi membutuhkan keseimbangan dan ketepatan bahan-bahan yang dipakai. Contoh pencampuran larutan asam dan alkohol pada kondisi seimbang dapat menjaga struktur sel pada kondisi yang stabil dan memungkinkan untuk diamati, tetapi reaksi beberapa asam yang berlebihan dapat menyebabkan struktur sel menyusut.
Pembuatan gelas objek preparat bertujuan mengoptimalkan kromosom sehingga mudah dilihat di bawah mikroskop. Sel diolesi di atas gelas objek dan diwarnai dengan mencelupkannya ke dalam larutan pewarna kromosom giemsa.
Hal penting yang perlu diperhatikan adalah tidak boleh menggerakkan cover glass karena akan merusak sel. Hasil penemuan aktivitas kromosom pada spesimen difoto dan kemudian diamati dengan software pada komputer sehingga memudahkan penghitungan jumlah kromosom. Beberapa kasus yang perlu diperhatikan di dalam melakukan pengamatan analisis kromosom yang dicantumkan pada Tabel 1 (Jurčák, 1999).
Tabel 1. Kesalahan yang banyak terjadi dalam pengamatan mitosis sel dan penyebabnya
Sumber : Jurčák, 1999
Kesalahan Penyebab
1. Inti terwarnai dengan jelas, tetapi tahapan mitosis tidak terlihat.
a. Pemotongan material tunas tidak
pada waktu yang tepat. 2. Kromosom tidak jelas. a. Waktu fiksasi terlalu pendek.
b. Konsentrasi pewarna terlalu rendah.
c. Pewarna yang digunakan sudah rusak atau terlalu lama disimpan.
d. Suhu selama pewarnaan terlalu rendah.
e. Waktu pewarnaan terlalu pendek.
3. Beberapa sel menumpuk satu sama lain.
a. Waktu melunakkan jaringan terlalu pendek.
b. Pembuatan larutan untuk maserasi tidak tepat.
c. Kurang tenaga ketika menekan gelas objek.
4. Sel meristem pecah, tahapan mitosis atau kromosom tidak dapat dilihat.
a. Gelas penutup bergeser jauh ketika ditekan.
b. Gelas penutup ditekan terlalu keras atau berulang-ulang.
BAHAN DAN METODE
Waktu dan Tempat
Kegiatan penelitian dilaksanakan dari bulan Januari 2009 sampai Januari 2010. Tempat pelaksanaan penelitian in vitro dilakukan di Laboratorium Bioteknologi Tanaman, IPB, Dramaga, Bogor. Uji sitologi untuk menghitung jumlah kromosom dilakukan di Laboratorium Ekofisiologi Tanaman (Ekologi dan Fisilogi), Departemen Agronomi dan Hortikultura, Institut Pertanian Bogor. Analisis kloroplas serta stomata dilakukan di Pusat Studi Ilmu Hayati, IPB.
Bahan
Bahan tunas yang dipergunakan untuk penelitian ini adalah bahan tanaman
in vitro berupa tunas A. plowmanii Croat. yang telah berumur dua belas bulan.
Komposisi media perbanyakan digunakan dari komposisi media dasar MS (Murashige dan Skoog) (Tabel Lampiran 1) + 1 mg/l BAP + 0.1 mg/l IBA untuk menginduksi tunas. Perendaman planlet dengan media cair yaitu MS + 2 mg/l BAP + 0.5 mg/l NAA + larutan kolkisin sesuai perlakuan. Media untuk subkultur setelah perlakuan perendaman yaitu MS + 2 mg/l BAP + 0.5 mg/l NAA. Sumber sukrosa adalah 30 g/l gula, selain itu 5 g/l agar-agar, pH larutan media sebelum autoclave adalah 5.9.
Pada uji sitologi bahan tanaman yang digunakan adalah akar dari tunas A. plowmanii Croat., aquades, HCl 1 N, Orsein 2%, cat kuku yang bening, tisu, alkohol 70%, dan spiritus.
Alat
Peralatan laboratorium yang dipergunakan dalam proses penelitian yaitu botol kultur, pipet, timbangan digital, pH meter, magnetic stirer, erlenmeyer, panci, pengaduk, pipet volumetrik, kompor gas, plastik, gelang karet, autoclave,
bunsen, spiritus, korek api, plastik wrap, penggaris, rak kultur, shaker, microfilter,
refrigerator, dan kamera.
Pada uji sitologi menggunakan peralatan-peralatan yaitu gelas objek, cover
glass, label, mikroskop cahaya, mikroskop mikrometer, silet, solatip bening,
pinset, pensil dengan ujung penghapus, kuas, microfilter, dan micro tube.
Metode Penelitian
Pada penelitian yang dilaksanakan terdiri atas dua faktor, yaitu: a. Faktor I adalah konsentrasi kolkisin:
Kontrol = kontrol (tanpa perendaman)
C0 = konsentrasi kolkisin 0% dengan media MS cair C1 = konsentrasi kolkisin 0.02%
C2 = konsentrasi kolkisin 0.04% C3 = konsentrasi kolkisin 0.06% b. Faktor II adalah lamanya waktu perendaman:
T1 = waktu perendaman selama 24 jam T2 = waktu perendaman selama 48 jam T3 = waktu perendaman selama 72 jam
Sebagai perlakuan kontrol adalah tunas A. plowmanii Croat. tanpa perendaman dengan kolkisin untuk mengurangi adanya kontaminasi. Rancangan yang dipergunakan adalah rancangan kelompok lengkap teracak (RKLT) dengan 3 ulangan pada masing-masing 13 perlakuan. Kombinasi perlakuan antara konsentrasi kolkisin dan lama perendaman disajikan pada Tabel 2. Tunas direndam dengan kolkisin sesuai perlakuan, selanjutnya disubkultur ke dalam media perbanyakan dengan memotong-motong menjadi satu tunas. Satu ulangan terdapat lima botol kultur. Setiap botol ditanam dua tunas. Pada penelitian ini terdapat 390 individu tunassebagai satuan percobaan yang diamati.
Model rancangan yang dipergunakan adalah sebagai berikut: Yij = µ + τi + βj + (MN)ij + Єijk
Keterangan :
perlakuan ke-j dari faktor lama perendaman (T) pada ulangan ke-k. µ : nilai rataan umum pengamatan
τi : pengaruh perlakuan konsentrasi kolkisin ke-i (i = 1, 2, 3, 4)
(MN)ij : pengaruh interaksi antara konsentrasi kolkisin ke-i (i = 1, 2, 3, 4) dengan lama perendaman ke-j (j = 1, 2, 3)
Єijk : galat perlakuan konsentrasi kolkisin ke-i, perlakuan lama perendaman ke-j pada ulangan ke-k (k = 1, 2, 3)
i : perlakuan konsentrasi kolkisin j : perlakuan lama perendaman k : ulangan
Tabel 2. Kombinasi perlakuan antara konsentrasi kolkisin dan lama perendaman
Keterangan: C Konsentrasi Kolkisin (C0 = 0%; C1 = 0.02%; C2 = 0.04%; C3 = 0.06%) T Lama Perendaman ( T1 = 24 jam; T2 = 48 jam; T3 = 72 jam)
Data dianalisis dengan uji F untuk mengetahui interaksinya antara konsentrasi kolkisin dengan lama perendaman. Apabila sidik ragam yang diperoleh berpengaruh nyata, selanjutnya melakukan uji DMRT (Duncan’s
Multiple Range Test) pada taraf nyata 5% untuk mengetahui pengaruh beda antar
perlakuan. Pengolahan data menggunakan program Statistic Analysis System (SAS for Windows v6. 12). Penghitungan jumlah kromosom, jumlah kloroplas pada sel penjaga (guard cell), kerapatan stomata, dan ukuran stomata dengan menggunakan microsoft office excel.
Perlakuan
Konsentrasi kolkisin (%)
Lama perendaman (jam)
0 24 48 72 Kontrol Kontrol - - - C0 - C0T1 C0T2 C0T3 C1 - C1T1 C1T2 C1T3 C2 - C2T1 C2T2 C2T3 C3 - C3T1 C3T2 C3T3
Pelaksanaan Penelitian
1. Sterilisasi Botol, Alat Tanam, dan Laminar Air Flow Cabinet
Botol dan alat-alat yang dipergunakan disterilkan dalam autoclave dengan temperatur 121oC dengan tekanan 17.5 psi (pound per square inch) selama satu jam. Menyalakan blower dan lampu laminar, kemudian laminar tersebut disemprot dengan alkohol 70% dan mengeringkannya dengan tisu. Sterilisasi ruang tanam dilakukan dengan menyemprotkan alkohol 96%. Laminar dan ruang tanam didiamkan selama satu jam.
2. Pembuatan Media
a. Pembuatan Media Penginduksian Tunas
Pembuatan media MS dilakukan dengan mengambil larutan stok yang telah dipersiapkan terlebih dahulu. Volume larutan stok yang diambil sesuai dengan keperluan seperti pada Tabel Lampiran 1 dan ditambahkan zat pengatur tumbuh 1 mg/l BAP, dan 0.1 mg/l IBA. Campuran media stok ditambahkan dengan 30 g/l gula. Larutan tersebut selanjutnya ditambahkan aquades hingga mencapai satu liter. Larutan diatur pHnya hingga mencapai 5.9 dengan menambahkan KOH atau HCl 1 N. Larutan tersebut ditambahkan 5 g/l agar, selanjutnya dimasak sampai larutan mendidih.
Botol media bervolume 200 ml disiapkan dan diisi larutan media sebanyak 25 ml/botol, selanjutnya ditutup dengan plastik dan diikat rapat dengan karet gelang. Media disterilkan ke dalam autoclave selama 20 menit. Media yang telah steril disimpan di ruangan dengan suhu 19oC.
b. Subkultur Planlet
Laminar air flow cabinet dan ruang tanam yang digunakan terlebih dahulu
disemprot dengan alkohol. Mempersiapkan semua alat tanam yang sudah steril, kemudian direndam dalam alkohol 70%, serta dibakar api dari bunsen saat proses penanaman berlangsung. Alat yang masih panas didiamkan di dalam botol kosong yang telah steril agar mendingin. Pemindahan tunas atau subkultur ke botol media penginduksian tunas dengan komposisi media dasar MS yang tertera pada Tabel
Lampiran 1, kemudian ditambahkan zat pengatur tumbuh 1 mg/l BAP dan 0.1 mg/l IBA. Saat pemindahan planlet berbonggol besar dan mempunyai akar yang panjang, maka perlu dipotong dengan pisau steril di dalam petridish, kemudian ditanam pada media dengan satu botol berisi satu tunas
A. plowmanii Croat. Planlet yang telah disubkultur dipindahkan ke ruang kultur
untuk dijadikan sebagai propagul selama 15 MST (minggu setelah tanam) dan disimpan dalam ruang inkubasi bersuhu 23±2oC.
3. Pembuatan Larutan Kolkisin a. Pembuatan Larutan Kolkisin
Kolkisin dilarutkan sesuai dengan perlakuan. Konsentrasi kolkisin yang dibuat adalah 0.02%, 0.04%, dan 0.06%, serta pembuatan larutan stok kolkisin sebesar 2% (1 g kolkisin/50 ml aquabides). Pembuatan larutan kolkisin dilakukan di dalam laminar air flow cabinet, yaitu (peneliti menggunakan baju lab, sarung tangan, dan masker) :
a. Laminar air flow cabinet disterilkan dengan alkohol 70% dan ruang tanam
dengan alkohol 96%, kemudian didiamkan selama satu jam.
b. Senyawa kolkisin yang ditimbang sebanyak 1 gram yang dimasukan ke dalam labu erlenmeyer yang berisi aquabides sebanyak 50 ml. Tabung erlenmeyer berisi larutan kolkisin tersebut ditutup dengan erat menggunakan plastik (selama pembuatan kolkisin blower pada laminar dan AC ruang tanam dimatikan).
c. Kolkisin dilarutkan secara merata dengan menggoyangkan diatas magnetic
stirer.
d. Larutan tersebut disterilkan dengan microfilter (ukuran mess 0.22 µ). e. Labu erlenmeyer yang telah berisi larutan kolkisin, kemudian disimpan di
dalam refrigerator yang bersuhu 40C.
b. Pengenceran Larutan Kolkisin untuk Perlakuan Perendaman
Pengenceran konsentrasi kolkisin dalam 50 ml dilakukan di dalam laminar, yaitu :
a. Laminar air flow cabinet dan ruang tanam disterilkan dengan alkohol,
kemudian didiamkan selama satu jam.
b. Kolkisin dilarutkan dengan konsentrasi 0.02% dengan cara 50 ml MS cair steril ditambah 0.5 ml dari larutan stok kolkisin steril 2%.
c. Kolkisin dilarutkan dengan konsentrasi 0.04% dengan cara 50 ml MS cair steril ditambah 1 ml dari larutan stok kolkisin steril 2%.
d. Kolkisin dilarutkan dengan konsentrasi 0.06% dengan cara 50 ml MS cair steril ditambah 1.5 ml dari larutan stok kolkisin steril 2% .
4. Perendaman Planlet dalam Larutan Kolkisin dan Penanaman
Bahan tunas yang telah disubkultur dan disimpan dalam ruang inkubasi untuk prekondisi selama 15 MST (minggu setelah tanam), kemudian dilakukan perendaman ke dalam larutan kolkisin sesuai dengan perlakuan. Pelaksanaan perendaman dilakukan di dalam laminar dan peralatan yang dipergunakan dalam keadaan steril. Perendaman dilakukan dengan merendam tunas anturium pada larutan kolkisin pada berbagai konsentrasi media cair tanpa kolkisin dan tanpa perendaman (kontrol), 0% (C0), 0.02% (C1), 0.04% (C2), 0.06% (C3). Tunas direndam di dalam media MS cair yang telah diberi kolkisin sesuai dengan perlakuan. Sebagai kontrol 1 tunas tidak direndam. Sebagai kontrol 2 (C0) tunas direndam dilarutan MS tanpa kolkisin. Penyimpanan selama perendaman dikocok dengan menggunakan sheaker. Perendaman dilakukan selama 24-72 jam sesuai dengan perlakuan. Botol yang berisi tunas diletakkan di atas sheaker dan digoyang dengan kecepatan 50 rpm. Pada setiap botol media ditanam dua tunas. Suhu ruang inkubasi 23±2oC, penyinaran 16 jam/hari, dan intensitas penyinaran ±1.000-2.000 lux. Tunas diinkubasi selama 11 MSP (minggu setelah perlakuan).
5. Uji Sitologi
Analisis jumlah kromosom dilakukan dengan menggunakan metode
squash. Squashing (sediaan tekan) digunakan untuk komponen sel suatu jaringan. Sample yang diamati kromosomnya sebanyak tiga sample setiap ulangan. Pada
HCl 1 N dan Orsein ke dalam microtube. Uji sitologi dilakukan pada pukul 09.12-09.25 WIB dan diulang untuk setiap konsentrasi sesuai dengan lamanya perendaman. Langkah-langkah untuk pengujian sitologi, yaitu :
Tunas diambil sebanyak tiga sample setiap ulangan dari planlet yang bebas bakteri dan cendawan. Dipilih akar yang masih muda atau akar yang memiliki ujung
berwarna kuning (dilakukan di dalam laminar).
Pukul 09.12-09.25 WIB memotong bagian ujung akar ±1 cm (dilakukan di dalam laminar).
Fiksasi akar.
Potongan diangkat dari petridish dan dimasukan ke larutan 1 N HCl dan direndam di air hangat pada suhu 16oC selama satu menit (dilakukan di luar laminar).
Potongan akar diangkat, kemudian direndam ke dalam pewarna Orsein 2% selama 2 jam (dilakukan di luar laminar).
Bagian tudung akar dibuang dan dipotong tipis bagian meristem akar untuk pengamatan kromosom. Materi dimasukan ke dalam gelas objek yang telah ditetesi pewarna Orsein 2%, kemudian ditutup dengan cover glass dan ditekan
dengan jari tengah atau dipukul perlahan hingga bagian akar pipih dengan menggunakan pangkal pensil berkaret.
Gelas objek dipanaskan dengan cara melewatkan gelas objek di atas api.
Pengamatan di bawah mikroskop dan melakukan pemotretan pada proses penggandaan kromosom.
Bagian pinggir preparat dioleskan dengan cat kuku bening agar cover glass tidak bergeser dan Orsein tidak cepat menguap.
Melakukan penghitungan jumlah kromosom dari hasil foto dengan perbesaran menggunakan software Microsoft Office Picture Manager.
6. Analisis Kloroplas dan Stomata
Pengamatan kloroplas dan stomata dilakukan secara bersamaan. Sample yang diamati kloroplas dan stomata sebanyak tiga sample setiap ulangan. Langkah-langkahnya sebagai berikut :
Sehelai daun dipotong dari tiga tunas yang berbeda pada satu ulangan. Pengambilan daun dilakukan pada pukul 12.00-13.00 WIB. Proses yang sama
untuk setiap ulangan dan perlakuan yang berbeda (dilakukan di dalam laminar).
Daun dipotong dengan ukuran 1x1 cm (dilakukan diluar laminar).
Bagian permukaaan atas daun ditempelkan ke solatip.
Bagian permukaan bawah daun dipukul-pukul secara perlahan agar tipis dengan menggunakan scalple, namun tidak merusak organel di dalam daun.
Solatip direkatkan diatas gelas objek.
Pengamatan di bawah mikroskop dan dilakukan pemotretan pada kloroplas dan stomata.
Dilakukan penghitungan jumlah kloroplas dan jumlah stomata dari hasil foto dengan perbesaran menggunakan software Microsoft Office Picture Manager.
7. Pengamatan
Pengamatan dilakukan setiap minggu dari luar botol kultur selama 11 MSP. Beberapa peubah yang diamati dari eksplan tunas sebagai berikut :
a. Persentase kontaminasi (%)
Pada pengamatan persentase kontaminasi dilakukan setelah perendaman dan penanaman. Pengamatan dilakukan sampai 11 MSP.
Persentase eksplan hidup = ∑ eksplan yang ditanam – mati- terkontaminasi x 100 % ∑ eksplan yang ditanam
b. Tinggi tunas (cm)
Pengukuran tunas mulai dari minggu pertama setelah perlakuan perendaman hingga 11 MSP. Proses pengukuran menggunakan penggaris dengan cara menempelkan alat ukur ke dinding botol kultur yang dimulai dari pangkal batang hingga daun tertinggi dari planlet.
c. Jumlah tunas
Menghitung berdasarkan tunas yang telah terbentuk sampai 11 MSP. d. Jumlah daun
Menghitung jumlah daun yang tumbuh dari minggu pertama setelah perlakuan perendaman sampai 11 MSP. Penghitungan daun berdasarkan daun yang telah membuka penuh.
e. Jumlah akar
Melakukan pengamatan pada saat setelah perlakuan perendaman sampai 11 MSP.
f. Panjang akar terpanjang (cm)
Melakukan pengamatan pada saat setelah perlakuan perendaman sampai 11 MSP. Melakukan pengukuran dari akar tumbuh atau pangkal batang sampai ujung akar.
i. Menghitung jumlah kromosom
Waktu pengambilan akar pada pukul 09.12-09.25 WIB dan pukul 11.30 WIB melakukan pengamatan kromosom di bawah mikroskop cahaya setelah tahapan fiksasi selesai. Mendokumentasikan proses terjadinya penggandaan kromosom, maka dari hasil foto tersebut dilakukan penghitungan jumlah kromosomnya dengan menggunakan software Microsoft Office Picture
Manager. Pengamatan kromosom pada mikroskop sampai pembesaran
j. Menghitung jumlah kloroplas dan stomata
Pengamatan jumlah koloroplas dan stomata dengan mikroskop mikrometer, maka dari hasil foto tersebut dilakukan penghitungan jumlah kloroplas dan jumlah stomata dengan menggunakan software Microsoft Office
Picture Manager. Pengukuran stomata dengan cara panjang stomata dan lebar
sel penjaga diukur dengan penggaris mikrometer yang ada pada lensa. Gambar 2 menunjukkan cara pengukuran stomata.
Gambar 2. Cara pengukuran panjang stomata dan lebar sel penjaga stomata
Pengamatan kloroplas dan stomata dengan menggunakan mikroskop mikrometer dengan pembesaran 40x10 dan pembesaran pada kamera digital 3 kali. Pengambilan bahan ini dilakukan pada pukul 12.00-13.00 WIB.
Panjang stomata
Lebar sel penjaga
Sel penjaga (guard cell)
HASIL DAN PEMBAHASAN
Kondisi Umum Percobaan
Tunas A. plowmanii Croat. yang dipergunakan dalam penelitian ini diperoleh dari planlet in vitro yang sudah berumur dua belas bulan, sehingga perlu disubkultur. Planlet anturium yang tumbuh bergerombol disubkultur dengan memotong-motong menjadi satu tunas. Terdapat eksplan tunas berakar dan eksplan yang belum mempunyai akar. Tunas tersebut dilakukan prekondisi selama 15 MST (minggu setelah tanam) dan dilanjutkan dengan pemberian perlakuan.
Persentase kultur yang terkontaminasi cukup tinggi pada beberapa perlakuan, seperti tercantum pada Tabel 3.
Tabel 3. Persentase tingkat kontaminasi kultur A. plowmanii Croat. selama 11 MSP
Perlakuan
Lama perendaman
(jam)
Persentase (%) kontaminasi pada
minggu ke-MSP Konsentrasi kolkisin (%) 1 4 8 11 Kontrol 0 0.00 0.00 0.00 0.00 0 24 0.00 0.00 0.00 0.00 0 48 93.33 100.00 100.00 100.00 0 72 50.00 50.00 100.00 100.00 0.02 24 0.00 0.00 0.00 0.00 0.02 48 66.70 76.67 76.67 76.67 0.02 72 0.00 0.00 0.00 0.00 0.04 24 0.00 0.00 0.00 0.00 0.04 48 0.00 33.33 43.33 43.33 0.04 72 56.67 70.00 70.00 70.00 0.06 24 63.33 63.33 96.67 96.67 0.06 48 0.00 0.00 0.00 0.00 0.06 72 30.00 36.67 36.67 36.67
Keterangan : MSP : Minggu setelah perlakuan
Sebagian besar kontaminasi pada kultur disebabkan oleh bakteri yang menyerang pada 1 MSP. Penyebab kontaminasi diperkirakan karena kurang terjaganya kebersihan saat melakukan pencampuran antara larutan kolkisin
dengan larutan MS sehingga larutan sudah terkontaminasi dan menyebabkan eksplan yang direndam menyerap larutan yang sudah terkontaminasi. Faktor eksternal merupakan penyebab bakteri masuk ke dalam larutan. Perkiraaan faktor eksternal tersebut seperti pipet yang digunakan kurang steril, bulb yang mengeluarkan udara tidak steril, dan proses pemindahan pipet yang berisi larutan kolkisin ke larutan MS. Gejala pada permukaan media tunas yang terkontamiansi terlihat adanya lapisan lendir putih (Gambar 3). Upaya sterilisasi dengan menggunakan alkohol 30%, alkohol 10% dan betadine tidak membuat tunas bebas kontaminasi, namun kembali terserang bakteri. Kontaminasi tidak hanya disebabkan oleh bakteri, cendawan juga mulai muncul pada 8 MSP. Subkultur dilakukan bila tunas terkontaminasi. Pada satu minggu setelah subkultur, tunas terserang cendawan. Faktor eksternal seperti air pada plastik yang kemudian menetes pada permukaan media dapat membawa kontaminan penyebab kontaminasi. Pertumbuhan kontaminan akibat cendawan pada media lebih cepat dibandingkan dengan pertumbuhan tunas. Jika cendawan telah mengenai tunas dapat menyebabkan pertumbuhan tunas terhambat.
(a) (b)
Gambar 3. Kontaminasi pada kultur in vitro A. plowmanii Croat. setelah perlakuan kolkisin (a) Kontaminasi oleh bakteri pada 1 MSP, (b) Kontaminasi oleh cendawan pada 8 MSP
Pertumbuhan tunas A. plowmanii Croat. kontrol 1 tanpa perendaman kolkisin berbeda dengan kontrol 2 yang direndam pada media MS cair tanpa kolkisin (C0). Hal ini karena adanya pemberian ZPT eksogen dari perendaman
dan media tanam terhadap hormon endogen tunas. Hormon dalam tunas berubah karena melakukan perimbangan hormon, sehingga pertumbuhan tunas berbeda. Kolkisin bersifat toksik sehingga perlakuan dengan perendaman tunas dicampur dengan larutan MS bertujuan agar tunas tetap memperoleh nutrisi.
Pertumbuhan tunas setelah diberikan perlakuan kolkisin terhambat dibandingkan kontrol. Pengaruh interaksi antara konsentrasi kolkisin dan lama perendaman dengan kolkisin selain berpengaruh pada pertumbuhan yang terhambat juga munculnya kimera dan kalus pada organ daun. Kondisi planlet pada perlakuan C3T3 terlihat daun berwarna kuning (Gambar 4), sedangkan pada perlakuan yang lain terlihat sama dengan kontrol.
(a) (b) (c)
Gambar 4. Kondisi tunas in vitro A. plowmanii Croat. setelah diberi perlakuan kolkisin (a) Tunas kontrol warna daun hijau, (b, c) Tunas pada perlakuan C3T3 dengan warna daun kuning
Berdasarkan hasil uji F interaksi antara taraf konsentrasi dan lama perendaman dengan kolkisin tidak berpengaruh nyata terhadap peubah tinggi tunas, namun sangat nyata terhadap peubah jumlah tunas, jumlah daun, jumlah akar, dan panjang akar. Taraf konsentrasi kolkisin berpengaruh sangat nyata terhadap peubah jumlah tunas dan jumlah akar; berpengaruh nyata terhadap peubah jumlah daun (pada 5-7 MSP) dan panjang akar (pada 1-8 MSP dan 10-11 MSP); tidak berpengaruh nyata terhadap peubah tinggi tunas, jumlah daun (pada 1-4 MSP dan 8-11 MSP) dan panjang akar (pada 9 MSP). Lama perendaman dengan kolkisin berpengaruh tidak nyata terhadap