COMPUTER PROGRAM FOR DESIGNING CATHODIC
PROTECTION SYSTEM SACRIFICIAL ANODE METHOD
MUTIA DELINA
6305000157
GRADUATE PROGRAM IN MATERIAL SCIENCE
FACULTY OF MATHEMATIC AND SCIENCES
INDONESIA UNIVERSITY
2007
PEMBUATAN PERANGKAT LUNAK PEMBANTU
PERANCANGAN PROTEKSI KATODIK
SISTEM ANODA KORBAN
Tesis diajukan sebagai salah satu syarat memperoleh gelar
Magister dalam bidang ilmu material
MUTIA DELINA
6305000157
PROGRAM STUDI MATERIAL SCIENCE
PROGRAM PASCA SARJANA
UNIVERSITAS INDONESIA
2007
ABSTRAK
Korosi atau karat merupakan peristiwa penurunan mutu material pada bahan logam akibat intraksi yang tidak menguntungkan dengan lingkungan. Korosi tidak dapat dihindari atau dihilangkan, namun dapat dikendalikan dengan melakukan proteksi katodik sistem anoda korban, yaitu memasang anoda korban pada bagian yang hendak diproteksi. Pemasangan anoda korban memerlukan desain yang tepat dan akurat agar sesuai dengan kebutuhan arus proteksi. Oleh karena itu diperlukan sebuah perangkat lunak atau program yang dapat digunakan untuk membantu perancangan desain proteksi katodik system anoda korban. Perangkat lunak ini nantinya dapat diaplikasikan pada beberapa kasus seperti proteksi untuk pipa baja, tiang penyangga dermaga dan lambung kapal baja. Perangkat lunak proteksi katodik system anoda korban memerlukan input luas area yang akan diproteksi, jenis anoda yang akan dipergunakan, berat anoda dan umur desain proteksi. Output dari perangkat lunak ini antara lain jumlah anoda yang diperlukan, jarak pemasangan antar anoda, pemasangan anoda yang efektif (horizontal atau vertical). Perangkat lunak ini dibuat dengan menggunakan software Microsoft Visual Basic 6.0.
ABSTRACT
Corrosion or rust is degradation of metal quality because of its disadvantages interaction with environment. We cannot avoid corrosion or annihilate it, but we can prevent it by protecting the metal with sacrificial anodizing system of cathodic protection. Sacrificial anodizing system is the sacrificial anode setting in the area that needs protection. The setting needs good design. So the design will appropriate with the current protection necessity. Because of that we need a program to help us for planning the protection design. The program will be applied in some cases such as protection for steel pipe, quay pole and ship hull. It needs some inputs, which are the wide area, kind of anode, weight of anode and the age of protection. This program output would be amount of anode, distance set between anode, effectiveness setting of anode (horizontal or vertical). The program is created using Microsoft Visual Basic 6.0 software.
i
KATA PENGANTAR
Puji dan syukur penulis panjatkan kehadirat Allah SWT, yang telah memberikan rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan tesis yang berjudul :
“Pembuatan Perangkat Lunak Pembantu Perancangan Proteksi Katodik Sistem Anoda Korban”
Tesis ini merupakan salah satu peryaratan untuk memperoleh ijazah Magister pada program studi Ilmu Material Program Pasca Sarjana Universitas Indonesia.
Pada kesempatan yang berbahagia ini penulis ingin menyampaikan ucapan terima kasih yang sebesar-besarnya kepada:
1. Bapak Dr. Ir. Johny Wahyuadi Soedarsono, DEA, selaku pembimbing yang telah memberikan pengarahan serta meluangkan waktu bagi penulis untuk menyelesaikan tesis ini.
2. Bapak Dr. Bambang Soegijono, selaku ketua Program Studi Ilmu Material Program Pasca Sarjana Universitas Indonesia.
3. Bapak Dr. Mohammad Hikam, selaku sekretaris Program Studi ilmu Material Program Pasca Sarjana Universitas Indonesia.
4. Staf Pengajar Program Studi Ilmu Material Program Pasca Sarjana Universitas Indonesia.
5. Ibu Dra. Yuliarsi DR selaku Kepala Divisi Program Pendidikan PP IPTEK yang telah memberikan kesempatan kepada penulis untuk menyelesaikan tesis ini. 6. Kedua orang tua, Mas Rinto serta adik-adikku yang telah memberikan dukungan
ii
7. Rekan-rekan Mahasiswa angkatan 2005 Program Studi Ilmu Material Program Pasca Sarjana universitas Indonesia yang telah memberikan semangat dan bantuan selama pembuatan tesis.
Semoga Allah SWT melimpahkan kebahagiaan dan kesejahteraan atas jasa dan budi baik yang telah diberikan kepada penulis.
Penulis berharap semoga tesis ini dapat bermanfaat dan penulis juga berharap pembaca dapat memberikan kritik dan saran demi sempurnanya tesis ini.
Jakarta, Juni 2007
iii
DAFTAR ISI
Hal Lembar persetujuan Abstrak Kata Pengantar ………. iDaftar isi ……….. iii
Daftar Gambar ……… v
Daftar Tabel ……… vii
BAB I PENDAHULUAN 1.1 Latar Belakang Masalah ……… 1
1.2 Tujuan Penelitian ……… 2
1.3 Pembatasan Masalah ……… .3
BAB II TINJAUAN PUSTAKA 2.1 Pengertian Korosi ……… 4
2.2 Jenis-Jenis Korosi ………... 9
2.2.1 Korosi Merata ………... 9
2.2.2 Korosi Sumuran ……… 10
2.2.3 Korosi Antar Butir ………. 10
2.2.4 Korosi Erosi ………11
2.2.5 Korosi Galvanik ...………. 12
2.2.6 Korosi Celah ………. 14
2.3 Laju Korosi ………. 15
iv
2.4.1 Pelapisan ………. 16
2.4.2 Perlakuan Lingkungan ………. 17
2.4.3 Pemilihan Material ……….. 17
2.4.4 Desain Berlebih dan Perbaikan Desain ………. 17
2.4.5 Proteksi Katodik ………17
2.5 Rumus-rumus Proteksi Katodik dalam Program ………21
2.5 Program Visual basic 6.0 ……….. 26
BAB III PROSEDUR PENELITIAN ……… 29
BAB IV HASIL PENELITIAN DAN PEMBAHASAN 4.1 Program perancangan proteksi katodik ………33
4.2 Melakukan pengujian ………. 38
4.2.1 Uji komposisi ………. 38
4.2.2 Uji Korosi……… 40
4.2.3 Potensial Proteksi……… 49
4.3 Analisi hasil perhitungan ……….. 50
BAB V KESIMPULAN DAN SARAN……… 55
Daftar Acuan ……… 56
Lampiran 1 – Fowchar Program………. 57
Lampiran 2 – Listing Program……… 60
v
DAFTAR GAMBAR
Gambar 2.1 Mekanisme Korosi ……… 5
Gambar 2.2 Korosi pada permukaan logam………5
Gambar 2.3 Reaksi elektrokimia pada logam ...…………6
Gambar 2.4 Korosi yang terjadi antara tembaga dan besi baja..……… 9
Gambar 2.5 Korosi Merata ……….9
Gambar 2.6 Mekanisme Korosi Sumuran ………..10
Gambar 2.7 Korosi Sumuran ………10
Gambar 2.8 Korosi Antar Butir.………..11
Gambar 2.9 Korosi Erosi ………11
Gambar 2.10 Mekanisme Korosi Galvanik ……….13
Gambar 2.11 Korosi Galvanik ………..13
Gambar 2.12 Mekanisme Korosi Celah ……….14
Gambar 2.13 Korosi Celah ………14
Gambar 2.14 Proteksi katodik dengan anoda korban ………. 18
Gambar 2.15 Auto List Member ………27
Gambar 2.16 Tampilan IDE Visual Basic 6.0 ……… 27
Gambar 2.17 Window Code ………. 28
Gambar 3.1. Pengamplasan ………30
Gambar 3.2 Sebelum pengamplasan ………...30
Gambar 3.3 Setelah pengamplasan ………. 30
Gambar 3.4 Timbangan BOSCH SAE 200 ……….. 31
Gambar 3.5 Pengecekan sambungan kabel dengan multimeter ………31
Gambar 3.6 Diagram alir penelitian ……….. 32
Gambar 4.1 Tampilan awal program ……….33
vi
Gambar 4.3 Program desain proteksi untuk penyangga dermaga………34 Gambar 4.4 Program untuk menghitung proteksi pada kapal baja..………….35 Gambar 4.5 Output Program……….….……… 35 Gambar 4.6 Perhitungan desain proteksi pada kapal baja………... 37 Gambar 4.7 Grafik pengaruh kecepatan air terhadap laju korosi baja
AISI 1020 tanpa proteksi ……..………. . 41 Gambar 4.8 Perbandingan kebutuhan berat anoda Al data pengujian
dan hasil perhitungan program ………44 Gambar 4.9 Perbandingan kebutuhan berat anoda seng data pengujian
Dan hasil perhitungan program………47 Gambar 4.10 Perbandingan kebutuhan berat anoda magnesium data
pengujian dan hasil perhitungan program……….49 Gambar 4.11 Efek kecepatan air laut terhadap korosi baja………. 51
vii
DAFTAR TABEL
Tabel 2.1 Deret Elektrokimia..……….. …… 8
Tabel 2.2 Deret Galvanis ……….. …...12
Tabel 2.3 Standar kimia alloy magnesium………...……… 19
Tabel 2.4 Grade magnesium alloy………..………...……… 19
Tabel 2.5 Komposisi anoda senguntuk lingkungan air laut……… 20
Tabel 2.6 Sifat anoda galvanis………...……… 21
Tabel 2.7 Beberapa tombol toolbar dan fungsinya.……… 28
Tabel 4.1 Komposisi kimia baja AISI 1020.……….. 38
Tabel 4.2 Komposisi kimia anoda aluminium………. 39
Tabel 4.3 Komposisi kimia anoda seng……… 39
Tabel 4.4 Komposisi kimia anoda magnesium ……….. 40
Tabel 4.5 Laju korosi baja AISI 1020 ……….………... 40
Tabel 4.6 Data eksperimen pengaruh kecepatan air terhadap pengurangan berat anoda aluminium……….. 42
Tabel 4.7 Perhitungan kebutuhan anoda aluminium………..….……… 44
Tabel 4.8 Data eksperimen pengaruh kecepatan air terhadap pengurangan berat anoda seng………. 44
Tabel 4.9 Perhitungan kebutuhan anoda Zn ……..………... 46
Tabel 4.10 Data eksperimen pengaruh kecepatan air terhadap pengurangan Berat anoda magnesium………. 47
Tabel 4.11 Perhitungan kebutuhan anoda magnesium……… 49
Tabel 4.12 Potensial proteksi terhadap pasangan katoda dan anoda….………… 50
Tabel 4.13 Perbedaan nilaikebutuhan berat anoda aluminium hasil eksperimen Dan hasill perhitungan program………. 52 Tabel 4.14 Perbedaan nilai kebutuhan berat anoda seng hasil eksperimen dan
viii
Hasil perhitungan program……….. 52 Tabel 4.15 Perbedaan nilai kebutuhan berat anoda magnesium hasil
Eksperimen dan hasil perhitungan………. 52 Tabel 4.16 Deret elektrokimia………..….………… 53
1
BAB I
PENDAHULUAN
1.1 Latar Belakang
Korosi merupakan salah satu masalah serius yang berakibat pada timbulnya kerugian dalam segi pembiayaan. Berdasarkan penelitian di Amerika, korosi telah menelan biaya ratusan milyar dolar setiap tahunnya. Biaya yang ditimbulkan oleh korosi telah dipelajari oleh beberapa negara, hasil dari penelitian tersebut menyatakan bahwa biaya yang ditimbulkan oleh korosi adalah 1 sampai dengan 5% dari Gross National Product. Biaya tersebut meliputi utilitas 34.7%, transportasi
21.5%, infrastruktur 16.4%, pemerintahan 14.6%, produksi dan manufaktur 12,8% [1].
Korosi tidak dapat dihilangkan namun dapat dicegah dengan memproteksi material dari lingkungan. Salah-satunya adalah dengan proteksi katodik sistem anoda korban. Proteksi katodik sistem anoda korban telah digunakan secara meluas. Desain yang digunakan merupakan perpaduan antara pengalaman dan data experiment. Bagaimanapun kegagalan pada proteksi katodik tidak hanya akan berdapak pada kerugian secara ekonomi, tetapi juga pada keselamatan nyawa manusia dan lingkungan [2].
Kerugian secara ekonomi terjadi karena perusahaan harus mengeluarkan beberapa biaya ekstra. Biaya tersebut terbagi dalam biaya langsung berupa; perbaikan kerusakan material, dan biaya tidak langsung berupa; biaya yang timbul akibat menurunnya produksi, kentungan dan umur pakai alat.
Proteksi katodik sistem anoda korban memerlukan perhitungan dan perancangan yang matang agar desain sesuai dengan kebutuhan proteksi material
2 untuk jangka waktu tertentu. Desain yang tepat akan menolong perusahaan dari extracost akibat dari desain yang berlebihan atau kerusakan karena desain yang tidak tepat. Oleh karena itu diperlukan sebuah sarana berupa perangkat lunak untuk membantu desain proteksi katodik, sehingga desain yang yang dihasilkan sesuai dengan kebutuhan.
Banyak penelitian yang berkaitan dengan perancangan proteksi katodik denngan menggunakan program komputer antara lain Ernesto Santana dan Robert Adey [3] dalam The Journal of Corrosion Science and Engineering 2006, meneliti Validation of Cathodic Protection Design Using Computer Simulation. Kemudian
Ernesto Santana dan Robert Adey [4], meneliti tentang Predictive Modeling of Corrosion and Cathodic Protection System. V.G DeGiorgi [5] dalam Elsevier 2001,
meneliti tentang Evaluation of Perfect Paint Assumption in Modeling of Cathodic Protection System. Robert A Adey dan John Baynham [2], dalam Corrosion 2000,
meneliti tentang Design and Optimization of Cathodic Protection Systems Using Computer Simulation.
1.2 Tujuan Penelitian
1. Membuat perangkat lunak untuk membantu perncangan proteksi katodik system anoda korban untuk kapal baja, pipa baja dan tiang penyangga dermaga sehingga dihasilkan keluaran program berupa hasil perhitungan proteksi katodik system anoda korban.
2. Menghindari kesalahan dalam melakukan disain awal proteksi. 3. Menyediakan perkiraan disain proteksi dengan cepat dan murah.
4. Mengetahui efektifitas pemasangan anoda korban secara horizontal dibandingkan terhadap pemasangan anoda secara vertikal.
3
1.3 Pembatasan Masalah
1. Program yang digunakan adalah Visual Basic 6.0, karena terbatasnya kemampuan program ini, maka program hanya dapat digunakan untuk mendisain proteksi untuk lambung kapal baja, pipa baja dan tiang penyangga dermaga. 2. Material anoda yang digunakan dalam pemograman adalah aluminium, seng dan
magnesium.
3. Untuk validasi, pemodelan dilakukan dengan pengujian laboratorium dengan metoda kehilangan berat (WGL : Weight Gain Loss)
4. Anoda yang digunakan pada eksperimen hanya aluminium, seng dan magnesium.
5. Pengambilan data akan memvariasikan kecepatan alir air garam antara lain; 0.00 m/s, 0.09 m/s, 0.18 m/s, 0.27 m/s dan 0.36 m/s
4
BAB II
TINJAUAN PUSTAKA
2.1 Pengertian Korosi
Korosi merupakan penurunan mutu logam akibat reaksi elektrokimia dengan lingkungannya. Secara umum korosi meliputi hilangnya logam pada bagian yang ter-ekpose. Korosi terjadi dalam berbagai macam bentuk, mulai dari korosi merata pada seluruh permukaan logam sampai dengan korosi yang terkonsentrasi pada bagian tertentu saja.
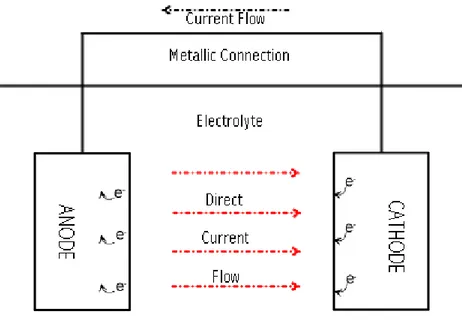
Korosi pada logam terjadi karena adanya aliran arus listrik dari satu bagian pada ke bagian yang lain di permukaan logam. Aliran arus ini akan menyebabkan hilangnya metal pada bagian dimana arus dilepaskan ke lingkungan (oksidasi atau reaksi anoda). Proteksi terjadi di titik dimana arus kembali ke permukaan logam (reaksi katoda).
Terdapat empat unsur pokok yang harus dipenuhi agar korosi dapat terjadi. Jika salah satunya hilang, maka korosi tidak dapat terjadi. Empat unsur pokok tersebut antara lain;
• Anoda, tempat terjanya reaksi oksidasi.
• Katoda, tempat terjadinya reaksi reduksi.
• Elektrolit, Lingkungan tempat katoda dan anoda ter-ekpose.
• Sambungan logam, katoda dan anoda harus disambung dengan menggunaan sambungan logam agar arus listrik dapat mengalir.
5 Gambar 2.1 Mekanisme Korosi
Pada logam yang sama, salah satu bagian permukaannya dapat menjadi anoda dan bagian permukaan lainnya menjadi katoda. Hal ini bisa saja terjadi karena kemungkinan logam terdiri dari phase yang berbeda, karena permukaan logam dilapisi dengan kondisi coating yang berbeda, atau karena di permukaan logam terdapat lebih dari satu macam elektrolit.
6 Logam dapat dicelupkan pada elektrolit atau permukaan logam dapat digenangi oleh elektrolit dan membentuk lapisan tipis. Laju korosi bergantung pada konduktifitas listrik elektrolit. Air murni memiliki konduktifitas listrik yang kurang baik sehingga laju korosi yang terjadi akan lebih rendah jika dibandingkan dengan larutan asam yang memiliki konduktifitas listrik tinggi.
Gambar 2.3 Reaksi elektrokimia pada logam
Salah satu contohnya adalah korosi yang terjadi antara seng dan asam HCl. Berikut ini merupakan gambaran reaksi elektrokimia yang terjadi;
Zn + 2HCl Æ ZnCl2 + H2
Seng bereaksi dengan larutan asam sehingga membentuk seng clorida dan melepaskan gas hidrogen ke udara. Reaksi ionik yang terjadi adalah sebagai berikut;
Zn + 2H+ + 2Cl-Æ Zn2+ + 2Cl- + H 2
Dengan menghapus Cl- pada kedua sisi, reaksi dapat disederhanakan menjadi; Zn + 2H+Æ Zn2+ + H2
(2) (1)
7 Reaksi di atas dapat dibagi menjadi reaksi anoda dan reaksi katoda.
Zn Æ Zn2+ + 2e- reaksi anoda
2H+ + 2e-Æ H2 reaksi katoda
Reaksi elektrokimia seperti pada (3) dan (4) hanya dapat terjadi pada nilai tertentu saja. Jika tersedia elektron pada (4), maka potensial pada permukaan akan menjadi lebih negatif, kelebihan elektron akan mengakibatkan arus negatif terkumpul pada logam atau pada larutan menunggu reaksi berikutnya terjadi. Reaksi tidak akan cukup cepat untuk mengakomodasi semua elektron yang tersedia. Potensial arus negatif ini disebut dengan polarisasi katodik. Kekurangan elektron pada metal karena pelepasan elektron yang terjadi pada (3) pada larutan akan menghasilkan perubahan arus positif yang disebut dengan polarisasi anoda. Jika kekurangan elektron (polarisasi) semakin besar, kecendrungan pemutusan hubungan anoda akan semakin besar. Polarisasi anoda yang terjadi akan mendorong terjadinya korosi dengan reaksi anoda (3).
Pada larutan elektrolit, permukaan akan mencapai nilai potensial yang setimbang Ecorr, yang nilainya tergantung pada kemampuan dan laju pertukaran
elektron pada reaksi katoda dan anoda. Pada saat nilai potensial meningkat dari Ecorr menjadi E, laju reaksi anoda atau laju korosi secara umum akan meningkat.
Polarisasi anoda dapat didefinisikan sebagai Єa = E - Ecorr. Tanpa polarisasi, laju
korosi akan terjadi sangat cepat. Polarisasi akan menurunkan reaksi korosi dan memperkecil logam yang hilang dengan cara merubah potensial pada anoda atau katoda atau pada keduanya, sehingga perbedaan potensial di antara kedua berubah menjadi minimum.
Kemampuan logam untuk menahan korosi biasanya bergantung pada posisi mereka dalam deret elektrokimia.
(3)
8 Tabel 2.1 Deret Elektrokimia
Jika dua buah logam yang jenisnya berbeda terpisah sangat jauh pada deret elektrokimia, maka arus listrik yang dihasilkan karena kontak yang terjadi diantara keduanya akan semakin besar. Logam yang berada pada deretan tabel bagian atas adalah logam yang aktif, sedangkan logam yang berada pada tabel bagian bawah adalah logam noble. Jadi, semakin kearah atas tabel maka logam akan semakin
mudah terkorosi dan semakin ke arah bawah tabel maka logam akan semakin terproteksi.
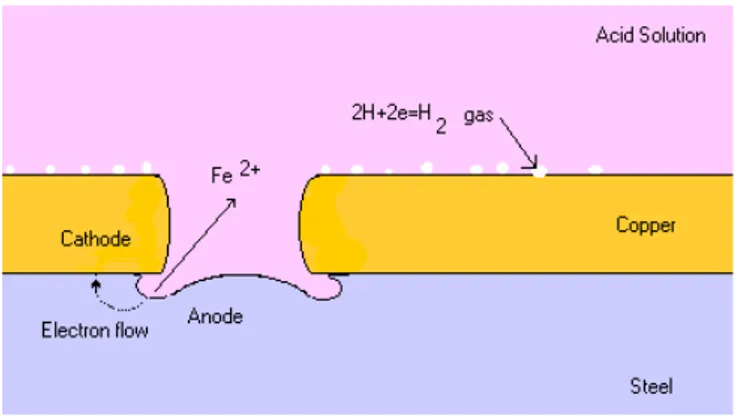
Salah satu contohnya adalah korosi yang terjadi antara tembaga dan besi baja yang direndam dalam larutan asam.
Element Ion Electrode Potential
(Volts) Hydrogen Overvoltage (Volts) Magnesium Mg2+ -1.87 ( Base End) 0.7 Zinc Al3+ -1.35 0.5 Aluminium Zn2+ -0.76 0.7 Chromium Cr2+ -0.6 0.32 Iron Fe2+ -0.44 0.18 Cadmium Cd2+ -0.4 0.5 Cobalt Co2+ -0.29 Nickel Ni2+ -0.22 0.15 Tin Sn2+ -0.14 0.45 Lead Pb -0.13 0.45 Hydrogen H+ 0.00 - Antimony Sb3+ +0.11 0.42 Copper Cu2+ +0.34 0.25 Silver Ag+ +0.8 0.1
Gold Au3+ +1.3 (Noble End) 0.35
Oxygen OH- +0.4
9 Gambar 2.4 Korosi yang terjadi antar tembaga dan besi baja
2.2 Jenis-Jenis korosi
Berdasarkan bentuk dan tempat terjadinya, korosi terbagi dalam beberapa jenis antara lain; korosi merata (uniform corrosion), korosi sumuran, korosi antar butir, korosi erosi, korosi galvanik dan korosi celah dan masih banyak lainnya. Berikut ini merupakan penjelasannya;
2.2.1 Korosi Merata
Korosi merata atau general corrosion merupakan bentuk korosi yang paling
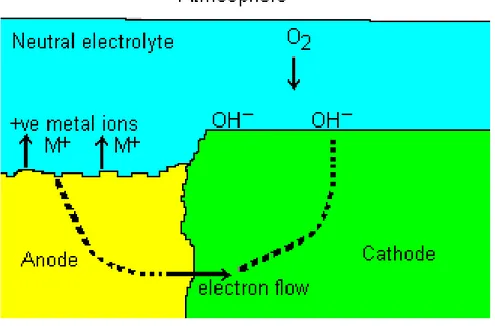
lazim terjadi. Korosi yang muncul terlihat merata pada seluruh permukaan logam dengan intensitas yang sama. Salah satu contohnya adalah effek dari korosi atmosfer pada permukaan logam. Korosi merata terjadi apabila seluruh bagian logam memiliki komposisi yang sama. Korosi jenis ini biasanya dapat diatasi dengan cara meng-coating permukaan logam.
10
2.2.2 Korosi Sumuran
Korosi sumuran merupakan korosi yang muncul dan terkonsentrasi pada daerah tertentu. Bentuk korosi ini biasanya disebabkan oleh klorida. Mekanisme terbentuknya korosi sumuran sama dengan korosi celah. Hanya saja korosi sumuran ukurannya lebih kecil jika dibandingkan dengan korosi celah. Karena jaraknya yang saling berdekatan satu sama lain, korosi sumuran akan mengakibatkan permukaan logam menjadi kasar. Korosi sumuran terjadi karena komposisi material yang tidak homogen, rusaknya lapisan pelindung, adanya endapan dipermukaan material, serta adanya bagian yang cacat pada material.
Gambar 2.6 Mekanisme Korosi Sumuran
Gambar 2.7 Korosi Sumuran
2.2.3 Korosi Antar Butir
Korosi antar butir atau interglanular corrosion merupakan korosi yang terjadi
11 karena adanya impuritas atau pengotor pada batas butir dan dan terjadi secara lokal disepanjang batas butir pada logam paduan.
Gambar 2.8 Korosi Antar Butir
Gambar di atas menunjukkan sebuah logam stainless steel yang terkorosi pada bagian yang terkena panas dimana jaraknya tidak jauh dari bagian las-lasan. Ini merupakan tipikal dari korosi antar butir pada austenic stainless steel. Korosi tipe
ini dapat dihilangkan dengan menggunakan stailess steel 321 atau 347 atau dengan menggunakan stainless stell yang tingkat karbonnya rendah (304L atau 316L)
2.2.4 Korosi Erosi
Korosi erosi merupakan gabungan dari kerusakan elekrokimia dan kecepatan fluida yang tinggi pada permukaan logam. Korosi erosi dapat pula terjadi karena adanya aliran fluida yang sangat tinggi melewati benda yang diam atau statis. Atau bisa juga terjadi karena sebuah objek bergerak cepat di dalam fluida yang diam, misalnya baling-baling kapal laut.
12 Bagian permukaan logam yang terkena korosi biasanya relatif lebih bersih jika dibandingkan dengan permukaan logam yang terkena korosi jenis lain. Erosi korosi dapat dikendalikan dengan menggunakan material yang terbuat dari logam yang keras, merubah kecepatan alir fluida atau merubah arah aliran fluida.
2.2.5 Korosi Galvanik
Korosi galvanik terjadi apabila dua buah logam yang jenisnya berbeda di pasangkan dan direndam dalam cairan yang sifatnya korosif. Logam yang rebih aktif atau anoda akan terkorosi, sementara logam yang lebih noble atau katoda tidak akan
terkorosi. Pada tabel galvanisasi, aluminium dan seng lebih aktif jika dibandingkan dengan baja.
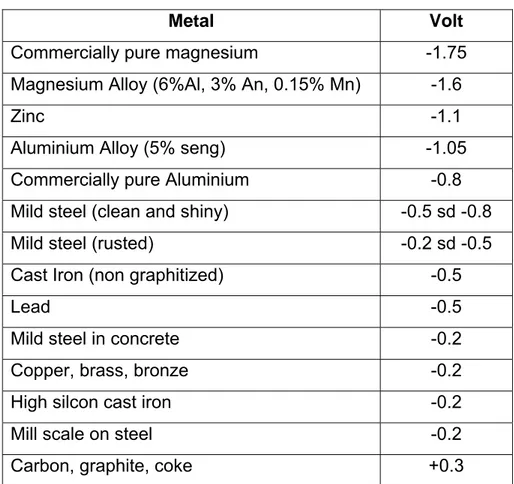
Tabel 2.2 Deret Galvanis
Metal Volt
Commercially pure magnesium -1.75 Magnesium Alloy (6%Al, 3% An, 0.15% Mn) -1.6
Zinc -1.1 Aluminium Alloy (5% seng) -1.05
Commercially pure Aluminium -0.8 Mild steel (clean and shiny) -0.5 sd -0.8 Mild steel (rusted) -0.2 sd -0.5 Cast Iron (non graphitized) -0.5
Lead -0.5
Mild steel in concrete -0.2
Copper, brass, bronze -0.2
High silcon cast iron -0.2
Mill scale on steel -0.2
13 Gambar 2.10 Mekanisme korosi galvanik
Gambar 2.11 Korosi Galvanik
Korosi galvanik ini banyak terjadi pada benda yang menggunakan lebih dari satu macam logam sebagai komponennya, misalnya pada automotif. Jika aluminium terhubung langsung dengan baja, maka aluminium akan terkorosi. Untuk mengatasi hal ini, maka di antara aluminium dan baja harus ditempatkan sebuah benda non logam atau isolator untuk memisahkan kontak listrik di antara keduanya.
Mekanisme korosi galvanik biasanya digunakan untuk sistem proteksi pada komponen baja, misalnya proteksi pada lambung kapal, tiang penyangga dermaga, pipa baja, tiang penyangga jembatan dan lain sebagainya.
14
2.2.6 Korosi Celah
Korosi celah merupakan korosi yang terkonsentrasi pada daerah tertentu. Korosi celah terjadi karena adanya larutan atau elektrolit yang terperangkap di dalam celah atau lubang, misalnya pada sambungan dua permukaan logam yang sejenis, permukaan logam yang retak, baut dan tapal. Elektrolit yang terperangkap pada lubang akan menimbulkan beda konsentrasi oksigen, sehingga terbentuk sel korosi. Daerah dengan konsentrasi oksigen tinggi berperan sebagai katoda dan daerah konsentrasi oksigen rendah berperan sebagai anoda.
Gambar 2.12 Mekanisme korosi celah
15
2.3 Laju Korosi
Korosi sangat dipengaruhi oleh lingkungan misalnya temperatur pH, oksigen, kecepatan fluida, dan zat-zat oksidator. Untuk menghitung laju korosi, terdapat dua metode yang dapat digunakan antara lain metode kehilangan berat atau weight gain loss (WGL) dan metode elektrokimia.
DAT
W
R
=
534
(2.1)Dimana
R = laju korosi (mil per year) W = kehilangan berat (mg) D = Berat jenis (g/cm3) A = Luas permukaan (inchi2)
T = Rentan waktu yang digunakan untuk pengujian (jam)
Satuan laju korosi MPY diatas dapat dikonversi dalam beberapa tipe satuan lainnya, antara lain 1 mpy = 0.0254 mm/yr = 25.4 µm/yr = 2.90 mm/h = 0.805 pm/s.
Atau laju korosi dapat dihitung dengan persamaan berikut ini;
DAT
W
R
=
87600
(2.2) DimanaR = laju korosi (mil per year) W = kehilangan berat (mg)
16 D = Berat jenis (g/cm3)
A = Luas permukaan (cm2)
T = Rentan waktu yang digunakan untuk pengujian (jam)
DAT
W
R
=
87
.
6
(2.3)Dimana
R = laju korosi (mil per year) W = kehilangan berat (mg) D = Berat jenis (g/cm3) A = Luas permukaan (cm2)
T = Rentan waktu yang digunakan untuk pengujian (jam)
2.4 Metode Pencegahan Korosi
Lima macam metode yang digunakan untuk mengontrol korosi adalah pelapisan atau coating, perlakuan lingkungan, pemilihan material, desain berlebih
dan proteksi katodik.
2.4.1 Pelapisan
Pelapisan merupakan cara yang paling umum dilakukan untuk melindungi logam dari serangan korosi. Pelapis yang dapat digunakan antara lain cat, logam (galvanisasi, plastik dan semen. Pada dasarnya pelapis-pelapis ini berfungsi untuk melindungi logam dari reaksi yang tidak menguntungkan dengan lingkungan, oleh karena itu pelapis-pelapis ini harus bersifat mudah dilapiskan, memiliki daya adhesi
17 yang baik, dapat bertahan lama dan memiliki sifat tahan terhadap korosi, tahan terhadap temperatur tinggi, tahan air, dan lain sebagainya.
2.4.2 Perlakuan Lingkungan
Perlindungan terhadap korosi dapat juga dilakukan dengan mengusahakan lingkungan menjadi tidak korosif. Namun hal ini biasanya hanya bisa dilakukan pada lingkungan terbatas. Misalnya mengurangi atau menghilangkan uap air dan partikel-partikel korosi yang bersifat korosif.
2.4.3 Pemilihan Material
Pencegahan korosi dengan memilih material dilakukan dengan menggunakan material logam ataupun paduannya yang bersifat tahan korosi, misalnya titanium ataupun baja tahan karat.
2.4.4 Desain Berlebih dan Perbaikan Desain
Pencegahan korosi dengan menggunakan desain berlebih dilakukan dengan cara menambah ukuran material yang sebenarnya, agar umur pakainya dapat diperpanjang sesuai dengan kebutuhan.
2.4.5 Proteksi Katodik
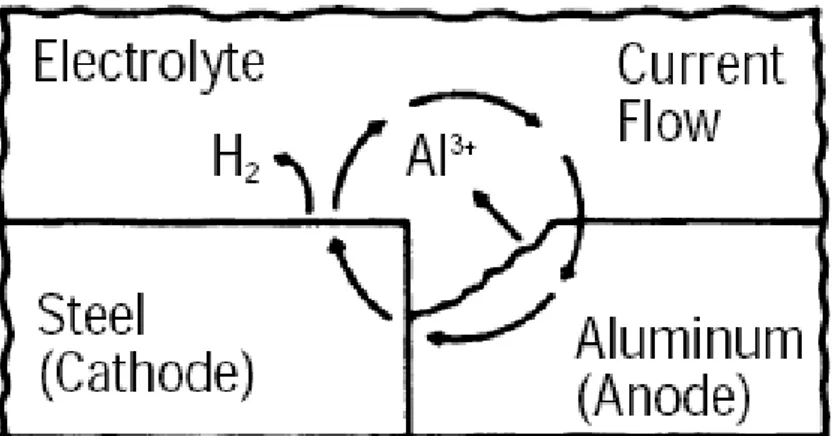
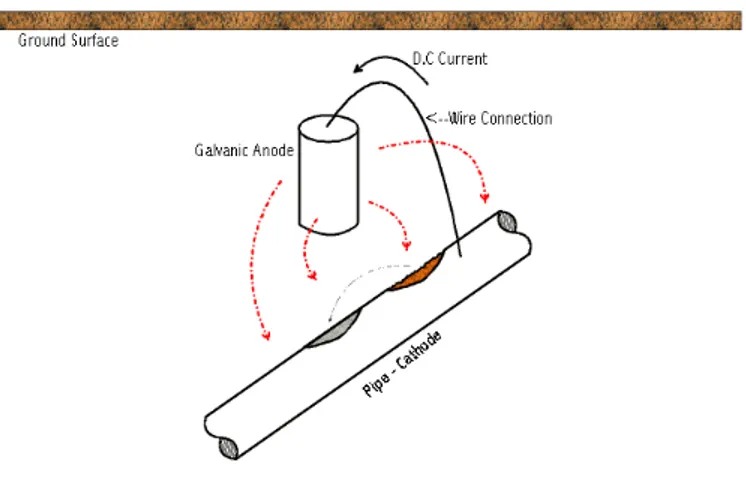
Proteksi katodik dapat dilakukan dengan dua cara yaitu dengan menggunakan anoda korban (sacrificial anode) dan inpress current (ICCP). Proteksi katodik dengan
anoda korban terjadi saat sebuah logam dihubungkan dengan logam yang lebih reaktif (anoda). Hubungan ini mengarah pada sebuah rangkaian galvanik. Untuk memindahkan korosi secara efektif dari struktur logam, material anoda harus
18 mempunyai beda potensial cukup besar untuk menghasilkan arus listrik. Penggunaan proteksi katodik secara efektif akan menyediakan proteksi yang baik pada seluruh area permukaan material. Kombinasi coating dan proteksi katodik akan
memberikan pilihan yang lebih ekonomis dan efektif untuk memproteksi material pada lingkungan tanah dan air laut.
Gambar 2.14 Proteksi katodik dengan anoda korban
Terdapat tiga macam material yang dibiasanya digunakan dalam proteksi katodik untuk material baja, yaitu magnesium, seng dan aluminium. Pemilihan anoda untuk proteksi tergantung pada restifitas dan elektrolit yang akan digunakan. Berikut ini merupakan keterangannya;
• Magnesium
Anoda magnesium biasanya digunakan untuk proteksi katodik pada lingkungan tanah. Terdapat dua buah alloy megnesium yang umum digunakan pada proteksi katodik yaitu High-Potential Magnesium dan H-1
Alloy. High Potential Alloy dihasilkan langsung dari magnesium yang disuling
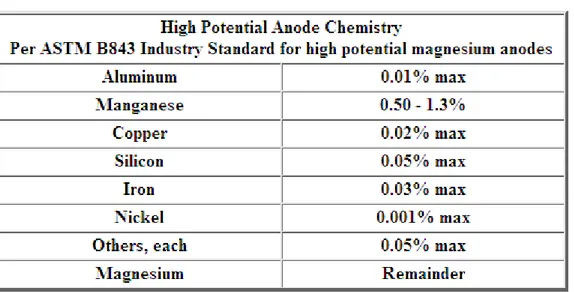
dari air laut, sementara H-1 Alloy dihasilkan dari magnesium yang diperoleh dari recycling facilities. High-Potential Alloy menyediakan maksimum tegangan
19 Alloy menghasilkan tegangan keluaran yang lebih rendah yaitu -1.40 volt relatif terhadap tembaga sulfat. Pemilihan alloy magnesium pada proteksi katodik membutuhkan pertimbangan kebutuhan arus, resistifitas tanah, dan biaya yang akan dikeluarkan. Standar kimia yang dibutuhkan pada alloy magnesium adalah sebagai berikut;
Tabel 2.3 Standar kimia alloy magnesium
20
• Seng
Anoda seng digunakan untuk protesi katodik pada lingkungan tanah yang memiliki resistifitas rendah, beberapa kondisi air seperti air laut, air payau dan air tawar. Berikut ini merupakan tabel komposisi anoda seng untuk pengunaan pada lingkungan air laut.
Tabel 2.5 Komposisi anoda seng untuk lingkungan air laut
Anoda seng yang standar digunakan pada proteksi katodik di lingkungan air laut dan lingkungan air payau adalah mengandung aluminium dan cadminium.
• Aluminium
Anoda aluminium digunakan pada lingkungan air laut dan beberapa kondisi air tawar. Aluminium memiliki umur yang lebih panjang jika dibandingkan dengan magnesium. Aluminium juga memiliki arus dan karakteristik berat yang lebih baik jika dibandingkan dengan seng. Dalam pembuatannya aluminium biasanya dicampur dengan mercuri, antimoni, indium, tin.
21 Material anoda yang dipilih harus dipertimbangkan dari material yang akan diproteksi. Anoda harus lebih reaktif jika dibandingkan dengan material yang akan diproteksi. Kelemahan dari proteksi katodik sistem anoda korban ini adalah terbatasnya umur pakai anoda serta arus proteksi yang dapat digunakan. Dengan demikian anoda korban harus diganti secara berkala.
Berkut ini merupakan tabel sifat anoda galvanis.
Tabel 2.6 Sifat anoda galvanis
Anoda Effisiensi (%) Energy Capability (Ah/lb) Laju Konsumsi (lb/Ay) Potesial Vs CuCuSO4 (volts) Seng 95 353 24.8 -1.10 Aluminium (Al-Zn-In) 85 830 10.5 -1.10 Magnesium (H-1 Alloy) 50 500 17.5 -1.45 Magnesium
(High Potensial Alloy)
50 500 17.5 -1.70
2.5 Rumus-Rumus Proteksi Katodik dalam Program Luas permukaan pipa baja yang diproteksi
(
D
)
L
A
=
π
×
/
100
×
(2.4)dengan :
A= luas permukaan pipa (cm2)
π= 3.14
D= dimeter pipa (cm) L= panjang pipa (m)
22
Kebutuhan total arus proteksi
( )
1000
Cd
A
lp
=
×
(2.5) dengan:lp= kebutuhan total arus proteksi (A)
A= luas permukaan pipa (m2)
Cd= rapat arus (mA/m2)
Berat total anoda yang diperlukan
μ
C
Y
lp
w
tot=
×
×
(2.6) dengan: totw = berat total anoda yang diperlukan (kg)
lp= kebutuhan total arus proteksi (A)
Y= umur disain proteksi (tahun)
C= laju konsumsi anoda (kg/Ampere.tahun) μ= faktor utilisasi (0<μ<1)
Jumlah anoda yang diperlukan
a tot
w
w
23 dengan:
n= jumlah anoda yang diperlukan (buah)
tot
w = berat total anoda yang diperlukan (kg)
a
w = berat tiap anoda (kg)
Jarak pemasangan antar anoda
n
L
s
=
(2.8)dengan:
s= jarak pemasangan antar anoda (m)
L= panjang pipa (m)
n= jumlah anoda yang diperlukan (buah)
Kebutuhan arus proteksi tiap jarak anoda
n
lp
lps
=
(2.9)dengan:
lps= kebutuhan arus proteksi tiap jarak anoda (A)
lp = kebutuhan total arus proteksi (A)
n = jumlah anoda yang diperlukan (buah)
Tahanan Anoda yang dipasang Horizontal
⎟
⎠
⎞
⎜
⎝
⎛
−
=
ln
4
1
2
dal
la
la
Rh
π
ρ
(2.10)24 dengan:
Rh= tahanan anoda yang dipasang horizontal (ohm) ρ = resistivitas lingkungan (ohm.cm)
la = panjang anoda (cm) dal= diameter anoda (cm)
Tahanan Anoda yang dipasang Vertikal
⎟
⎠
⎞
⎜
⎝
⎛
−
=
ln
8
1
2
dal
la
la
Rv
π
ρ
(2.11) dengan:Rv = tahanan anoda yang dipasang vertikal (A) ρ = resistivitas lingkungan (ohm.cm)
la = panjang anoda (cm) dal = diameter anoda (cm)
Keluaran Arus Proteksi Tiap Anoda Horizontal
(
)
Rh
Ec
Ea
lah
=
−
(2.12) dengan:lah=keluaran arus proteksi tiap anoda horizontal (A) Ea=Potensial anoda (volt)
25 Ec=potensial katoda (volt)
Rh= tahanan anoda yang dipasang horizontal (ohm)
Keluaran Arus Proteksi Tiap Anoda Vertikal
(
)
Rv
Ec
Ea
lav
=
−
(2.13) dengan:lav =keluaran arus proteksi tiap anoda vertikal (A) Ea=Potensial anoda (volt)
Ec=potensial katoda (volt)
Rv= tahanan anoda yang dipasang vertikal (ohm)
Rumus proteksi katodik pada kapal baja Luas bawah garis air
Dp
Cb
D
Bm
Lpp
A
=
×
×
×
×
+
6
.
25
×
35
56
.
1
(2.14) dengan:A = Luas bawah garis air (m2) Lpp=Panjang garis air (m)
Bm = Lebar terbesar garis air (m)
D= Draft sarat/daya muat kapal (m)
Cb= Coefisien block
26
Kuat arus yang dibutuhkan
1000
20
A
I
reg=
×
(2.15)Dengan:
reg
I =Arus yang dibutuhkan (A)
A = Luas bawah garis air (m2) Current density air laut = 20 mV/A
Berat total anoda yang dibutuhkan
85
.
0
2700
8760
×
×
×
=
I
Y
W
tot reg (2.16) dengan: totW = berat total kebutuhan anoda (kg)
reg
I = Arus yang dibutuhkan (A)
2.6 Program Visual Basic 6.0
Visual Basic 6.0 merupakan program penghasil aplikasi yang berkerja pada system operasi windows. Kelebihan dari program ini adalah pemakai tidak perlu bersusah payah untuk menghapal Syntax Procedure karena Auto List Member dan Auto Quick akan selalu menampilkan beberapa pilihan yang dapat digunakan.
27 Gambar 2.15 Auto List Member
Dalam Visual Basic 6.0, program aplikasi dibuat pada sebuah bidang kerja yang sebut dengan integrated Development Integration (IDE). Bagian-bagian yang
terdapat pada IDE antara lain menu, toolbar, form, window code, toolbox, project explorer, window properties, window form layout dan window immediate.
Gambar 2.16 Tampilan IDE Visual Basic 6.0
Toolbox Form Project
Explorer PropertiesWindow Form LayoutWindow Toolbar
28 Agar program berjalan sesuai dengan keinginan, listing program ditulis pada window code.
Gambar 2.17 Window Code
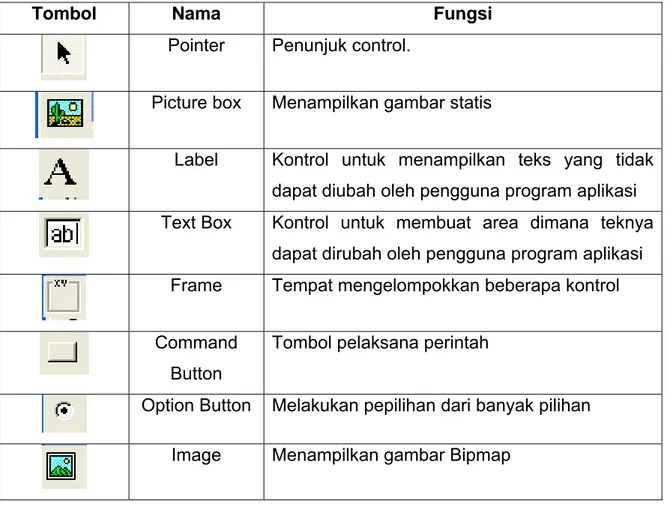
Selain listing, program membutuhkan beberapa tombol yang digunakan untuk menjalankan program, tombol ini dapat dipilih dari toolbox. Beberapa tombol yang digunakan dalam perangkat lunak proteksi katodik antara lain;
Tabel 2.7 Beberapa tombol toolbar dan fungsinya
Tombol Nama Fungsi
Pointer Penunjuk control.
Picture box Menampilkan gambar statis
Label Kontrol untuk menampilkan teks yang tidak dapat diubah oleh pengguna program aplikasi Text Box Kontrol untuk membuat area dimana teknya
dapat dirubah oleh pengguna program aplikasi Frame Tempat mengelompokkan beberapa kontrol
Command Button
Tombol pelaksana perintah
Option Button Melakukan pepilihan dari banyak pilihan
29
BAB III
PROSEDUR PENELITIAN
Dalam perrcobaan ini terdapat beberapa tahapan yang harus dilakukan untuk membuat perangkat lunak pembantu perancangan proteksi katodik system anoda korban. Tahapan-tahapan tersebut antara lain:
1. Studi literatur
Pada tahapan ini dikumpulkan data-data antara lain persamaan-persamaan yang akan digunakan dalam perhitungan proteksi katodik system anoda korban.
2. Membuat program
2.1 Membuat flowchart program
2.2 Membuat program perancangan proteksi katodik system anoda korban. Program atau perangkat lunak Proteksi Katodik Sistem Anoda Korban ini dibuat dengan menggunakan software Visual Basic 6.0. Program dibuat untuk memperoteksi kapal baja, pipa baja dan tiang penyangga dermaga, seperti yang tertera pada Bab I Pendahuluan.
3. Melakukan pengujian
Pengujian ini dilakukan untuk membandingkan hasil perhitungan program dengan data yang didapat dari hasil percobaan di laboratorium. Percobaan dilakukan dengan cara mengukur laju korosi dengan menggunakan metode kehilangan berat. Pengujian program ini hanya akan dilakukan dengan menggunakan anoda aluminium, seng dan magnesium sesuai dengan yang tertera pada Bab I Pendahuluan. Baja yang digunakan pada pengujian ini adalah baja tipe AISI 1020. Lingkungan air laut diganti dengan air garam 3,5 % dengan variasi kecepatan air.
30 3.1 Persiapan sampel
3.1.1 Baja dan anoda diberi tanda dengan menggunakan stamping. Hal ini dilakukan untuk mengidentifikasi sampel. Tanda yang dipilih adalah sebagai berikut:
1 = Baja
2 = Anoda Al 3 = Anoda Zn
3.1.2 Permukaan baja dibersihkan dari karat dengan menggunakan amplas
Gambar 3.1 Pengamplasan
31 3.1.3 Membersihkan baja dari organik seperti gemuk maupun minyak dengan menggunakan aseton.
3.1.4 Menimbang massa awal baja dan anoda korban menggunakan timbangan dengan ketelitian 0,1 mg.
3.1.5 Baja dihubungkan dengan anoda korban menggunakan kawat tembaga 3.1.6 Memeriksa sambungan baja dan anoda dengan menggunakan multimeter
Gambar 3.4 Timbangan BOSCH SAE 200
Gambar 3.5 Pengecekan sambungan kabel dengan multimeter
32 3.2 Pelaksanaan Uji Korosi
Dalam uji korosi sampel direndam dalam air garam selama 3 hari atau 72 jam dengan beberapa kondisi antara lain;
3.2.1 Air diam (0 m/s)
3.2.2 Air bergerak (0.09 m/s, 0.18 m/s, 0.27 m/s, 0.36 m/s)
Agar penelitian dapat lebih terfokus maka dibuat sistimatika penelitian sebagaimana tertera dibawah ini.
DIAGRAM ALIR PENELITIAN
Gambar 3.6. Diagram Alir Penelitian
Merencanakan tujuan dan program yang akan dibuat Perangkat lunak pembantu perhitungan proteksi katodik
system anoda korban
Rumus-rumus proteksi system anoda korban Literatur
Hasil perhitungan program Proses pembuatan program
Analisis hasil program dan validasi Literatur
Kesimpulan
33
BAB IV
HASIL PENELITIAN DAN PEMBAHASAN
4.1 Program Perancangan Proteksi Katodik
Program perancangan proteksi katodik dibuat dengan menggunakan software visual basic 6.0. Program ini menyediakan tiga pilihan aplikasi pada tampilan awal yaitu untuk pipa baja, penyangga dermaga dan kapal baja.
Gambar 4.1 Tampilam awal program
Masing-masing pilihan aplikasi akan menyediakan perhitungan desain proteksi katodik system anoda korban sesuai dengan kondisi lingkungan yang dikehendaki; di dalam tanah, air laut mengalir, air laut diam.
Pada masing-masing aplikasi, pengguna program diminta untuk memasukkan beberapa input data antara lain kondisi lingkungan, jenis anoda yang akan digunakan, presentase coating, umur desain proteksi, dimensi daerah yang akan
34 diproteksi, factor utilisasi, dimensi serta berat anoda yang akan digunakan, potensial anoda dan resistifitas lingkungan.
Gambar 4.2 Program desain proteksi untuk pipa baja
35 Gambar 4.4 Program untuk menghitung proteksi pada kapal baja
Dari input data tersebut program akan meng-output luas area yang diproteksi, kebutuhan total arus, berat total anoda yang diperlukan, jumlah anoda yang dibutuhkan, jarak pemasangan antar anoda, kebutuhan arus proteksi tiap jarak anoda, tahanan anoda yang dipasang vertical dan horizontal serta keluaran proteksi tiap anoda vertical dan horizontal.
36 Output program juga akan memberikan informasi apakah disain proteksi tersebut dapat diaplikasikan atau tidak.
Untuk mencoba program ini maka pada program perhitungan proteksi katodik digunakan contoh perhitungan proteksi pada kapal baja dengan data masukkan sebagai berikut:
Potensial baja kelingkungan :1.1 volt Resistifitas lingkungan : 25 ohm.cm Panjang anoda : 30 cm Potensial anoda : 1 volt Panjang garis air : 82.5 m
Draft : 3 m
Lebar terbesar garis air : 11.12 m Diameter propeller : 1.5 m Umur desain proteksi : 3 tahun Current density air laut : 20 mV/A Berat anoda : 9 kg
Jenis Anoda : Aluminium Coefficient Block : 0.85 Panjang Anoda : 30 cm Diameter Anoda : 11.89 cm
Maka nilai keluaran yang dihasilkan oleh program adalah sebagai berikut; Luas area proteksi : 1172.48 m2
Kuat arus yang dibutuhkan : 23.45 Ampere Berat anoda yang dibutuhkan :269 kg
37 Jumlah anoda yang dibutuhkan : 30 buah
Jarak pemasangan antar anoda : 6.2757 m
Kebutuhan arus proteksi tiap jarak anoda : 0.78 Ampere Tahanan anoda yang dipasang horizontal : 0.5736 ohm Tahanan anoda yang dipasang vertikal : 0.7854 ohm Keluaran Arus Proteksi Tiap Anoda Horizontal : 0.1743 Ampere Keluaran Arus Proteksi Tiap Anoda Vertikal : 0.1273 Ampere
Nilai keluaran arus proteksi horizontal dan vertikal dibandingkan dengan kebutuhan arus proteksi tiap jarak anoda. Jika nilai keluaran arus proteksi lebih kecil dari pada kebutuhan arus proteksi, maka desain tersebut tidak dapat diaplikasikan. Karena nilai keluaran arus proteksi anoda horizontal 0.1743 Ampere lebih kecil dari pada kebutuhan arus proteksi 0.7854 Ampere maka disain ini tidak dapat diaplikasikan. Karena nilai keluaran arus anoda vertikal 0.1273 Ampere juga lebih kecil dari pada kebutuhan arus proteksi 0.7854 Ampere, maka desain ini juga tidak dapat diaplikasikan. Untuk itu pengguna program harus memasukkan data baru dan mencari desain yang sesuai dengan kebutuhan arus proteksi.
38
4.2 Melakukan Pengujian
Untuk membuktikan keakuratan program maka dilakukan penelitian dengan melakukan perendaman pada material baja AISI 1020. Material baja ini direndam dengan empat kondisi yaitu direndam tanpa perlindungan anoda, direndam dengan proteksi anoda aluminium, direndam dengan proteksi anoda seng, dan direndam dengan proteksi anoda magnesium.
4.2.1 Uji Komposisi
Sebelum melakukan pengujian ketiga macam material ini dilakukan uji komposisi dengan XRF merek JEOL. Berikut ini merupakan hasil uji komposisinya.
a. Komposisi Baja AISI 1020
Tabel 4.1 Komposisi kimia Baja AISI 1020
No Element Designation 1 Carbon (C) 0.18037 2 Silicon (Si) 0.21676 3 Tembaga (Cu) 0.04374 4 Pospor (P) 0.0186 5 Mangan (Mn) 0.50998 6 Lead (Pb) 0.00074 7 Silicon (Si) 0.21676 8 Timah (Sn) 0.00240 9 Aluminium (Al) 0.04769 10 Niobium (Nb) 0.00175 11 Nikel (Ni) 0.02958 12 Molibdenum (Mo) 0.00213 13 Zirkonium (Zr) 0.00064 14 Vanadium (V) 0.00214 15 Wolfram (W) 0.00123 16 Titanium (Ti) 0.00183 17 Cromium (Cr) 0.03662 18 Besi (Fe) 98.8982
39 b. Komposisi Anoda Anoda Korban
Tabel 4.2 Komposisi Kimia Anoda Aluminium
No Element Designation
1 Aluminium (Al) Remainder
2 Silicon (Si) 0.151 3 Titanium (Ti) 0.0123 4 Mercury (Hg) - 5 Besi (Fe) 0.0617 6 Seng (Zn) 2.29 7 Magnesium (Mg) - 8 Indium (In) 0.0165 9 Tembaga (Cu) - 10 Cadmium (Cd) -
Tabel 4.3 Komposisi Kimia Anoda Seng
No Element Designation 1 Seng (Zn) remaider 2 Besi (Fe) 0.40 3 Timah (Sn) - 4 Tembaga (Cu) - 5 Aluminium (Al) 0.418 6 Cadmium (Cd) 0.0417 7 Indium (In) - 8 Lead (Pb) 0.0007 9 Silicon (Si) 0.0004 10 Thalium (Tl) -
40 Tabel 4.4 Komposisi kimia anoda magnesium
No Element Designation 1 Aluminium (Al) 3.754 2 Seng (Zn) 6.998 3 Mangan (Mn) - 4 Silicon (Si) 2.118 5 Tembaga (Cu) - 6 Nikel (Ni) - 7 Besi (Fe) 0.0383 8 Calcium (Ca) - 9 Timbal (Pb) 0.0121 10 Magnesium (Mg) Remainder 4.2.2 Uji Korosi
Dimensi dan massa seluruh sampel di ukur sebelum melakukan pengujian. Dimensi diukur dengan menggunakan jangka sorong dengan ketelitian 0.001 cm. Sedangkan berat sampel diukur menggunakan timbangan dengan ketelitian 0.1 mg. Sesuai dengan kondisi lingkungan yang telah disebutkan pada Bab III bahwa sampel di rendam dalam air garam dengan variasi kecepatan; 0.00 m/s, 0.09 m/s, 0.18 m/s, 0.27 m/s dan 0.36 m/s selama 3 hari atau 72 jam. Berikut ini merupakan data yang didapat dari hasil pengujian.
a. Baja AISI 1020 tanpa proteksi
Tabel 4.5 Laju korosi baja AISI 1020 Kecepatan Air (m/s) pH rata-rata Pengurangan Berat (mg) Laju Korosi (mm/yr) 0.00 7.02 25.1 0.1351 0.09 7.02 84.8 0.4484 0.18 7.02 158 0.8062 0.27 7.02 193 1.0076 0.36 7.02 .246 1.2842
41 Dari table data 4.5 dibuat sebuah grafik hubungan antara kecepatan alir air dengan laju korosi baja AISI 1020.
Gambar 4.7 Grafik pengaruh kecepatan air terhadap laju korosi baja AISI 1020 tanpa proteksi
Laju korosi baja AISI 1020 dapat dihitung dengan menggunakan persamaan (2.3) pada BAB II. Berikut ini merupakan salah satu contoh perhitungannya
W = 25.1 mg D = 7.86 g/cm3 A = 28.75 cm3
42 b. Kebutuhan berat anoda korban
Tabel 4.6 Data eksperimen pengaruh kecepatan air terhadap pengurangan berat anoda aluminium Kecepatan air (m/s) pH rata-rata Luas area (cm2) T (jam) Pengurangan berat (mg) 0.00 7.04 28.708 72 0.0803 0.09 7.04 29.025 72 0.1018 0.18 7.04 28.639 72 0.1184 0.27 7.04 28.000 72 0.1255 0.36 7.04 28.685 72 0.1375
Sementara nilai yang didapat dari perhitungan program adalah sebagai berikut;
V = 0 m/s (air diam)
A = 28.708 cm2 atau 0.0028 m2 Y = 3 hari atau 0.008 tahun Cd = 269 mA/m2
C = 3.2 kg/AY
= 0.90
Perhitungan kebutuhan proteksi
43 V = 0.09 m/s (air bergerak)
A = 29.025 cm2 atau 0.0029 m2 Y = 3 hari atau 0.008 tahun Cd = 377 mA/m2
C = 3.2 kg/AY
= 0.90
Perhitungan kebutuhan proteksi
44 Berikut ini merupakan table data dari hasil perhitungan kebutuhan berat anoda Al
Tabel 4.7 Perhitungan kebutuhan anoda aluminium Kecepatan Air (m/s) Luas Area (cm2) T (Jam) W (mg) 0.00 28.708 72 0.021 0.09 29.025 72 0.031 0.18 28.639 72 0.030 0.27 28.000 72 0.030 0.36 28.685 72 0.030
Hasil perhitungan program kemudian dibandingkan dengan data pengujian dalam grafik berikut ini
Gambar 4.8 Perbandingan kebutuhan berat anoda Al dari data pengujian dan hasil perhitungan program
Tabel 4.8 Data eksperimen pengaruh kecepatan air terhadap pengurangan berat anoda seng Kecepatan air (m/s) pH rata-rata Luas area (cm2) T (jam) Pengurangan berat (mg) 0.00 7.04 28.328 72 0.1787 0.09 7.04 28.000 72 0.1791 0.18 7.04 27.904 72 0.2115 0.27 7.04 28.434 72 0.2265 0.36 7.04 28.486 72 0.2547
45 Sementara nilai yang didapat dari perhitungan program adalah sebagai berikut; V = 0 m/s (air diam)
A = 28.328 cm2 atau 0.0028 m2 Y = 3 hari atau 0.008 tahun Cd = 269 mA/m2
C = 11.2 kg/AY
= 0.90
Perhitungan kebutuhan proteksi
Ampere
V = 0.09 m/s (air bergerak) A = 28.000cm2 atau 0.0028 m2 Y = 3 hari atau 0.008 tahun Cd = 377 mA/m2
C = 11.2 kg/AY
46 Perhitungan kebutuhan proteksi
Ampere
Tabel 4.9 Perhitungan kebutuhan anoda Seng Kecepatan Air (m/s) Luas Area (cm2) T (Jam) W (mg) 0.00 28.328 72 0.0749 0.09 28.000 72 0.105 0.18 27.904 72 0.101 0.27 28.434 72 0.105 0.36 28.486 72 0.105
Hasil perhitungan program kemudian dibandingkan dengan data pengujian dalam grafik berikut ini
47 Gambar 4.9 Perbandingan kebutuhan berat anoda seng dari data pengujian
dan hasil perhitungan program
Tabel 4.10 Data eksperimen pengaruh kecepatan air terhadap pengurangan berat anoda magnesium Kecepatan air (m/s) pH rata-rata Luas area (cm2) T (jam) Pengurangan berat (mg) 0.00 7.04 29.971 72 3.7182 0.09 7.04 29.017 72 4.3554 0.18 7.04 29.850 72 4.8623 0.27 7.04 28.810 72 4.4911 0.36 7.04 28.860 72 4.8750
Sementara nilai yang didapat dari perhitungan program adalah sebagai berikut; V = 0 m/s (air diam)
A = 29.971cm2 atau 0.0029 m2 Y = 3 hari atau 0.008 tahun Cd = 269 mA/m2
C = 8 kg/AY
48 Perhitungan kebutuhan proteksi
Ampere
V = 0.09 m/s (air bergerak) A = 29.017 cm2 atau 0.0029 m2 Y = 3 hari atau 0.008 tahun Cd = 377 mA/m2
C = 8 kg/AY
= 0.90
Perhitungan kebutuhan proteksi
49 Tabel 4.11 Perhitungan kebutuhan anoda magnesium
Kecepatan Air (m/s) Luas Area (cm2) T (Jam) W (mg) 0.00 29.971 72 0.055 0.09 29.017 72 0.077 0.18 29.850 72 0.077 0.27 28.810 72 0.075 0.36 28.860 72 0.075
Gambar 4.10 Perbandingan kebutuhan berat anoda Magnesium dari data pengujian
dan hasil perhitungan program
4.2.3 Potensial Proteksi
Potensial proteksi anoda korban aluminium, seng dan magnesium terhadap katoda baja AISI 1020. Berikut ini merupakan hasil pengukuran yang telah dilakukan;
50 Tabel 4.12 Potensial proteksi terhadap pasangan katoda dan anoda
No Anoda korban Potensial proteksi pH
1 Aluminium -0.497 7.43
2 Seng -0.933 4.27
3 Magnesium -0.919 11.42
Jika dilihat dari data pada table 4.12 dapat diketahui bahwa potensial proteksi anoda aluminium lebih positif jika dibandingkan dengan anoda seng dan magnesium
4.3 Analisis Hasil Perhitungan
Hasil perhitungan dari program proteksi katodik system anoda korban yang telah dibuat dengan program Visual Basic 6.0 dibandingkan dengan data yang diperoleh dari hasil eksperimen. Perbandingan yang dilakukan meliputi angka-angka yang diperoleh program serta presentase selisihnya terhadap angka yang diperoleh dari data eksperimen.
4.3.1 Baja AISI 1020 tanpa proteksi
Baja yang berada pada lingkungan air laut (NaCl) akan mengalami korosi karena adanya ion Cl-. Ion Cl- akan memecah lapisan pasif pada baja. Saat bersentuhan dengan permukaan logam, ion Cl- akan melarutkan ion-ion logam dan memudahkan ion-ion tersebut masuk ke larutan.
Laju korosi baja AISI 1020 ternyata akan semakin meningkat seiring dengan meningkatnya nilai kecepatan air. Berikut ini merupakan grafik pengaruh kecepatan air terhadap perubahan laju korosi pada baja.
51 Gambar 4.11 Efek kecepatan air laut terhadap laju korosi pada baja [9]
Gambar grafik tersebut menunjukkan bahwa semakin tinggi kecepatan air laut maka semakin tinggi pula laju korosi pada baja. Hal ini sesuai dengan teori yang tercantum pada Bab 2. Landasan teori bahwa laju korosi logam dipengaruhi oleh aliran fluida.
4.3.2 Anoda Aluminium
Berat total anoda aluminium yang diperlukan untuk memproteksi baja AISI 1020 dalam kondisi air diam pada experiment adalah 0.0803 mg. Sementara kebutuhan berat anoda aluminium yang didapat dari hasil perhitungan adalah 0.021 mg, terdapat perbedaan nilai yang signifikan. Jadi perbedaan hasil perhitungan program terhadap hasil eksperiment adalah sebagai berikut
52 Tabel 4.13 Perbedan nilai kebutuhan berat anoda aluminium hasil experiment dan
hasil perhitungan program Kecepatan Air (m/s) Data Eksperiment (mg) Data Perhitungan Program (mg) Persentase Perbedaan 0.00 0.0803 0.021 73.8% 0.09 0.1018 0.031 69.5% 0.18 0.1184 0.030 74.6% 0.27 0.1255 0.030 76.1% 0.36 0.1375 0.030 78.1% 4.3.3 Anoda Seng
Tabel 4.14 Perbedan nilai kebutuhann berat anoda seng hasil experiment dan hasil perhitungan program Kecepatan Air (m/s) Data Eksperiment (mg) Data Perhitungan Program (mg) Persentase Perbedaan 0.00 0.1787 0.074 58.5% 0.09 0.1791 0.105 41.3% 0.18 0.2115 0.101 52.2% 0.27 0.2265 0.105 53.6% 0.36 0.2547 0.105 58.7% 4.3.4 Anoda Magnesium
Tabel 4.15 Perbedan nilai kebutuhan berat anoda magnesium hasil experiment dan hasil perhitungan program
Kecepatan Air (m/s) Data Eksperiment (mg) Data Perhitungan Program (mg) Persentase Perbedaan 0.00 3.7182 0.055 98.5% 0.09 4.3554 0.077 98.2% 0.18 4.8623 0.077 98.4% 0.27 4.4911 0.075 98.3% 0.36 4.8750 0.075 98.4%
53 Jika melihat nilai pengurangan berat yang terdapat pada anoda magnesium, jelas sekali bahwa pengurangan berat yang terjadi sangat besar jika dibandingkan dengan pengurangan berat yang terjadi pada anoda aluminium dan seng. Pada table deret elektrokimia berikut ini juga diterangkan bahwa pada table bagian atas merupakan logam yang lebih reaktif atau lebih mudah terkorosi.
Tabel 4.16 Deret Elektrokimia
Metal Volt
Commercially pure magnesium -1.75 Magnesium Alloy (6%Al, 3% An, 0.15% Mn) -1.6
Zinc -1.1 Aluminium Alloy (5% seng) -1.05
Commercially pure Aluminium -0.8 Mild steel (clean and shiny) -0.5 sd -0.8 Mild steel (rusted) -0.2 sd -0.5 Cast Iron (non graphitized) -0.5
Lead -0.5
Mild steel in concrete -0.2
Copper, brass, bronze -0.2
High silcon cast iron -0.2
Mill scale on steel -0.2
Carbon, graphite, coke +0.3
Magnesium berada pada table bagian paling atas serta memiliki nilai elektrode potensial paling negative jika dibandingkan dengan aluminium dan seng. Dengan demikian magnesium paling reaktif jika dibandingkan dengan aluminium dan seng. Hal inilah yang menyebabkan pengurangan berat anoda magnesium lebih besar jika dibandingkan dengan pengurangan berat anoda aluminium dan anoda seng. Oleh
54 karena itu sebaiknya anoda magnesium tidak digunakan untuk memproteksi baja pada lingkungan air laut.
Demikian halnya dengan seng, seng memiliki elektroda potensial yang lebih negative dari pada aluminium dan lebih positif jika dibandingkan dengan magnesium. Hal inilah yang menyebabkan pengurangan berat anoda seng lebih tinggi jika dibandingkan dengan aluminium dan lebih rendah jika dibandingkan dengan magnesium.
Jika membandingkan nilai pengurangan berat anoda yang didapat dari eksperimen dan nilai pengurangan berat anoda yang didapat dari perhitungan program, terlihat adanya perbedaan nilai kebutuhan berat anoda. Hal ini terjadi karena program tidak memperhitungkan kecepatan air laut, sementara data pada eksperimen menunjukkan bahwa kecepatan air laut sangat mempengaruhi kebutuhan berat anoda. Dimana semakin tinggi kecepatan air maka semakin tinggi pula kebutuhan berat anoda korban. Selain itu pada bab 2 landasan teori juga disebutkan bahwa laju korosi dipengaruhi oleh beberapa factor, dimana salah satunya adalah laju fluida.
Agar program ini dapat digunakan maka program harus memasukkan sebuah nilai konstanta pengali pada kebutuhan berat anoda agar perhitungan program sesuai dengan data yang didapat dari eksperimen atau menambahkan persamaan yang memperhitungkan pengaruh laju fluida terhadap laju korosi dan pengurangan berat anoda.
55
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Laju korosi baja AISI 1020 tanpa proteksi semakin meningkat seiring dengan meningkatnya kecepatan air.
2. Proteksi katodik dengan menggunakan anoda korban sangat effektif untuk melindungi baja dari serangan korosi.
3. Pengurangan massa anoda magnesium lebih tinggi jika dibandingkan dengan pengurangan massa anoda seng dan aluminium, oleh karenanya anoda magnesium tidak cocok digunakan pada lingkungan air laut.
4. Program dapat digunakan untuk mendisain proteksi katodik system anoda korban pada pipa baja, penyangga dermaga dan kapal baja.
5. Program dapat diaplikasi untuk mendisain proteksi katodik dengan menambahkan factor konstanta atau menambahkan persamaan yang dapat menberikan nilai pengaruh laju fluida terhadap laju korosi dan pengurangan berat anoda.
5.2 Saran
1. Untuk pengembangan penelitian lebih lanjut, program perlu dilengkapi dengan memperhitungkan kecepatan air laut.
2. Memperhitungkan persentase coating.
3. Melengkapi program dengan gambar model dari benda yang akan diproteksi, lengkap dengan letak anoda, jumlah anoda, jangkauan arus proteksi yang dikeluarkan.
56
DAFTAR ACUAN
1. News Corrosioncost.com, juni 2006
2. Robert A Adey dan John Bayham, “Design and Optimization of Cathodic Protection Systems Using Computer Simulation”, Paper no 00723 - Corrosion 2000.
3. Ernesto Santana dan Robert Adey, “Validation of Cathodic Protection Designs Using Computer Simulation”, The Journal of Corrosion Science and Engineering, Volume 19 Preprint 16, Februari 2006.
4. Ernesto Santana dan Robert Adey, “Predictive Modeling of Corrosion and Cathodic Protection Systems.
5. V.G. DeGiorgi, “Evaluation of Perfect Paint Assumptions in Modeling of Cathodic Protection Systems”. Elsevier, October 2001.
6. Denny A Jones, “Principles and Prevention of Corrosion”, Macmillan Publishing Company, New York, 1992.
7. Kenneth R Trethewey dan John Chamberlain, “Korosi Untuk Mahasiswa Sains dan Rekayasa”, PT. Gramedia Pustaka Utama, Jakarta, 1991.
8. William D Callister Jr, “Material Science and Engineering An Introduction”, John Wiley and Sons Inc, Canada 1991.
9. James H Bryson, “Corrosion of Carbon Steels”, Inland Steel Company, ASM International, 2002.
56 FLOWCHART PROGRAM
DESAIN PROTEKSI KATODIK SISTEM ANODA KORBAN
Kapal Baja Pipa Baja Penyangga Dermaga A B Perlakuan Lingkungan Input D,L,Y,µ, wa,la,dal,Ea A Jenis Anoda Lampiran 1
56 ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ − = ln 4 1 2 dal la la Rh
π
ρ
⎟
⎠
⎞
⎜
⎝
⎛
−
=
ln
8
1
2
dal
la
la
Rv
π
ρ
(
)
Rh Ec Ea lah= −(
)
Rv Ec Ea lav = − B selesai Perlakuan Lingkungan Input Bm,Lpp,D,Dp,Y,µ , wa,la,dal,Ea Jenis Anoda56
Dp
Cb
D
Bm
Lpp
A
=
×
×
×
×
+
6
.
25
×
35
56
.
1
1000
20
A
I
reg=
×
85
.
0
2700
8760
×
×
×
=
I
Y
W
tot reg ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ − = ln 4 1 2 dal la la Rhπ
ρ
⎟
⎠
⎞
⎜
⎝
⎛
−
=
ln
8
1
2
dal
la
la
Rv
π
ρ
(
)
Rh Ec Ea lah = −(
)
Rv Ec Ea lav= − selesai56
LISTING PROGRAM PROTEKSI KATODIK SISTEM ANODA KORBAN
Private Sub Command1_Click()
Form1.Caption = "Proteksi Katodik Pada Pipa Baja" Option1.Enabled = True Option2.Enabled = True Option1.Value = False Option2.Value = False Option6.Caption = "Al-Zn-Mercury" Option7.Caption = "Al-Zn-Indium" Image1.Visible = False Image2.Visible = True Image3.Visible = False Image4.Visible = False
Label1.Caption = "Persentase Coating (0% - 95%)" Label2.Caption = "%"
Label5.Caption = "Diameter pipa" Label7.Caption = "Panjang pipa"
Label9.Caption = "Faktor utilisasi (0 < x < 1)" Label10.Caption = "Potensial baja ke lingkungan" Label11.Caption = "volt" Label40.Caption = "" Command1.Enabled = False Command2.Enabled = False Command3.Enabled = False End Sub
Private Sub Command2_Click()
Form1.Caption = "Proteksi Katodik Pada Tiang Penyangga Dermaga" Option1.Enabled = True
Option2.Enabled = True Option1.Value = False Option2.Value = False
Label1.Caption = "Persentase Coating (0% - 95%)" Label2.Caption = "%" Option6.Caption = "Al-Zn-Mercury" Option7.Caption = "Al-Zn-Indium" Image1.Visible = False Image2.Visible = False Image3.Visible = True Image4.Visible = False
Label5.Caption = "Diameter tiang" Label7.Caption = "Panjang tiang"
Label9.Caption = "Faktor utilisasi (0 < x < 1)" Label10.Caption = "Potensial baja ke lingkungan" Label11.Caption = "volt" Label40.Caption = "" Command1.Enabled = False Command2.Enabled = False Command3.Enabled = False End Sub
Private Sub Command3_Click() Image1.Visible = False
Image2.Visible = False
56
Image3.Visible = False Image4.Visible = True
Form1.Caption = "Proteksi Katodik Pada Kapal Baja" Option1.Enabled = True Option2.Enabled = False Option1.Value = False Option2.Value = False Option6.Caption = "Al" Option7.Caption = "Zn"
Label1.Caption = "Potensial baja ke lingkungan" Label2.Caption = "volt"
Label5.Caption = "Panjang garis air" Label7.Caption = "Lebar terbesar garis air" Label9.Caption = "Draft"
Label10.Caption = "Diameter propeler" Label11.Caption = "meter" Label40.Caption = "meter" Command1.Enabled = False Command2.Enabled = False Command3.Enabled = False End Sub
Private Sub Command4_Click()
Dim A As Currency 'luas area proteksi Dim D As Currency 'Diameter pipa Dim L As Currency 'panjang pipa
Dim lp As Currency 'kebutuhan total arus proteksi Dim Cd As Currency 'rapat arus lingkungan Dim Ct As Currency 'kondisi coating
Dim Wtot As Currency 'Jumlah total kebutuhan berat anoda Dim n As Currency 'jumlah anoda yang dibutuhkan
Dim Wa As Currency 'berat satu buah anoda Dim Y As Currency 'umur desain proteksi Dim u As Currency 'faktor utilisasi Dim C As Currency 'laju konsumsi anoda
Dim s As Currency 'jarak pemasangan antar anoda Dim lpp As Currency 'Panjang garis air
Dim Bm As Currency 'Lebar terbesar garis air Dim Dr As Currency 'draft kapal
Dim Dp As Currency 'diameter propeler
Dim Ireg As Currency 'Kuat arus yang dibutuhkan
Dim lps As Currency 'kebutuhan arus proteksi tiap jarak anoda Dim la As Currency 'panjang anoda
Dim dal As Currency 'diameter anoda Dim Ea As Currency 'potensial anoda Dim rho As Currency 'potensial lingkungan Dim Ec As Currency 'potensial baja kelingkungan
Dim lah As Currency 'keluaran proteksi tiap anoda horizontal Dim lav As Currency 'keluaran proteksi tiap anoda vertikal Dim mj As Currency 'massa jenis aluminium
Text12.Enabled = False Text13.Enabled = False Text14.Enabled = False Text15.Enabled = False Text16.Enabled = False Text17.Enabled = False
56 Text18.Enabled = False Text19.Enabled = False Text20.Enabled = False Text21.Enabled = False
If Form1.Caption = "Proteksi Katodik Pada Kapal Baja" Then 'input data Ec = Text1.Text Y = Text2.Text lpp = Text3.Text Bm = Text4.Text Dr = Text5.Text Dp = Text6.Text Wa = Text7.Text la = Text8.Text 'dal = Text9.Text Ea = Text10.Text rho = Text11.Text Dim o As Currency If Text1.Text = "" Then
o = MsgBox(" Lengkapi input data ", vbInformation, "Data tidak lengkap") End If
A = (15.6 * lpp) * (((Bm * Dr * 0.85) / 35) ^ 0.5) + (6.25 * (Dp ^ 2)) lp = (20 * A) / 1000
If Option6.Value = True Then C = 2700
mj = 2.7 End If
If Option7.Value = True Then C = 780 mj = 7.14 End If dal = 2 * (((1000 * Wa) / (3.14 * la * mj)) ^ 0.5) Wtot = (lp * Y * 8760) / (C * 0.85) n = Wtot / Wa s = (2 * (lpp + Bm)) / n lps = lp / n
Rh = rho / (2 * 3.14 * la) * (2.303 * (Log(4 * la / dal)) - 1) Rv = rho / (2 * 3.14 * la) * (2.303 * (Log(8 * la / dal)) - 1) lah = Abs((Ea - Ec) / Rh)
lav = Abs((Ea - Ec) / Rv) Text9.Text = dal Text12.Text = A Text13.Text = lp Text14.Text = Wtot Text15.Text = n Text16.Text = s Text17.Text = lps Text18.Text = Rh Text19.Text = Rv Text20.Text = lah Text21.Text = lav GoTo akhir