TEORI
Sifat PVT Senyawa Murni
Suatu senyawa murni dapat digolongkan ke dalam fasa gas, fasa cair dan fase padat. Tidak ada rumus umum untuk menentukannya. Namun, dapat ditentukan dengan hubungan permukaan P-V-T,hal ini berlaku apabila terlihat seperti berikut
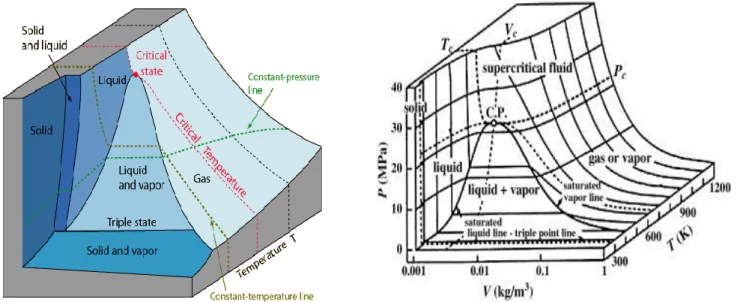
Gambar 1. Hubungan P-V-T untuk senyawa murni (tampak 3 Dimensi)
Gambar Ini menunjukkan:
1. Fase gas, fase cair dan fase padat;
2. Daeah fasa yang berdampingan seperti cair-uap, padat-uap dan padat-cair
Pada gambar diatas merupakan hubungan P-V-T untuk senywa murni. Pada gambar ini dapat menunjukkan karakteristik pada setiap fasa didalam nya. Titik koordinat pada permukaan P-V-T menggambarkan kondisi suatu tekanan, volume spesifik, dan suhu yang dapat diasumsikan ketika zat tersebut berada dalam kesetimbangan.
Untuk lebih detail nya menmbahasa fasa-fasa disalam nya, maka dalam lecture note ini, dibagi atas dua bagian besar yakni pada diagram PT terhadap (Tekanan dan temperatur) dan diagram PV (tekanan dan volume)
1. Diagram PT Untuk Senyawa Murni
Gambar A. Diagram PT Untuk Senyawa Murni
Berdasarkan diagram PT diatas menunjukkan titik-titik koordinat dimana tekanan dan suhu berada pada keadaan setimbang. Ada 3 daerah pada diagram PT yang ditunjukkan pada gambar diagram diatas.
Daerah fasa Padat ditunjukkan pada garis 1-2, daerah fasa Cair ditunjukkan pada garis 2-c sedangkan garis 2-3 menunjukkan hubungan fasa Padat/Cair. Kondisi ke 3 garis ini menunjukkan kondisi P dan T yang berdampingan ini adalah daerah fasa tunggal. Daerah fasa tunggal adalah daerah dari 2 fasa berbeda dimana keadaan 2 fasa tersebut setimbang, seperti hal nya berikut ini; fasa cair-uap , fasa padat-cair dan fasa padat-uap. Dalam 2 fasa yang berdampingan tersebut dapat terjadi perubahan fasa seperti ; penguapan (vaporation), melebur (melting) dan pengembunan (sublimation). Apabila tekanan dan suhu dalam 2 daerah fasa ini tidak independen maka salah satu fasa tidak dapat mengubah fasa lain nya. Daerah fasa ini tidak dapat/berlaku pada diagram tekanan dan volume (diagram PV) serta kondisi temperatur lain. 3 fasa yang berada pada garis kesetimbangan atau melewati titik kesetimbangan disebut “Triple line” atau “Triple point”
Daerah fasa padat-cair pada diagram ditunjukkan pada garis 2-3 merupakan kurva melting (melebur); daerah fasa padat-uap berada pada garis 1-2 merupakan kurva sublimation (mengembun) sedangkan daerah fasa cair-uap berada pada garis 2-C merupakan kurva vaporation (penguapan).
Ada terdapat daerah yang berada pada suhu dan tekanan yang lebih besar dari Tc (suhu kritis) dan Pc (tekanan kritis) yang ditandai dengan garis putus-putus pada gambar diatas, dimana tidak ada batasan pada fasa tersebut, tetapi dapat dibatasi dengan menyelaraskan daerah fasa cair (A) dan daerah fasa gas (B).
Daerah fasa yang melebihi tekanan kritis (Pc) dan suhu kristis (Tc) tersebut dapat dapat dianggap sebagai fasa gas apabila hasil kondensasi dari temperatur mengalami penurunan pada tekanan konstan. Sedang kan daerah tesebut dapat dianggap sebagai fasa cair apabila hasil penguapan dari tekanan mengalami penurunan pada suhu konstan. Apabila kedua proses itu tidak terjadi pada daerah putus-putus tersebut, maka daerah itu disebut daerah fluid atau daerah cair-gas. Arti nya fasa cair dan fasa gas tidak dapat dibedakan.
Daerah gas dapat dibagi atas 2 bagian yang ditunjukkan pada daerah vertikal putus-putus di diagram fasa diatas. Daerah fasa gas yang berada pada disebelah kiri dari garis vertikal adalah daerah dimana gas dapat dikondensasikan atau dikompresi pada tekanan konstan atau dilakukan pendinginan pada suhu konstan, daerah tersebut disebut daerah fasa vapor (uap) lewat panas, sedangkan daerah lainnya adalah daerah yang berada pada sebelah kanan garis tersebut yang melebihi suhu kritis (T>Tc) disebut daerah fluida superkritis artinya daerah yang fasa gas dan fasa cair pada daerah yang yang melebih suhu dan tekanan kritis tidak dapat dibedakan lagi.
2. Diagram PV Untuk Senyawa Murni
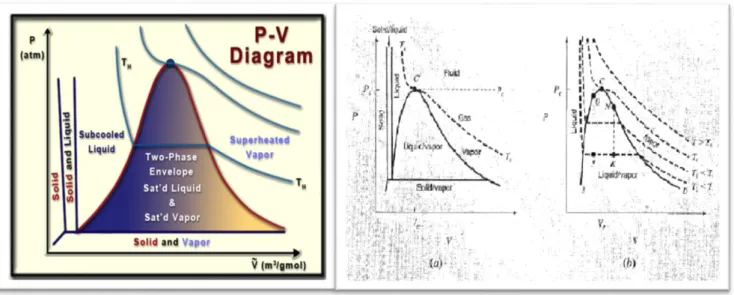
Gambar B. Diagram PV Untuk Senyawa Murni Dan Daerah Fasa Cair Dengan Isoterm
Pada gambar a, tidak menyediakan informasi tentang volume sedangkan pada diagram b ini menyediakan informasi volume. Pada diagram PV (gambar b) terdapat beberapa batasan-batasan area seperti area dengan 2 fase ; padat/cair , padat/uap ; dan cair/uap yang semuanya dalam keadaan setimbang. Pada diagram PT, jumlah fasa relatif menentukan molar (atau spesifik) volume, dimana titik kesetimbangan (triple point) nya berada pada garis lurus mendatar dengan 3 fasa yang berkaitan pada setiap suhu dan tekanan nya.
Pada digram PV (gambar b) menunjukkan cairan, cair/uap dan daerah uap dilapisi/dikaitkan dengan 4 isoterm. Isoterm pada gambar (a) adalah garis vertikal dan pada temperatur yang lebih tinggi daripada Tc (suhu kritis) tidak melewati batasan fasa, sedangkan pada gambar (b) isoterm ditandai dengan T>Tc hal ini dikarenakan agar lebih halus prosesnya.
Garis yang ditandai dengan T1 dan T2 adalah suhu subkritis dan terdiri dari 3
segmen. Setiap isotermis dari segmen horizontal menggambarkan seluruh kemungkinan campiran dari cair dan uap. Pada kesetimbangan, garis tersebut terletak mulai dari 100% cairan pada sisi kiri hingga 100 % uap pada sisi kanan akhir nya. Titik-titik antar akhir ini berbentuk kubah yang ditandai dengan BCD. Sisi setengah sebelah kiri (dari B ke C) merupakan fasa cairan (jenuh) pada suhun titik didih nya (boiling) dan sisi setengah sebelah kanan (dari C ke D) merupakan fasa uap (jenuh) pada suhu kondensasinya. Bagian horizontal dari isoterm terletak pada saturasi tertentu atau tekanan uap yang diberikan pada gambar (a) dimana isoterm melintasi kurva penguapan.
Daerah fasa cair/uap terletak dibawah kubah BCD yakni berada pada sisi dari kiri ke kanan pada masung-masing lainnya. Subcooled-cair berada pada tekanan rendah dan superheated-cair berada pada temperatur tinggi dari titik didih yang diberikan oleh tekanan, isoterm dalam daerah subcooled-cair sangat curam karena volume cair berubah sedikir dengan adalnya perubahan besar pada tekanan.
Daerah 2 fasa pada segmen horizontal isoterm menjadi semakin pendek pada temperatur yang lebih tinggi, yang pada akhir nya berkurang ke titik di C. Dengan demiikian isoterm kritis (critical isoterm) yang ditandai dengan Tc menunjukka perubahan di titik kritis C pada bagian atas kurva kubah. Pada titik ini lah fasa cair dan uap tidak bisa dibedakan satu sama lainnya karena kompoisis mereka sama.
Lembar Tugas Mahasiswa
I. Soal Pemicu: Kondisi 1;
Memperkirakan posisi titik pada diagram fasa untuk air mendidih di gunung Himalaya!
Jawab:
Kondisi diatas dapat diasumsikan bahwa untuk mendidihkan air di gunung himalaya memerlukan data faktor lingkungan disekitar nya. Asumsi nya adalah Keadaan diatas gunung himalaya memiliki Tekanan yang Rendah dan Suhu yang Rendah.
Suhu Rendah nya berada di range : ( Ttriple point > Tkondisi 1 < Tcritical point)
Tekanan Rendah nya berada di range : ( Pkondisi 1 < Ptriple point )
Sehingga terjadi adanya perubahan fase cair menjadi fase uap yang dapat dilihat dalam diagram fasa.
Berikut Letak Posisi kondisi 1 Didiagram Fasa
Kondisi 2;
Memperkirakan posisi titik pada diagram fasa untuk air mendidih di Ancol air Jakarta!
Jawab:
Kondisi diatas dapat diasumsikan bahwa untuk mendidihkan air di gunung himalaya memerlukan data faktor lingkungan disekitar nya. Asumsi nya adalah Keadaan Ancol area Jakarta memiliki Tekanan yang Normal dan Suhu yang Normal.
Suhu Normal nya berada di range : ( Ttriple point > Tkondisi 2 < Tcritical point)
Tekanan Normal nya berada di range : (Ptriple point > Pkondisi 2 < Pcritical point
Sehingga terjadi adanya perubahan fase cair menjadi fase uap yang dapat dilihat dalam diagram fasa.
Berikut Letak Posisi kondisi 2 Didiagram Fasa
Kondisi 3;
Memperkirakan posisi titik pada diagram fasa untuk es meleleh di Kutub utara! Jawab:
Kondisi diatas dapat diasumsikan bahwa untuk melelehkan es di kutub utara memerlukan data faktor lingkungan disekitar nya. Asumsi nya adalah Keadaan kutub utara memiliki Tekanan yang Tinggi dan Suhu yang Rendah.
Suhu Rendah nya berada di range : ( Tkondisi 3 < Ttriple point)
Tekanan Tinggi nya berada di range : (Ptriple point > Pkondisi 3 < Pcritical point )
Sehingga terjadi perubahan fase dari fase padat menjadi fase cair yang dapat dilihat dalam diagram fasa.
Berikut Letak Posisi kondisi 3 Didiagram Fasa
Kondisi 4;
Memperkirakan posisi titik pada diagram fasa untuk es meleleh dibawah tekanan sepatu ski (ice melting under the blade of a skater shoe)!
Jawab:
Kondisi diatas dapat diasumsikan bahwa untuk melelehkan es dibawah tekanan sepatu ski memerlukan data faktor lingkungan disekitar nya. Asumsi Keadaan yang dimiliki adalah Tekanan yang Tinggi dan Suhu yang Rendah.
Suhu Rendah nya berada di range : ( Tkondisi 4 < Ttriple point)
Tekanan Tinggi nya berada di range : (Ptriple point > Pkondisi 4 < Pcritical point ).
Sehingga terjadi adanya perubahan fase dari fase padat menjadi fase cair yang dapat dilihat dalam diagram fasa.
Berikut Letak Posisi kondisi 4 Didiagram Fasa 1. Diagram PT
Kondisi 5;
Memperkirakan posisi titik pada diagram fasa untuk supercritical water used to destroy waste!
Jawab:
Kondisi diatas dapat diasumsikan bahwa untuk membersihkan kotoran-kotoran dengan air superkritis, Asumsi keadaan yang dimiliki adalah Tekanan yang Tinggi dan Suhu yang Tinggi.
Suhu Normal nya berada di range : ( Tkondisi 5 > Tcritical point)
Tekanan Normal nya berada di range : (Pkondisi 5 > Pcritical point )
Kesimpulannya, fase supercritical water yang digunakan untuk membersihkan kotoran adalah fase cair-gas (fluida). Hal ini terjadi karena adanya perubahan fase cair menjadi fase fluida yang dapat dilihat dalam diagram fasa.
Berikut Letak Posisi kondisi 5 Didiagram Fasa 1. Diagram PT
Kondisi 6;
Memperkirakan posisi titik pada diagram fasa untuk air dan uap air pada titik didih yang sama!
Jawab:
Kondisi diatas dapat diasumsikan bahwa untuk fasa uap (water vapor) dan air (water) mempunya suhu dan tekanan yang sama untuk mencapai titik didih normal nya yakni didaerah kurva penguapan,
Asumsi keadaan Suhu nya berada di range : ( Tkondisi 6 > Ttriple point)
Tekanan nya berada di range : (Pkondisi 6 > Ptriple point )
Kesimpulannya, fase water vapor dan water mempunyai keadaan yang sama pada tekanan titik didih normal nya apabila ada berada pada pada vaporation curve.
Berikut Letak Posisi kondisi 6 Didiagram Fasa 1. Diagram PT
Kondisi 7;
Memperkirakan posisi titik pada diagram fasa untuk air dan uap air pada density yang sama!
Jawab:
Kondisi diatas dapat diasumsikan bahwa untuk fasa uap (water vapor) dan cair (water) mempunya suhu dan tekanan yang sama untuk mencapai density nya, Asumsi keadaan yang dimiliki adalah Tekanan sama dan Suhu sama.
Suhu nya berada di range : ( Tkondisi 7 = Tcritical point)
Tekanan nya berada di range : (Pkondisi 7 Pcritical point )
Kesimpulannya, fase water vapor dan water mempunyai keadaan yang sama pada tekanan titik didih normal nya apabila ada perbedaan tekanan yang diberikan.
Berikut Letak Posisi kondisi 6 Didiagram Fasa 1. Diagram PT
II. Mengapa Es Mengapung Di Laut Antartika? Jawab :
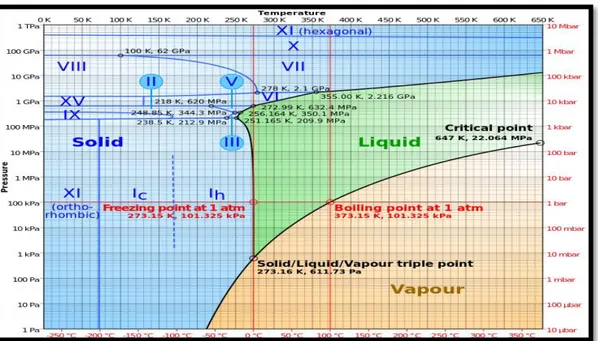
Berdasarkan diagram fasa air yang ditunjukkan pada gambar dibawah ini ;
(sumber diagram: http://en.wikipedia.org/wiki/Phase_diagram)
Es merupakan perubahan fase dari fase cair menjadi fase padat, Proses es terjadi karena faktor lingkungan dimana di laut antartika memiliki tekanan yang tingi dengan suhu yang sangat rendah hal ini terlihat pada diagram . Perubahan ini terjadi pada freezing point (titik beku) air di diagram fasa dimana air membeku pada tekanan 100kPa dan suhu 0oC. Lalu mengapa es dapat mengapung?
Es mengapung karena pada saat air sudah berada pada freezing point, maka pada saat itu masa jenis es (density) menjadi lebih rendah dibandingkan masa jenis air murni (semula), sehingga es mengapung dilaut antartika karena massa jenis nya lebih ringan dibanding masssa jenis air.
Air (H2O) berbeda dari senyawa-senyawa lainnya. Air memiliki densitas yang lebih
rendah pada fasa solid dibandingkan pada fasa cair. Saat membeku, volume air berekspansi (bertambah). Massa air tetap sementara volumenya bertambah sehingga densitas air pada fasa solid (sebagai es) akan lebih kecil jika dibandingkan air fasa cair. Akibatnya saat mulai membeku, es akan mengapung sementara air akan berada di bawah es. Es adalah air yang membeku. Pembekuan ini terjadi bila air didinginkan di bawah 0 °C (273.15 K, 32 °F) pada tekanan atmosfer standar. Es dapat terbentuk pada suhu yang lebih tinggi dengan tekanan yang lebih tinggi juga, dan air akan tetap sebagai cairan atau gas sampai -30 °C pada tekanan yang lebih rendah. Saat senyawa lain berubah dari cairan menjadi padatan, molekul-molekulnya akan menjadi lebih padat sehingga densitas padatannya akan lebih besar daripada cairannya. Air memiliki densitas paling tinggi pada suhu 4oC dan densitasnya akan menurun pada suhu yang lebih rendah dan lebih tinggi. Gambar 13 menunjukkan hubungan densitas dan temperatur dari air.
Kenaikan tekanan menyebabkan fase es menjadi lebih padat. Hal ini disebabkan terbentuknya ikatan yang lebih rapat pada molekul-molekulnya. Demikian pula pada fasa cair, densitas air meningkat dengan kenaikan tekanan.
Akibat sifat tersebut, banyak kolam atau danau pada musim dingin cenderung untuk terpisah membentuk dua lapisan (es di bagian atas dan air di bagian bawah). Masih terdapatnya air pada danau tersebut karena tekanan dan suhu yang dibutuhkan untuk membekukan seluruh air menjadi es belum tercapai. Terbentuknya es pada permukaan danau menyebabkan suhu air di bagian bawah es meningkat karena adanya es di permukaan danau menghambat perpindahan kalor dari air ke lingkungan sehingga air di bagian bawah es tidak ikut membeku. Akibatnya, tidak seluruh kolam atau danau membeku menjadi es saat musim dingin.
(Gambar 1. Hubungan Densitas Dan Temperatur Air)
III. Mengapa air tidak dapat digenggam? Jawab :
Jika kita masukkan zat cair ke dalam suatu wadah,akan kita dapati bentuk zat cair tadi mengikuti wadah yang ditempatinya.Hal ini menunjukkan bahwa bentuk zat cair tidaklah tetap atau selalu berubah-ubah mengikuti wadah yang ditempatinya.Walaupun demikian,volume zat cair sifatnya selalu tetap tidak bergantung pada wadah.
Jika zat cair ditempatkan dalam wadah yang terbuka,maka bagian yang terbuka dari zat cair tersebut dinamakan permukaan zat cair.Permukaan zat cair umumnya selalu mendatar,walaupun bentuk wadahnya berbeda.Karena zat cair memiliki volume yang tetap, maka zat cair tidak dapat dimampatkan dalam wadah yang lebih kecil.
Berikut experiment yang membuktikan bahwa air itu tidak dapat dimamfatkan.:
(Gambar b. Water is incompressible at piston example)
IV. Variabel Intensive dan Ekstensive? Jawab :
Berdasarkan jumlah dan ukurannya, materi dapat juga dibedakan atas sifat ekstensif dan sifat
intensif. Sifat ekstensif adalah sifat yang bergantung pada jumlah zat, misalnya massa dan volume. Sifat intensif adalah sifat yang tidak bergantung pada jumlah zat, misalnya titik leleh, titik beku,
massa jenis, dan kalor jenis.
V. Proses Isobar/Isokorik?Isoterm? Jawab:
a. Proses Isokoris
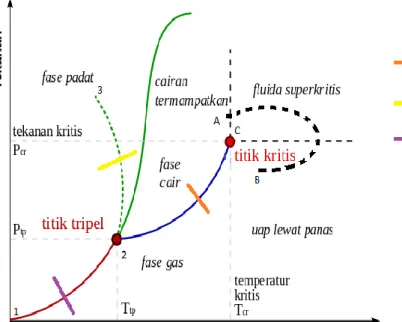
Diagram P-T untuk zat murni secara umum dapat dilihat dalam gambar berikut ini. Diagram ini sering juga disebut dengan diagram fasa zat karena menunjukkan ketiga jenis fasa zat yang dipisahkan oleh garis.
Pada gambar disamping, terlihat dua lokasi untuk garis melting line yang dibedakan dengan jenis garis. Garis putus-putus melting line merupakan garis melting line untuk zat yang memuai saat beku, sementara untuk zat yang menyusut saat beku garis melting line nya berupa garis biasa.
Dari gambar diatas terlihat bahwa kondisi liquid (cair) hanya dapat terjadi pada tekanan diatas tekanan triple point.
b. Proses Isobar
(Gambar 2. Diagram Fasa Proses Isobar)
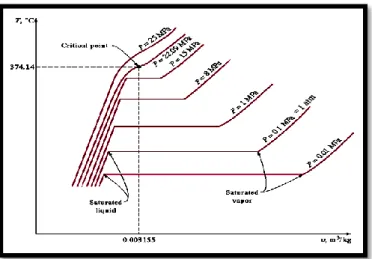
Diagram T-v pada proses perubahan fasa air. Terlihat, pada tekanan dibawah 1 atm, ruas mixture lebih panjang, sementara pada tekanan diatasnya, ruas tersebut semakin pendek dan akhirnya berbentuk satu titik saja yang disebut ctitical point
Bila tekanan sistem tersebut kita naikkan lagi , maka ruas campuran akan terus memendek hingga akhirnya pada tekanan tertentu, ruas campuran ini hanya akan berbentuk titik saja. Titik ini disebut dengan titik kritis ( critical point). Definisi yang tepat untuk menggambarkan titik kritis ini adalah suatu titik dimana keadaan dari saturated liquid dan saturated vapor adalah sama .
c. Proses Isoterm
(Gambar 3. Diagram Fasa Proses Isobar)
Proses ini digambarkan pada garis T1 = constan pada gambar berikut
Jika proses yang sama diulangi untuk suhu yang lebih tinggi, maka garis yang sama akan diperoleh dengan garis T1=costant, namun ruas pada campuran saturated liquid – vapor akan menjadi lebih pendek (lihat garis T2 = constant di atas).
Bila suhu dinaikkan lagi, dan proses yang sama diulang, akan tercapai suatu kondisi dimana ruas campuran saturated liquid – vapor hanya berbentuk titik yang kita kenal dengan nama titik kritis.
VI. Tentukan titik, garis dan permukaan derajat kebebsana pada diagram PVT air menggunakan aturan fasa Gibbs?
Jawab :
Aturan fasa Gibbs
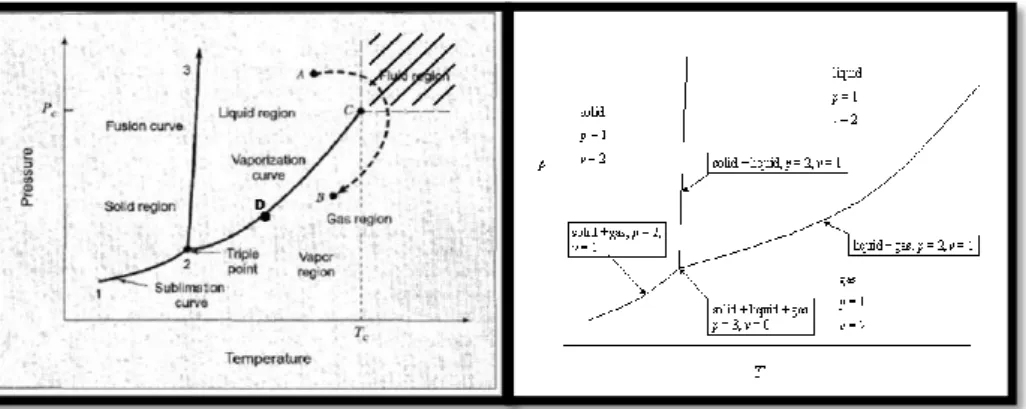
Saat dua fasa mengalami kesetimbangan keadaan dari sistem tetap (fix) tida berubah dan hanya adasatu kondisi. Contohnya adalah sistem dengan kesetimbangan antara uap air dengan air padatekanan 101,33 kPa hanya akan terjadi pada suhu 100oC, tidak pada suhu lain. Saat tekanan diubah,otomatis suhu kesetimbangan sistem tersebut juga berubah.Untuk semua sistem yang berada dalam keadaan setimbang, jumlah variabel bebas yang harusdiketahui diberikan oleh aturan fasa Gibbs yang dirumuskan sebagai berikut.
F = 2 –π + N
Dengan F adalah derajat kebebasan yang menyatakan jumlah variabel bebas yang harus diketahui, π adalah jumlah fasa pada sistem kesetimbangan, dan N adalah jumlah senyawa kimia.Nilai minimum dari F (derajat kebebasan)adalah 0. Saat F =0 keadaan sistem sudah tertentu tekanandan suhuya. Contohnya ada pada titik tripel (triple point) pada air. Dimana pada titik ini terdapatuap air, air dan es secara bersamaan (π= 3), N = 1 karena senyawanya hanya ada air (H2O), maka F =0. Titik trple air hanya terjadi pada 0,01oC dan
0,0061 bar, perbahan salah satu atau dua variabeltersebut akan menyebaban salah satu fasa menghilang dari sistem.
(Gambar 1. Diagram PT Untuk Senyawa Murni)
Gambar 1 diatas menunjukan diagram PT (tekanan-suhu) sebuah komponen murni. Pada Gambar 3 jelas diperlihatkan titik tripel pada titik 2 dan hanya ada satu titik tripel. Dan jelas hanya terjadi padatekanan dan suhu tertentu saja.Keterangan dari Gambar 3 adalah sebagai berikut:
1. Garis 1-2 adalah kurva sublimasi (sublimation curve) yang membatasi fasa gas dan fasa padat.
2. Garis 2-3 adalah kurva fusi ( fusion curve) yang membatasi fasa padat dan fasa cair.
3. Garis 2-C adalah kurva penguapan (vaporization curve) yang membatasi fasa gas dan fasa cair.
Garis-garis diatas disebut garis jenuh (saturated curve) yitu suatu keadaan dimana saat tekanan atau suhunya berubah sedikit saja maka akan terjadi perubahan fasa. Titik-titik yang terdapat pada garistersebut adalah titik jenuh (saturated ) dimana terdapat dua fasa yang setimbang, sehingga untuk komponen murni menghasilkan nilai F = 1. Artinya hanya dengan 1 varibel (tekanan atau suhu) saja dapat diketahui varibel yang lainnya. Contohnya titik D saat kita mengetahui besar tekanannya kita dapat langsung mengetahui besar suhunya, begitu juga sebaliknya saat kita mengetahui besar suhunya kita dapat langsung mengetahui tekanannya dengan cara menarik garis lurus sejajar sumbu x atau sumbu y.
Daerah yang dibatasi garis-garis diatas disebut daerah satu fasa, sehingga untuk komponen murni daerah ini memiliki nilai F = 2. Yang artinya harus diketahui dua variabel untuk mengetahui sifat( properties) dari komponen yang bersangkutan.Garis yang membatasi fasa cair dan fasa gas tidak dapat secara kontinu digambar, karena pada suhudan tekannan tertentu kedua fasa ini tidak dapat dibedakan. Daerah yang diarsir (Gambar 1) adalah daerah fluid ( fluid region) atau kadang disebut supercritical fuild dimana antara fasa gas dan fasa cair sudah tidak dapat dibedakan. Daerah ini terletak diatas tekanan kritis dan diatas suhu kritis dari komponen murni. Titik koordinat antara tekanan kritis dan suhu kritis ini dinamakan titik kritis(critical point ) (titik C pada Gambar 1) yaitu titik dimana tekanan dan suhu tertinggi saat fasa gas dancair masih dapat dibedakan.
Kuva A-B adalah perubahan fasa dari cair ke gas yang tidak melewati tahap jenuh, ini dapat dilakukan dengan mengatur suhu dan tekanan.