47
Perkembangan Serat Batang Rosella (
Hibiscus sabdariffa var.Sabdariffa
)
dengan Perlakuan Naungan dan Volume Penyiraman yang Berbeda
Tri Astuti *, Sri Darmanti*
*Laboratorium Biologi Struktur dan Fungsi Tumbuhan Jurusan Biologi F. MIPA UNDIP
Abstract
The crop of rosella (Hibiscus sabdariffa var.Sabdariffa)known as medicienal crop and fiber producting crop. Last research was known as pulp. Growth of stem fiber are influenced by environmental factors. The aim of this research is to know the development of stem fiber is treated with different shading and volumes of water sprinkler. Factorial completely randomized design (RCD) was used in this research. The first factor was three levels of shading (I0: 0%, I1: 55%, I2:75%) while the second factor was three levels volumes of watering sprinkler (P1: 240 mL, P2: 480 mL, P3: 720 mL). The observed variable was total, diameter and long of rosella stem fiber cell. Collected data were analysed using Analysis of Variance (ANOVA) followed by Duncan’s Multiply Range Test (DMRT). The result of this research indicate that there are influence interaction shading and volum water sprinkler to rosella stem fiber development. Shading treatment at all volums of water sprinkler have an effect on to improve the length and diameter cell fiber, without shading treatment with volum of water sprinkler at soil field capacity of improve the amount of fiber cell.
Keywords : Hibiscus sabdariffa, growth of stem fiber, shading, volume of water sprinkler.
Abstrak
Tanaman rosella (Hibiscus sabdariffa var. Sabdariffa ) dikenal sebagai tanaman obat dan penghasil serat. Penemuan terbaru, serat rosella juga berpotensi sebagai bahan baku industri kertas (pulp). Perkembangan serat batang rosella sangat dipengaruhi oleh faktor lingkungan. Penelitian ini bertujuan untuk mengetahui perkembangan serat batang rosella yang diperlakukan dengan naungan dan volume penyiraman air yang berbeda. Penelitian menggunakan Rancangan Acak Lengkap (RAL) pola faktorial. Faktor pertama adalah naungan (I0 : 0%, I2 : 55% dan I3 : 75%) dan faktor kedua adalah volume penyiraman (P0 : 270 mL, P2 : 480 mL dan P3 : 720 mL). Variabel yang diamati adalah jumlah sel, diameter sel dan panjang sel serat batang rosella. Data yang diperoleh dianalisis dengan Analysis of Variance (ANOVA) dilanjutkan dengan uji Duncan. Hasil dari penelitian ini menunjukkan bahwa terdapat interaksi pengaruh naungan dan penyiraman terhadap perkembangan serat rosela. Perlakuan naungan pada semua volume penyiraman berpengaruh meningkatkan diameter dan panjang sel serat, sedang perlakuan tanpa naungan dengan penyiraman pada kapasitas lapang berpangaruh meningkatkan jumlah sel serat. Kata kunci : Perkembangan serat, Hibiscus sabdariffa, intensitas cahaya, penyiram
PENDAHULUAN
Rosella saat ini menjadi tanaman yang diminati oleh masyarakat karena berbagai produk yang dapat dihasilkan dari bunga dan seratnya sehingga mengalami peningkatan
budidaya yang cukup tinggi. Varietas yang umum dibudidayakan ada 2 jenis yaitu rosella berkelopak bunga kuning (Hibiscus sabdariffa var. Altisima) yang biasa dimanfaatkan serat batangnya sebagai bahan membuat tali dan
48
karung goni (Anonim, 2008) dan rosella berkelopak bunga merah (H. sabdariffa var. Sabdariffa) yang biasa dimanfaatkan sebagai tanaman obat meskipun varietas ini juga mepunyai potensi untuk diambil seratnya .
Tanaman rosella merupakan tanaman semusim, sehingga setelah selesai masa pembungaannya tanaman akan mati dan sebagian besar masyarakat sudah tidak dapat memanfaatkannya lagi. Pemanfaatan batang tanaman rosella merah yang juga memiliki potensi serat dapat menambah nilai ekonomi tanaman rosella.
Pertumbuhan dan perkembangan tanaman rosella merupakan peristiwa yang sangat kompleks, yang dipengaruhi oleh faktor internal dan faktor lingkungan. Faktor internal yang mempengaruhi antara lain factor hormonal dan genetik sedangkan factor lingkungan meliputi cahaya, air, temperatur, kelembaban, ion organik dan gravitasi. Faktor cahaya berperan dalam pertumbuhan lewat berbagai proses , baik karena intensitasnya, kualitasnya serta lamanya penyinaran. Menurut Gardner (1991), cahaya berpengaruh dalam pertumbuhan dan perkembangan tanaman melalui perannya dalam menurunkan kadar auksin sehingga mengurangi tinggi tanaman. Pengaruh intensitas cahaya terhadap pertumbuhan berhubungan juga dengan tingkat fotosintesis sebagai sumber energi (Retnaningrum, 2001). Pemberian naungan pada tanaman berpengaruh mengurangi intensitas cahaya yang sampai ke tanaman.
Penyediaan air bagi pertumbuhan tanaman berpengaruh langsung terhadap sintesis hormon, proses metabolisme serta morfologi tanaman. Pada penyediaan air yang rendah sintesis auksin, giberelin dan sitokinin menjadi terhambat dan sintesis absisi bertambah (Gardner, 1991). Defisit air akan mempengaruhi pertumbuhan vegetatif tanaman. Proses ini pada sel tanaman ditentukan oleh tekanan turgor. Selain itu ketersediaan air juga mempengaruhi perluasan sel-sel pada jaringan penyusun organ vegetatif (Santoso, 1990).
Sel serat merupakan sel meristematik yang telah mengalami diferensiasi. Pertumbuhan dan perkembangan serat merupakan hasil dari proses pertambahan jumlah dan ukuran sel. Pertambahan jumlah sel suatu organisme terjadi karena proses pembelahan sedangkan proses penambahan ukuran sel terjadi karena proses pembentangan sel. Proses pembelahan sel menentukan dasar untuk pertumbuhan yang merupakan serangkaian proses yang diatur secara biokimia. Serangkaian proses ini mencakup pembentukan karbohidrat pada proses fotosintesis, pengisapan dan gerakan air dan zat hara pada proses absorbsi dan translokasi, serta penyusunan dan perombakan protein kompleks dan lemak-lemak dari fragmen karbon dan persenyawaan organik pada proses metabolisme tanaman (Salisbury, 1995). Jaringan ini harus dilengkapi dengan cadangan makanan yang cukup, hormon dan vitamin untuk dapat membelah. Sel-sel baru hasil pembelahan memerlukan karbohidrat dalam jumlah yang
49
besar, karena dinding-dindingnya terbuat dari selulosa dan protoplasmanya terbuat dari gula (Fosket, 1994).
Berdasarkan hal diatas maka penting untuk dikaji perkembangan serat batang rosella yang dipengaruhi oleh kombinasi naungan dan volume penyiraman yang berbeda.
METODOLOGI
Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) pola faktorial dengan 2 faktor yaitu faktor pertama adalah naungan (I0=
intensitas tanpa naungan, I1= naungan paranet
55% dan I2= naungan paranet 75%) dan faktor
kedua adalah volume penyiraman (P1= 240 mL,
P2= 480 mL dan P3= 720 mL). Masing-masing
perlakuan dengan 5 ulangan. Penentuan volume air perlakuan dilakukan berdasarkan kapasitas lapang tanah yang akan digunakan untuk menanam. Perlakuan diberikan selama 95 hari setelah tanaman berumur 3 minggu. Setelah dipanen, dibuat preparat penampang lintang dan penampang bujur batang dengan metode tanpa embedding dan preparat maserasi (Handari, 1983). Pengukuran dimensi serat menggunakan mikroskop Olympus BH-2 dengan pembesaran 40 X, 100 X dan 400 X.. Dalam pengukuran dimensi serat yaitu panjang serat dan diameter serat dipilih serat yang utuh atau tidak patah, rusak, terlipat, pecah, terpotong dan kerusakan lainnya (Husein, 2004). Variabel yang diukur adalah: jumlah sel serat sklerenkim batang tiap berkas, diameter serat batang dan panjang serat batang. Variabel pendukung yang diukur adalah
intensitas cahaya, dilakukan setiap hari pada waku yang sama.
Data yang diperoleh dianalisis dengan uji ANOVA (analysis of varian) dan hasil dilanjutkan uji Duncan dengan taraf kepercayaan 95% (Hanafiah, 2001).
HASIL DAN PEMBAHASAN
Pengaruh intensitas cahaya dan penyiraman air yang berbeda terhadap perkembangan serat batang rosella dapat diketahui dari 3 variabel yang diamati yaitu jumlah sel, diameter sel dan panjang sel serat batang rosella.
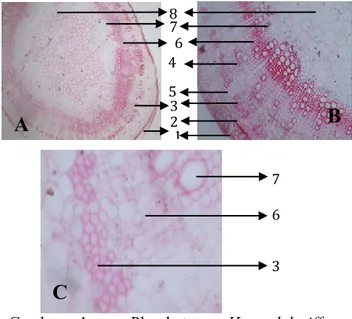
Preparat penampang lintang dan penampang bujur batang tanaman rosella diamati menggunakan fotomikrograf, diperoleh Gambar 1 dan Gambar 2 sebagai berikut:
Gambar 1. : Pl. batang H. sabdariffa, A.Perbesaran 40 X, B. Perbesaran 100 X, C. Perbesaran 400 X. Keterangan: 1. Epidermis, 2. Parenkim, 3. Sel Sklerenkim, 4. Kambium, 5. Daerah dilatasi, 6. Floem, 7. Xilem, 8. Empulur.
2 6
1
3 5 4 7A
B
C
8 7 6 350
Gambar 2: Penampang bujur serat batang H.sabdariffa, A. Perbesaran 100 X, B.Perbesaran 400 X. Keterangan : 1. Sel Sklerenkim, 2. Ujung sel sklerenkim hasil pembelahan
Hasil analisis data jumlah sel serat tiap berkas tersaji pada Tabel 1, diameter sel serat pada Tabel 2 dan panjang sel serat pada Tabel 3.
Tabel 1. Jumlah sel serat sklerenkim tiap berkas yang dipengaruhi oleh naungan dan volume penyiraman yang berbeda.
Intensitas cahaya Penyiraman Rata-rata P1 P2 P3 I0 13.5c 16.14a 17.4a 15.68a I1 14.06bc 17.22a 15.7ab 15.66a I2 9.78d 8.92d 9.26d 9.32b 12.45b 14.09a 14.12a
Tabel 1 menunjukkan berdasarkan hasil uji Anova diketahui bahwa perlakuan naungan, volume penyiraman dan interaksi kedua faktor tersebut memberikan pengaruh yang berbeda nyata terhadap jumlah sel serat sklerenkim batang rosella. Hasil uji lanjut Duncan dengan tingkat signifikansi 95% (Tabel 1) menunjukkan bahwa perlakuan tanpa naungan menghasilkan jumlah sel serat sklerenkim yang sama dengan perlakuan naungan paranet 55% tetapi lebih banyak dibandingkan perlakuan naungan paranet
75%. Perlakuan volume penyiraman 480 mL dan 720 mL menghasilkan jumlah sel serat sklerenkim yang sama dan lebih banyak dibandingkan volume penyiraman 240 mL. Interaksi kedua faktor menunjukkan tanaman pada volume penyiraman 480 mL dan 720 mL menghasilkan jumlah sel serat terbanyak baik pada perlakuan tanpa naungan ataupun naungan paranet 55%.
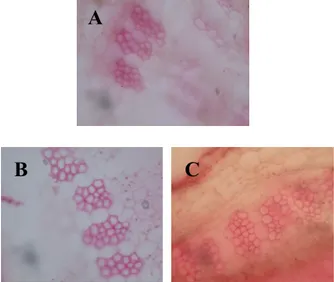
Hasil pengamatan jumlah sel pada perlakuan naungan yang berbeda dapat dilihat pada gambar berikut ini:
Gambar 3. Penampang lintang batang rosella pada perbesaran 400 X dengan perlakuan A. tanpa naungan, B. naungan paranet 55%, C. naungan paranet 75%
Jumlah sel terbanyak pada penelitian ini dihasilkan oleh tanaman dengan perlakuan tanpa naungan dan pada naungan 55% (Tabel 1, Gambar 3). Pengaruh cahaya terhadap pembelahan sel melalui mekanisme penyediaan cadangan makanan untuk proses pembelahan. Intensitas cahaya yang tinggi pada tempat tanpa
1
2
A
B
A
B
51
naungan akan meningkatkan proses fotosintesis tanaman sehingga karbohidrat yang dihasilkan untuk proses pembelahan sel juga meningkat. Hal ini sesuai pendapat Fosket (1994), yaitu laju pembelahan sel tergantung pada persediaan karbohidrat yang cukup. Pembelahan sel terjadi pada jaringan-jaringan meristematik pada titik tumbuh batang dan akar dan pada kambium. Jaringan ini harus dilengkapi dengan cadangan makanan yang cukup, hormon dan vitamin untuk dapat membelah. Hormon yang berperan penting dalam pembelahan sel adalah auksin dan sitokonin. Sitokinin menyebabkan perbanyakan sel pada suatu jaringan tumbuhan yang diisi atau disuplai oleh tingkat auksin yang optimal. Kedua hormon ini saling bekerja sama dalam proses mitosis pada pembelahan sel, auksin meregulasi kegiatan sel yang berhubungan dengan replikasi DNA ketika sitokinin meregulasi permulaan mitosis.
Hasil pengamatan perbedaan jumlah sel pada perlakuan penyiraman yang berbeda dapat dilihat pada gambar berikut ini:
Gambar 4. Penampang lintang batang rosella pada perbesaran 400 X dengan perbedaan volume penyiraman: A. 240 mL, B. 480 mL, C. 720 mL
Tanaman pada perlakuan volume penyiraman 240 mL menghasilkan jumlah sel serat sklerenkim yang lebih sedikit dibandingkan pada volume 480 mL dan 720 mL (Tabel 1, Gambar 4). Hal ini dikarenakan volume penyiraman 240 mL kurang dari kapasitas lapang media, sehingga tanaman mengalami kekurangan air. Kekurangan air pada tanaman menurut Gardner (1991) akan menyebabkan proses-proses metabolisme tersebut terganggu sehingga mengakibatkan proses pembelahan sel-sel tumbuhan menjadi terhambat. Ketersediaan air bagi tumbuhan mempunyai peranan yang sangat penting dalam pembentukan protein dan lemak tumbuhan, baik sebagai pelarut zat-zat yang digunakan dalam proses metabolisme maupun berperan sebagai pengangkut hasil metabolisme untuk digunakan tumbuhan itu sendiri dalam proses perkembangan sel. Selain itu Salisbury (1995) juga menyatakan bahwa serangkaian proses pembelahan mencakup pembentukan karbohidrat pada proses fotosintesis, pengisapan dan gerakan air dan zat hara pada proses absorbsi dan translokasi, serta penyusunan dan perombakan protein kompleks dan lemak-lemak dari fragmen karbon dan persenyawaan organik pada proses metabolisme tanaman. Sehingga tanaman yang kekurangan air pembelahan selnya lebih terhambat dibandingkan tanaman dengan penyiraman yang sesuai dengan kapasitas lapang media tanam
A
52
yang dalam penelitian ini yaitu volume 480 mL dan volume 720 mL.
Interaksi kedua faktor menunjukkan tanaman pada perlakuan volume penyiraman 480 mL dan 720 mL menghasilkan jumlah sel serat terbanyak baik pada perlakuan tanpa naungan ataupun naungan paranet 55% (Tabel 1). Hal ini menunjukkan bahwa pada kombinasi volume penyiraman 480 mL dan 720 mL dengan intensitas cahaya tanpa naungan dan naungan paranet 55% sel tanaman akan lebih banyak membelah. Hal ini disebabkan adanya cadangan makanan untuk proses pembelahan yang lebih banyak dari perlakuan intensitas cahaya yang tinggi juga dengan penyediaan air yang memenuhi kapasitas media lapang dibandingkan perlakuan naungan paranet 75% dan volume penyiraman 240 mL.
Tabel 2 Diameter sel serat sklerenkim (µm) yang dipengaruhi oleh naungan dan volume penyiraman yang berbeda.
Intensitas Cahaya Penyiraman Rata-rata P1 P2 P3 I0 36.13e 35.98e 46.02cd 39.38c I1 57.74a 53.27ab 56.09a 54.7a I2 41.61de 48.46bc 46.17cd 45.42b 45.16b 45.9b 49.42a
Tabel 2. menunjukkan berdasarkan hasil uji Anova diketahui bahwa perlakuan naungan, volume penyiraman dan interaksi kedua faktor tersebut memberikan pengaruh yang berbeda nyata terhadap diameter sel serat sklerenkim batang rosella. Hasil uji Duncan dengan tingkat signifikansi 95% menunjukkan bahwa perlakuan
naungan paranet 55% menghasilkan ukuran diameter sel serat sklerenkim paling besar diikuti perlakuan naungan paranet 75% sedangkan perlakuan tanpa naungan menghasilkan diameter sel serat sklerenkim terkecil. Perlakuan volume penyiraman 720 mL menghasilkan ukuran diameter sel serat sklerenkim paling besar sedangkan volume penyiraman 480 mL dan 240 mL menghasilkan diameter sel serat sklerenkim yang sama. Interaksi kedua faktor menunjukkan bahwa tanaman pada perlakuan naungan paranet 55% pada volume penyiraman yang berbeda menghasilkan diameter sel terbesar.
Tanaman pada naungan 55% menghasilkan diameter terbesar dibandingkan perlakuan tanpa naungan dan naungan paranet 75% (Tabel 2, Gambar 3). Hal ini disebabkan intensitas cahaya yang tinggi pada tempat tanpa naungan akan mengakibatkan perusakan auksin tanaman yang berperan dalam proses perluasan sel. Hal ini sesuai dengan pendapat Gardner (1991) yang menyatakan bahwa cahaya berperan dalam menurunkan kadar auksin, sehingga dapat mengurangi tinggi tanaman. Peran auksin dalam perluasan sel melalui mekanisme peningkatan auksin dalam sel, sehingga menyebabkan tekanan osmotik sel meningkat. Peningkatan tekanan osmotik akan menyebabkan sel mengalami peningkatan pengambilan air, sehingga volume vakuola bertambah. Sedangkan sel terdiri dari larutan osmotik yang dikelilingi oleh membran semipermeabel yang elastis, sehingga memungkinkan perluasan sel.
53
Membran sel ditutup oleh dinding sel yang plastis dan akan menghalangi perluasan sel. Larutan di dalam sel lebih pekat daripada di luar sel yang lebih encer, sehingga air akan masuk ke dalam sel melalui proses osmosis. Pengambilan air secara osmosis akan meningkatkan volume sel sedangkan dinding sel tidak elastis lagi. Hal ini akan menghambat perluasan sel dari hasil osmosis. Tahap awal pemanjangan sel dengan merusak hubungan ikatan-ikatan polisakarida melalui penyusunan kembali polimer dinding. Hal ini mengurangi tekanan dinding dan turgor sel, sehingga memungkinkan pengambilan air bertambah. Ketika sel telah mengambil air maka tekanan hidrostastik dari tekanan osmotik mulai mendesak dinding sel. Tekanan ini akan diimbangi dengan tekanan turgor pada dinding sel. Dinding sel secara elastis dipertahankan oleh kekuatan turgor sampai turgor cukup untuk mengurangi gradien potensial air sampai nol. Setelah proses pemanjangan, dinding dijaga lebih lanjut keutuhannya oleh ikatan-ikatan yang berhubungan dengan polimer dinding (Davies, 1988; Fosket, 1994).
Tanaman pada volume penyiraman 720 mL menghasilkan diameter sel terbesar dibandingkan volume 240 mL dan 480 mL (Tabel 2, Gambar 4). Hal ini disebabkan penyediaan air yang berlebih akan menyebabkan kondisi di dalam tanaman menjadi lebih pekat, sehingga terjadi perbedaan gradien potensial air. Hal ini akan menyebabkan sel mengalami peningkatan pengambilan air sehingga volume vakuola bertambah dan terjadi perluasan sel.
Interaksi kedua faktor menunjukkan bahwa tanaman pada perlakuan naungan paranet 55% pada volume penyiraman yang berbeda menghasilkan diameter sel terbesar (Tabel 2). Hal ini disebabkan oleh kadar auksin yang lebih besar pada perlakuan naungan 55% dibandingkan perlakuan lainnya. Sehingga perluasan sel lebih banyak terjadi, meskipun seharusnya volume penyiraman 720 mL pada naungan paranet 55% menghasilkan diameter sel yang lebih besar karena ketersediaan air yang memenuhi.
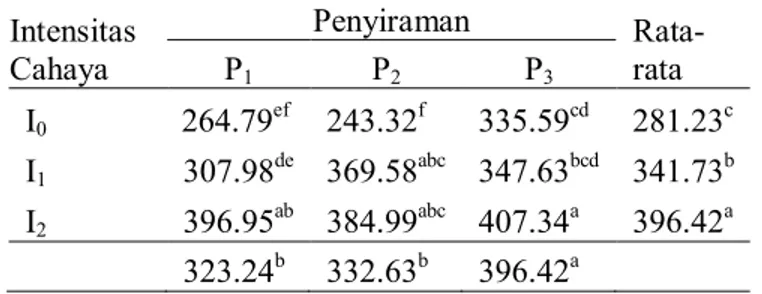
Tabel 3 Panjang sel serat sklerenkim (µm) yang dipengaruhi oleh naungan dan volume penyiraman yang berbeda.
Intensitas Cahaya Penyiraman Rata-rata P1 P2 P3 I0 264.79ef 243.32f 335.59cd 281.23c I1 307.98de 369.58abc 347.63bcd 341.73b I2 396.95ab 384.99abc 407.34a 396.42a 323.24b 332.63b 396.42a
Tabel 3 menunjukkan berdasarkan hasil uji Anova diketahui bahwa perlakuan naungan, volume penyiraman dan interaksi kedua faktor tersebut memberikan pengaruh yang berbeda nyata terhadap panjang sel serat sklerenkim batang rosella. Hasil uji Duncan dengan tingkat signifikansi 95% menunjukkan bahwa perlakuan naungan paranet 55% menghasilkan ukuran panjang sel serat sklerenkim paling panjang diikuti perlakuan naungan paranet 75% sedangkan perlakuan tanpa naungan menghasilkan panjang sel serat sklerenkim terpendek. Perlakuan volume penyiraman 720
54
mL menghasilkan ukuran panjang sel serat sklerenkim paling panjang sedangkan volume penyiraman 480 mL dan 240 mL menghasilkan panjang sel serat sklerenkim yang sama. Interaksi kedua faktor menunjukkan bahwa panjang sel terpanjang dihasilkan oleh tanaman dengan kombinasi perlakuan naungan paranet 55% dan volume penyiraman 720 mL.
Perbedaan intensitas cahaya memberikan pengaruh yang berbeda nyata terhadap ukuran sel-sel serat sklerenkim pada pertumbuhan batang rosella, baik terhadap ukuran diameter sel maupun panjang sel. Tanaman pada naungan paranet 75% menghasilkan sel serat sklerenkim terpanjang diantara perlakuan yang lain (Tabel 3). Panjang sel serat sklerenkim bertambah seiring dengan intensitas cahaya yang semakin rendah pada naungan paranet 75%. Hal ini disebabkan oleh meningkatnya jumlah auksin pada tanaman yang terletak pada intensitas cahaya rendah. Perusakan auksin karena cahaya lebih sedikit pada tanaman yang ternaungi paranet 75%. Auksin menyebabkan perluasan dan peningkatan plastisitas dinding sel akibat mengendurnya matriks polisakarida. Auksin berikatan dengan plasmalesma terutama dengan lesitin, yang menyebabkan peningkatan respirasi dan pengambilan kalium. Dinding sel menjadi lebih liat dengan cara penimbunan polisakarida tambahan di dalam matriks yang longgar. Hormon lain seperti Giberelin juga diketahui sebagai penyebab pemanjangan pada beberapa jaringan pada kondisi tertentu (Gardner, 1991; Krishnamoorthy, 1983).
Tanaman pada perlakuan volume penyiraman 720 mL memberikan hasil panjang sel serat sklerenkim terpanjang (Tabel 3). Ketersediaan air mempunyai peranan penting dalam proses pertumbuhan sel. Proses pemanjangan membutuhkan pemberian air yang banyak, adanya hormon tertentu yang memungkinkan dinding-dinding sel merentang dan adanya gula. Daerah pembesaran sel tepat berada di belakang titik tumbuh. Ketika sel-sel pada daerah ini mulai membesar, vakuola-vakuola yang besar terbentuk, vakuola-vakuola ini secara aktif menyerap air dalam jumlah besar. Akibat dari absorbsi air dan adanya hormon auksin yang memacu perentangan sel, sel akan memanjang. Tanaman yang terpenuhi air akan membantu proses metabolisme sel dan berakibat pada proses pembentangan sel. Kelebihan air bagi pertumbuhan tanaman akan menyebabkan sel-sel menjadi terbentang secara optimal karena tekanan turgor sel meningkat disebabkan sel tumbuhan terisi penuh oleh air. Sebagai tambahan dari pertambahan ukuran sel, dinding-dindingya bertambah tebal karena menumpuknya selulosa tambahan yang berasal dari gula (Gardner, 1991; Wilkinson, 1994).
Interaksi kedua faktor menunjukkan bahwa panjang sel terpanjang dihasilkan oleh tanaman dengan kombinasi perlakuan naungan 75% dan volume penyiraman 720 mL (Tabel 3). Hal ini disebabkan adanya kombinasi faktor pemanjangan sel antara peran auksin yang lebih tinggi pada perlakuan naungan 75% dan potensial air yang lebih tinggi pada perlakuan
55
volume penyiraman 720 mL sehingga menghasilkan sel yang lebih panjang dibandingkan kombinasi perlakuan lainnya.
KESIMPULAN
Dari hasil penelitian ini dapat disimpulkan bahwa terdapat interaksi pengaruh naungan dan penyiraman terhadap perkembangan serat batang rosela. Perlakuan naungan pada semua volume penyiraman berpengaruh meningkatkan diameter dan panjang sel serat rossela, sedang perlakuan tanpa naungan dengan penyiraman pada kapasitas lapang berpangaruh meningkatkan jumlah sel serat rosella.
DAFTAR PUSTAKA
Anonim. 2008. Rosella Dulu dan Kini. http://ditjenbun.deptan.go.id/semusimbun/ semusim/index.php?option=com_content& task=view&id=112&Itemid=37. 22 September 2008
Davies, P. J. 1988. Plant Hormones. Mikley Publishing. London
Fosket, D.E. 1994. Plant Growth and Development: A Molecular Approach. Academic Press. California.
Gardner, F.P & Pearce, R.B. 1991. Fisiologi Tanaman Budidaya. Alih Bahasa: Herawati Susilo. UI Press. Jakarta.
Handari, S.S.1983. Metode Pewarnaan. Bharatara Karya Aksara. ITB. Bandung. Hanafiah, K.A 2001. Rancangan Percobaan
Teori dan Aplikasi. PT Raja Grafindo Persada. Jakarta.
Hidayat, E. 1995. Anatomi Tumbuhan Berbiji. ITB. Bandung.
Husein, N. 2004. Anatomi Kayu Palele (Castanovis javanica). Jurnal Ilmu & teknologi Kayu Tropis Vol.2 No.2. 20 Oktober 2008.
Krishnamoorthy. 1983. Plant Growth Substances Including Application in Agriculture. Tata Mc Graw Hill Publshing. New Delhi.
Retnaningrum. 2001. Pembungaan dan
Faktor-faktor yang Mempengaruhi.
http://jakarta.litbang.deptan.go.id/klinikagr ibisnis/index.php?option=content&task=vi ew&id=27&Itemid=67. 10 Desember 2007.
Salisbury, F.B & Ross, C.W. 1995. Fisiologi Tumbuhan, edisi ke-4. Alih Bahasa: Diah R Lukman. ITB. Bandung.
Santoso. 1990. Metabolisme Pertumbuhan Pada Tumbuhan Tingkat Tinggi. Proyek Pelatihan Jangka Pendek Dalam Negeri. Yogyakarta.
Wilkinson, R.E. 1994. Plant Environment Interactions. Markel Dekker Inc. Georgia.