ABSTRAK
Salah satu faktor pembatas dalam melakukan transplantasi adalah bahwa tipe sel spermatogonia yang memiliki kemampuan terkolonisasi tidak terkarakterisasi dengan baik. Penelitian ini bertujuan untuk 1) melakukan karakterisasi tipe sel spermatogonia dari jaringan testis ikan gurami dan 2) menentukan sumber donor ikan gurami. Untuk keperluan karakterisasi, dilakukan kajian histologis testis dari 3 ekor ikan gurami (bobot 700-900 g/ekor) dengan karakter morfologi yang diamati adalah diameter sel dan inti, volume sel dan inti, volume sitoplasma dan jumlah sel dalam satu sista. Penentuan sumber donor dilakukan dengan kajian histologis testis ikan gurami dari bobot tubuh <500 g, 500–1000 g dan >1000 g, masing-masing 3 ekor. Parameter yang diamati adalah kelimpahan sel spermatogonia yang diformulasikan sebagai frekuensi relatif sel spermatogonia. Hasil yang diperoleh menunjukkan bahwa karakter diameter sel, volume sel, dan volume sitoplasma dapat dijadikan karakter pembeda tipe sel spermatogonia ikan gurami. Tipe spermatogonia yang memiliki peluang terkolonisasi adalah sel yang berdiameter 14,43–20,53µm. Bobot ikan gurami yang terbaik dijadikan sebagai sumber donor adalah yang berada pada kisaran 500 g hingga 1000 g per ekor.
Kata kunci : karakterisasi, morfologi, sel spermatogonia, ikan gurami, donor
*) Bab ini sebagian telah dipublikasi dengan judul : Morphological characteristic of spermatogonia and testis dissociation: a preliminary study for the germ cell transplantation in giant gourami (Osphronemus goramy), pada Indonesian Aquaculture Journal 5(2):163-171.
II. THE MORPHOLOGICAL CHARACTERIZATION OF
GIANT GOURAMI SPERMATOGONIA AND THE
DETERMINATION OF DONOR
ABSTRACT
One of the major limitation to the transplant procedure is that the type of spermatogenic that are able to colonize is not well characterized. The aim of this research were 1) to identify type and characteristic of spermatogonia in testis of giant gourami, and 2) to detemine the donor for the application of germ cell transplantation in giant gourami. All research were based on histological approach. We defined histomorphological characteristic of four types of spermatogonia from three giant gourami (weight 700–900 g) including diameter and volume of cell and nuclear, volume of cytoplasm and the amount of spermatogonia per cyst. Meanwhile, to determine donor based on the abundant of spermatogonia in each testis formulated as relative frequency, the testis were isolated from three different body weight group, those were <500 g, 500–1000 g and >1000 g (n=3,each). The result showed that diameter of cell, volume of cell and volume of cytoplasm could be used for characterization of type of spermatogonia. The type of spermatogonia with cell diameter ranged between 14.43 to 20.53 µm were identified having high probability of colonization. The best source of donor was testis of giant gourami weighed ranged from 500 g to 1000 g
Key words : characterization, morphology, spermatogonia, giant gourami, donor
PENDAHULUAN
Spermatogonia merupakan sel germinal yang merupakan cikal bakal terbentuknya spermatozoa yang selanjutnya setelah proses fertilisasi akan berkembang menjadi satu organisme baru yang membawa material genetik dari gamet asalnya. Selama proses spermatogenesis berlangsung, spermatogonia akan mengalami tahapan perkembangan selanjutnya menjadi spermatosit, spermatid dan spermatozoa dalam satu sista (Vilela et al. 2003). Perkembangan sel germinal yang sama dalam satu sista ini yang membedakan tahapan perkembangan sel germinal ikan dengan tahapan perkembangan sel germinal pada vertebrata lainnya.
Seperti vertebrata pada umumnya spermatogenesis pada ikan melalui tiga tahap perkembangan sel yaitu 1) tahap proliferasi sel atau tahap mitosis (tahap
spermatogonia), 2) tahap meiosis (tahap spermatosit) dan 3) tahap diferensiasi sel (tahap spermiogenik) (Hess & Franca 2007). Tahap spermatogonia merupakan tahapan perkembangan sel yang paling diminati untuk diteliti karena sel spermatogonia mengawali proses spermatogenesis dan peningkatan jumlah sel germinal bergantung pada proliferasi aktif spermatogonia (deRooij & Russel 2000).
Spermatogonia memiliki beberapa keistimewaan karena terdapat sekolompok sel yang memiliki karakteristik menyerupai PGC (primordial germ cell) atau sel punca dengan tingkat development plasticity yang tinggi yakni spermatogonia yang dapat berkembang tidak hanya menjadi sel spermatozoa tetapi juga dapat berkembang menjadi oosit (Okutsu et al. 2006a). Sifat-sifat spermatogonia tersebut menjadikan lebih banyak peneliti yang menggunakan sel spermatogonia sebagai sel donor dibandingkan PGC yang jumlahnya sangat terbatas dalam satu individu.
Secara umum spermatogonia terbagi menjadi dua tipe, yaitu spermatogonia yang tidak terdiferensiasi (spermatogonia A) dan spermatogonia yang terdiferensiasi (spermatogonia B). Spermatogonia yang tidak terdiferensiasi ini memiliki sifat seperti sel punca dan pada aplikasi teknologi transplantasi, hanya spermatogonia yang memiliki karakteristik menyerupai sel punca saja yang mampu terkolonisasi pada gonad resipien (Okutsu et al. 2006a, Yano et al. 2008). Beberapa peneliti cenderung membagi spermatogonia atas beberapa tipe, yaitu diawali dengan sel punca spermatogonia (primary spermatogonia), spermatogonia A, spermatogonia transisi (intermediate spermatogonia) dan spermatogonia B yang dibedakan berdasarkan karakter morfologisnya, yaitu diameter sel, morfologi inti dan jumlah sel dalam satu sista (Miura 1999, Schulz et al. 2005, Fishelson et al. 2006, Almeida et al. 2008, Zapata 2009). Selama ini karakterisasi terhadap spermatogonia dapat menjadi faktor pembatas dalam tahapan transplantasi.
Identifikasi spermatogonia dengan tepat akan membantu perolehan suspensi sel donor yang kaya akan spermatogonia. Pada hewan mamalia seperti tikus, terdapat dua pendekatan yang dilakukan oleh para peneliti untuk mendapatkan suspensi sel yang kaya dengan spermatogonia, yaitu pendekatan biokimia seperti
penggunaan penanda spesifik untuk sel spermatogonia dan pendekatan biologi dengan memanfaatkan sifat-sifat biologi reproduksi hewan tersebut, seperti penggunaan hewan mutan yang pada testisnya hanya ada kelompok sel spermatogonia (Grisswold et al. 2001).
Pada ikan, penggunaan penanda sel spesifik untuk isolasi spermatogonia dalam kegiatan transplantasi telah dilakukan pada ikan rainbow trout oleh Yano et al. (2008). Pendekatan lain adalah berdasarkan sifat biofisik sel. Salah satu metode yang umum digunakan adalah pemisahan sel spermatogonia dari sel testikular lainnya dengan metode percoll gradient densitas seperti yang dilakukan pada ikan nila (Lacerda et al. 2008). Dengan metode tersebut suspensi sel testikular yang kaya akan spermatogonia dapat diperoleh.
Baik pendekatan penanda sel spesifik maupun dengan pendekatan sifat biofisik sel membutuhkan aplikasi teknik yang tidak sederhana sehingga pada penelitian ini upaya untuk mendapatkan suspensi sel testikular yang kaya akan spermatogonia ditempuh melalui pendekatan lain, yaitu dengan cara mencari tahap perkembangan gonad ikan gurami berdasarkan bobot tubuh yang memiliki kelimpahan spermatogonia yang maksimum. Pendekatan ini juga dilakukan oleh Takeuchi et al. (2009) dalam kegiatan transplantasi sel testikular pada ikan nibe dengan mencari tahap perkembangan ikan nibe berdasarkan ukuran panjang ikan donor yang memiliki spermatogonia terbanyak. Semakin besar persentase sel spermatogonia khususnya sel punca spermatogonia dan spermatogonia A dalam suspensi sel testikular yang ditransplantasikan, maka semakin besar peluang sel spermatogonia terkolonisasi pada resipien. Oleh karena itu pada penelitian ini dilakukan kajian histologis jaringan testis berdasarkan bobot tubuh untuk mendapatkan gambaran karakteristik sel-sel testikular ikan gurami khususnya spermatogonia. Informasi karakteristik sel-sel testikular tersebut selanjutnya menjadi acuan dalam mengevaluasi kelimpahan sel spermatogonia jaringan testis yang diisolasi dari beberapa kelompok bobot tubuh ikan gurami. Evaluasi ini dilakukan untuk mendapatkan sumber donor bagi kegiatan transplantasi sel testikular ikan gurami ke larva ikan nila sebagai resipien.
BAHAN DAN METODE Karakterisasi Morfologi Sel Spermatogonia
Gonad ikan jantan (testis) dari 3 ekor ikan gurami dengan bobot tubuh sekitar 700–900 g/ekor diisolasi dan difiksasi dalam larutan Bouin selama 24 jam untuk selanjutnya diproses secara histologis menurut metode Kiernan (1990) hingga diperoleh preparat potongan melintang dan berseri dengan ketebalan potongan 5 µm. Preparat diwarnai dengan pewarnaan Hematoksilin-Eosin dan diamati di bawah mikroskop. Identifikasi morfologi sel-sel testikular merujuk pada Takashima & Hibiya (1995). Parameter yang diamati adalah diameter sel dan inti sel, volume sel dan inti sel, volume sitoplasma serta jumlah sel dalam satu sista. Pengamatan morfologi sel serta diameter sel dan inti sel dilakukan pada 30 sel/tipe sel yang dipilih secara acak dari tiga lapang pandang pada setiap potongan melintang testis. Untuk menghindari perhitungan berulang, pengamatan dilakukan pada setiap potongan dengan kelipatan 6 dari setiap preparat testis bagian tengah. Volume sitoplasma adalah selisih antara volume inti dan volume sel. Pengamatan jumlah sel per sista dilakukan pada enam sista utuh per tipe sel spermatogonia pada setiap testis.
Estimasi Kelimpahan Sel Spermatogonia pada Testis Ikan Gurami
Penelitian ini menggunakan sumber donor dari tiga kelompok bobot tubuh ikan gurami, yaitu 1) kelompok bobot tubuh <500 g/ekor, 2) kelompok bobot tubuh 500–1000 g/ekor, 3) kelompok bobot tubuh >1000 g/ekor. Sebanyak 3 pasang testis ikan gurami per kelompok bobot tubuh diisolasi dan difiksasi dalam larutan Bouin selama 24 jam serta diproses secara histologis menurut metode Kiernan (1990). Preparat histologis diwarnai dengan pewarnaan Hematoksilin-Eosin. Pengamatan preparat menggunakan mikroskop Olympus IX70 yang disambungkan dengan kamera dan program TUCSEN. Pengamatan dilakukan pada tiga lapang pandang per preparat yang dipilih secara acak merujuk pada metode Carrasco et al. (1998). Parameter yang diamati adalah kelimpahan sel punca spermatogonia atau spermatogonia stem cell (SSC), spermatogonia A (SpA), spermatogonia transisi (SpT), spermatogonia B (SpB) dan sel-sel germinal serta sel somatik lainnya yang diistilahkan sebagai sel selain spermatogonia (SL).
Data kelimpahan diformulasikan sebagai frekuensi relatif (FR), yaitu persentase rasio jumlah grid yang di dalamnya terdapat tipe sel yang diamati dan total grid (Carasso et al. 1998).
Analisis Data
Data kuantitatif karakteristik morfologi yang disajikan dalam bentuk nilai tengah diuji secara statistik menggunakan ANOVA (analysis of variance), dan dilanjutkan dengan uji Duncan multiple range test untuk menentukan beda nyata antar perlakuan. Analisis menggunakan program SPSS 17.0 for windows dan MS Office Excell 2007.
HASIL DAN PEMBAHASAN Karakteristik Morfologi Sel Spermatogonia Ikan Gurami
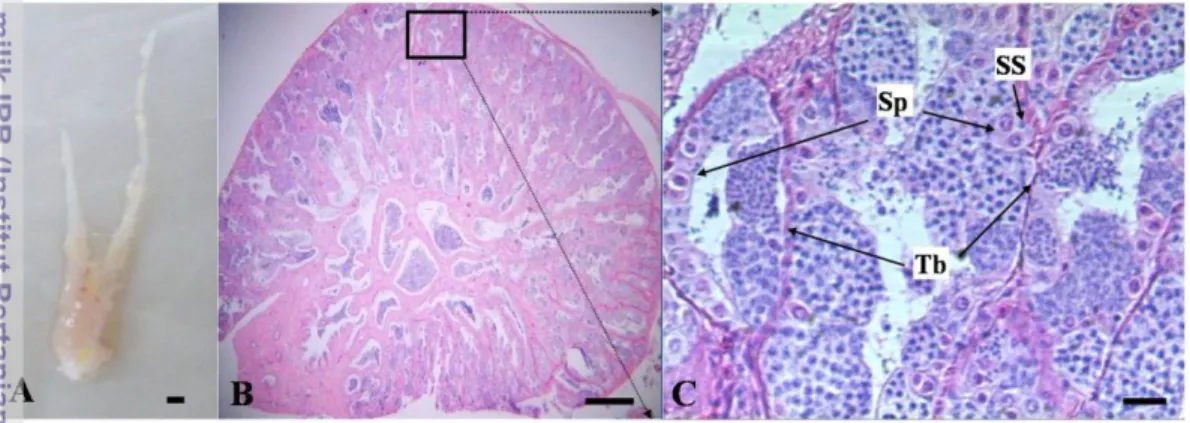
Testis ikan gurami terdiri atas sepasang organ yang tidak simetris (Gambar 1A). Hasil pengamatan preparat histologis jaringan testis ikan gurami (indeks gonad somatik/IGS= [11,78±2,93]x10-5) memperlihatkan bahwa terdapat tiga tahap spermatogenesis pada jaringan yang diamati, yaitu tahap spermatogonia, tahap spermatosit dan tahap spermiogenik. Testis ikan gurami memiliki tipe unrestricted spermatogonia yang berarti spermatogonia tersebar di sepanjang tubulus (Gambar 1B dan 1C). Spermatogonia berukuran lebih besar dibandingkan sel-sel testikular lainnya, dan umumnya terletak di bagian tepi serta dikelilingi oleh satu atau beberapa sel sertoli (Gambar 1C, ditunjukkan dengan tanda panah). Distribusi sel spermatogonia pada ikan gurami ini juga terlihat pada ikan rainbow trout, gilthead seabream, ikan nila dan beberapa ikan lainnya (Takashima & Hibiya 1995).
Determinasi tipe sel spermatogonia yang ada di jaringan testikular khususnya pada awal terjadinya spermatogenesis hingga saat ini masih belum jelas dan masih sering diperdebatkan (deRooij & Russel 2000). Beberapa peneliti menyatakan bahwa PGC pada mamalia ketika mencapai jaringan bakal gonad dan berasosiasi dengan sel-sel somatik akan berubah menjadi gonosit yang biasa disebut prespermatogonia. Gonosit pada mamalia dewasa ini mungkin sama dengan spermatogonia tak terdiferensiasi atau mungkin juga merupakan tipe sel
sebelum spermatogonia tak terdiferensiasi (deRooij & van Dissel-Emiliani 1997). Untuk karakterisasi morfologis tipe-tipe spermatogonia, umumnya para peneliti melakukannya berdasarkan diameter sel dan inti sel, morfologi inti sel dan jumlah sel dalam satu sista seperti pada ikan rainbow trout (Takashima & Hibiya 1995), catfish (Santos et al. 2001), ikan nila (Schulz et al. 2005, Nobrega et al. 2009), dan ikan zebra (Leal et al. 2009). Berdasarkan studi histomorfometrik jaringan testikular beberapa jenis ikan tersebut diketahui deskripsi morfologi beberapa tipe spermatogonia.
Gambar 1 Testis dan penampang melintang histologis testis ikan gurami. A. Sepasang organ testis tidak simetris (bobot tubuh= 740 g,
IGS=1,35x10-4), skala: 1 mm; B. Penampang melintang testis (insersi: kotak), skala: 200 µm; C. Insersi: spermatogonia (Sp) tersebar di daerah tepi tubulus (Tb) dengan sel sertoli (SS) di sekitarnya, skala: 20 µm. Pewarnaan: Hematoksilin-Eosin.
Pada ikan zebra, spermatogonia yang paling awal disebut oleh Leal et al. (2009) sebagai SpA tidak terdiferensiasi dengan ciri-ciri merupakan sel tunggal dengan diameter inti sel terbesar (ø = 8,6±0,1 µm) dan volume sel terbesar (V = 677 ± 34 µm3), sedikit heterokromatin pada intinya serta terdapat 1 atau 2 nukleoli pada intinya jika diamati di bawah mikroskop elektron. Pada ikan zebra SpA tidak terdiferensiasi ini ditandai dengan membran inti sel tidak beraturan yang diprediksi sebagai SSC. Takashima & Hibiya (1995) juga menggambarkan morfologi yang sama untuk SSC ikan rainbow trout. SpA tidak terdiferensiasi ini akan melakukan proses memperbaharui diri (self renewal) dan juga sebagai penghasil SpA terdiferensiasi dengan cara pembelahan secara mitosis.
Leal et al. (2009) menggambarkan SpA terdiferensiasi dengan ciri-ciri benang-benang kromatin pada inti sudah mulai memadat menyerupai flek-flek yang tidak beraturan pada bagian membran inti sel. Jumlah SpA dalam satu sista pada ikan zebra adalah 2, 4, atau 8 sel. Namun, pada ikan nila jika jumlah sel dalam sista sudah mencapai lebih dari dua sel dikategorikan sebagai SpB (Schulz et al. 2005). Hingga saat ini belum ada terminologi yang jelas mengenai spermatogonia tidak terdiferensiasi dan terdiferensiasi. Menurut deRooij & Russel (2000) istilah terdiferensiasi dan tidak terdiferensiasi erat kaitannya dengan perubahan fungsi sel sebagai sel punca. Meskipun demikian dinyatakan pula bahwa spermatogonia telah mengalami diferensiasi jika terjadi perubahan penampakan morfologis pada sitoplasma dan intinya.
Sel SpA akan berproliferasi menghasilkan SpB dengan ciri-ciri sudah terjadi kondensasi heterokromatin dan terdistribusi secara merata pada bagian tepi membran inti sehingga membran inti semakin terlihat jelas, berbentuk bulat dengan diameter menjadi lebih kecil dari diameter SpA. Umumnya para peneliti menyebut SpB sebagai spermatogonia terdiferensiasi. Menurut Chaves-Poso et al. (2005) selama proses spermatogenesis berlangsung diameter inti sel berkurang sekitar 1–2 µm.
Deskripsi tipe SpA tidak terdiferensiasi seperti yang digambarkan Leal et al. (2009) atau SSC seperti yang digambarkan Takashima & Hibiya (1995) ini juga ditemukan pada preparat histologis testis ikan gurami dan umumnya terdapat pada bagian tepi tubulus atau dekat tunika albuginea dengan ciri-ciri merupakan sel tunggal, diameter terbesar, membran inti sel sering tidak terlihat, inti berbentuk lonjong dan pucat karena belum terbentuk banyak kondensasi benang-benang kromatin. Pada penelitian ini jumlah nukleoli pada inti tidak dapat terlihat dengan jelas karena pengamatan hanya dilakukan menggunakan mikroskop cahaya. Dengan morfologi inti sel yang menyerupai dengan yang digambarkan oleh Takashima & Hibiya (1995), maka tipe sel ini diidentifikasi sebagai SSC ikan gurami.
Gambar 2 Tipe spermatogonia yang ditemukan pada preparat histologis ikan gurami. SSC: sel punca spermatogonia, SpA:spermatogonia tipe A, SpT: spermatogonia transisi, SpB: spermatogonia tipe B. Panah merah menunjukkan sel sertoli. Skala : 20 µm. Pewarnaan : Hematoksilin-Eosin.
Pada bagian tepi tubulus jaringan testikular ikan gurami (Gambar 2) juga ditemukan tipe spermatogonia dengan membran inti yang sudah mulai terlihat jelas bentuknya, tapi masih terlihat pucat karena belum banyak terjadi kondensasi benang-benang kromatin. Jumlah sel ini dalam satu sista mencapai 2–4 sel sehingga tipe sel ini diduga merupakan turunan dari SSC yang membelah menjadi SpA. Pada lokasi yang sama terdapat tipe sel yang memiliki ukuran diameter inti yang tidak berbeda nyata dengan SpA, namun secara morfologi intinya menyerupai SpB. Inti sel sudah terlihat lebih pekat karena kondensasi heterokromatin semakin banyak dan jumlah sel dalam satu sista juga lebih banyak (Gambar 2). Karena tipe sel ini memiliki sebagian kriteria SpA dan SpB, maka tipe sel tersebut dikategorikan sebagai SpT. Yang membedakan SpB dari tipe spermatogonia lainnya adalah diameter sel dan inti paling kecil, inti berwarna
lebih pekat dengan benang-benang kromatin di tepi sel yang menurut deRooij & Russel (2000) morfologi tersebut mengindikasikan kemungkinan telah terjadi proses diferensiasi yang ditandai dengan semakin banyaknya benang-benang heterokromatin pada inti sel.
Deskripsi morfologi tipe-tipe spermatogonia yang ada pada ikan gurami menunjukkan bahwa karakter diameter sel, volume sel dan volume sitoplasma berbeda nyata pada keempat tipe spermatogonia yang teridentifikasi (Tabel 1 dan Lampiran 1). Dengan demikian untuk kebutuhan identifikasi dapat digunakan ukuran diameter sel, volume sel dan volume sitoplasma sebagai karakter pembeda.
Tabel 1 Deskripsi morfologi tipe spermatogonia pada ikan gurami
Tipe Sel Diameter sel (µm) Diameter inti (µm) Volume sel (µm3) Volume inti (µm3) Volume sitoplasma (µm3) Jumlah sel/sista SSC 18,63±1,90a 8,79±1,15a 3.490±1.087a 374±136a 3.115±1.017a 1 SpA 15,96±1,53b 8,38±1,32b 2.186±617b 330±147b 1.854±524b 2-4 SpT 12,33±1,17c 8,33±1,06b 1.008±276c 317±122b 691±208c 6-22 SpB 8,88±1,41d 5,92±1,13c 394±207d 121±78c 273±141d 18-48
Keterangan: SSC: sel punca spermatogonia, SpA: Spermatogonia tipe A, SpT: spermatogonia transisi, SpB: spermatogonia tipe B.
Huruf superskrip yang berbeda setelah angka pada kolom yang sama menunjukkan beda nyata (P<0,05). Angka adalah rata-rata±SD, n=3.
Berdasarkan penelitian Yano et al. (2008), hanya spermatogonia tidak terdiferensiasi yang terkolonisasi pada resipien ikan rainbow trout. Spermatogonia ikan rainbow trout tidak terdiferensiasi ini dikategorikan sebagai SpA dengan ukuran diameter sel sekitar 15 µm. Spermatogonia terdiferensiasi atau SpB yang berukuran sekitar 10 µm tidak terkolonisasi. Namun demikian pada hewan mencit telah dibuktikan bahwa SpA terdiferensiasi (SpA1-4) juga
dapat terkolonisasi, meskipun dengan efisiensi kolonisasi yang rendah (Barocca et al. 2009).
Pada ikan nila dewasa, Schulz et al. (2005) melaporkan terdapat 7 tipe spermatogonia yang terdiri atas 1 tipe SpA dan 6 tipe SpB. Dilaporkan pula bahwa volume sel dan inti sel SpA pada ikan nila masing-masing 2.261±82 µm dan 548±20 µm, sedangkan volume sel dan inti sel SpB ikan nila masing-masing
berukuran 992±35 µm dan 251±9 µm atau ukuran diameter sel SpA dan SpB pada ikan nila masing-masing 16,28 µm dan 12,38 µm. Dengan demikian diameter sel SpA ikan nila dan ikan gurami ini tidak berbeda jauh dengan spermatogonia ikan gurami, meskipun secara taksonomi kedua ikan ini telah terpisah pada tingkat ordo. Berdasarkan hasil identifikasi tipe sel spermatogonia pada Tabel 1 dan beberapa rujukan diameter sel donor spermatogonia yang berhasil terkolonisasi pada beberapa jenis ikan air tawar (Okutsu et al. 2006b, Lacerda et al. 2010), diduga spermatogonia yang memiliki peluang terkolonisasi pada ikan gurami adalah yang dikategorikan sebagai SSC dan SpA dengan diameter sel masing-masing 18,63±1,90 µm dan 15,96±1,53 µm, atau dapat dikatakan bahwa sel spermatogonia yang memiliki peluang untuk terkolonisasi adalah sel yang berdiameter antara 14,43 hingga 20,53 µm.
Evaluasi Testis Ikan Gurami sebagai Sumber Donor pada Beberapa Tahap
Perkembangan Berdasarkan Bobot Tubuh
Berbeda dengan ikan air tawar pada umumnya, ikan gurami belum dapat diidentifikasi jenis kelaminnya berdasarkan ciri-ciri seks sekunder pada umur muda. Dari 10 ekor ikan gurami berbobot tubuh <500 g yang diduga jantan, hanya 3 ekor yang gonadnya teridentifikasi jantan setelah dilakukan pemeriksaan di bawah mikroskop dengan bobot tubuh rata-rata 301±88 g. Pada kelompok ikan dengan bobot tubuh 500–1000 g dan >1000 g, jenis kelamin jantan sudah dapat dikenali berdasarkan ciri-ciri sekundernya, yaitu memiliki benjolan atau nonong pada dahinya dan pangkal sirip dadanya yang putih bersih tanpa pigmen. Bobot tubuh rata-rata ikan gurami dari kelompok 500-1000 g adalah 733±104 g sedangkan dari kelompok > 1000 g bobot tubuh rata-rata ikan gurami yang digunakan adalah 1393±261 g. Pengelompokan berdasarkan bobot tubuh dilakukan karena hingga saat ini belum ada informasi yang jelas tentang tahap perkembangan gonad pada ikan gurami.
Berbagai macam cara dilakukan para peneliti untuk mendeskripsikan kepadatan atau kelimpahan sel. Beberapa peneliti menggunakan nilai frekuensi relatif (FR) untuk menggambarkan profil perkembangan sel germinal atau untuk menggambarkan kepadatan sel dalam satu satuan luas (Carrasco et al. 1998,
Bendsen et al. 2001, Segatelli et al. 2004). Pada penelitian ini digunakan grid 10x10 dengan luas grid 220x170 µm2.
Hasil kuantifikasi sel testikular preparat histologis testis ikan gurami pada berbagai bobot tubuh dapat dilihat pada Tabel 2 dan Lampiran 2. Frekuensi relatif rata-rata SSC pada testis dari kelompok ikan gurami <500 g tidak berbeda nyata (P>0,05) dengan testis dari kelompok ikan gurami 500–1000 g dan lebih tinggi dibandingkan dengan kelompok ikan gurami berbobot tubuh >1000 g. Nilai FR rata-rata SpA, SpT dan SpB tertinggi (P<0,05) terdapat pada testis dari kelompok ikan gurami berbobot tubuh 500–1000 g. Jenis sel selain spermatogonia tampak mendominasi pada semua kelompok dengan perbedaan tidak nyata (P>0,05).
Tabel 2 Frekuensi relatif rata-rata (%) spermatogonia dari jaringan testis ikan gurami pada berbagai bobot tubuh (g)
Tipe sel <500 g (IGS rata-rata=1,49x10-4) 500–1000 g (IGS rata-rata= 1,62x10-4) >1000 g (IGS rata-rata= 1,14x10-4) SSC 3,94 ± 1,18a 2,96 ± 1,20a 0,34 ± 0,50b SpA 14,71 ± 4,60b 23,23 ± 3,75a 7,13 ± 2,34c SpT 11,80 ± 2,90b 18,99 ± 4,76a 15,26 ± 3,97b SpB 6,98 ± 6,01b 17,17 ± 6,68a 15,22 ± 2,67a SL 49,03 ± 5,93a 41,39 ± 6,75a 46,20 ± 14,10a
Keterangan: SSC: sel punca spermatogonia, SpA: Spermatogonia tipe A, SpT: spermatogonia transisi, SpB: spermatogonia tipe B, SL: sel germinal derivat sel spermatogonia dan sel-sel somatik, BT: bobot tubuh, IGS: indeks gonada somatik.
Huruf superskrip yang berbeda setelah angka pada baris yang sama menunjukkan beda nyata (P<0,05). Angka adalah rata-rata±SD, n=3.
Menurut Zapata (2009), untuk menjadi sumber donor, syarat yang harus dimiliki adalah jumlah spermatogonia tidak terdiferensiasi melimpah dan jumlah relatif sel testikular lainnya khususnya yang mengalami tahap meiosis dan sel-sel somatik sedikit. Semakin banyak jumlah spermatogonia tidak terdiferensiasi maka peluang terkolonisasinya sel donor pada gonad resipien semakin besar (Meachem et al. 2001). Sel testikular lainnya terutama spermatozoa dan sel-sel somatis lain sebaiknya dalam jumlah sedikit karena kedua tipe sel ini menjadikan larutan disosiasi memiliki viskositas tinggi sehingga proses injeksi akan terganggu (Zapata 2009).
Berdasarkan studi karakteristik morfologi spermatogonia ikan gurami sebelumnya diketahui bahwa jenis sel yang memiliki peluang terkolonisasi adalah SSC dan SpA. Dengan demikian berdasarkan hasil perhitungan kelimpahan spermatogonia pada Tabel 2 maka ikan gurami yang terbaik dijadikan sebagai sumber donor adalah yang berasal dari kelompok dengan kisaran bobot tubuh 500–1000 g karena memiliki populasi SSC yang relatif besar, jumlah SpA tertinggi serta jumlah SL (sel derivat spermatogonia dan sel somatik) yang terendah dibandingkan testis ikan yang berasal dari kedua kelompok bobot tubuh ikan gurami lainnya.
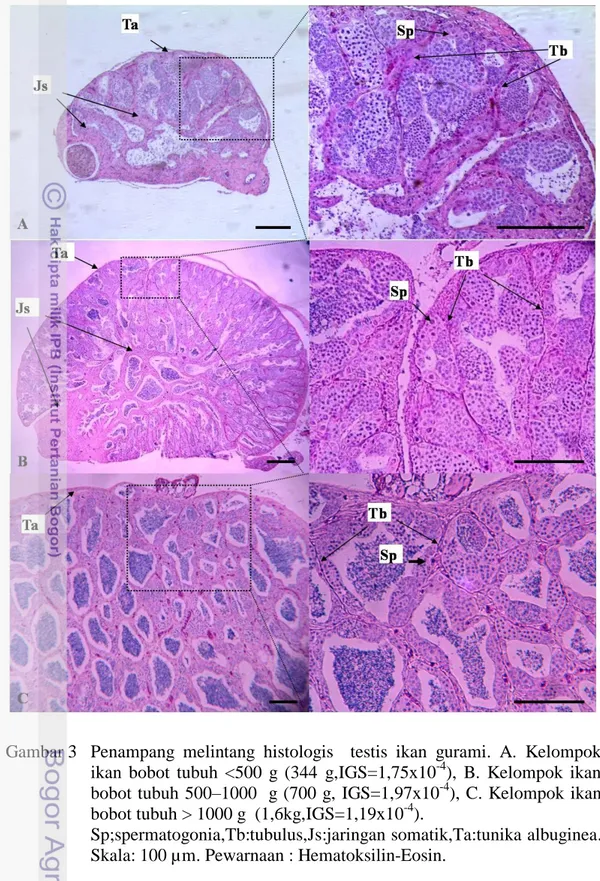
Kelayakan testis dari kelompok ikan berbobot tubuh 500–1000 g sebagai sumber donor juga tampak pada profil penampang melintang jaringan histologis testis (Gambar 3). Penampang melintang jaringan histologis testis pada Gambar 3 menggambarkan bahwa pada ikan dengan bobot <500 g, tubulus yang berisi sel-sel germinal hanya mengisi sebagian dari rongga gonad dan sebagian lagi terisi oleh jaringan-jaringan somatik sehingga besarnya nilai FR dari komponen SL pada ikan berbobot tubuh <500 g didominasi oleh sel-sel somatik. Beda halnya dengan kelompok ikan dengan bobot tubuh >1000 g yang hampir seluruh bagian testis tersusun atas tubulus yang berisi sel germinal sehingga tingginya jenis sel selain spermatogonia disebabkan oleh melimpahnya jumlah sel testikular tahap spermatosit dan spermiogenik.
Berdasarkan hasil evaluasi profil penampang melintang jaringan histologis testis, sumber sel donor terbaik dari penelitian ini adalah testis dari kelompok ikan gurami dengan bobot tubuh berada dalam kisaran 500 g hingga 1000 g dengan bobot rata-rata 733±104 g karena memiliki frekuensi relatif SSC dan SpA yang tinggi dan SL yang lebih rendah. Faktor lain yang perlu dipertimbangkan adalah bahwa ikan gurami dengan bobot tubuh >500 g lebih mudah diidentifikasi jenis kelaminnya melalui ciri-ciri sekundernya dibandingkan ikan gurami dengan bobot tubuh <500 g.
Gambar 3 Penampang melintang histologis testis ikan gurami. A. Kelompok ikan bobot tubuh <500 g (344 g,IGS=1,75x10-4), B. Kelompok ikan bobot tubuh 500–1000 g (700 g, IGS=1,97x10-4), C. Kelompok ikan bobot tubuh > 1000 g (1,6kg,IGS=1,19x10-4).
Sp;spermatogonia,Tb:tubulus,Js:jaringan somatik,Ta:tunika albuginea. Skala: 100 µm. Pewarnaan : Hematoksilin-Eosin.
Mengidentifikasi sumber donor yang mengandung banyak spermatogonia untuk mendapatkan suspensi sel donor yang kaya akan spermatogonia dibutuhkan untuk meningkatkan keberhasilan transplantasi (Hill & Dobrinsky 2006). Okutsu et al. (2006b) menyuntikkan sekitar 18.000 sel testikular ikan rainbow trout (di
dalamnya termasuk 10.000 spermatogonia) ke resipien dan jumlah sel yang terkolonisasi pada resipien hanya berkisar 1–9 sel per resipien. Demikian halnya pada hewan mamalia seperti tikus memiliki peluang kolonisasi sel donor spermatogonia pada gonad resipien hanya sekitar 7–20% dari 100 SSC yang ditransplantasikan (Nagano et al. 1999).
Semakin sedikit jumlah spermatogonia yang terkandung dalam suspensi sel yang disuntikkan tentunya akan semakin sedikit peluang sel yang dapat terkolonisasi. Berbagai macam teknik digunakan para peneliti untuk mengisolasi sel spermatogonia dari populasi sel testikular namun untuk teknik-teknik tersebut membutuhkan teknologi tinggi dan biaya yang cukup besar. Mencari sumber donor berdasarkan ukuran, umur atau bobot tubuh merupakan teknik yang paling sederhana untuk mendapatkan sumber donor yang kaya akan spermatogonia.
KESIMPULAN
1. Karakter diameter sel, volume sel dan volume sitoplasma dapat dijadikan karakter pembeda ke empat tipe spermatogonia ikan gurami, yaitu SSC, SpA, ST, dan SpB.
2. Sel spermatogonia ikan gurami yang memiliki peluang terkolonisasi adalah yang memiliki ukuran diameter sel 14,43 µm hingga 20,53 µm.
3. Sumber donor yang terbaik dari penelitian ini adalah yang berada pada kisaran bobot tubuh 500 g hingga 1000 g dengan kelimpahan rata-rata SSC dan SpA masing-masing adalah 2,96±1,20% dan 23,23±3,75%.