Studi Pengaruh Karboksimetil Kitosan terhadap Sistem Pertahanan Tubuh
Non-spesifik pada Ikan Mas (
Cyprinus Carpio
)
Study of The Effects of Carboxymethyl Chitosan on The Non-specific Defense System
in The Carp (
Cyprinus Carpio
)
1 2 2
Ristyana Dewi Hernawati , Triyanto , Murwantoko
1
Mahasiswa Jurusan Perikanan, Universitas Gadjah Mada, Yogyakarta
2
Jurusan Perikanan, Universitas Gadjah Mada, Yogyakarta Email: [email protected]
Abstract
Carp (Cyprinus carpio) is a freshwater fish with a high economic value, but very susceptible to diseases. One of effort to increase the productivity is by enhancing non-specific defense system. The purpose of this study is to determine the effect of carboxymethyl chitosan on enhancement non-specific defense system of carp. Carboxymethyl chitosan was obtained by alkylation process in which monochloroacetic acid in alkaline conditions was added. Carboxymethyl chitosan was given to carps at dosages of 30 µg/g, 75 µg/g and 105 µg/g, by intra muscular injection respectively. Seven and 14 days after administration of carboxymethyl chitosan, measurements of non-specific immune system parameters were done. The results showed that, administration of carboxymethyl chitosan on carps affected the phagocytic activity and lymphocytes counts. However, carboxymethyl chitosan did not give any effect to NBT activity, hematocrit, number of erythtocytes and leukocytes, monocytes and neutrophil counts in blood as well.
Key words: carp, a non-specific defense system, carboxymethyl chitosan, phagocytic activity, NBT
Abstrak
Ikan mas (Cyprinus carpio) merupakan ikan air tawar dengan harga jual yang tinggi, tetapi sangat rentan terhadap serangan penyakit. Salah satu upaya yang dapat dilakukan untuk meningkatkan produktifitas adalah dengan meningkatkan sistem pertahanan tubuh non-spesifik. Tujuan penelitian ini adalah untuk mengetahui pengaruh pemberian karboksimetil kitosan terhadap sistem pertahanan tubuh non-spesifik pada ikan mas. Karboksimetil kitosan diperoleh melalui proses alkilasi kitosan dengan penambahan asam monokloroasetat pada suasana alkali. Karboksimetil kitosan diberikan pada ikan mas dengan dosis 30 µg/g, 75 µg/g dan 105 µg/g secara intra muskuler. Tujuh dan 14 hari setelah pemberian karboksimetil kitosan, pertahanan tubuh non-spesifik dianalisis. Hasil penelitian ini menunjukkan, bahwa pemberian karboksimetil kitosan pada ikan mas berpengaruh terhadap aktifitas fagositosis dan jumlah limfosit. Tetapi, karboksimetil kitosan tidak memberikan pengaruh yang nyata terhadap aktifitas NBT, hematokrit, jumlah eritrosit dan leukosit, jumlah monosit dan neutrofil dalam darah.
Pendahuluan
Ikan mas (Cyprinus carpio) merupakan ikan air tawar dengan harga jual yang tinggi, tetapi sangat rentan terhadap serangan penyakit. Hal tersebut dapat terjadi karena kondisi padat tebar, suhu dan kandungan bahan organik yang tinggi dapat menimbulkan stres sehingga ikan mudah terserang penyakit. Penyakit ikan merupakan salah satu kendala dalam usaha budidaya. Secara ekonomis masalah penyakit pada ikan merugikan usaha budidaya, menurunkan produksi, kualitas ikan dan bahkan dapat menyebabkan kematian massal. Salah satu upaya untuk meningkatkan keberhasilan budidaya ikan adalah penyediaan benih yang sehat. Menurut Baratawidjaja (2006), pada umumnya ikan memiliki imunitas atau sistem pertahanan tubuh yang terbagi menjadi 2 kelompok, yaitu sistem pertahanan tubuh spesifik dan sistem pertahanan tubuh non-spesifik. Sistem pertahanan tubuh non spesifik berfungsi untuk melawan segala jenis patogen.
Imunostimulan merupakan senyawa biologis, sintesis atau senyawa lainnya yang dapat meningkatkan sistem respon imun non-spesifik. Penggunaan imunostimulan pada budidaya ikan bermanfaat bagi kesehatan ikan dan pencegahan terhadap penyakit (Saptiani, 1996). Kitosan adalah salah satu senyawa biologis yang dapat digunakan sebagai imunostimulan. Kitosan merupakan produk hasil deasetilasi kitin yang dapat diperoleh melalui proses kimia, mikrobiologis maupun enzimatis. Topik kitosan dipilih karena aplikasinya yang begitu luas di berbagai bidang dan sumbernya sangat berlimpah karena negara Indonesia mengekspor udang beku tanpa kulit dan kepala ke Amerika
Serikat setiap tahun. Menurut Sugita et al. (2009), sekitar 80 – 90% ekspor udang dilakukan dalam bentuk udang beku tanpa kepala dan kulit, diperkirakan menghasilkan limbah yang bobotnya mencapai 50 – 60% dari bobot udang utuh.
Kitosan larut pada kebanyakan larutan asam organik pada pH ± 4, tetapi tidak dapat larut pada pH lebih besar dari 6,5 , juga tidak larut dalam pelarut air, alkohol dan aseton. Kitosan tersebut dapat dimodifikasi supaya mampu larut dalam air sehingga penggunaannya tidak terbatas. Menurut Davies et al. (1989), kitosan dapat memiliki sifat larut dalam air apabila terdapat penambahan gugus asetat, laktat atau klorida. Salah satu senyawa aktif turunan kitosan yang larut air adalah karboksimetil kitosan, yaitu kitosan dengan penambahan gugus asetat. Karboksimetil kitosan diperoleh melalui proses alkilasi kitosan dengan penambahan asam monokloroasetat pada suasana alkali atau kitosan yang diendapkan dalam kondisi alkali. Senyawa t e r s e b u t m e m i l i k i b a n y a k f u n g s i u n t u k diaplikasikan, antara lain dalam pembuatan obat-obatan, pengawet makanan, kesehatan dan budidaya pertanian.
alternatif dalam pencegahan penyakit ikan karena imunostimulan berfungsi meningkatkan sistem pertahanan tubuh non-spesifik sebagai mekanisme pelindung terhadap serangan penyakit.
Materi dan Metode
Enam puluh ekor ikan mas (Cyprinus carpio) dengan berat 20 ± 3 g digunakan pada penelitian ini. Semua ikan mas dipelihara di Laboratorium Penelitian Jurusan Perikanan Universitas Gadjah Mada, Yogyakarta. Ikan dibagi secara acak menjadi empat kelompok perlakuan, masing-masing terdiri dari 15 ekor. Kelompok P1 = Kontrol, P2 = diberi karboksimetil kitosan 35 µg/g ikan (0,1 ml), P3 = diberi karboksimetil kitosan 70 µg/g ikan (0,1 ml), dan P4 = diberi karboksimetil kitosan 105 µg/g ikan (0,1 ml). Karboksimetil kitosan diberikan secara intra muskular. Gambaran hematologis ikan diamati sebelum dan setelah pemberian karboksimetil kitosan (setelah 7 hari dan 14 hari). Uji pertahanan tubuh non-spesifik yang dilakukan meliputi: uji hematokrit, uji aktifitas NBT, uji aktifitas fagositosis, perhitungan jumlah eritrosit dan leukosit, serta diferensiasi leukosit.
Preparasi N-O karboksimetil kitosan (Liu et al.,
2001)
Preparasi N-O karboksimetil kitosan dilakukan sebagai berikut: 20 g kitosan bubuk dicampur dengan 200 ml larutan isopropanol dan diaduk selama 30 menit. Selanjutnya, ditambahkan larutan sodium hidroksida 40% sebanyak 50,4 ml. Penambahan larutan sodium hidroksida dilakukan secara bertahap kurang lebih 6 kali setiap 5 menit, kemudian diaduk selama 45 menit. Setelah kitosan
terlihat mengental, ditambahkan 24 g asam monokloroasetat yang sebelumnya dilarutkan dalam 32 ml larutan isopropanol. Penambahan asam monokloroasetat ini dilakukan secara bertahap kurang lebih 5 kali setiap 5 menit. Sampel dipanaskan pada suhu 60° C selama 3 jam. Setelah disaring, pelet dicuci dengan etanol 70% dan selanjutnya dicuci dengan etanol absolut. Selanjutnya sampel dikeringkan pada suhu 60° C dan diblender menjadi tepung karboksimetil kitosan.
Uji kelarutan (Basmal et al., 2005)
Uji kelarutan karboksimetil kitosan dilakukan sebagai berikut: 1 ml larutan PBS dimasukkan ke dalam labu erlenmeyer. Kemudian ditambahkan tepung karboksimetil kitosan sedikit demi sedikit sambil diaduk hingga jenuh. Larutan disaring, filtrat yang diperoleh dimasukkan ke dalam cawan kosong yang sebelumnya telah ditimbang (W ), kemudian 0
diuapkan pada suhu 105° C selama kurang lebih 6 jam atau sampai mencapai berat konstan (W ). 1
Jumlah karboksimetil kitosan yang larut adalah banyaknya karboksimetil kitosan yang terdapat dalam cawan. Untuk menghitung persentase kelarutan karboksimetil kitosan digunakan perhitungan sebagai berikut:
% Larut = (W1 - W0) x 100%
Uji pertahanan tubuh non-spesifik (Anderson
and Siwicki, 1994)
a. Uji hematokrit
menit. Persentase hematokrit dihitung dengan mengukur tinggi eritrosit pada tabung kapiler kemudian dihitung menggunakan rumus:
% Hematokrit = –––––––––– x 100%
(Keterangan : a = eritrosit; b = plasma; c = leukosit)
b. Uji aktifitas nitrobluetetrazolium (NBT)
Uji aktifitas nitrobluetetrazolium (NBT) secara spektrofotometri dilakukan sebagai berikut: 100 µl sampel darah dimasukkan ke dalam cawan mikrotiter, kemudian ditambah dengan 100 µl larutan NBT 0,2%. Homogenkan dan diamkan selama 30 menit. Selanjutnya diambil 50 µl campuran kemudian masukkan ke dalam tabung r e a k s i y a n g b e r i s i 1 m l l a r u t a n N , N -dimethylformamide (DMF). Sentrifuge pada kecepatan 3000 rpm selama 5 menit. Supernatan diambil kemudian dispektrofotometri pada 540 nm. Kuvet yang digunakan harus terbuat dari kaca karena larutan N,N-dimethylformamide (DMF) dapat mendegradasi plastik.
c. Uji aktifitas fagositosis
Uji aktifitas fagositosis dilakukan sebagai berikut: Tabung kapiler hematokrit diisi dengan sampel darah+EDTA dan disentrifugasi dengan cara yang sama seperti pada uji hematokrit. Tabung kapiler hematokrit kemudian dipotong pada batas antara eritrosit dan leukosit. Bagian leukosit dimasukkan ke dalam cawan mikrotiter, kemudian
8
ditambah S. aureus (kepadatan 10 sel/ml) dengan volume yang sama. Berikutnya S. aureus dicampur dengan leukosit secara pipetting dan diinkubasi selama 20 menit. Sampel dari cawan mikrotiter diambil ± 5 µl dan diteteskan pada gelas objek, dibuat preparat ulas, dan didiamkan dengan cara
dikering anginkan. Preparat difiksasi etanol 95% selama 5 menit, dan dikering anginkan. Selanjutnya preparat diwarnai safranin 0,15% selama 10 menit dan diamati dengan mikroskop perbesaran 1000 x, minimal 100 sel. Aktivitas fagositosis (AF) dihitung menggunakan rumus:
a a + b + c
S fagosit yang a tif
AF = ––––––––––––––––––– x100% S fagosit yang diamati
d. Perhitungan jumlah eritrosit
Perhitungan jumlah eritrosit dilakukan sebagai berikut: Sampel darah dipipet dengan pipet gondok eritrosit sampai tanda 0.5 kemudian diencerkan dengan larutan Hayem sampai tanda 101 (pengenceran 200 x), digojog sampai homogen. Selanjutnya, sampel darah diteteskan pada hemositometer, diamati di bawah mikroskop. Dihitung jumlah eritrosit yang terdapat dalam 5 kotak kecil. Jumlah eritrosit per liter dihitung menggunakan rumus:
S sel yang dihitung
6 Seritrosit/liter = –––––––––––––––––– x pengenceran x 10 volume yang dihitung
e. Perhitungan jumlah leukosit
mikroskop. Dihitung jumlah leukosit yang terdapat dalam 4 kotak besar. Jumlah leukosit per liter dihitung menggunakan rumus:
S sel yang dihitung
6 Sleukosit/liter = –––––––––––––––––– x pengenceran x 10 volume yang dihitung
f. Uji diferensiasi leukosit
Uji diferensiasi leukosit dilakukan sebagai berikut: Tabung kapiler hematokrit diisi dengan sampel darah dan disentrifugasi dengan cara yang sama seperti pada uji hematokrit. Tabung kapiler hematokrit kemudian dipotong pada batas antara eritrosit dan leukosit. Bagian leukosit diteteskan pada gelas objek, dibuat preparat ulas dan didiamkan dengan cara dikeringkan. Preparat difiksasi dengan metanol selama 5-10 menit kemudian dikering anginkan. Preparat selanjutnya diwarnai dengan Giemsa selama 25 menit dan diamati di bawah mikroskop. Dihitung bentuk-bentuk leukosit pada sediaan apus darah. Penghitungan dihentikan bila jumlahnya telah mencapai 100 sel.
Hasil dan Pembahasan
Karboksimetil kitosan diperoleh melalui proses alkilasi. Menurut Mourya et al. (2010), metode a l k i l a s i d e n g a n m e m a n f a a t k a n a s a m m o n o k l o r o a s e t a t a k a n m e n g h a s i l k a n N -karboksimetil kitosan dan O--karboksimetil kitosan di berbagai kondisi reaksi berbeda. Proses karboksimetilasi terjadi setelah kitosan dalam
kondisi basa (pH 8-8,5) bereaksi dengan asam monokloroasetat. Berdasarkan Farmakope Indonesia edisi IV (Anonim, 1995), karboksimetil kitosan yang dihasilkan pada penelitian ini termasuk dalam kriteria larut dengan tingkat kelarutan sebesar 4,46%, sehingga untuk melarutkan 1 g karboksimetil kitosan dibutuhkan 22,42 ml air.
Tabel 1. Aktifitas fagositosis (%) pada ikan mas dengan perlakuan pemberian berbagai dosis karboksimetil kitosan
Dosis karboksimetil kitosan
(µg/g ikan)
Waktu (hari)
0
7
14
0
53,0
a52,4
a80,2
a35
48,8
a75,2
b81,0
a70
52,8
a82,2
b92,8
ab105
50,8
a84,4
b99,0
bKeterangan: Setiap nilai yang diikuti dengan huruf yang sama dalam satu kolom
menunjukkan tidak
beda nyata (pada á = 5%)
Meningkatnya konsentrasi karboksimetil k i t o s a n y a n g d i b e r i k a n s e j a l a n d e n g a n m e n i n g k a t n y a a k t i f i t a s f a g o s i t o s i s y a n g menunjukkan adanya peningkatan sistem pertahanan tubuh seluler pada ikan mas. Pemberian karboksimetil kitosan ini diduga mampu merangsang produksi berbagai protein seperti komplemen yang berperan sebagai opsonin yang meningkatkan fagositosis, sebagai faktor kemotaktik dan juga menimbulkan lisis pada bakteri. Aktifitas fagositosis adalah suatu kegiatan sel-sel
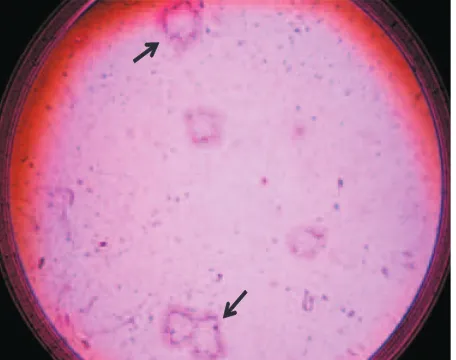
[image:6.595.57.538.130.231.2]fagositik untuk melakukan fagositosis dalam suatu sistem kekebalan non-spesifik dengan melibatkan sel mononukleus (makrofag) dan polimorfonukleus (neutrofil). Proses fagositosis meliputi beberapa tahap, yaitu kemotaksis, menangkap, memakan, memusnahkan dan mencerna. Kemotaksis merupakan gerakan dimana sel-sel fagosit mendekati bakteri (Baratawidjaja, 2006). Aktifitas fagositosis merupakan perbandingan antara sel fagosit yang aktif dengan sel fagosit yang teramati. Aktifitas fagositosis yang teramati ditunjukkan pada Gambar 1.
[image:6.595.313.541.525.705.2] [image:6.595.57.284.526.705.2]Gugus fungsional amina pada karboksimetil kitosan dapat menarik protein membran sel, yaitu glutamat yang merupakan komponen membran sel bakteri. Gugus amina bermuatan positif sangat kuat sehingga dapat berikatan dengan dinding sel bakteri yang relatif bermuatan negatif (Andres et al., 2007).
2+
Gugus tersebut dapat menarik mineral Ca yang terdapat pada dinding sel bakteri dengan membentuk ikatan kovalen koordinasi, dapat pula menarik
2+
mineral Mg yang terdapat pada ribosom sel bakteri. Ribosom merupakan organela sel yang berfungsi sebagai tempat sintesis protein, yang kadang-kadang melekat pada membran nukleus sel (Sari, 2008). Karboksimetil kitosan melakukan pengikatan
intraseluler, menghalangi mRNA, dan menghambat sintesis protein bakteri. Akhirnya, sel bakteri akan mengalami lisis.
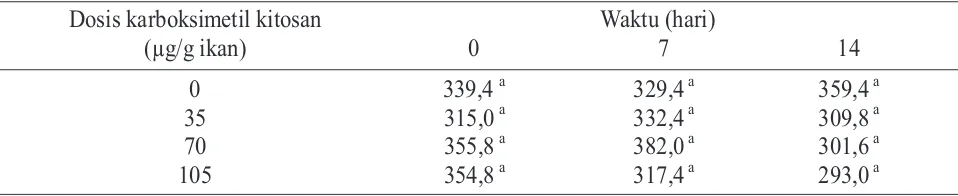
Parameter berikutnya yang diamati adalah nilai aktifitas nitrobluetetrazolium (NBT). Uji aktifitas NBT digunakan untuk menganalisis produksi oksigen radikal. Larutan NBT akan direduksi oleh formazan pada reaksi dengan oksigen radikal yang diproduksi oleh neutrofil dan monosit. Analisis produksi oksigen radikal dianalisis menggunakan spektrofotometer dengan panjang gelombang 540 nm. Berdasarkan hasil pengukuran yang ditunjukkan pada Tabel 2, pemberian karboksimetil kitosan tidak memberikan pengaruh terhadap aktifitas NBT.
Tabel 2. Nilai aktifitas nitrobluetetrazolium (NBT) pada ikan mas dengan perlakuan pemberian berbagai dosis karboksimetil kitosan
Dosis karboksimetil kitosan
(µg/g ikan)
Waktu (hari)
0
7
14
0
35
70
105
339,4
a329,4
a359,4
a315,0
a332,4
a309,8
a355,8
a382,0
a301,6
a354,8
a317,4
a293,0
aKeterangan: Setiap nilai yang diikuti dengan huruf yang sama dalam satu kolom menunjukkan tidak beda nyata (pada á = 5%)
Hasil penelitian ini juga membuktikan, bahwa pemberian karboksimetil kitosan tidak berpengaruh terhadap jumlah neutrofil dan monosit pada ikan mas (Tabel 3 dan 4). Neutrofil dan monosit yang teraktifasi dapat menghasilkan absorbansi 20 – 30% lebih tinggi, dan ini menunjukkan produksi oksigen radikal yang lebih tinggi untuk pertahanan penyakit. Pemberian karboksimetil kitosan pada penelitian ini tidak mampu mengaktifkan neutrofil dan monosit untuk memproduksi oksigen radikal,
[image:7.595.59.538.407.505.2]dalam sel bakteri yang kemungkinan dapat menyebabkan plasmolisis, dengan dibantu oleh sitokin (ã-interferon). Oksigen radikal dengan cepat dikonversi menjadi hidrogen peroksida (H O ) yang 2 2
memiliki sifat bakterisidal yang kuat. Selain itu,
oksigen radikal yang bersifat toksik terhadap patogen dikonversi pula menjadi radikal hidroksi
-(OH ) yang memiliki kemampuan mendegradasi membran lipid bakteri.
Tabel 3. Jumlah neutrofil (%) yang dihitung tiap 100 leukosit pada ikan mas dengan perlakuan pemberian berbagai dosis karboksimetil kitosan
Dosis karboksimetil kitosan
(µg/g ikan)
Waktu (hari)
0
7
14
0
0,6
a1,2
a1,2
a35
0,8
a1,0
a0,8
a70
105
0
a0
a0,6
a0,2
a1,4
a0
aKeterangan : Setiap nilai yang diikuti dengan huruf yang sama dalam satu kolom menunjukkan tidak beda nyata (pada á = 5%)
Tabel 4. Jumlah monosit (%) yang dihitung tiap 100 leukosit pada ikan mas dengan perlakuan pemberian berbagai dosis karboksimetil kitosan
Dosis karboksimetil kitosan
(µg/g ikan)
Waktu (hari)
0
7
14
0
35
70
12,2
a13,8
a13,6
a10,2
a9,2
b13,8
a11,0
a9,8
b8,8
a105
13,6
a8,4
b11,8
aKeterangan : Setiap nilai yang diikuti dengan huruf yang sama dalam satu kolom menunjukkan tidak beda nyata (pada á = 5%)
Pada penelitian ini juga diamati bentuk neutrofil dan monosit dengan pewarnaan Giemsa (Gambar 3 dan 5). Inti neutrofil mempunyai 3 – 5 lobi, sitoplasma agak asidofil dan mengandung 2 jenis granula (Johnson, 1994). Monosit pada ikan memiliki morfologi hampir sama dengan monosit
pada mamalia, inti berbentuk oval, terletak mendekati tepi sel dan mengisi sebagian isi sel (Hoffman, 1977).
Dalam preparat ulas, neutrofil
memiliki 3 lobi, sedangkan monosit tampak
[image:8.595.61.538.238.336.2] [image:8.595.59.538.446.542.2]Gambar 3. Neutrofil hasil pengamatan Gambar 4. Neutrofil ikan mujair (Trewavas, 1983)
Gambar 5. Monosit hasil pengamatan Gambar 6. Monosit ikan mujair (Erika, 2008)
Kondisi kesehatan ikan juga dapat diketahui dari hasil pemeriksaan darah, yaitu dengan melihat kadar hematokritnya. Hasil uji hematokrit ikan dapat
[image:9.595.57.285.87.257.2]menggambarkan kesehatan ikan. Hasil pengamatan kadar hematokrit (%) pada ikan mas dapat dilihat pada Tabel 5.
Tabel 5. Kadar hematokrit (%) pada ikan mas dengan perlakuan pemberian berbagai dosis karboksimetil kitosan
Dosis karboksimetil kitosan
(µg/g ikan)
Waktu (hari)
0
7
14
0
36,67
a38,14
a36,28
a35
29,24
a33,85
a30,31
a70
29,84
a36,98
a32,71
a105
36,18
a35,61
a35,46
a [image:9.595.310.538.289.455.2] [image:9.595.57.284.289.460.2] [image:9.595.56.539.599.695.2]Pemberian karboksimetil kitosan pada berbagai dosis tidak memberikan pengaruh yang nyata terhadap kadar hematokrit pada ikan mas. Menurut Anderson and Siwicki (1994), imunostimulan sangat jarang memberikan pengaruh terhadap kadar hematokrit pada ikan kecuali jika ikan yang kita amati mengalami stres yang tinggi. Berdasarkan pengamatan, kadar hematokrit ikan mas berkisar antara 30 – 38%. Kadar hematokrit normal pada rainbow trout berkisar 30 – 40%. Berdasarkan International System of SI Units in
Ichthyo-haematology, kadar hematokrit normal pada ikan karper berkisar antara 28 – 40%, hal ini berarti bahwa ikan yang diamati dalam keadaan sehat. Pemberian karboksimetil kitosan pada penelitian ini
tidak memberikan efek negatif terhadap ikan sehingga aman untuk dimanfaatkan sebagai imunostimulan.
Pemberian karboksimetil kitosan juga tidak memberikan pengaruh yang nyata terhadap jumlah eritrosit. Berdasarkan pengamatan, jumlah eritrosit ikan mas setelah pemberian karboksimetil kitosan
6 3
berkisar antara 0,56 – 1,34 x 10 sel/mm (Tabel 6). Nilai tersebut masih dalam kisaran normal karena jumlah eritrosit normal pada ikan common carp
6 3
sebesar 0,84 x 10 sel/mm (Johnny et al., 2003) dan berdasarkan International System of SI Units in Ichthyohaematology, jumlah eritrosit normal pada
6 3
ikan karper berkisar antara 1,1 – 1,8 x 10 sel/mm .
3
Tabel 6. Jumlah eritrosit per mm pada ikan mas dengan perlakuan pemberian berbagai dosis karboksimetil kitosan
Dosis karboksimetil kitosan
(µg/g ikan)
Waktu (hari)
0
7
14
0
35
1,27 x10
6 a0,99 x10
6 a0,86 x10
6 a0,56 x10
6 a0,97 x10
6 a0,97 x10
6 a70
1,17 x10
6 a0,89x10
6 a0,92 x10
6 a105
1,42 x10
6 a0,76 x10
6 a1,34 x10
6 aKeterangan : Setiap nilai yang diikuti dengan huruf yang sama dalam satu kolom menunjukkan tidak beda nyata (pada á = 5%)
Menurut Anderson (1992), leukosit merupakan salah satu komponen darah yang berfungsi sebagai pertahanan non-spesifik yang akan melokasi dan mengeliminasi patogen melalui fagositosis. Berdasarkan hasil pengamatan, pemberian karboksimetil kitosan tidak memberikan pengaruh yang nyata terhadap jumlah leukosit pada ikan mas (Tabel 7). Pada pengamatan terlihat, bahwa jumlah leukosit pada ikan mas meningkat seiring
[image:10.595.59.538.409.508.2]darah menuju jaringan dalam melakukan fungsinya. Jumlah leukosit akan meningkat secara pesat dalam waktu yang singkat apabila terjadi suatu penyakit
infeksi. Tetapi pada penelitian ini, jumlah leukosit yang teramati dalam keadaan normal.
3
Tabel 7. Jumlah leukosit per mm pada ikan mas dengan perlakuan pemberian berbagai dosis karboksimetil kitosan
Dosis karboksimetil kitosan
(µg/g ikan)
Waktu (hari)
0
7
14
0
2,47 x10
3 a1,47 x10
3 a2,87 x10
3 a3,30 x10
3 a35
70
2,61 x10
3 a1,01 x10
3 a3,24 x10
3 a1,73 x10
3 a5,28 x10
3 a105
2,66 x10
3 a1,32 x10
3 a4,11 x10
3 aKeterangan : Setiap nilai yang diikuti dengan huruf yang sama dalam satu kolom menunjukkan tidak beda nyata (pada á = 5%)
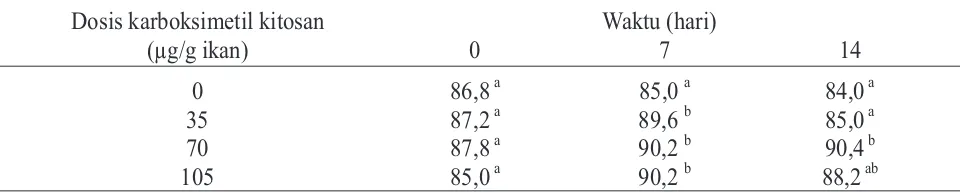
Pengamatan jumlah limfosit (%) pada ikan mas ditunjukkan pada Tabel 8. Pemberian karboksimetil kitosan berpengaruh nyata terhadap jumlah limfosit, walaupun begitu jumlah limfosit dari seluruh
perlakuan masih dalam kisaran normal dimana berdasarkan International System of SI Units in Ichthyohaematology, jumlah limfosit normal pada ikan karper berkisar antara 76 – 97,5%.
Tabel 8. Jumlah limfosit (%) yang dihitung tiap 100 leukosit pada ikan mas dengan perlakuan pemberian berbagai dosis karboksimetil kitosan
Dosis karboksimetil kitosan
(µg/g ikan)
Waktu (hari)
0
7
14
0
86,8
a85,0
a84,0
a35
87,2
a89,6
b85,0
a70
87,8
a90,2
b90,4
b105
85,0
a90,2
b88,2
abKeterangan : Setiap nilai yang diikuti dengan huruf yang sama dalam satu kolom menunjukkan tidak beda nyata (pada á = 5%)
Perlakuan yang paling besar pengaruhnya terhadap jumlah limfosit dalam darah adalah pemberian karboksimetil kitosan dengan dosis 70 µg/g ikan dimana dapat meningkatkan jumlah limfosit dalam darah hingga 90,4%. Limfosit merupakan sel yang penting dalam respon imun
[image:11.595.59.539.203.299.2] [image:11.595.58.538.476.572.2]limfosit tampak sebagai sel kecil dengan inti yang besar dan mengandung sedikit sitoplasma. Menurut Fujaya (2004), limfosit tidak bersifat fagositik, tetapi memegang peranan penting dalam pembentukan antibodi. Kekurangan limfosit dapat menurunkan konsentrasi antibodi dan menyebabkan meningkatnya serangan penyakit. Menurut Erika (2008), dengan pewarnaan Giemsa, limfosit ditandai dengan bentuk sel yang bundar dengan sejumlah kecil sitoplasma non granula berwarna biru cerah atau ungu pucat.
Berdasarkan hasil penelitian ini terbukti, bahwa pemberian karboksimetil kitosan pada ikan mas dapat meningkatkan persentase aktifitas fagositosis dan jumlah limfosit dalam darah. Hal tersebut mengindikasikan, bahwa karboksimetil kitosan dapat dimanfaatkan sebagai salah satu bahan stimulasi sistem imun seluler bagi ikan mas karena dapat meningkatkan imunitas non-spesifik. Akan tetapi, karboksimetil kitosan tidak memberikan pengaruh yang nyata terhadap nilai aktifitas NBT, hematokrit, jumlah eritrosit dan leukosit, jumlah monosit dan neutrofil dalam darah. Perlu dilakukan penelitian lanjutan mengenai perhitungan indeks fagositosis ikan mas akibat pemberian karboksimetil kitosan.
Ucapan Terima Kasih
Ucapan terima kasih disampaikan kepada Prof. drh. R. Wasito, M.Sc., Ph.D., Fakultas Kedokteran Hewan Universitas Gadjah Mada yang telah membimbing dalam penulisan naskah.
Daftar Pustaka
Anderson (1992) Immunostimulants, Adjuvants and Vaccine Carrier In Fish: Application to Aquaculture. J. Fish. Dis. 2: 281-307.
Anderson, D. P. and Siwicki, A. K. (1994) Simplified Assays for Measuring Non-specific Defense M e c h a n i s m s I n F i s h. F i s h H e a l t h Section/American Fisheries Society Meetings. Seattle, Washington.
Andres, Y., Giraud, L., Gerente, C., Le Cloirec P. (2007) Antibacterial Effects of Chitosan Powder: Mechanisms of Action. J. Environ. Technol. 28(12): 1357-1363.
Anonim (1995) Farmakope Indonesia, Edisi IV. Direktorat Jenderal Pengawasan Obat dan Makanan. Departemen Kesehatan Republik Indonesia.
Baratawidjaja, K. G. (2006) Imunologi Dasar, Edisi ke Tujuh. Balai Penerbit Fakultas Kedokteran Universitas Indonesia, Jakarta.
Basmal, J., Prasetyo, A. dan Fawzya, Y. N. (2005) Pengaruh Konsentrasi Asam Monokloroasetat dalam Proses Karboksimetilasi Kitosan terhadap Karboksimetil Kitosan yang Dihasilkan. J. Penel. Perikan. Ind. 11: 1-9. Davies, D. H., Helson and Hayes (1989)
N,O-Carboxymethyl-chitosan A New Water Soluble Derivative In Chitin and Chitosan. Braek S. G., T. Anthonsen an P. Sanford (ed). Applied Science. London.
Erika, Y. (2008) Gambaran Diferensiasi Leukosit pada Ikan Mujair (Oreochromis mossambica) di Daerah Ciampea Bogor. Skripsi. Institut Pertanian Bogor, Bogor.
Hastuti, S. D. (2010) Potensi Ekstrak Lidah Buaya (Aloe Vera) sebagai Imunostimulan untuk Meningkatkan Sistem Kekebalan Non Spesifik pada Ikan Mas (Cyprinus carpio). J. Sci. 1: 144-150.
Hoffman, G. L. (1977) Methods for The Diagnosis of Fish Disease. Amerid Publ. Co. Pvt. Ltd. New Delhi.
Irianto, A. (2005) Patologi Ikan Teleostei. Gadjah Mada University Press, Yogyakarta.
Johnny, F., Zafran, Roza, D. dan Mahardika, K. (2003) Hematologis Beberapa Spesies Ikan Laut. J. Penel. Perikan. Ind. 9: 63-71.
Johnson, K. E. (1994) Histology and Cell Biology. Alih bahasa. Binarupa Aksara, Jakarta.
Liu, X. F., Guan, Y. L., Yang, D. Z., Li, Z. and Yao, K. D. (2001) Antibacterial Action of Chitosan and Carboxymethylated Chitosan. J. Appl. Polymer Sci. 79: 1324-1335.
Mudjiutami, E., Ciptoroso, Zainun, Z., Sumarjo dan Rahmat (2007) Pemanfaatan Imunostimulan untuk Pengendalian Penyakit pada Ikan Mas. J. Bud. Air Tawar. 4: 1-9.
Mourya, V. K., Nazma, N. I. and Ashutosh, T. (2010) Carboxymethyl Chitosan and Its Applications. Adv. Mat. Lett. 1: 11-13.
Sabaa, M. W., Mohamed, N. A., Mohamed, R. R., Khalil N. M. and El Latif, S. M. A. (2010) Synthesis, Characterization and Antimicrobial Activity of Poly (N-vinyl imidazole) Grafted Carboxymethyl Chitosan. J. Carbohydrate Polymers. 79: 998-1005.
Saptiani, G. (1996) Gambaran Sistem Kekebalan Non Spesifik pada Ikan Gurame (Osphronemus gouramy) akibat Pemberian Immunostimulan. Tesis. Institut Pertanian Bogor, Bogor.
Sari (2008) Pengaruh Pemberian Biodek terhadap Kualitas Limbah Cair Tahu. Tesis. Universitas Lambung Mangkurat, Banjarmasin.
Seyfarth, F., Schliemann, S., Elsner, P. and Hipler, U. C. (2008) Antifungal Effect of High and Low Molecular Weight Chitosan Hydrochloride, C a r b o x y m e t h y l C h i t o s a n , C h i t o s a n Oligosaccharide and N-Acetyl-D-Glucosamine Against Candida albicans, Candida krusei and Candida glabrata. Inter. J. Pharm. 353: 139-148.
Sugita, P., Wukirsari, T., Sjahriza, A. dan Wahyono, D. (2009) Kitosan: Sumber Biomaterial Masa Depan. IPB Press, Bogor.