BAB II
TINJAUAN PUSTAKA 2.1. Logam Berat
Logam berat adalah unsur logam yang mempunyai densitas <5 g/cm3 dalam air laut, logam berat terdapat dalam bentuk terlarut dan tersuspensi. Dalam kondisi alam ini, logam berat dibutuhkan oleh organism untuk pertumbuhan dan perkembangan hidupnya (Effendi, 2000).
Selain bersifat racun, logam berat juga terakumulasi dalam sedimen dan biota melalui proses biokonsentrasi, bioakumulasi dan biomagnifikasi oleh biota laut. Logam-logam berat yang masuk ke dalam tubuh hewan umumnya tidak dikeluarkan lagi dari tubuh mereka. Karena itu logam-logam cenderung untuk menumpuk dalam tubuh mereka. Sebagai akibatnya, logam-logam ini akan terus ada di sepanjang rantai makanan. Hal ini disebabkan karena predator pada satu trofik level yang lebih rendah yang telah tercemar (Hutabarat, 1991).
Logam juga dapat menyebabkan timbulnya suatu bahaya pada makhluk hidup. Hal ini terjadi jika sejumlah logam mencemari lingkungan. Logam-logam tertentu sangat berbahaya jika ditemukan dalam konsentrasi tinggi dalam lingkungan, karena logam tersebut mempunyai sifat merusak tubuh makhluk hidup. Di samping hal tersebut, beberapa logam sangat diperlukan dalam proses kehidupan makhluk hidup. Dalam hal ini logam dapat dibagi menjadi dua bagian, yaitu logam esensial dan nonesensial. Logam esensial adalah logam yang sangat membantu di dalam proses fisiologi makhluk hidup dengan jalan membantu kerja enzim atau pembentukan organ dari makhluk yang bersangkutan. Sedangkan logam non esensial adalah logam yang peranannya dalam tubuh makhluk hidup belum diketahui, kandungannya dalam jaringan hewan sangat kecil dan apabila kandungannya tinngi akan merusak organ tubuh makhluk yang bersangkutan (Vogel, 1994).
atas unsur Mn dan Fe. Tingkat toksisitas logam berat terhadap hewan air, mulai dari yang paling toksik, adalah Hg, Cd, Zn, Pb, Cr, Ni dan Co. tingkat toksisitas terhadap manusia dari yang paling toksik adalah Hg, Cd, Ag, Ni, Pb, As, Cr, Sn, dan Zn (Widowati dkk. 2008).
Banyak logam yang bersifat toksik dalam air dan mencemari air tawar maupun air laut. Jika pencemaran air karena logam terjadi maka organisme pertama yang terpengaruh akibat penambahan polutan logam ke perairan adalah organisme dan tumbuhan yang tumbuh di perairan atau habitat tertentu. Dalam tubuh makhluk hidup, logam mengalami biokonsentrasi dan bioakumulasi sehingga kadar logam di dalam tubuh makhluk hidup lebih besar daripada di lingkungan perairan. Logam juga mengalami biomagnifikasi, kadarnya semakin meningkat dengan peningkatan posisi organisme pada rantai makanan. Karena interaksi antar organism di dalam suatu ekosistem maka dampak dari limbah logam tersebut pada akhirnya akan sampai pada hierarki rantai makanan tertinggi yaitu manusia (Santoso, 2012)
Beberapa hasil penelitian mengungkapkan bahwa terdapat beberapa macam penyakit pada manusia akibat memakan makanan dan meminum minuman yang mengandung logam berat seperti kanker, gangguan saluran cerna, ginjal, dan lain-lain. Toksisitas (daya racun) logam berat tergantung dari jenis, kadar, efek sinergi antagonis dan sifat fisik-kimianya. Semakin besar kadar logam berat maka daya toksisitasnya semakin besar (Hellawel, 1986).
2.2. Logam Kadmium
Menurut Sunardi (2006) kadmium merupakan salah satu unsur logam transisi golongan 2B yang berwarna putih perak dan mudah dibentuk.kadmium memiliki massa atom 112,41 sma, densitas 8,65 gram/cm3, dan memiliki titik lebur 594,26 K. Kadmium ditemukan di alam dalam mineral greenockite, dan dipisahkan dengan seng melalui penyulingan (destilasi) bertingkat atau melalui proses elektrolisis.
Unsur logam berat kadmium (Cd) terdapat dalam tanah secara alami dengan kandungan rata-rata rendah yaitu 0,4 mg/kg tanah. Pada tanah yang bebas polusi kandungannya adalah 0,06-1,00 mg/kg tanah. Peningkatan kandungan kadmium dapat berasal dari asap kendaraan dan pupuk fosfat yang terakumulasi di tanah. Pada umumnya tanaman menyerap hanya sedikit (1-5 %) larutan kadmium yang ditambahkan ke dalam tanah. Akumulasi dalam jangka waktu lama dapat meningkatkan kandungan kadmium dalam tanah dan tanaman yang sedang tumbuh. Sayuran mengakumulasi kadmium lebih banyak dibandingkan tanaman pangan lainnya (Subowo, dkk. 1999).
Menurut Sudarmadji (2006), dalam tubuh manusia kadmium terutama dieliminasi melalui urin. Hanya sedikit yang diabsorbsi, yaitu 5-10 %. Absorbsi dipengaruhi oleh faktor diet seperti intake protein, kalsium, Vitamin D dan trace logam seperti seng (Zn). Proporsi yang besar adalah absorbsi melalui pernapasan yaitu antara 10-40 % tergantung keadaan fisik. Uap kadmium sangan toksik dengan lethal dose melalui pernapasan diperkirakan 10 menit terpapar sampai dengan 190 mg/m3 selama 240 menit akan dapat menimbulkan kematian. Gejala umum keracunan Cd adalah sakit di dada, nafas sesak, batuk-batuk dan lemah.
Senada dengan Darwono (1995) bahwa masuknya kadmium dalam batas yang tidak diizinkan sangat berbahaya karena dapat menyebabkan penyakit jantung, efek lain yaitu dapat meracuni pernafasan yang mengakibatkan kerusakan pada paru-paru, usus, hati, ginjal dan akhirnya dapat menyebabkan kematian. Pada umumnya keracunan kadmium dapat merusak semua sel tubuh (Darwono, 1995)
senyawa kadmium berpotensi berbahaya dan beracun. Ketika kadmium dilebur, maka kadmium akan menguap ke atmosfir dan pada konsentrasi tinggi dapat menyebabkan penyakit pada ginjal dan tulang sumsum serta emphisema.
Kadmium (Cd) memiliki waktu paruh 30 tahun dan dapat terakumulasi pada ginjal mengalami disfungsi. Jumlah normal kadmium dalam tanah berada di bawah 1 ppm, tetapi angka tertinggi 1700 ppm dijumpai pada permukaan sampel tanah yang diambil di dekat pertambangan biji seng (Zn). Kadmium lebih mudah terakumulasi pada tanaman dibandingkan dengan ion logam berat lainnya seperti timbal (Pb).
Kadmium bergabung bersama timbal dan merkuri sebagai the big three heavy metal yang memiliki tingkat bahaya tertinggi pada kesehatan manusia. Menurut badan dunia FAO/WHO, konsumsi per minggu yang ditoleransikan bagi manusia adalah 400-500 g per orang atau 7 mg per kg berat badan. Kadmium yang terdapat dalam tubuh manusia sebagian besar diperoleh melalui makanan dan tembakau, hanya sejumlah kecil berasal dari air minum dan polusi udara (Widaningrum, 2007).
2.3. Kitosan
Kitosan ditemukan oleh C. Roughet pada tahun 1859 dengan cara memasak kitin dengan basa. Perkembangan penggunaan kitin dan kitosan meningkat pada tahun 1940-an, terlebih dengan semakin diperlukannya bahan alami oleh berbagai industri sekitar tahun 1970-an. Kitosan merupakan produk deasetilasi kitin. Kualitas dan nilai ekonomi kitosan dan kitin ditentukan oleh kualitas dan harga jualnya. Perbedaan antara kitin dan kitosan didasarkan pada kandungan nitrogennya. Bila nitrogen kurang dari 7% maka polimer disebut kitin dan apabila kandungan total nitrogennya lebih dari 7% disebut kitosan. Perbedaan lainnya antara kitin dan kitosan terdapat dalam derajat deasetilasinya. Kitosan mempunyai derajat deasetilasi berkisar antara 80-90%, akan tetapi kebanyakan publikasi menggunakan istilah kitosan apabila derajat deasetilasi lebih besar 70% (Kaban, 2009).
polisakarida kationik alami yang diperoleh dari deasetilasi kitin yang banyak terdapat di alam. Kitin dapat diperoleh dari crustacean atau berbagai fungi. Kitosan sebagai polimer alami dapat dihasilkan dari hewan berkulit keras terutama dari laut seperti udang, rajungan, kepiting dengan kadar kitosan antara 10-15%. Selain dari kulit hewan laut, kitosan juga dapat diperoleh dari dinding sel jamur antara lain Aspergillus niger.
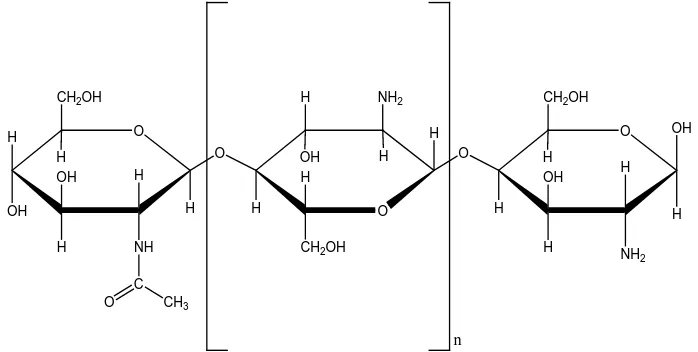
2.3.1. Struktur Molekul Kitosan
Kitosan adalah padatan amorf putih kekuningan, tidak beracun dan baik sebagai flokulan dan koagulan serta mudah membentuk membran atau film (Meiratna, 2008), merupakan polimer rantai panjang yang disusun oleh monomer-monomer glukosamina. Kitosan adalah glukosamina (2-amino-2-deoksi-β-D-glukosa) yang berkaitan dengan polimer β-1,4 dan mengandung N-asetilglukosamina yang lebih sedikit. Berat molekul kitosan adalah 1,036 x 106 Dalton. Berat molekul tergantung dari degradasi yang terjadi pada saat proses pembuatannya (Astuti, 2008).
Rumus umum kitosan adalah (C6H11NO4)n atau disebut sebagai
(1,4)-2-amina-2-deoksi-β-D-Glukosa. Struktur kitosan dapat dilihat pada Gambar 2.1.
2.3.2. Sifat dan Karakteristik Kitosan
Sifat dari kitosan adalah tidak larut dalam air, memiliki ketahanan kimia cukup baik, larut dalam larutan asam tetapi tidak larut dalam basa dan ikatan silang kitosan memiliki sifat tidak larut dalam media campuran asam dan basa, memiliki reaktivitas kimia yang tinggi karena mengandung gugus -OH dan gugus -NH2
(Muzzarelli, 1997). Kitosan juga mempunyai sifat yang lebih spesifik yaitu dengan adanya sifat bioaktif, biokomposit, pengkelat, antibakteri dan dapat terdegradasi (Kumar, dkk., 2000).
Sandford dan Hutchins sebagaimana dikutip Meiratna (2008) menyatakan sifat kationik, biologi, dan sifat kimia kitosan adalah sebagai berikut :
1. Sifat kationik
Jumlah muatan positif tinggi: suatu muatan per unit gugus glukosamin, jika banyak material bermuatan negatif (seperti protein) maka muatan positif kitosan berinteraksi kuat dengan muatan negatif lain (polimer), flokulan yang baik:gugus NH3+ berinteraksi dengan muatan negatif dari polimer lain.
2. Sifat biologi
Sifat biologi kitosan berkaitan dengan sifat antibakteri. Kitosan digunakan sebagai antibakteri dikarenakan beberapa sifat yang dimiliki yaitu kemampuannya dalam menghambat pertumbuhan mikroorganisme perusak dan kemampuannya dalam memberikan pelapisan terhadap produk sehingga meminimalkan interaksi antara produk dan lingkungannya. Berbagai hipotesa yang sampai saat ini masih berkembang mengenai mekanisme kerja kitosan sebagai pengawet adalah afinitas yang dimiliki oleh kitosan yang sangat kuat dengan DNA mikroba sehingga dapat berikatan dengan DNA yang kemudian mengganggu mRNA dan sintesa protein (Hadwiger dan Loschke 1978 diacu dalam Hardjito 2006).
Kitosan sebagai polikationik amina akan berinteraksi dengan kutub negatif dari lapisan sel bakteri (Young dan Kauss 1983 diacu Chaiyakosha, dkk. 2007). Helander, dkk. (2001) diacu Chaiyakosha, dkk. (2007) menyatakan bahwa reduksi sejumlah sel bakteri disebabkan oleh perubahan permukaan sel dan kehilangan fungsi pelindung dalam sel bakteri tersebut. Bakteri Gram negatif dengan lipopolisakarida dalam lapisan luarnya memiliki kutub negatif yang sangat sensitif terhadap kitosan. Dalam penelitiannya Tsai, dkk. (2002) menemukan bahwa kitosan dapat menghambat pertumbuhan Escherichia coli, adanya penghambatan ini disebabkan oleh adanya keelektronegatifan permukaan sel E. coli. Perubahan dalam potensial permukaan E.coli selama pertumbuhan, yaitu terjadinya peningkatan keelektronegatifan seiring dengan peningkatan umur sel, yaitu sampai pertumbuhan lambat, namun keelektronegatifan akan menurun setelah bakteri mencapai fase stasioner. Di lain pihak, Simpson (1997) diacu Suptijah (2006) menyatakan bahwa kitosan dapat digunakan sebagai antibakteri dengan mekanisme sebagai berikut: kitosan dapat berikatan dengan membran sel, diantaranya dengan glutamat yang merupakan komponen membran sel. Selain berikatan dengan protein membran, terutama fosfatidil kolin (PC) sehingga menyebabkan permeabilitas inner membran (IM) jadi meningkat dan dengan meningkatnya permeabilitas IM memberi jalan yang mudah untuk keluarnya cairan sel. Khususnya pada E. coli setelah 60 menit komponen enzim β -galaktosidase dapat terlepas, berarti dapat keluar dengan sitoplasma bahkan sambil membawa komponen metabolit yang lain, yang berarti terjadi lisis. Sehubungan dengan meningkatnya lisis maka tidak akan terjadi pembelahan sel (regenerasi), bahkan dapat sampai mati.
Secara khusus juga kitosan telah diketahui aktif terhadap Stahylococcus aureus (Fernandez, dkk., 2008). Aktivitas antibakteri kitosan berkolerasi erat dengan karakteristik permukaan sel mikroba tersebut. Hal ini dikarenakan muatan positif yang berasal dari gugus asam amino dalam suasana pH asam (di bawah 6,5) yang menyebabkan depolarisasi membran seluler mikroba, sebagai akibat terganggunya integritas dinding sel dari hubungan molekul yang menyebabkan kematian bagi mikroba (Kong, dkk., 2010).
Hal ini senada dengan Prashanth & Tharanathan (2007) aktivitas antimikroba, yaitu molekul polikationik kitosan berinteraksi dengan sel didominasi komponen anionik dinding (lipopolisakarida dan protein) dari mikroorganisme, yang mengakibatkan kebocoran intraseluler komponen akibat perubahan permeabilitas membran, mencegah nutrisi memasuki sel, pada saat masuk ke sel, mengikat DNA, menghambat RNA dan sintesis protein, mengikat melalui interaksi hidrofobik. Kitosan menunjukkan spektrum luas aktivitas antimikroba terhadap kedua gram positif dan bakteri gram negatif dan jamur. Aktifitas antibakteri kitosan berhubungan dengan karakteristik permukaan sel mikroba tersebut. Hal ini dikarenakan muatan positif yang berasal dari gugus asam amino dalam suasana pH asam (dibawah 6,5), yang menyebabkan depolarisasi membran seluler mikroba, sebagai akibat terganggunya integritas dinding sel dari hubungan molekul yang menyebabkan kematian bagi mikroba. Kitosan tidak larut dalam air diatas pH 5.5, basa dan kebanyakan pelarut organik, tetapi ,larut dalam asam organik encer (Swastawati, dkk., 2007), sehingga pada suasana asam kitosan dapat larut dan bekerja, sedangkan dalam suasana basa dia tidak akan bereaksi.
3. Sifat kimia
Kitosan mempunyai reaktifitas kimia yang baik karena mempunyai sejumlah gugus hidroksil (-OH) dan gugus amina (-NH2) pada rantainya merupakan
netral dan asam seperti selulosa, dekstran, peptin, asam alginate, agar, dan agarose (Kumar, 2000).
Keberadaan gugus amina (-NH2) dan hidroksil (-OH) menjadikan kitosan
sebagai polisakarida yang reaktif untuk adsorpsi dan dapat berinteraksi dengan molekul yang bermuatan negatif. Kitosan telah digunakan di berbagai bidang industri seperti industri makanan aditif, kosmetik, material pertanian dan untuk anti bakterial. Kitosan juga sering digunakan sebagai adsorben pada ion logam dan spesies organik. Hal ini disebabkan oleh adanya gugus amina dan gugus hidroksil dari rantai kitosan yang dapat dijadikan sebagai tempat untuk berkoordinasi dan bereaksi (Lee, dkk., 2009). Atom nitrogen pada gugus amina menyediakan pasangan elektron bebas yang dapat bereaksi dengan kation logam. Pada pH asam, gugus amina terprotonasi sehingga meningkatkan kelarutan kitosan yang bersifat tidak larut dalam pelarut alkali dan pada pH netral (Bernkop, dkk., 2004).
2.3.3. Kegunaan Kitosan
Menurut Robert (1992), kitosan mudah mengalami degradasi secara biologis, tidak beracun dan baik sebagai flokulan dan koagulan serta mudah membentuk membran atau film. Kitosan merupakan suatu biopolymer alam yang reaktif yang dapat melakukan perubahan-perubahan kimia.
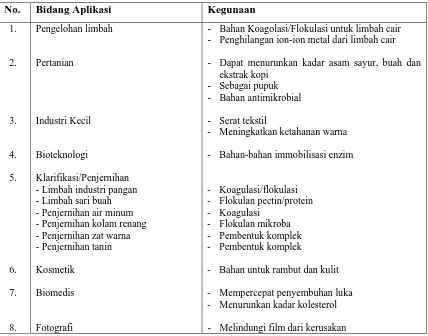
Beberapa aplikasi dan kegunaan kitosan di berbagai bidang ditunjukkan pada tabel 2.2 seperti berikut:
Tabel 2.2. Aplikasi dan kegunaan kitosan di berbagai bidang
No. Bidang Aplikasi Kegunaan
1. - Limbah industri pangan - Limbah sari buah - Penjernihan air minum - Penjernihan kolam renang - Penjernihan zat warna - Penjernihan tanin Kosmetik
Biomedis
Fotografi
- Bahan Koagolasi/Flokulasi untuk limbah cair - Penghilangan ion-ion metal dari limbah cair - Dapat menurunkan kadar asam sayur, buah dan
ekstrak kopi - Sebagai pupuk - Bahan antimikrobial - Serat tekstil
- Meningkatkan ketahanan warna - Bahan-bahan immobilisasi enzim
- Koagulasi/flokulasi - Flokulan pectin/protein - Koagulasi
- Flokulan mikroba - Pembentuk komplek - Pembentuk komplek
- Bahan untuk rambut dan kulit - Mempercepat penyembuhan luka - Menurunkan kadar kolesterol - Melindungi film dari kerusakan
(Sumber: Robert (1992))
2.3.4. Kemampuan Kitosan Untuk Menyerap Logam
oleh Lestari dan Aulia (2011) dengan metode perendaman (bacth), dimana diperoleh persen daya serap sebesar 57,07% dalam waktu perendaman selama 15 menit. Lestari dan Aulia (2011) menjelaskan bahwa mekanisme penyerapan logam kadmium (Cd) tersebut terjadi karena adanya pengikatan Cd oleh gugus N dan O yang terdapat dalam kitosan.
Menurut Redjeki (2012), kitosan dapat mengikat ion-ion logam karena memiliki pasangan electron bebas pada gugus amina primer yang bersifat nukleofilik sebagai akseptor proton sehingga gugus amina ini dapat terprotonasi. Gugus amina bebas –NH2 kitosan dapat mengadsorpsi ion logam (seperti Zn, Cd, Cu, Pb, Mg dan
Fe ) dengan membentuk senyawa kompleks (khelat) (Knoor, 1984). Reaksi pembentukan kompleks (khelat) merupakan reaksi asam-basa Lewis, dengan asam Lewis adalah penerima elektron dan basa Lewis adalah penyumbang elektron. Pada pembentukan kompleks kitosan-ion logam, ligan –NH2 bertindak sebagai basa Lewis
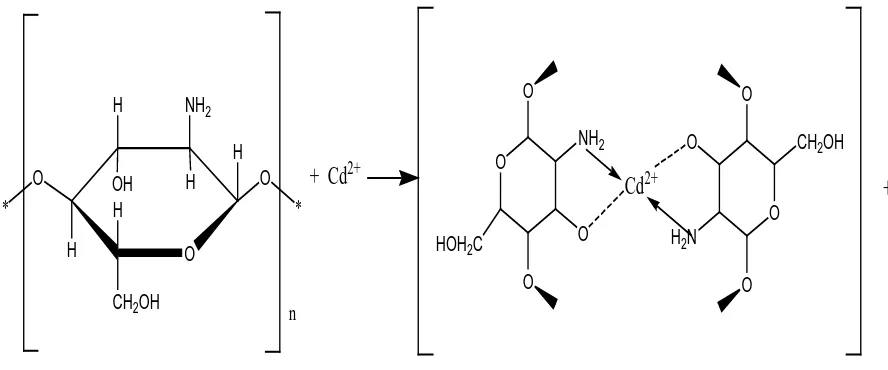
yang menyumbangkan sepasang elektron ke ion Cd (II) membentuk ikatan kovalen koordinasi. Adapun mekanisme reaksi pembentukan khelat kitosan dengan logam kadmium (Cd) dapat dilihat pada Gambar 2.2 seperti berikut:
Gambar 2.2. Reaksi Pembentukan Khelat Kitosan dengan Logam Kadmium (Kaminski dan Modrzejewska, 1997)
Kemampuan kitosan untuk mengikat logam dengan cara pengkhelat adalah dihubungan dengan kadar nitrogen yang tinggi pada rantai polimernya. Kitosan mempunyai satu kumpulan amino linier bagi setiap unit glukosa. Kumpulan amino ini mempunyai satu kumpulan amino linier bagi setiap unit glukosa. Kumpulan amino ini mempunyai sepasang elektron yang dapat berkoordinat atau membentuk ikatan-ikatan aktif dengan kation-kation logam. Unsur nitrogen pada setiap monomer kitosan dikatakan sebagai gugus yang aktif berkoordinat dengan kation logam (Hutahahean, 2001).
Interaksi kitosan dengan ion logam terjadi karena proses pengkompleksan dimana penukaran ion, penyerapan dan pengkhelatan terjadi selama proses berlangsung. Ketiga proses tersebut tergantung dari ion logam masing-masing seperti penukaran ion logam Ca. Kitosan menunjukkan afinitas yang tinggi pada logam transisi golongan 3, begitu pula pada logam yang bukan golongan alkali dengan konsentrasi rendah (Muzzarelli, 1973).
Pada umumnya mekanisme serapan kitosan terhadap logam dapat dirumuskan pada cara yaitu (1) secara pengkhelatan, dimana terbentuknya ikatan aktif antara nitrogen kitosan dengan kation logam, dalam hal ini nitrogen dari kitosan bertindak sebagai basa lewis yang menyumbangkan sepasang elektron untuk berkoordinat dengan logam, (2) secara pertukaran ion yaitu berlaku pertukaran antara proton dari kitosan dengan kation logam, (3) secara memperangkap, dimana ion logam terperangkap dalam lingkaran rantai polimer.
Menurut Mc Kay (1987) dalam Meriatna (2008), kitosan mempunyai kemampuan untuk mengikat logam dan membentuk kompleks kitosan dengan logam. Contoh mekanismenya adalah sebagai berikut:
2.4. Selulosa
2.4.1. Struktur Selulosa
Selulosa merupakan senyawa organik yang paling melimpah di bumi. Diperkirakan sekitar 1011 ton selulosa dibiosintesis tiap tahun dan selulosa mencakup sekitar 50% dari karbon tak bebas di bumi. Selulosa membentuk komponen serat dari dinding sel tumbuhan (Fessenden, 1986).
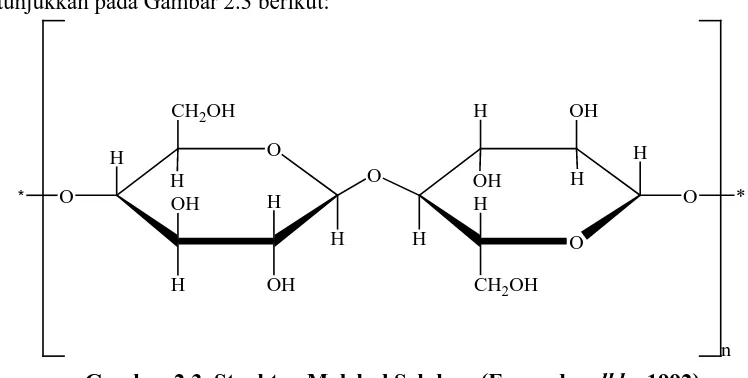
Selulosa tersusun dari unit-unit anhidroglukopiranosa yang tersambung dengan ikatan β-1,4-glikosidik membentuk suatu rantai makromolekul tidak bercabang. Setiap unit anhidroglukopiranosa memiliki tiga gugus hidroksil (Potthast, dkk., 2006; Zugenmainer, 2008). Selulosa mempunyai rumus empirik (C6H10O5)n
dengan n~1500 dan berat molekul ~ 243.000 (Rowe, dkk., 2009). Struktur selulosa
terdiri dari rantai polimer β-glukosa yang dihubungkan dengan ikatan glikosida 1,4 yang
ditunjukkan pada Gambar 2.3 berikut:
Gambar 2.3. Struktur Molekul Selulosa (Fessenden dkk., 1992)
2.4.2. Sifat Fisika Kimia Selulosa
Menurut Wibisono (2011), selulosa merupakan komponen utama dalam pembuatan kertas. Selulosa adalah senyawa organik penyusun utama dinding sel dari tumbuhan. Adapun sifat dari selulosa adalah berbentuk senyawa berserat, mempunyai tegangan tarik yang tinggi, tidak larut dalam air dan pelarut organik.
Selulosa mempunyai struktur rantai yang linier, sehingga kristal selulosa menjadi stabil. Bahan berbasis selulosa sering digunakan karena memiliki sifat mekanik yang baik seperti kekuatan dan modulus regang yang tinggi, kemurnian tinggi, kapasitas mengikat air tinggi, dan struktur jaringan yang sangat baik (Gea, dkk ., 2011).
2.4.3. Sumber Selulosa
Selulosa merupakan salah satu polimer yang tersedia melimpah di alam. Produksi selulosa sekitar 100 milyar ton setiap tahunnya. Sebagian dihasilkan dalam bentuk selulosa murni seperti yang terdapat dalam rambut biji tanaman kapas. Namun paling banyak adalah yang berkombinasi dengan lignin dan polisakarida lain seperti hemiselulosa dalam dinding sel tumbuhan berkayu, baik pada kayu lunak dan keras, jerami atau bamboo. Selain itu selulosa juga dihasilkan oleh bakteri Acetobacter xylinum secara ekstraseluler (Klemm, dkk., 1998). Senyawa ini juga dijumpai dalam plankton bersel satu atau alga di lautan, juga pada jamur dan bakteri (Potthast et al., 2006; Zugenmainer, 2008). Sebagai bahan baku kimia, selulosa telah digunakan dalam bentuk serat atau turunannya selama sekitar 150 tahun (Habibi, dkk., 2010).
Ada dua serat alam yang utama yaitu kapas dan wol, yang awalnya merupakan selulosa polisakarida dan yang belakangan merupakan suatu protein. Sutera, serat protein lainnya, diproduksi dalam kuantitas yang sangat sedikit. Serat-serat sintesis diklarifikasikan sebagai selulosa dan nonselulosa (Stevens, 2001).
Selulosa merupakan struktur dasar sel-sel tanaman, oleh karena itu merupakan bahan alam yang paling penting yang dibuat oleh organisme hidup. Selulosa terdapat pada semua tanaman dari pohon bertingkat tinggi hingga organisme primitif seperti rumput laut, flagelata dan bakteria. Kadar selulosa yang tinggi terdapat dalam rambut biji (kapas, kapok) dan serabut kulit (rami, flax, henep), lumut, ekor kuda dan bacteria yang mengandung selulosa (Wegener, 1985).
vitro secara enzimatik dari selobiosal flourida, dan kemosintesis dari glukosa dengan pembukaan cincin polimerisasi turunan benzil dan pivaloyl. Dari ketiga mikroorganisme tersebut, hanya spesies Acetobacter xylinum yang diketahui dapat menghasilkan selulosa dalam jumlah besar. Sumber selulosa lain adalah dari hewan, yang disebut tunicin atau selulosa hewan karena diperoleh dari organisme bahari tertentu dari kelas Tunicata (Gea, 2010).
2.4.4. Kemampuan Selulosa sebagai Adsorben Penyerap Ion Logam
Penelitian tentang studi adsorpsi logam dengan menggunakan adsorben telah banyak dilakukan. Memanfaatkan limbah hasil pertanian atau perkebunan sebagai adsorben yang mengandung selulosa untuk studi adsorpsi logam juga telah banyak dilakukan akhir-akhir ini. Fatma (2002) telah meneliti sabut kelapa untuk penyerapan ion logam kadmium (Cd). Abia dan Asuquo (2007) meneliti serat buah kelapa sawit sebagai adsorben ion logam Cd (II) dan Cr (III). Igwe dan Abia (2007) meneliti batang jagung sebagai adsorben ion logam Cd (II), Pb (II) dan Zn (II). Igwe dan Abia (2006) meneliti serat/sabut kelapa sebagai adsorben logam As (III). Babarinde, dkk. (2008) meneliti pembungkus buah jagung sebagai biosorben ion logam.
Selain menggunakan berbagai jenis adsorben di atas, adapula adsorpsi dapat dilakukan dengan menggunakan tumbuhan lain sebagai penyerap logam berat baik yang berasal dari tumbuhan di air dan tumbuhan yang hidup di tanah. Contohnya adalah pemanfaatan rumput alang-alang sebagai biosorben Cr (VI) (Rahmi, 2009), adsorpsi merkuri (II) pada biomassa daun eceng gondok (Al-Ayub, 2010) dan adsorpsi ion Pb (II) dalam air dengan jerami padi (Yanuar, 2009).
(OH) yang membuat selulosa poliol dengan gugus fungsi alkohol primer ( -CH2OH)
atau alkohol sekunder (-CHOH) sehingga dapat terjadi adsorpsi pada material selulosa.
2.5. Alang-Alang
Alang-alang atau ilalang yang memiliki nama ilmiah yaitu Imperata cylindrica yang merupakan rumput asli Indonesia yang sangat mudah sekali tumbuh dan berkembang. Alang-alang ialah sejenis rumput berdaun tajam, yang kerap menjadi gulma di lahan pertanian. Alang-alang menyebar secara alami mulai dari India hingga ke Asia
Timur, Asia Tenggara, Mikronesia, dan Australia. Kini alang-alang juga ditemukan di Asia
Utara, Eropa, Afrika, dan Amerika (Wibisono, 2011).
Menurut Moenandir (1988), alang-alang (Imperata Cylindrica) dalam sistematika (taksonomi) tumbuhan dapat diklasifikasikan sebagai berikut:
Divisi : Spermatophyta Sub divisi : Angiospermae Kelas : Moncotyledonae
Bangsa : Poales
Suku : Gramineae
Marga : Imperata
Jenis : Imperata cylindrica. Nama umum : Alang-alang
Menurut Sutiya (2012), sampai saat ini pemanfaatan alang-alang masih sangat terbatas, walaupun alang-alang dapat digunakan sebagai bahan baku pulp dan pembuatan kertas sebagai alternatif bahan baku kayu. Selain itu, alang-alang yang semula dianggap gulma bisa memberikan nilai ekonomis yang tinggi jika diolah. Berdasarkan penelitian yang telah dilakukan adapun kandungan kimia alang-alang dapat ditunjukkan pada Tabel 2.3.
Tabel 2.3. Kandungan Kimia Alang-Alang
No. Kandungan Kimia Alang-Alang Persentase (%) 1.
Hal ini senada dengan Wibisono (2011) menyatakan bahwa bahan kering dari alang-alang mengandung abu sebesar 5,42 %, silika 3,6 %, lignin 18,12 %, pentosan 28,58 %, dan kadar alfa selulosa 44,28 %, dan juga mempunyai derajat polimerisasi berkisar 600-1500.
2.6. Selulosa Mikrokristal
Selulosa mikrokristal adalah selulosa yang berbentuk kristalin yang telah mengalami depolimerisasi parsial dan fraksinasi, berwarna putih, tidak berbau, tidak berasa, berbentuk serbuk dan merupakan partikel berpori (Adel, 2011).
(Keshk and Haija, 2011). Umumnya, bahan baku yang berbeda menghasilkan struktur dan morfologi MCC yang berbeda.
Umumnya, selulosa mikrokristal dibuat dengan proses hidrolisis menggunakan asam. Senada dengan Rowe, dkk. (2009) yang menyatakan bahwa selulosa mikrokristal dibuat dengan cara hidrolisis terkontrol alfa selulosa, suatu pulp dari tumbuhan yang berserat dengan larutan asam mineral encer. Namun, penelitian Oyeniyi (2012) bahwa proses pembuatan MCC berkembang dengan nilai kristalinitas dan kemurnian yang tinggi. Penelitian-penelitian tersebut menyimpulkan bahwa proses pembuatan selulosa mikrokristal adalah proses menghilangkan bagian amorf dan meninggalkan bagian kristalin dari selulosa (Hsu, 1996).
2.7. Adsorpsi
Adsorpsi adalah proses akumulasi substansi di permukaan antara dua fase yang terjadi secara fisika dan kimia, atau proses terserapnya molekul-molekul pada permukaan eksternal atau internal suatu padatan. Akumulasi yang terjadi dapat berlangsung pada proses cair-cair, cair-padat dan padat-padat. Proses adsorpsi sangat cocok untuk memisahkan bahan dengan konsentrasi yang kecil dari campuran lain yang mengandung bahan dengan konsentrasi tinggi. Adsorpsi digunakan dalam pengolahan air buangan industri, terutama untuk mengurangi komponen-komponen organik misalnya warna, fenol, detergen, zat-zat toksik dan zat-zat organik yang sukar diuraikan (Mc Cabe, dkk. 1989)
Proses adsorpsi berlangsung tiga tahap yaitu pergerakan molekul-molekul adsorbat menuju permukaan adsorben, penyebaran molekul-molekul adsorbat ke dalam rongga-rongga adsorben dan penarikan molekul-molekul adsorbat oleh permukaan aktif membentuk ikatan yang berlangsung sangat cepat (sorpsi) (Metcalf and Eddy, 1979).
2.8. Penggunaan Kitosan – Selulosa sebagai Adsorben
Menurut Bilal (2001) bahwa selulosa mempunyai kemampuan untuk mengadsorpsi logam berat dengan biaya yang rendah. Selain itu berdasarkan percobaan sebelumnya telah diketahui bahwa kayu dan komponennya, seperti selulosa, lignin, hemiselulosa, dan sebagainya, telah digunakan dalam industri perawatan air untuk menghilangkan logam berat seperti Cu(II), Pb(II), Cd(II), Cr(III) dan sebagainya. Disisi lain, penghilangan ion logam berat dari air buangan dan limbah cair industri telah memberikan banyak perhatian selama beberapa tahun terakhir ini. Hal tersebut disebabkan karena ion logam tersebut telah menyebabkan masalah kesehatan dalam kehidupan manusia dan hewan.
Kitosan murni pada umumnya digunakan sebagai biosorben logam berat dalam bentuk serpihan (flakes) (Jonsson-Charrier dkk., 1996) dan serbuk (powder) (Lima and Airoldi, 2000), sedangkan bentuk kitosan termodifikasi meliputi kitosan ikat silang (Cao dkk., 2002), dan dipadukan dengan material pendukung selulosa menjadi komposit kitosan-selulosa (Herwanto, B. dan E. Santoso., 2006). Selulosa berfungsi sebagai material pendukung. Selulosa dipilih sebagai bahan pendukung karena termasuk bahan biopolimer dengan struktur kimiawi yang mirip dengan kitosan, dimana kemiripan struktur kimiawi kitosan dan selulosa akan menjadikan kedua biopolimer bersifat kompatibel dan mempunyai gaya adhesi yang baik.
(Wan Ngah dkk., 2002). Serbuk kitosan dengan ukuran partikel yang lebih kecil mempunyai kapasitas adsorpsi yang lebih besar dari pada serbuk dengan ukuran partikel lebih besar (Karthikeyan dkk., 2004).
2.9. Beberapa Metode Analisis dan Karakterisasi Film 2.9.1. Spektroskopi Infra Merah Fourier-Transform (FT-IR)
Spektroskopi inframerah merupakan salah satu teknik analisis yang paling penting yang tersedia untuk para ilmuwan saat ini. Salah satu keuntungan besar dari spektroskopi inframerah adalah bahwa hampir semua sampel dapat dipelajari. Cairan, larutan, pasta, bubuk, film, serat, gas dan permukaan semuanya dapat dianalisis. Spektroskopi FTIR telah meningkatkan kualitas spektrum inframerah dan meminimalkan waktu yang dibutuhkan untuk memperoleh data. Spektroskopi inframerah adalah teknik yang didasarkan pada getaran dari atom molekul. Spektrum inframerah biasanya diperoleh dengan melewatkan radiasi inframerah melalui sampel dan menentukan bagian mana dari radiasi yang diserap pada energi tertentu. Energi yang muncul di setiap puncak dalam spektrum penyerapan dapat disamakan dengan frekuensi getaran dari bagian molekul sampel (Stuart, 2004)
Karakterisasi gugus ujung dapat dilakukan menggunakan FT-IR. Spektroskopi FT-IR atau Fourier Transform Infrared dapat menganalisis gugus ujung suatu senyawa. Dalam penelitian Darni dan Utami (2010) uji FT-IR digunakan untuk mengidentifikasi bahan kimia yang terkandung dalam suatu polimer.
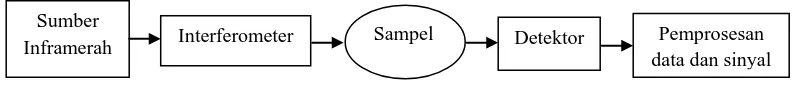
Komponen dasar sebuah FT-IR ditunjukkan pada Gambar 2.4. seperti berikut:
Gambar 2.4. Skema komponen dasar FT-IR
Sumber
Cahaya infra merah terbagi menjadi 3 yakni, infra merah dekat, infra merah pertengahan, dan infra merah jauh. Hampir semua senyawa, termasuk senyawa organik menyerap dalam daerah inframerah. Agar senyawa bentuk padat dapat dianalisis pada daerah inframerah maka senyawa tersebut harus dibuat film, dilebur, atau dilumatkan menjadi cairan yang kental (mull), didispersikan dalam senyawa halida organik menjadi bentuk cakram atau pellet, atau dilarutkan dalam berbagai pelarut. Polimer organik dapat dibuat film di antara dua lempengan garam setelah dilarutkan dalam pelarut yang cocok (Sastrohamidjojo, 1992).
2.9.2. Uji Kekuatan Tarik
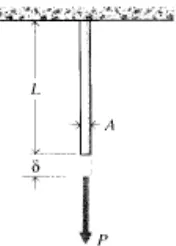
Uji yang paling sering digunakan untuk sifat mekanik dari suatu bahan adalah uji tarik, yang mana suatu kepingan atau silinder dari bahan, yang memiliki panjang L dan luas area A, diletakkan di salah satu ujung dan berada pada posisi aksial P – menyatakan panjang spesimen- di sisi lainnya. Adapun gambar spesimen uji kekuatan tarik ditunjukkan seperti Gambar 2.5. berikut:
Gambar. 2.5. Spesimen Uji Tarik
Sifat mekanis biasanya dipelajari dengan mengamati sifat kekuatan tarik (σt)
spesimen mengalami perubahan bentuk (deformasi) maka definisi kekuatan tarik dinyatakan dengan luas penampang semula (A0). Kekuatan tarik suatu bahan dapat
dilihat pada persamaan (Wirjosentono, 1995).
σ
t = FmaksA0
dimana: σt menyatakan kuat tarik, Fmaks menyatakan beban maksimum, A0
menyatakan luas penampang bahan.
Satuan untuk tegangan adalah N/m2 (disebut juga Pascal atau Pa) dalam system SI dan 1b/in2 (atau psi) dalam satuan yang sering digunakan di Amerika Serikat (Roylance, 2008)
2.9.3. Thermogravimetric Analysis (TGA)
Thermogravimetric Analysis (TGA) memantau perubahan massa dari suatu zat sebagai fungsi temperatur atau waktu selama sampel diletakkan pada suatu program temperatur yang teratur. TGA sering digunakan untuk mengatur material polimer berdasarkan stabilitas termalnya dengan membandingkan kehilangan berat versus temperatur.
Kegunaan TGA yang kedua adalah menentukan laju kehilangan uap, diluent, dan monomer yang tak beraksi yang harus dihilangkan dari bahan polimer. Bahan polimer dapat dipirolisis dengan peralatan TGA untuk menentukan pengisis karbon hitam atau sisa material anorganik.
penentuan komponen yang volatil dan menguap dalam material sampel, studi kinetik, dan reaksi oksidasi-reduksi (Patnaik, 2004).
2.9.4. Mikroskop Pemindai Elektron (SEM)
SEM berbeda dengan mikroskopi elektron transmisi (TEM) dalam hal ini suatu berkas insiden elektron yang sangat halus di-scan menyilangi permukaan sampel dalam sinkronisasi dengan berkas tersebut dalam tabung sinar katoda. Electron-elektron yang terhambur digunakan untuk memproduksi sinyal yang memodulasi berkas dalam tabung sinar katoda, yang memproduksi suatu citra dengan kedalaman medan yang besar dan penampakan yang hamper tiga dimensi.
Dalam penelitian morfologi permukaan SEM terbatas pemakaiannya, tetapi memberikan informasi yang bermanfaat mengenai topologi pemukaan dengan resolusi sekitar 100 Ǻ. Aplikasi -aplikasi yang khas mencakup penelitian disperse-dispersi pigmen dalam cat, pelepuhan atau peretakan koting, batas-batas fasa dalam polipaduan yang tak dapat campur, struktur sel busa-busa polimer, dan kerusakan pada bahan perekat. SEM teristimewa berharga dalam mengevaluasi penanaman (implant) bedah polimerik bereaksi baik dengan lingkungan bagian-bagiannya (Stevens,2001).
2.9.5. Spektrofotometer Serapan Atom (SSA)
Prinsip kerja SSA adalah mengacu pada absorbsi atom terhadap cahaya. Atom-atom menyerap cahaya pada panjang gelombang tertentu, tergantung sifat unsurnya. Dengan absorbsi energi, atom akan memperoleh lebih banyak energi, sehingga akan naik tingkat energinya dari keadaan dasar (ground state) ke tingkat energi tereksitasi (excited state). Energi ini akan dipancarkan kembali ketika atom tereksitasi turun kembali ke keadaan dasarnya. Energi inilah yang akan terdeteksi oleh detektor (Hendayana, 1994).
terisap oleh aliran gas bahan bakar dan oksigen yang cepat. Berbeda dengan spektroskopi sinar tampak, metode ini tidak mempedulikan warna larutan, sedangkan larutan cuplikan diatomisasi dahulu (Hendayana, 1994).
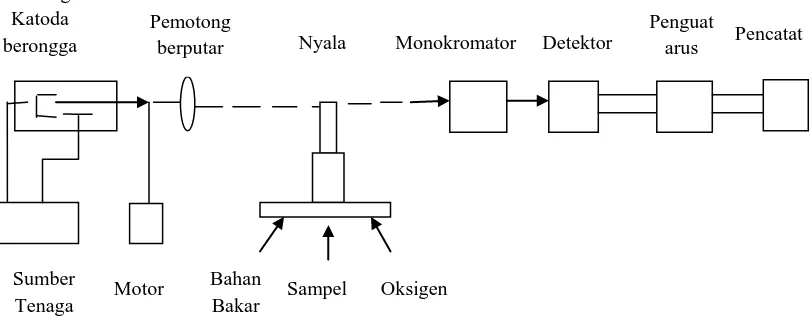
Sistem peralatan pada Spektrofotometri serapan atom adalah :
Gambar 2.6. Komponen-komponen spektrofotometer serapan atom (Day, 1998) 1. Sumber Sinar
Sumber sinar yang lazim dipakai adalah lampu katoda berongga (hollow cathode lamp). Lampu ini terdiri atas tabung kaca tertutup yang mengandung suatu katoda dan anoda. Katoda sendiri berbentuk silinder berongga yang terbuat dari logam atau dilapisi dengan logam tertentu. Tabung logam ini diisi dengan gas mulia (neon atau argon) dengan ttekanan rendah (10-15 torr). Neon biasanya paling sering dipakai karena memberikan intensitas pancaran yang lebih rendah. Bila antara katoda dan anoda diberikan tegangan yang tinggi (600 volt), maka katoda akan memancarkan berkas-berkas elektron yang bergerak menuju anoda yang mana kecepatan dan energinya sangat tinggi. Elektron-elektron dengan energi tinggi ini dalam perjalanannya menuju anoda akan bertabrakan dengan gas-gas mulia yang diisikan tadi.
Akibat dari tabrakan-tabrakan ini membuat unsur-unsur gas mulia akan kehilangan elektron dan menjadi ion bermuatan positif. Ion-ion gas mulia yang
Tabung Katoda berongga
Pemotong
berputar Nyala Monokromator Detektor
Penguat
arus Pencatat
Sumber
Tenaga Motor
Bahan
bermuatan positif selanjutnya akan bergerak ke katoda dengan kecepatan dan energi yang tinggi pula. Sebagaimana disebutkan di atas, pada katoda terdapat unsur-unsur yang sesuai dengan unsur yang akan dianalisis. Unsur-unsur ini akan ditabrak oleh ion-ion positif gas mulia. Akibat tabrakan ini, unsur-unsur akan terlempar keluar dari permukaan katoda. Atom-atom unsur dari katoda ini kemudian akan mengalami eksitasi ke tingkat energi-energi elektron yang lebih tinggi dan akan memancarkan spektrum pancaran dari unsur yang sama dengan unsur yang akan dianalisis.
2. Tempat sampel
Dalam analisis dengan spektrofotometri serapan atom, sampel yang akan dianalisis harus diuraikan menjadi atom-atom netral yang masih dalam keadaan gas. Ada berbagai macam alat yang dapat digunakan untuk mengubah suatu sampel menjadi uap atom-atom yaitu :
a. Nyala (Flame)
Nyala digunakan untuk mengubah sampel yang berupa padatan atau cairan menjadi bentuk uap atomnya, dan juga berfungsi untuk atomisasi. Pada cara spektrofotometri emisi atom, nyala ini berfungsi untuk mengeksitasikan atom dari tingkat dasar ke tingkat yang lebih tinggi.
Suhu yang dapat dicapai oleh nyala tergantung pada gas-gas yang digunakan, misalnya untuk gas batubara-udara, suhunya kira-kira sebesar 1800 0C, gas alam-udara 1700 0C, asetilen-udara 2200 0C, dan gas asetilen-dinitrogen oksida (N2O)
sebesar 3000 0C.
b. Tanpa nyala (Flameless)
pengatoman (atomising). Pada umumnya waktu dan suhu pemanasan tanpa nyala dilakukan dengan cara terprogram.
3. Monokromator
Pada spektrofotometri serapan atom, monokromator dimaksudkan untuk memisahkan dan memilih panjang gelombang yang digunakan dalam analisis. Disamping sistem optik, dalam monokromator juga terdapat suatu alat yang digunakan untuk memisahkan radiasi resonansi dan kontinyu yang disebut dengan chopper.
4. Detektor
Detektor digunakan untuk mengukur intensitas cahaya yang melalui tempat pengatoman. Biasanya digunakan tabung penggandaan foton (photomultiplier tube). Ada dua cara yang dapat digunakan dalam sistem deteksi yaitu yang memberikan respon terhadap radiasi resonansi dan radiasi kontinyu, dan yang hanya memberikan respon terhadap radiasi resonansi
5. Readout
Readout merupakan suatu alat penunjuk atau dapat juga diartikan sebagai sistem pencatat hasil. Pencatat hasil dilakukan dengan suatu alat yang telah terkalibrasi untuk pembacaan suatu angka transmisi atau absorbs. Hasil pembacaan dapat berupa angka atau berupa kurva dari suatu recorder yang menggambarkan absorbansi atau intensitas emisi (Rohman, 2007).
2.9.6 Partikel Size Analizer (PSA)