ISOLASI DAN IDENTIFIKASI MOLEKULER VIRUS PAPILLOMA PADA Macaca fascicularis DAN Macaca nemestrina DI FASILITAS
PENANGKARAN PUSAT STUDI SATWA PRIMATA-INSTITUT PERTANIAN BOGOR
ISTI KARTIKA SARI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2013
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis yang berjudul Isolasi dan Identifikasi Molekuler Virus Papilloma pada Macaca fascicularis dan Macaca nemestrina di Fasilitas Penangkaran Pusat Studi Satwa Primata – Institut Pertanian Bogor adalah benar hasil karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir tesis ini.Bogor, Agustus 2013 Isti Karika Sari P053110031
RINGKASAN
ISTI KARTIKA SARI Isolasi dan Identifikasi Molekuler Virus Papilloma Macaca fascicularis dan Macaca nemestrina di Fasilitas Penangkaran Pusat Studi Satwa Primata Institut Pertanian Bogor di bawah bimbingan IRMA HERAWATI SUPARTO dan DIAH ISKANDRIATI
Penyakit kanker leher rahim yang disebabkan oleh virus papilloma manusia (human papillomavirus/HPV) masih dianggap sebagai penyebab kematian utama pada wanita di seluruh dunia, sehingga penelitian mengenai virus papilloma beserta obat-obatan dan vaksin untuk pencegahannya terus dilakukan. Virus papilloma adalah virus DNA dari famili papillomaviridae. Virion papilloma tidak memiliki selubung, berdiameter 55 nm dan mempunyai kapsid ikosahedral. Virus ini memperbanyak diri pada inti sel serta menyebabkan infeksi laten yang kronis. Genom virus papilloma berbentuk sirkuler, ukuran panjangnya 8 kbp, mempunyai 8 jendela baca terbuka (open reading frame) dan dibagi menjadi gen early (E) dan late (L). Gen E menyintesis 6 protein E, yaitu E1, E2, E4, E5, E6 dan E7, yang banyak terkait pada proses replikasi virus dan onkogen. Sementara itu gen L menyintesis 2 protein, yaitu L1 dan L2 yang terkait pada pembentukan kapsid (Hakim2010).
Untuk keperluan penelitian biomedis, sering kali dibutuhkan hewan model yang dapat mencerminkan aspek-aspek penyakit pada manusia. Satwa primata memiliki kemiripan yang tinggi dengan manusia, baik dalam segi evolusi genetik, anatomis, fisiologis, biokimia, dan sistem organ, juga gen kankernya. Satwa primata dari genus macaca adalah genus dengan penyebaran tertinggi di bumi yang tersebar dari Jepang hingga Afganistan. Sejauh ini terdapat 22 spesies yang termasuk dalam genus macaca. Pada awalnya, monyet rhesus atau M. mulatta yang banyak digunakan untuk penelitian biomedis, akan tetapi pemerintah India menerapkan larangan untuk mengimpor hewan ini. Sejak saat itu, Macaca fascicularis (monyet ekor panjang/MEP) dan Macaca nemestrina (beruk) yang jumlah dan populasinya banyak terdapat di Asia Tenggara, mulai digunakan sebagai hewan untuk penelitian. Sebagai hewan model, berbagai aspek medis yang berkaitan dengan kedua spesies tersebut banyak dipelajari oleh para peneliti.
Dalam penelitian ini digunakan metode polymerase chain reaction (PCR) dan perunutan nukleotida untuk mengidentifikasi jenis virus papilloma yang menginfeksi saluran genital pada MEP dan beruk di penangkaran Pusat Studi Satwa Primata Institut Pertanian Bogor. Analisis runutan nukleotida dilakukan dengan menggunakan program Clustal W 2.1 dan Mega 5.1. Pembentukan pohon filogenetik mengunakan neighbor joining dengan pengulangan bootstrap 1000 kali.
Hasil penelitian menunjukkan bahwa virus papilloma yang menginfeksi MEP sebesar 32.7% (78/238) dan beruk 12% (4/31). Kedua spesies tersebut terinfeksi oleh Macaca fascicularis papillomavirus (MfPV) tipe 3, 4, 5, 7, dan 9 yang termasuk genus Alpha papillomavirus dengan homologi sebesar 80 - 100%. Virus papilloma yang menginfeksi beruk adalah jenis yang sama dengan virus papilloma yang menginfeksi MEP dengan kemiripan antara 82% - 99% berdasarkan daerah L1. Untuk lebih menjelaskan jenis virus papilloma yang menginfeksi beruk, perlu dilakukan identifikasi keseluruhan genom virus
tersebut, karena untuk menentukan jenis virus tersebut diperlukan identifikasi urutan nukleotida yang lebih lengkap. Ternyata salah satu dari beruk terinfeksi virus papilloma yang memiliki homologi sebesar 76% dengan HPV tipe 52. Ini merupakan laporan pertama mengenai kejadian infeksi virus papilloma pada beruk sehingga analisis genom lanjutan perlu dilakukan. Hasil penelitian juga menunjukkan bahwa kedua spesies satwa primata tersebut dapat dimanfaatkan menjadi hewan model untuk penelitian virus papilloma maupun penyakit kanker serviks pada manusia.
Kata kunci: Virus papilloma, kanker serviks, hewan model, Macaca fascicularis, Macaca nemestrina
SUMMARY
ISTI KARTIKA SARI The Isolation and Molecular Identification of Papillomavirus in Macaca fascicularis and Macaca nemestrina at Animal Facility of Primate Research Centre – Bogor Agricultural University. Under supervision of IRMA HERAWATI SUPARTO and DIAH ISKANDRIATI
Cervical cancer is still regarded as a major cause of death in women world wide, hence research on papilloma viruses, their drugs and vaccines for the prevention are still continued. Papilloma virus is a DNA virus of the family papillomaviridae. Papilloma virions have no sheath, the diameter of 55 nm, and icosahedral capsid. The virus multiplies in the cell nucleus and causes chronic latent infection. The virus genome has a circular form, 8 kbp in length with 8 open reading frames. The genome is divided into early (E) and late (L) genes. The E gen synthesizes 6 E proteins, namely E1, E2, E4, E5, E6 and E7, which are linked into the process of viral replication and oncogenes. Meanwhile, the L gene synthesizes 2 proteins, the L1 and L2, which are related to the formation of the capsid (Hakim 2010).
In order to obtain the best result of the cancer research, it is highly requested to obtain appropriate animal model that reflect aspects of human disease. Non-human primates have high similarity with humans, both in terms of the evolution of the genetic, anatomical, physiological, biochemical and organ systems, as well as in cancer genes. Non-human primates of the genus Macaca is a genus with the highest distribution worldwide, from Japan to Afghanistan. So far, there are 22 species are included in the genus Macaca. Originally rhesus monkeys or M. mulatta are widely used for biomedical research, but since the Indian government imposed a ban on importing these animals, then Macaca fascicularis (Long-tailed Macaque, cynomolgus) and Macaca nemestrina (Pig-tailed Macaque), which has high population in Southeast Asia, began to be used as research animal. Various medical aspects related to both species are commonly studied by many researchers as an animal model for human diseases.
This study is using the polymerase chain reaction (PCR) method and nucleotide tracking to identify papillomavirus tipes that infect the genital tract of Macaca fascicularis and Macaca nemestrina, which is kept in breeding facilities of Primate Research Center, IPB. The analysis of nucleotide sequences were performed using the Clustal W 2.1 and 5.1 Mega program. The establishment of phylogenetic tree using neighbor joining with 1000 times bootstrap repetition.
The results showed that the papillomavirus that infect Macaca fascicularis was 32.7% (78/238) and Macaca nemestrina 12% (4/31). Both species were infected by Macaca fascicularis papillomavirus (MfPV) tipe 3, 4, 5, 7 and 9, belongs to the genus Alpha papillomavirus with homology of 80 - 100%. Papilloma virus that infected the pig-tailed macaque was the same tipe of papillomavirus that infected the cynomolgus with similarity between 82% - 99% based on L1 region. To further explain the tipes of papilloma viruses that infected the pig-tailed macaque, it is necessary to identify the entire genome of the virus. To determine the tipe of the virus, it requires the identification of a more complete nucleotide sequence. It is interesting because papillomavirus that infected the pigtail macaques has 76% homology with the HPV tipe 52. This is the first report
on the incidence of papillomavirus infection in the pigtail macaque genome that further analysis needs to be done. The results also showed that the two species of non-human primates can be utilized as an animal model for the study of papillomavirus and cervical cancer in humans.
Keywords: Papillomavirus, cervic cancer, animal model, Macaca fascicularis, Macaca nemestrina
© Hak Cipta Milik IPB, Tahun 2011
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis ini dalam bentuk apa pun tanpa izin IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Primatologi
ISOLASI DAN IDENTIFIKASI MOLEKULER VIRUS PAPILLOMA PADA Macaca fascicularis DAN Macaca nemestrina DI FASILITAS
PENANGKARAN PUSAT STUDI SATWA PRIMATA-INSTITUT PERTANIAN BOGOR
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2013
-Judul Tesis : Isolasi dan Identifikasi Molekuler Virus Papilloma pada Macaca
fascicularis dan Macaca nemestrina di Fasilitas Penangkaran Pusat
Studi Satwa Primata Institut Pertanian Bogor Nama : Isti Kartika Sari
NIM : P053110031
Disetujui oleh Komisi Pembimbing
Dr. dr. Irma H. Suparto, MS Dr. drh. Diah Iskandriati
Ketua Anggota
Diketahui oleh
Ketua Program Studi Primatologi LlCl\.i;U~':;).\;<l\..Ulli:1l1 Pascasruj ana
Prof.Dr.drh. Dondin Sajuthi MSc
Judul Tesis : Isolasi dan Identifikasi Molekuler Virus Papilloma pada Macaca fascicularis dan Macaca nemestrina di Fasilitas Penangkaran Pusat Studi Satwa Primata Institut Pertanian Bogor
Nama : Isti Kartika Sari NIM : P053110031 Disetujui oleh Komisi Pembimbing Dr. dr. Irma H. Suparto, MS Ketua Diketahui oleh Dr. drh. Diah Iskandriati Anggota
Ketua Program Studi Primatologi
Prof.Dr.drh. Dondin Sajuthi MSc
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian ini adalah mengenai virus papilloma pada dua spesies satwa primata yang banyak di gunakan sebagai hewan model biomedis. Virus ini merupakan penyebab kanker serviks yang menyebabkan banyak kematian pada wanita.
Terimakasih yang sebesar-besarkan penulis ucapkan kepada Ibu Dr dr Irma H. Suparto, MS dan Ibu Dr drh. Diah Iskandriati selaku pembimbing yang sangat banyak memberikan arahan dan masukan berharga bagi penulis. Kepada bapak Dr Ir Dedy Duryadi S, DEA selaku penguji luar komisi serta atas bimbingannya. Juga kepada Prof drh Dondin Sajuthi, PhD, MST sebagai ketua program studi Primatologi atas kesempatan yang diberikan kepada penulis. Kepada Dr drh Joko Pamungkas MSc atas dana dan fasilitas laboratorium yang diberikan kepada penulis termasuk dispensasi waktu untuk menuntut ilmu. Ibu Profesor Supraptini Mansyur atas perbaikan dan masukkan untuka thesis saya. Kepada rekan-rekan tercinta: Maryati, Silmi, Mita, Uus, Dede, Dewiyanti, Sri, Sela, Tri, Iin, Elis, Permanawati, Suryo, Devy, Diah Pawitri, Ramdan, pak Budi, pak Dede, mbak Yanti dan Yana atas kerjasama dan diskusi yang sangat berharga. Ananda Rifqi R Sukmana atas editing gambarnya yang hebat. Ungkapan terima kasih juga disampaikan kepada suami tercinta, putri-putriku yang cantik Usi dan Dila serta ayah, mamah, ibu, beserta adik-adik tersayang, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2013
DAFTAR ISI
DAFTAR TABEL vi DAFTAR GAMBAR vi DAFTAR LAMPIRAN vi PENDAHULUAN 1 Latar Belakang 1 Tujuan Penelitian 2 Manfaat Penelitian 2 TINJAUAN PUSTAKA 2 Virus Papilloma 3 Patogenesis 4Virus papilloma pada Satwa Primata 5
Genus Macaca 7
METODE 8 Isolasi DNA virus dengan Teknik PCR Koleksi Sampel dan Kontrol Positif 8 Ekstraksi DNA dan PCR 8 Identifikasi DNA Virus 8
Perunutan Nukleotida 9
Analisis dan Pembuatan Pohon Filogenetik 10
HASIL DAN PEMBAHASAN 10
SIMPULAN DAN SARAN 21
Simpulan 21
Saran
DAFTAR PUSTAKA 22
LAMPIRAN 25
DAFTAR TABEL
1. Virus Papilloma pada Satwa Primata dan Homologinya dengan
Virus Papilloma Manusia 6
2. Hasil Pensejajaran Daerah L1 13
3. Indeks Kesamaan menurut CLUSTALW 2.1 15
4. Matriks Jarak berdasarkan Kimura2 Parameter 17
5. Matriks Jarak berdasarkan Kimura2 Parameter HPV Berbeda Genus 18
DAFTAR GAMBAR
1 Angka Kejadian HPV menurut Geografi 3
2 Organisasi Genetik HPV tipe 16 4
3 Lapisan epitel skuamosa serviks 5
4 Pohon Filogenetik Virus Papilloma 7
5 Genom Lengkap Virus Papilloma dan Daerah yang di Amplifikasi 9
6 Elektroforegram 10
7 Angka Kejadian Infeksi Virus Papilloma di Fasilitas Penangkaran
Pusat Studi Satwa Primata Institut Pertanian Bogor 11 8 Hasil Elektroferegram Sampel untuk Purifikasi 12
9 Hasil Pensejajran dengan CLUSTAL W 2.1 16
10 Pohon Filogenetik dari Virus Papilloma dengan Pembandingnya 17
DAFTAR LAMPIRAN
1 Hasil Pensejajaran Nukleotida 25
2 Hasil CLUSTAL W 2.1 27
PENDAHULUAN
Latar BelakangKanker serviks merupakan salah satu jenis kanker yang paling sering menyerang wanita, dan merupakan penyebab kematian terbesar kedua pada wanita, setelah kanker payudara. Angka kematian akibat serangan kanker serviks diseluruh dunia mencapai 50% dari seluruh kasus kanker serviks per tahun. Hampir 80% kejadian kanker serviks yang menyerang wanita tersebut terjadi di negara-negara berkembang. Saat ini di Asia tidak kurang dari 265 000 orang didiagnosa mengidap kanker serviks setiap tahunnya, sekitar 142 000 diantaranya kemudian mengakibatkan kematian. Menurut data WHO (2010), Indonesia memiliki jumlah penderita kanker serviks terbesar kedua setelah Cina. Angka kejadian kanker di Indonesia cukup tinggi, yaitu 100 kasus dari 100 000 orang. Setiap tahun terdapat 15 000 kasus baru dengan kematian sebanyak 8000 orang. Data diatas menunjukkan bahwa kanker serviks termasuk penyakit berisiko tinggi dan penyebab kematian pada wanita.
Kanker serviks pada manusia terutama disebabkan oleh virus papilloma manusia (Human Papilloma Virus/HPV) (Willyman 2011). Selain menyebabkan kanker serviks, HPV juga dapat menyebabkan berbagai jenis kutil pada tangan, kaki, lidah, mulut, dan bibir. Pada keadaan yang lebih ganas, HPV dapat menyebabkan kutil kelamin pada penis, vagina, dan dubur. Virus ini dapat menyebabkan pertumbuhan sel yang tidak normal yang disebut displasia. Kelainan ini akan berkembang menjadi anal intraepithelial neoplasia (AIN), kanker serviks (cervical cancer), atau kanker penis (Thoma 2010).
Virus ini menginfeksi membran mukosa dan kulit epitel pada vertebrata dengan cara menginduksi proliferasi sel. Selain pada manusia, virus papilloma juga telah diidentifikasi pada lebih dari 20 spesies mamalia yang berbeda serta pada burung dan reptil. Karena dianggap sangat penting secara medis, virus papilloma dipelajari dengan sangat intensif dan sampai saat ini telah ditemukan lebih dari 100 jenis virus papilloma (Bernard dan Chan 2007). Selama ini, pemahaman tentang biologi virus papilloma, khususnya untuk kepentingan manusia, terkendala oleh sulitnya mendapatkan hewan model serta hewan yang terinfeksi secara alami oleh virus papilloma manusia. Kemajuan penklonaan molekul genom virus papilloma pada awal tahun 1980 merupakan terobosan untuk mempelajari gen virus tersebut.
Ketersediaan sekuens genomik, baik yang lengkap maupun sebagian, dari berbagai tipe virus papilloma telah memungkinan pembentukan struktur taksonomi virus tersebut dan memberikan gambaran mengenai evolusi virus papilloma dengan inangnya. Virus papilloma terdeteksi pada berbagai jenis primata non-manusia, ada sekitar 30 jenis virus papilloma pada satwa primata antara lain berasal dari saluran genital M. fascicularis (monyet ekor panjang, MEP) dan M. mulatta (monyet rhesus) betina, hyperplasia lapisan epitel mulut dan tenggorokan simpanse kerdil dan kanker penis pada monyet rhesus jantan.
Satwa primata (Non-human Primate, NHP) khususnya MEP dan M. nemestrina (beruk) merupakan satwa primata yang banyak digunakan sebagai hewan
2
model. Kedua spesies satwa primata tersebut diketahui memiliki kedekatan anatomi dan fisiologi dengan manusia, sehingga merupakan hewan model yang ideal untuk mempelajari virus papilloma. Pengetahuan mengenai urutan genom pada virus papilloma dapat dimanfaatkan untuk pengembangan vaksin tidak hanya vaksin untuk pencegahan tetapi juga vaksin untuk pengobatan. Untuk pengujian kedua jenis vaksin tersebut dibutuhkan hewan model yang tepat dan dapat menjadi model penyakit yang mirip dengan manusia.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengisolasi dan mengidentifikasi jenis virus papilloma yang menginfeksi MEP dan beruk secara molekuler melalui conserve genom L1.
Manfaat Penelitian
Manfaat yang diharapkan dari penelitian ini memberikan informasi jenis virus papilloma yang menginfeksi MEP dan khususnya pada beruk yang belum pernah diisolasi dan dilaporkan sebelumnya. Informasi ini dapat digunakan untuk keperluan penelitian biomedis yang lebih lanjut dan pengembangan hewan model.
TINJAUAN PUSTAKA
Virus papilloma selalu dikaitkan dengan penyakit kanker serviks pada wanita. Meskipun tidak seluruh anggota dari keluarga virus ini merupakan penyebab kanker serviks, tetapi angka kematian yang disebabkan oleh kanker serviks merupakan yang terbesar kedua setelah kanker payudara. Oleh karenanya famili virus ini terus dipelajari dengan intensif. Badan kesehatan dunia (World Health Organization/WHO) telah mengeluarkan suatu panduan yang terus diperbaharui mengenai virus papilloma manusia dan kanker yang menyertainya. Hampir semua (99%) kanker serviks disebabkan oleh infeksi HPV. Virus ini dapat menginfeksi lapisan epitel kulit seluruh tubuh dan di daerah yang berselaput lendir, seperti mulut dan kelamin. Lebih dari 40 jenis HPV diketahui menginfeksi daerah kelamin (Moosavi et al. 2008). Berdasarkan tingkat keganasannya, HPV dibagi menjadi 2 tipe virus, yaitu tipe low-risk (risiko rendah) yang cenderung menyebabkan tumor jinak dan tipe high-risk (risiko tinggi) yang menyebabkan tumor ganas (Munoz et al.2003).
Menurut Paavonen et al. (2007), setiap tahun virus papilloma telah menyebabkan 500 ribu kasus baru infeksi di seluruh dunia, 250 ribu diantaranya menyebabkan kematian akibat kanker.serviks dan infeksi kanker vulva, vagina, anal, dan penis. Kejadian infeksi virus papilloma diseluruh dunia dapat dilihat pada Gambar 1 :
3
Gambar 1 Angka kejadian HPV menurut daerah geografi (Willyman 2011)
Gambar diatas menunjukkan bahwa kanker serviks tersebar di seluruh dunia, baik di negara maju maupun negara berkembang. Menurut buku panduan WHO (2010), terdapat banyak faktor yang menyebabkan begitu tingginya infeksi virus papilloma diantaranya adalah karena kondisi sosial ekonomi, pelayanan kesehatan masyarakat, serta tingkat pendidikan yang masih rendah. Selain itu, faktor penyebab lainnya adalah gaya hidup yang kurang sehat, seperti berganti pasangan seksual, melakukan hubungan seksual pada usia dini dan kebiasaan merokok. Karena berbagai alasan tersebut diatas, maka penelitian mengenai virus papilloma terus dilakukan secara intensif, baik untuk mengembangkan vaksin dan pengobatan; mempelajari struktur, evolusi, dan perkembangan virus serta untuk mempelajari epidemologi dan angka kejadian. Untuk melaksanakan berbagai penelitian tersebut, maka dibutuhkan hewan sebagai model pengganti yang sesuai.
Virus papilloma
Virus papilloma adalah virus DNA dari famili papillomaviridae. Virion papilloma tidak memiliki selubung, berdiameter 55 nm dan mempunyai kapsid ikosahedral. Virus ini memperbanyak diri pada inti sel serta menyebabkan infeksi laten yang kronis. Genom virus papilloma berbentuk sirkuler, ukuran panjangnya 8 kpb, mempunyai 8 jendela baca terbuka (open reading frame) dan dibagi menjadi gen early (E) dan late (L). Gen E menyintesis 6 protein E, yaitu E1, E2, E4, E5, E6, dan E7, yang banyak terkait pada proses replikasi virus dan onkogen. Sementara itu gen L menyintesis 2 protein, yaitu L1 dan L2 yang terkait pada pembentukan kapsid (Hakim2010). Gen L1 dan L2 menempati posisi yang berdekatan dan mencakup sekitar 40% dari keseluruhan genom virus.
Pada pertengahan tahun 1950-1960, virus papilloma dan virus polio melalui pengamatan dengan menggunakan mikroskop elektron, dimasukkan ke dalam famili Papoviridae berdasarkan kesamaan yang dimilikinya, yaitu genom sirkuler dari DNA untai ganda dan struktur simetris ikosahedral yang tidak memiliki selubung (ribu)
4
Pada sekitar tahun 1980, setelah teknik sekuensing ditemukan, ternyata diketahui adanya perbedaan, yaitu virus polio memiliki ukuran genom 5000 pasang basa, sedangkan virus papilloma memiliki ukuran genom 8000 pasang basa. Disamping ketidaksamaan tersebut, ternyata keduanya juga memiliki perbedaan dalam urutan asam amino, kecuali satu segmen yang homolog, yaitu gen E (de Villiers et al. 2004).
Gambar 2 Organisasi genetik HPV tipe 16. Genom berbentuk sirkular, molekul utas ganda DNA 7,904 pb. Gen –gennya adalah E1 s/d E7 , L1 dan L2 (Levine 1992).
Jendela baca terbuka (open reading frame) daerah (region) L1 yang mengkodekan bagian kapsid mayor merupakan daerah gen yang paling lestari dalam genom virus papilloma, dan telah digunakan untuk keperluan identifikasi jenis selama 15 tahun terakhir. Suatu tipe virus papilloma diakui sebagai virus baru apabila urutan genom pada daerah L1 berbeda 10% dari jenis virus papilloma terdekat. Jika perbedaannya antara 2%-10% akan dikategorikan sebagai sub-tipe dan apabila kurang dari 2% disebut sebagai varian (deVilliers et al 2004). Gen E meliputi sekitar setengah dari keseluruhan genom, ada beberapa gen yang tumpang tindih pada daerah ini. Diantara L1 dan E6 ada daerah yang tidak dikodekan oleh gen yang merupakan daerah asal replikasi serta elemen yang mengatur transkripsi. Daerah ini disebut sebagai LCR atau Long Control Region.
Patogenesis
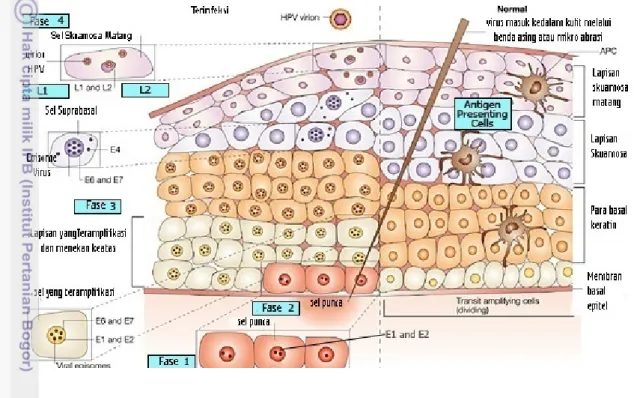
Ciri khusus dari replikasi virus papilloma adalah hubungan yang erat antara replikasi virion dengan perubahan sel epitel kulit. Infeksi dimulai dari virus yang masuk ke dalam sel melalui mikro abrasi jaringan permukaan epitel, sehingga memungkinkan virus masuk ke dalam sel basal. Pada sel basal, terutama sel punca, sel-sel ini terus membelah kemudian bermigrasi mengisi sel bagian atas, berdiferensiasi dan menyintesis keratin. Protein virus pada infeksi HPV mengambil alih perkembangan siklus sel dan mengikuti diferensiasi sel. Saat ini masih terdapat kontroversi mengenai mekanisme HPV masuk ke dalam sel. Sebagian bukti menunjukkan bahwa virus masuk ke dalam sel melalui reseptor α6-integrin dan
5 episom dan terjadi aktivasi promoter awal virus papilloma (gen E). Sintesis DNA virus terjadi di dalam sel yang terinfeksi dengan salinan episom sekitar 50-100 genom setiap sel. Setelah sel basal membelah, episom HPV mengalami replikasi dan didistribusikan diantara sel baru yang terbentuk. Virus akan mengikuti perjalanan sel dengan melakukan diferensiasi dan tetap aktif saat sel yang mengandung HPV berdiferensiasi, promoter akhir (gen L) teraktivasi dan membentuk kapsid, dan kemudian terbentuklah virion baru HPV hasil replikasi (Hakim 2010).
Gambar 3 Lapisan epitel skuamosa pada serviks dan ekspresi protein setelah infeksi virus papilloma (Frazer 2004)
Virus Papilloma pada Satwa Primata
Virus papilloma merupakan virus yang umum menginfeksi hewan dan manusia, banyak jenis hewan yang diketahui memiliki virus papilloma yang spesifik. Bos taurus (BPV/ Bovine papillomavirus), memiliki 12 tipe virus papilloma yang menginfeksi epitel kulit, penis, dan saluran pencernaan. Virus papilloma kuda (EqPV/Equine papillomavirus) menginfeksi bagian genital, kulit dan oral. Selain itu, virus papilloma terdapat pada berbagai spesies cervidae (rusa), anjing dan kucing serta banyak spesies hewan lainnya masing-masing memiliki virus papillomanya sendiri. Spesifitas spesies tersebut dimungkinkan karena adanya interaksi molekul yang sangat spesifik antara virus dan inangnya. Pada primata, spesifitas tersebut menjadi semakin nyata, yang berarti setiap primata memiliki virus papillomanya sendiri (Bernard dan Chan 2007). Virus papilloma primata yang telah diidentifikasi secara mikroskopis, imunologi dan molekuler, diantaranya:
Rhesus Monkey papillomavirus (RhPV) adalah virus papilloma asal satwa primata yang pertama kali dan satu-satunya yang diakui sebagai spesies oleh ICTV (International Committee on Taxonomy of Viruses), virus ini ditularkan secara
6
seksual dalam suatu koloni monyet rhesus. Sekuens virus papilloma spesifik telah dideteksi dari metastasis nodus limpa suatu sel tumor penis (penile squamous cell carcinoma) seekor monyet rhesus. Hasil analisisnya, berupa genom lengkap RhPV yang terintegrasi pada tumor ini dan memperlihatkan homologi yang tinggi dengan HPV 16 (91%).
Macaca fascicularis papillomavirus (MfPV) pertama kali dilaporkan pada tahun 1997. MfPV diidentifikasi berdasarkan daerah gen L1 dengan primer MY09/MY11, kemudian partikel virus papilloma dideteksi dari papilloma penis seekor MEP liar. Hasil histologi dari spesimen serviks dan vagina MEP menunjukkan adanya neoplasia intraepitel serta banyak yang menunjukkan lesi jinak papilloma pada vagina. MEP terinfeksi oleh 7 varian virus papilloma berdasarkan sekuens gen daerah L1.
Chimpanzee papillomavirus adalah virus papilloma ditemukan pada simpanse dan simpanse kerdil sehingga dinamakan Common Chimpanzee Papillomavirus (CCPV) dan Pygmy Chimpanzee Papillomavirus (PCPV). Keduanya memiliki kesamaan relatif 89% sebagai virus papilloma simpanse.
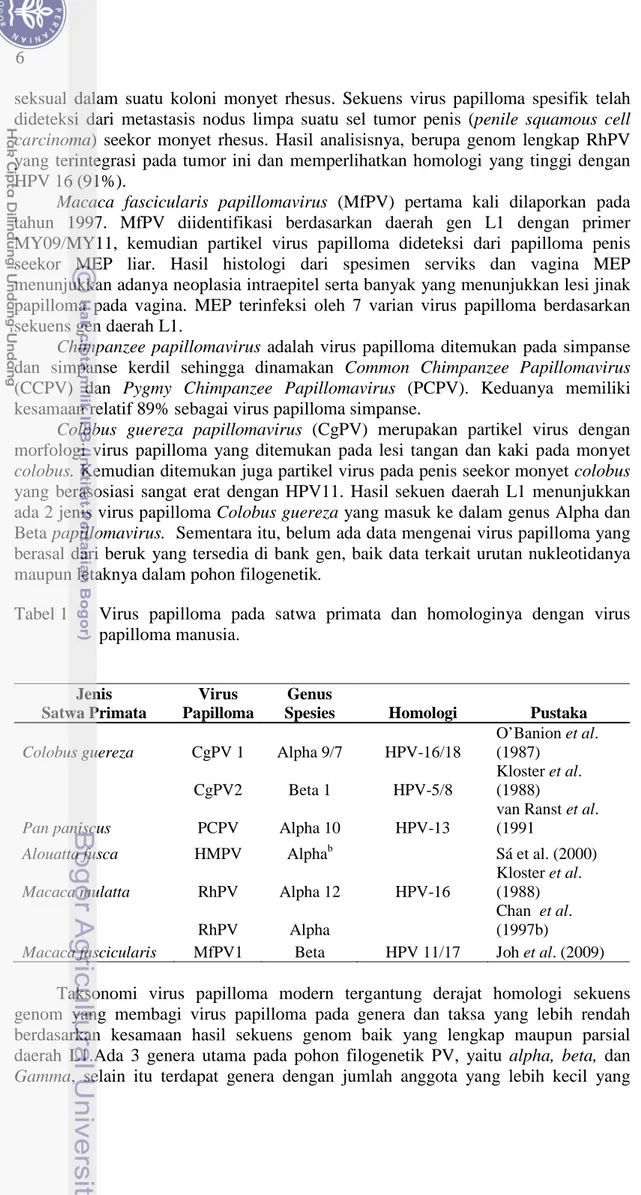
Colobus guereza papillomavirus (CgPV) merupakan partikel virus dengan morfologi virus papilloma yang ditemukan pada lesi tangan dan kaki pada monyet colobus. Kemudian ditemukan juga partikel virus pada penis seekor monyet colobus yang berasosiasi sangat erat dengan HPV11. Hasil sekuen daerah L1 menunjukkan ada 2 jenis virus papilloma Colobus guereza yang masuk ke dalam genus Alpha dan Beta papillomavirus. Sementara itu, belum ada data mengenai virus papilloma yang berasal dari beruk yang tersedia di bank gen, baik data terkait urutan nukleotidanya maupun letaknya dalam pohon filogenetik.
Tabel 1 Virus papilloma pada satwa primata dan homologinya dengan virus papilloma manusia. Jenis Satwa Primata Virus Papilloma Genus
Spesies Homologi Pustaka
Colobus guereza CgPV 1 Alpha 9/7 HPV-16/18
O’Banion et al. (1987)
CgPV2 Beta 1 HPV-5/8
Kloster et al. (1988)
Pan paniscus PCPV Alpha 10 HPV-13
van Ranst et al. (1991
Alouatta fusca HMPV Alphab Sá et al. (2000)
Macaca mulatta RhPV Alpha 12 HPV-16
Kloster et al. (1988)
RhPV Alpha
Chan et al. (1997b)
Macaca fascicularis MfPV1 Beta HPV 11/17 Joh et al. (2009)
Taksonomi virus papilloma modern tergantung derajat homologi sekuens genom yang membagi virus papilloma pada genera dan taksa yang lebih rendah berdasarkan kesamaan hasil sekuens genom baik yang lengkap maupun parsial daerah L1.Ada 3 genera utama pada pohon filogenetik PV, yaitu alpha, beta, dan Gamma, selain itu terdapat genera dengan jumlah anggota yang lebih kecil yang
7 dinamai berdasarkan alphabet Yunani seperti Omega. Lambda, Kappa, Sigma, Nu, Mu, Iota, Delta dan sebagainya. Untuk penamaan jenis PV disesuaikan dengan inangnya, ada yang berdasarkan nama ilmiah inangnya
Gambar 4 Pohon filogenetik virus papilloma (Bernard dan Chan 2007)
Genus Macaca
Genus macaca saat ini diketahui menjadi model paling penting dalam riset biomedis untuk berbagai penyakit pada manusia. Lebih dari 70 jenis penyakit infeksius dari berbagai etiologi seperti bakteri, virus, jamur, parasit dan prion yang telah dimodelkan oleh satwa primata. Keragaman yang luar biasa dari penyakit manusia meliputi penyakit anak-anak (children diseases), penyakit tropis, penyakit menular seksual, onkogenik, neurologis, penyakit degeneratif, penyakit berpotensi bioterorisme dan penyakit-penyakit lain yang belum diketahui menyebabkan penelitian terus dilakukan dan membutuhkan hewan model yang tepat (Gardner dan Luciw 2008).
Disamping manusia, macaca adalah genus dengan penyebaran tertinggi di bumi, tersebar dari Jepang hingga Afganistan. Sejauh ini terdapat 22 spesies (Voevodin dan Marx 2009) yang termasuk dalam genus macaca. Awalnya monyet rhesus atau M. mulatta yang banyak digunakan untuk penelitian biomedis, tetapi sejak pemerintah India menerapkan larangan untuk mengimpor hewan ini, maka MEP dan beruk yang jumlah dan populasinya banyak terdapat di Asia Tenggara, mulai digunakan sebagai hewan untuk penelitian. Oleh karena itu, berbagai aspek medis yang berkaitan dengan kedua spesies tersebut banyak dipelajari oleh para peneliti untuk dijadikan hewan model bagi penyakit manusia.
Dalam penelitian mengenai virus papilloma ditemukan bahwa sekitar 50% monyet rhesus di berbagai pusat penelitian primata terinfeksi oleh virus papilloma
8
yang menular melalui interaksi seksual (Ostrow et al.1990). Hasil analisis PCR pada sampel genital MEP dan monyet rhesus menunjukkan keduanya merupakan inang alami virus papilloma genital yang memiliki keragaman genetik yang mirip dengan virus papilloma pada manusia (Chan et al. 1997). Terdapat neoplasia epitel pada bagian vagina dan serviks MEP yang berasosiasi dengan virus papilloma, yang tidak ditemukan pda hewan lain (Wood et al. 2004).
METODE
Penelitian ini dilakukan melalui beberapa tahapan, yaitu pengambilan sampel, ekstraksi DNA sampel, amplifikasi dengan PCR, ekstraksi dari gel agarosa, perunutan nukleotida, dan analisis bioinformatika. Daerah yang diamplifikasi oleh primer adalah daerah L1 yang merupakan pembentuk kapsid mayor dari virus papilloma, merupakan daerah paling lestari dari genom virus dan telah digunakan untuk identifikasi jenis selama 15 tahun terakhir
Isolasi DNA Virus dengan Teknik PCR Koleksi sampel dan kontrol positif
Seluruh prosedur yang dilakukan terhadap hewan laboratorium ini telah disetujui oleh Komisi Pengawasan Kesejahteraan dan Penggunaan Hewan Penelitian Pusat Studi Satwa Primata IPB nomor 11-B006-IR. Ulasan serviks dikoleksi dari 238 ekor MEP dan 31 ekor beruk betina dewasa, dengan pertumbuhan gigi M3/M3 (setara dengan usia 6 tahun ke atas) yang dipelihara di fasilitas penangkaran Pusat Studi Satwa Primata IPB, Institut Pertanian Bogor. Pengambilan ulasan sampel dengan menggunakan vaginal cytobrush di daerah serviks dan vagina. Sample ini disimpan dalam media TEN Buffer (2 ml Tris HCl 1M pH 7.5; 0.2 ml EDTA 0.5M; 0.2 ml NaCl 5M dan 97.6 ml akuades) dan disimpan dalam suhu 4 oC sampai siap dilakukan pemeriksaan lebih lanjut.
Kontrol positif yang digunakan dalam penelitian ini adalah sel HeLa (ATCC CCL-2) yang dikembangkan dari jaringan kanker serviks. Sel ini merupakan sel lestari yang berasal dari kanker serviks dan jumlah sel yang digunakan untuk kultur jaringan sebanyak 5x106.
Ekstraksi DNA dan PCR
DNA dari sampel dan kontrol positif diekstraksi dengan menggunakan QIAmp DNA Blood mini kit (QIAGEN, Hilden, Germany) sesuai dengan petunjuk perusahaan. Primer yang digunakan dalam penelitian ini mengacu pada Chen et al (2009), yaitu Mac26. MY11 (forward) 5’ GCCCAAGGCCACAACAATGG3’ dan Mac26. MY09 (reverse) 5’ CGACCCAAGGGAAACTGGTC3’. Primer ini akan mengamplifikasi daerah L1 sebesar 450 pasang basa. Reagen mastermix PCR terdiri dari 1 µl (10 pmol) primer dan 12.5 µl Go Taq green mastermix (Promega) yang terdiri dari Taq DNA Polymerase 400 µM, dNTP konsentrasi 400 µM, MgCl 3 mM, bufer pereaksi,serta 5.5 µl free nuclease water dan 5 µl DNA hasil ekstraksi. Amplifikasi dilakukan dengan menggunakan mesin PCR Perkin Elmer tipe 9700 melalui tahapan pre PCR 95 ⁰C 3 menit, denaturasi 95 ⁰C 20 detik, annealing 55 ⁰C, ekstensi 72 ⁰C 20 detik dan post PCR 72 ⁰C selama 10 menit dengan 40 kali
9 pengulangan. Hasil amplifikasi DNA divisualisasikan pada gel agarosa konsentrasi 1.8% dan dibaca pada mesin geldock (Biorad) dengan menggunakan penanda DNA (Vivantis 100bp) sebesar 1000 pasang basa.
Gambar 5 Genom lengkap virus papilloma dan daerah yang diamplifikasi oleh primer Mac26 MY 11 dan Mac26 MY 09 (Molijn 2004).
Identifikasi DNA Virus Perunutan Nukleotida
Hasil positif PCR selanjutnya dipurifikasi untuk analisis runutan DNA. Pemotongan gel dilakukan pada bagian pita yang berpendar saat diradiasi oleh sinar ultraviolet. Potongan gel hasil amplifikasi kemudian dipurifikasi dengan menggunakan kit ekstraksi gel, sesuai dengan prosedur dari QIAquick gel extraction kit dari Qiagen (Qiagen, Hilden, Germany). Hasil purifikasi produk PCR tersebut selanjutnya dirunutkan di Macrogen Inc., Korea.
Analisis Runutan Nukleotida dan Pembuatan Pohon Filogenetik
Runutan nukleotida selanjutnya dianalisis dengan metode BLAST (Basic Local Alignment) dan disejajarkan menggunakan program komputer CLUSTALW 2.1, sedangkan jarak ditentukan dengan Kimura 2 parameter. Pohon filogenetik dikonstruksi menggunakan program Mega 5.1 dengan metode neighbor-joining. Sebagai pembanding untuk pohon filogenetik, diambil virus papilloma berasal dari bank gen. Analisis bootstrap 1000 kali untuk menvalidasi bentuk pohon filogenetik terbaik.
Sebagai pembanding digunakan Pan troglodytes papillomavirus tipe 2 protein kapsid mayor (Bank Gen: JF806547.1), Colobus monkey papillomavirustipe 1 protein kapsid mayor gen (L1), cds parsial, Bank Gen: U72629.1, Rhesus monkey papillomavirusstrain gen RhPV-e L1, cds parsial Bank Gen: U89660.1, Macaca fascicularis papillomavirusisolate MfAA18 protein kapsid mayor gen (L1), cds parsial Bank Gen: AF364496.1, Bovine papillomavirus tipe1 genom lengkap Bank Gen: X02346.1, Caretta caretta papillomavirus, genom lengkap Bank Gen:
10
EU493092.1, Canine oral papillomavirus genom lengkap Bank Gen: D55633.1, Equinepapillomavirus2, genom lengkap Bank Gen: EU503122.1, Rattus novergicus papillomavirus Bank Gen: GQ180114, Human papillomavirus Tipe 16 Bank Gen: AF548854.1 dan Sus scrofa papillomavirus Bank Gen: NC_011280.1.
Hasil dan Pembahasan
Isolasi DNA VirusPemilihan umur betina dewasa dilakukan berdasarkan pertimbangan bahwa hewan betina tersebut aktif secara seksual karena mikroabrasi pada dinding serviks biasanya terjadi saat aktivitas tersebut. Mikroabrasi mengakibatkan virus mudah masuk ke dalam lapisan basal epitel serviks. Aktivitas seksual juga mengakibatkan regenerasi sel epitel yang lebih cepat untuk menggantikan sel-sel epitel yang terbuang. DNA virus yang terdapat dalam sel epitel serviks diekstraksi dan diuji keberadaannya secara molekuler dengan teknik PCR.
Berdasarkan hasil PCR pada daerah L1 menunjukkan bahwa sampel yang positif terhadap virus papilloma, baik MEP maupun beruk, dapat teramplifikasi dengan baik oleh primer Mac26 MY11 dan Mac26 MY09. Hasil elektroforesis horizontal dengan gel agarosa 1.8% memperlihatkan gambaran pita yang jelas pada daerah 450 pasang basa, sejajar dengan kontrol positif virus papilloma dari DNA sel HeLa (Gambar 6).
Gambar 6 Elektroforegram terhadap 8 dari 238 sampel Macaca fascicularis (Mf) dan 3 dari 31 sampel Macaca nemestrina (Mn). (1) marker Vivantis 100 bp; (2), (5), (8) sampel negatif Mf; (3), (4), (6), (7) sampel positif Mf; (9) sampel negatif Mn; (10), (11), (12) sampel positif Mn; (13), (14) kontrol positif sel HeLa; dan (15) kontrol negatif Mastermix.
Daerah L1 yang berukuran sekitar 450 pasang basa merupakan wilayah yang membentuk kapsid mayor dari virus papilloma, protein tersebut akan diekspresikan pada akhir pembentukan virion yang terjadi pada lapisan superbasal kulit. Daerah ini
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
1000 pb
500pb
11 merupakan daerah yang paling lestari dalam genom virus serta menjadi wilayah konsensus (consensus region) untuk identifikasi suatu jenis virus. Primer MY ditujukan untuk menguatkan daerah nt 6582–7033 dan menghasilkan produk sebesar 450 pasang basa (Morris 2005). Primer MY09/011 digunakan secara luas untuk mempelajari sejarah alami virus papilloma dan perannya hingga menjadi kanker di daerah genital. Selanjutnya pasangan primer ini banyak digunakan untuk berbagai studi penting terkait kanker serviks dan HPV. Sensitivitas dan kemampuan primer ini untuk mendeteksi lebih dari 25 genotip virus papilloma yang menginfeksi saluran genital memberikan kesempatan yang sangat luas dan menjadikannya sebagai “standar emas” untuk deteksi virus papilloma. Primer ini terus dikembangkan untuk menambah sensitivitas dalam mendeteksi virus papilloma dan resistensinya terhadap pengaruh dari inang virus tersebut mengingat virus papilloma adalah virus yang sangat spesies spesifik.
Gambar 7 Angka kejadian infeksi virus papilloma pada monyet ekor panjang (M. fascicularis) dan beruk (M. nemestrina) di fasilitas penangkaran Pusat Studi Satwa Primata-Institut Pertanian Bogor ( jumlah seluruh sampel, jumlah sampel positif).
Berdasarkan hasil identifikasi virus dengan menggunakan teknik PCR pada sampel ulasan serviks, angka kejadian infeksi virus papilloma pada MEP di fasilitas penangkaran PSSP-IPB adalah 32.7% (78/238), sedangkan pada beruk adalah 12% (4/31) Wood et al. (2004) dalam laporannya menyampaikan bahwa identifikasi virus papilloma secara molekuler di fasilitas Wake Forest University sebesar 35% pada MEP betina dan 29% pada monyet rhesus betina. Menurut Chen et al (2007), angka kejadian infeksi virus papilloma pada MEP betina dewasa yang diimpor dari Cina dan Indonesia sebesar 24.9%. Secara deteksi molekuler pada M. mulatta, menurut laporan Ostrow et al. (1990) terdapat 29% hewan yang terinfeksi. Hasil perhitungan di fasilitas penelitian lain menunjukkan bahwa infeksi virus papilloma genital pada MEP dan M. mulatta berkisar pada angka 25 - 35%. Temuan dalam penelitian tersebut berada dalam kisaran yang sesuai dengan hasil penelitian di PSSP-IPB yang menunjukkan angka kejadian 32.7% pada MEP, pada beruk angka kejadian infeksi virus papilloma lebih kecil (12%).
Penelitian mengenai infeksi virus papilloma pada beruk belum pernah dilaporkan maka angka kejadian yang relatif kecil (12%) tersebut belum tentu menunjukkan angka kejadian infeksi yang sesungguhnya, baik di alam maupun di
12
penangkaran. Hal ini disebabkan karena jumlah sampel yang diambil lebih rendah dari jumlah sampel MEP.
Faktor lain yang dapat mempengaruhi angka infeksi virus adalah kondisi fasilitas hewan dapat dianggap sebagai fasilitas yang bersih dengan kondisi kesehatan hewan yang baik, serta pakan dan perawatan yang juga baik. Faktor-faktor tersebut dapat mengurangi resiko penularan virus. Kejadian infeksi di alam belum tentu menunjukkan angka yang mirip dengan kejadian di fasilitas penangkaran.
Hasil analisis PCR sampel ulas serviks dari monyet rhesus dan MEP menunjukkan bahwa kedua spesies tersebut merupakan induk semang alami dari virus papilloma genital yang memiliki kesamaan relatif dengan virus papilloma pada manusia. Neoplasia sel epitel yang berasosiasi dengan virus papilloma ditemukan pada 5% MEP yang ditangkarkan, sehingga pada monyet yang terinfeksi ditemukan kelainan sitologi yang mirip dengan kelainan pada manusia (Wood et. al. 2007). Kemiripan yang lain, yaitu cara penularan melalui hubungan seksual seperti yang terjadi pada koloni monyet rhesus dilaporkan oleh Ostrow et al. (1990). Sampai saat ini belum ada laporan mengenai gambaran sitologi dari monyet Indonesia yang terinfeksi virus papilloma, kedepannya perlu dilakukan analisis sitologi dari hewan-hewan yang terinfeksi diatas untuk menambah informasi mengenai patogenesis virus papilloma pada MEP dan beruk.
Gambar 8 menunjukkan elektroforegram hasil perbanyakan sampel positif yang akan dipurifikasi untuk mendapatkan runutan nukleotida melalui proses perunutan
Mf 7616 Mf AB543 Mn 9439 Mn 5434 Gambar 8 Hasil elektroforesis sampel positif untuk purifikasi gel
Perunutan nukleotida adalah suatu proses penentuan urutan nukleotida pada suatu fragmen DNA. Pengetahuan akan runutan nukleotida dari suatu gen atau genom akan sangat bermanfaat untuk memahami cara kerja gen dan protein dalam mempengaruhi aktivitas pada suatu organisme. Pada virus papilloma, perbedaan urutan nukleotida di daerah E-6 dan E-7 dapat mempengaruhi keganasan jenis virus papilloma tersebut, sementara perbedaan di daerah L1 dapat mempengaruhi jenis dan klasifikasinya. Tujuan dari runutan dalam penelitian ini adalah untuk mengetahui jenis virus papilloma yang menginfeksi kedua jenis macaca yang dipelihara di fasilitas hewan PSSP-IPB serta mengetahui kedudukannya dalam pohon filogenetik.
13 Virus papilloma adalah salah satu jenis virus yang banyak dipelajari dan memiliki kekhususan spesies yang sangat tinggi. Hingga saat ini terdapat lebih dari 100 tipe virus papilloma yang telah tercatat. Virus papilloma pada genus macaca yang telah banyak dipelajari berasal dari MEP dan M. mulatta. Macaca fascicularis papillomavirus (MfPV) terbagi atas 11 tipe, yaitu MfPV1 sampai dengan MfPV11. Virus MfPV 1 dan MfPV2 termasuk dalam genus Beta Papillomavirus, sedangkan sisanya MfPV3 hingga MfPV11 termasuk genus Alpha Papillomavirus (Bernard 2010).
Hasil perunutan nukleotida virus papilloma MEP dan beruk pada penelitian ini selanjutnya dibandingkan dengan runutan nukleotida virus papilloma yang ada di bank gen menggunakan program BLAST dan NCBI (National Centre for Biotechnology Information) dan hasilnya ditampilkan pada Tabel 2
Tabel 2 Hasil pensejajaran daerah L1 sampel dibandingkan tingkat homologinya dengan tipe virus papilloma yang ada di Bank Gen
Sampel % Tipe Papilloma Nomor Akses
Mf AB411 83% Macaca fascicularis papillomavirus tipe 7
Mac 18 genom lengkap EF 558838.1
84%
Rhesus papillomavirus stran a-L1 parsial
CDS U89656.1
Mf AB4847 99% Macaca fascicularis papillomavirus tipe 4
Mac 54 genom lengkap EF 558841.1
76% Macaca fascicularis papillomavirus tipe
52 Isolat QU07294 genom lengkap EF 558841.1
Mf 7616 100% Macaca fascicularis papillomavirus tipe 3
Mac 52 genom lengkap EF 558839.2
98% Macaca fascicularis papillomavirus tipe
36 Isolat MOC 171 genom lengkap EF 591299.1
Mf AB453 98% Macaca fascicularis papillomavirus tipe 9
Isolat Mac 592 genom lengkap EU 490516.1
87% Macaca fascicularis papillomavirus tipe 5
Mac 76 genom lengkap EF 558843.1
Mn 9439 83% Macaca fascicularis papillomavirus tipe 5
Mac 76 genom lengkap EF 558843.1
82% Macaca fascicularis papillomavirus tipe 9
isolat genom lengkap EU 490576.1
Mn 5434 99% Macaca fascicularis papillomavirus tipe 4
Mac 54 genom lengkap EF 558841.1
76% Human papillomavirus tipe 52 isolat 7294
genom lengkap HQ 537751.1
Perbandingan deduksi urutan asam amino dari L1 kapsid virus papilloma sampel menunjukkan kemiripan yang sangat tinggi, yaitu antara 76-100% dengan
14
virus papilloma MEP yang telah diidentifikasi sebelumnya. Ada beberapa tipe virus papilloma MEP yang menginfeksi sampel, yaitu MfPV tipe 3, 4, 5, 7, dan 9. Virus papilloma yang menginfeksi beruk adalah jenis yang sama dengan virus papilloma yang menginfeksi MEP dengan kemiripan antara 82-99% berdasarkan daerah L1. Untuk lebih menjelaskan jenis virus papilloma yang menginfeksi beruk maka perlu dilakukan identifikasi keseluruhan genom virus tersebut, karena untuk menentukan jenis virus tersebut diperlukan identifikasi urutan nukleotida yang lebih lengkap.
Hasil analisis data menunjukkan informasi yang menarik, yaitu virus papilloma yang menginfeksi Mn 5434 memiliki homologi 76% dengan virus papilloma pada manusia tipe 52. HPV tipe 52 adalah jenis yang berisiko tinggi untuk menjadi kanker serviks. Saat ini, penelitian untuk vaksin dan pencegahan kanker serviks lebih banyak ditujukan pada HPV tipe 16 dan 18. Menurut hasil penelitian Takehara et al. (2011), HPV tipe 16 dan 18 paling banyak terjadi di Asia, Afrika Utara, Eropa dan Amerika Utara, sedangkan di wilayah Asia Timur, meliputi Jepang dan Cina, kanker serviks yang paling banyak terjadi diakibatkan oleh HPV tipe 52 dan 58. Lin et al. (2006) melaporkan hasil identifikasi jenis HPV berisiko tinggi pada 4383 wanita di Hongkong dan Taiwan Selatan sebesar 63% adalah tipe 52 dan 58, sedangkan tipe 16/18 hanya menginfeksi 30%. Dengan demikian, prospek dimasa depan sangat terbuka kemungkinan untuk pengembangan vaksin HPV yang berasal dari HPV tipe 52 dan 58 (Lin et al 2006).
HPV tipe 52 dan 58, keduanya berhubungan erat dengan HPV tipe 33, yang terkait erat dengan HPV 16. HPV tipe 52 telah diisolasi dan diklona dari berbagai sumber antara lain displasia serviks di Amerika Serikat dan kanker serviks invasif di Jepang dan Indonesia. HPV58 telah diklon dari jaringan kanker serviks seorang wanita Jepang. HPV 16, HPV 33, HPV 52, dan HPV 58 semuanya dikelompokkan bersama-sama pada satu cabang pohon filogenetik HPV yang menunjukkan kesamaan dalam potensi patogen mereka sebagai virus papilloma berisiko tinggi penyebab kanker serviks.
Sejalan dengan pesatnya perkembangan teknik-teknik dalam biologi molekuler, seperti PCR dan perunutan DNA, maka penggunaan runutan DNA dalam penelitian filogenetika juga meningkat dengan pesat dan telah dilakukan pada semua tingkatan taksonomi, misalnya famili, marga, dan spesies. Filogenetika molekuler mengkombinasikan teknik biologi molekuler dengan statistik untuk merekonstruksi hubungan antar mahluk hidup. Pemikiran dasar penggunaan sekuen DNA dalam studi filogenetika adalah terjadinya perubahan basa nukleotida menurut waktu, sehingga akan dapat diperkirakan kecepatan evolusi yang terjadi dan akan dapat direkonstruksi hubungan evolusi antara satu kelompok organisme dengan yang lainnya. Beberapa alasan digunakannya sekuen DNA, antara lain (1) DNA merupakan unit dasar informasi yang mengkode organisme; (2) relatif lebih mudah untuk mengekstrak dan menggabungkan informasi mengenai proses evolusi suatu kelompok organisme, sehingga mudah untuk dianalisis; (3) peristiwa evolusi secara komparatif mudah untuk dibuat model; dan (4) menghasilkan informasi yang banyak dan beragam, dengan demikian akan ada banyak bukti tentang kebenaran suatu hubungan filogenetik. Sekuen DNA telah menarik perhatian para praktisi taksonomi dunia untuk dijadikan karakter dalam penelitian karena menawarkan data yang akurat melalui pengujian homologi yang lebih baik terhadap karakter-karakter yang ada dan sekuen DNA telah terbukti menghasilkan sebuah hubungan kekerabatan yang lebih alami (Hidayat dan Pancoro 2006).
15 Sejak ditemukannya teknik perunutan DNA, telah lebih dari 100 tipe virus papilloma baru ditemukan (Bernard dan Chan 2007). Virus papilloma termasuk ke dalam famili Papillomaviridae yang kemudian dibagi menjadi beberapa tipe sesuai dengan spesies inang yang ditumpanginya, misalnya HPV pada manusia, MfPV pada monyet ekor panjang, RhPV, dan sebagainya. Dengan sistem klasifikasi terbaru, virus papilloma terbagi menjadi beberapa genus, seperti Alpha papillomavirus, Beta papillomavirus, Delta papillomavirus, dan Lambda papillomavirus.
Hasil pensejajaran nukleotida virus papilloma asal MEP dan beruk dilakukan dengan menggunakan program CLUSTALW 2.1dan hasilnya ditunjukkan pada Gambar 9. Berdasarkan pensejajaran terdapat kemiripan yang cukup tinggi antar virus-virus isolat tersebut dengan kesamaan mencapai 88.5%. Hal ini ditunjang pula dengan hasil pohon filogenetik yang menggambarkan semua isolat hasil penelitian ini berada pada satu kelompok cabang pohon.
Hasil analisis dengan CLUSTALW 2.1 menunjukkan bahwa angka kesamaan tertinggi (similarity) adalah antara sampel MfAB411 dan MfAB453 (Tabel 3).
Tabel 3 Indeks kesamaan menurut CLUSTALW 2.1 Indeks
kesamaan MfAB4847 Mf7167 MfAB411 MfAB453 Mn5434 Mn9349
MfAB4847 88.5321 66.2844 66.2844 84.8624 67.8899 Mf7167 88.5321 66.2844 66.2844 84.8624 67.8899 MfAB411 66.2844 66.2844 86.6972 72.0183 66.5138 MfAB453 66.2844 66.2844 86.6972 72.0183 66.5138 Mn5434 84.8624 84.8624 72.0183 72.0183 66.9725 Mn9349 67.8899 67.8899 66.5138 66.5138 66.9725
Angka kesamaan (homologi) yang cukup tinggi pada sekuens virus papilloma daerah L1 yang berasal dari fasilitas penangkaran PSSP-IPB. Hal ini sesuai dengan hasil dari pohon filogenetik yang menempatkan seluruh sampel pada satu kelompok (cluster)
Jarak evolusi antar virus papilloma dilihat dari perubahan runutan nukleotida dihitung berdasarkan Kimura2 Parameter , dimana perubahan transversi dan transisi dirubah menjadi matriks jarak dan dihitung, semakin sedikit perbedaan antar dua runutan maka jarak yang diperoleh semakin kecil. Karena runutan nukleotida yang sama dianggap berasal dari nenek moyang yang sama. Dua runutan yang terdekat disebut sebagai tetangga (neighbour) . Matriks jarak memperlihatkan besarnya perubahan runutan nukleotida antara spesies yang dibandingkan (table 4). Semakin kecil nilai nilainya semakin dekat kekerabatan antara spesies tersebut. Matriks jarak juga menunjukkan panjang cabang dari pohon filogenetik, dimana panjang cabang adalah nilai matriks jarak dibagi 2.
16
CLUSTALW 2.1multiple sequence alignment
MfAB411 AACCAGGTGTGTCCTACTGTGGTGGATACTACCAGAAGGCACAAACATGACACTCTGTGC MfAB453 AACCAGGTGTGTCCTACTGTGGTGGATACTACCAGAAGGCACAAACATGACACTCTGTGC MfAB4847 AACCAGGTATTCCTTACTGTTGTAGATACCACTACGAGAGCCCAATATGACGCTCTGTGC Mf7167 AACCAGGTATTCCTTACTGTTGTAGATACCACTACGAGAGCCCAATATGACGCTCTGTGC Mn5434 AACCAGGTGTTCCTCACTGTTGTAGATACCACTAGAAGGCACCAATATGACGCTCTGTGC Mn9349 AACCAAGTATTTCTTACTGTTGTGGATACAACTAGAAAGCACTAATATGACGCTATGTGC *****.**.* * ***** **.***** ** * .*.. .* ** *****.**.***** MfAB411 AGCCACAAACGCTTTAGATGGCACTTATAAAAATGAAAATTTTAAAGAGTACCTGCGCCA MfAB453 AGCCACAAACGCTTTAGATGGCACTTATAAAAATGAAAATTTTAAAGAGTACCTGCGCCA MfAB4847 TGCCACAAACACAGCTGAACAGACATATAAAAACGAAAATTTTAAGGAATATTTGCGCCA Mf7167 TGCCACAAACACAGCTGAACAGACATATAAAAACGAAAATTTTAAGGAATATTTGCGCCA Mn5434 TGCCACAAACACCGCTGAACAGACATATAAAAACGAAAATTTTAAGGAATATTTGCGCCA Mn9349 AGCAACAAATGCAGCAGAGCAGACATATAAGAATGATAATTTTAAAGAGTACTTGCGTCA :**.***** .* :** . **:*****.** **:********.**.** **** ** MfAB411 CGTGGAAGAATATGACTTGCAATTTATCTTTCAATTGTGCAAAATAACTCTCACTACTGA MfAB453 CGTGGAAGAATATGACTTGCAATTTATCTTTCAATTGTGCAAAATAACTCTCACTACTGA MfAB4847 TGTAGAGGAGTTTGACCTGCAATTTATTTTTCAACTATGCAAAATCACTCTCACTACAGA Mf7167 TGTAGAGGAGTTTGACCTGCAATTTATTTTTCAACTATGCAAAATCACTCTCACTACAGA Mn5434 TGTAGAGGAGTTTGACCTGCAATTTATTTTTCAACTATGCAAAATCACTCTCACTACAGA Mn9349 CGTGGAAGAATATGACCTCCAGTTTATGTTTCAACTGTGCAAAATTACCCTAACAACAGA **.**.**.*:**** * **.***** ****** *.******** ** **.**:**:** MfAB411 TGTTATGGCCTACATTCACAGCATGGATGCCAGCATCCTGGGAGGACTGGAACTTTGGAT MfAB453 TGTTATGGCCTACATTCACAGCATGGATGCCAGCATCCTGGGAGGACTGGAACTTTGGAT MfAB4847 TGTTATGGCATACATACATGGCATGGATGCTGGCATTTTAGGAGGACTGGAATTTTGGGC Mf7167 TGTTATGGCATACATACATGGCATGGATGCTGGCATTTTAGGAGGACTGGAATTTTGGGC Mn5434 TGTTATGGCATACATACATGGCATGGATGCTGGCATTTTAGGAGGACTGGAATTTTGGGC Mn9349 GGTAATGGCATACATACACAACATGGATGCTAACATTTTGGGAGGATTGGAATTTTGGGT **:*****.*****:** ..********* ..*** *.****** ***** *****. MfAB411 TGCAGCCCCCTCCGTCCGGGACTTTGCAGGACACCTATAGGTTTGTTTACCTCTGCTGCC MfAB453 TGCAGCCCCCTCCGTCCGGGACTTTGCAGGACACCTATAGGTTTGTTTACCTCTGCTGCC MfAB4847 TGCAGCCCCCTCCTTCTGGCACCTTGGAGGATACGTACCGCTTTGTTTACCTCAGCTGCC Mf7167 TGCAGCCCCCTCCTTCTGGCACCTTGGAGGATACGTACCGCTTTGTTTACCTCAGCTGCC Mn5434 TGCACCCCCCTCCTTCTGGCACCTTGGAGGATACCTACCGCTTTGATTACCTCAGCTGCC Mn9349 TGCAGCCCCCCCCCTCTGGCACTTTGGAGGACACTTACAGATTTGTTTACCTCTGCTGCT **** ***** ** ** ** ** *** **** ** ** .* ****:*******:***** MfAB411 ATTACATGTCAAAAAAACGCCCCCCCTAAAGAAAAAGAAGACCCCCTGGATAAGTATACA MfAB453 ATTACATGTCAAAAAAACGCCCCCCCTAAAGAAAAAGAAGACCCCCTGGATAAGTATACA MfAB4847 ATTACATGTCAGAAAAATGCGCCCCCCAAGGAAAAGGTGGACCCCCTGGATCAGTATACA Mf7167 ATTACATGTCAGAAAAATGCGCCCCCCAAGGAAAAGGTGGACCCCCTGGATCAGTATACA Mn5434 ATCACATGTCAGAAAAATCCCCCCCCCAAGGAAAAGGTGCACCCCCTGGATCATTATACA Mn9349 ATTACCTGTCAAAAGAATACGCCCCCCAAGGAAAAGGTTGACCCCCTAAATCAGTTTACA ** **.*****.**.** * ***** **.*****.*: *******..**.* *:**** MfAB411 TTTTGGGATGTAAATTTAAAAGAAAAATTTTCTGCTGACTTAGACCAGTTTCCCTTGGGT MfAB453 TTTTGGGATGTAAATTTAAAAGAAAAATTTTCTGCTGACTTAGACCAGTTTCCCTTGGGT MfAB4847 TTTTGGGAAGTAGACCTAAAAGAAAAGTTTTCTGCAGATTTAGACCAGTTTCCCTTCCGA Mf7167 TTTTGGGAAGTAGACCTAAAAGAAAAGTTTTCTGCAGATTTAGACCAGTTTCCCTTCCGA Mn5434 TTTTGGGAAGTACACCTAAAAGAAAAGTTTTCTGCAGATTTAGACCAGTTTCCCTTGGGT Mn9349 TTCTGGGATGTAGATTTAAAGGAAAAATTTTCAGCTGATTTGGACCAGTTTCCCTTGGGT ** *****:*** * ****.*****.*****:**:** **.************** *: MfAB411 CGAAGACAACGAGGGC MfAB453 CGAAGACAACGAGGGC MfAB4847 CGAAGACAACGAGGGC Mf7167 CGAAGACAACGAGGGC Mn5434 CGAAGACAACGAGGGC Mn9349 CGAAGACAACGAGGGC
17 Tabel 4 Matriks Jarak berdasarkan Kimura2 Parameter
1 2 3 4 5 6 7 8 9 10 11 12 13 MfPV tipe 9 MfPV tipe 7 0.35 MfPV tipe 5 0.72 0.25 MfPV tipe 4 0.56 0.26 0.43 MfPV tipe 3 0.33 0.28 0.31 0.42 Mf AB4847 0.46 0.22 0.37 0.97 0.33 Mf 7167 0.46 0.22 0.37 0.97 0.33 n.a MfAB411 0.5 0.39 0.83 0.68 0.43 0.5 0.5 MfAB453 0.5 0.39 0.83 0.68 0.43 0.5 0.5 n.a Mn5434 0.45 0.22 0.37 0.42 0.34 0.2 0.2 0.58 0.58 Mn9349 0.38 0.3 0.42 0.7 0.26 0.55 0.55 0.43 0.43 0.53 HPV 16 0.37 0.43 0.42 0.37 0.28 0.31 0.31 0.32 0.32 0.32 0.4 Pan 0.36 0.47 0.42 0.42 0.54 0.34 0.34 0.35 0.42 0.42 0.3 0.32
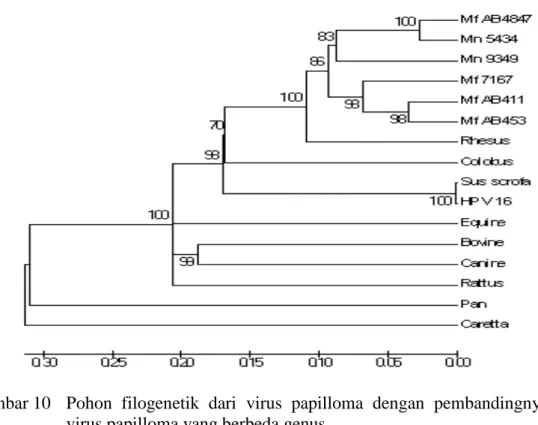
Selanjutnya dilakukan analisis dengan menggunakan pohon filogenetik untuk membandingkan antara sampel yang berasal dari fasilitas hewan PSSP dengan Macaca fascicularis papilloma virus yang berasal dari bank gen.
Dari hasil penghitungan dengan matriks jarak berdasarkan Kimura-2 parameter, terlihat bahwa jarak antara spesies-spesies diatas sangat dekat, yang berarti bahwa berdasarkan daerah L1 tidak ada perbedaan tipe virus papilloma baru.
Gambar 10 Pohon filogenetik dari virus papilloma dengan pembandingnya dari bank gen
Pohon filogenetik dari virus papilloma asal MEP baik yang berasal dari sampel dengan MfPV pembandingnya yang berasal dari bank gen menunjukkan bahwa semua MfPV mempunyai kekerabatan yang cukup dekat. Angka boostrap yang
18
tinggi menunjukkan bahwa posisinya sudah tidak akan berubah lagi, sedangkan angka boostrap yang rendah menunjukkan bahwa letak MfPV masih dapat berubah.
Perbandingan antara virus papilloma yang berasal dari sampel dengan beberapa virus papilloma yang berasal dari genus yang berbeda yang berasal dari bank gen, dilakukan dengan menggunakan Kimura2 Parameter. Hasilnya menunjukkan seluruh virus pailloma yang berasal dari asilitas hewn PSSP-IPB memiliki jarak genetic yang sangan dekat dan ini mendukung hasil analisis CLUSTALW 2.1 yang menunjukkan homologi yang besar antara virus-virus di fasilitas ini.
Tabel 5 Matriks Jarak berdasarkan Kimura2 parameter antara virus papilloma yan berbeda genus 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 1 Bovine 2 Caretta 0.3 3 Canine 0.17 0.33 4 Equine 0.16 0.37 0.16 5 Rattus 0.2 0.33 0.21 0.18 6 Pan 0.24 0.28 0.21 0.56 0.16 7 Colobus 0.25 0.48 0.17 0.16 0.16 0.49 8 Rhesus 0.22 0.34 0.15 0.14 0.17 0.3 0.21 9 MfAB4847 0.2 0.33 0.17 0.15 0.15 0.27 0.23 0.29 10 Mf7167 0.23 0.26 0.15 0.17 0.17 0.31 0.21 0.39 0.33 11 MfAB411 0.2 0.37 0.14 0.15 0.19 0.26 0.26 0.32 0.45 0.35 12 MfAB453 0.2 0.41 0.14 0.16 0.17 0.28 0.22 0.21 0.37 0.25 0.28 13 Mn9349 0.2 0.3 0.15 0.17 0.13 0.33 0.27 0.22 0.42 0.21 0.31 0.25 14 Mn5434 0.19 0.42 0.15 0.15 0.17 0.31 0.22 0.23 0.32 0.35 0.49 0.38 0.44 15 Sus scrofa 0.21 0.32 0.19 0.17 0.21 0.21 0.3 0.26 0.31 0.26 0.31 0.23 0.25 0.21 16 HPV16 0.2 0.31 0.19 0.17 0.21 0.21 0.3 0.25 0.31 0.25 0.31 0.22 0.24 0.21 0
Kontruksi pohon filogenetik dibuat dengan metode neighbour-joining, yaitu salah satu cara pembentukan pohon filogenetik yang mengacu pada pemilihan nodus terdekat. Data yang diperoleh akan dikompresi menjadi matriks jarak dan terus dilakukan berulang-ulang sampai terbentuk pohon filogenetik terbaik. Pengulangan bootstrap ditujukan untuk menguji kebenaran dengan pengulangan perhitungan statistik
19
Gambar 10 Pohon filogenetik dari virus papilloma dengan pembandingnya dari virus papilloma yang berbeda genus
Hasil analisis seluruh sampel yang berasal dari fasilitas hewan PSSP-IPB berada dalam satu cluster menunjukkan bahwa mereka dekat secara kekerabatan dan masih saling berhubungan. Seluruh sampel yang berasal dari Fasilitas Penangkaran PSSP-IPB berada dalam famili Papillomaviridae dan genus Alpha papillomavirus bersama dengan virus papilloma dari monyet rhesus. Genus Alpha papillomavirus adalah genus terbesar dalam klasifikasi virus papilloma merupakan penyebab lesi/kutil pada lapisan epitel mukosa maupun kulit, terdiri dari virus papilloma yang berisiko tinggi dan rendah (high risk-low risk) berdasarkan data molekulernya. Termasuk dalam genus ini, adalah HPV tipe 16, 31, 33, 35, 52, 58, dan 67 yang merupakan penyebab kanker serviks pada manusia.
Sementara itu papillomavirus pembanding berasal dari genus yang berbeda, Equine virus papilloma-2 berasal dari genus Dyoiota, Bovine virus papilloma- 1 genom lengkap berasal dari genus Delta virus papilloma, Canine virus papilloma berasal dari genus Lambda dan sebagainya. Selain itu, virus papilloma yang berasal dari primata non-manusia membentuk cabang tersendiri yang terpisah dari virus papilloma lainnya, menunjukkan kekerabatan yang dekat dari inang mereka. Pohon filogenetik tersebut juga menunjukkan bahwa virus papilloma yang berasal dari Pan troglodytes (Chimpanzee) berada cukup jauh dengan virus papilloma dari satwa primata lainnya. Menurut Bernard et al (2006), pohon filogenetik virus papilloma terbentuk dari dua cabang utama yang disebut supergrup, yaitu virus papilloma genital dan virus papilloma epidermis. Virus papilloma genital menginfeksi daerah genital dan dapat berkembang menjadi kanker serviks, sedangkan virus papilloma epidermis menginfeksi daerah epidermis dan dapat berkembang menjadi kanker kulit. Sementara itu, virus papilloma chimpanse (ChPV) dan pigmi chimpanse (PCPV) membentuk cabang kecil tersendiri bersama HPV-6, HPV-11 dan HPV-13. Sesuai dengan hasil pensejajaran dengan CLUSTALW 2.1 M. fascicularis 4847 (Mf
20
4847) dan M. nemestrina 5434 (Mn 5434), pada pohon filogenetik diatas kedua hewan ini memilik tipe virus papilloma yang sama. Hal ini bisa disebabkan karena kedua virus tersebut berasal dari nenek moyang yang sama atau karna daerah yang di sejajarkan baru sebagian yaitu 450 dari 8000 pasangan basa pembentuk virus papilloma.
Dalam pohon filogenetik ini juga di bandingkan virus papilloma yang berasal dari spesies-spesie yang berbeda cukup jauh dari primata dan hasilnya cukup menarik. Virus papilloma yang berasal dari kulit sejenis penyu laut Caretta caretta berada cukup jauh dengan virus papilloma primata dalam pohon filogenetik ini, menunjukkan kekerabatannya jauh dengan virus papilloma genital primata. Sedangkan virus papilloma babi (Sus scrofa papillomavirus /SsPV),memiliki kesamaan yang sangat dekat dengan HPV tipe 16. Virus papilloma ini diisolasi dari kulit sehat babi, SsPV memiliki kedekatan yang cukup besar dengan HPV tipe 16 yang merupakan virus papilloma genital pada manusia yaitu 98,8% (Stevens et al, 2008) sehingga letaknya dalam pohon filogenetik sangat dekat dengan genus Alphapillomavirus. Meskipun demikian ada perbedaan mendasar yaitu virus papilloma pada babi tidak memiliki daerah baca terbuka E7, sehingga secara keseluruhan virus papilloma pada babi berbeda dengan virus papilloma pada manusia.
Dari hasil analisis diatas, secara molekuler penggunaan satwa primata dapat menjadi model bagi penyakit kanker serviks. Karena kemajuan teknik PCR telah memungkinkan penapisan dengan cepat hewan yang terinfeksi atau tidak. Analisis hasil PCR dari virus papilloma genital M. fascicularis betina menunjukkan bahwa mereka merupakan inang alami dari virus papilloma genital yang terkait dan memiliki keragaman genetik yang mirip dengan HPV (Chan et al. 1997) Selain itu MEP juga menunjukkan gejala-gejala seperti penebalan sel epitel pada lapisan skuamosa serviks dan vagina, terjadinya kanker/karsinoma serviks dan penis dan terjadi transmisi virus karena hubungan seksual seperti yang terjadi pada manusia, menunjukkan bahwa genus macaca dapat menjadi model yang berharga untuk mempelajari HPV (Gardner 2008). Adanya kaitan yang erat antara PV yang menginfeksi macaca seperti RhPV-1 yang identik dengan HPV 16. Sedangkan pada penelitian ini HPV yang menginfeksi Mn5434 ternyata memiliki kemiripan dengan HPV 52 yang merupakan HPV berisiko tinggi menjadi kanker serviks semakin memberikan nilai tambah penggunaan macaca untuk penelitian kanker serviks. HPV tipe 52 merupakan prospek ke depan pengembangan vaksin HPV karena banyak menyerang wanita di kawasan Asia Timur.
21
Simpulan dan Saran
Simpulan
Hasil penelitian ini menunjukkan terdapat 5 tipe virus Macaca fascicularis Virus Papilloma (MfPV) yang menginfeksi kedua spesies macaca di fasilitas Penangkaran Pusat Studi Satwa Primata, Institut Pertanian Bogor, yaitu MfPV tipe 3, 4, 5, 7, dan 9 dengan kemiripan antara 76% - 100% dan termasuk dalam genus Alpha papillomavirus. Tidak ada virus papilloma spesifik yang menginfeksi beruk berdasarkan daerah L1, karena menurut urutan sekuens nukleotidanya memiliki kemiripan antara 82% - 99% dengan virus papilloma yang menginfeksi MEP. Prevalensi infeksi virus papilloma di fasilitas hewan PSSP-IPB adalah sebesar 32.7% pada MEP (78/238) dan 12% (4/31) pada beruk. Isolasi dan identifikasi jenis virus papilloma pada beruk ini merupakan laporan pertama.
Saran
Perlu dilakukan penelitian lebih lanjut mengenai jenis virus papilloma yang menginfeksi MEP dan beruk terutama genom lengkapnya beruk yang belum tersedia di bank gen. Sebagai negara yang kaya akan sumber daya alam satwa primata, Indonesia dapat berperan dalam penelitian bidang penyakit dan obat-obatan khususnya virus papilloma, penelitia ini menunjukkan bahwa satwa primata khusunya beruk dan monyet ekor panjang dapat dimanfaatkan dengan bijaksana untuk penelitian biomedis.
22
DAFTAR PUSTAKA
Bernard HU, Chan SY. 2007. Animal Papillomaviruses. Singapore. NUS
Bernard HU, Calleja-Macias IE, Dunn ST. 2006. Genome variation of human papillomavirus types: phylogenetic andmedical implications. Int J Cancer. 118(5):1071-6. doi: 10.1002/ijc.21655
Chan SY, Bernard HU, Ratterree M, Bikerbak A,.Faras AJ, Ostrow RS. 1997. Genomic Diversity and Evolution of Papillomaviruses In Rhesus Monkey. J Virol . 71(7): 4938–4943.
Frazer IH. 2004. Prevention of cervical cancer through papillomavirus. Nat Rev Immunol. 4(1):46-54.
Chen Z, Schiffman M, Herrero R, Desalle R, Burk RD. 2007. Human papillomavirus (HPV) types 101 and 103 isolated from cervicovaginal cells lack an E6 open reading frame (ORF) and are related to gamma-papillomaviruses. J Virol . 360(2):447-53. doi:10.1016
Gardner BM, Luciw PA. 2008. Macaque Models of Human Infectious Disease. ILAR J. 99 (2) : 220-55
Hidayat T dan Pancoro A 2006 Sistematika dan Filogenetika Molekuler. Jurusan Biologi. Universitas Pendidikan Indonesia. Bandung. Makalah
Lin H, Ma Y-Y, Moh J-S, Ou Y-C, Shen Y-C, ChangChien C-C. 2006. High prevalence of genital human papillomavirus type 52 and 58 infection in women attending gynecologic practitioners in South Taiwan. J Gynecol Oncol. 101:40 – 45.
Hakim L. 2010 Biologi Patogenesis Human Papillomavirus. Fakultas Kedokteran Universitas Brawijaya. Malang. Pr
Joongho J, Hopper K, Doorslaer K, Sunberg JP, Jenson AB Ghim SJ. 2009 Macaca fascicularis papillomavirus type 1: a non human primate betapapillomavirus causing rapidly progressive hand and foot papillomatosis. J Gen Virol . 90 (4 ) : 987-994 . doi 10.1099/vir.0.006544-0
Molijn A, Kleter B. Quint W and van Doorn LJ. 2004. Molecular diagnosis of human papillomavirus (HPV) infections. Review. J Clin Virol. 32S S43–S51. doi:10.1016/j.jcv.2004.12.00
Moosavi SS, Soltani S, and Shaikpoor M. 2008. A Comparison between Cytological method and PCR in the Diagnosis of HPV Infection among patient with
23 Cervical Cancer Biotech. 7(4): 798-811. doi: 10.3923 /biotech.2008.798.802.
Morris BJ. 2005. Cervical human papillomavirus screening by PCR: advantages of targeting the E6/E7 region. Clin Chem Lab Med. 43(11):1171–1177 doi: 10.1515/CCLM. 203
Munoz N, Bosch FX, Sanjose SM, Herrero R, Castellsague X, Shah KV, Snijders P, Meijer CJ. 2003. Epidemiologic Classification of Human Papillomavirus Tipes Associated with Cervical Cancer. N Engl J Med. 348:518-527. doi: 10.1056/NEJMoa021641
Ostrow RS, McGlennen MR, Shaver MK, Kloster BE, Houser D, Faras AJ. 1990. A rhesus monkey model for sexual transmission of a papillomavirus isolated from a squamous cell carcinoma. Proc Natl Acad Sci.87:8170-8174
Paavonen JP, Jenkins D, Bosch FX, Naud P, Salmeron J, Wheeler CM, Chow SN, Apter DL, Kitchener HC, Castellsaque X et al. 2007. Efficacy of a prophylactic adjuvanted bivalent L1 virus-like-particle vaccine against infection with human papillomavirus types 16 and 18 in young women: an interim analysis of a phase III double-blind, randomised controlled trial. Lancet. 369 (9580):2161 – 2170
Rosilawati MK, Bela B, Indarti J. 2007. Deteksi Human Papillomavirus tipe 16 dan 18 dengan teknik PCR dan hibridasi dotblot dengan pelacak DNA Biotin. Obstet Ginekol ID. 31(4):218-251
Stevens H, Rector A, Van Der Kroght K, Van Ranst M. 2008. Isolation and Clonning of Two Variant Papillomavirus from Domestic Pig: Sus srofa papillomaviruses type 1 variants a and b. J Gen Virol. 89, 2474-2481.doi: 10.1099/vir.0.2008/003186-0
Takehara K, Toda T, Nishimura T, Sakane J, Kawakami Y, Mizunoe T, Nishiwaki M, Taniyama K. 2011. Clinical studyhuman papillomavirus types 52 and 58 are prevalent in uterine cervical squamous lesions from Japanese women. Pat Rsc Int. Vol 2011, Article ID 246936. 7 pages. doi:10.4061/2011/246936 Thoma SR. 2010. Human Papillomavirus. Jogjakarta (ID) : UniversitasSanata
Dharma Pr.
Voevodin AF, Marx PA 2009. Simian Virology. New Delhi: Wiley-Blackley
Wood H, Borgerink WH, Register TC, Scott L, Cline JM. 2004. Cervical and vaginal epithelial neoplasms in cynomolgus monkeys. Vet Pathol. 41: 108-115. doi: 10.1354/vp.41-2-108
deVilliers EM, Fauquet C, Broker TR, Bernard HU, Hausen H. 2004. Classification of papillomaviruses. J Virol. 324:13-27
24
Wilyman J. 2011. The pathogenesis of Human Papillomavirus (HPV) in the development of cervical cancer: are HPV vaccines a safe and effective management strategy?. [internet] BSEM March 2011,The Health Hazards of Disease Prevention [diunduh pada 2012 Sept 20] tersedia pada : http:// http://www.ecomed.org.uk/wp-content/uploads/2011/09/6-wilyman.pdf [WHO] World Health Organization. 2010. Human Papillomavirus and Related