Makalah Seminar Tugas Akhir
PENGENDALIAN pH DALAM BEJANA DEFECATOR PADA PROSES PEMURNIAN
NIRA (GULA) DENGAN KONTROL PROPORSIONAL – INTEGRAL
Mustaghfiri Asror[1], Iwan Setiawan, S.T., M.T.[2], Budi Setiyono, S.T., M.T.[2]
Jurusan Teknik Elektro, Fakultas Teknik, Universitas Diponegoro Jln. Prof. Sudharto, Tembalang, Semarang, Indonesia
ABSTRAK
Pada proses pengolahan tebu menjadi nira (gula) yaitu khususnya pada proses pemurnian bagian sulfitasi pengendalian nilai pH masih banyak dilakukan pengamatan pH menggunakan indikator universal atau BTB (Brom Tymol Blue) yang dilakukan dilokasi proses secara manual. Pada tugas akhir ini akan dibuat alat otomatis untuk mengendalikan agar didapatkan nilai pH nira yang sesuai dengan proses Defekasi di bejana defecator dengan penambahan susu kapur secara otomatis pada proses pemurnian nira.
Model analitik proses pengendalian pH (atau –log[H+]) terdiri dari dua dinamika yaitu, reaksi pencampuran dan reaksi invariant yang didapatkan dengan menyelesaikan kesetimbangan elektro-kimia non-linier. Secara keseluruhan dinamika proses tersebut adalah model yang nonlinier, sehingga diperlukan pengendali yang mampu mengatasi karakteristik nonlinier ini. Pengendali nonlinear pada dasarnya sangat cocok untuk diterapkan pada pengendalian pH akan tetapi pengendali nonlinear lebih rumit dan lebih mahal dibandingkan pengendali linear. Oleh karena itu dalam penelitian ini diusulkan pengendali linear yang mampu untuk mengatasi karakteristik nonlinear pada pH.
Pengendali linear yang digunakan adalah kontroler PI yang mempunyai parameter tuning khusus yang telah dirancang sedemikian rupa sehingga memiliki kemampuan menghadapi sistem nonlinier. Berdasarkan hasil percobaan hasil uji bumptest tuning PI mempunyai parameter (Kp= 3, Ki= 0,1)
Kata Kunci: Kontrol Nira, sensor pH, Defecator. I PENDAHULUAN
Pada proses pemurnian nira terdapat tiga buah jenis proses, yaitu Defekasi, Sulfitasi dan Karbonatasi. Pada saat ini sebagian besar pabrik gula di Indonesia menggunakan proses sulfitasi dalam memurnikan nira karena dapat menekan biaya produksi. Pada umumnya proses sulfitasi yang ada pada Pabrik Gula masih bersifat manual dengan pengamatan pH menggunakan indikator universal BTB (Brom Tymol Blue) yang dilakukan dilokasi proses dan beberapa juga sudah menggunakan kontrol otomatsi namun masih menggunakan kontrol on – off.
Kendali pH merupakan kendali jenis yang tak linear, sehingga untuk mengatasinya juga diperlukan kendali jenis nonlinear namun kendali nonlinear merupakan sistem kendali yang kompleks dan agak rumit serta lebih mahal. Sehingga pada tugas ahkir ini digunakan kendali linear yang mampu untuk mengatasi karakteristik nonlinear pH. Teknik kendali konvensional seperti PI merupakan sebuah teknik kendali yang banyak diterapkan dibidang industri pada saat ini, namun kendala dari sistem kendali konvensional ini membutuhkan pengetahuan tentang parameter-parameter sistem terlebih dahulu. Pada sistem yang kompleks terdapat kendala dalam menentukan parameter-parameter yang sesuai agar mendapatkan respon
keluaran yang stabil. Salah satu solusi terhadap kesulitan tersebut adalah dengan melakukan penalaan PI secara otomatik pada sebuah plant yang akan dikendalikan.
II DASAR TEORI 2.1. Pengendali PI
Pengendali proporsional yang memberikan aksi kontrol proporsional dengan error akan mengakibatkan efek pada pengurangan rise time dan menimbulkan kesalahan keadaan tunak (offset). Pengendali integral yang memberikan aksi kontrol sebanding dengan jumlah kesalahan akan mengakibatkan efek yang baik dalam mengurangi kesalahan keadaan tunak tetapi dapat mengakibatkan respon transien yang memburuk. Dalam waktu kontinyu, sinyal keluaran pengendali PI dapat dirumuskan sebagai berikut.
t i p etdt T t e K Co 0 1 ... (1) denganCo = sinyal keluaran pengendali PI. Kp = konstanta proporsional. Ti = waktu integral.
Diagram blok pengendali PI dapat dilihat pada Gambar 1 masukan + -Co E(s) Y(s) s K K i p
Gambar 1 Diagram blok pengendali PI.
2.2. Perhitungan Parameter PI berdasarkan informasi Uji Bumptest
Model self regulating process pada dasarnya dapat didekati oleh sebuah model matematis FOPDT (First Order Plus Ded Time) yang hanya dicirikan oleh tiga buah parameter yaitu Process transport delay – L, Process time constant – T, Process static gain- K
Ketiga parameter yang menggambarkan dinamika proses, secara praktis dapat diperoleh atau diidentifikasi melalui eksperimen sederhana BumpTest atau sinyal tangga secara open loop pada mode kontrol manual (lihat Gambar 2).
Kontroller PID Penggerak(Actuator) Proses
Sensor (Transmitter) SP (set Points) + -PV e(error)
Input dari Operator Auto
Manual CO
MV Ex Kontroller PID komersil
Gambar 2 Percobaan BumpTest pada kontrol manual
Secara teknis percobaan BumpTest dilakukan dengan cara memberi perubahan tangga (step) sinyal output kontroler (CO) oleh operator pada saat proses mengalami keadaan steady (menetap) disekitar titik kerja nominalnya. Gambar 3 menunjukan salah satu contoh hasil percobaan BumpTest.
Gambar 3 Respon Tangga percobaan BumpTest untuk model FOPDT
Gambar 3 diatas merupakan grafik respon tangga percobaan BumpTest yang mana parameter-parameter proses FOPDT (First Order Plus Ded Time) dapat dicari sebagai berikut:
a. Keterlambatan transportasi proses (L) = waktu yang terjadi pada proses yang dihitung sejak terjadi perubahan tangga pada CO sampai variabel proses (PV) yang dikontrol mulai menanggapi perubahan input CO.
b. Konstanta waktu (T) = Waktu yang di perlukan sehingga nilai PV mencapai kurang lebih 63 % dari keadaan steady akhir setelah waktu tunda.
c. Gain Statis Proses (K) = Perbandingan perubahan PV terhadap perubahan CO dalam keadaan steadynya. Gain statis bisa bernilai positif maupun negatif tergantung jenis control valve yang di gunakan.
0 1 0 1 CO CO PV PV CO PV K
2.3. Penalaan Pengendali PID Metode ke-1 Ziegler-Nichols
Metode ke-1 didasarkan pada respon plant terhadap masukan tangga (step) dalam kalang terbuka. Plant yang tidak mempunyai integrator, akan menghasilkan kurva tanggapan terhadap masukan tangga, seperti halnya pada hasil respon uji Bumptest yang diperlihatkan pada gambar 2.
Parameter-parameter yang didapat dari kurva reaksi digunakan untuk menentukan parameter-parameter pengendali PID berdasarkan tetapan-tetapan empiris Zielger-Nichols. Rumus-rumus untuk mencari parameter pengendali menggunakan metode kurva reaksi ditabelkan pada Tabel 1.
Tabel 1 Rumus parameter PID dengan penalaan Ziegler-Nichols metode ke-1.
Pengendali Kp Ti Td
P T/LK - -
PI 0.9T/KL 3,33L -
PID 1,2T/KL 2L 0,5L
2.4. Teori Dasar pH
pH atau derajat keasaman yang digunakan
untuk menyatakan tingkat keasaaman atau basa yang dimiliki oleh suatu zat, larutan atau benda. Umumnya indikator sederhana yang digunakan adalah kertas lakmus yang berubah menjadi merah bila keasamannya tinggi dan biru bila keasamannya rendah. Istilah pH berasal dari "p", lambang matematika dari negatif logaritma, dan "H", lambang kimia untuk unsur Hidrogen. pH adalah singkatan dari power of Hydrogen. Definisi yang formal tentang pH adalah negatif logaritma dari aktivitas ion Hidrogen seperti dinyatakan pada persamaan 2.
pH = -log[H+] dan pOH= -log[OH-] ...(2)
pH dibentuk dari informasi kuantitatif yang dinyatakan oleh tingkat derajat keasaman atau basa yang berkaitan dengan aktivitas ion hidrogen. Nilai pH dari suatu unsur adalah perbandingan antara konsentrasi ion hidrogen [H+] dengan konsentrasi ion hidroksil [OH-]. Jika konsentrasi H+ lebih besar dari OH-, material disebut asam; yaitu nilai pH adalah kurang dari 7. Jika konsentrasi OH- lebih besar dari H+, material disebut basa, dengan suatu
nilai pH lebih besar dari 7. Jika konsentrasi H+ sama dengan OH- maka material disebut sebagai material netral. Asam dan basa mempunyai ion hidrogen bebas dan ion alkali bebas. Besarnya konsentrasi ion H+ dalam larutan disebut derajat keasaman.
Pada suhu kamar: pKw = pH + pOH = 14 .
2.5. Proses Pemurnian Nira (Clarification) di Bejana Defecator
Tujuan dari stasiun pemurnian adalah menghilangkan kotoran – kotoran yang terkandung dalam nira dan untuk memisahkan bukan gula sebanyak mungkin dari dalam nira dengan kehilangan gula sedikit mungkin dan biaya seminimal mungkin dengan kualitas gula yang dihasilkan bermutu baik memenuhi tuntutan pasar.
Proses Pemurnian dimulai dengan nira mentah dari bak penampungan dipompa ke pemanas I atau heater I, dengan pompa sentrifugal melalui pipa pemasukan, kemudian turun dan bersirkulasi dalam pipa pemasukan secara kontinyu, untuk selanjutnya keluar melalui pipa pengeluaran atas. Proses selanjutnya adalah defekasi dengan susu kapur. Nira yang keluar dari heater I dipompa ke kalduser yang mempunyai 2 ruang berisi nira dan susu kapur. Alat ini dinamakan defekator. Proses pemberian susu kapur dilakukan 3 tahap.
Bejana defecator merupakan suatu alat untuk mereaksikan nira dengan susu kapur untuk mendapatkan pH yang alkalis dengan cara pengadukan. Didalam proses pemurnian nira pada umumnya dilakukan dengan tiga tahap yaitu:
d. Pada defecator I, pemberian susu kapur mencapai nilai pH nira antara 7,0 – 7,2.
e. Pada defecator II, pemberian susu kapur mencapai nilai pH nira antara 8,2 – 8,5.
f. Pada defecator III, pemberian susu kapur mencapai nilai pH nira antara 9,5 – 10.
Pada Tugas Akhir ini pengendalian hanya dilakukan pada bejana defecator. Pengendalian yang dilakukan yaitu mempertahankan nilai pH nira sesuai dengan referensi yang diinginkan pada proses defekasi diBejana defecator. Pengendalian nilai pH Nira dilakukan dengan menambahkan susu kapur kedalam plant sehingga didapatkan nilai pH nira yang diinginkan. Persamaan reaksi kimia pencampuran antara Nira dengan susu kapur pada bejana Defecator yang terjadi adalah sebagai berikut:
Ca(OH)2 + C6H12O6 → Ca(C6H10O6) + 2H 2 O
3. PERANCANGAN
Pada perancangan pengendali pH nira ini menggunakan Metode pengendali PI. Pada plant ini juga dihubungkan dengan Komputer dengan fasilitas komunikasi serial untuk melakukan pengamatan secara grafik. Blok diagram
Pengendalian pH nira ini secara garis besar dapat dilihat pada gambar 3.1 berikut.
Kontroler PI Pengontrol Tegangan AC Pompa Air Tiruan Bejana Defecator Sensor pH + pH controler -+
Set Point Error CO
pH terukur
Gambar 4 Diagram blok dasar sistem pengendalian pH Nira.
Pada blok diagram diatas merupakan sistem pengendalian pH Nira di Bejana Defekator pada proses pemurnian Nira. Pengendalian nilai pH output Nira dilakukan dengan mengatur besar kecilnya kosentrasi ion hidrogen susu kapur yang diberikan dengan nilai pH sebagai variabel yang diukur, pemberian ion hidrogen susu kapur yang dilakukan dengan cara mengatur besarnya debit aliran masukan susu kapur yang di kendali oleh besar kecilnya tegangan AC yang di berikan ke Pompa.
3.1. Perancangan Perangkat Keras (Hardware)
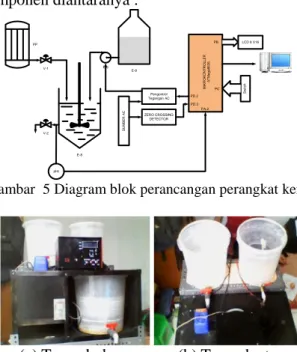
Perancangan Pengendalian pH dalam bejana defecator pada proses pemurnian nira (gula) dengan kendali PI membutuhkan beberapa komponen diantaranya : PP V-1 E-8 E-6 E-9 Pengontrol Tegangan AC ZERO CROSSING DETECTOR PD.3 S U M B E R A C PD.2 LCD 8 X16 PB M IK R O K O N T R O L L E R A T M e g a 8 5 3 5 V-2 pHt PA.2 S w it c h PC
Gambar 5 Diagram blok perancangan perangkat keras
(a) Tampak depan (b) Tampak atas
Gambar 6 Gambar plant pengendali pH yang digunakan 3.2. Perancangan Sensor Keasaman (PE03),
Buffer CA3140
Sensor keasaman adalah suatu transducer yang berfungsi mengubah besaran yang berupa tingkat keasaman menjadi suatu besaran listrik. Untuk jenis sensor keasaman yang dipakai adalah sensor pH dari produk Trans Instrument dengan jenis PE03 dan pH Controler tipe BL931700 sebagai Transmiter sensor pH. Sensor ini mengubah tingkat keasaman menjadi besaran listrik yang berupa tegangan.
Gambar 7 sensor + pH Controler tipe BL931700 3.3. Perancangan Program Utama
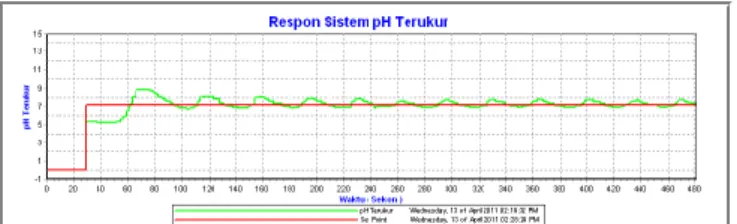
Program utama dimulai dengan inisialisasi awal untuk masing-masing Port dan register. Setelah inisialisasi, program akan ke menu Mode off yang berfungsi sebagai default. Pada menu off apabila tombol OK ditekan akan melakukan setting point pH, nilai Kp, Ki dan nilai CO awal. Pada Mode off Program akan ke Mode Manual atau mode Auto setelah sakelar ke posisi on.
Pada menu pilihan terdapat pilihan mode manual dan mode otomatis untuk mengendalikan nilai pH pada Bejana Defecator menggunakan pengendali PI. Pada mode manual juga di berikan fasilitas untuk uji Bumptest untuk menentukan nilai parameter Kp dan Ki yang digunakan untuk proses pengendalian Algoritma PI berdasarakan informasi hasil dari uji dan akan dilakukan tuning manual berdasarkan metode tuning yang digunakan.
Mulai
Inisialisasi I/O Register, ADC dan LCD
Mode ON Dipilh? ya Tidak Mode auto Dipilih? ya Tidak Mode Otomatis Algoritma PI Menampilkan pH, CO, kirim serial Mode Manual Mode BumpTest Dipilh? Tidak ya Proses Open Loop Input man CO Menampilkan pH, CO, kirim serial
Input SP, Kp, Ki, CO
CO=CO+20%
Gambar 8 Diagram alir program utama. 4. PENGUJIAN DAN ANALISIS
4.1. Pengujian Sensor pH
Pengukuran ini dilakukan dengan cara melakukan pencampuran antara 2 larutan yang bersifat asam dengan larutan yang bersifat basa. Pengukuran pertama kali dilakukan dengan larutan yang bersifat asam dalam hal ini Nira cair dengan nilai pH yang terukur sebesar pH 4.00 dan sedikit demi sedikit di campurkan dengan larutan yang bersifat basa dalam hal ini Susu Kapur. Dari hasil pengkuran ini dapat dilihat pada Tabel 4.2 dibawah ini:
Tabel 2 Hasil Pengukuran Transmitter pH No pH Terukur Out Transmitter pH
1 2 3 4 5 6 7 8 4.00 5.00 6.00 7.00 8.00 9.00 10.00 11.00 0.84 V 0.95 V 1.07 V 1.19 V 1.29 V 1.40 V 1.51 V 1.62 V
Dari Tabel 2 terlihat bahwa pada hasil pembacaan pada display Transmitter pH (pH Controler) dengan Output Transmitter pH (pH Controler) yang terukur telah menunjukkan hasil yang kurang linear. Grafik yang merepresentasikan data hasil pembacaan Transmiiter pH dengan Tegangan Output yang terukur dapat dilihat pada gambar 9 dibawah ini:
Perbandingan nilai pH terukur
y = 0.1112x + 0.3986 0 0.2 0.4 0.6 0.8 1 1.2 1.4 1.6 1.8 0 2 4 6 8 10 12 pH terbaca V ou t t er uk ur
Gambar 9 Grafik perbandingan pH Terukur dengan Tegangan Output (pH Controler).
4.2. Pengujian Kalang Terbuka (Uji Bumptest)
Pada pengujian kalang terbuka, plant dalam mode manual dan diberikan sinyal kontrol secara mendadak dengan besar selisih COawal dengan COakhir sebesar 20%. Pada awalnya mikrokontroler memberi masukan berupa sinyal kendali CO ke pengontrol tegangan AC sebesar 15 % dan saat kondisi plant dalam keadaan steady mikrokontroler memberikan sinyal kendali sebesar 35 % sampai didapatkan kondisi plant dalam keadaan steady. Tanggapan keluaran nilai pH Nira pada plant ditunjukkan pada gambar 10.
11.5 5 6.5 20 % 9.1 36 28 6.8 13
Gambar 10 Tanggapan keluaran sistem pengendalian pH berdasarkan hasil uji Bumptest.
Berdasarkan hasil uji eksperimen Bumptest diatas didapatkan nilai parameter – parameter sebagai berikut: % 325 . 0 20 5 . 6 pH K 1 . 9 5 ) 5 . 6 * % 63 ( % 63 pv
82 . 6 5 ) 5 . 6 * % 28 ( % 28 pv
23
13
36
%
63
t
15
13
28
%
28
t
12 ) 15 23 ( 5 . 1 T 11 12 23 LSehingga Model Empirik FOPDT dari
s e s s G 11 1 12 325 . 0 ) (
dengan menggunakan tuning Ziegler – Nichols akan didapatkan parameter Kp dan Ki sebagai berikut :
02
.
3
58
.
3
8
.
10
11
*
325
.
0
12
*
9
.
0
Kp
63
.
36
11
*
33
.
3
Ti
08 . 0 63 . 36 02 . 3 Ti Kp Ki4.3. Pengujian dengan Nilai Referensi Naik
Gambar 11 adalah gambar respon kendali pH nira dengan pemberian referensi naik dari pH 7.2 sampai pH 9.5. Pada saat diberikan nilai referensi awal yaitu pada nilai pH 7.2 sistem mengalami waktu tunda (td) yang diperlukan adalah 25 detik, Waktu naik (tr) 5 detik serta waktu puncak (tp) sebesar 40 detik. Pada awal pemberian referensi pH sistem menghalami overshoot yang lumayan besar sekitar 1.4 hal ini dikarenakan sifat dari sistem yang dikendalikan bersifat nonlinear dan juga actuator penggerak juga bersifat nonlinear. Namun setelah detik ke 280 pH referensi dinaikkan pada nilai pH 8.5 sistem menunjukkan respon yang stabil tidak terjadi kesalahan keadaan tunak begitu juga setelah detik ke 570 pH referensi dinaikan ke nilai pH 9.5 dan sistem nilai pH output segera mengikuti nilai pH referensi yang dtentukan dan respon sistem stabil. Setelah detik ke 800 pengujian dihentikan.
Gambar 11 Respon sistem dengan pemberian referensi naik pH 7.2, pH 8.5 dan pH 9.5.
Pada hasil pengujian sistem kendali pH Nira dengan referensi naik menunjukkan bahwa semakin besar referensi pH yang diberikan, maka sistem menunjukkan respon yang stabil berbeda halnya saat pertama kali plant dihidupkan, respon sistem mengalami overshoot yang cukup besar dikarenakan sifat bahan plant yang nonlinear serta pada nilai pH netral sifatnya sangat reaktif sehingga pada pengendalian pH netral cenderung berosilasi karena sifat pH termasuk persamaan logaritmik. Osilasi yang terjadi ini juga dikarenakan karena
sifat actuator yang nonlinear juga terjadi proses reaksi kimia atau molaritas ion pada plant model dalam jumlah yang tidak dapat diketahui secara tepat sedangkan parameter yang diukur merupakan pH bukan molaritas ion hidrogen.
4.4. Respon Pengendalian pH Tanpa Gangguan
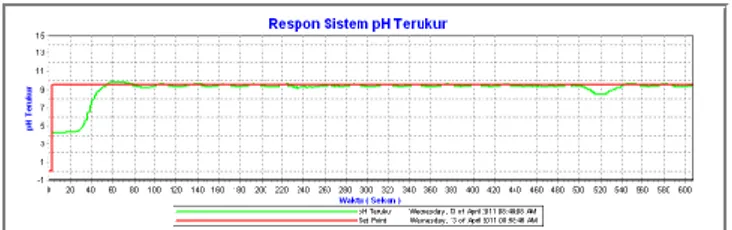
Pada hasil pengujian kedua dilakukan dengan referensi nilai pH pada 7.2 seperti tampak pada gambar 4.4. Pada pengujian tanggapan pengendalian pH dengan referensi pH 7.2 dilakukan selama 500 detik. Respon sistem cenderung berosilasi memiliki waktu tunda (td) yang diperlukan sekitar 20 detik, waktu naik (tr) sekitar 30 detik, waktu puncak sekitar 40 detik. Selama sekitar 70 detik sistem mengalami overshoot sebesar 1.3 pH. Waktu penetapan cenderung tidak bisa diperhitungkan karena respon sistem cenderung berosilasi sekitar ± 1.2 pH disekitar nilai titik referensi.
Gambar 12 Tanggapan sistem pengendalian pH tanpa gangguan dengan referensi pH 7.2.
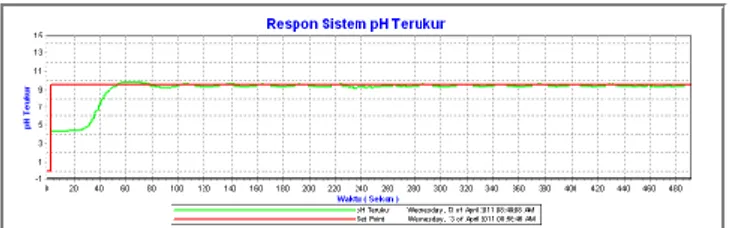
Pada hasil pengujian ketiga dilakukan dengan referensi nilai pH pada 8.5 seperti tampak pada gambar 13. Pada pengujian tanggapan pengendalian pH dengan referensi pH 8.5 dilakukan selama 320 detik. Respon sistem cenderung berosilasi memiliki waktu tunda (td) yang diperlukan sekitar 30 detik, waktu naik (tr) sekitar 45 detik, waktu puncak sekitar 55 detik. Selama sekitar 30 detik sistem mengalami overshoot sebesar 0.9 pH. Waktu penetapan cenderung tidak bisa diperhitungkan karena respon sistem cenderung berosilasi sekitar ± 0.8 pH disekitar nilai titik referensi.
Gambar 13 Tanggapan sistem pengendalian pH tanpa gangguan dengan referensi pH 8.5.
Pada hasil pengujian keempat dilakukan dengan referensi nilai pH pada 9.5 seperti tampak pada gambar 14. Pada pengujian tanggapan pengendalian pH dengan referensi pH 9.5 dilakukan selama 500 detik. Respon sistem cenderung berosilasi namun tidak terlalu besar sperti pada pengujian dengan nilai pH 7.2, memiliki waktu tunda (td) yang diperlukan sekitar 40 detik, waktu naik (tr) sekitar 45 detik, waktu puncak sekitar 60
detik. Pada pengujian ini tidak mengalami overshoot yang berarti karena overshoot yang terjadi sangat kecil dengan lonjakan maksimum sebesar pH 0.3. Waktu penetapan sekitar detik ke 100, Osilasi yang terjadi sekitar ± 0.15 pH disekitar nilai titik referensi.
Gambar 14 Tanggapan sistem pengendalian pH tanpa gangguan dengan referensi pH 9.5.
Pada hasil pengujian pengendalian pH dengan referensi nilai pH 7.2 ditunjukkan pada gambar 12 diatas merupakan nilai pH netral yang mana pada pengujian tersebut mengalami osilasi terus menerus namun tetap mengikuti nilai referensi yang diinginkan. Hal ini berbeda pada pengujian ketiga dengan referensi pH 8.5 respon sistemnya lebih stabil jika dibandingkan dengan referensi pH 7.2 sedangkan pada referensi pH 9.5 respon menunjukkan sistem yang lebih stabil yang dibuktikan dengan osilasi yang semakin berkurang. Untuk overshoot respon yang dihasilkan juga pada referensi pH 9.5 lebih kecil jika dibandingkan dengan referensi nilai pH yang lebih rendah dan bisa ditentukan waktu penetepan yaitu sekitar didetik ke 100.
Fenomena ini dikarenakan pada pH netral sifatnya sangat reaktif karena berada pada titik tengah-tengah asam dan basa sedangkan kosentrasi yang terjadi sebenarnya reaksi campuran antara ion hidrogen yang mana pada kondisi dan ukuran tertentu memiliki nilai pH yang tidak sama sehingga apabila dicampur dengan sedikit saja bahan yang bersifat asam maupun basa akan cepat bereaksi dan menimbulkan osilasi terus menerus. Pada kasus pengendalian pH ini dikarenakan terjadi suatu reaksi kimia yang tidak bisa diukur secara tepat reaksi yang terjadi jika dicampurkan dan juga karena plant yang dikendalikan merupakan cairan yang mengalir. Penentuan nilai pH akhir ini juga karena sifat pH merupakan fungsi logaritmic sehingga kendali ini merupakan suatu kendali yang tidak linear dan jika nilai pH akhir campuran yang terjadi juga dipengaruhi oleh volume dan berat dari reaksi kimia yang dilakukan, untuk 2 cairan kimia yang dilakukan dengan volume dan berat yang berbeda akan mempunyai nilai pH yang sedikit berbeda. Sehingga
4.5. Respon Pengendalian pH Terhadap
Gangguan
Pada pengujian terhadap gangguan dilakukan untuk mengetahui respon sistem terhadap gangguan secara mendadak sehingga akan diketahui kemampuan plant. Gangguan ini berasal
dari volume Nira yang diberikan dengan mengatur besar kecilnya kran input.
Pada pengujian kelima ini dilakukan pengujian tanggapan sistem pengendalian pH terhadap gangguan dengan referensi 7.2 tampak pada gambat 15. Gangguan ini dilakukan pada detik 400 yaitu dengan menambahkan Nira kedalam tangki. Pada pengujian ini karena respon sistem cenderung berosilasi sehingga pada nilai pH terukur tampak sama pada detik-detik yang lain namun masih bisa kelihatan. Saat terajadi gangguan tampak nilai pH Terukur mengalami. Pada pengujian ini tampak bisa dilihat pada grafik CO yang mana peningkatannya tajam dari pada nilai CO yang lain setelah mengalami overshoot. Setelah nilai pH mendekati nilai titik referensi respon segera akan mengalami hasil respon yang sama sebelum terjadinya gangguan dan tetap berosilasi mendekati nilai titik referensi yang telah ditentukan seperti halnya sebelum terjadi gangguan.
Gambar 15 Tanggapan sistem pengendalian pH terhadap gangguan dengan referensi pH 7.2.
Pada pengujian keenam ini dilakukan pengujian tanggapan sistem pengendalian pH terhadap gangguan dengan referensi 8.5 tampak pada gambat 16. Gangguan ini dilakukan pada detik 340 yaitu dengan menambahkan Nira kedalam tangki. Pada pengujian ini karena respon sistem cenderung berosilasi sehingga pada nilai pH terukur tampak sama pada detik-detik yang lain namun masih bisa kelihatan karena osilasi yang terjadi lebih mengecil dariapada pengujian pada nilai pH 7.2. Saat terajadi gangguan tampak nilai pH Terukur mengalami.. Pada pengujian ini tampak bisa dilihat pada grafik CO yang mana peningkatannya tajam dari pada nilai CO yang lain setelah mengalami overshoot. Setelah nilai pH mendekati nilai titik referensi respon segera akan mengalami hasil respon yang sama sebelum terjadinya gangguan dan tetap berosilasi mendekati nilai titik referensi yang telah ditentukan seperti halnya sebelum terjadi gangguan.
Gambar 16 Tanggapan sistem pengendalian pH terhadap gangguan dengan referensi pH 8.5.
Pada pengujian ketujuh ini dilakukan pengujian tanggapan sistem pengendalian pH
terhadap gangguan dengan referensi 9.5. Gangguan ini dilakukan pada detik 500 yaitu dengan menambahkan Nira kedalam tangki. Saat terajadi gangguan tampak nilai pH Terukur mengalami penurunan sampai pada nilai pH. Pada pengujian ini tampak bisa dilihat pada grafik pH Terukur dan CO yang mana peningkatannya tajam dari pada nilai CO yang lain setelah mengalami overshoot.
Gambar 17 Tanggapan sistem pengendalian pH terhadap gangguan dengan referensi pH 9.5.
V PENUTUP 5.1. Kesimpulan
Berdasarkan hasil pengujian dan analisis yang dilakukan didapatkan hal-hal penting sebagai berikut:
1. Sistem pengaturan PH secara otomatis yang dibuat mampu mempertahankan PH di dalam plant model sesuai dengan kisaran PH 7,2 hingga 9.5.
2. Hasil pengukuran tegangan output pH Controler untuk setiap kenaikan nilai pH terdapat selisih sehingga digunakan persamaan linear untuk pendekatan nilai pH sebenarnya yaitu y=0.1112x+0.3986.
3. Dari hasil uji Bumptest bisa ditentukan nilai parameter Kp=4.1 dan Ki=0.1 untuk proses pengendalian berdasarkan tuning Ziegler Nichols.
4. Respon sistem pada nilai referensi 7.2 menghasilkan tanggapan yang cenderung berosilasi dibandingkan pada referensi pH 9.5 lebih stabil dikarenakan sifat plant dan actuator yang nonlinear.
5.2. Saran
Beberapa saran yang dapat dilakukan untuk pengembangan sistem lebih lanjut,yaitu sebagai berikut:
1. Untuk memperoleh respon sistem yang lebih baik lagi, maka dapat dicoba dengan menggunakan sensor yang memiliki keakuratan dan stabilitas yang cukup baik.
2. Menggunakan Valve pada penginjeksian larutan Susu Kapur ke dalam plant Bejana Defecator. 3. Menggunakan aksi kontrol yang lain yang dapat
mengatasi Plant Nonlinear.
4. Perlu dilakukannya analisa perubahan suhu terhadap nilai hasil pengukuran PH, sehingga dapat dirancang sebuah rangkaian untuk mengkompensasi perubahan suhu.
DAFTAR PUSTAKA
Andrianto, Heri, Pemrograman Mikrokontroler AVR ATMega16 Menggunakan Bahasa C (CodeVisionAVR), Penerbit Informatika, Bandung, 2008.
Bejo Agus,C & AVR Rahasia Kemudahan Bahasa C dalam Mikrokontroler ATMega8535, Penerbit Graha Ilmu, Yogyakarta, 2008.
Brosilow, Coleman and Babu Joseph, Techniques of Model-Based Control, Prentice Hall International Series, New Jersey, 2001.
Budiharto Widodo, Panduan Praktikum Mikrokontroler AVR ATmega16, PT Elex Media Komputindo, Jakarta, 2008.
Chang Raymond, Kimia Dasar : Konsep-konsep Inti jilid 2, diterjemahkan oleh Suminar Seiati Achmadi, Erlangga, Jakarta, 2004.
Gunterus, Frans, Falsafah Dasar: Sistem Pengendalian Proses, PT Elex Media Komputindo, Jakarta, 1997.
Heryanto, M. Ary dan Wisnu Adi P, Pemrograman Bahasa C Untuk Mikrokontroler AT MEGA 8535, Penerbit Andi, Yogyakarta, 2008.
Indra, Bakhtiar K, Skripsi: Penerapan Metode Auto Tuning PI Relay Feedback Ziegler-Nichols pada Pengendalian Level Ketinggian Cairan Menggunakan Mikrokontroler ATmega 8535, Teknik Elektro, Universitas Diponegoro, Semarang. Kuswurj, R, Pengaruh ph Defekasi dan Kewayuan Tebu Dalam Proses Pemurnian Nira Terhadap
Kualitas Nira Jernih,
http://www.risvank.com/?cat=72 Oktober, 2009. Lazuardi, M, skripsi: Aplikasi mikrokontroler AT89S51 sebagai kontroler Proporsional pada pengaturan PH, Teknik Elektro, Universitas Diponegoro, Semarang.
Malvino. “Prinsip – Prinsip Elektronika”. Jakarta : Erlangga, 1996.
Meade, George P, Cane Sugar Handbook, Kanada, 1883.
Ogata, Katsuhiko, Teknik Kontrol Automatik Jilid 1, diterjemahkan oleh Edi Leksono, Erlangga, Jakarta, 1994.
Ogata, Katsuhiko, Teknik Kontrol Automatik Jilid 2, diterjemahkan oleh Edi Leksono, Erlangga, Jakarta, 1994.
Setiawan, Iwan., Kontrol PID untuk Proses Industri, PT. Elex Media Komputindo,Jakarta,2008. Soetedjo, Setiadi, introduction To Process Machinery and Facilities on Sugar Factory: Lembaga Pendidikan Perkebunan, Yogyakarta. Wardhana L, Belajar Sendiri Mikrokontroler AVR Seri ATMega8535 Simulasi, Hardware, dan Aplikasi, Penerbit Andi, Yogyakarta, 2006.
Winoto Ardi, Mikrokontroler AVR ATmega8/32/16/8535 dan Pemrogramannya dengan Bahasa C pada WinAVR, Penerbit
Informatika, Bandung, 2008.
---, ATmega8535 Data Sheet, http://www.atmel.com.
---,Liquid Crystal Display Module M1632 : User Manual, Seiko Instrument Inc., Japan, 1987.
---,http://suwargana.multiply.com/journal/item/. January 2008.
BIODATA MAHASISWA
Penulis lahir di Tegal dan sekolah dari SD sampai SMK di Kab. Tegal dan melanjutkan dibangku kuliah DIII Instrumentasi & Elektronika di Universitas Diponegoro. Sekarang sedang aktif melanjutkan studi pendidikan strata I di Jurusan Teknik Elektro Universitas Diponegoro konsentrasi Kontrol dan masih aktif di salah satu perusahaan Swasta di Semarang sebagai staff EDP.
Pembimbing I Pembimbing II
Iwan Setiawan, S.T., M.T. NIP. 197309262000121001
Budi Setiyono, S.T., M.T. NIP. 197005212000121001