dy/igsb/swm/analisis & interpretasi data kinetika-sistem reaktor batch/2007/halaman 1 dari 15 halaman PERCOBAAN KINETIKA REAKSI
Salah satu cakupan atau ruang lingkup studi kinetika reaksi adalah penentuan kecepatan reaksi secara kuantitatif; hal ini menjadi titik berat pekerjaan seorang chemical engineer yang harus melakukan perancangan reaktor kimia dalam skala komersial. Untuk itulah, pecobaan atau eksperimen kinetika harus dilakukan. Beberapa pendekatan umum yang harus dilakukan dalam melakukan percobaan kinetika reaksi adalah:
1. Pemilihan spesies (reaktan atau produk) untuk memantau atau mengamati keberlangsungan reaksi dan/atau untuk menspesifikasi kecepatan reaksi.
2. Pemilihan jenis reaktor yang digunakan dan mode pengoperasiannya (misalnya: reaktor batch yang beroperasi pada volume tetap)
3. Pemilihan metode untuk mengamati keberlangsungan reaksi terhadap waktu (misalnya: dengan analisis kimia)
4. Pemilihan strategi percobaan, yakni bagaimana cara melakukan percobaan kinetika, termasuk jumlah dan jenis percobaan yang diperlukan; bagaimana mengantisipasi adanya kemungkinan reaksi-reaksi samping; bagaimana kondisi operasinya; bagaimana menjamin supaya data-data yang dihasilkan mempunyai reproducibility yang tinggi; dsb.
5. Pemilihan metode untuk menentukan harga-harga parameter kecepatan reaksi secara kuantitatif/numerik.
Penentuan persamaan kecepatan reaksi biasanya dilakukan melalui 2 langkah prosedur, yakni: 1. Pengaruh konsentrasi (concentration-dependence) yang dilakukan pada suhu tetap
2. Pengaruh suhu (temperature-dependence) yang dilakukan untuk memperoleh harga konstanta kecepatan reaksi (k) sebagai fungsi suhu. Untuk ini, percobaan dilakukan pada berbagai variasi suhu T.
Sistem reaktor (dalam percobaan kinetika):
1. Reaktor batch (umumnya digunakan untuk studi kinetika reaksi-reaksi homogen)
2. Reaktor alir / kontinyu (umumnya digunakan untuk studi kinetika reaksi-reaksi heterogen) Percobaan kinetika sistem batch pada umumnya dilakukan pada kondisi isotermal dan pada volume-tetap (atau densitas-volume-tetap), karena hasilnya lebih mudah diinterpretasikan. Selain itu, percobaan batch melibatkan peralatan-peralatan yang relatif sederhana, sehingga mudah diterapkan dalam percobaan skala-kecil.
Keberlangsungan reaksi pada berbagai waktu (concentration-dependence) secara kuantitatif dapat diamati atau dipantau melalui pengukuran-pengukuran:
1. Pengukuran konsentasi komponen i (Ci) secara langsung; Metode Kimia
Contohnya: titrasi asam dengan basa, titrasi basa dengan asam, presipitasi ion dalam suatu senyawa insoluble.
Metode kimia ini sering digunakan untuk reaksi-reaksi yang berlangsung relatif lambat. 2. Pengukuran konsentasi komponen i (Ci) secara tidak langsung, yakni melalui pengukuran
sifat-sifat lain yang bergantung kepada konsentrasi; Metode Fisika
Pada saat reaksi kimia berlangsung, sifat-sifat fisik sistem reaksi mengalami perubahan seiring dengan perubahan komposisi kimiawi yang terjadi. Oleh karena itulah, perubahan sifat-sifat fisik yang bersesuaian (secara kuantitatif) yang diukur menunjukkan (secara tidak langsung) kecepatan reaksinya. Hubungan antara sifat-sifat fisik tersebut dengan konsentrasi atau komposisi harus ditentukan melalui prosedur kalibrasi yang menghasilkan kurva kalibrasi atau kurva/grafik standar.
Keuntungan metode fisika ini adalah pemantauan keberlangsungan reaksi dapat dilakukan secara kontinyu/terus-menerus, melalui penggunaan instrumen-instrumen yang bersesuaian, tanpa mengganggu sistem reaksi (yang disebabkan oleh kegiatan pengambilan sampel). Contoh metode-metode fisika:
♦ Perubahan tekanan total sistem reaksi (pada sistem reaktor batch bervolume-tetap) pada reaksi fase gas yang melibatkan perubahan jumlah mol gas.
ANALISIS & INTERPRETASI DATA KINETIKA
dy/igsb/swm/analisis & interpretasi data kinetika-sistem reaktor batch/2007/halaman 2 dari 15 halaman
♦ Perubahan volume sistem reaksi (pada sistem reaktor batch bertekanan-tetap)
♦ Perubahan sudut putaran optik zat-zat (dalam sistem reaksi yang melibatkan isomer-isomer optik aktif; misalnya reaksi inversi sukrosa). Instrumen yang digunakan adalah polarimeter yang mengukur sudut putaran cahaya yang terpolarisasi karena melewati sistem.
♦ Perubahan hantaran listrik zat-zat (dalam sistem reaksi yang melibatkan zat-zat yang terionisasi; misalnya reaksi hidrolisis etil asetat). Reaksi dilakukan di dalam sebuah sel hantaran.
♦ Perubahan indeks bias zat-zat, yang melibatkan penggunaan refraktometer (untuk sistem fase cair) atau interferometer (untuk sistem fase gas)
♦ Perubahan warna atau kekeruhan atau serapan cahaya (absorbansi) zat-zat. Instrumen yang digunakan adalah spektrofotometer.
Selain besaran-besaran yang bersifat concentration-dependent tersebut di atas, beberapa besaran berikut ini perlu diukur dalam studi kinetika reaksi, yakni:
1. Suhu, T (pada umumnya T tidak hanya perlu diukur, melainkan juga perlu dikontrol atau dikendalikan, karena kecepatan reaksi relatif sangat dipengaruhi oleh suhu),
2. Tekanan, P,
3. Besaran-besaran geometrik (seperti: panjang, L, dilatometer (untuk sistem reaktor bervolume-berubah), luas permukaan katalis, A, dan volume bejana reaksi, V),
4. Waktu, t, dan
5. Laju alir fluida yang masuk dan keluar reaktor, Q (dalam sistem reaktor alir)
PROSEDUR ANALISIS DAN INTERPRETASI DATA KINETIKA
Prosedur ini dimaksudkan untuk mengolah, menganalisis, dan menginterpretasikan data-data percobaan, guna menghasilkan persamaan kecepatan reaksi secara kuantitatif.
Dua prosedur atau metode atau teknik analisis dan interpretasi data kinetika: 1. Metode integral (atau integrasi)
Didasarkan pada hasil integrasi persamaan kecepatan reaksi. Pada metode ini, analisis data kinetika dilakukan dengan mengalurkan beberapa fungsi konsentrasi reaktan versus waktu, dalam grafik-grafik yang bersesuaian.
Relatif mudah digunakan dan diterapkan, meskipun bersifat trial and error Direkomendasikan untuk: ♦ pengujian sebuah mekanisme reaksi
♦ persamaan-persamaan kinetika yang sederhana
♦ data-data kinetika yang persebarannya tidak cukup baik (atau tidak menentu)
2. Metode diferensial (atau diferensiasi)
Didasarkan pada diferensiasi data-data percobaan (konsentrasi versus waktu) untuk memperoleh kecepatan reaksi yang sebenarnya. Pada metode ini, analisis data kinetika dilakukan dengan menduga beberapa hubungan antara kecepatan reaksi sebagai fungsi konsentrasi, dan menguji dugaan-dugaan tersebut melalui grafik-grafik yang bersesuaian. Terkait langsung dengan persamaan kecepatan reaksi dalam bentuk diferensial.
Mengevaluasi harga-harga turunan dCi/dt atau dpi/dt atau dP/dt dalam persamaan kecepatan reaksi (dari data-data percobaan)
Dapat digunakan untuk persamaan-persamaan kinetika yang lebih kompleks Memerlukan data-data yang banyak dan akurat
Pada sistem reaktor batch bervolume-tetap atau berdensitas-tetap (constant-volume or constant-density batch reactor), kecepatan reaksi homogen komponen i dapat dinyatakan sebagai:
dt C d dt
V n d
dt n d V
1
r i
i i
i =
⎟ ⎠ ⎞ ⎜ ⎝ ⎛ = =
dy/igsb/swm/analisis & interpretasi data kinetika-sistem reaktor batch/2007/halaman 3 dari 15 halaman Hubungan antara tekanan parsial i (pi) dengan tekanan total sistem (P atau Pt atau π):
P y
pi = i dan t i i
n n y =
Karena:
∑
= ii 1
y maka:
∑
= ii P p
Hubungan antara tekanan parsial i (pi) dengan konsentrasi molar i (Ci): T
R C z T R V n z
p i i
i ⎟ =
⎠ ⎞ ⎜ ⎝ ⎛
= atau:
T R z
p
C i
i =
Pada densitas yang relatif rendah: z =1; dan untuk penyederhanaan, jika gas-gas dianggap mengikuti perilaku gas ideal, maka:
T R
p
C i
i = sehingga:
dt p d T R
1 dt
C d
r i i
i = =
Jika: ri =kCin maka:
( )
n in ni
i p
T R
k T
R p k dt
p d T R
1
= ⎟⎟ ⎠ ⎞ ⎜⎜ ⎝ ⎛ =
sehingga:
( )
inn i 1 n
i p k' p
T R
k t
d p
d = =
−
(Ingat kembali: bagaimana cara menjabarkan hubungan antara konsentrasi dengan tekanan, pada materi kuliah sebelumnya)
Untuk reaksi-reaksi fase gas dengan perubahan jumlah mol, cara sederhana untuk menentukan kecepatan reaksi adalah dengan mengikuti atau mengamati perubahan tekanan total sistem reaksi.
Tinjaulah reaksi dengan persamaan stoikiometri berikut: a A + b B r R + s S
Hubungan antara tekanan parsial komponen dengan perubahan tekanan total sistem selama reaksi berlangsung dinyatakan sebagai:
(
0)
0 A A
A P P
b a s r
a p
T R C
p −
− − + − = =
(
0)
0 R R
R P P
b a s r
r p
T R C
p −
− − + + = =
0 , inert inert
inert C RT p
p = =
atau, secara umum:
(
0)
i i 0 i i
i C RT p P P
p = = + −
∑
ν νKeterangan:
pi ≡ tekanan parsial i setiap saat pi0 ≡ tekanan parsial i mula-mula P ≡ tekanan total sistem setiap saat P0 ≡ tekanan total sistem mula-mula yi ≡ fraksi mol i fase gas
ni ≡ jumlah mol i
nt ≡ jumlah mol total (termasuk inert) Ci ≡ konsentrasi molar i
z ≡ faktor kompresibilitas gas V ≡ volume sistem reaksi (fluida)
R ≡ konstanta gas universal T ≡ suhu mutlak
νi ≡ koefisien stoikiometri reaksi (jangan lupa konvensi untuk harga νi!!)
k ≡ konstanta kecepatan reaksi (berbasis satuan konsentrasi molar)
k’ ≡ konstanta kecepatan reaksi (berbasis satuan tekanan)
n ≡ orde reaksi
METODE INTEGRAL UNTUK ANALISIS DATA
Beberapa metode yang tercakup dalam metode integral untuk menganalisis data kinetika: 1. Metode grafik (atau metode grafik pembanding)
Metode ini bersifat trial and error
dy/igsb/swm/analisis & interpretasi data kinetika-sistem reaktor batch/2007/halaman 4 dari 15 halaman
Kelengkungan positif akan teramati jika orde reaksi yang ditebak (atau diasumsikan) lebih besar daripada orde reaksi yang sebenarnya. Dan sebaliknya, kelengkungan negatif akan teramati jika orde reaksi yang ditebak (atau diasumsikan) lebih kecil daripada orde reaksi yang sebenarnya.
Prosedur umum metode integral untuk analisis data (metode grafik): Mulai
Data-data percobaan kinetika
Tentukan model persamaan kinetika yang dianggap mewakili
Tebak orde reaksi
Integrasikan persamaan kinetika yang ditinjau
Linierisasikan persamaan yang bersesuaian
Hitung harga-harga parameter kinetikanya
Persamaan kinetika (lengkap dengan harga-harga parameter kinetikanya)
Selesai Sesuai dengan data percobaan kinetika?
Ya Tidak
2. Metode merata-ratakan harga k (k averaging procedure) – metode numerik Metode ini bersifat trial and error
dy/igsb/swm/analisis & interpretasi data kinetika-sistem reaktor batch/2007/halaman 5 dari 15 halaman Perhatikan 2 buah grafik berikut ini!! Grafik (a) menunjukkan harga-harga k yang tidak konsisten (karena adanya variasi yang cukup lebar antara harga-harga k yang dihitung pada pasangan-pasangan data yang berbeda). Grafik (b) menunjukkan harga-harga k yang relatif konsisten (karena harga-harga k yang dihitung pada pasangan-pasangan data yang berbeda tidak terlalu bervariasi).
(a) (b)
Catatan: Konsistensi harga k biasanya berarti pula bahwa harga-harga k tersebut relatif tetap (pada pasangan-pasangan data yang berbeda), dan tidak menunjukkan kecenderungan naik ataupun turun.
Beberapa macam cara perhitungan harga k: (a) Metode long-interval (b) Metode short-interval (c) Metode least-squares Ilustrasi:
Untuk pasangan data-data kinetika berikut ini:
t 0 t1 t2 t3 t4 t5
CA CA0 CA1 CA2 CA3 CA4 CA5
Jika orde reaksi yang ditebak: n = 1, maka persamaan kecepatan reaksi yang telah diintegrasi mempunyai bentuk: kt
C C ln
A 0
A = ... (*)
Dengan demikian, jika reaksi yang ditinjau benar-benar berorde-1, maka plot antara A 0 A C C ln
versus t akan menghasilkan bentuk yang linier (garis lurus). Atau, harga-harga k yang dihitung berdasarkan kinetika reaksi orde-1 akan konsisten. Langkah-langkah yang sama atau analog berlaku juga jika orde yang ditebak: selain n = 1.
(a) Metode long-interval:
t 0 t1 t2 t3 t4 t5
CA CA0 CA1 CA2 CA3 CA4 CA5
k tebakan orde-1 - 1 1 A 0 A 1 t C C ln k = 2 2 A 0 A 2 t C C ln k = 3 3 A 0 A 3 t C C ln k = 4 4 A 0 A 4 t C C ln k = 5 5 A 0 A 5 t C C ln k =
Maka, harga k rata-ratanya =
5 k k k k k i k 5 4 3 2 1
i = + + + +
∑
∑
(b) Metode short-interval:
t 0 t1 t2 t3 t4 t5
CA CA0 CA1 CA2 CA3 CA4 CA5
k tebakan orde-1 - 0 t C C ln k 1 1 A 0 A
1 = −
1 2 2 A 1 A 2 t t C C ln k − = 2 3 3 A 2 A 3 t t C C ln k − = 3 4 4 A 3 A 4 t t C C ln k − = 4 5 5 A 4 A 5 t t C C ln k − =
Maka, harga k rata-ratanya =
5 k k k k k i k 5 4 3 2 1
i = + + + +
dy/igsb/swm/analisis & interpretasi data kinetika-sistem reaktor batch/2007/halaman 6 dari 15 halaman (c) Metode least-squares
Berdasarkan metode least-squares terhadap persamaan (*), maka harga k untuk orde tebakan
n = 1, dapat dihitung dengan cara:
∑
∑
⎜⎜⎝⎛ ⎟⎟⎠⎞ = 2 i Ai 0 A i t C C ln . t kNomor 0 1 2 3 4 5 Jumlah
t 0 t1 t2 t3 t4 t5
∑
tiCA CA0 CA1 CA2 CA3 CA4 CA5
∑
CAi2
t - t12 t22 t32 t42 t52
∑
ti2A 0 A C C ln . t - 1 A 0 A 1 C C ln . t 2 A 0 A 2 C C ln . t 3 A 0 A 3 C C ln . t 4 A 0 A 4 C C ln . t 5 A 0 A 5 C C ln .
t
∑
⎟⎟⎠ ⎞ ⎜⎜ ⎝ ⎛ Ai 0 A i C C ln . t
(Ingat kembali: bagaimana cara menentukan parameter-parameter sebuah persamaan empirik dengan metode least-squares/kuadrat terkecil, pada mata kuliah lain yang bersesuaian).
3. Metode fractional-life atau metode waktu paruh (half-life)
Metode ini didasarkan pada hubungan antara fractional-life atau waktu paruh reaksi dengan konsentrasi reaktan A mula-mula (lihat kembali di dalam materi kuliah sebelumnya).
Hubungan antara waktu paruh (t½) versus konsentrasi awal reaktan:
( )
(
)
A01 nn 1 2 1 C k 1 n 1 t 2 1 − − − −
= atau:
( )
(
)
(
)
A0n 1
2
1 1 n logC
k 1 n 1 2 1 log t
log + −
⎟⎟ ⎟ ⎠ ⎞ ⎜⎜ ⎜ ⎝ ⎛ − − = −
[n ≠ 1]
Analog, hubungan antara waktu fraksional (tF) versus konsentrasi awal reaktan:
(
)
A01 n n 1 F C k 1 n 1 F t − − − −= atau:
(
)
(
)
A0n 1
F 1 n logC
k 1 n 1 F log t
log ⎟⎟+ − ⎠ ⎞ ⎜⎜ ⎝ ⎛ − −
= − [n ≠ 1]
Pada metode ini, percobaan dilakukan dengan mengukur harga-harga t½ atau tF pada berbagai variasi konsentrasi awal reaktan (CA0). Plot linier antara log t½ atau log tF versus log CA0 menghasilkan kemiringan/slope sebesar (1-n) dan intercept sebesar
( )
(
)
⎟⎟⎟ ⎠ ⎞ ⎜ ⎜ ⎜ ⎝ ⎛ − − − k 1 n 1 2 1 log n 1 atau(
)
⎟⎟⎠⎞ ⎜⎜ ⎝ ⎛ − − − k 1 n 1 F log n 1. Dengan demikian, harga orde reaksi (n) dan konstanta kecepatan reaksinya (k) dapat dihitung berdasarkan harga-harga slope dan intercept tersebut.
METODE DIFERENSIAL UNTUK ANALISIS DATA
Metode diferensial dilakukan dengan mengevaluasi seluruh term dalam persamaan kecepatan reaksi yang berbentuk diferensial (meliputi:
dt C d i , t d p d i , atau t d P d
) dan menguji kesesuaian bentuk persamaan kecepatan reaksi yang ditinjau dengan data-data yang diperoleh berdasarkan percobaan. Harga-harga parameter kinetikanya dapat ditentukan melalui prosedur atau teknik linierisasi terhadap model persamaan kinetika yang ditinjau. Jika ada 2 model persamaan kinetika yang ditinjau:
1. Bentuk: A An
A k C
dt C d
r =− =
−
Bentuk ini dapat dilinierisasi menjadi: A log k n.logCA dt
C d
log ⎟= +
⎠ ⎞ ⎜
⎝
⎛−
dy/igsb/swm/analisis & interpretasi data kinetika-sistem reaktor batch/2007/halaman 7 dari 15 halaman (Catatan: logaritma bilangan dasar 10
(log) dapat saling digantikan dengan logaritma bilangan dasar natural (ln))
2. Bentuk:
A 2
A 1 A
A
C k 1
C k dt
C d r
+ = −
= −
Bentuk ini dapat dilinierisasi menjadi: (a)
A 1 1 2
A C
1 k
1 k k
dt C d
1
+ =
− atau: 1 1 A
2
A C
1 k
1 k k r 1
+ = −
(b)
A A
2 2 1 A
C dt
C d
k 1 k k dt
C
d ⎟⎠
⎞ ⎜
⎝ ⎛− − =
− atau:
(
)
A A
2 2 1 A
C r k
1 k k
r = − − −
(a) (b) Catatan:
Selain dengan teknik linierisasi terhadap model persamaan kinetika yang dipilih (seperti yang disajikan di atas), metode diferensial juga dapat dilakukan secara trial and error.
Tinjaulah persamaan kecepatan reaksi yang dituliskan dalam bentuk umum: )
C ( f t d
C d
r A A
A =− =
−
dan f(CA) ditebak atau diasumsikan. Bentuk persamaan kecepatan reaksi tebakan tersebut dianggap sesuai jika plot antara
t d
C d
r A
A =−
− versus f (CA) menghasilkan bentuk yang linier. (lihat gambar berikut ini)
dy/igsb/swm/analisis & interpretasi data kinetika-sistem reaktor batch/2007/halaman 8 dari 15 halaman Prosedur umum metode diferensial untuk analisis data:
Mulai
Data-data percobaan kinetika: t, CA
Tentukan model persamaan kinetika yang dianggap mewakili
Linierisasikan persamaan yang bersesuaian
Hitung harga-harga parameter kinetikanya
Persamaan kinetika (lengkap dengan harga-harga parameter kinetikanya)
Selesai Sesuai dengan data percobaan kinetika?
Ya Tidak
Tentukan atau evaluasi harga-harga dCA/dt (atau kemiringan kurva) pada harga-harga CA yang dipilih Plotkan data-data CA vs t (atau gambarkan 'smooth curve'
yang merepresentasikan kecenderungan data)
Catatan:
Perhatikan 2 buah grafik di samping. Contoh smooth-curve atau freehand-curve ditunjukkan pada kurva (a). Smooth-curve harus dibuat secara hati-hati, dengan pandangan mata. Pada umumnya kurva ini tidak akan melewati semua titik data, tetapi mampu menunjukkan
kecenderungan (trendline) data. Bandingkanlah dengan kurva (b), yang melewati semua titik data, tetapi justru tidak menunjukkan
kecenderungan data.
(a) (b)
♦ Penentuan dt
C d A
Beberapa metode yang digunakan untuk mengevaluasi harga dt
C d A
: 1. Metode grafik
dy/igsb/swm/analisis & interpretasi data kinetika-sistem reaktor batch/2007/halaman 9 dari 15 halaman Perhatikanlah gambar di samping!!
Berdasarkan smooth-curve antara CA versus t yang telah dibuat, beberapa buah garis singgung dapat ditarik/dibuat secara sembarang (atau random), pada beberapa titik data yang bersesuaian.
Harga slope setiap garis singgung tersebut merupakan harga-harga
dt C d A
yang dievaluasi.
Metode diferensiasi
(a) Diferensiasi sederhana
Yakni dengan mengambil pendekatan harga:
t CA
Δ Δ
− sebagai
t d
C d A − , dan CA rata-rata
( )
CA sebagai CA pada dua pasangan data yang berdekatan.Ilustrasi:
t CA Δt - ΔCA
t CA
Δ Δ
−
A C
0 CA0
t1 – 0 CA0 - CA1
0 t
C C
1 1 A 0 A
− −
½ (CA0 + CA1) t1 CA1
t2 –t1 CA1 - CA2
1 2
2 A 1 A
t t
C C
− −
½ (CA1 + CA2) t2 CA2
t3 – t2 CA2 – CA3
2 3
3 A 2 A
t t
C C
− −
½ (CA2 + CA3) t3 CA3
dst. dst. dst. dst. dst. dst.
(b) Diferensiasi equal-area
Merupakan pengembangan dari diferensiasi sederhana (pada butir (a)). Algoritma:
Lakukan perhitungan
t CA
Δ Δ
− seperti pada butir (a).
Plotkan harga-harga
t CA
Δ Δ
− versus t ke dalam sebuah histogram (diagram batang). Buatlah sebuah garis yang mewakili
kecenderungan data-data
t CA
Δ Δ
− versus t dan yang akan memotong histogram (atau setiap batang pada histogram) menjadi dua area dengan luas yang (hampir) sama antara area bagian atas dan area bagian bawah
equal-area
Evaluasi harga-harga
t d
C d A
− berdasarkan perpotongan antara garis tersebut dengan histogram (atau setiap garis vertikal pada histogram)
ΔCA
Δt
Slope ≈ t CA
Δ Δ
Garis singgung pada kurva
t
t CA
Δ Δ
−
atau
t d
C d A −
1 A
t C
Δ Δ
−
2 A
t C
Δ Δ
−
1 A
t d
C d −
0 A
t d
dy/igsb/swm/analisis & interpretasi data kinetika-sistem reaktor batch/2007/halaman 10 dari 15 halaman Ilustrasi:
t CA Δt - ΔCA
t CA Δ Δ − t d C d A − 0 CA0 0 A t d C d −
t1 – 0 CA0 - CA1
0 t C C t C 1 1 A 0 A 1 A − − = − Δ Δ
t1 CA1
1 A t d C d −
t2 –t1 CA1 - CA2
1 2 2 A 1 A 2 A t t C C t C − − = − Δ Δ
t2 CA2
2 A t d C d −
t3 – t2 CA2 – CA3
2 3 3 A 2 A 3 A t t C C t C − − = − Δ Δ
t3 CA3 ...
dst. dst. dst. dst. dst.
dst.
(kolom ini ditentukan berdasarkan pembacaan
dari grafik) 2. Metode numerik
Finite difference
Data-data kinetika:
t 0 t1 t2 ... tk-1 tk tk+1 ... tm-2 tm-1 tm CA CA0 CA1 CA2 ... CA,k-1 CA,k CA,k+1 ... CA,m-2 CA,m-1 CA,m
Untuk data pertama :
t 2 C C 4 C 3 dt C
d A0 A1 A2
0 t A Δ − + − = ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ =
... (a)
Untuk data-data tengah :
t 2 C C dt C
d A,k 1 A,k 1
t A k Δ − + − = ⎟ ⎠ ⎞ ⎜ ⎝ ⎛
... (b)
Untuk data terakhir :
t 2 C 3 C 4 C dt C
d A,m 2 A,m 1 A,m
t t A m Δ + − = ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ − − =
... (c) Catatan: Cara ini baik diterapkan untuk data-data kinetika yang harga Δt-nya tetap. Jika pada poin k terjadi perubahan interval Δt, maka dapat digunakan persamaan (a).
Pendekatan polinomial orde-k (metode Polymath)
Cara ini dilakukan dengan memplotkan data-data CA vs t, kemudian proses curve-fitting dilakukan terhadap persamaan CA = f(t) yang didekati dengan persamaan polinomial orde k:
k k 1 k 1 k 3 3 2 2 1 0
A a a t a t a t ... a t a t
C = + + + + + − − +
sehingga:
(
)
k 1k 2 k 1 k 2 3 2 1
A a 2a t 3a t ... k 1 a t ka t
dt C
d − −
− + − + + + + =
ai merupakan konstanta-konstanta polinomial, yang terhitung dari proses curve-fiiting (atau, bisa juga ditentukan dengan paket software komputer seperti MS Excel, dsb).
Catatan:
Jika model persamaan kecepatan reaksi (dengan lebih dari satu reaktan) mempunyai bentuk umum: ...
C C k
rA = Am Bn
dy/igsb/swm/analisis & interpretasi data kinetika-sistem reaktor batch/2007/halaman 11 dari 15 halaman
( )
r logk mlogC nlogC ... log − A = + A+ B+dan selanjutnya harga-harga parameter kinetika k, m, n, ... dapat ditentukan melalui teknik least-squares dengan metode regresi multilinier (multiple linear regression).
Penentuan harga-harga parameter ini juga dapat dilakukan dengan merancang serangkaian percobaan sedemikian sehingga:
Harga m ditentukan dengan melakukan serangkaian tempuhan percobaan di mana konsentrasi reaktan B (CB) dibuat tetap, sedangkan konsentrasi reaktan A (CA) dibuat bervariasi, dan kemudian kecepatan reaksi untuk masing-masing tempuhan percobaan diukur.
Harga n ditentukan dengan melakukan serangkaian tempuhan percobaan di mana konsentrasi reaktan A (CA) dibuat tetap, sedangkan konsentrasi reaktan B (CB) dibuat bervariasi, dan kemudian kecepatan reaksi untuk masing-masing tempuhan percobaan diukur.
Harga k selanjutnya dapat ditentukan berdasarkan harga m dan n yang telah dihitung sebelumnya.
Metode percobaan seperti ini biasa disebut sebagai metode isolasi. Metode isolasi juga dapat diterapkan dengan merancang percobaan (untuk kasus reaksi dengan 2 reaktan, A dan B) di mana salah satu reaktan dikondisikan dalam konsentrasi yang berlebih dibandingkan dengan konsentrasi reaktan yang lain. Dengan demikian, konsentrasi yang berlebih ini dapat dianggap tetap (atau relatif tidak berkurang selama berlangsungnya reaksi) dan karenanya dapat dianggap sebagai suatu konstanta atau tetapan.
Contoh: Reaksi: a A + b B produk reaksi
Jika kecepatan reaksinya dituliskan dalam bentuk: −rA =k CAm CBn
dan CB dibuat berlebih (sedemikian sehingga: CB >>> CA, atau: CB = CB0 = konstanta) maka kecepatan reaksinya dapat disusun ulang menjadi:
−rA =kCAmCB0n =
(
kCB0n)
CAm =k'CAm(Perhatikanlah bahwa, pada kasus ini, kecepatan reaksi yang semula berorde [m+n] dengan konstanta kecepatan reaksi sebesar k, berubah menjadi berorde m-semu dengan konstanta kecepatan reaksi
semu sebesar k’ = k CB0n, melalui penggunaan metode isolasi)
♦ Metode Initial Rate (r0)
Metode ini merupakan salah satu bentuk metode diferensial, sama dengan metode-metode diferensial yang lain. Perbedaannya adalah hanya pada
penggunaan harga-harga kecepatan reaksi yang diukur pada t = 0 (r0), yang diperoleh dengan melakukan ekstrapolasi pada
konsentrasi-konsentrasi reaktan yang diukur pada periode waktu reaksi yang relatif singkat.
Percobaan dilakukan dengan mengukur kecepatan reaksi awal (initial rate) pada berbagai variasi konsentrasi awal reaktan, dan reaksi
dilangsungkan hanya hingga konversi reaktan pembatas yang sangat kecil (sekitar 5-10% atau kurang).
Pada metode ini, setiap pengukuran kecepatan reaksi melibatkan sebuah percobaan yang baru. Harga r0 ditentukan dengan mengukur slope awal dari masing-masing kurva konsentrasi vs waktu (pada harga konsentrasi reaktan awal yang berbeda-beda). (Perhatikan grafik di samping!!).
dy/igsb/swm/analisis & interpretasi data kinetika-sistem reaktor batch/2007/halaman 12 dari 15 halaman Berdasarkan beberapa model umum persamaan kinetika reaksi yang telah diperkenalkan sebelumnya (di atas), persamaan-persamaan kecepatan reaksi yang berdasarkan metode initial rate dapat dituliskan sebagai berikut:
n
A A kC r =
− n
0 A 0
A kC
r = −
−rA =kCAmCBn... −rA0 =kCA0mCB0n...
A 2
A 1 A
C k 1
C k r
+ = −
0 A 2
0 A 1 0 A
C k 1
C k r
+ = −
Dengan menggunakan metode initial rate, harga-harga parameter kinetika reaksi yang bersesuaian dapat ditentukan secara analog dengan menggunakan metode-metode yang telah disajikan sebelumnya.
CONTOH SOAL
Di dalam sebuah reaktor batch bervolume-tetap, reaktan A terdekomposisi menurut persamaan reaksi homogen berikut: A produk
Komposisi A dalam reaktor (CA) yang diukur pada berbagai variasi waktu t disajikan sebagai berikut:
t (detik) 0 20 40 60 120 180 300
CA (mol/liter) 10 8 6 5 3 2 1
Tentukan persamaan kinetika reaksi yang merepresentasikan data-data kinetika tersebut di atas, dengan menggunakan teknik integral dan teknik diferensial.
Persamaan kecepatan reaksi dianggap mengikuti model hukum pangkat: A An
A kC
dt C d
r =− =
−
Penyelesaian:
I. Penyelesaian dengan Teknik atau Metode Integral
Teknik integral dapat dilakukan melalui metode grafik dan metode merata-ratakan harga k (khususnya, long-interval k averaging procedure), pada beberapa harga orde reaksi yang ditebak. Untuk bentuk persamaan kecepatan reaksi: A An
A kC
dt C d
r =− =
−
dan jika ditebak:
n = 0, maka persamaan kecepatan reaksi yang telah diintegrasi menjadi: CA0 −CA =kt (a) sehingga harga k tebakan orde-0 menjadi:
t C C
k= A0− A (b)
n = 1, maka persamaan kecepatan reaksi yang telah diintegrasi menjadi: kt C C ln
A 0
A = (c)
sehingga harga k tebakan orde-1 menjadi:
t C C ln
k A
0 A
= (d)
n = 2, maka persamaan kecepatan reaksi yang telah diintegrasi menjadi: kt
C 1 C
1
0 A A
=
− (e)
sehingga harga k tebakan orde-2 menjadi: t
C 1 C
1
k A A0
−
= (f)
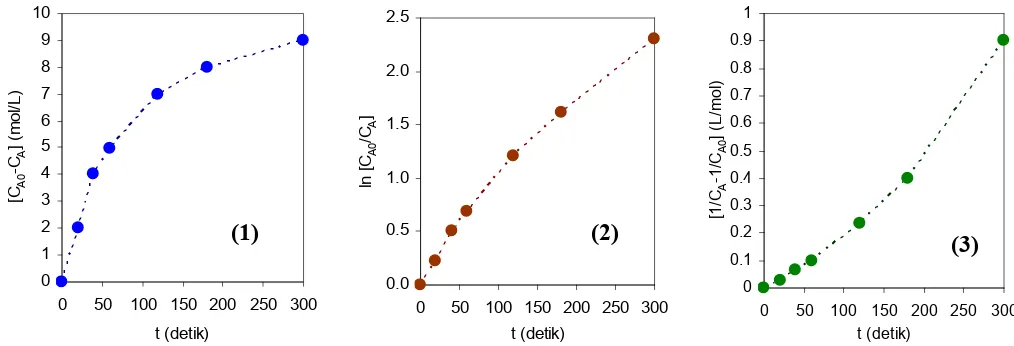
Hasil-hasil perhitungan terhadap persamaan-persamaan (a), (b), (c), (d), (e), dan (f) tersaji pada tabulasi berikut ini.
t (detik)
CA
(mol/L) CA0 - CA A 0 A
C C ln
0 A A C
1 C
1
− k tebakan orde-0 (mol/L.detik)
k tebakan orde-1 (detik-1)
k tebakan orde-2 (L/mol.detik)
1 2 3 4 5 6 7 8
0 10 0 0 0 - - -
20 8 2 0,2231 0,025 0,1 0,0112 1,25 .10-3
40 6 4 0,5108 0,0667 0,1 0,0128 1,67 .10-3
60 5 5 0,6931 0,1 0,0833 0,0116 1,67 .10-3
120 3 7 1,2040 0,2333 0,0583 0,0100 1,94 .10-3
180 2 8 1,6094 0,4 0,0444 0,0089 2,22 10-3
300 1 9 2,3026 0,9 0,03 0,0077 3,00 .10-3
Plot terhadap persamaan (a), (c), dan (e) tersaji pada 3 buah grafik berikut ini. Metode initial rate
dy/igsb/swm/analisis & interpretasi data kinetika-sistem reaktor batch/2007/halaman 13 dari 15 halaman 0
1 2 3 4 5 6 7 8 9 10
0 50 100 150 200 250 300 t (detik)
[C
A0
-C
A
] (
m
o
l/L
)
0.0 0.5 1.0 1.5 2.0 2.5
0 50 100 150 200 250 300 t (detik)
ln
[
CA0
/C
A
]
0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1
0 50 100 150 200 250 300 t (detik)
[1
/C
A
-1
/C
A0
] (
L
/mol
)
Analisis:
(a) Berdasarkan metode grafik, terlihat bahwa baik grafik (1), grafik (2), maupun grafik (3), ketiga-tiganya sama-sama tidak menunjukkan plot yang berbentuk garis lurus (linier). Hal ini berarti bahwa orde-0, orde-1, dan orde-2 bukanlah orde yang sesuai untuk kasus reaksi ini. Perhatikanlah bahwa grafik (1) dan grafik (2) mempunyai kelengkungan yang sama, yakni kelengkungan turun/negatif, sedangkan grafik (3) mempunyai kelengkungan naik/positif. Hal ini berarti bahwa orde reaksi yang sebenarnya tidak berada di antara orde-0 dan orde-1, melainkan di antara orde-1 dan orde-2.
(b) Berdasarkan metode perata-rataan harga k menggunakan long-interval procedure, terlihat dari tabel di atas bahwa harga-harga k yang dihitung untuk masing-masing tebakan orde-0, orde-1, dan orde-2 sama-sama tidak menunjukkan adanya konsistensi (karena harga-harga k-nya berubah-ubah selama interval waktu pengamatan reaksi). Dengan demikian, dapat disimpulkan bahwa orde-0, orde-1, dan orde-2 bukanlah orde yang sesuai untuk kasus reaksi ini.
(c) Karena orde reaksi yang sebenarnya belum dapat ditentukan dengan mengunakan kedua metode di atas, maka persoalan ini perlu diselesaikan dengan alternatif metode yang lain, misalnya metode waktu paruh reaksi.
Teknik Integral dengan Metode Waktu Paruh Reaksi
Hubungan antara waktu paruh reaksi dengan konsentrasi reaktan awal:
( )
(
)
A01 nn 1 2 1
C k 1 n
1 t
2 1
− −
− −
= [n ≠ 1] ... (g)
atau, jika dilinierisasikan:
( )
(
)
(
)
A0n 1
2
1 1 n logC
k 1 n
1 2 1 log t
log + −
⎟⎟ ⎟
⎠ ⎞
⎜⎜ ⎜
⎝ ⎛
− − =
−
... (h)
Persamaan (h) merupakan plot linier antara log t½ vs log CA0, dengan harga slope sebesar
(
1−n)
danintercept-nya sebesar
( )
(
)
⎟⎟ ⎟
⎠ ⎞
⎜⎜ ⎜
⎝ ⎛
− − −
k 1 n
1 2 1 log
n 1
. Dengan demikian, harga-harga n dan k dapat ditentukan
berdasarkan harga-harga slope dan intercept tersebut.
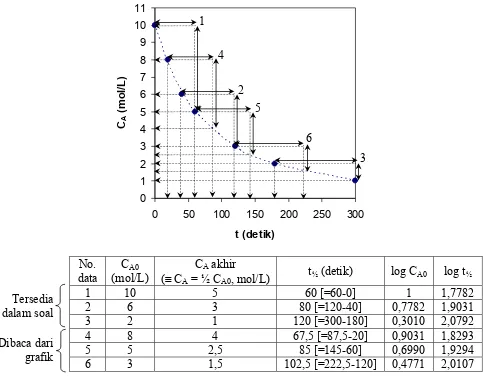
Untuk membuat tabulasi data antara t½ vs CA0, lakukan langkah-langkah berikut ini:
Plotkan data-data CA vs t, kemudian buatlah sebuah smooth curve yang mewakili kecenderungan data-data tersebut.
Ambil beberapa harga CA0 secara sembarang (dari grafik)
Hitunglah harga-harga CA masing-masing (Jangan lupa, jika menggunakan metode waktu paruh, maka: CA = ½ CA0)
Hitunglah waktu yang dibutuhkan untuk mengkonversi tiap pasangan data CA0 dan CA (dapat dilihat secara visual dari grafik)
Hasil perhitungan untuk 6 buah data CA0 yang diambil secara sembarang disajikan pada tabulasi berikut ini.
dy/igsb/swm/analisis & interpretasi data kinetika-sistem reaktor batch/2007/halaman 14 dari 15 halaman
0 1 2 3 4 5 6 7 8 9 10 11
0 50 100 150 200 250 300
t (detik)
CA
(
m
ol/L
)
No. data
CA0 (mol/L)
CA akhir
(≡ CA = ½ CA0, mol/L)
t½ (detik) log CA0 log t½
1 10 5 60 [=60-0] 1 1,7782
2 6 3 80 [=120-40] 0,7782 1,9031
3 2 1 120 [=300-180] 0,3010 2,0792
4 8 4 67,5 [=87,5-20] 0,9031 1,8293
5 5 2,5 85 [=145-60] 0,6990 1,9294
6 3 1,5 102,5 [=222,5-120] 0,4771 2,0107
Plot antara log t½ vs log CA0:
1.75 1.80 1.85 1.90 1.95 2.00 2.05 2.10
0 0.25 0.5 0.75 1 1.25
log CA0
log t
1/
2
Berdasarkan regresi linier yang bersesuaian: Slope = (1-n) = -0,422
n = 1,422 n ≈ 1,4
∴ Orde reaksinya = 1,4
Intercept =
( )
(
n 1)
k 2,2141 12 1 log
n 1
= ⎟ ⎟ ⎟
⎠ ⎞
⎜ ⎜ ⎜
⎝ ⎛
− − −
Karena n = 1,4, maka: k = 0,005
∴ Konstanta kecepatan reaksinya, k = 0,005 (L/mol)0,4.detik-1
Jadi: A A1,4
A 0,005C
dt C d r =− = −
II. Penyelesaian dengan Teknik atau Metode Diferensial
Jika teknik diferensial digunakan untuk menyelesaikan persoalan dalam kasus ini, maka bentuk persamaan kecepatan reaksi: A An
A kC
dt C d
r =− =
−
perlu diubah menjadi: A log k n.logCA dt
C d
log ⎟= +
⎠ ⎞ ⎜
⎝
⎛− atau: A lnk n.lnCA
dt C d
ln ⎟= +
⎠ ⎞ ⎜
⎝ ⎛−
agar harga-harga n dan k-nya dapat ditentukan. 1
2
3 4
5
6
Slope = -0,422 Intercept = 2,2141 R2 = 0,99
dy/igsb/swm/analisis & interpretasi data kinetika-sistem reaktor batch/2007/halaman 15 dari 15 halaman Harga
dt C d A
dievaluasi meggunakan metode menarik garis-garis singgung pada grafik CA vs t pada beberapa harga CA yang dipilih.
0 0.5 1 1.5 2 2.5 3 3.5 4 4.5 5 5.5 6 6.5 7 7.5 8 8.5 9 9.5 10 10.5 11
-25 0 25 50 75 100 125 150 175 200 225 250 275 300
t (detik)
C
A
(
m
o
l/L
)
Berdasarkan gambar di atas, dibuatlah tabulasi berikut ini. Nomor
data t (detik)
CA
(mol/L) Slope, dt C d A
, dari grafik CA vs t di atas ⎟
⎠ ⎞ ⎜
⎝ ⎛−
dt C d
log A
A
C log
1 0 10 [10-0] / [0-75] = -0,1333 -0,875 1
2 20 8 [10-0] / [-3-94] = -0,1031 -0,987 0,903
3 40 6 [10-0] / [-21-131] = -0,0658 -1,182 0,778
4 60 5 [8-0] / [-15-180] = -0,0410 -1,387 0,699
5 120 3 [6-0] / [-10-252] = -0,0238 -1,623 0,477
6 180 2 [4-1] / [24-255] = -0,0108 -1,967 0,301
7 300 1 [3-1] / [-10-300] = -0,0065 -2,190 0
Plot antara ⎟
⎠ ⎞ ⎜
⎝ ⎛−
dt C d
log A
vs logCA:
-2.5 -2.0 -1.5 -1.0 -0.5 0.0
0.0 0.2 0.4 0.6 0.8 1.0
log CA
log (
-dC
A
/d
t)
Berdasarkan regresi linier yang bersesuaian:
Slope = n = 1,3779 n ≈ 1,4
∴ Orde reaksinya = 1,4 Intercept = logk =2,2773
k = 10-2,2773 = 5,3 .10-3 k ≈ 0,005
∴ Konstanta kecepatan reaksinya,
k = 0,005 (L/mol)0,4.detik-1
Jadi: A A1,4
A 0,005C
dt C d r =− = −
Slope = 1,3779 Intercept = -2,2773 R2 = 0,98
7
6 5 4
3
2 1 4
5
6
7
Smooth curve yang merepresentasikan data
Data percobaan yang dilaporkan, 7 titik data