F
ARMAKOGENETIKA
danya banyak jalur biokimia berbeda yang terlibat dalam reaksi obat, tentunya ada beberapa gen yang mempengaruhi metabolisme obat. Tujuan dari bab ini adalah untuk memberikan ulasan tentang pengetahuan kontrol genetika pada metabolisma obat.
A
Polimorfisme genetik yang mempengaruhi metabolisme obat
Satu dari kelompok gen terpenting yang terkait dengan metabolisme obat adalah sekelompok gen sitokrom-P450. Jumlah gen P450 yang secara fungsi berbeda dalam suatu spesies sedikitnya 60 dan mungkin lebih dari 200. Produk dari sekelompok gen ini adalah enzim yang mengandung haemyang disebut sebagai mono-oksigenase, yang terdapat pada garis depan ‘pertahanan’ melawan senyawa kimia ‘asing’, yang menampilkan beberapa fungsi biokimia berbeda termasuk hidroksilasi, dehalogenasi, dealkilasi, deaminasi, dan reduksi, sebagai langkah penting pertama pada detoksifikasi.
Sementara masih banyak yang perlu dipelajari mengenai enzim-enzim ini, khususnya pada ternak domestik, telah ada bukti substansial tentang polimorfisme pada beberapa gen P450, yang berkorelasi dengan reaksi terhadap beberapa obat termasuk debrisoquin, sparteine, dextrometorphan, trycylic antidepressants, opioids, beta-adrenergic receptor antagonis, mephenytoin, mephobarbital, hexobarbital, dan diazepam. Bentuk mutan enzim P450 menghambat metabolisme obat-obat ini, yang reaksi obatnya bersifat merugikan, termasuk adanya efek samping.
Polimorfisme lain yang telah terdokumentasi secara baik pada metabolisme obat terkait dengan lokus untuk enzim N-acetyltransferase
(NAT), yang terlibat dalam sejumlah reaksi acetylation numerous. Alel cacat pada lokus ini menghasilkan deaktivasi lebih lambat pada berbagai obat termasuk isoniazid, sulphametazine dan beberapa sulfonamid lain, hydralazine, procainamide, dapsone, asam para-amino benzoic, phenelzine, dan
aminoglutethimide; serta bahan-bahan seperti clonazepam, nitrazepam, benzidine, 2-amino-fluorene, beta-naphtylamine, dan bahkan kafein! Sekali lagi, kepentingan klinis alel mutan muncul akibat efek samping yang dipicu oleh kegagalan melakukan deaktivasi kimia.
Genetika dan pembiusan
Satu dari banyak kasus yang dimengerti secara baik tentang landasan genetik mengenai respon obat pada ternak adalah reaksi terhadap pembiusan halothane pada babi, yang, seperti diterangkan pada Bab 6, telah digunakan sebagai tes untuk malignant hyperthermia syndrome (MHS). Reaktor biasanya menunjukkan gejala kekakuan pada daerah punggung setelah 2 menit dibius halothane, yang terkait dengan hyperthermia cepat yang segera manyebabkan kematian jika halothane tidak segera dipindahkan. Reaksi terhadap halothane terjadi karena homozigot untuk alel resesif, yang biasanya diberi simbol hal atau n.
Selain peran yang jelas terkait dengan MHS, hal juga penting sebab ada hubungan kuat antara reaksi halothane dan sifat-sifat penting secara ekonomi yaitu porcine stress syndrom (PSS), yang ditandai oleh kematian mendadak setelah stres kecil, dan oleh daging pucat (pale), lunak (soft), eksudatif/berair (PSE). Kebalikan dengan sifat yang tidak diinginkan ini, hal
juga mempunyai manfaat penting yaitu meningkatkan hasil daging berkadar lemak rendah (lean). (Seperti disebutkan dalam Bab 5, hal ini tampaknya merupakan contoh lain mengenai seleksi memilih heterozigot, yang menjelaskan mengapa hal tetap dalam frekuensi tinggi pada beberapa populasi di dunia.) Opini terbagi karena membuat keadaan apakah manfaatnya lebih besar daripada kerugiannya. Dalam beberapa kasus, karena perannya yang jelas, puluhan ribu babi dilakukan uji halothane di seluruh dunia setiap tahun selama tahun 1980-an, dan lokus halothane
merupakan subjek penelitian internasional. Di tahun 1991, terobosan besar terjadi saat tim peneliti Kanada yang dipimpin oleh David MacLennan melaporkan isolasi dan kloning gen halothane pada babi. Lebih lanjut, dengan membandingkan sekuen nukleotida dari dua alel (normal dan hal), MacLennan dan koleganya menunjukkan bahwa hal berbeda dari alel normal dengan substitusi 18 nukleotida. Namun demikian, hanya ada satu dari substitusi nukleotida tersebut membuat substitusi asam amino; sisanya merupakan mutasi tersembunyi (silent mutation). Ini berarti bahwa seluruh efek yang merugikan dari alel hal (MHS, PSS, dan PSE), ditambah efek yang
sebagai substitusi basa tunggal. Ini terjadi pada nukleotida ke-1843 (dimana C diganti oleh T), yang menyebakan terjadinya substitusi asam amino (arginine diganti oleh cysteine) pada posisi ke-615 dalam rantai polipeptida.
Produk polipeptida dari gen halothane mempunyai nama yang tidak sama dengan ryanodine receptor, sebab ini pertama kali diidentifikasi sebagai protein yang mengikat sangat kuat pada alkaloid tanaman yang disebut
ryanodine. Ini sebenarnya merupakan saluran pelepasan kalsium (calcium release channel/CRC) pada retikulum sarkoplasmik dari otot rangka, yang memungkinkan ion kalsium mengalir ke dalam jaringan otot yang mengitari, yang menyebabkan kontraksi otot.
Molekul CRC sangat besar, yang terdiri atas rantai tunggal berukuran sekitar 5.000 asam amino, yang artinya bahwa total sekuen penyandi dari gen tersebut kira-kira berukuran 15.000 pb. Ini membuat perbedaan substitusi basa tunggal antara alel normal dan alel hal sangat luar biasa; dua bentuk alternatif dari polipeptida dibedakan hanya oleh satu asam amino dalam sebuah rantai 5.000 asam amino! Perbedaan sederhana ini terjadi pada satu posisi dalam polipeptida yang berperan penting terhadap laju kalsium, yang kemudian menimbulkan seluruh efek (manfaat dan kerugiannya) pada gen halothane.
Kloning gen CRC telah memungkinkan dilakukannya uji DNA secara ekstensif dalam populasi babi di seluruh dunia. Indikasi awal adalah bahwa mutasi yang sama bertanggung jawab untuk seluruh kasus MHS pada babi. Pada manusia situasi ini tidak terlalu jelas; dalam beberapa keluarga mutasi yang sama seperti pada babi dikaitkan dengan MHS, tapi pada keluarga lain, MHS memisah secara independen dari gen CRC, yang mengindikasikan bahwa ada gen lain yang terlibat dalam MHS. Dengan adanya heterogenetitas pada manusia, kita seharusnya tidak terlalu heran jika suatu saat nanti kita menemukan kasus MHS pada babi yang tidak terkait dengan gen CRC.
Daya Tahan
Warfarin
Warfarin adalah antikoagulan yang digunakan secara ekstensif pada pengobatan; itu juga digunakan sebagai racun pada hewan pengerat.
Hanya lima tahun setelah diperkenalkan sebagai rodentisida di Inggris, tikus yang kebal ditemukan di lapangan. Sembilan tahun kemudian (pada tahun 1967, ketika pertamakali estimasi menjadi tersedia), frekuensi tikus yang kebal mendekati 50% dalam area dimana warfarin digunakan secara teratur, dan tampaknya frekuensi ini akan terus bertambah. Namun demikian, frekuensi tikus yang kebal tetap pada level tengah (sekitar 50%) sejak saat itu. Apakah yang menyebabkan keseimbangan tengah yang tampak stabil ini?
Jawabannya terletak pada pengertian proses penggumpalan darah. Dalam istilah sederhana, penggumpalan merupakan suatu rangkaian kompleks dalam reaksi biokimia yang melibatkan berbagai faktor penggumpalan. Beberapa faktor ini, yaitu protein II, VII, IX, dan X, membutuhkan vitamin K untuk mengaktifkannya. Secara khusus, vitamin K adalah ko-faktor untuk fase karboksilase dalam pengaktifan tersebut, dimana asam amino glutamic acid tertentu dalam polypeptide faktor pembekuan diubah menjadi asam gamma-carboxyglutamic (disebut Gla) oleh enzim γ-glutamylcarboxilase. Karboksilasi ini memungkinkan faktor pembekuan mengikat ion kalsium, yang kemudian memungkinkan faktor-faktor tersebut mengikatkan diri ke fosfolipid pada permukaannya. Ini merupakan cara bagaimana penggumpalan darah diawali. Pada saat setiap molekul vitamin K telah menyelesaikan tugas karboksilasinya, molekul ini telah menjadi vitamin K epoxide, yang kemudian dikurangi oleh enzim
epoxide reductase kembali pada bentuk aslinya, sebagai persiapan untuk siklus karboksilasi berikutnya. Proses karboksilasi yang diikuti pengurangan tersebut dinamakan siklus vitamin K .
Warfarin mempunyai struktur yang sangat mirip dengan vitamin K, dan oleh karena itu mengikat epoxide reductase, mencegahnya dari siklus ulang vitamin K epoxide. Hasilnya adalah suatu vitamin K epoxide, sutau bentuk defisiensi vitamin K, dan oleh karenanya kekurangan faktor pembekuan.
Ada beberapa bentuk yang berbeda mengenai kekebalan yang bersifat mewaris dari warfarin pada hewan pengerat. Satu dari yang paling mudah dipahami melibatkan satu alel resesif autosom, R, yang menyandi suatu bentuk yang agak berbeda dari epoxide reductase yang mempunyai daya ikat lebih rendah terhadap warfarin. Tapi karena vitamin K dan warfarin memiliki kemiripan struktur molekul, bentuk mutan epoxide reductase juga mempunyai daya ikat lebih rendah terhadap vitamin K. Konsekuensi praktis untuk ini adalah bahwa ternak homozigot untuk alel resisten memerlukan vitamin K 20 kali lipat lebih tinggi dalam makannya, untuk mengompensasi daya ikat yang rendah dari enzim yang dihasilkan oleh alel ini. Jika peningkatan kebutuhan ini tidak bisa dipenuhi, homozigot untuk alel resisten menderita kelainan pendarahan yang sama seperti homozigot yang dipicu oleh warfarin
pada ternak yang rentan, yaitu kelainan akibat kekurangan di dalam faktor pembekuan darah yang tergantung pada vitamin K.
Beberapa penelitian mengenai fitness relatif pada setiap genotype yang dihasilkan dari aksi faktor-faktor ini telah dilakukan. Menggunakan hasil dari dua penelitian di Inggris, laporan yang agak sederhana berikut ini mengilustrasikan aspek utama tentang cerita warfarin.
Karena homozigot RR mempunyai kebutuhan vitamin K lebih tinggi dibandingkan heterozigot (RS, S adalah alel normal/wild-type yang rentan),
dengan genotipe RS mempunyai fitness di antara dua homozigot, misalnya 0,46, 0,77 dan 1,00 berturut-turut untuk RR, RS, SS. Dari Bab 5, ini menjadi bukti bahwa hasil dari rangkaian fitness relatif adalah bahwa alel R mungkin dipindahkan dari populasi, atau dipertahankan pada frekuensi rendah oleh keseimbangan seleksi-mutasi.
Ketika warfarin diperkenalkan, kedua heterozigot RS dan homozigot
RR adalah resisten. Tapi homozigot RR masih mempunyai fitness lebih rendah karena kebutuhannya yang lebih besar untuk vitamin K. Dan homozigot SS mempunyai fitness yang lebih rendah dari heterozigot RS
karena mereka rentan terhadap warfarin. Oleh karena itu, dengan adanya
warfarin, ada superioritas heterozigot untuk fitness. Dalam suatu penelitian,
fitness relatif dengan adanya warfarin adalah 0,37, 1,00, dan 0,68 berturut-turut untuk RR, RS dan SS. Ini ditinggalkan bagi pembaca untuk menjelaskan, dengan menggunakan konsep yang didiskusikan pada Bab 5, bahwa konsekuensi yang diharapkan dari perubahan ini pada fitness relatif adalah kenaikan frekuensi alel R ke ekuilibrium baru 0,34, yang terkait dengan frekuensi tikus yang kebal kira-kira 0,56 pada kelahiran setiap generasi.
Ini adalah contoh klasik tentang polimorfisme stabil. Membiarkan kematian beberapa tikus RR karena kekurangan vitamin K, dan ukuran tubuhnya yang tampak lebih kecil dan kekurangan dominasi sosial, laporan di atas merupakan suatu penjelasan yang cukup untuk frekuensi yang teramati dari tikus kebal. Ini juga merupakan penjelasan yang cukup memadai untuk penurunan secara teratur dari frekuensi tikus resisten yang diamati pada area di mana penggunaan warfarin telah dikurangi setelah penggunaan ekstensif sebelumnya.
Cerita mengenai warfarin mungkin contoh yang paling dramatis dari implikasi praktis tentang variasi genetika di dalam respon terhadap obat. Meskipun penggunaan warfarin sebagai rodentisida tidak langsung berhubungan dengan penggunaanya atau obat lain pada ternak domestik atau manusia, cerita warfarin menekankan bahwa perbedaan antara individu ada dalam kaitannya dengan respon obat dan bahwa perbedaan ini kadang-kadang di bawah kontrol genetik.
Tidak mengherankan, pengaruh warfarin bisa ditiru melalui mutasi pada lokus yang menyandi enzim yang terlibat dalam siklus vitamin K. Sebagai contoh, kekurangan pada seluruh factor pembekuan yang tergantung pada vitamin K (II,VII, IX, dan X), yang dilaporkan pada kucing Devon Rex, tampaknya akibat mutasi pada lokus γ-glutamylcarboxylase
Farmakogenetika Multifaktor
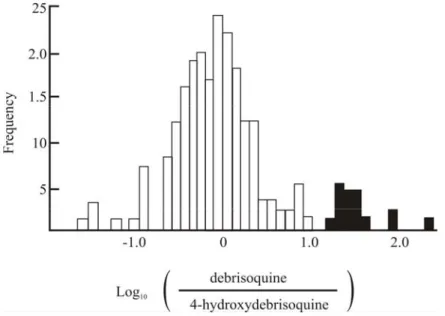
Pada contoh yang digambarkan di atas, alel pada lokus tunggal mempunyai pengaruh luas pada metabolisme obat tertentu. Ini digambarkan pada Gambar 9.1. Namun demikian, Gambar 9.1 juga menunjukkan bahwa ada variasi substansial di dalam setiap dua kelompok. Variasi ini analog dengan apa yang terlihat pada Bab 6, ketika kita membahas liability pada cacat dan penyakit: ini adalah multifaktor, yang kita maksudkan bahwa hal itu karena kombinasi dari sejumlah faktor non-genetik yang tak diketahui ditambah sejumlah gen yang tidak diketahui.
Gambar 9.1 Konsentrasi obat debrisoquine pada urin anggota populasi, setelah pemberian dosis standar obat. Konsentrasi digambarkan sebagai batang dari rasio persentase dosis yang dikeluarkan sebagai
debrisoquine pada persentase dosis yang dikeluarkan sebagai 4-hydroxydebrisoquine. Batang hitam menunjukkan homozigot untuk alel kurang metabolizer; batang putih adalah homozigot untuk alel normal atau yang heterozigot.
Jika tidak ada gen tunggal berpengaruh besar yang terlibat dalam metabolisme obat tertentu, distribusi yang dihasilkan dari konsentrasi obat dalam suatu populasi yang mengikuti dosis standar obat tersebut merupakan distribusi normal berbentuk-lonceng unimodal yang telah
bisa begitu tinggi sehingga menghasilkan pengaruh racun. Pada ekstrim yang lain, konsentrasi bisa begitu rendah sehingga obat tersebut tidak efektif. Variabilitas dalam respon terhadap dosis standar untuk obat tertentu jelas mempunyai implikasi praktis. Karena biasanya tidak ada cara untuk mengetahui, sebelum pemberian obat, dimana individu tertentu berada pada distribusi keseluruhan, ada sedikit yang dapat dilakukan dalam hal penentuan dosis yang sesuai untuk individu tertentu. Namun demikian, penting untuk diingat bahwa ada variabilitas antar individu dalam respon terhadap sebagian besar obat, dan bahwa ini kadang-kadang bisa menyebabkan toxic (bersifat racun) atau hasil yang tidak efektif dari dosis standar suatu obat.
Gambar 9.2. Distribusi kontinyu dari konsentrasi obat dihasilkan dari aksi beberapa gen dan beberapa faktor non-genetika.
Pada akhirnya, biologi molekuler dan pemetaan gen akan menyebabkan teridentifikasinya seluruh gen yang mempengaruhi metabolisme obat, termasuk obat dengan pengaruh kecil maupun besar.
Facial Eczema pada Domba
Suatu situasi tidak biasa yang bisa dikelompokkan sebagai farmakogenetik multifaktor terjadi pada penyakit facial eczema pada domba, yang disebabkan oleh jamur racun sporidesmin. Senyawa kimia ini dihasilkan oleh anggota genus Pithomyces, yang hidup di sampah mati pada lahan padang rumput di Pulau Utara Selandia Baru. Biokimia dari penyakit ini belum diketahui, tapi ada bukti penting untuk variasi multifaktor pada
respon terhadap racun: beberapa ternak tidak terpengaruh sama sekali, ternak lainnya terpengaruh pada level subklinis yang dapat menyebabkan penurunan produksi secara substansial, dan lainnya lagi menunjukan gejala klinis yang parah termasuk fotosensitivitas dan kerusakan jaringan, yang kadang-kadang menyebabkan kematian. Heritabilitas respons terhadap racun adalah sekitar 40%, yang menunjukkan kepada kita bahwa ada banyak perbedaan genetik antar individu dalam kemampuannya menanggulangi racun. Konsisten dengan nilai heritabilitas tersebut, seleksi untuk kekebalan yang meningkat tehadap dosis standar dari racun tersebut menghasilkan penurunan dramatis kejadian penyakit tersebut, dari sekitar 65% turun sampai sekitar 20% hanya dalam waktu enam tahun.
Bacaan Lebih Lanjut
Doehmer, J., Goeptar, A. R., and Vermeulen, N. P. E. (1993). Cytochromes P450 and drug resistance. Cytotechnology, 12, 357--66.
Gonzalez, F. J. and Idle, J. R. (1994). Pharmacogenetic phenotyping and genotyping - present status and future potential. Clinical Pharmacokinetics, 26, 59--70.
Kalow, W. (ed.) (1992). Pharmacogenetics of drug metabolism. Pergamon, Oxford.
Kalow, W. (1993). Pharmacogenetics--its biologic roots and the medical challenge. Clinical Pharmacology and Therapeutics, 54, 235--41.
Maclennan, D. H. (1992). The genetic basis of malignant hyperthermia. Trends in Pharmacological Sciences, 13, 330--4.
Meyer, U. A. (1994). Pharmacogenetics--the slow, the rapid, and the ultrarapid. Proceedings of the National Academy of Sciences, 91, 1983--84. Oguri, K., Yamada, H., and Yoshimura, H. (1994). Regiochemistry of
cytochrome P450 isozymes. Annual Review of Pharmacology and Toxicology, 34, 251--79.