1
PENENTUAN KADAR TOLUENA
DENGAN MENGGUNAKAN TEKNIK KROMATOGRAFI GAS
LAPORAN PRAKTIKUM KIMIA INSTRUMEN Tanggal Praktikum : 03 Desember 2010
Disusun Oleh : Kelompok 7
Risa Nurkomarasari (0800530) Ersan Yudhapratama (0801357)
Redi Ahmad Fauzi (0805450)
JURUSAN PENDIDIKAN KIMIA
FAKULTAS PENDIDIKAN MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS PENDIDIDKAN INDONESIA 2010
2
Tanggal Praktikum : 03 Desember 2010
PENENTUAN KADAR TOLUENA
DENGAN MENGGUNAKAN TEKNIK KROMATOGRAFI GAS
A. Tujuan Praktikum
1. Mahasiswa dapat mengenal cara pengoperasian instrument GC
2. Mahasiswa dapat memahami cara kerja instrumen GC untuk analisis kualitatif dan kuantitatif
3. Dapat menentukan kadar toluene dalam sampel menggunakan instrument GC
B. Tinjauan Pustaka
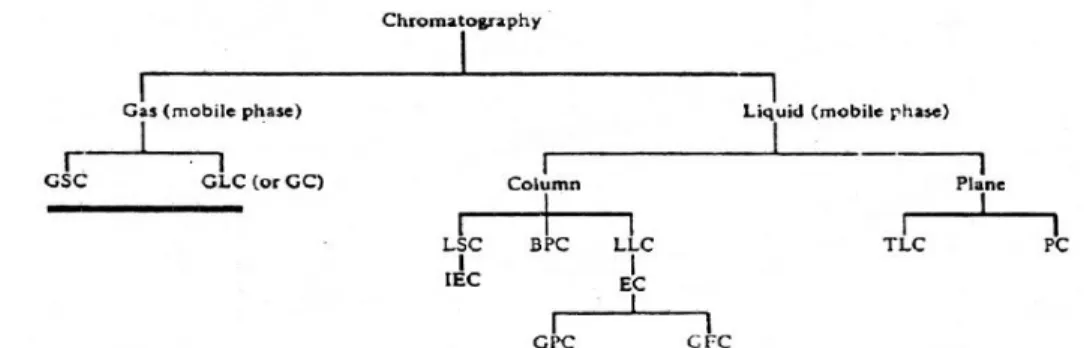
Kromatografi gas merupakan suatu metode pemisahan dan pengukuran yang didasarkan pada perbedaan distribusi komponen-komponen dalam sampel diantara dua fasa dengan menggunakan gas sebagai fasa gerak dan zat padat atau zat cair sebagai fasa diam. Berdasarkan fasa diamnya, kromatografi gas dibagi menjadi dua bagian yaitu :
1. Gas Liquid Chromatography (GLC), fasa diamnya berwujud cair. Cairan tersebut merupakan cairan yang tidak mudah menguap yang melekat pada padatan pendukung yang inert berupa butiran halus. Prinsip pemisahannya perbedaan partisi komponen-komponen dari suatu sampel di antara fasa diam dan fasa gerak.
2. Gas Solid Chromatography (GSC), fasa diamnya berwujud padat. Padatan yang digunakan misalnya karbon, zeolit dan silika gel. Prinsip pemisahannya berdasarkan adsorpsi terhadap fasa diam.
3
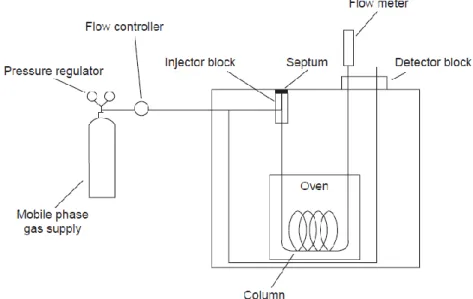
Adapun diagram alat kromatografi gas adalah sebagai berikut :
Gambar 2. Diagram alat kromatografi gas
(Harvey, David.2004 : 563) Mekanisme kerja kromatografi gas adalah sebagai berikut, gas dalam silinder baja bertekanan tinggi dialirkan melalui kolom yang berisis fasa diam. Cuplikan berupa campuran yang akan dipisahkan, biasanya dalam bentuk larutan, disuntikan ke dalam aliran gas tersebut. Kemudian cuplikan dibawa oleh gas pembawa ke dalam kolom dan di dalam kolom terjadi proses pemisahan. Komponen-komponen campuran yang telah terpisahkan satu persatu meninggalkan kolom. Suatu detector diletakan di ujung kolomuntuk mendeteksi jenis maupun jumlah komponen campuran. Hasil pendeteksian direkam dengan recorder dan dinamakan kromatogram yang terdiri dari beberapa peak. Jumlah peak yang dihasilkan menyatakan jumlah komponen (senyawa) yang terdapat dalam campuran. Sedangkan luas peak bergantung kepda kuantitas suatu komponen dalam campuran. Karena peak-peak dalam kromatogram berupa senyawa segitiga maka luasnya dapat dihitung berdasarkan tinggi dan lebar peak tersebut.
Kromatografi gas merupakan salah satu teknik kromatografi yang bias digunakan untuk memisahkan senyawa-senyawa organic. Senyawa-senyawa yang dapat ditentukan dengan kromatografi gas sangat banyak, namun ada batasannya. Senyawa-senyawa tersebut harus mudah menguap dan stabil pada temperature pengujian, utamanya dari 50-300°C. Jika senyawa tidak mudah menguap atau tidak
4
stabil pada temperature pengujian, maka senyawa tersebut bias diderivatisasi agar dapat dianalisis dengan kromatografi gas. (Tim Kimia Analitik Instrumen. 2010 : 15)
Keuntungan-keuntungan dari Kromatografi Gas antara lain :
- Kromatografi Gas akan memisahkan campuran-campuran yang mengandung banyak komponen dengan perbedaan titik didih rendah.
- Analisis cepat (biasanya 10 -15 menit)
- Sensitif (dengan detektor T.C.D. ppm, F.I.D. low ppm. E.C.D. ppb)
- Bisa dipakai untuk menganalisis berbagai macam campuran, hidrokarbon, obat, pestisida, gas-gas dan steroid-steroid.
- Mudah dioperasikan dan tekniknya terpercaya. - Volume yang diperlukan sangat kecil ( 1 – 10 μl ) - Baik pada analisa kualitatif dan kuantitatif
- Hasilnya mudah ditafsirkan
- Puncak kromatogram. Kualitatif ( dengan retensi waktu )Kuantitatif ( daerah puncak adalah konsentrasi α)
Instrumentasi kromatografi gas terdiri dari beberapa komponen yaitu
1. Gas Pembawa
Gas yang dapat digunakan sebagai fasa gerak dalam kromatografi gas harus bersifat inert (tidak bereaksi) dengan cuplikan maupun fasa diam. Gas-gas yang biasa digunakan adalah gas helium, argon, nitrogen dan hidrogen. Karena gas disimpan dalam slinder baja bertekanan tinggi karena gas tersebut akan mengalirkan dengan sendirinya secara cepat sambil mengambil atau membawa komponen-komponen campuran yang akan atau yang sudah dipisahkan. Dengan demikian gas tersebut juga pembawa (carrier gas). Oleh karena gas pembawa mengalir dengan cepat maka pemisahan denga teknik kromatografi gas hanya memerlukan waktu beberapa menit saja.
Karakteristik tiga jenis gas pembawa hidrogen, helium, dan nitrogen diperlihatkan pada gambar dibawah ini :
Gambar3. Krakteristik gas pembawa hidrogen, helium, dan nitrogrn
5
Gas N2 memerlukan kecepatan alir yang lambat (10 cm/detik) untuk mencapai kinerja (efisiensi) yang optimum dengan HETP minimum. Sementara H2 dan He dapat dialirkan lebih cepat untuk memperoleh efisiensi yang optimum, 25 cm/detik untuk gas He dan 35 cm/detik. Berdasarkan gambar diatas, terlihat bahwa kinerja H2 berkurang sedikit demi sedikit dengan kenaikan kecepatan alir. Sedangkan kinerja N2 berkurang secara drastis dengan kenaikan laju alir. Hal ini berarti bahwa H2 dapat memberikan resolusi yang hampir sama dengan yang lain pada laju alir yang lebih cepat.
Oleh karena solute lebih cepat melalui H2 dan He daripada melalui N2 maka H2 dan He memberikan resolusi yang lebih baik pada kecepatan alir tinggi. Semakin cepat solute berkesetimbangan diantara fasa gerak dan fasa diam maka semakin kecil pula faktor transfer massa. Difusi solut yang cepat dalam H2 dan He membantu mempercepat kesetimbangan di antara fasa gerak dan fasa diam sehingga meningkatkan efisiensi atau menurunkan harga HETP. Dalam hal efisiensi, H2 merupakan pilihan gas pembawa yang baik. Kalau percobaan dilakukan pada tekanan tetap, kecepatan alir akan berkurang ketika suh dinaikan. Keuntungan lain gas pembawa H2 adalah memberikan efisiensi relatif stabil dengan perubahan kecepatan alir. Sayngnya H2 mudah meledak bila berkontak dengan udara. Oleh karena itu, He banyak digunakan sebagai pengganti H2.
Kotoran yang terdapat dalam gas pembawa dapat merusak kolom secara perlahan karena fasa diam berekasi dengan kotoran tersebut. Oleh karena itu, gas berkualitas tinggi harus digunakan untuk merawat kolom dari kerusakan. Untuk menghilangkan kotoran dalam gas pembawa, biasanya gas dialirkan melalui saringan yang disebut molecular seive untuk menghilangkan air dan hidrokarbon.
Kriteria gas pembawa antara lain :
Bersifat inert dan kemurniannya tinggi Tekanan berkisar antara 10 – 50 psi Laju alir berkisar antara 25 -50 mL/mnt
6
Disesuaikan dengan detektor
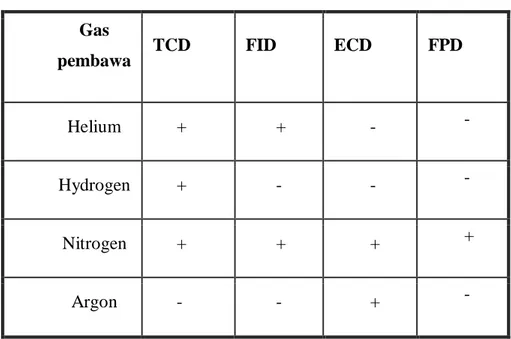
Tabel 1. Jenkis Gas Pembawa
Gas
pembawa TCD FID ECD FPD
Helium + + - -
Hydrogen + - - -
Nitrogen + + + +
Argon - - + -
2. Pemasukan Cuplikan
Cuplikan yang dapat dianalisa dengan teknik kromatografi gas dapat berupa zat cair atau gas. Dengans yarat cuplikan tersebut mudah menguap dan stabil (tidak rusak pada kondisi operasional). Ditempat pemasukan cuplikan terdapat pemanas yang suhunya dapat diatur untuk menguapkan cuplikan. Suhu tempat penyuntikan cuplikan biasanya sekitar 50 derajat di atas titik didih cuplikan. Bila cuplikan rusak pada suhu tersebut maka cuplikan tersebut tidak dapat dianalisa dengan teknik kromatografi gas. Jumlah cuplikan yang disuntikan ke dalam aliran fas gerak sekitar 5 µL.
Tempat pemasukan cuplikan cair ke dalam pak kolom biasanya terbuat dari tabung gelas di dala blok logam panas. Cuplikan disuntikan dengan bantuan alat untuk melalui karet septum kemudian diuapkan di dalam tabung gelas. Gas pembawa meniup uap cuplikan melalui kolom koromataografi. Untuk kolom analitik memerlukan antara 0,1-10 µL cuplikan cair sedangkan kolom analitik preparatif memerlukan antara 20-1000µL. Cuplikan berbentuk gas dapat dimasukan dengan bantuan alat suntik gas (gas-tight syringe) atau kran gas (gas-sampling value).
7
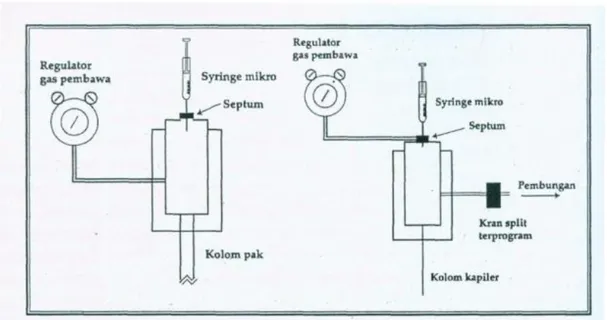
Gambar 4. Sistem pemasukan cuplikan untuk kolom pak dan kolom kapiler
Alat pemasukan cuplikan untuk kolom terbuka dikelompokkan ke dalam dua katagori yaitu injek spilt (split injection) dan injeksi splitleass (spitless injection). Injeksi split dimaksudkan untuk mengurangi volume cuplikan yang masuk ke kolom. Volume cuplikan yang masuk ke kolom hanya 0,1-10% dari 0,1-2µL, sementara sisanya dibuang.
Jenis injeksi split tidak berguna untuk analisis renik karena kebanyakan cuplikandibuang. Untuk keperluan analisis kuantitatif yang baik dan untuk analisis renik maka injeksi jenis splitless lebih cocok. Dalam hal ini, larutan encer cuplikan dalam tempat pelarut yang mudah menguap disuntuikan ke dalam tempat pemasukan cuplikan dengan keadaan kran 1 dan kran 2 tertutup. Suhu kolom mula-mula 20-250C lebih rendah dari titik didih pelarut sehingga berkondensasi pada permulaan kolom. Ketika solut terperangkap oleh kabut pelarut maka solut-solut tersebut terkumpul pada permulaan kolom yang akan membentuk peak tajam. Sebagian pelarut (dan cuplikan yang masih berbentuk uap dekat septum akan menyebabkan tailing (pelebaran peak). Oleh karena itu, setelah 20-60 detik kran 1 dibuka untuk mengeluarkan uap dekat septum. Dengan injeksi splitless, kebanyakan cuplikan (sekitar 80%) masuk kepermulaan
8
kolom disebut perangkap dingin (cold trapping). Suhu kolom mula-mula 1500C lebih rendah dari titik didih solut. Pelarut dan solut dengan titik didih rendah dielusi secara cepat tapi solut dengan titik didih rendah dielusi sebagai kumpulan kabut. Pada pemanasan kolom, pemisahaan solut-solut dengan titik didih tinggi terjadi.
3. Kolom
Kolom merupakan tempat terjadinya proses pemisahan. Untuk kromatografi gas dikenal dua jenis kolom yaitu jenis pak (packed column) dan jenis terbuka open tubular column).
Kolom pak (packed column)
Kolom pak terbuat dari stainless steel atau gelas dengan garis tengah 3-6 mm dan panjang 1-5 m. Kolom diisi dengan serbuk zat padat halus atau zat padat sebagai zat pendukung yang dilapisi zat cair kental yang sukar menguap sebagai fasa diam. Jenis kolom pak ini lebih disukai untuk tujuan preparatif karena dapat menampung jumlah cuplikan yang banyak.
Gambar 5. Kolom pak Kolom terbuka (open tubular column)
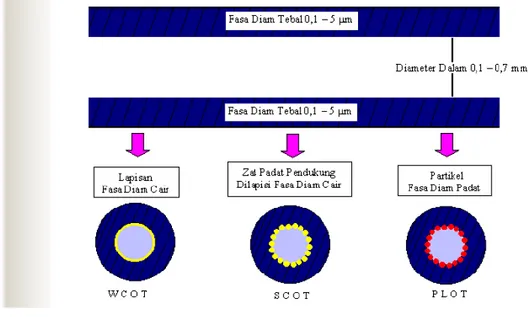
Kolom terbuka (kolom kapiler) lebih kecil dan lebih panjang daripada kolom pak. Diameter kolom terbuka berkisar antara 0,1-0,7 mm dan panjangnya berkisar antara 15-100 m. Jenis kolom ini disebut juga kolom kapiler. Untuk mempermudah penyimpanan, biasanya kolom terbuka dibentuk spiral dengan garis tengah 18 cm.
9
Gambar 6. Kolom kapiler
Tiga faktor yang mempengaruhi resolusi : efisiensi, selektifitas dan retensi. Dengan kolom terbuka, faktor-faktor tesebut akan bertambah. Jadi penggunaan kolom terbuka memberikan resolusi yang lebih tinggi daripada penggunaan kolom pak. Keuntungan lain penggunaan kolom terbuka adalah waktu analisis lebih pendek daripada penggunaa kolom pak karena fasa gerak tidak mengalami hambatan ketika melewati kolom.
Kolom terbuka terdiri dari tiga jenis yaitu untuk wall-coated open tubular solumn (wcot), fasa diam cairan kental dilapiskan secara merata pada dinding dalam kolom. Dengan rancangan support-cated open tubular column (acot), partikel zat padat pendukung seperti silika atau alumunium ditempelkan pada dinding dalam kolom. Partikel pendukung ini lebih dahulu dilapisi zat cair kental sehingga fasa diam untuk meningkatkan luas permukaan. Pada rancangan ketiga, porous-layer open tubular column (plot), partikel zat padat yang ditempatkan pada dinding dalam kolom bertindak sebagai fasa diam.
Gambar7. Kolom kapiler
Jenis kolom terbuka berupa pipa kapiler yang umumnya terbuat dari gelas yang bahan dasarnya silika, SiO2 yang mempunyai sedikit gugus silamol (Si-O-H). Fufus silanol ini dapat berikatan dengan solut menghasilkan peak tailing (peak yang melebar ke belakang) terutama kalau fasa diamnya sudah mengalami erosi. Peak tailing ini mengebabkan rendahnya efisiensi.
10
Fasa diam
Seperti telah dibahas dalam topik kolom, umumnya fasa diam yang sering digunakan dalam kromatografi gas berbentuk zat cair kental sukar menguap. Dengan demikian janis kromatografi ini disebut kromatografi partisi gas-cair. Jumlah fasa diam yang digunakan dinyatakan dalam persen zat padat pendukung. Jumlah yang umum berkisar antara 2-10%. Jika fasa diam melebihi 30% dari zat padat pendukung maka efisiensi kolom mulai berkurang. Kerugian lainnya adalah faktor kapasitas bertambah basar atau waktu retansi tambah lama. Demikian pula bila jumlah fasa diam kurang dari 2% maka permukaan zat padat pendukung tidak tertutup semuanya sehingga solut polar berikatan terlalu kuat dengan zat pendukung. Selain zat cair, beberapa zat padat dapat digunakan sebagai fasa diam seperti alumina untuk memisahkan hodrokarbon.
Pengoperasian Kolom
Kolom dapat dioperasikan dengan dua cara , yaitu : secara isotermal (temperature konstan) dan temperatur terprogram (variabel peningkatan temperatur dan waktu ditahan pada temperatur konstan).
a. Operasi Isotermal
Pada operasi isotermal, temperatur kolom dijaga konstan. Batas temperatur maksimum dan minimum dipengaruhi stabilitas dan karakter fisik fase diam. Batas bawah ditentukan oleh titik beku dan batas atas ditentukan oleh “bleed” dari fase diam. Bleed adalah fase diam masuk ke detektor. Secara umum pada mode operasional ini, injektor dioperasikan 30°C diatas temperatur komponen dengan titik didih maksimum (kolom kemasan konvensional).
Untuk pemisahan sederhana, mode isotermal sudah cukup baik. Hal ini disebabkan perbedaan antara tekanan uap dan kelarutan dari campuran komponen sudah cukup mempengaruhi pemisahan yang baik pada suhu yang dipilih. Namun, untuk campuran yang lebih kompleks, pemisahan yang kompleks membutuhkan suhu yang bervariasi.
b. Operasi temperatur terprogram (TPGC)
Pada kromatografi gas temperatur terprogram, temperatur oven dikendalikan oleh sebuah program yang dapat mengubah tingkatan pemanasan yang terjadi antara 0,25°C sampai 20°C. Sebuah oven massa rendah
11
mengijinkan pendinginan dan pemanasan cepat dari kolom yang dapat ditahan sampai 1°C dari temperatur yang diperlukan. Pada operasi temperatur terprogram diperlukan pengendali aliran untuk memastikan kesetabilan aliran gas. Kestabilan aliran sangat diperlukan untuk mencapai stabilitas hasil detektor yang baik yang ditunjukan pada garisbawah/baseline datar yang stabil. Fase diam harus stabil secara termal melewati range temperatur yang lebar. Bleed dapat diganti dengan menjalankan dua kolomyang identik secara tandem, satu untuk pemisahan komponen dan yang lain untuk melawan “bleed”.
Suhu kolom dapat diprogram, misalnya pada keadaan awal pengukuran dilakukan pada suhu kolom 400C dan pada akhir pengukuran 1500C dengan kenaikan suhu 50C per menit.
4. Detektor
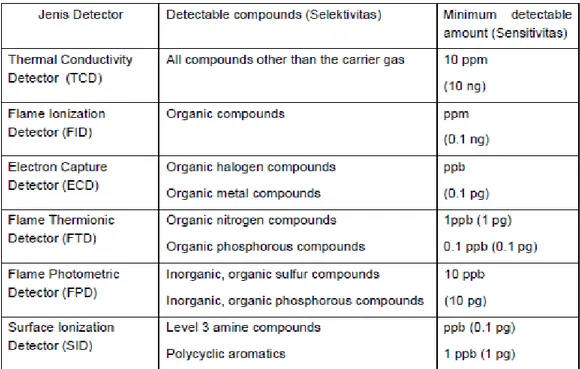
Detektor berperan mendeteksi solute-solute yang keluar dari kolom. Berbagai jenis detektor meliputi detektor daya hantar panas, detektor ionisasi nyala, detektor penangkap elektron, detektor dotometri nyala, detektor nyala alkali dan detektor spektroskopi nyala. Detektor daya hantar panas dan detektor spektroskopi nyala merupakan detektor universal sedangkan yang lainnya merupakan dengan detektor spesifik.
a. Detektor daya hantar panas (Thermal Conductivity Detector, TCD)
Detektor jenis ini mengukur kemampuan zat dalam memindahkan panas dari daerah panas ke daerah dingin. Semakin besar daya hantar semakin cepat pula panas dipindahkan. Detektor ini terdiri dari filamen panas tungsten-rhenium yang ditempatkan pada aliran gas yang datang dari arah kolom kromatografi. Selama gas pembawa mengalir secara konstan maka tahanan akan konstan dan begitu pula sinyal yang dikeluarkannya. Ketika solut keluar dari kolom maka daya hantar aliran gas menjadi menurun sehingga kecepatan pendingin filamen oleh aliran gas berkurang secara proposional. Filament menjadi lebih panas, tahanan bertambah, dan perubahan keluaran sinyal teramati.
12
Gambar8. Detektor daya hantar panas (Thermal Conductivity Detector, TCD) b. Detektor ionisasi nyala (Flame Ionization Detector, FID)
Diagram detektor ionisasi nyala diperlihatkan dalam gambar dibawah. Solut yang keluar dari kolom dicampur H2 dan udara kemudian dibakar pada nyala dibagian dalam detektor. Atom karbon senyawa organik dapat menghasilkan radikal CH yang selanjutnya menghasilkan ion CHO+ dalam nyala hidrogen udara.
CHO+ yang dihasilkan dalam nyala bergerak ke katoda yang berada diatas nyala. Arus yang mengalir di antara anoda dan katoda diukur dan diterjemahkan sebgai sinyal pada rekorder. Detektor ini jauh lebih peka daripada detektor daya hantar panas. Kepekaan detektor ionisasi nyala akan lebih meningkatkan kalau N2 digunakan sebagai gas pembawa.
Gambar9. Detektor ionisasi nyala (Flame Ionization Detector, FID)
-13
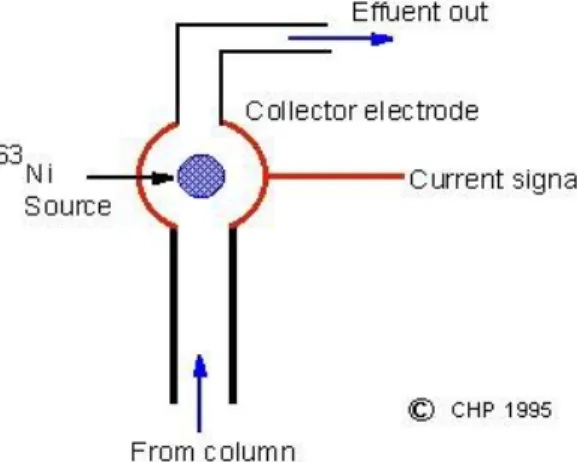
c. Detektor penangkap elektron (Electron Capture Detector, ECD)
Detektor penangkap electron mengukur kehilangan sinyal ketika analit terelusi dari kolom kromatografi. Sebagai gas pembawa dapat digunakan N2 kering atau 5% metana dalam argon. Alternatif lain, menambahkan N2 bila H2 atau He digunakan sebagai gas pembawa. Gas nitrogen yang memasuki detektor diionisasikan oleh electron bernergi tinggi (sinar beta) yang diemisikan oleh radioaktif 63Ni atau 3H. Elektron yang terbentuk ditarik ke anoda dan menghasilkan sejumlah kecil arus. Bila molekul analit yang mempunyai afinitas elektron tinggi memasuki detektor maka sebagian electron ditangkap sehingga arus yang mengalir ke anoda berkurang.
Gambar10. Detektor penangkap elektron (Electron Capture Detector, ECD) d. Detektor fotometri nyala
Detektor fotometri nayala merupakan fotometer emisi optik yang berguna untuk mendeteksi senyawa-senyawa yang mengandung fosfor atau belerang seperti pestisida dalam polutan udara. Solute yang terelusi memasuki nyala hidrogen udara seperti dalam detektor ionisasi nyala. Fosfor dan belerang tereksitasi ke tingkat energi yang lebih tinggi yang kemudian melepaskan energi dalam bentuk cahaya.
14
e. Detektor nyala alkali
Detektor ini merupakan modifikasi detektor ionisasi nyala yang selektif peka terhadap fosfor atau fosfor dan nitrogen. Detektor ini penting sekali untuk analisis obat-obatan.
f. Detektor spektroskopi massa
Spectrometer massa disambungkan dengan keluaran kromatografi gas. Ketika gas solut memasuki spektrometer massa maka molekul senyawa organik ditembaki dengan elektron berenergi tinggi sehingga molekul tersebut pecah menjadi molekul-molekul yang lebih kecil. Pecahan molekul-molekul terdeteksi berdasarkan massanya yang digambarkan sebagai spectra massa. Setiap komponen campuram yang telah terpisahkan dengan kromatografi gas akan tergambar dalam satu spectra massa.
Tabel 2. Jenis detector GC
Penerapan kromatografi gas sebagai analisis kualitatif dan analisis kuantitatif. Analisis kualitatif
Dalam kromatografi gas, jumlah peak yang tampak dalam kromatografi menunjukan jumlah komponen yang terdapat dalam campuran.
1. Cara yang paling sederhana untuk mengidenatifikasi peak kromatografi gas adalah dengan cara membandingkan waktu retensi analit dengan waktu retensi
15
standar. Untuk mendapatkan waktu retensi standar dapat dilakukan dengan percobaan kromatografi gas untuk senyawa yang diketahui.
Gambar 12. perbandingan spektrum sampel dengan spektrum standar yang baik
Namun analisa kualitatif dengan waktu retensi tidak bisa dijadikan analisa kualitatif yang baik, karena pada kromatografi gas, waktu retensi untuk satu komponen di dalam satu sampel saja, sangat sulit untuk mendapatkan waktu retensi yang sama persis pada pengulangan berikutnya. Hal inilah yang menjadikan waktu retensi tidak bisa dijadikan sebagai dasar yang baik dari analisa kualitatif pada kromatografi gas. Namun, masih ada dua cara lagi untuk dijadikan sebagai dasar analisa kualitatif dari kromatografi gas, yaitu dengan menggunakan ko-kromatografi dan dengan menggunakan instrumen tambahan.
2. Dengan melakukan ko-kromatografi
Standar ditambahkan kepada cuplikan kemudian dilakukan kromatografi gas. Bila luas salah satu peak bertambah yang dapat terlihat dari tinggi peak analit yang mengalami pertambahan luasnya identik dengan standar.
16
3. Metode spektrometri dapat digunakan untuk mengidentifikasi peak krometografi gas. Spektrometer massa atau spektrometer infra merah dapat langsung disambungkan kekolom kromatografi gas. Setiap peak dapat direkam sprektranya secara menyeluruh.
4. Setiap komponen yang telah terpisahkan dan keluar dari kolom dikondensasi untuk kemudian dilakuakn analisis spektrometri NMR sengan syarat detektor nondestruktif harus digunakan.
Analisis kuantitatif
a. Pendekatan tinggi peak
Pendekatan ini berlaku apabila lebar peak standar dan analit tidak berbeda. Dengan kata lain, kondisi kolom tidak boleh menyebabkan perubahan lebar peak. Oleh karena itu, beberapa vareiabel harus dikontrol, seperti suhu, kolom, laju alir eluen dan laju injeksi cuplikan. Selain itu volume injeksi yang berlebih (oveloading) harus dicegah. Kesalahan dengan pendekatan ini berkisar antara 5 sampai 10 %.
b. Pendekatan area peak
Area peak dapat memperhitungkan lebar peak sehingga lebar peakyang berbeda antara standar dan analit tidak masalah. Oleh karen aitu, melaului pendekatan ini lebih memuaskan daripada tinggi peak, dari sudut parameter analisis karena memperhitungkan aspek lebar peak. Akan tetapi, tinggi peak lebih mudah diukur dan lebih teliti ditentukan untuk peak yang runcing.
c. Metode kalibrasi
Analisis kuantitatif dengan metode ini kita harus mempersiapkan sederet larutan standar yang komposisinya sama dengan analit. Tiap larutan standar diukur sehingga diperoleh kromatogram untuk tiap larutan standar. Selanjutnya diplot area peak atau tinggi peak sebagai fungsi konsentrasi larutan standar. Plot data harus diperoleh garis lurus yang memotong titik nol. Sumber kesalahan pada metode ini biasanya variasi velume cuplikan dan kadang-kadang laju injeksi menjadi suatu faktor kesalahan. Kesalahan yang disebabkan oleh perubahan volume cuplikan dapat dikurangi dengan mneggunakan sistem injeksi cuplikan pada HPLC.
d. Metode normalisasi area
Metode ini dimaksudkan untuk mengurangi kesalahan yang berhubungan dengan injeksi cuplikan. Dengan metode ini diperlukan elusi yang sempurna, semua
17
komponen campuran harus keluar dari kolom. Area setiap peak yang mencul dihitung. Area-area peak tersebut dikoreksi terhadap respon detektor untuk jenis senyawa yang berbeda. Selanjutnya konsentrasi analit ditentukan dengan membandingkan area suatu peak terdapat total area semua komponen.
e. Metode standar internal atau standar dalam
Metode yang digunakan apabila tinggi dan luas peak kromatografi tidak hanya dipengaruhi oleh banyaknya contoh, tetapi juga oleh fluktuasi laju aliran gas pengemban, temperatur kolom dan detektor, dan sebagainya, yaitu oleh variasi faktor-faktor yang mempengaruhi kepekaan dan respon detektor. Efek tersebut dapat dihilangkan dengan metode standar internal yang diketahui dari zat pembanding ditambah sampel yang akan dianalisis.
C. Alat dan Bahan Praktikum
Alat
1. Instrumen GC 1 set
2. Labu takar 10 mL 7 buah
3. Gelas kimia 1 buah
4. Corong 1 buah
5. Pipet mikro 1 mL 2 buah
6. Pipet mikro 10 mL 1 buah
7. Ball Pipet 3 buah
8. Pipet tetes 1 buah
Bahan
1. Xilena p.a 2. Toluene p.a 3. Heksana p.a 4. Sampel premium
18 D. Prosedur Kerja
a) Pembuatan Deret Larutan Standar Toluena
Dibuat 5 larutan deret standar toluena dalam heksana dengan konsentrasi 5, 10, 15, 20, 25 %. Ke dalam masing-masing larutan ditambahkan xilena sehingga konsentrasi xilena dalam larutan menjadi 3%.
b) Penyiapan Sampel Premium
Disiapkan 3 mL larutan sampel premium, kemudian ditambahkan larutan premium dan toluena dengan perbandingan 3 : 1 (3,75 ; 1,25) mL.
c) Penyiapan Instrumen GC
Dilakukan pengesetan terhadap instrument kromatografi. Tombol “ON” ditekan pad sakelar listrik. Diatur suhu kolom, suhu injector dan suhu detektor. Pompa dijalankan dan alat dibiarkan stabil selama 1 jam. Diset suhu injektor 150°C. suhu detektor 200°C, dan suhu kolom 70°C dipertahankan selama 5 menit dan deprogram dengan kenaikan 1C/menit sampai 150C. Digunakan detektor MS (Spektroskopi Massa), jenis kolom HP-5 bersi polisiloksan, gas pembawa He dengan kecepatan alir gas 2,7 mL/menit. Alat kromatografi siap digunakan setelah semua parameter selesai diset.
d) Pengukuran Dengan Instrumen GC
Diambil sebanyak 0,2 μL larutan standar toluene 5% dengan syringe dan diinjeksikan dengan GC. Diulangi untuk larutan standar yang lain. Diambil sebanyak 0,2 μL sampel yang disiapkan oleh fasilitator dengan syringe dan diinjeksikan pada GC. Diambil 0,2 μL premium murni dengan syringe dan diinjeksikan pada GC. Diambil sebanyak 0,2 μL sampel premium yang sudah ditambah standar toluene dengan syringe dan diinjeksikan pada GC.
19 E. Hasil dan Analisis Data
Data Hasil pengamatan
a. Tabel Data Pengamatan dari deret standar
% Toluena % Xilena Luas Area Toluena Luas Area Xilena
Perbandingan Luas Toluena terhadap Luas Xilena (Luas Toluena:Luas
Xilena) 5 3 517735 251862 2.05562967 10 3 504326 87661 5.753139937 15 3 783527 61613 12.71691039 20 3 689020 33561 20.53037752 25 3 1161893 62880 18.47794211 % Toluena % Xilena Tinggi Toluena Tinggi Xilena
Perbandingan Tinggi Toluena terhadap Tinggi Xilena (Tinggi Toluena:Tinggi
Xilena) 5 3 149715 68203 2.195138044 10 3 149256 24908 5.992291633 15 3 225163 17820 12.63540965 20 3 201826 10465 19.28580984 25 3 324115 18659 17.37043786
b. Tabel Data Pengamatan Sampel
Jenis Sampel Luas Area Toluena
Luas Area Xilena
Perbandingan Luas Toluena terhadap Luas Xilena (Luas
Toluena:Luas Xilena)
Sampel Tidak Diketahui 772538 55627 13.88782426
Sampel Premium 1680688 868743 1.93462048
20
Perhitungan untuk menentukan kadar toluena dalam sampel yang tidak diketahui
Diketahui :
Persamaan garis dari kurva kalibrasi adalah y = 0.9524x-2.3798 R2 = 0.8960 Rasio (Perbandingan Luas Toluena : Luas Xilena) = 13.88782426
Penyelesaian :
Kadar toluena dalam sampel : 13.88782426= 0.9524x -2.3798 x = 13.88782426 +2.3789 0.9524 x = 16.26762426 0.9524 x = 17.080
Jadi kadar toluena dalam sampel sebesar 17.080%
y = 0.9524x - 2.3798 R² = 0.8960 0 5 10 15 20 25 0 10 20 30 P erb an d in ga n L u as T o lu en a : L u as X ile n a Konsentrasi toluena
Kurva Kalibrasi Konsentarsi Toluena
Terhadap Perbandingan Luas Toluena :
Luas Xilena
Linear (Perbandingan Luas Toluena : Luas Xilena)
21
Analisis Data
Pada praktikum kali ini dilakukan penentuan kadar toluena dalam sampel dengan menggunakan teknik kromatografi gas yang bertujuan untuk mengenal pengoperasian alat kromatografi gas, dan dapat memahami cara kerja instrument GC untuk analisis kualitatif dan kuantitatif.
Prinsip dasar kromatografi gas adalah suatu metode pemisahan dan pengukuran yang didasarkan pada perbedaan distribusi komponen-komponen dalam sampel diantara dua fasa yaitu fasa gerak dan fasa diamnya. Kriteria senyawa yang dapat ditentukan dengan kromatografi gas adalah senyawa yang mudah menguap dan stabil pada temperature pengujian. Toluena dan premium merupakan senyawa yang mudah menguap serta stabil pada suhu pengoperasian sehingga dapat ditentukan dengan kromatografi gas. Baik sebagai analisis kualitatif ataupun kuantitatif.
Alat/instrument yang digunakan pada praktikum kali ini adalah GC-MS, yaitu suatu alat kromatografi gas yang dihubungkan dengan detector MS (Mass Spectroscopy). Tahapan dari pengoperasian alat ini adalah menyalakan power supply, IG, MS dan GC secara berurutan, pilih Class-5000 kemudian set suhu injector sebesar 150oC, suhu kolom dan suhu detector. Suhu kolom mula-mula pada suhu 70oC selama 5 menit, kemudian terjadi kenaikan suhu sebesar 10oC/menit hingga suhu kolom 150oC. Suhu detektor diset pada suhu 200oC. Parameter lain yang harus diatur pada instrument GC-MS ini antara lain aliran fasa geraknya yaitu sebagai gas pembawa yang digunakan adalah Helium Ultra High Pure bersifat inert dan tidak bereaksi dengan fasa diam atau cuplikan. Gas helium memberkian resolusi yang lebih baik pada kecepatan alir yang tinggi karena solut berdifusi lebih cepat melalui helium dibandingkan gas nitrogen. Setelah semua parameter dikondisikan, aktifkan tuning, klik auto tune, load method yang akan digunakan, klik start tunggu beberapa start samapai hasilnya di print out, setelah selesai klik close tuning. Aktifkan method development, set GC parameter, set MS parameter, save method yang akan dideskripsikan, klik exit. Aktifkan real time analysis, pilih single sample parameter, isi deskripsi yang diinginkan. Lakukan send parameter. Tunggu hingga GC dan MS ready, kemudian sampel siap diinjeksi. Selanjutnya aktifkan Post run analysis, pilih browser untuk analisis sampel secara kualitatif menggunakan MS. Load file yang akan dianalisa, lakukan pengaturan peak top comment (peak label) dan lakukan reintegrasi. Pilih display spektrum search pada
22
peak tertentu. Lakukan report pada yang bagian yang diinginkan. Untuk mengakhiri, dinginkan temperatur injector, kolom dan detektor pada GC-MS monitor sampai temperatur ruangan (30oC). Bila sudah terkontrol, klik vacum control, lakukan auto shut down. Perangkat alat dimatikan secara berurutan dari computer, GC, MS IG kemudian gas Helium.
Suhu tempat penyuntikan cuplikan atau suhu injector biasanya sekitar 50°C di atas titik didih cuplikan. Suhu injector diset pada 150°C, hal ini sesuai dengan titik didih heksana (69°C), toluene (111°C), dan xilena (144°C) yang semuanya berada di bawah suhu injector. Sehingga ketika diinjeksikan senyawa-senyawa tersebut berubah menjadi fasa gasnya. Mode operasional pada percobaan kali ini yaitu dilakukan dengan mode suhu terprogram (suhu kolom dinaikan secara teratur selama pengukuran). Mode pemrograman suhu memberikan hasil jauh lebih baik dari pada mode isotermal. Biasanya mode isothermal menghasilkan peak yang tumpang tindih pada kromatogram sehingga sulit dilakukan identifikasi. Sedangkan pada mode terprogram komponen keluar dari kolom dengan jarak satu peak ke peak lain tidak terlalu jauh dan juga tidak terlalu berdekatan. Pada mode terprogram ini, cuplikan yang masuk ke dalam kolom ketika belum mencapai titik didihnya akan berkondensasi menjadi cairan dan menjadi gas kemudian dibawa oleh fasa gerak menuju detector ketika mencapai titik didihnya. Solut yang bertitik didih rendah dan interaksinya lemah terhadap fasa diam akan keluar lebih dulu dari kolom dan menuju detector. Sebaliknya solut yang berinteraksi kuat dengan fasa diam akan keluar lebih lama dari dalam kolom. Prinsip pengukurannya didasarkan pada respon cuplikan terhadap detector. Read out akan keluar sebagai kromatogram.
Pada praktikum kali ini, dibuat deret standar dari toluena dengan konsentrasi 5,10,15,20,25 %. Sampel yang akan ditentukan kadar toluenanya berupa sampel yang tidak beridentitas dan sampel premium. Untuk menganalisis hasil dari percobaan dengan kromatografi gas ini dapat dilakukan analisis kualitatif dan analisis kuantitatif.
Kromatografi gas dapat digunakan untuk tujuan analisis kualitatif ketika digunakan FTIR atau MS sebagai detektor yang identifikasinya berdasarkan spektrum keluarannya. Cara sederhana lain yang digunakan untuk analisis kualitatif yaitu dengan membandingkan waktu retensi analit dengan waktu retensi satndar; ko-kromatografi yaitu standar ditambahkan kepada cuplikan kemudian dilakukan kromatografi gas. Bila
23
luas salah satu peak bertambah yang dapat terlihat dari tinggi peak maka peak analit yang mengalami pertambahan luasnya identik dengan standar.
Analisa kualitatif dengan waktu retensi pada percobaan kali ini tidak bisa dijadikan analisa kualitatif yang baik, karena pada kromatografi gas, waktu retensi untuk satu komponen di dalam satu sampel saja, sangat sulit untuk mendapatkan waktu retensi yang sama persis pada pengulangan berikutnya. Hal inilah yang menjadikan waktu retensi tidak bisa dijadikan sebagai dasar yang baik dari analisa kualitatif pada kromatografi gas.
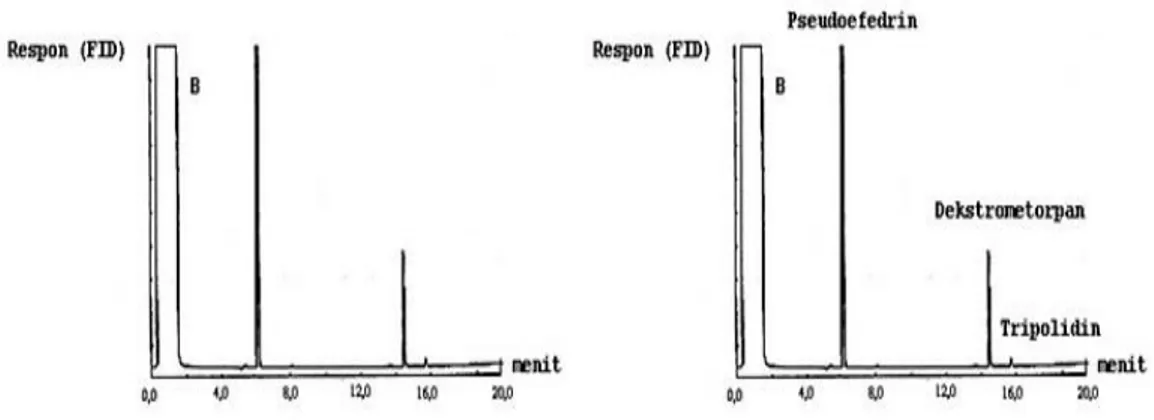
Analisis kualitatif pada percobaan kali ini dilakukan dengan menggunakan metode ko-kromatografi yaitu dengan menambahkan toluene ke dalam sampel premium. Dari profil kromatogram premium dan premium ditambah toluene dapat dilihat bahwa ada salah satu peak yaitu peak 5 yang mengalami perubahan. Sehingga dapat disimpulkan bahwa peak 5 identik dengan standar yaitu toluena.
Selain dengan metode ko-kromatografi analisis kualitatif pada percobaan kali ini juga dapat ditentukan dengan mass spectroscopy (spektroskopi massa). Dari hasil percobaan, diperoleh 15 peak yang muncul dengan waktu rettensi sampai 3,142 menit hal ini berarti ada dalam premium ada 15 komponen. Puncak pertama dianalisis dengan spektroskopi massa, yang menunjukan adanya senyawa pentane dalam sampel premium.
Dalam kromatografi gas untuk analisis kuantitatif dapat digunakan metode kalibrasi, metode standar internal, dan metode normalisasi area. Pada percobaan metode yang dipakai adalah metode standar internal, yaitu dengan menambahkan zat kedalam larutan standar dalam jumlah yang konstan, dalam hal ini xilena dengan konsentrasi tetap sebesar 3%.
Pengolahan data dilakukan dengan membuat 4 kurva kalibrasi yaitu kurva kalibrasi konsentrasi toluena terhadap luas area peak toluene, Kurva kalibrasi konsentrasi toluena terhadap tinggi peak toluene, kurva kalibrasi konsentrasi toluena terhadap perbandingan luas area peak toluena : luas area peak xilena, kurva kalibrasi konsentrasi toluena terhadap perbandingan tinggi peak toluena : tinggi peak xilena.
Jika dilihat dari profil kromatogram hasil percobaan dapat dikatakan bahwa hasil dari percobaan kali ini tidak sesuai dengan yang seharusnya. Terdapat tailing pada profil kromatogram, resolusinya tidak terlalu bagus oleh karena itu berpengaruh
24
terhadap luas area atau tinggi dari peak masing-masing komponen, seharusnya semakin tinggi konsentrasi dari larutan deret standar maka luas area dan tinggi peaknya semakin besar. Sehingga kurva yang diperoleh kelinieritasannya rendah. Di bawah ini merupakan data kelinieritasan dari 4 kurva kalibrasi :
kurva kalibrasi konsentrasi toluena terhadap luas area peak toluene R² = 0.7559 kurva kalibrasi konsentrasi toluena terhadap perbandingan luas area peak toluena :
luas area peak xilena R² = 0.8960
Kurva kalibrasi konsentrasi toluena terhadap tinggi peak toluene R² = 0.7804 kurva kalibrasi konsentrasi toluena terhadap perbandingan tinggi peak toluena :
tinggi peak xilena. R² = 0.8931
Penyimpangan ini terjadi karena ada kesalahan pada saat pembuatan larutan standar yang kurang kuantitatif atau pada saat mendorong sampel ke dalam kolom (pemasukan cuplikan) yang tidak sempurna.
Pengolahan data tidak dilakukan dengan membuang salah satu data yang menyimpang, karena jika ada data yang dibuang hasil dari perhitungan kadarnya terlalu jauh dari yang seharusnya. Sehingga dilakukan pengolahan data untuk menentukan kadar toluena dalam sampel digunakan kurva yang mempunyai regresi atau kelinieritasannya paling tinggi yaitu kurva kalibrasi konsentrasi toluena terhadap perbandingan luas area peak toluena dan luas area xilena yaitu R² = 0.8960, dengan persamaan garis y = 0.9524x-2.3798 .
Kurva kalibrasi konsentrasi toluene terhadp perbandingan luas area peak toluene memberikan regresi yang paling tinggi karena pengaruh dari metode standar internal. Metode ini digunakan apabila tinggi dan luas peak kromatografi tidak hanya dipengaruhi oleh banyaknya contoh, tetapi juga oleh fluktuasi laju aliran gas pengemban, temperatur kolom dan detektor, dan sebagainya, yaitu oleh variasi faktor-faktor yang mempengaruhi kepekaan dan respon detektor. Efek tersebut dapat dihilangkan dengan metode standar internal yang diketahui dari zat pembanding ditambah sampel yang akan dianalisis.
Setelah dilakukan perhitungan diperoleh kadar toluena dalam sampel yang tidak beridentitas sebesar 17,080 %.
25 F. Kesimpulan
Berdasarkan percobaan yang telah dilakukan, diperoleh bahwa, kadar toluena dalam sampel yang tidak beridentitas sebesar 17,080 %.
26
Daftar Pustaka
Harvey, David. (2000). Modern Analytical Chemistry. USA: The McGraw-Hill Companies.
Hendayana, Sumar. (1994). Kmia Instrumen Edisi Kesatu. Semarang : IKIP Semarang Press.
Hendayana, Sumar. (2006). KIMIA PEMISAHAN Metode Kromatografi dan Elektroforensis Modern. Bandung : PT. Remaja Rosdakarya.
Tim Kimia Analitik Instrumen. (2010). Penuntun Praktikum Kimia Analitik Instrumen (KI-431). Bandung : Jurusan Pendidikan Kimia FPMIPA UPI.
Wiryawan, Adam. Dkk. (2007). Kimia Analitik. Malang :Departemen Pendidikan Nasional
27
LAMPIRAN
1. Cara Pembuatan Larutan
Pembuatan deret larutan standar toluena Diketahui :
- % xilena dalam larutan 3%
- volume xilena = 3 100𝑥 5 mL = 0.15 mL Volume larutan =5 mL a. Toluena 5% volume toluena = 5 100x 5 mL = 0.25 mL volume heksana = (5-0.15-0.25) mL = 4.6 mL
Larutan toluena dipipet sebanyak 0.25 mL, kemudian dimasukkan ke dalam labu takar 5 mL. Setelah itu ditambahkan larutan xilena sebanyak 0.15 ml dan di tandabataskan dengan larutan heksana.
b. Toluena 10 %
volume toluena = 10
100x 5 mL = 0.5 mL
volume heksana = (5-0.15-0.5) mL
= 4.35 mL
Larutan toluena dipipet sebanyak 0.5 mL, kemudian dimasukkan ke dalam labu takar 5 mL. Setelah itu ditambahkan larutan xilena sebanyak 0.15 ml dan di tandabataskan dengan larutan heksana.
c. Toluena 15%
volume toluena = 15
100x 5 mL = 0.75 mL
volume heksana = (5-0.15-0.75) mL
= 4.1 mL
Larutan toluena dipipet sebanyak 0.75 mL, kemudian dimasukkan ke dalam labu takar 5 mL. Setelah itu ditambahkan larutan xilena sebanyak 0.15 ml dan di tandabataskan dengan larutan heksana.
d. Toluena 20 %
volume toluena = 20
28
volume heksana = (5-0.15-1) mL
= 3.85 mL
Larutan toluena dipipet sebanyak 1 mL, kemudian dimasukkan ke dalam labu takar 5 mL. Setelah itu ditambahkan larutan xilena sebanyak 0.15 ml dan di tandabataskan dengan larutan heksana.
e. Toluena 25 %
volume toluena = 25
100x 5 mL = 1.25 mL
volume heksana = (5-0.15-1.25) mL
= 3.6 mL
Larutan toluena dipipet sebanyak 1.25 mL, kemudian dimasukkan ke dalam labu takar 5 mL. Setelah itu ditambahkan larutan xilena sebanyak 0.15 ml dan di tandabataskan dengan larutan heksana.
2. Data Pengamatan
a. Pengamatan Larutan
Larutan xilena p.a : Larutan tidak berwarna
Larutan toluena p.a : Larutan tidak berwarna
Larutan heksana p.a : Larutan tidak berwarna
Larutan deret standar : Larutan tidak berwarna
Sampel premium : Larutan berwarna kuning
Larutan toluene p.a. ditambah premium : Larutan berwarna kuning pudar
b. Parameter Instrumen GC-MS
Merk Alat GC-MS : SHIMADZU QP-5050
Suhu injector : 150°C
Suhu detektor : 2000C
Suhu kolom :700C selama 25 menit deprogram
dengan kenaikan 100C/ menit sampai 1500C
Detektor : MS
29
Tekanan gas : 62,0 kPa
Kolom : HP5 (metilpolisiloksan) Panjang = 30 m; diameter = 0.32 mm
Kecepatan alir : 2,7 mL/menit
Waktu : 8 menit
c. Cara Pengoperasian Alat GC-MS
Nyalakan transformator/power supply. Tekan tombol „on” pada alat GC-MS berturut-turut pada Ion Gauge (IG), MS dan GC. Alirkan gas He. Hidupkan pula computer, monitor dan printer.
Pilih menu Class 5000, klik vacum control dan jalankan auto start up.
Aktifkan GC-MS monitor, set temperatur injector, kolom dan detektor. Tunggu hingga tekanan vakum dibawah 5 kPa.
Aktifkan tuning, klik auto tune, load method yang akan digunakan, klik start tunggu beberapa start samapai hasilnya di print out, setelah selesai klik close tuning.
Aktifkan method development, set GC parameter, set MS parameter, save method yang akan dideskripsikan, klik exit.
Aktifkan real time analysis, pilih single sample parameter, isi deskripsi yang diinginkan.
Lakukan send parameter. Tunggu hingga GC dan MS ready, kemudian lakukan injeksi sampel.
Tunggu hingga analisis selesai.
Aktifkan Post run analysis, pilih browser untuk analisis sampel secara kualitatif. Load file yang akan dianalisa, lakukan pengaturan peak top comment (peak label) dan lakukan reintegrasi. Pilih display spektrum search pada peak tertentu. Lakukan report pada yang bagian yang diinginkan.
Untuk mengakhiri, dinginkan temperatur injector, kolom dan detektor pada GC-MS monitor sampai temperatur ruangan (30oC). Bila sudah terkontrol, klik vacum control, lakukan auto shut down.
30
Matikan perangkat alat dengan urutan : computer, GC, MS IG dan gas He.
d. Data Hasil Percobaan
Tabel Data Pengamatan deret standar % Toluena % Xilena Luas Area Toluena Luas Area Xilena
Perbandingan Luas Toluena terhadap Luas Xilena (Luas Toluena:Luas
Xilena) 5 3 517735 251862 2.05562967 10 3 504326 87661 5.753139937 15 3 783527 61613 12.71691039 20 3 689020 33561 20.53037752 25 3 1161893 62880 18.47794211 % Toluena % Xilena Tinggi Toluena Tinggi Xilena
Perbandingan Tinggi Toluena terhadap Tinggi Xilena (Tinggi
Toluena:Tinggi Xilena) 5 3 149715 68203 2.195138044 10 3 149256 24908 5.992291633 15 3 225163 17820 12.63540965 20 3 201826 10465 19.28580984 25 3 324115 18659 17.37043786
Tabel Data Pengamatan Sampel Tidak Beridentitas Jenis Sampel Luas Area
Toluena
Luas Area Xilena
Perbandingan Luas Toluena terhadap Luas Xilena (Luas
Toluena:Luas Xilena)
Sampel Tidak Diketahui 772538 55627 13.88782426
Tabel Data Pengamatan
Sampel Luas area
toluena
Luas area xilena
Perbandingan Luas area toluena : xilena
31
premium + toluena p.a.
(3:1) 1180805 172770 6.834548822 Kurva Kalibrasi y = 29,460.2000x + 289,397.2000 R² = 0.7559 0 200000 400000 600000 800000 1000000 1200000 1400000 0 5 10 15 20 25 30 Lu as a rea t o lu en a Konsentrasi Toluena
Kurva Kalibrasi Konsentrasi terhadap luas
area toluena
Luas Toluena Linear (Luas Toluena)
y = 0.9524x - 2.3798 R² = 0.8960 0 5 10 15 20 25 0 5 10 15 20 25 30 P erb an d in ga n L u as a rea t o lu e n a : l u as a rea x ile n a Konsentrasi Toluena
Kurva Konsentarsi Toluena Terhadap
Perbandingan Luas Toluena : Luas Xilena
Perbandingan Luas Toluena : Luas Xilena
Linear (Perbandingan Luas Toluena : Luas Xilena)
32 y = 8,027.4000x + 89,604.0000 R² = 0.7804 0 50000 100000 150000 200000 250000 300000 350000 0 10 20 30 Ti n ggi T o lu en a Konsentrasi Toluena
Kurva Konsentrasi Toluena Terhadap
Tinggi Toluena
Tinggi Toluena Linear (Tinggi Toluena)
y = 0.8729x - 1.5974 R² = 0.8931 0 5 10 15 20 25 0 5 10 15 20 25 30 P e rb an d in ga n ti n gg i t o lu e n a : T in gg i x ile n a Konsentrasi toluena
Kurva Konsentrasi Toluena Terhadap
Perbandingan Tinggi Toluena : Tinggi
Xilena
Perbandingan Tinggi Toluena : Luas Xilena Linear (Perbandingan Tinggi Toluena : Luas Xilena)
33
Perhitungan untuk menentukan kadar toluena dalam sampel yang tidak diketahui menggunakan kurva kalibrasi konsentrasi toluana terhadap perbandingan luas area toluene : luas area xilena karena memberikan regresi paling mendekati paling tinggi (mendekati 1).
Diketahui :
Persamaan garis dari kurva kalibrasi adalah y = 0.9524x-2.3798 R2 = 0.8960
Rasio (Perbandingan Luas Toluena : Luas Xilena) = 13.88782426 Penyelesaian :
Kadar toluena dalam sampel : 13.88782426= 0.9524x -2.3798 x = 13.88782426 +2.3789 0.9524 x = 16.26762426 0.9524 x = 17.080
Jadi kadar toluena dalam sampel sebesar 17.080%
e. Dokumentasi Foto Praktikum