EFEKTIVITAS EKSTRAK DAUN MAHKOTA DEWA (Phaleria macrocarpa) SEBAGAI ANTIBAKTERI
UNTUK MENCEGAH SERANGAN BAKTERIAeromonas hydrophila PADA IKAN GURAMI (Osphronemus gouramy)
The Effectiveness of mahkota dewa (Phaleria macrocarpa) leaf extract as Antibacterial to Prevent the Aeromonas hydrophila Bacteria attack against Gouramy(Osphronemus gouramy).
1
Henny Christien, 2Yunasfi, 2Riri Ezraneti
1
Program Studi Manajemen Sumberdaya Perairan, Fakultas Pertanian, Universitas Sumatera Utara, (Email: [email protected])
2
Staf Pengajar Program Studi Manajemen Sumberdaya Perairan, Fakultas Pertanian, Universitas Sumatera Utara
ABSTRACT
Disease prevention in fish using chemicals or antibiotics lead to microbial resistance. One of alternative to control the disease is to use plant extract. This study aimed to assess the antibacterial potential of mahkota dewa (Phaleria macrocarpa) leaf extract against disease causing bacteria Aeromonas hydrophila or Motil Aeromonas Septicemia (MAS) in fry of gouramy. The research method used was an experimental laboratory through ini vitro tests and 48-hour LC50 tests. The in vitro tests used 5 treatments and 2 replications, while the 48-hour LC50 for the test as many as five treatments and three replications. Treatment for in vitro test was a paper disc soaked in a solution of mahkota dewa leaf extract at a concentration of 250 ppm, 500 ppm, 600 ppm, 750 ppm, and the control (0 ppm), then placed on an agar medium that had been overgrown with Aeromonas hydrophila, and then incubated at 370C for 24 hours. Treatment of 48-hour LC50 test remedy, namely fry 4-6 cm sized gouramy marinated in mahkota dewa leaf extract solution at a concentration of 0%, 2%, 4%, 6%, and 8% for 48 hours. Data were analyzed descriptively. In vitro test results showed that mahkota dewa leaf extract at a concentration of 2% - 8% as an antibacterial potential of Aeromonas hydrophila with inhibition zone diameters ranging from 13,53 to 20,5 mm. The test results showed 48-hour LC50 of Gouramy fry mortality by 50% for gouramy fry is soaked in a solution of mahkota dewa leaf extract at a concentration of 600.536 ppm, based on EPA Probit analysis. The concentration of mahkota dewa leaf extract is safe for gouramy fry is 10% from the 48-hour LC50 value, that is 60.0536 ppm.
Keywords : Aeromonas hydrophila, fry of Gouramy, mahkota dewa leaf
PENDAHULUAN
Indonesia memiliki perairan tawar yang sangat luas dan berpotensi besar dalam usaha budidaya berbagai jenis ikan air tawar. Potensi pengembangan perikanan budidaya dan dukungan pasar internasional yang besar, diharapkan produksi perikanan secara nasional dapat meningkat. Budidaya ikan yang dulunya
bersifat subsistem beralih menjadi budidaya yang bersifat komersial dengan pola semi-intensif ataupun intensif.
Masalah yang sering dihadapi dalam kegiatan budidaya ikan adalah adanya penyakit pada ikan yang bersifat patogenik baik dari golongan parasit, jamur, bakteri, dan virus. Menurut Kordi (2004), berkembangnya penyakit ikan dalam
proses budidaya ikan pada dasarnya disebabkan terjadinya ketidakseimbangan interaksi antara faktor lingkungan, mikroba air dan ikan yang merubah kualitas air menjadi buruk sehingga mikroba patogen berkembang dalam air dan menyerang ikan budidaya.
Satu diantara berbagai penyakit ikan yang berbahaya adalah penyakit Motile Aeromonas Septicemia (MAS) atau penyakit bercak merah yang disebabkan oleh bakteri Aeromonas hydrophila. Menurut Kamiso dan Triyanto (1993), A. hydrophila merupakan bakteri gram negatif yang bersifat patogen primer dan selalu terdapat di air, sehingga kemungkinan wabah penyakit oleh bakteri ini sangat besar. A. hydrophila menyerang berbagai jenis ikan air tawar, termasuk ikan gurami.
Dalam mengatasi serangan agens patogen pada ikan, sering menggunakan bahan kimia maupun antibiotik. Pemakaian bahan kimia dan antibiotik secara terus menerus dengan konsentrasi yang kurang tepat, akan meningkatkan resistensi terhadap bahan kimia dan antibiotik tersebut. Selain itu adanya bahaya yang ditimbulkan terhadap lingkungan, ikan, dan manusia yang mengkonsumsinya seperti pencemaran lingkungan, menurunkan nafsu makan ikan, dan adanya sifat karsinogenik bagi manusia. Untuk menghindari penggunaan bahan kimia maupun antibiotik, alternatif yang dapat dilakukan adalah pemanfaatan anti bakterial yang bersifat alami (Mulyani, dkk., 2013).
Satu dari berbagai bahan alam yang mengandung anti bakteri adalah daun Mahkota dewa (Phaleria macrocarpa) yang mengandung senyawa aktif sebagai antimikroba. Berdasarkan uraian diatas, maka perlu dilakukan penelitian mengenai efektivitas ekstrak daun Mahkota dewa sebagai antibakteri untuk mencegah serangan bakteri A. hydrophila pada ikan gurami (Osphronemus gouramy).
BAHAN DAN METODE Alat dan Bahan
Alat yang digunakan adalah cawan petri, laminar air flow, pipet tetes, gelas ukur, tabung reaksi, botol vial, beaker glass, rak tabung, inkubator, jarum ose, rotary evaporator, labu erlenmeyer, blender, kertas saring, pipet tetes, spreader, refrigerator, oven, timbangan analitik, autoklaf, vortex, hot plate, pinset, magnetic stirrer, akuarium ukuran 60 x 40 x 30 cm sebanyak 19 buah, aerator sebanyak 20 buah, DO meter, termometer, dan pH meter.
Bahan yang digunakan adalah daun mahkota dewa, Isolat Murni Bakteri A. hydrophila yang diperoleh dari Stasiun Karantina Ikan Pengendalian Mutu dan Keamanan Hasil Perikanan Kelas I Medan I, Trypticase soy agar (TSA), larutan FeCl3 1%, Pereaksi Bouchardat, Pereaksi Wagner, Pereaksi Mayer, Pereaksi Dragendroff, Larutan 0,5 Mc. Farland, Larutan CeSO4, Plat Thin Layer Cromatography (TLC), aquades, alkohol 70%, metanol, NaCl 0,9% kertas label, air, kertas cakram, kapas, alumunium foil, dan benih ikan gurami berukuran 4-6 cm sebanyak 150 ekor.
Pelaksanaan Penelitian
Penelitian ini dilakukan 3 tahap yaitu uji fitokimia, uji antibakteri (In Vitro), dan uji LC50 48 Jam. Masing-masing tahap dengan perlakuan dan pengulangan yang berbeda.
Pembuatan Ekstrak Daun Mahkota dewa
Daun Mahkota dewa segar dicuci dengan menggunakan air bersih. Kemudian daun mahkota dewa dikering-anginkan. Daun mahkota dewa yang sudah kering diblender sehingga diperoleh bubuk kering. Daun Mahkota dewa tersebut kemudian dimasukkan ke dalam maserator dan diisi dengan metanol. Maserasi dilakukan selama 2 x 24 jam. Selanjutnya hasilnya (filtrat ekstrak metanol) disaring dengan menggunakan kertas saring dan
ditampung dalam erlenmeyer sehingga diperoleh filtrat ekstrak metanol yang bebas dari kotoran. Filtrat ekstrak metanol kemudian dievaporasi dengan menggunakan rotary evaporator pada suhu 40 ᵒC dengan kecepatan 120 rpm sampai tidak terjadi lagi pengembunan pelarut pada kondensor (Rosidah dan Afiziah, 2012).
Uji Fitokimia Daun Mahkota Dewa
Uji fitokimia daun mahkota dewa merupakan uji yang dilakukan untuk mengetahui senyawa-senyawa kimia yang terdapat di dalamnya. Tahapan pengujian saponin, steroid/terpenoid, alkaloid dan fenolik dilakukan berdasarkan metode Harborne (1998) dan pengujian glikosida berasarkan metode Medika Indonesia tahun 1995.
Simplisia sebanyak 10 gram dimasukkan ke dalam labu Erlenmeyer yang telah berisi pelarut metanol 100 ml kemudian diaduk dan direndam selama 24 jam.
a. Pengujian golongan fenolik
Ekstrak sampel diambi 1 ml dimasukkan ke dalam tabung reaksi kemudian ditambah FeCl3 1% jika terjadi perubahan warna menjadi hitam maka positif terdapat senyawa fenolik.
b. Pengujian golongan alkaloid
Ekstrak sampel diambil 4 ml dimasukkan masing-masing 1 ml kedalam 4 tabung reaksi. Tabung pertama ditambah 2 tetes pereaksi Bouchardat, apabila terbentuk endapan berwarna cokelat sampai hitam maka sample positif alkaloid. Tabung kedua ditambah 2 tetes pereaksi Dragendroff, apabila terbentuk endapan berwarna merah/jingga maka sampel positif alkaloid. Tabung ketiga ditambah 2 tetes pereaksi Mayer, apabila terbentuk endapan berwarna putih/kuning maka sampel positif alkaloid. Tabung keempat ditambah 2 tetes pereaksi Wagner, apabila terbentuk endapan
berwarna cokelat maka sampel positif alkaloid.
c. Pengujian golongan terpenoid/steroid
Ekstrak diambil sebanyak 2 ml dimasukkan ke dalam tabung reaksi, kemudian ditambahkan 2 tetes pereaksi Lieberman-Bouchard. Apabila terbentuk warna biru/hijau menunjukkan adanya terpenoid/steroid.
Pengujian dengan CeSO4 dilakukan dengan metode Thin Layer Cromatography (TLC) dengan cara ekstrak sampel diteteskan ke plat TLC kemudian disemprot dengan pereaksi CeSO4 dan dipanaskan di atas hot plate. Perubahan warna yang terjadi di plat diamati dan dibandingkan dengan standar tripenoid dan β-sitosterol yang terbentuk.
d. Pengujian golongan saponin
Setelah 24 jam ampas dari proses maserasi diambil dengan spatula sebanyak 0,5 gram dan dimasukkan ke dalam tabung reaksi dan ditambahkan 10 ml aquades. Tabung reaksi dikocok hingga muncul buih. Ekstrak diberi 1 tetes HCl, bila buih terbentuk ± 10 menit maka positif terdapat senyawa saponin.
e. Pengujian flavonoid
Ekstrak sampel diambil 1 ml dimasukkan ke dalam tabung reaksi kemudian ditambah FeCl3 1% jika terjadi perubahan warna menjadi merah jingga maka positif terdapat senyawa flavonoid.
Uji In Vitro Sterilisasi Alat
Sebelum melakukan pengujian, alat dan bahan disterilisasi dengan tujuan membersihkan atau membebaskan alat dan bahan dari mikroorganisme. Alat-alat yang akan disterilisasi dicuci terlebih dahulu dengan menggunakan detergen setelah itu dikeringkan. Sebelum dimasukkan ke dalam autoklaf, cawan petri dibungkus dengan kertas sampul dan tabung reaksi ditutup dengan kapas, kemudian dibungkus dengan kertas dan diikat. Alat
dimasukkan ke dalam autoklaf, kemudian autoklaf dihidupkan dengan suhu 121 °C selama 20 menit setelah selesai autoklaf dibuka dan semua alat dipindahkan (Barus, dkk. 2013).
Pengenceran ekstrak daun Mahkota dewa
Pengenceran ekstrak daun Mahkota dewa dilakukan dengan melarutkan ekstrak daun Mahkota dewa dengan aquades kedalam wadah berupa botol vial sesuai dengan konsentrasi tiap perlakuan yaitu A. Tanpa perlakuan 0% (kontrol), B. Perlakuan ekstrak daun mahkota dewa 2,0% (0,2 gram ekstrak daun mahkota dewa dilarutkan dengan 10 ml aquades), C. Perlakuan ekstrak daun mahkota dewa 4,0% (0,4 gram ekstrak daun mahkota dewa dilarutkan dengan 10 ml aquades), D. Perlakuan ekstrak daun mahkota dewa 6,0% (0,6 gram ekstrak daun mahkota dewa dilarutkan dengan 10 ml aquades), E. Perlakuan ekstrak daun mahkota dewa 8,0% (0,8 gram ekstrak daun mahkota dewa dilarutkan dengan 10 ml aquades).
Pembuatan Media
Media TSA 10 gram ditimbang dan dilarutkan dengan 250 ml aquades dalam Erlenmeyer dan dipanaskan di atas hot plate sambil di aduk menggunakan magnetik stirrer. Selanjutnya media didinginkan, lalu Erlenmeyer ditutup dengan kapas dan dibalut alumunium foil. Selanjutnya Erlenmeyer tersebut disterilisasi menggunakan autoklaf dengan suhu 121°C selama 15 menit. Setelah selesai media TSA dituang ke dalam petridisk di dalam Laminar air flow agar tidak terjadi kontaminasi (Barus, 2013).
Pembuatan Agar Miring
Ke dalam tabung reaksi steril dimasukkan 3 ml media TSA steril, didiamkan hingga memadat pada posisi miring kira-kira 45° (Ditjen POM diacu oleh Mierza, 2011).
Peremajaan Biakan Murni
Bakteri diambil dengan menggunakan jarum ose steril, lalu ditanam pada media TSA miring dengan cara menggoreskan jarum ose yang mengandung bakteri A. hydrophila kemudian diinkubasi selama 18 - 24 jam pada suhu 36 -37oC dalam inkubator (Ditjen POM diacu oleh Mierza, 2011).
Pembuatan Larutan Suspensi
Pembuatan suspensi dilakukan dengan cara mengambil 1 sampai 2 jarum ose A. hydrophila yang dimasukkan ke dalam larutan NaCl 0,9% selanjutnya dihomogenkan dengan vortex. Kemudian, kekeruhan suspensi tersebut dibandingkan dengan larutan standar 0,5 McFarland. Bila kekeruhan suspensi tersebut tidak cocok dengan turbiditas larutan standar maka dapat ditambahkan koloni A. hydrophila pada suspensi atau mengencerkan suspensi tersebut dengan menambahkan NaCl 0,9% (Barus, 2013).
Penanaman Bakteri
Penanaman Bakteri menggunakan metode cawan sebar (spread plate) . Pada metode cawan sebar, 1 ml suspensi bakteri yang telah diencerkan disebar pada media TSA yang telah disiapkan. Selanjutnya, suspensi dalam cawan petri disebarkan dengan spreader pada suhu (37°C) selama 1-2 hari (Barus, 2013).
Uji daya hambat ekstrak daun Mahkota dewa
Kertas cakram (diameter 6 mm) diresapkan dalam larutan ekstrak. Kertas cakram tersebut kemudian diletakkan di atas permukaan media bakteri menggunakan pinset dan ditekan sedikit. Media bakteri yang sudah dipasangi bahan antibakteri diinkubasi pada suhu 37°C selama 18-24 jam. Pembacaan awal dapat dilakukan setelah 6-8 jam. Diameter zona hambatan yang terbentuk diukur menggunakan jangka sorong (Barus, 2013).
Uji LC50 48 Jam
Persiapan Wadah
Akuarium dengan ukuran 60 x 40 x 30 cm yang telah disediakan dicuci bersih dan dikeringkan. Selanjutnya akuarium diisi air sebanyak 10 liter. Akuarium tersebut dilengkapi dengan aerator.
Peletakkan Benih Ikan Gurami
Setelah dilakukan persiapan wadah, selanjutnya dimasukkan 10 ekor benih ikan gurami ke dalam tiap akuarium yang tersedia dibiarkan beradaptasi selama 1 hari.
Pembuatan Larutan Induk
Pembuatan larutan induk dilakukan dengan melarutkan ekstrak daun mahkota dewa kedalam air. Uji pengenceran berdasarkan rumus
(dengan V1 adalah volume air media yang akan digunakan, N1 adalah konsentrasi ekstrak daun mahkota dewa dalam stok,V2 adalah volume larutan standar yang digunakan, dan N2 adalah konsentrasi ekstrak daun mahkota dewa yang digunakan), dengan konsentrasi yang berbeda sebagai perlakuan, yakni A. Tanpa perlakuan 0 ppm (kontrol) (0 mg/l), B.
Perlakuan ekstrak daun Mahkota dewa 250
ppm (250 mg/l), C. Perlakuan ekstrak daun Mahkota dewa 500 ppm (500 mg/l), D. Perlakuan ekstrak daun Mahkota dewa 600 ppm (600 mg/l), dan E. Perlakuan ekstrak daun Mahkota dewa 750 ppm (750 mg/l), selanjutnya dihasilkan volume larutan induk dengan konsentrasi yang berbeda yakni A. 0 liter (Kontrol), B. 2,5 liter, C. 5 liter, D. 6 liter dan D. 7,5 liter, dan jika dijumlahkan menghasilkan 21 liter larutan induk (dari 21 liter air dimasukkan 21 gram ekstrak mahkota dewa). Setiap perlakuan dilakukan sebanyak 3 kali ulangan sehingga total air yang digunakan adalah 63 liter
Pencampuran larutan ekstrak daun Mahkota dewa ke dalam wadah
Setelah benih ikan gurami dimasukkan kedalam tiap akuairum yang telah berisi air, selanjutnya dilakukan pengurangan volume air di tiap-tiap akuarium sesuai terhadap volume larutan induk ekstrak dengan konsentrasi yang berbeda sebagai perlakuan yakni Akuarium perlakuan A. 10 liter – 0 liter = 10 liter; Akuarium perlakuan B. 10 liter – 2,5 liter = 7,5 liter; Akuarium perlakuan C. 10 liter – 5 liter = 5 liter; Akuarium perlakuan D. 10 liter – 6 liter = 4 liter; dan Akuarium perlakuan E. 10 liter – 7,5 liter = 2,5 liter. Selanjutnya dilakukan proses pencampuran larutan induk sesuai konsentrasi kedalam tiap-tiap akuarium yakni Akuarium perlakuan A. 10 liter air akuarium + 0 liter larutan induk = 10 liter; Akuarium perlakuan B. 7,5 liter air akuarium + 2,5 liter larutan induk = 10 liter; Akuarium perlakuan C. 5 liter air akuarium + 5 liter larutan induk ekstrak = 10 liter; Akuarium perlakuan D. 4 liter + 6 liter = 10 liter; dan Akuarium perlakuan E. 2,5 liter + 7,5 liter = 10 liter. Uji LC50 48 jam ini dilakukan masing-masing sebanyak 3 ulangan.
Pengamatan Kualitas Air
Untuk menjaga kualitas air selama percobaan dilakukan penyiponan setiap hari. Parameter kualitas air yang diukur meliputi suhu, DO, dan pH. Pengukuran dilakukan selama 2 hari pada pagi dan sore hari. Dokumentasi kegiatan penelitian dapat dilihat pada Lampiran 2.
Analisis Data
Untuk zona hambat, analisis data menggunakan ANOVA, dan apabila terdapat perbedaan yang nyata dilakukan uji BNT. Selanjutnya untuk analisis data uji LC50 48 jam dengan menggunakan software Analisis EPA Probit.
HASIL DAN PEMBAHASAN Hasil
Uji Fitokimia Daun Mahkota Dewa
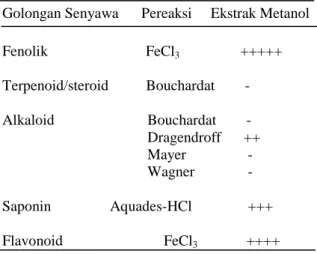
Hasil pengujian ekstrak daun mahkota dewa memperlihatkan bahwa ekstrak metanol daun mahkota dewa mengandung senyawa fenolik, alkaloid, saponin, dan flavonoid. Hasil pengujian fitokimia daun mahkota dewa dengan pelarut metanol dapat dilihat pada Tabel 1. Tabel 1.Hasil uji fitokimia masing-masing ekstrak daun mahkota dewa
Golongan Senyawa Pereaksi Ekstrak Metanol
Fenolik FeCl3 +++++ Terpenoid/steroid Bouchardat - Alkaloid Bouchardat - Dragendroff ++ Mayer - Wagner - Saponin Aquades-HCl +++ Flavonoid FeCl3 ++++ Uji In Vitro
Ekstrak daun mahkota dewa menunjukkan adanya zona hambat pada bakteri A. hydrophila sebagai bakteri uji. Hasil pengamatan menunjukkan adanya peningkatan diameter zona hambat pada bakteri A. hydrophila pada masing-masing konsentrasi. Pengaruh setiap konsentrasi terhadap diameter zona bening dapat dilihat pada Gambar 3
Gambar 3. Pengaruh setiap konsentrasi terhadap diameter zona bening
Hasil pengujian ekstrak daun mahkota dewa terhadap pertumbuhan bakteri A. hydrophila menunjukkan adanya zona hambat pada ekstrak. Besarnya zona hambat yang dihasilkan oleh ekstrak terlihat dengan adanya zona hambat di sekitar cakram (Gambar 4.)
(1) (2)
Gambar 4. Zona hambat (1) ulangan I (2) ulangan II ekstrak daun mahkota dewa dengan pelarut metanol terhadap pertumbuhan bakteri A. hydrophila
Uji LC50 48 Jam
Semakin besar konsentrasi ekstrak daun mahkota dewa yang dilarutkan dalam setiap akuarium benih ikan gurami menunjukkan peningkatan jumlah kematian. Pengaruh setiap konsentrasi terhadap mortalitas dapat dilihat pada Gambar 5.
Gambar 5. Pengaruh setiap konsentrasi terhadap mortalitas
Ekstrak daun mahkota dewa yang dilarutkan dalam setiap akuarium benih
14.05 16 18 20 13 14 16.5 21 0 5 10 15 20 25 2.00% 4.00% 6.00% 8.00% KONSENTRASI EKSTRAK DAUN MAHKOTA DEWA
D IA M E T E R Z O N A B E N IN G (m m ) ulangan 1 ulangan 2 Rata-rata
ikan gurami sebagai hewan uji menunjukkan jumlah kematian yang berbeda setiap jam pengamatan. Mortalitas pertama terjadi pada jam ke- 6 pada konsentrasi 600 ppm dan 750 ppm. Hasil pengamatan mortalitas ikan uji pada setiap jam pengamatan dapat dilihat pada Lampiran 6.
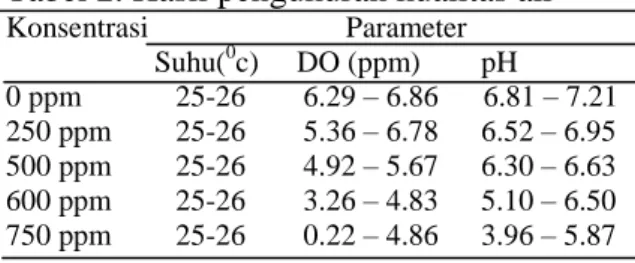
Pengukuran kualitas air dilakukan setiap hari pada pagi dan sore hari. Parameter kualitas air yang diukur meliputi suhu, DO, dan pH. Hasil pengukuran kualitas air setiap konsentrasi dapat dilihat pada Tabel 2.
Tabel 2. Hasil pengukuran kualitas air
Konsentrasi Parameter Suhu(0c) DO (ppm) pH 0 ppm 25-26 6.29 – 6.86 6.81 – 7.21 250 ppm 25-26 5.36 – 6.78 6.52 – 6.95 500 ppm 25-26 4.92 – 5.67 6.30 – 6.63 600 ppm 25-26 3.26 – 4.83 5.10 – 6.50 750 ppm 25-26 0.22 – 4.86 3.96 – 5.87 Pembahasan
Uji Fitokimia Daun Mahkota Dewa
Hasil uji fitokimia fenolik menunjukkan hasil positif pada pelarut metanol ditandai dengan terjadinya perubahan warna menjadi ungu gelap setelah diberi FeCl3 seperti yang terlihat pada Lampiran 3. Sukarja (1992) diacu oleh Dewi (2013) menyatakan bahwa ciri khas fenolik adalah terbentuk warna biru atau ungu dengan besi (III) klorida. Warna yang terbentuk diduga berupa besi (III) heksa fenolat sehingga uji ini memberikan indikasi gugus OH aromatik. Menurut Robinson (1995), beberapa senyawa fenolik bersifat menolak atau racun terhadap hewan pemangsa tumbuhan (herbivor), beberapa bersifat racun serangga (insektisida), sementara senyawa fenol yang lain mempengaruhi perkembangbiakan binatang pengerat.
Hasil uji fitokimia terpen/steroid menunjukkan hasil negatif pada pereaksi CeSO4 hal ini didasarkan bahwa tidak adanya perubahan warna menjadi biru hijau setelah dipanaskan diatas hotplate seperti yang terlihat pada Lampiran 3. Hal
ini berbeda dengan pernyataan Sofianti (2006) yang menunjukkan adanya kandungan terpen/steroid pada ekstrak etanol daun muda dan daun tua mahkota dewa. Menurut Sofianti (2006), perbedaan kandungan metabolit sekunder pada jenis tanaman yang sama seringkali terjadi karena pengaruh lingkungan. Pernyataan tersebut didukung oleh Kardono (2003) yang diacu oleh Septiawati (2008) bahwa perbedaan kandungan metabolit sekunder pada jenis tanaman yang sama seringkali terjadi karena perbedaan jenis pelarut yang digunakan saat ekstraksi, variasi genetik, individual, dan kondisi geografis tempat tumbuh.
Hasil uji fitokimia alkaloid menunjukkan hasil negatif pada pereaksi Bouchardat, Mayer, dan Wagner. Uji fitokimia alkaloid menunjukkan hasil positif pada pereaksi Dragendroff ditandai dengan adanya endapan merah jingga seperti yang terlihat pada Lampiran 3. Menurut Harbone (1987) uji alkaloid dilakukan berdasarkan reaksi warna dengan pereaksi Dragendrof dan terbentuk endapan merah jingga diperkirakan endapan tersebut adalah kalium alkaloid. Robinson (1995) menyatakan bahwa alkaloid tersebar luas di dunia tumbuhan. Berbagai perkiraan menyatakan bahwa presentase jenis tumbuhan yang mengandung alkaloid terletak dalam rentang 15-30%. Satu-satunya sifat kimia alkaloid yang paling penting adalah kebasaannya. Metode pemurnian dan pencirian umumnya mengandalkan sifat ini. Alkaloid biasanya diperoleh dengan cara mengekstraksi bahan tumbuhan dengan memakai air yang diasamkan yang melarutkan alkaloid.
Hasil uji fitokimia saponin menunjukkan hasil positif pada pelarut metanol ditandai dengan munculnya buih setelah diberi aquades kemudian dikocok selama ± 10 menit seperti yang terlihat pada Lampiran 3. Menurut Robinson (1995) Saponin mula-mula diberi nama demikian karena sifatnya yang menyerupai sabun (bahasa Latin Sapo berarti sabun).
Saponin adalah senyawa aktif permukaan yang kuat bekerja sebagai antimikroba dan menimbulkan busa jika dikocok dalam air dan pada larutan yang sangat kental, saponin sangat beracun untuk ikan. Suparjo (2008) menyatakan bahwa saponin mengandung senyawa polar yang dapat larut dalam air dan sifat non polar karena memiliki gugus hidrofob yaitu aglikon. Oleh karena itulah dapat terbentuk busa karena saponin terdirpersi diantara senyawa polar dan non polar.
Hasil uji fitokimia flavonoid menunjukkan hasil positif terhadap pereaksi FeCl3 ditandai dengan warna merah jingga seperti yang terlihat pada Lampiran 3. Rohyami (2008) menjelaskan bahwa flavonoid merupakan termasuk senyawa fenolik alam yang potensial sebagai antioksidan dan mempunyai bioaktivitas sebagai obat. Salah satu tanaman yang mengandung flavonoid adalah mahkota dewa (P. macrocarpa). Senyawa ini ditemukan pada batang, daun, dan buah. Menurut Sofianti (2006), Secara semi kuantitatif, diketahui bahwa ekstrak daun muda dan daun tua mahkota dewa memiliki kandungan kelompok senyawa yang sama.
Uji In Vitro
Hasil pengamatan terhadap uji in vitro menunjukkan larutan ekstrak daun mahkota dewa dapat menghambat pertumbuhan bakteri, terlihat dari terbentuknya zona bening di sekitar kertas cakram, zona bening tersebut menunjukkan zona hambat pertumbuhan bakteri. Setiap konsentrasi memberikan diamater zona hambat yang berbeda, hal ini mengindikasikan bahwa setiap konsentrasi memberikan respon daya hambat yang berbeda terhadap pertumbuhan bakteri. Pada Gambar 4. menunjukkan kertas cakram yang tidak mengandung larutan ekstrak daun mahkota dewa (kontrol) menyebabkan pertumbuhan bakteri Aeromonas hydrophila tidak terhambat, terbukti dari diameter zona bening 0 mm.
Menurut Brock dan Mardigan (1994), keefektifan senyawa antibakteri tergantung dari jenis bakteri dan karakteristik bakteri. Bakteri A. hydrophila termasuk gram negatif, oksidasi positif dan mampu memfermentasikan beberapa jenis gula, seperti glukosa, fruktosa, maltosa, dan trehalosa.
Hasil pengukuran rata-rata diameter zona hambat bakteri dengan menggunakan ekstrak daun mahkota dewa antara 13,53 mm hingga 20,5 mm. Diameter zona hambat terkecil diperoleh pada konsentrasi ekstrak daun mahkota dewa 2% dan yang terbesar 8% yang dapat dilihat pada Gambar 3. Hal ini memperlihatkan bahwa semakin besar konsentrasi yang digunakan, semakin besar diameter zona hambat yang diperoleh, artinya aktivitas antibakteri ekstrak daun mahkota dewa semakin meningkat dengan meningkatnya konsentrasi ekstrak tersebut. Sebagaimana pendapat Lesmanawati (2006) bahwa banyaknya jumlah koloni yang tumbuh menunjukkan besarnya daya antibakteri suatu bahan. Semakin sedikit koloni bakteri yang tumbuh maka semakin baik daya antibakteri dari bahan tersebut.
Menurut pendapat Bell (1984) jika diameter zona hambat yang terbentuk lebih besar atau sama dengan 6 mm, maka ekstrak dikategorikan memiliki aktivitas antibakteri dan bila diameter zona hambat yang terbentuk lebih kecil dari 6 mm atau tidak terbentuk maka ekstrak tersebut dikategorikan tidak memiliki aktivitas antibakteri. Pada Gambar 3. Menunjukkan zona hambat yang dihasilkan lebih besar dari 6 mm, maka dapat disimpulkan bahwa ekstrak daun mahkota dewa pada konsentrasi 2% hingga 8% memiliki aktivitas antibakteri terhadap bakteri A. hydrophila. Semakin besar konsentrasi ekstrak daun mahkota dewa, maka bahan aktif sebagai antibakteri semakin besar pula. Lisdawati (2002) menyatakan bahwa adanya aktivitas antibakteri ini disebabkan oleh kandungan senyawa-senyawa yang yang terdapat dalam mahkota dewa.
Toksisitas mahkota dewa yang sangat tinggi menyebabkan tanaman ini memiliki aktivitas antimikroba, seperti halnya tanaman marga phaleria lainnya.
Hasil pengamatan antibakteri ekstrak daun mahkota dewa menunjukkan adanya zona bening di tiap perlakuan selain perlakuan kontrol yang tidak mengandung ekstrak daun mahkota dewa. Zona bening yang terbentuk ini disebabkan karena adanya aktifitas senyawa aktif dari golongan alkaloid, saponin dan fenolik yang dikandung ekstrak daun mahkota dewa ini sebagai anti bakteri yang dapat dilihat pada Tabel 1. Hal ini sesuai dengan pemaparan Sofianti (2006) yang menyatakan bahwa dari hasil analisis fitokimia diketahui ekstrak etanol daun muda dan daun tua mahkota dewa menunjukkan adanya alkaloid, senyawa fenolik, dan saponin.
Buckley dkk.,(1981) diacu oleh Rahman (2008) menjelaskan bahwa cara kerja zat antimikrobial alkaloid dan flavonoid terhadap bakteri A. hydrophila diduga dengan menghambat kerja enzim bakteri sehingga mengganggu reaksi biokimiawi dan mengakibatkan terganggunya metabolisme atau matinya sel bakteri A. hydrophila dan diduga pula adanya penghambatan pembentukan enzim berupa toksin ekstraseluler yang merupakan faktor virulensi bakteri A. hydrophila.
Hasil analisa data zona hambat dengan menggunakan uji ANOVA menunjukkan pengaruh nyata (P<0,05). Data rinci uji ANOVA dapat dan dapat dilihat pada Lampiran 4. Analisa data dengan uji BNT menunjukkan semakin besar konsentrasi ekstrak daun mahkota dewa, semakin besar pula zona hambat bakteri A. hydrophila yang terpapar ekstrak daun mahkota dewa tersebut. Pengaruh sangat nyata konsentrasi ekstrak daun mahkota dewa terhadap besarnya zona hambat bakteri A. hydrophila pada selang kepercayaan 99% (P<0,001) (Lampiran 6.)
Uji LC50 48 Jam
Pengujian LC50 48 jam ekstrak daun mahkota dewa terhadap benih ikan gurami memperlihatkan mortalitas 50% berada pada konsentrasi 600 ppm. Pada Lampiran 5. Software analisis EPA probit menunjukkan konsentrasi ekstrak daun mahkota dewa sebesar 600,536 ppm menyebabkan kematian benih ikan gurami sebanyak 50% dalam waktu 48 jam. Semakin tinggi konsentrasi ekstrak daun mahkota dewa, maka jumlah kematian benih ikan gurami pun semakin banyak yang dapat dilihat pada Lampiran 6. Hal ini terjadi karena ekstrak daun mahkota dewa mengandung senyawa aktif sebagai antimikroba, namun dalam konsentrasi yang tinggi dapat meracuni benih ikan gurami. Senyawa antimikroba yang bersifat racun bagi ikan jika dalam konsentrasi tinggi adalah saponin. Sebagaimana pendapat Robinson (1995) bahwa saponin adalah senyawa aktif permukaan yang kuat bekerja sebagai antimikroba dan dalam larutan yang sangat kental saponin sangat beracun untuk ikan, dan tumbuhan yang mengandung saponin telah digunakan sebagai racun.
Hasil uji LC50 konsentrasi ekstrak daun mahkota dewa dengan software analisis EPA Probit menunjukkan nilai LC50 sebesar 600,536 ppm menyebabkan kematian sebanyak 50%. Menurut Wibisono (1989) diacu oleh Nedi dkk., (2006), bahwa nilai yang aman (safety concentration) bagi organisme dari daya racun toksisitas adalah 10% dari nilai LC50. Oleh karena itu, konsentrasi yang ekstrak daun mahkota dewa yang aman digunakan untuk ikan gurami adalah 10% dari 600,536 ppm yakni 60,0536 ppm. Konsentrasi ini tidak berbeda jauh dengan penelitian Rosidah dan Afiziah (2012) dengan uji LC50 ikan gurami terhadap ekstrak jambu biji yakni konsentrasi aman yang didapatkan adalah 60,058 ppm.
Kualitas Air
Menurut Kamaludin (2011), kualitas air merupakan salah satu faktor yang mempengaruhi timbulnya penyakit pada ikan, karena penyakit muncul dari interaksi antara inang, patogen, dan lingkungan. Kualitas air yang berada di luar kisaran optimum kebutuhan hidup ikan akan menyebabkan ikan mengalami stress, sehingga akibatnya ikan lebih mudah terserang penyakit. Oleh karena itu kondisi kualitas air selama perlakuan harus diperhatikan, agar tetap berada pada kisaran normal.
Hasil pengukuran DO menunjukkan kandungan oksigen yang terrendah yakni 0.22 – 4.86 ppm berada pada konsentrasi tertinggi yaitu 750 ppm yang dapat dilihat pada Tabel 2. Kandungan oksigen terrendah ini memberikan efek terhadap jumlah mortalitas ikan gurami yang terpapar. Berdasarkan Gambar 5. mortalitas ikan gurami mengalami peningkatan bersamaan dengan semakin besarnya konsentrasi esktrak daun mahkota dewa sebagai perlakuan, dan pada Tabel 2. menunjukkan bahwa kandungan oksigen terlarut mengalami penurunan bersamaan dengan semakin besarnya konsentrasi esktrak daun mahkota dewa yang diberikan. Dapat disimpulkan bahwa semakin rendah kandungan oksigen uji LC50 ekstrak daun mahkota dewa terhadap ikan gurami, semakin tinggi pula mortalitas ikan gurami tersebut.
Oksigen terlarut merupakan kebutuhan mutlak yang harus terpenuhi pada media pemeliharaan ikan. Berdasarkan Tabel 2, diketahui bahwa kisaran oksigen terlarut media pengujian LC50 berada pada kisaran 0.22 – 6.86 ppm. Menurut Boyd (1982), kandungan oksigen terlarut kurang dari 1 mg/l akan mematikan ikan, pada kandungan 1-5 mg/l cukup mendukung kehidupan ikan tetapi pertumbuhan ikan lambat, dan pada kandungan oksigen lebih dari 5 mg/l pertumbuhan ikan akan berjalan normal.
Hasil pengukuran suhu menunjukkan tidak adanya perbedaan temperatur terhadap setiap media uji dengan berbeda konsentrasi. Tabel 2. menunjukkan suhu media uji pada konsentrasi 0 ppm sampai 750 ppm selama masa percobaan masih berada dalam kisaran optimum kebutuhan hidup ikan gurami yaitu pada kisaran 25 – 26°C. Hal ini sesuai dengan kualitas air yang dipaparkan menurut Standar Nasional Indonesia (2000) yaitu kisaran suhu optimal untuk ikan gurami berada pada kisaran 25oC – 30oC. Menurut Khairuman dan Amri (2003) diacu oleh Nirmala dan Rasmawan (2010), suhu yang optimal untuk pertumbuhan ikan gurami adalah pada kisaran 24.9 – 28°C.
Hasil pengukuran pH media uji pada konsentrasi 0 ppm sampai 600 ppm adalah 6.50 – 7.21. Kadar pH tersebut masih berada dalam kisaran optimum kebutuhan hidup ikan gurami. Sedangkan pada konsentrasi 750 ppm, nilai pH berada pada nilai terrendah berada dibawah standar kelayakan pH untuk kegiatan budidaya yakni 3.96 - 5.87. Standar Nasional Indonesia (2000) menetapkan, secara umum nilai pH 6.5 – 8.5 merupakan kualitas air yang dianjurkan untuk kelayakan budidaya perikanan. Menurut Augusta (2012), pH sebesar 5 – 6 masih dapat di tolerir oleh ikan. Boyd (1982) menyatakan nilai pH yang mematikan bagi ikan yaitu lebih kecil dari 4 dan lebih besar dari 11. Pada pH lebih kecil dari 6.5 atau lebih besar dari 9.5 dalam waktu lama akan mempengaruhi pertumbuhan dan reproduksi pada ikan.
Berdasarkan Tabel 4. mortalitas ikan gurami mengalami peningkatan bersamaan dengan semakin besarnya konsentrasi esktrak daun mahkota dewa sebagai perlakuan, dan pada Tabel 2. menunjukkan bahwa kandungan pH mengalami penurunan bersamaan dengan semakin besarnya konsentrasi esktrak daun mahkota dewa yang diberikan. Dapat disimpulkan bahwa semakin rendah pH dalam uji LC50 ekstrak daun mahkota dewa
terhadap ikan gurami, semakin tinggi pula mortalitas ikan gurami tersebut.
Hasil pengukuran kualitas air yang dapat dilihat pada Tabel 2. menunjukkan semakin tingginya konsentrasi daun mahkota dewa yang diberikan maka kualitas air yaitu DO dan pH mengalami penurunan sehingga ikan gurami yang terpapar ekstrak mengalami peningkatan mortalitas. Kematian yang meningkat ini disebabkan karena ikan gurami yang terpapar mengalami stres karena perubahan kualitas air. Hal ini sesuai dengan pernyataan Irianto (2005) diacu oleh Solichin (2013) bahwa kondisi lingkungan turut menentukan tingkat stres. Ekstrak yang diberikan membuat kondisi lingkungan mengalami perubahan kualitas air yang dapat menyebabkan stresnya ikan. Pada saat ikan mengalami stres, ikan akan mengeluarkan banyak tenaga secara ekstra untuk menghadapi perubahan lingkungan yang mendadak. Ikan menggunakan energi berlebihan untuk mempertahankan diri dalam waktu tertentu sehingga energi untuk pertumbuhannya berkurang. Stres dapat mengakibatkan daya tahan tubuh ikan menurun bahkan menyebabkan kematian.
Kesimpulan
1. Hasil uji fitokimia ekstrak daun mahkota dewa (P. macrocarpa) dengan pelarut metanol mengandung senyawa fenolik, alkaloid, saponin dan Flavonoid.
2. Ekstrak daun mahkota dewa mampu menghambat pertumbuhan bakteri Aeromonas hydrophila karena mengandung senyawa antimikroba. 3. Ekstrak daun mahkota dewa
memiliki nilai LC50 48 jam sebesar 600, 536 ppm. Konsentrasi ekstrak daun mahkota dewa yang aman digunakan untuk ikan gurami adalah 10% nilai LC50 48 jam tersebut yakni 60,0536 ppm.
Saran
Sebaiknya dilakukan uji In Vivo dengan langsung menguji terhadap ikan sakit untuk lebih mengetahui ekstrak daun mahkota dewa sebagai antibakteri alami.
DAFTAR PUSTAKA
Agoes, A. 2010. Tanaman Obat Indonesia. Salemba Medika. Jakarta.
Augusta, T . S. 2012. Aklimatisasi Benih Ikan Nila (Oreochromis spp.) dengan Pencampuran Air Gambut. Jurnal Ilmu Hewan Tropika. 1 (2): 78-82.
Barus, W. N. U. 2013. Uji Efektivitas Antibakteri Ekstrak Daun Kamboja (Plumiera rubra) pada Konsentrasi yang Berbeda terhadap Pertumbuhan Aeromonas hydrophila Secara In Vitro. Skripsi. Fakultas Pertanian. Universitas Sumatera Utara. Medan.
Bell, S. M. 1984. Antibiotic Sensitivity Testing By The CDS Method, New South Wales. Clinical Microbiology Update Programme. The Prince Wales Hospital.
Boyd, C. E. 1982. Water Quality Management for Pond Fish Culture. Else Vier Scientific Publishing Company. Amsterdam.
Brock, T. D dan Mardigan, M.T., 1994. Biology of Microorganism. Fifth Edition. Prentice-Hall International. New York.
Dewi, R.M. 2013. Aktivitas Antimikroba Ekstrak Biji Teratai (Nymphaea pubescens L) Terhadap Bakteri Aeromonas hydrophila, Streptococcus agalactia, dan Jamur Saprolegnia sp. Skripsi. Fakultas Pertanian. Universitas Sumatera Utara. Medan.
Evy, K.R. Mujiutami, E dan Sujono, K. 2001. Usaha Perikanan Di Indonesia. Mutiara Sumber Widya. Jakarta.
Firnanda, R., Sugito., Fakhrurrazi dan Ambarwati, D.V.S. 2013. Isolasi A. hydrophila Pada Sisik Ikan Nila (Oreochromis niloticus) Yang Diberi Teoung Daun Jaloh (Salix tetrasperma Roxb). Jurnal Medika Veterinaria. 7 (1): 22-24.
Harbone, J. B. 1987. Metode Fitokimia. Institut Teknologi Bandung. Bandung.
Kamaludin. 2011. Efektifitas Ekstrak Lidah Buaya Aloe vera Untuk Mengobati Infeksi Aeromonas hydrophila Pada Ikan Lele Dumbo Clarias sp. Melalui Pakan. Skripsi. Fakultas Perikanan Dan Ilmu Kelautan. Institut Pertanian Bogor. Bogor.
Kamiso, H.N dan Triyanto. 1993. Vaksinasi A. hydrophila untuk Menanggulangi Penyakit MAS pada Lele Dumbo. Abstrak. Simposium Perikanan Indonesia I. Jakarta.
Kordi, K. M. G. 2004. Penanggulangan Hama dan Penyakit Ikan. Kerjasama Penerbit Rineka Cipta dan Penerbit Bina Adiaksara. Jakarta.
Lesmanawati, W. 2006. Potensi Mahkota Dewa Phaleria Macrocarpa Sebagai Antibakteri Dan Imunostimulan Pada Ikan Patin Pangasianodon hypophthalamus Yang Diinfeksi Dengan Aeromonas hydrophila. Skripsi. Fakultas Perikanan Dan Ilmu Kelautan. Institut Pertanian Bogor. Bogor.
Lisdawati, V. 2002. Brine Shrimp Lethality Test (BSLT), Bioassay Antikanker In Vitro dengan Sel Leukimia L1210, dan Isolasi Penentuan Struktur Molekul Senyawa Kimia Dari Buah Mahkota Dewa. Tesis. Fakultas Matematika dan Ilmu Pengetahuan Alam. Universitas Indonesia. Jakarta.
Lisdawati, V. Sumali W dan Kardono L.B.S., 2005. Bioasai In Vitro Antikanker Terhadap Sel Leukimia L1210 Dari Berbagai Fraksi Ekstrak Daging Buah Dan Kulit Biji Mahkota Dewa (Phaleria Macrocarpa). Jurnal Bahan Alam Indonesia. 5 (1): 303-309.
Mierza, V. 2011. Uji Antibakteri Ekstrak Etanol dan Fraksi Umbi Bawang Sabrang (Eleutherine Palmifolia Merr.). Tesis. Fakultas Farmasi Universitas Sumatera Utara. Medan.
Mulyani, Y. Bachtiar, E dan Kurnia, A. M. U. 2013. Peranan Senyawa Metabolit Sekunder Tumbuhan Mangrove Terhadap Infeksi Bakteri A. hydrophila Pada Ikan Mas (Cyprinus carpio L.). Jurnal Akuatika. 4 (1): 1-9.
Nedi, S., Thamrin dan Huria, M. 2006. Toksisitas deterjen terhadap benih
ikan kakap putih (lates calcarifer,
bloch). Jurnal Berkala Perikanan Terubuk. 33(2): 75-51.
Nirmala dan Rasmawan. 2010. Kinerja Pertumbuhan Ikan Gurami (Osphronemus gouramy) yang dipelihara pada media bersalinitas dengan pemaparan medan listrik. Jurnal Akuakultur Indonesia. 9 (1): 46-55.
Rahman, M. F. 2008. Potensi Antibakteri Ekstrak Daun Pepaya Pada Ikan Gurami Yang Diinfeksi Bakteri Aeromonas hydrophila. Skripsi. Fakultas Kedokteran Hewan. Institut Pertanian Bogor. Bogor.
Robinson, T. 1995. Kandungan Bahan Organik Tumbuhan Tinggi. Institut Teknologi Bandung. Bandung.
Rohyami, Y. 2008. Penentuan Kandungan Flavonoid dari Ekstrak Metanol Daging Buah Mahkota Dewa (Phaleria Macrocarpa Scheff Boerl). Jurnal Logika. 5 (1): 1-8.
Rosidah dan Afizia, W.M. 2012. Potensi Ekstrak Daun Mahkota dewa Sebagai Antibakterial Untuk Menanggulangi Serangan Bakteri A. hydrophila pada Ikan Gurami (Osphronemus Gouramy lacepede). Jurnal Akuatika. 3 (1): 19-27.
Septiawati, T. 2008. Daya hambat ekstrak etanol buah mahkota dewa terhadap aktivitas α – Glukosidase secara in vitro. Skripsi. Fakultas Matematika dan Ilmu Pengetahuan Alam. Institut Pertanian Bogor. Bogor.
Setiawan, B dan Suhartono, E. 2008. Efek Jus Daun Mahkota Dewa (Phaleria Macrocarpa) Sebagai Antimodifikasi Protein Plasma Akibat Reaksi Glikosilasi In Vitro. Skripsi. Fakultas Kedokteran. Universitas Lambung Mangkurat. Banjarbaru.
Simanjuntak, P. 2008. Identifikasi Senyawa Kimia dalam Buah Mahkota Dewa (Phaleria Macrocarpa), Thymelaceae. Jurnal Ilmu Kefarmasian Indonesia. 6 (1): 23-28.
Soeksmanto, A. 2006 Pengaruh Ekstrak Butanol Buah Tua Mahkota Dewa (Phaleria Macrocarpa) terhadap Jaringan Ginjal Mencit (Mus musculus). Jurnal Biodiversitas. 7 (3): 278-281.
Sofianti, D. 2006. Potensi Antioksidasi Daun Mahkota Dewa (Phaleria Macrocarpa (Scheff.) Boerl). Skripsi. Fakultas Matematika Dan Ilmu Pengetahuan Alam. Institut Pertanian Bogor. Bogor.
Solichin, A., Niniek, W dan Dimas, S.M. 2013. Pengaruh Ekstrak Bawang Putih (Allium sativum ) dengan Dosis yang Berbeda terhadap Lepasnya Suckers Kutu Ikan ( Argulus sp. ) pada Ikan Koi (Cyprinus carpio). Journal of Management of Aquatic Resources. 2(2): 46-53.
Standar Nasional Indonesia. 2000. Induk ikan gurami (Osphronemus goramy, Lac) kelas induk pokok (Parent Stock). SNI : 01 – 6485. 1 – 2000.
Standar Nasional Indonesia. 2000. Produksi benih ikan gurami (Osphronemus goramy, Lac) kelas benih sebar. SNI : 01 – 6485. 3 – 2000.
Tone, D. S. Wuisan, J dan Mambo, C. 2008. Uji Efek Analgesik Ekstrak Daun Mahkota Dewa (Phaleria Macrocarpa) Pada Mencit (Mus musculus). Skripsi. Fakultas Kedokteran. Universitas Sam Ratulangi. Manado.