DESTILASI DAN EKSTRAKSI
I. Tujuan
Pada akhir percobaan mahasiswa diharapkan paham dan terampil dalam : a. Melakukan destilasi untuk pemisahan dan pemurnian zat cair
b. Mengkalibrasi termometer
c. Melakukan teknik ekstraksi untuk pemisahan senyawa organik Prinsip destilasi dan ekstraksi
II. Landasan teori
Ekstraksi pelarut atau biasa disebut penyarian, merupakan suatu proses pemisahan dimana suatu zat terdistribusi dalam dua pelarut yang tidak bercampur. Penyarian merupan proses pemisahan dimana suatu zat terdistribusi kedalam dua pelarut yang tidak saling bercampur. Kegunaan besar dari penyarian ini adalah kemungkinan untuk pemisahan dua senyawa atau lebih berdasarkan perbedaan koefisien distribusinya (Kd)
(Rudi, 2010)
Ekstraksi pelarut menyangkut distribusi suatu zat terlarut (solut) diantara dua fasa air yang tidak saling bercampur[3]. Teknik ekstraksi sangat berguna untuk pemisahan secara cepat dan “bersih” baik untuk zat organik maupun zat anorganik. Cara ini dapat digunakan untuk analisis makro maupun mikro. Melalui proses ekstraksi, ion logam dalam pelarut air ditarik keluar dengan suatu pelarut organik (fasa organik). Secara umum, ekstraksi ialah proses penarikan suatu zat terlarut dari larutannya di dalam air oleh suatu pelarut lain yang tidak dapat bercampur dengan air (fasa air). Tujuan ekstraksi ialah memisahkan suatu komponen dari campurannya dengan menggunakan pelarut
Walaupun suatu minyak mentah boleh jadi diperlakukan ke destilasi dalam vakum dan penyulingan secara bertingkat, boleh tetap beberapa minyak berharga membiarkan vacuum-residuum . minyak yang Berharga ini adalah yang disembuhkan oleh bahan ekstraksi pelarut, dan aplikasi bahan ekstraksi pelarut] yang pertama di dalam penyulingan menjadi kesembuhan lebat meminyaki gudang utama dengan sejenis metan (C3H8) deasphalting.Dalam memesan untuk memulihkan lebih minyak yang kasar vacuum-reduced, sebagian besar untuk yang pecah katalitis feedstocks, molekular lebih tinggi menimbang t bahan pelarut seperti sejenis gas hidrokarbon ( C4H 10), dan bahkan pen tane ( C 5H12)
(Speight, 2006) Ekatraksi dilakukan dengan dua cara, yaitu (1) ekstraksi langsung, dan (2) Ekstraksi dengan pelarut dan destilasi uap sekaligus. Pada ekstraksi langsung, sampel dikocok dengan pelarut dietil eter dan dipisahkan fase airnya. Fase pelarut selnjutnya dikeringkan dengan Na2SO4 anhidrat dan dipekatkan dengan rotari evaporator. Sedangkan pada ekstraksi dengan alat “Linkens-Nickerson” digunakan dietil eter sebagai pelarut. Sampel dicampur dengan air destilat dan suhu penangas air pada labu pelarut diatur 37,5oC, ekstraksi-destilasi dilangsungkan selama 1 jam. Pelarut yang sudah mengandung komponen volatil ini dikeringkan dengan Na2SO4 anhidrat, dipekatkan dengan rotari evaporator
(Amohorseya, 1995)
Ekstraksi merupakan metode pemisahan yang didasarkan atas perbedaan kelarutan suatu solute dalam pelarut. Teknik ekstraksi kontinu dikhususkan bagi zat dengan D (harga banding distribusi) yang sangat kecil (<1), atau jika harga factor pemisahan β mendekati satu. Bila keadaan ini terjadi, maka ekstraksi bertahap dengan corong pisah menjadi kurang praktis, karena harus dilakukan ratusan kali. Ada bermacam-macam alat untuk proses ini. Pada prinsipnya di dalam peralatan tersebut terjadi aliran kontinu (terus menerus) dari pelarut melalui suatu larutan zat yang akan diekstrak. Pelarut yang telah membawa zat yang terekstrak, diuapkan,
kemudian didinginkan, sehingga dapat digunakan lagi. Jika perlu pelarut yang lebih segar dapat ditambahkan terus menerus.
(mafia,2012) Uap suatu cairan selalu terdapat di atas cairan tersebut walaupun pada suhu di bawah titik didihnya. Kecenderungan molekul-molekul cairan menguap, merupakan sifat yang tetap pada suhu tetap yang disebut sebagai tekanan uap
Prinsip destilasi adalah penguapan dan pengembunan kembali uapnya, pada tekanan dan suhu tertentu. Titik didih suatu cairan adalah suhu di mana tekanan uapnya sama dengan tekanan atmosfir. Tujuan destilasi adalah pemurnian zat cair pada titik didihnya
Ada 4 jenis cara destilasi yaitu :
1. Destilasi biasa, pada cara destilasi ini tekanan uap di atas cairan adalah tekanan atmosfir (titik didih normal). Untuk senyawa murni, suhu yang tercatat pada termometer yang ditempatkan pada tempat terjadinya proses destilasi adalah sama dengan titik didih destilat.
2. Destilasi vakum digunakan untuk menguapkan suatu cairan pada tekanan rendah, jauh di bawah titik didihnya. Biasanya untuk destilasi zat cair yang mudah terurai pada suhu tinggi.
3. Destilasi bertingkat atau destilasi terfraksi, digunakan untuk memisahkan campuran zat cair yang mempunyai perbedaan titik didih tidak berbeda banyak. Pada destilasi ini menggunakan kolom yang panjang dan mempunyai sekat/trap yang banyak, di tiap trap akan terjadi proses penguapan-pengembunan tersendiri sehingga akan terjadi proses pemisahan kedua komponen dalam banyak tahap. Pada bagian bawah akan terdapat campuran uap yang kaya dengan fraksi yang mempunyai titik didih tinggi, sedangkan pada bagian atas akan terdapat campuran uap yang kaya dengan fraksi titik didih rendah. Makin banyak trap yang dipunyai, makin banyak proses fraksinasi tersebut, sehingga pemisahan akan terjadi lebih sempurna (hukum Raoult).
4. Destilasi azeotrop. Azeotropik adalah larutan campuran dua senyawa yang mempunyai titik didih tetap dengan komposisi campuran tetap pula.
(Tim kimia organik,2014:1)
III. Prosedur kerja
III.1 alat dan bahan a. alat
Labu alas bundar 100 mL Set alat destilasi
Termometer 200 °C Batu didih Pembakar bunsen Penangas air Corong pisah 100 mL Erlenmeyer 100 mL
Corong Buchner dan pengisap Statip dan klem bundar
Batang pengaduk Tabung reaksi besar b. Bahan Benzena teknis Metanol teknis Asam benzoat Toluena Larutan NaOH 10% Larutan HCl 10% Kertas indicator Kertas saring
III.2 skema kerja 1. destilasi
kalibrasi thermometer
Dicelupi termometer mengkalibrasi titik nol termometer
Dimasukkan kedalam tabung reaksi Dimasukkan sedikit batu didih Di panaskan secara perlahan sampai mendidih
Dimasukkan thermometer pada uap permukaan atas air
destilasi biasa pemurnian
Dimasukkan kedalam labu sebanyak 50 ml Dimasukkan batu didih
Dipanaskan sampai mendidih Diatur pemanasan sehingga destilat menentes secara teratur
Dicatat suhu pada saat tetesan pertama mulai jatuh
Diganti penampung yang bersih, untuk menampung destilat murni
Dicatat suhu dan volume destilat secara teratur
Pemisahan
Dimasukkan ke labu destialat Dilakukan pemanasan
Diatat suhu dan volume destilat Hasil pengamatan 10 mL aquades Hasil pengamatan benzen teknis Hasil pengamatan 50 mL campuran metanol–air (perbandingan 50:50) Hasil pengamatan
2. ekstraksi
Dimasukkan ke corong pisah
Dilakukan ekstraksi Dibiarkan
Dipisahkan lapisan bagian bawah ke dalam erlenmeyer 100 mL
Diulangi lagi ektraksi
Ditambahkan kesetiap larutan ekstrak Diatur PH nya 2
Disaring endapan dengan corong Buchner
Dicuci endapan dengan air dingin Dikeringkan endapan pada udara terbuka
Ditimbang Kristal
Dibandingkan hasil keduanya 30 mL larutan asam
benzoat dalam toluen
15 mL larutan NaOH 10%
35 mL larutan HCl 10%.
IV. hasil dan pembahasan
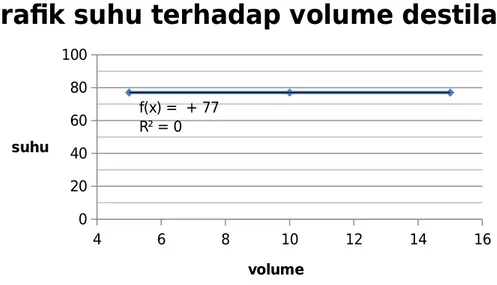
IV.1 data pengamatan 1. Destilasi Destilasi Biasa A. Pemurnian (1) Volume (mL) Suhu (oC) 5 77 10 77 15 77
Suhu tetesan pertama : 63oC
Volume destilat : 15 mL
Waktu destilat pertama : 6 menit, 9 detik Pemurnian (2) Volume (mL) Suhu (oC) 5 78 10 79 15 80 20 80 25 80
Suhu tetesan pertama : 75oC
Volume destilat :25 mL
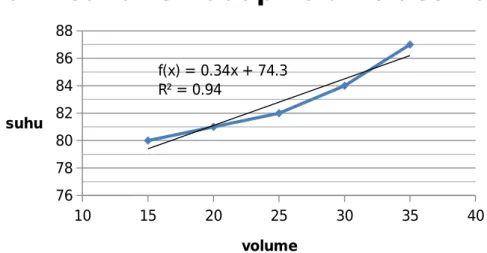
B. Pemisahan (1) Volume (mL) Suhu (oC) 5 79 10 79,5 15 80 20 81 25 82 30 84 35 87
Suhu tetesan pertama : 70oC
Volume destilat : 27,5 mL
Waktu tetesan pertama destilat : 4 menit,1 detik Pemisahan (2) Volume (mL) Suhu (oC) 5 72 10 73 15 74 20 73 25 74 30 75 35 75 40 75
Suhu tetesan pertama : 61oC
Volume destilat : 16 mL
Waktu tetesan pertama destilat : 5 menit,47 detik 2. Ekstraksi
Berat kertas saring = 1 gram
Berat kertas saring + endapan = 6,566 gram
Berat endapan = 5,566 gram
IV.2 Pembahsan
Pada praktikum ini praktikan meakukan percobaan tentang destilasi dan ekstraksi.tujuan dari percobaan ini dimaksudkan agar mahasiswa dapat melakukan destilasi untuk pemisahan atau pemurnian zat cair,mengkalibrasi thermometer,melakukan teknik destilasi untuk pemisahan senyawa organic serta mengetahui prinsip destilasi dan ekstraksi.
1. destilasi
Destilasi adalah proses pemisahan yang didasarkan pada tingkat volatilitas (kemudahan suatu zat menguap) pada suhu dan tekanan tertentu.prinsip dari destilasi yaitu penguapan dan pengembunan kembali uapnya, pada tekanan dan suhu tertentu.
Tujuan destilasi adalah pemurnian zat cair pada titik didihnya, dan memisahkan cairan dari zat padat atau memisahkan zat cair dari campuran zat cair lainnya yang mempunyai titik didih yang berbeda.
Destilasi biasa
Secara umum destilasi terdiri dari 4 macam yaitu: 1) Destilasi biasa
2) Destilasi vakum 3) Destilasi bertingkat 4) Destilasi azeotrop
Namun pada percobaan ini lebih difokuskan pada destilasi biasa atau destilasi normal.pada destilasi ini, tekanan uap di atas cairan adalah tekanan atmosfir (titik didih normal). Untuk senyawa murni, suhu yang tercatat pada termometer yang ditempatkan pada tempat terjadinya proses destilasi adalah sama dengan titik didih destilat
Adapun percobaan yang telah dilakukan oleh praktikan adalah sebagai berikut;
Kalibrasi termometer
pada percobaan ini,terdapat 2 kelompok secara bergantian yang melakukan tahap pemisahan.sebenarnya,sebelum masuk melakukan percobaan destilasi ini,termometer yang digunakn harus dikalibrasi terlebih dahulu agar pengukuran yang dilakukan pada destilasi biasa dapat berhasil dan memeproleh hasil yang akurat dan terpercaya.namun praktikan tidak melakukannya karena es yang dibutuhkan untuk kalibrasi tidak ada.
Untuk melakukan kalibrasi pada titik nol termometer dapat dilakukan mencelupkan termometer pada campuran air dan es yang diaduk homogen.mengapa campuran yang digunakan adalah air dan es?karena air dan es adalah campuran dingin yang dapat menurunkan suhu sampai suhu 00C.sedangkan untuk memperoleh 100 pada termometer dapat
dilakukan dengan mencelupkan termometer pada permukan cairan aquades yang mendidih yang sebelumnya telah diberi batu didih.air mendidih digunakan karena air mendidih mempunyai titik didih sebesar 1000C.
Destilasi biasa
Destilasi biasa, pada cara destilasi ini tekanan uap di atas cairan adalah tekanan atmosfir (titik didih normal). Untuk senyawa murni, suhu yang tercatat pada termometer yang ditempatkan pada tempat terjadinya proses destilasi adalah sama dengan titik didih destilat.
Adapun percobaan yang dilakukan pada destilasi biasa adalah sebagi berikut :
Pemurnian
menurut literatur,setelah peralatan destilasi secara sederhana dipasang secara lengkap,seharusnya praktikan mengalirkan air pendingin/kondensor, arah aliran dari bawah ke atas agar proses pendinginan dapat berjalan dengan baik dan uap air melalui kondensor akan menjadi cairan sehingga dapat ditampung sebagai hasil distilasi .kemudian benzene teknis yang dimasukkan dalam labu destilasi sebanyak 50 ml agar uap yang dihasilkan cepat.sebelum melakuak pemanasan.terlebih daulu praktikan memasukkan batu didih kedalam labu yang akan dipanaskan.tujuannya adalah untuk untukmempercepat proses pendidihan sampel dengan menahan tekanan atau menekan gelembung panas pada sampel serta menyebarkan panas yang ada menyebar ke seluruh bagian sampel, fungsi lainnya dari batu didih yaitu agar dapat menyeimbangkan larutan pada proses pemanasan sehingga larutan tidak keluar (meletup) dari labu alas bulat pada proses pemanasan.
Pada tahap pemurnian,praktikan melakukan 2 kali pengulangan untuk mendapatkan data yang akurat.pada pengulangan yang pertama kalinya,setelah benzene teknis dipanaskan,diperoleh suhu destilat tetesan pertama yaitu 630C dan waktu destilat pertama menetes yaitu
setiap volume destilat 5 ml.ternyata suhu nya konstan hingga volume destilat 15 ml.suhu yang diperoleh yaitu 770C.
Untuk mengetahui volume destilat yang dihasilkan 5 ml,praktikan menggunakan metode tetes dimana 1 ml di asumsikan menjadi 20 tetes,jadi praktikan menghitung hingga 100 tetes dan kemudian melihat suhu yang ditunjukkan oleh thermometer yang dimasukkan pada labu destilasi yang sedang dipanaskan.
Grafik suhu terhadap volume destilat pada pemurnian 1 :
4 6 8 10 12 14 16 0 20 40 60 80 100 f(x) = + 77 R² = 0
grafik suhu terhadap volume destilat
volume suhu
Gambar 4.2.1.1 : grafik suhu terhadap volume destilat
Dengan cara yang sama,kelompok lain melakukan percobaan ini.suhu pada pertama kali destilat menetes yaitu 750C dan waktu pertama kali
destilat menetes setelah 1 menit 49 detik.setelah diamati setiap volume destilat yang dihasilkan 5 ml maka suhu yang terlihat pada thermometer semakin lama semakin naik.dengan suhu akhirnya konstan yaitu pada suhu
0 5 10 15 20 25 30 77 78 79 80 81 f(x) = 0.1x + 77.9 R² = 0.78
grafik suhu terhadap volume destilat
volume suhu
Gambar 4.2.1.2 : grafik suhu terhadap volume destilat
tidik didih yang dimiliki benzen adalah 80,1oC seharusnya benzen akan
mendidih dan terbentuk destilat pada suhu tersebut tetapi pada percobaan ini tetesan destilat pertama yang praktikan dapatkan yaitu pada suhu 64oC. Hasil ini kemungkinan dipengaruhi oleh alat yang
digunakan. Proses terbentuknya destilat dari proses pemurnian benzen ini yaitu dimulai pada saat benzen mulai mendidih, kemudian uap benzen tersebut bergerak menuju tekanan yang lebih rendah, pada bagian ujung adapter penampung distilat terdapat lubang sebagai pengurang tekanan sehingga uap benzen akan mengarah ke arah lubang tersebut menuju ke kondensor untuk kemudian ditampung dalam labu alas bulat (erlenmeyer).Jarak antara labu destilasi dengan pemanas berpengaruh pada proses pemanasan, semakin dekat jarak antara labu dengan pemanas maka akansemakin cepat pula larutan yang ada dalam labu mendidih
Pemisahan
Percobaan ini memiliki prosedur yang sama dengan percobaan sebelunya,yang membedakannya adalah senyawa yang akan dipisahkan
yaitu campuran methanol-air. Air dan metanol keduanya merupakan senyawa polar. Hal ini dikarenakan keduanya memiliki titik didih yang tinggi, titik didih air yaitu 100⁰C sedangakan titik didih metanol yaitu 64,7⁰C. Titik didih air lebih tinggi dibandingkan metanol dikarenakan ikatan hidrogen air dapat membentuk lebih banyak ikatan hidrogen dibandingkan dengan metanol. Semakin kuatnya ikatan hidrogen yang terbentuk menyebabkan terjadinya kenaikan titik didih. Ini disebabkan karena ikatan hidrogen yang sangat kuat membutuhkan energi yang kuat pula untuk bisa memutuskan ikatan hidrogen, sehingga untuk bisa membuat air mendidih dibutuhkan suhu yang lebih besar dibandingkan suhu untuk mendidihkan metanol.
Pada pemisahan 1, Dengan cara yang sama,kelompok lain melakukan percobaan ini.suhu pada pertama kali destilat menetes yaitu 700C dan
waktu pertama kali destilat menetes setelah 4 menit 1 detik.setelah diamati setiap volume destilat yang dihasilkan 5 ml maka suhu yang terlihat pada thermometer semakin lama semakin naik.karena hingga 700 tetes destilat yang telah dihasilkan dan praktikan tidak menemukan suhu yang konstan,maka praktikan menghentikan percobaan.setelah diukur volume destilat yang dihasilkan dengan menggunakan gelas ukur,maka volume destilat yang dihasilkan hanya 27,5.seharusnya,jika 100 tetes diasumsikan 5 ml maka volume destilat yang dihasilkan adalah 35 ml karena 700tetea/20tetes=35 ml.kemungkinan kesalahan ini terjadi karena kurang ketelitian dan kecermatan dalam pengamatan praktikum
10 15 20 25 30 35 40 76 78 80 82 84 86 88 f(x) = 0.34x + 74.3 R² = 0.94
grafik suhu terhadap volume destilat
volume suhu
Gambar 4.2.1.3 : grafik suhu terhadap volume destilat
Pengulangan yang kedua dihasilkan suhu pertama kali destilat menetes yaitu 610C.terjadi setelah pemanasan selama 5 menit 47 detik.
Suhu yang diperoleh setiap 5 ml destilat yang dihasilkan ada yang naik dan ada yang turun,namun pada akhir pengamatan suhu nyacenderung naik dan lama kelamaan suhunya konstan.suhu konstan nya adalah 750C
Grafik suhu terhadap volume destilat pada pemisahan 2 :
0 5 10 15 20 25 30 35 40 45 70 71 72 73 74 75 76 f(x) = 0.08x + 72 R² = 0.82
grafik suhu terhadap volume destilat
volume suhu
Gambar 4.2.1.3 : grafik suhu terhadap volume destilat 2. Ekstraksi
Metoda pemisahan adalah bagian paling penting di dalam kimia organik, yaitu ekstraksi, kristalisasi/penyaringan, destilasi dan kromatografi. Teknik ekstraksi dan kristalisasi tergantung pada sifat kelarutan senyawa organik, sedangkan yang lainnya tergantung pada sifat fisiknya, titik didih untuk destilasi dan adsorpsi untuk kromatografi.
Ekstraksi adalah metoda pemisahan yang melibatkan proses pemindahan suatu senyawa dari satu fasa ke fasa lain. Jika kedua fasa tersebut adalah zat cair yang tidak saling bercampur, disebut ekstraksi cair-cair. Dalam sistem ini senyawa tersebut berpartisi di antara kedua pelarut. Keberhasilan pemisahan sangat tergantung pada perbedaan kelarutan senyawa tersebut dalam kedua pelarut. Secara umum prinsip pemisahannya adalah senyawa tersebut kurang larut dalam pelarut yang satu dan sangat larut di pelarut lainnya. Air banyak dipakai dalam sistem ekstraksi cair-cair senyawa organik, karena banyak senyawa organik yang bersifat ion atau sangat polar yang cukup larut dalam air. Pelarut lainnya adalah pelarut organik non polar (tak bercampur dengan air). Dalam sistem ekstraksi ini akan dihasilkan dua fasa yaitu fasa air (aqueous) dan fasa organik. Selain syarat kelarutan yang harus berbeda jauh perbedaannya di kedua pelarut tersebut, syarat lainnya adalah pelarut organik harus mempunyai titik didih jauh lebih rendah dari senyawa terekstraksi biasanya di bawah 100°C, tidak mahal dan tidak bersifat racun. Dasar metoda ekstraksi adalah distribusi senyawa di antara dua fasa cair yang berada dalam keadaan kesetimbangan.
Pada percobaan ini,senyawa yang akan diekstrak adalah asam benzoat dalam toluen.pengekstraknya berupa NaOH 10%.Tujuan dari penambahan NaOH yaitu untuk mengubah asam benzoat dalam toulene menjadi garam natrium benzoat yang dapat larut dalam air dan tidak larut dalam toulene, sehingga larutan akan memisah
menjadi dua fase. Dimana terdiri dari fase toulene dan fase larutan garam natrium benzoat dalam air.ekstraksi dilakukan sebanyak 3 kali untuk mengetahui perbandingannya.kemudian masing-masing ekstrak ditambahkan HCl agar terdapat endapan dan dapat dipisahkan secara kristalisasi. Tujuan dari proses pengasaman ini yaitu untuk mereaksikan antara garam natrium benzoat yang dihasilkan dengan asam, sehingga akan membentuk asam benzoat yang berupa endapan putih yang tidak larut atau sedikit larut dalam air.setelah terbentu endapan sempurna selanjutnya disaring dengan corong buchner lalu dicuci dengan air dingin.setelah dikeringkan dan ditimbang.Massa yang diperoleh adalah 6,566 gram. Namun massa kertas saring adalah 1 gram. Maka massa endapan yang kering tanpa kertas saring adalah 5, 566 gram.
V. Penutup
V.1 kesimpulan
berdasarkan percobaan yang telah dilakukan dapat diambil kesimpulan bahwa:
a) destialsi adalah pemisahan atau pemurnian zat yang didasarkan pada perbedaan volatilitas kemudahan suatu zat menguap) dengan suhu dan tekanan tertentu
b) kalibrasi thermometer dapat dilakukan menggunakan air yang dicampurkan dengan es untuk mengaklibrasikan titik nol pada thermometer
c) prinsip destilasi adalah penguapan dan pengembuana.prinsip ekstrasi adalah pemisahan berdasarka perbedaan sifat kelarutan V.2 saran
pada praktikum ini banyak sekali zat atau alat yang kurang lengkap sehingga praktikan harus bergabung dengan kelompok lain untuk melalukak percobaan ini dan menyebabakan percobaan yang praktikan lakukan tidak sempurna.sebaiknya,zat dan alat yang dibutuhkan harus tersedia lengkap sehingga praktikan lebih bisa menguasai praktikum yang dilakukan
VI. daftar pustaka
Verita, Amohorseya. 1995. Analisis Kandungan Flavor Yang
Dihasilkan Oleh Hansenula anomala Yang ditumbuhkan pada substrat air kelapa. Jakarta:Bul. Tek. Dan Industri Pangan
Rudi. 2010. Penuntun Dasar-Dasar Pemisahan Analitik. Kendari:Universitas Haluoleo
Speight J.G. 2006.The Chemistry and Technology of Petroleum
Fourth Edition. LLC :Taylor & Francis Group.
Suyanti. 2008. Ekstraksi Konsentrat Neodimium Memakai Asam
di-2-etilheksilfosfat. Yogyakarta:SDM Teknologi Nuklir..
Tim kimia organic.penuntun praktikum kimia rganik.jambi:universitas jambi