PENGEMBANGAN POLISAKARIDA DARI MIKROALGA BTM 11
SEBAGAI INHIBITOR RNA HELIKASE VIRUS HEPATITIS C
A.Zaenal Mustopa1*, Dwi Susilaningsih1, Linda Sukmarini1, Muhammad Ridwan1, Delicia1, Hasim2
1Pusat Penelitian Bioteknologi LIPI. Jl. Raya Bogor Km 46, Cibinong, 16911
2Departemen Biokimia, Institut Pertanian Bogor. Kampus IPB Darmaga, 16680
*e-Mail: azmustopa@yahoo.com
Disajikan 29-30 Nop 2012
ABSTRAK
Hepatitis C Virus (HCV) merupakan salah satu penyebab penyakit liver kronis di dunia. Hingga saat ini belum ditemukan baik obat maupun vaksin terhadap penyakit ini. Pengobatan saat ini untuk infeksi HCV yaitu menggunakan Interferon atau kombinasinya dengan ribavirin. Sebagai salah satu pendekatan untuk memecahkan masalah ini adalah mencari obat yang merupakan inhibitor spesifik dari enzim yang esensial untuk replikasi virus tersebut. Enzim helikase adalah salah satu diantaranya. Karena selain aktivitas helikase, enzim ini juga memiliki aktivitas ikatan RNA (RNA binding activity) dan ATPase. Inhibitor enzim RNA helikase HCV dapat diperoleh dari hasil metabolit sekunder dari tumbuhan yang dihasilkan secara alami, misalnya dari mikroalga. Penelitian ini bertujuan mengpurifikasi dan mengkarakterisasi polisakarida dari mikroalga BTM 11 yang memiliki aktivitas inhibisi terhadap RNA helikase virus hepatitis C. Gen RNA helikase HCV telah di kloning pada plasmid pET-21b dan telah diekspresikan di E.coli BL21(DE3)pLysS serta telah di purifikasi dengan kromatografi afinitas. Enzim yang telah di purifikasi tersebut digunakan untuk menskrining inhibitor RNA helikase HCV. Skrining inhibitor RNA helikase dari 50 ekstrak mikroalga menunjukan mikroalga BTM 11 mempunyai aktivitas inhibisi tertinggi sebesar 80% (5X dilusi). Purifikasi polisakarida inhibitor dengan teknik kromatografi gel filtrasi menunjukan fraksi 10 dengan aktifitas inhibisi tertinggi sebesar 88 dan konsentrasi glukose antara 0.596-5.562 mg/ml. Identifikasi dengan KCKT dengan standar maltopentaose dan glukose
menunjukan peak tajam dengan retention time (Rt) sebesar 4,183 adalah maltopentaosa sedangkan peak lainnya yang terdeteksi
dengan Rt5,673 adalah glukosa. Struktur kimia dari maltopentaosa di analisis dengan NMR. Karakterisasi polisakarida inhibitor
terhadap penyimpanan menunjukan aktifitas inhibisi stabil pada penyimpanan 28ºC, suhu pemanasan 40-60°C dan pH 2-4. Sedangkan pengaruh perlakuan enzim detergen dan protease inhibitor menunjukan bahwa semua sampel stabil terhadap pengaruh enzim, detergen dan protease inhibitor kecuali terhadap pengaruh SDS di mana terjadi penurunan aktifitas inhibisi RNA helikase HCV. Uji BSLT terhadap polisakarida mikroalga BTM 11 menunjukan bahwa polisakarida tersebut bersifat tidak toksik.
Kata Kunci: HCV, Mikroalga BTM 11, Polisakarida, RNA helikase
I. PENDAHULUAN
Hepatitis C merupakan penyakit yang disebabkan oleh Virus hepatitis C (HCV). Diperkirakan 3% dari penduduk dunia terinfeksi HCV ini (Lavancy et al, 1999). Di Indonesia, data Direktur Jenderal Pengendalian Penyakit dan Penyehatan Lingkungan Departemen Kesehatan, jumlah penderita Hepatitis C berkisar antara lima juta hingga tujuh juta jiwa.
Selama ini, belum ada vaksin dan obat yang benar-benar menyembuhkan penyakit infeksi HCV ini. Interferon atau kombinasinya dengan ribavirin yang banyak digunakan untuk penanganan infeksi HCV saat ini hanya mampu menyembuhkan tidak lebih dari 30% pasien.
Beberapa upaya telah dilakukan dalam rangka penemuan obat ini. Diantaranya adalah penemuan inhibitor terhadap enzim yang esensial untuk replikasi virus tersebut,
seperti protease, helikase, dan polymerase. Enzim helikase,
selain memiliki aktivitas helikase itu sendiri, juga memiliki aktivitas ikatan RNA (RNA binding) dan ATPase (RNA-stimulated ATPase), dan kedua aktivitas ini berpengaruh terhadap aktivitas helikase. Oleh karena itu, enzim ini menjadi target yang potensial untuk penemuan obat anti-virus. Inhibitor helikase dapat diuji dengan uji inhibisi terhadap RNA binding atau ATPase.
Inhibitor enzim dapat diperoleh dari senyawa kimia, ekstrak dari tanaman, dan hasil metabolit sekunder dari organisme tertentu yang dihasilkan secara alami misalnya
-20 0 20 40 60 80 100 1 4 7 10 13 16 19 22 25 28 % in hi bi si Fraksi
ke-saja dari mikroalga. Beberapa studi mikroalga sebagai anti virus telah dilakukan antara lain: Dunaliella primalecta antivirus terhadap virus herpes simpleks (HSV) (Ohta et al, 1988); anti enterovirus dari isolat Spirulina plantesis (Shih et
al, 2003); anti entero virus dari Phorphyridium (Thalinsky et al,
2002).
Studi terhadap 50 ekstrak microalga, 8 ekstrak menunjukan aktivitas inhibisi tertinggi terhadap RNA helikase HCV (40-100%). Aktifitas yang paling tinggi adalah alga hijau BTM 11 dengan aktivitas inhibisi 80% (5x dilusi) (Mustopa, dkk 2011). Isolasi dan purifikasi senyawa kimia inhibitor dari ekstrak alga hijau BTM 11 dengan kolom kromatografi gel filtrasi menunjukan aktivitas inhibisi sebesar 81,2% pada fraksi ke-3 dan separasi senyawa aktif dengan kromatografi lapis tipis (KLT) menunjukkan terdapatnya fraksi aktif dari inhibitor tersebut.
Biomassa microalga mengandung komposisi kimia yang potensial, misalnya protein, karbohidrat, pigmen (klorofil dan karetenoid), asam amino, lipid, dan hidrokarbon (Sanchez et al. 2007). Mikroalga mempunyai kemampuan untuk mensintesis semua asam amino, baik esensial maupun non esensial. Karbohidrat yang dihasilkan dapat ditemukan dalam bentuk pati, glukosa, gula, dan polisakarida lainnya. Penelitian ini bertujuan untuk mengpurifikasi dan karakterisasi polisakarida inhibitor dari mikroalga BTM 11.
II. METODOLOGI
A. Ekspresi dan purifikasi enzim helikase HCV
Ekspresi dan pemurnian RNA helikase berdasarkan metode Utama et al, 2000. Ekspresi helikase di E. coli BL21(DE3)pLysS akan diinduksi dengan isopropil β-D-thiogalaktopiranosidase (IPTG). Helikase dipurifikasi dengan kromatografi afinitas (TALON resin, Novagen) dan dianalisa kemurniannya dengan SDS-PAGE.
B. Uji ATPase
Uji ATPase dilakukan dengan mengukur konsentrasi fosfat yang terurai dari ATP menjadi ADP dan P, yang dihasilkan dari reaksi enzim RNA helikase dengan ATP. Uji ATPase dilakukan sebagai berikut: 50 µL/well campuran reaksi yang terdiri dari 10 mM buffer MOPS (pH 6.5), 2 mM
ATP, 1 mM MgCl2, dan enzim RNA helikase diinkubasi
dalam 96 well microtiter plate pada suhu ruangan selama 30
menit. Kemudian dilakukan pewarnaan dengan
penambahan 100 µL/well larutan pewarna (air; 0,081% malachite green; 5.7% ammonium molybdate dalam 6 N HCl; 2.3% polyvinil alkohol=2:2:1:1, v/v) dan diinkubasi selama 5 menit. Reaksi pewarnaan dihentikan dengan penambahan 25 µL/well 30% sodium sitrat kemudian diukur absorbansinya pada absorban 620 nm dengan referensi 405 nm (Utama et al, 2000).
C. Purifikasi Polisakarida inhibitor microalga BTM 11 Purifikasi polisakarida inhibitor dilakukan dengan menggunakan metode Shi et al, 2007. Kolom kromatografi yang sudah dipadatkan dicuci menggunakan ddH2O. Sebanyak 1 mL sampel polisakarida inhibitor diinjeksikan ke dalam kolom kromatografi. Eluen yang digunakan adalah
larutan ddH2O dengan laju alir sebesar 1 mL/menit. Hasil
elusi ditampung dan diuji ATPase. D. Analisis polisakarida
Fraksi hasil pemisahan di ukur konsentrasinya dengan menggunakan reaksi phenol–sulfuric acid (Dubois et al. 1956). Glukosa dijadikan sebagai standar (Cuesta et al, 2003). E. Identifikasi polisakarida inhibitor microalga BTM 11
Fraksi tertinggi aktifitas penghambatan diuji
kemurniannya dengan Kromatografi Cair Kinerja Tinggi (KCKT). Identifikasi polisakarida menggunakan KCKT dengan standar maltopentaosa, rhamnosa, arabinosa, xylosa, manosa, glukosa dan galaktosa Selanjutnya ikatan kimia polisakarida dianalisis dengan FTIR (Fourier transform infrared spectroscopy).
F. Karakterisasi polisakarida inhibitor microalga BTM 11 Karakterisasi polisaksrida inhibitor dilakukan terhadap waktu penyimpanan, suhu pemanasan, pH, enzim, detergen dan protease inhibitor. Waktu penyimpanan dilakukan pada suhu -20 ºC, 4ºC dan suhu ruang (±28ºC) selama 3 minggu. Selanjutnya dilakukan uji ATPase setiap minggu. Karakterisasi terhadap suhu pemanasan dilakukan pada
suhu 40oC, 50 oC, 60oC, 70 oC, 80oC, 90oC dan 100oC dan uji
ATPase dilakukan setiap 10 menit sekali selama 60 menit. Pengaruh pH terhadap aktivitas inhibisi polisakarida inhibitor dilakukan pada pH (2 - 12) dan diinkubasi selama 60 menit. Sedangkan pengaruh enzim dilakukan terhadap 0,1 mg/ml Lysozim, Trypsin, Proteinase K, dan Katalase), uji detergen ( 1% (v/v) Sodium Dodecyl Sulfate (SDS), Triton X-100, Tween 20, dan Urea) dan uji protease inhibitor ( 1% EDTA).
Gambar 1. Elektroforegram SDS-PAGE hasil ekpresi dan
purifikasi dengan TALONTMRNA helikase HCV (M: marker, IV:
M V 0,00 10,00 20,00 30,00 40,00 Minutes 1,00 2,00 3,00 4,00 5,00 6,00 7,00 8,00 9,00 10,00 11,00 12,00 13,00 4 , 1 8 3 5 , 6 7 3
G. Uji Toksisitas Brine Shrimp Lethal Toxicity (BSLT) Uji BSLT dilakukan menurut Nurhayati et al. (2006) yang dimodifikasi. Larva Artemia salina Leach dimasukkan sebanyak 10 ekor ke dalam tabung reaksi yang telah diberi larutan polisakarida dengan konsentrasi 0 (kontrol), 10, 100, 200, 500 dan 1000 ppm dan ditambahkan air laut sampai 3 ml. Setiap perlakuan dibuat 3 kali ulangan. Semua tabung reaksi diinkubasi pada suhu kamar di bawah penerangan lampu TL 40 watt. Pengamatan dilakukan setelah 48 jam dengan menghitung jumlah A. salina yang mati pada tiap
konsentrasi kemudian dihitung nilai LC50 dengan
memasukkan angka probit (50% kematian larva uji).
III.
HASIL DAN PEMBAHASAN
A. Ekspresi dan purifikasi enzim helikase
Protein NS3 RNA helikase diekspresikan dengan menambahkan IPTG pada medium LB cair, di mana E. Coli BL21(DE3)pLysS dikulturkan. RNA helikase kemudian dimurnikan dengan resin TALON. Analisa dengan SDS-PAGE menunjukan bahwa RNA helikase dari HCV berhasil dipurifikasi dengan bobot molekul + 54 kDa. Protein helikase tersebut digunakan untuk uji inhibisi.
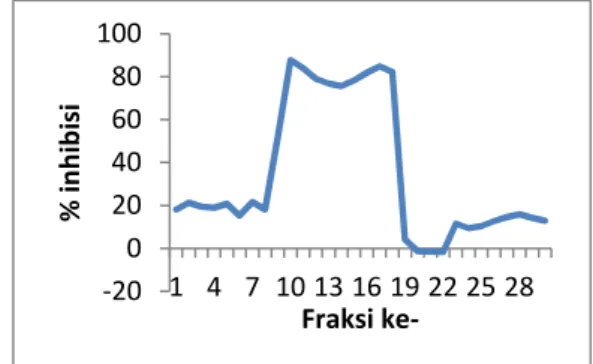
Gambar 2. Inhibisi fraksi polisakarida terhadap aktifitas ATPase RNA helikase HCV
B. Purifikasi mikroalga inhibitor
Purifikasi polisakarida inhibitor dilakukan dengan kromatografi gel filtrasi dengan fase diam sepharose 4B dan fase gerak ddH2O. Fraksinasi ini menghasilkan 30 fraksi yang ditampung masing-masing 1 mL. Fraksi yang diperoleh diuji aktivitasnya dengan uji kolorimetri ATPase.
Berdasarkan uji ATPase terhadap 30 fraksi terlihat bahwa fraksi 10 sampai 18 mempunyai aktivitas inhibisi terhadap enzim RNA helikase dari HCV di atas 70% dan fraksi 10
mempunyai aktivitas penghambatan tertinggi sebesar 88% (Gambar 2).
C. Analisis polisakarida
Konsentrasi gula dilakukan dengan dengan
menggunakan reaksi phenol–sulfuric acid. Hasil
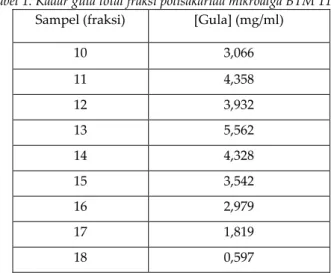
Pengukuran konsentrasi gula menunjukan bahwa fraksi ke 10 dan 18 mempunyai nilai konsentrasi antara 0.596-5.562 mg/ml. Nilai konsentrasi glukosa tertinggi diperoleh dari fraksi 13 dengan nilai 5.562 mg/mL. Kadar gula total dari fraksi polisakarida mikroalga BTM 11 terlihat pada Tabel 1.
Tabel 1. Kadar gula total fraksi polisakarida mikroalga BTM 11.
Sampel (fraksi) [Gula] (mg/ml)
10 3,066 11 4,358 12 3,932 13 5,562 14 4,328 15 3,542 16 2,979 17 1,819 18 0,597
D. Identifikasi mikroalga inhibitor
Fraksi dengan aktivitas tertinggi (fraksi 10) dianalisis kemurniannya menggunakan teknik KCKT. Tingkat kemurnian akan terlihat dari banyaknya peak yang terdeteksi Tingkat kemurnian paling tinggi diperoleh jika hanya terdapat satu peak yang terdeteksi. Kromatogram fraksi 10 dapat dilihat pada Gambar 3.
Gambar 3. Hasil HPLC polisakarida mikroalga BTM 11
Hasil kromatografi menunjukkan dua peak yang
terdeteksi dengan satu peak tajam dengan retention time (Rt)
4,183 dan peak lainnya dengan Rt 5,673. Identifikasi
polisakarida menggunakan KCKT dengan standar
50 75 100 150 250 M IV W1 W2 E1 50 kDa
M V 0,00 5,00 10,00 15,00 20,00 25,00 30,00 Minutes 1,00 2,00 3,00 4,00 5,00 6,00 7,00 8,00 9,00 10,00 11,00 12,00 13,00 14,00 15,00 5 , 5 4 5 M V 0,00 5,00 10,00 15,00 20,00 25,00 30,00 Minutes 1,00 2,00 3,00 4,00 5,00 6,00 7,00 8,00 9,00 10,00 11,00 12,00 13,00 14,00 15,00 4 , 1 8 3
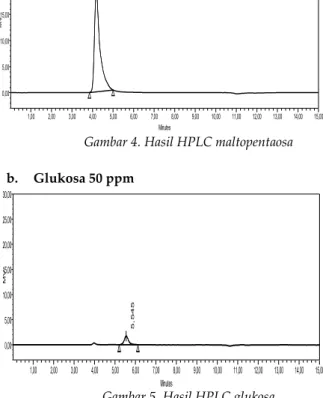
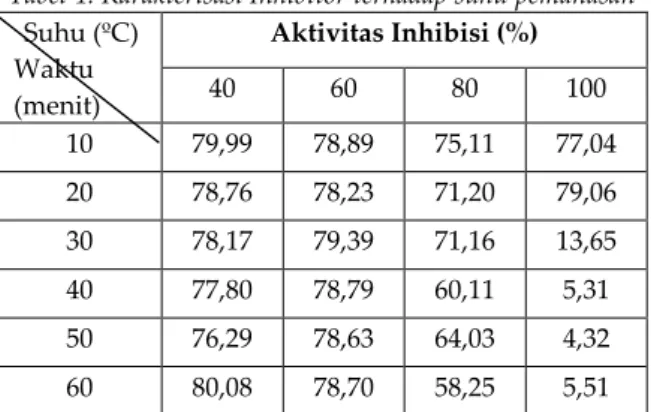
maltopentaosa, rhamnosa, arabinosa, xylosa, manosa, glukosa dan galaktosa. Hasil KCKT dengan maltopentaosa dan glukosa dapat dilihat pada gambar 4 dan 5.
a. Maltopentaosa 900 ppm
Gambar 4. Hasil HPLC maltopentaosa
b. Glukosa 50 ppm
Gambar 5. Hasil HPLC glukosa
Hasil kromatografi fraksi 10 menunjukkan peak yang
terdeteksi dengan retention time (Rt) sebesar 4,183 sama
dengan maltopentosa dan peak lainnya dengan Rt5,673 sama
dengan glukosa.
Gambar 6. Spektrum FT-IR fraksi 10
Ikatan-ikatan kimia polisakarida inhibitor dilakukan dengan FTIR. Spektrum hasil pengukuran FT-IR memberikan spektrum yang jelas pada lokasi gugus fungsi
maupun finger print pada range 3600-600 cm- (Gambar 6).
Pita serapan yang lebar pada daerah bilangan gelombang
3600-3000 cm-. Spektrum FT-IR fraksi 11 hampir sama
dengan spektrum standar mahopentaosa 100 ppm.
Uji ATPase terhadap maltopentosa dilakukan untuk melihat pengaruh maltopentosa dalam menginhibisi RNA helikase HCV. Hasil pengujian maltopentosa sintetik terhadap aktifitas inhibisi RNA helikase HCV dapat dilihat pada Tabel 2.
Tabel 2. Aktifitas inhibisi maltopentosa terhadap RNA helikase HCV
Sampel Aktivitas Inhibisi (%)
Sampel murni 84,98 Maltopentaosa (100 ppm) 7,93 Maltopentaosa 500 ppm) 10,5 Maltopentaosa (1000 ppm) 13,23
Hasil pengujian tersebut menunjukan bahwa
maltopentaosa sintetik tidak menunjukan aktifitas inhibisi terhadap RNA helikase HCV. Hal ini dilihat dari aktifitas inhibisi berkisar 8-13% pada konsentrasi 100-1000 ppm. Hasil ini menunjukan bahwa maltopentaosa dari mikroalga BTM 11 diduga berperan dalam menghambat aktifitas inhibisi RNA helikase HCV. Hal ini menunjukan bahwa terdapat komponen aktif mikroalga yang menunjukkan aktifitas biologis sebagai antivirus. Talyshinsky et al. (2002) menjelaskan bahwa dekstran sulfat dan polisakarida yang dihasilkan mikroalga berpotensi menghambat HIV tipe 1 dan 2 dengan cara menghambat induksi sitopatogenetik dan ekspresi antigen dari virus HIV. Sulfat polisakarida yang dihasilkan juga dapat menghambat aktivitas reverse
transcriptase dan RNAse pada proses replikasi retrovirus.
Shih et al. (2003) menjelaskan bahwa allophycocyanin yang dihasilkan oleh Spirulina platensis dapat menetralisir efek sitopatik dari enterovirus pada sel manusia secara in vitro.
Tabel 3. Karakterisasi Inhibitor terhadap waktu penyimpanan
Suhu (ºC) Aktivitas Inhibisi (%)
Hari
ke-7 Hari ke-14 Hari ke-21
-20 76,45 85.57 56.65
4 78,30 82.59 62.48
Suhu ruang
(28) 78,59 82.79 80.08
E. Karakterisasi polisakarida inhibitor
Penyimpanan dan pemanasan berpengaruh terhadap aktifitas bahan bioaktif dari mikroalga. Semakin lama waktu 6 0 0 8 0 0 1 0 0 0 1 2 0 0 1 4 0 0 1 6 0 0 1 8 0 0 2 0 0 0 2 4 0 0 2 8 0 0 3 2 0 0 3 6 0 0 4 0 0 0 1 / c m 6 2 . 5 6 5 6 7 . 5 7 0 7 2 . 5 7 5 7 7 . 5 8 0 8 2 . 5 8 5 8 7 . 5 9 0 9 2 . 5 9 5 9 7 . 5 1 0 0 % T 345 2.58 33 79.29 334 2.6 4 33 17. 56 23 55.08232 8.08 206 5. 76 1635 .64 16 27.92 1203 .5 8 113 4.14 10 08. 77 678 .9 4 64 0.37 596 .0 0 547 .78 1 2 0 5 3 1 0 1 7 9
simpan semakin menurun aktifitasnya. Karakterisasi inhibitor terhadap waktu penyimpanan dapat dilihat pada Tabel 3. Hasil pengujian menunjukan terjadi penurunan aktifitas pada hari ke-21 pada penyimpanan suhu -20º C dan 4ºC. Sedangkan penyimpanan suhu ruang (±28ºC) menunjukan aktifitas inhibisi stabil selama 3 minggu.
Hasil penelitian memperlihatkan adanya perbedaan yang signifikan antara ke empat perlakuan suhu pemanasan. Suhu pemanasan yang paling stabil adalah 40°C selama 60 menit dengan aktivitas inhibisi sebesar 80,08%. Pada suhu pemanasan 100 °C setelah 20 menit terjadi penurunan aktivitas secara signifikan. Aktivitas inhbisi awal 77,04% turun menjadi 5.51 % (Tabel 4)
Tabel 4. Karakterisasi Inhibitor terhadap suhu pemanasan
Suhu (ºC) Waktu (menit) Aktivitas Inhibisi (%) 40 60 80 100 10 79,99 78,89 75,11 77,04 20 78,76 78,23 71,20 79,06 30 78,17 79,39 71,16 13,65 40 77,80 78,79 60,11 5,31 50 76,29 78,63 64,03 4,32 60 80,08 78,70 58,25 5,51
pH akan berpengaruh terhadap aktivitas inhibisi polisakarida inhibitor dari mikroalga BTM11. Aktifitas inhibisi polisakarida inhibitor RNA helikase HCV terhadap perlakuan pH terlihat pada Tabel 5. Aktivitas tertinggi polisakarida inhibitor didapat pada perlakuan pH 2 tetapi relatif tinggi pula di pH asam (pH 4). Hal ini menunjukkan bahwa polisakarida inhibitor tersebut memiliki rentang ketahanan terhadap pH asam. Tetapi aktifitas nya menurun pada kondisi pH netral dan basa. Dengan adanya ketahanan terhadap pH asam, memungkinkan penelitian lebih lanjut dalam pengembangan polisakarida tersebut sebagai obat antivirus HCV baru baik sebagai obat oral maupun intravena.
Tabel 5. Karakterisasi Inhibitor terhadap pH
pH Aktivitas Inhibisi (%) Sampel murni 90,17 2 91,96 4 89,66 6 11,53 8 13,72 10 16,67 12 31,53
Hasil penelitian terhadap aktifitas inhibisi RNA helikase HCV menunjukan bahwa semua sampel stabil terhadap pengaruh enzim, detergen dan protease inhibitor kecuali terhadap pengaruh SDS di mana terjadi penurunan aktifitas inhibisi RNA helikase. Karakteristik inhibitor RNA helikase HCV terhadap perlakuan enzim, detergen dan protease inhibitor dapat dilihat pada Tabel 6.
Tabel 6. Karakterisasi Inhibitor terhadap enzim, detergen dan protease inhibitor No Sampel Aktifitas(%) 1 EDTA 73.22 2 SDS 49.15 3 Urea 72.94 4 Tween 20 83.74 5 Triton X100 72.67 6 Enzim katalase 68.47 7 Protease K 67.65 8 Lisozim 67.17 9 Tripsin 67.77
F. Uji Toksisitas Brine Shrimp Lethal Toxicity (BSLT) Uji toksisitas diperoleh dari konsentrasi polisakarida mikroalga BTM 11 yang dapat menyebabkan kematian sebesar
50% A. salina Leach (LC50). Hasil pemaparan polisakarida
mikroalga terhadap A. salina selama 48 jam ditampilkan pada Tabel7.
Tabel 7. Nilai LC50(µg/ml) ekstrak polisakarida mikroalga BTM 11.
Ulangan konsentrasi (µg/ml) % Mortalitas Probit LC50 (µg/ml) 1 0 0 1.92 12,705.30 10 0 1.92 100 10 3.72 200 20 4.16 500 0 1.92 1000 60 5.25 2 0 0 1.92 16,088.73 10 0 1.92 100 0 1.92 200 0 1.92 500 0 1.92 1000 100 8.09 3 0 0 1.92 28,488.65 10 0 1.92 100 0 1.92 200 0 1.92 500 10 3.72 1000 100 8.09 Rata-rata LC50 19,094.23
Hasil analisis uji BSLT menunjukan semakin tinggi konsentrasi yang diujikan maka cenderung semakin banyak
A. salina yang mati. Sesuai dengan pernyataan Harborne
(1987) bahwa semakin tinggi konsentrasi polisakarida maka sifat toksiknya akan semakin tinggi. Berdasarkan kategori toksisitas maka polisakarida mikroalga BTM 11 bersifat tidak toksik (Meyer et al. 1982).
IV.
KESIMPULAN
Enzim RNA helikase HCV berhasil dipurifikasi dengan bobot molekul sebesar 54 kDa. Polisakarida dari mikroalga BTM 11 telah dipurifikasi dengan kromatografi gel filtrasi dan fraksi ke-10 merupakan fraksi tertinggi dengan aktifitas inhibisi sebesar 88%. Pengukuran konsentrasi dari polisakarida inhibitor menunjukan bahwa fraksi ke 10 dan 18 mempunyai nilai konsentrasi antara 0.596-5.562 mg/ml. Hasil identifikasi awal dengan HPLC telah teridentifikasi jenis Polisakarida Inhibitor dari mikroalga BTM 11 yaitu Maltopentaosa dan Glukosa. Karakterisasi polisakarida inhibitor terhadap penyimpanan menunjukan bahwa aktifitas inhibisi stabil pada penyimpanan 28ºC, suhu pemanasan 40-60°C dan pH 2-4. Sedangkan pengaruh perlakuan enzim detergen dan protease inhibitor menunjukan bahwa semua sampel stabil terhadap pengaruh enzim, detergen dan protease inhibitor kecuali terhadap pengaruh SDS di mana terjadi penurunan aktifitas inhibisi RNA helikase HCV. Uji BSLT terhadap polisakarida mikroalga BTM 11 menunjukan bahwa polisakarida tersebut bersifat tidak toksik.
DAFTAR PUSTAKA
[1] Chan KM, Delfert D, Junger KD. 1986. A direct
colorimetricc assay for Ca2+ stimulated ATPase activity.
Anal Biochem 157: 375-380.
[2] Cuesta, G., Suarez, N., Bessio, M. I., Ferreira, F., & Massaldi, H. 2003. Quantitative determination of pneumococcal capsular polysaccharide serotype 14 using a modification of phenol–sulfuric acid method. Journal of Microbiological Methods, 52(1), 69–73. [3] Dubois, M., Gilles K., Hamilton, J.K., Rebers, P.A., and
Smith, F. 1951. A colorimetric method for the determination of sugars. Nature 168:167-168.
[4] Harborne JB. 1987. Metode Fitokimia: Penuntun Cara
Modern Menganalisis Tumbuhan. Ed ke-2. Terjemahan
Padmawinata K dan Soediro I. Bandung: Institut Teknologi Bandung.
[5] Kabinawa INK. 2001. Mikroalga Sebagai Sumber Daya
Hayati (SDH) Perairan Dalam Perspektif Bioteknologi.
Bogor: Puslitbang Bioteknologi, Lembaga Ilmu Pengetahuan Indonesia.
[6] Lavancy D, Purcell R, Holinger FB, et al. 1999. Global surveillance and control of hepatitis C. J Viral Hepat 6: 35-47.
[7] Mustopa AZ. 2011. Isolation and identification of RNA helicase inhibitor from indonesia microalgae. TORAY,
unpublished.
[8] Meyer BN et al. 1982. Brine Shrimp: a convinient general bioassay for active plant constituents. Plant Medica 45: 31-34.
[9] Nurhayati APD, Abdulgani N, Febrianto R. 2006. Uji Toksisitas Ekstrak Eucheuma alvarezii terhadap Artemia
salina sebagai Studi Pendahuluan Potensi Antikanker. Akta Kimindo 2: 41– 46.
[10] Ohta et al. 1998. Anti-herpes simplex virus substances produced by the marine green alga, Dunaliella primolecta. J of App. Phycology 10:349-355.
[11] Shih SR, Tsai KN, Li YS, Chueh CC, Chan EC. 2003. Inhibition of enterovirus 71-induced apoptosis by allophycocyanin isolated from a blue-green alga Spirulina platensis. Journal of Medical Virology 70: 119-125
[12] Shi Y, Sheng J, Yang F, Hu Q. 2007. Purification and identification of polysaccharide derived from Chlorella pyrenoidosa. Food Chemistry 103: 101–105
[13] Talyshinsky M, Souprun Y, Huleihel M. 2002. Anti-viral activity of red microalgal polysaccharide againts retroviruses. Cancer Cell International 2(8): 1-7
[14] Tellinghuisen TL et al. 2007. Studying hepatitis C virus: making the best of a bad virus. J Virology 81: 8853-8867. [15] Utama A, Shimizu H, Morikawa S, Hasebe F, Morita K,
Igarashi A, Hatsu M, Takamizawa K, Miyamura T. 2000. Identification and characterization of the RNA helicase activity of japanese enchepalitis virus NS3 protein. FEBS Letter 456:74-78.