MAKALAH
AKTIVITAS ANTIHIPERGLIKEMIK DARI POLISAKARIDA
EKSTRASELULER YANG DIHASILKAN MIKROALGA Porphyridium cruentum
AYU CHRISTIEN RAHAWEMAN C351140181
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR BOGOR
2014
EKSTRASELULER YANG DIHASILKAN MIKROALGA Porphyridium cruentum
I. Pendahuluan
Laut merupakan bagian wilayah terluas yang melingkupi bumi. Indonesia memiliki luas laut sebesar 2/3 dari total wilayahnya sehingga memiliki potensi atau sumber daya yang besar, namun luasnya bagian ini tidak akan menghasilkan nilai apapun jika tidak dimanfaatkan secara maksimal. Sumber daya pada wilayah perairan Indonesia meliputi flora, fauna dan beragam mikroorganisme yang potensial seperti kapang dan bakteri endofit. Salah satu sumber daya laut yang berpotensi adalah mikroalga. Mikroalga adalah kelompok alga berukuran renik (kecil), ukuran diameter antara 3-30 μm, memiliki klorofil sehingga sangat efisien dalam menyerap dan memanfaatkan energi matahari dan CO2 untuk proses fotosintesis. Mikroalga terdiri dari banyak spesies yang hampir semuanya adalah organisme akuatik (Sasmita et al, 2004). Kelompok mikroalga dibedakan berdasarkan pigmen yang dikandungnya, yakni diatom (Bacillariophyceae), ganggang hijau (Chlorophyceae), ganggang emas (Chrysophyceae), dan ganggang biru (Cyanophyceae). Lingkungan perairan terdapat ratusan jenis mikroalga, namun belum banyak yang dimanfaatkan.
Biomassa mikroalga mengandung bahan-bahan penting yang sangat bermanfaat, misalnya protein, karbohidrat, lemak dan asam nukleat. Karbohidrat (polisakarida) yang terkandung dalam mikroalga memiliki manfaat yang besar seperti sumber energi seperti penghasil biofuel (Chinnasamy 2010), pakan, dan juga dalam bidang pengobatan yakni antidiabetes (antihiperglikemik). Penggunaan mikroalga dalam bidan farmasi sudah meluas yakni penghasil suplemen seperti Spirulina, senyawa antiinflamasi, antikanker, antioksidan, dan antihiperglikemik. Porphyridium cruentum merupakan mikroalga yang juga menghasilkan polisakarida ekstraseluler yang diekskresikan oleh sel melalui badan golgi ke dalam media kultur. Polisakarida ekstraseluler yang dihasilkan terdiri dari D-xylose, D-glucose, D-galactose, L-galactose, 3-O-methylxylose, 3-O-metylgalactose, dan D-glucuronic acid (Percival dan Foyle 1979).
Porphyridium cruentum, kultivasi dan pemanenan mikroalga Porphyridium cruentum, penghitungan jumlah sel, dan penentuan umur panen yang selanjutnya dilakukan pemisahan polisakarida, analisis komposisi biokimia biomassa Porphyridium cruentum, uji fitokimia, dan uji inhibisi α-glukosidase.
Penelitian tentang antihiperglikemik dari polisakarida ekstraseluler dan komposisi biokimia biomassa Porphyridium cruenttum belum banyak dilakukan, sehingga perlu dilakukan penelitian aktivitas antihiperglikemik polisakarida dan biomassa dari Porphyridium cruentum. Tujuan dari penulisan makalah ini adalah untuk mengkaji aktivitas antihiperglikemik dari polisakarida ekstraseluler yang dihasilkan mikroalga porphyridium cruentum, serta metode kultivasi dan proses produksi biomassa mikroalga porphyridium cruentum.
II. Tinjauan Pustaka
a. Deskripsi Porphyridium cruentum
Porphyridium cruentum adalah mikroalga merah bersel satu yang termasuk divisi Rhodophyta, hidup bebas atau berkoloni yang terikat dalam mucilago. Senyawa mucilago dieksresikan secara konstan oleh sel membentuk sebuah kapsul yang mengelilingi sel. Mucilago merupakan polisakarida sulfat yang bersifat larut dalam air (Vonshak 1988). Klasifikasi Porphyridium cruentum (Vonshak 1988) adalah sebagai berikut :
Kingdom : Plantae Divisi : Rhodophyta Sub Kelas : Bangiophycidae Ordo : Porphyridiales Famili : Porphyridiaceae Genus : Porphyridium
Spesies : Porphyridium cruentum
Gambar 1 Porphyridium cruentum (Department of Enviromental Science 2008)
laut, air tawar, maupun pada permukaan tanah yang lembab dan membentuk lapisan kemerah-merahan yang sangat menarik. Habitat asli dari Porphyridium cruentum diduga berasal dari laut karena dapat hidup dengan baik pada media cair maupun media padat air laut (Vonshak 1988). Porphyridium cruentum dibungkus oleh polisakarida yang merupakan heteropolimer asam yang dibentuk oleh gula sulfat. Polisakaridanya membentuk jembatan ion melalui dua ikatan kation dan memiliki bobot molekul yang tinggi. Ketebalan polisakarida bervariasi tergantung pada fase pertumbuhan dan kondisi pertumbuhan. Sebagian polisakarida diekskresikan ke dalam medium pertumbuhan, sehingga viskositasnya semakin tinggi (Arad et al. 1985).
Biomasa sel Porphyridium cruentum mengandung kadar air 1,25-8,83%, kadar abu 16,8-23,6%, karbohidrat 22,8-39,3%, protein 27,7-40,8%, dan total lemak 5,78-7,55% (Fuentes et al. 2000). Produk komersial dari Porphyridium diantaranya adalah asam arakidonat, polisakarida, dan fikoeritrin. Biomassa kering sel Porphyridium cruentum mengandung 2% asam arakidonat, 35% polisakarida, dan 8% fikoeritrin (Vonshak 1988). Pertumbuhan mikroalga dipengaruhi oleh faktor instrinsik dan ekstrinsik. Faktor instrinsik merupakan faktor yang berkaitan dengan metabolisme tubuh mikroalga, dalam hal ini adalah Porphyridium cruentum, sedangkan faktor ekstrinsik merupakan faktor yang berkaitan dengan lingkungan di mana Porphyridium cruentum tersebut tumbuh. Faktor lingkungan yang mempengaruhi pertumbuhan mikroalga Porphyridium cruentum diantaranya adalah suhu, cahaya, salinitas dan pH, serta nutrisi.
1. Suhu
Sel Porphyridium cruentum dapat tumbuh pada kisaran suhu 10-35 oC. Aktivitas optimum fotosintesis pada kultur Porphyridium cruentum terjadi pada suhu 25 oC (Vonshak 1988). Suhu optimum untuk pertumbuhan Porphyridium cruentum adalah 21-26 oC dan pada suhu di bawah 13 oC dan di atas 31 oC pertumbuhannya lambat (Golueke dan Oswald 1962 diacu dalam Vonshak 1988)
2. Cahaya
Pertumbuhan Porphyridium cruentum tergantung pada intensitas cahaya meskipun Porphyridium cruentum memiliki toleransi yang cukup tinggi terhadap intensitas cahaya. Kultur yang ditumbuhkan di bawah cahaya secara kontinyu akan tumbuh dengan cepat. Arad dan Richmond (2004) melaporkan bahwa faktor lingkungan yang penting untuk kultur mikroalga adalah cahaya yang merupakan faktor utama pada fotosintesis. Pertumbuhan mikroalga akan meningkat lebih dari 400% bila intensitas cahaya diubah dari 538 lux menjadi 4300 lux. Pertumbuhan ini juga diikuti dengan peningkatan volume sel dan granula sitoplasma. Kandungan pigmen dan ukuran kloroplast menurun sejalan dengan meningkatnya intensitas cahaya, total lemak (bb) Porphyridium cruentum pada siklus terang-gelap (12:12) lebih tinggi dibandingkan pada siklus terang–gelap (18:6) dan (6:18), dengan nilai total lemak berturut-turut adalah 19,3%, 18,3% dan 14,4% (Sung et al 2009).
3. Salinitas dan pH
bersaing hidup dengan mikroalga lainnya pada kondisi salinitas kurang dari 3,5% jika ditumbuhkan pada kultur terbuka. Salinitas sebesar 4,6% tidak menghambat proses pertumbuhan. Meskipun demikian salinitas dengan kisaran 3,5-4,5% dapat memacu pertumbuhan yang optimal (Arad dan Richmond 2004). Porphyridium cruentum juga toleran terhadap perubahan pH pada kisaran antara 5,2-8,3. Aktivitas fotosintesis menurun hingga maksimum 33% ketika pH turun mencapai 5 dan pH optimum fotosintesis Porphyridium cruentum adalah 7,5 (Colman dan Gehl 1983 diacu dalam Vonshak 1988)
4. Nutrisi
Porphyridium cruentum dapat menggunakan KNO3 dan ammonium sebagai sumber nitrogen. Pertumbuhan dapat juga dihasilkan dengan menggunakan urea sebagai sumber nitrogen pada medium air laut (Vonshak 1988). Menurut Arad et al. (1988), terbatasnya jumlah nitrogen dalam medium akan menghambat fotosintesis, namun terbatasnya jumlah nitrogen ini akan berdampak pada meningkatnya ekskresi polisakarida ke dalam medium. Porphyridium cruentum menggunakan CO2 sebagai sumber karbon. Pertumbuhan menjadi lebih cepat pada kultur yang diberi cahaya dan aerasi dengan udara yang mengandung CO2 (Vonshak 1988). Sumber sulfur diperoleh dari MgSO4, Na2SO3, atau Na2S2O3 dengan konsentrasi antara 5,4-27,0 mM akan menghasilkan pertumbuhan alga yang baik (Vonshak 1988).
b. Pertumbuhan Mikroalga
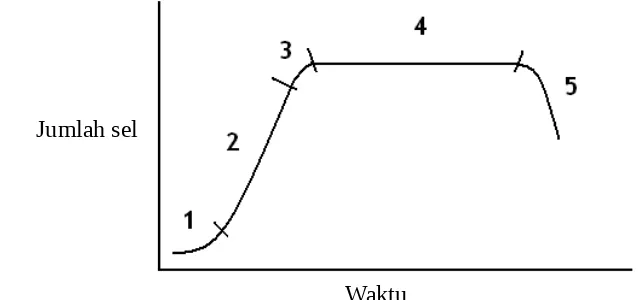
Pertumbuhan mikroalga pada kultur dapat ditandai dengan bertambah besarnya ukuran sel atau bertambahnya jumlah sel. Perkembangan sel dalam kultur mikroalga terdiri atas lima fase, yaitu fase lag (adaptasi), fase eksponensial (logaritmik), fase penurunan laju pertumbuhan (deklinasi), fase stasioner dan fase kematian. Fase lag merupakan fase pertama dalam pertumbuhan mikroalga dan mengalami penurunan tingkat metabolisme karena fase inokulum yang tidak merata dan terjadi proses adaptasi terhadap media kultur. Fase kedua adalah fase eksponensial di mana percepatan pertumbuhan dan perbandingan konsentrasi komponen biokimia menjadi konstan. Fase ketiga merupakan fase penurunan laju pertumbuhan yang disebabkan populasi sel terus bertambah namun tidak ada penambahan nutrien sedangkan pemanfaatan nutrien oleh mikroalga terus berlanjut, sehingga terjadi persaingan antar sel untuk mendapatkan nutrien yang semakin berkurang. Intensitas cahaya yang diterima sel semakin berkurang akibat jumlah sel yang semakin tinggi sehingga terjadi pembentukan bayangan dari sel itu sendiri juga dapat menyebabkan penurunan laju pertumbuhan.
Gambar 2 Pola pertumbuhan sel alga (1) fase lag, (2) fase eksponensial, (3) fase deklinasi, (4) fase stasioner, (5) fase kematian)
III. Prosedur Kultivasi Porphyridium cruentum dan Pengujian Aktivitas Antihiperglikemik
Pengujian aktivitas antihiperglikemik pada Porphyridium cruentum melalui beberapa tahapan yakni penyegaran inokulum mikroalga Porphyridium cruentum, kultivasi dan pemanenan mikroalga, penghitungan jumlah sel, dan penentuan umur panen dan jumlah etanol, pemisahan polisakarida, pengujian komposisi biokimia biomassa Porphyridium cruentum, yang meliputi uji kadar air, kadar abu, kadar protein, dan kadar karbohidrat, dan uji inhibisi α-glukosidase.
1) Penyegaran inokulum mikroalga Porphyridium cruentum
Kultivasi Porphyridium cruentum dilakukan dengan media Becker danpenyegaran Porphyridium cruentum dengan media Guillard. Medium Guillard digunakan untuk membuat suatu kondisi yang sama dengan media awal pertumbuhan mikroalga tersebut. Hal ini diharapkan dapat membantu Porphyridium cruentum untuk melakukan proses adaptasi terhadap lingkungan baru secara cepat. Selanjutnya pembuatan inokulum dan kultivasi mikroalga Porphyridium cruentum digunakan media Becker. Penyegaran stok mikroalga perlu dilakukan sebelum kultivasi dalam bioreaktor agar mikroalga yang ditumbuhkan dalam kondisi segar dan aktif. Penyegaran stok mikroalga dilakukan dalam keadaan aseptik pada suhu ruang di bawah penyinaran lampu pada selang 500-2000 lux dengan pemberian aerasi. Porphyridium cruentum dikultur dalam media yang diatur pada pH 7,6 dan disterilkan dengan lampu UV selama 30 menit.
2) Kultivasi dan pemanenan mikroalga Porphyridium cruentum
Kultivasi dilakukan dengan memindahkan 20% kultur segar Porphyridium cruentum ke dalam bioreaktor. Kultivasi dilakukan pada media Becker pada suhu ruang di bawah penyinaran lampu pada selang 500-2000 lux dengan pemberian aerasi. Selama kultivasi dilakukan penghitungan konsentrasi sel. Penghitungan konsentrasi sel mikroalga dilakukan untuk membuat kurva pertumbuhan. Penghitungan ini dilakukan setiap hari dengan menggunakan metode mikroskopis langsung menggunakan haemasitometer. Pemanenan dilakukan pada fase stasioner
Jumlah sel
dimana produksi polisakarida optimum. Pemanenan Porphyridium cruentum dilakukan dengan pengendapan menggunakan sentrifuge. Sentrifugasi dilakukan pada kecepatan 10.000 rpm selama 15 menit pada suhu 4oC. Biomassa dan media kultur terpisah. Media kultur disimpan pada suhu refrigerasi untuk keperluan pemisahan polisakarida.
3) Penghitungan jumlah sel (Hadioetomo 1993)
Penghitungan jumlah sel dilakukan dengan metode hitungan langsung sebagai berikut: a. Permukaan hitung haemasitometer dan kaca penutup dibersihkan dengan
menggunakan alkohol 70%.
b. Tutup kaca haemasitometer diletakkan pada permukaan haemasitometer. Suspensi biakan P. cruentum hasil pengambilan contoh dikocok, kemudian diambil dengan mikropipet sebanyak 25 μl. Suspensi tersebut diteteskan pada tempat menaruh sampel yang terdapat pada haemasitometer hingga suspensi P. cruentum menyebar pada ruang hitung.
c. Haemasitometer diletakkan di atas pentas mikroskop. Jumlah sel yang terdapat dalam 80 kotak kecil yang terletak dalam kotak bagian tengah yang berukuran 0,2 mm2 (5 x 16 x 0,0025 mm2) dihitung dengan mikroskop pada pembesaran 40x10. Perhitungan jumlah sel dilakukan sebanyak 2 kali ulangan. Penampang haemasitometer dapat dilihat pada Gambar 3.
Gambar 3 Penampang haemasitometer ( Kotak yang dihitung jumlah sel)
4) Penentuan umur panen
Penentuan umur panen diawali dengan pemisahan polisakarida. Sebanyak 10 mL sampel pada setiap umur kultur disentrifuse kemudian supernatannya ditambahkan dengan etanol teknis 96% dengan perbandingan 1:1. Hasil campuran ini didiamkan dan disimpan dalam freezer selama 24 jam. Kemudian dilakukan penyaringan dengan kertas saring untuk memisahkan polisakarida dan larutannya. Kertas saring kemudian dikeringkan dengan oven pada suhu 45 oC selama 6 jam. Hasil pengeringan ini kemudian ditimbang. Berat polisakarida didapat dari selisih antara kertas saring kering kosong dan kertas saring yang mengandung polisakarida. Umur panen ditentukan pada bobot polisakarida tertinggi.
Penentuan perbandingan jumlah etanol dilakukan dengan menambahkan etanol teknis 96% pada supernatan hasil panen. Penambahan etanol dilakukan pada perbandingan supernatan : etanol yaitu 1:2; 1:1; 1:0,75; 1:0,5; dan 1:0,25. Hasil campuran ini didiamkan dan disimpan dalam refrigerator selama 24 jam. Kemudian dilakukan penyaringan dengan kertas saring untuk memisahkan polisakarida dan larutannya. Kertas saring kemudian dikeringkan dengan oven pada suhu 45 oC selama 6 jam. Hasil pengeringan ini kemudian ditimbang. Berat polisakarida didapat dari selisih antara kertas saring kering kosong dan kertas saring yang mengandung polisakarida. Bobot polisakarida tertinggi merupakan konsentrasi etanol terpilih yang akan digunakan pada pemisahan polisakarida dalam jumlah besar.
6) Pemisahan polisakarida
Pemisahan polisakarida dilakukan dengan menambahkan etanol teknis 96% pada supernatan hasil panen. Penambahan etanol dilakukan pada perbandingan supernatan : etanol dengan konsentrasi terpilih. Hasil campuran ini didiamkan dan disimpan dalam refrigerator selama 24 jam. Kemudian dilakukan penyaringan dengan nylon mess 20 mess untuk memisahkan polisakarida dan larutannya. Hasil penyaringan kemudian ditimbang dan dihitung rendemennya. 7) Analisis komposisi biokimia biomassa Porphyridium cruentum
Analisis komponen biokimia biomassa dilakukan dengan beberapa analisis yakni analisis kadar air (AOAC 2005), analisis kadar abu (AOAC 2005), analisis kadar protein (AOAC 1980), dan analisis kadar lemak (AOAC 2005)
8) Uji fitokimia (Harborne 1987)
Uji fitokimia yang dilakukan antara lain dengan menguji komponen alkaloid dimana sejumlah sampel dilarutkan dalam beberapa tetes asam sulfat 2 N kemudian diuji dengan tiga pereaksi alkaloid yaitu, pereaksi Dragendorff, pereaksi Meyer, dan pereaksi Wagner. Hasil uji dinyatakan positif bila dengan pereaksi Meyer terbentuk endapan putih kekuningan, endapan coklat dengan pereaksi Wagner dan endapan merah hingga jingga dengan pereaksi Dragendorff; uji komponen steroid/ triterpenoid dimana sejumlah sampel dilarutkan dalam 2 mL kloroform dalam tabung reaksi yang kering. Lalu, 10 tetes anhidra asetat dan 3 tetes asam sulfat pekat ditambahkan ke dalamnya. Larutan berwarna merah yang terbentuk untuk pertama kali kemudian berubah menjadi biru dan hijau, menunjukkan reaksi positif. Uji komponen Flavonoid dilakukan dengan sejumlah sampel ditambahkan serbuk magnesium 0,10 mg dan 0,40 mL amil alkohol (campuran asam klorida 37% dan etanol 95% dengan volume yang sama) dan 4 mL alkohol kemudian campuran dikocok. Warna merah, kuning atau jingga yang terbentuk pada lapisan amil alkohol menunjukkan adanya flavonoid.
Uji saponin (uji busa) dapat dideteksi dengan uji busa dalam air panas. Busa yang stabil selama 30 menit dan tidak hilang pada penambahan 1 tetes HCl 2 N menunjukkan adanya saponin. Uji fenol hidrokuinon (pereaksi FeCl3) dimana sebanyak 1 gram sampel diekstrak dengan 20 mL etanol 70%. Larutan yang dihasilkan diambil sebanyak 1 mL kemudian ditambahkan 2 tetes larutan FeCl3 5%. Warna hijau atau hijau biru yang terbentuk menunjukkan adanya senyawa fenol dalam bahan.
Larutan enzim dibuat dengan melarutkan 1 mg α-glukosidase dalam 100 mL buffer fosfat (pH 7) yang mengandung 200 mg bovin serum albumin. Sebelum digunakan, sebanyak 1 mL larutan enzim tersebut diencerkan 25 kali dengan buffer fosfat (pH 7). Campuran reaksi terdiri dari 250 μl p-nitrofenil- -D-glukopiranosa (20 mM) sebagai substrat, 490 μl buffer fosfat (100 mM, pH 7) dan 10 μl larutan sampel dalam DMSO. Setelah campuran reaksi diinkubasi pada 37 oC selama 5 menit, 250 μl larutan enzim ditambahkan dan selanjutnya diinkubasi selama 15 menit. Reaksi enzim dihentikan dengan penambahan 1000 μl natrium karbonat (200 mM) dan p-nitro fenol yang dihasilkan dibaca absorbansinya pada 400 nm. Larutan standar (acarbose) dibuat dengan konsentrasi yang sama dengan larutan sampel, dengan melarutkan tablet Acarbose (Glucobay) dalam akuades dan HCl 2N. Larutan disentrifugasi dan supernatannya digunakan sebagai standar.
IV. Pembahasan
Polisakarida merupakan salah satu komponen yang dihasilkan oleh mikroalga Porphyridium cruentum. Fungsi biologi dari polisakarida pada Porphyridium cruentum, yaitu melindungi sel, pertukaran atau penampungan ion, membentuk penghalang yang sulit ditembus oleh gas dan air, serta sebagai tempat vitamin dan hormon. Polisakarida dari Porphyridium cruentum juga berfungsi untuk membentuk thallus pseudoparenkim yang dilakukan bersama-sama dengan sel (Vonshak 1988). Polisakarida terdiri atas 7-10% rantai sulfat ester dan dihubungkan oleh 5-7% protein. Viskositas polisakarida Porphyridium cruentum cukup tinggi dibandingkan dengan xanthan gum komersial. Produksi rata-rata tiap hari polisakarida Porphyridium cruentum sekitar 55 sampai 75 mg (berat kering) per liter.
Kultur Porphyridium cruentum dapat mencapai densitas sel yang tinggi pada waktu yang relatif singkat dan mengeluarkan polisakarida ke medium dalam jumlah besar. Polisakarida berbentuk kapsul yang mengelilingi sel dengan kekentalan yang bervariasi tergantung dengan fase pertumbuhan. Produksi polisakarida yang paling kental terjadi pada fase stasioner, yaitu jumlah sintesis polisakarida lebih besar dibandingkan dengan jumlah yang dikeluarkan ke dalam medium. Selama pertumbuhan viskositas medium meningkat dikarenakan pengeluaran polisakarida ke medium. Kondisi lingkungan yang berbeda berpengaruh terhadap jumlah produksi polisakarida. Produksi polisakarida tertinggi ketika jumlah sumber nitrogen terbatas. Polisakarida dapat diisolasi melalui presipitasi menggunakan cetylpiridinium chloride, diikuti dengan konversi menjadi kalsium dan dipresipitasi kembali dengan etanol. Prosedur ini akan menghasilkan polisakarida murni dan menjaga viskositas terhadap perubahan pH dan suhu (Vonshak 1988).
Porphyridium sp. berada dalam kisaran yang sama seperti yang dari getah xanthan dan DNA (Eteshola et al. 1996 diacu dalam Arad dan Richmond 2004). Menurut penelitian Kusumawarni (1998), secara umum produksi polisakarida terus meningkat dari waktu ke waktu. Selain faktor lingkungan, fase pertumbuhan juga berpengaruh terhadap produksi polisakarida. Produksi polisakarida akan meningkat pada fase stasioner. Hal ini menunjukkan bahwa kondisi lingkungan hingga akhir fase stasioner masih mendukung bagi pertumbuhan dan pembentukan polisakarida. Kondisi pertumbuhan yang baik akan menentukan kandungan polisakarida sebagai hasil fotosintesis. Sehingga semakin tinggi tingkat fotosintesis, semakin banyak pula polisakarida yang akan terbentuk.
Berdasarkan penelitian Agustini et al. (2009), produksi ekstraseluler Porphyridium cruentum dipengaruhi oleh lamanya waktu penyinaran. Produksi polisakarida ekstraseluler mencapai maksimum pada saat sel mengalami fase logaritmik akhir menuju ke fase stasioner. Berbeda halnya dengan penelitian Kusumawarni (1998), produksi polisakarida ekstraseluler akan meningkat saat sel mulai memasuki fase stasioner hingga akhir fase stasioner. Cahaya biru dan merah dapat digunakan untuk meningkatkan efisiensi fotosintesis dan meningkatkan produksi polisakarida ekstraseluler. Pertumbuhan dan produksi polisakarida ekstraseluler Porphyridium cruentum dipengaruhi oleh intensitas dan panjang gelombang cahaya. Pertumbuhan Porphyridium cruentum meningkat seiring dengan peningkatan intensitas cahaya, meskipun cahaya yang melebihi titik jenuh menjadi penghambat pertumbuhan mikroalga (You dan Barnett 2004).
Porphyridium cruentum menggunakan nitrat atau ammonium sebagai sumber nitrogen. Arad et al. (1988) melakukan penelitian dengan menggunakan tiga tipe kultur yaitu batch mode (pemberian nitrat pada awal kultivasi), continual mode (pemberian nitrat tiap hari), dan deficient mode (tanpa pemberian nitrat) menyatakan bahwa batch mode dan continual mode mengalami pertumbuhan yang sama, sedangkan pertumbuhan pada deficient mode terhambat. Jumlah polisakarida yang dihasilkan pada continual mode dan deficient mode tiap sel memiliki persamaan. Meskipun produksi polisakarida maksimal terjadi pada batch mode, tetapi jumlah polisakarida yang diekskresikan ke medium secara maksimal terjadi pada deficient mode. Jumlah nitrogen yang ditambahkan pada medium kultivasi berpengaruh terhadap distribusi antara jumlah polisakarida terlarut pada medium dan polisakarida yang terikat pada sel.
dan absorbsi glukosa serta menghambat metabolism sukrosa menjadi glukosa dan fruktosa (Ho dan Bray 1999).
MEDIA KULTIVASI Porphyridium cruentum
Proses kultivasi Porphyridium cruentum dilakukan dengan menggunakan media pertumbuhan yang menyediakan komponen nutrisi yang diperlukan oleh mikroalga pada umumnya. Kebutuhan unsure hara bagi kehidupan alga secara garis besarterbagi dua, yaitu unsure hara makro dan unsure hara mikro. Unsure hara makro terdiri dari N, P, K, S, Na, Si, dan Ca, sedangkan unsur hara terdiri dari Fe, Zn, Mn, Cu, Mg, Mo, Co, dan B. Unsur-unsur makro maupun mikro biasanya diberikan dalam bentuk senyawa. Unsur makro adalah hara yang diperlukan tanaman dan alga dalam jumlah yang relative banyak. Nitrogen (N) diberikan dalam bentuk NH4NO3, NH2PO4, NH2SO4. Nitrogen berfungsi untuk membentuk protein, lemak, dan berbagai senyawa organic lain, pertumbuhan dan pembentukan sel secara vegetative. Fosfor (P) diberikan dalam bentuk KH2PO4 yang berfungsi untuk metabolisme energy, sebagai stabilitor membrane sel, pengaturan metabolisme alga, pengaturan produksi pati/amilum, pembentukan karbohidrat, sangat penting dalam transfer energy, protein, dan sintesis asam amino serta kontribusi terhadap struktur dan asam nukleat.
Unsur K (kalium) memperkuat organ alga, memperlancar metabolisme dan penyerapan makanan, unsur S (sulfur) berperan dalampembentukan asam amino dan vitamin, unsure Ca (kalsium) berperan membantu menyusun dinding sel, mengatur permeabilitas membrane. Mg (magnesium) diberikan salam bentuk MgSO4.7H2O yang berperan dalam pembentukan klorofil, pembentukan karbohidrat, lemak, vitamin, dan untuk meningkatkan kandungan fosfat dan pembentukan protein. Kalium (K), diberikan dalam bentuk KH2PO4 yang berfungsi untuk pemanjangan sel, memperkuat tubuh alga, memperlancar metabolisme dan penyerapan makanan, ion kalsium ditransfer secara cepat menyebrangi membrane sel dan mengatur pH dan tekanan osmotic di antar sel. Unsur S merupakan unsure yang penting untuk pembentukan beberapa jenis protein, seperti asam amino dan vitamin B1.
Unsur mikro adalah unsure hara yang diperlukan mikroalga dalam jumlah sedikit. unsure Fe biasanya diberikan dalam bentuk senyawa dan berfungsi sebagai penyangga kestabilan pH medium dan berperan dalam pembentukan klorofil, Mn berperan sebagai activator enzim, unsure Zn berperan sebagai activator enzim dan penyusun klorofil, unsure Cu berperan sebagai bagian enzim fenolase, lactase, dan askorbat aksidase, unsur B berfungsi dalam translokasi karbohidrat, sebagai activator dan inaktivator zat pengatur tumbuh, unsure Cl berperan sebagai ion yang berpengaruh terhadap aktivitas enzim, Mo berperan dalam membentuk enzim reduktase, sintesis asam askorbat dan ikut dalam metabolisme fosfor.
PROSES PRODUKSI MIKROALGA
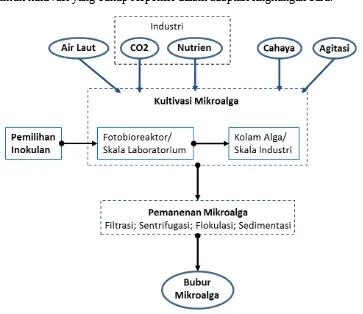
peningkatan biomassa spesies. Stok mikroalga dibudidayakan hingga jenuh di dalam tempat aquarium besar dengan pencahayaan dan aerasi terkontrol (sekitar 10 hari). Mikroalga dipanen dengan memisahkan air dan koloni mikroalga dengam metode penyaringan hingga diperoleh biomassa kering mikroalga (Gambar 4).
- Pemilihan inokulan atau starter adalah penentu daya pertumbuhan biakan mikroalga. Inokulan yang baik adalah inokulan yang mampu beradaptasi dengan kondisi kultur yang sangat berbeda dengan habitat asal starter. Spesies Porphyridium sp. merupakan inokulan untuk kultivasi yang cukup responsif dalam adaptasi lingkungan baru.
Gambar 4 Diagram alir proses produksi mikroalga
lebih besar yaitu sampai 5000 mL. Kultur semi outdoor menggunakan wadah kultur dengan kapasitas 40 L atau 100 L denganpencahayaan yang tidak terlalu kuat. Kultur dapatdilanjutkan dengan wadah berkapasitas 1000 L dengan volume yang lebih besar (10– 1000 m3) setara dengan kultur skala massal.
Gambar 5 Media kultivasi biomassa mikroalga skala laboratorium dan skala besar pada bak beton
Mikroalga dapat tumbuh dalam berbagai media yang mengandung cukup unsur hara makroseperti N, P, K dan unsur mikro lainnya dalam jumlah relatif sedikit yaitu besi (Fe), tembaga (Cu), mangan (Mn), seng (Zn), silicon (Si), boron (B), molybdenum (Mo), vanadium (V), dan kobalt (Co). Pupuk sebagai faktor penunjang pertumbuhan sel secara normal memerlukan minimal 16 unsur hara di dalamnya dan harus ada 3 unsur mutlak, yaitu nitrogen, fosfor, dan kalium. Pemasukan unsur N, P, K dalam air limbah yang berbeda pada kultivasi mikroalga akan menghasilkan produktivitas proksimat yang berbeda. Hal tersebut akibat asupan total nitrogen (TN) dan total fosfor (TP) yang disintesa oleh mikroalga juga berbeda.
Amonium adalah salah satu bentuk kimia yang paling umum dari nitrogen yang dapat mudah diserap oleh sebagian besar spesies mikroalga.Dalam hal ini, sumber murah nitrogen dalam air limbah atau effluen dapat digunakan untuk budidaya mikroalga (Razzak et al. 2013). Beberapa penelitian menunjukkan budidaya mikroalga berbasis limbah terhambat dengan konsentrasi TN tinggi , terutama amonium tinggi. Terlepas dari efek negatif pada pertumbuhan mikroalga dalam suplemen amonium, masih merupakan sumber nitrogen disukai jika parameter lingkungan untuk pengembangan yang tepat dari budaya dikendalikan (Razzak et al. 2013). Fosfor adalah unsur penting lainnya yang diperlukan untuk pertumbuhan mikroalga dan metabolisme.Fosfor merupakan elemen penting yang berkontribusi sebagai ATP dalam sel mikroalga.Oleh karena itu, ketersediaan fosfor memiliki dampak besar dalam pertumbuhan mikroalga seperti yang dapat dipertimbangkan dalam pengaruh fotosintesis (Razzak et al., 2013). Fosfor biasanya tersedia dalam air limbah sebagai spesies anion anorganik
sekitar 185-3,213 mg/L dari TN dan sekitar 30-987 mg/L dari TP, seperti cernaan anaerobik efluen sampah unggas, air limbah pupuk babi atau susu. Namun, jenis-jenis limbah selalu mengandung nutrisi dari konsentrasi yang sangat tinggi, dan dengan demikian harus diencerkan sebelum digunakan untuk budidaya mikroalga. Budidaya mikroalga membutuhkan air, cahaya, CO2 dan bahan-bahan anorganik sebagai nutrisi. Selain itu, peningkatan produktivitas budidaya mikroalga dipengaruhi oleh beberapa faktor antara lain pH, suhu,kadar CO2, cahaya, dan salinitas yang optimum (Wang et al 2013). Salinitas merupakan faktorlingkungan yang sangat berpengaruh terhadap pertumbuhan dan komponen biokimia mikroalga laut (Zhu et al 2008).
V. KESIMPULAN
Referensi
[AOAC] Association of Official Analitical Chemist. 1980. Official Method of Analysis of the Association of Official Analitical of Chemist. Arlington: The Association of Official Analitical Chemist, Inc.
[AOAC] Association of Official Analitical Chemist. 2005. Official Method of Analysis of the Association of Official Analitical of Chemist. Arlington: The Association of Official Analitical Chemist, Inc. Info Obat Indonesia 2009
Agustini NWS, Kusmiati, Jusuf E, Kabinawa IN. 2009. Produksi eksopolisakarida dari mikroalga Porphyridium cruentum yang berpotensi sebagai senyawa antiinflamasi kulit. http://www.biotek.lipi.go.id.
Arad SM, Adda M, Cohen E. 1985. The potential of production of sulfate polysaccharide from Porphyridium. Plant and Soil 89: 117-127.
Chinnasamy S, Bhatnagar A, Hunt RW, Das, KC. 2010. Microalgae cultivation in a wastewater dominated by carpet mill effluents for biofuel applications.Bioresource Technology 101, 3097–3105.
Fuentes MMR, Fernandez GGA, Perez JAS, Guerrero JLG. 2000. Biomass nutrient profiles of the microalga Porphyridium cruentum. Food Chemistry 70: 345-353.
Lee YK, Shen H. 2004. Basic Culturing Techniques. Dalam Richmond A, editor. Handbook of Microalgal Culture: Biotechnology and Applied Phycology. United Kingdom: Blackwell Publishing Company. 566 hlm.
Lehninger AL.2004. Dasar-dasar Biokimia Jilid II. Thenawidjaja M, penerjemah. Jakarta : Erlangga. Terjemahan dari : Principles of Biochemistry. 386 hlm.
Percival E, Foyle RAJ. 1979. The extracellular polysaccharides of Porphyridium cruentum and Porphyridium aerugineum. Carbohydrate Research 72: 165-176.
Razzak SA, Hossain MM, Lucky RA, Bassi AS, de Lasa H. 2013.Integrated CO2 capture, wastewater treatment and biofuel production by microalgae culturing.A review.Renewable Sustainable EnergyRev. 27, 622–653.
Sugiwati S. 2005. Aktivitas Antihiperglikemik dari Ekstrak Buah Mahkota Dewa [Phaleria macrocarpa (Scheff.) Boerl.] sebagai Inhibitor Alfa Glukosidase in vitro dan in vivo pada Tikus Putih. [tesis]. Bogor : Sekolah Pascasarjana Institut Pertanian Bogor.
Sung HO et al. 2009. Lipid production in Porphyridium cruentum grown under different culture conditions. Journal of Bioscience and Bioengineering 108(5): 429-434.
Vonshak A. 1988. Porphyridium. Dalam Borowitzka MA dan Borowitzka MJ, editor. Microalgal Biotechnology. New York: Cambridge University Press. 477 hlm.
Wang H, Zhang W, Chen L, Wang J, LiuT. 2013.The contamination and control of biological pollutants in mass cultivation of microalgae.Bioresource Technology 128: 745–750. You T, Barnett SM. 2004. Effect of light quality on production of extracellular polysaccharides
and growth rate of Porphyridium cruentum. Biochemical Engineering Journal 19 : 251– 258.