PROFIL PERTUMBUHAN DAN ANALISIS KANDUNGAN KARBOHIDRAT, PROTEIN, DAN LIPID MIKROALGA HIJAU-BIRU PADA MEDIUM AF-6
DENGAN PENAMBAHAN SUBSTRAT LIMBAH AMPAS SAGU
SKRIPSI
Diajukan untuk Memenuhi Sebagian dari Syarat untuk Memperoleh Gelar Sarjana Sains Program Studi Biologi
Disusun oleh
SARI LESTARI
0800661
PROGRAM STUDI BIOLOGI
JURUSAN PENDIDIKAN BIOLOGI
FAKULTAS PENDIDIKAN MATEMATIKA DAN ILMU
PENGETAHUAN ALAM UNIVERSITAS PENDIDIKAN INDONESIA
PROFIL PERTUMBUHAN DAN ANALISIS KANDUNGAN KARBOHIDRAT, PROTEIN DAN LIPID MIKROALGA HIJAU-BIRU PADA MEDIUM AF-6 DENGAN
PENAMBAHAN SUBSTRAT LIMBAH AMPAS
Oleh Sari Lestari
Sebuah skripsi yang diajukan untuk memenuhi salah satu syarat memperoleh gelar Sarjana Pendidikan pada Fakultas Matematika dan Ilmu Pengetahuan Alam
© Sari Lestari 2013
Universitas Pendidikan Indonesia
Februari 2013
Hak Cipta dilindungi undang-undang.
Skripsi ini tidak boleh diperbanyak seluruhnya atau sebagian,
LEMBAR PENGESAHAN
PROFIL PERTUMBUHAN DAN ANALISIS KANDUNGAN KARBOHIDRAT, PROTEIN DAN LIPID MIKROALGA HIJAU-BIRU PADA MEDIUM AF-6 DENGAN
PENAMBAHAN SUBSTRAT LIMBAH AMPAS SAGU
Oleh:
SARI LESTARI
0800661
DISETUJUI DAN DISAHKAN OLEH:
Pembimbing I Pembimbing II
Kusnadi, M. Si Dr. Topik Hidayat
NIP. 196805091994031001 NIP. 197004101997021001
Pembimbing III
Dr. Dwi Susilaningsih NIP. 196307131993032002
Mengetahui,
Ketua Jurusan Pendidikan Biologi FPMIPA UPI
PERNYATAAN
“Dengan ini saya menyatakan bahwa skripsi dengan judul “Profil Pertumbuhan dan Analisis Kandungan Karbohidrat, Protein dan Lipid Mikroalga Hijau-biru pada
Medium AF-6 dengan Penambahan Substrat Limbah Ampas Sagu” beserta seluruh
isinya adalah benar-benar karya saya sendiri, dan saya tidak melakukan penjiplakkan dan
pengutipan dengan cara yang tidak sesuai dengan etika keilmuan. Atas pernyataan ini,
saya siap menanggung resiko / sanksi yang diberikan kepada saya apabila kemudian
ditemukan adanya pelanggaran etika pada karya saya ini atau ada klaim dari pihak lain terhadap keaslian karya saya ini”.
Bandung, 15 Februari 2013
KATA PENGANTAR
Bismillahirrahmaanirrahiim,
Assalamu’alaikum, Wr, Wb
Segala puji hanya milik Allah SWT, yang menggenggam ke-Agungan dan
kesempurnaan di jagat raya, yang senantiasa memberikan kita berbagai
kenikmatan tiada tara dan mempermudah segala urusan setiap insan di muka
bumi ini, begitu juga dengan penyusun yang telah diberikan kesempatan dan
kemudahan dalam penyusunan skripsi ini. Shalawat dan salam semoga tetap
tercurah kepada khudwah kita Habibana wanabiana Rasulallah Muhammad SAW, juga kepada keluarga, para sahabatnya, para tabi’in dan sampai kepada kita selaku umatnya di akhir zaman.
Dalam penyusunan skripsi ini, penyususn banyak mendapatkan bantuan dan
sumbangan pemikiran, moril dan materil dari berbagai pihak. Oleh karena itu,
pada kesempatan ini penyusun ingin mengucapkan terimakasih kepada:
1. Dr. Riandi, M.Si selaku ketua Jurusan Pendidikan Biologi
2. Dr. Widi Purwianingsih, selaku ketua Program Studi Biologi dan Penguji
pada sidang kelulusan atas saran yang telah diberikan
3. Dra. Kusdianti M, Si., selaku pembimbing akademik Biologi C angkatan 2008
yang telah memberikan dukungan kepada penyusun dalam menyelesaikan
skripsi
4. Kusnadi M, Si., selaku pembimbing pertama atas segala saran, dukungan dan
perhatian yang diberikan selama penyusunan skripsi
5. Dr. Topik Hidayat, selaku pembimbing kedua atas segala bimbingan,
masukan, bantuan, dan perhatian yang diberikan selama penyusunan skripsi
6. Dr. Dwi Susilaningsih, selaku pembimbing ketiga atas segala izin, bimbingan,
iv
7. Wahyu Surakusumah, S.Si, M.T. dan Dr. Any Fitriani, M. Si selaku penguji
pada sidang kelulusan atas saran yang telah diberikan
8. Seluruh dosen, jajaran staf di jurusan Pendidikan Biologi dan laboran di
lingkungan Jurusan pendidikan Biologi FPMIPA UPI yang telah memberikan
ilmu dan bantuan selama ini
9. Mba hani, selaku mentor di laboratorium Bioenergi dan Bioproses Puslit
Bioteknologi atas segala sumbangan ide, saran, bimbingan, doa dan kritikan
yang sangat membangun selama proses penelitian hingga penulisan skripsi
10.Kak Adel, Pak Anam, Mas Swastika, Mba Dian, Mba Hilda, Zae, Heidy,
Indri, Mba Alfi, Mas Rifana dan Mba Puspita atas segala bantuan, dukungan,
saran, dan doanya selama masa penelitian dan penyusunan skripsi
11.Ayah, ibu, kakak, adik dan keluarga untuk semua nasehat, dukungan baik
materil dan moril, dan kesabaran dalam penantian
12.Ratna, Nurul, Dhora, untuk kesedian dalam menjadi pendengar yang baik,
dukungan, doa dan curhatannya selama ini
13.Teman-teman Biologi C 2008 atas kebersamaan dan dukungan selama ini
14.Semua pihak yang telah membantu kelancaran penyusunan skripsi ini yang
tidak bisa disebutkan satu persatu
Penyusun menyadari bahwa dalam penyusunan dan penulisan skripsi ini
masih banyak terdapat kekurangan dan kelemahannya. Oleh karena itu penulis
mengharapkan kritik dan saran yang membangun dari semua pihak guna
perbaikan skripsi ini. Semoga skripsi ini dapat memberikan manfaat, khususnya
bagi penulis dan umumnya bagi yang membacanya.
ABSTRAK
Mikroalga merupakan salah satu mikroorganisme yang berpotensi dalam menghasilkan beberapa senyawa berguna seperti karbohidrat, protein, dan lipid. Mikroalga juga dapat berperan sebagai agen bioremediasi. Penelitian ini bertujuan untuk menganalisis pertumbuhan dan kandungan nutrisi mikroalga berupa karbohidrat, protein dan lipid dari isolat LIPI-11A1, LIPI-11A2 dan LIPI-11A8 yang ditambahkan limbah ampas sagu ke dalam media AF-6 sebagai substrat tambahan. Tahap pertama yang dilakukan adalah kultivasi mikroalga secara bertingkat hingga siap kultivasi pada volume 5 Liter dengan penambahan substrat ampas sagu. Pengamatan pertumbuhan dilakukan berdasarkan Optical Density (λ 680 nm) dan berat biomassa. Uji kandungan senyawa yang dihasilkan menggunakan beberapa metode. Kandungan karbohidrat diukur berdasarkan prosedur Phenol-Sulphuric acid
method, kandungan protein diukur berdasarkan prosedur Bradford method, dan
kandungan lipid diukur berdasarkan prosedur Bligh and Dyer method. Hasil penelitian menunjukkan bahwa limbah ampas sagu sebagai substrat dapat meningkatkan kandungan nutrisi mikroalga LIPI-11A1, LIPI-11A2 dan LIPI-11A8. Ketiga jenis isolat mikroalga mampu tumbuh hingga penambahan 5000 ppm limbah. Kandungan nutrisi karbohidrat, protein dan lipid dari isolat LIPI-11A1 yang ditambahkan 500 ppm limbah berturut-turut yaitu 75,342 ppm, 6,646 ppm dan 8,23%. LIPI-11A2 dengan penambahan 5000 ppm limbah memiliki kandungan karbohidrat, protein dan lipid berturut-turut sebesar 261,09 ppm, 5,12 ppm dan 3,61%. Kandunga nutrisi isolat LIPI-11A8 dengan penambahan 5000 ppm yaitu 436,81 ppm karbohidrat, 5,52 ppm protein dan 7,34% lipid.
ABSTRACT
Microalgae is one of the microorganisms that have the potential to produce some useful compounds such as carbohydrates, proteins, and lipids. Microalgae can also serve as a bioremediation agent. This study aims to analyze the growth and nutritional microalgae form of carbohydrates, proteins and lipids from isolates LIPI-11A1, and LIPI LIPI-11a2-11A8 sago pulp waste were added to the media AF-6 as an additional substrate. The first stage is carried out in stages until the cultivation of microalgae cultivation on a volume prepared by the addition of substrate 5 Liter sago waste. Observations of growth is based on Optical Density (λ 680 nm) and a weight of biomass. Test Compounds produced using several methods. Carbohydrate content was measured by the procedure Phenol-sulfuric acid method, the protein content was measured by Bradford method procedure, and the lipid content measured according to Bligh and Dyer method. The results showed that sago waste as a substrate were able to increase the nutrient content of microalgae LIPI-11A1, and LIPI LIPI-11A2 and LIPI-11A8. The three types of microalgae isolates were able to grow to the addition of 5000 ppm of waste. Nutrient content of carbohydrates, proteins and lipids from LIPI-11A1 isolates were added 500 ppm respectively waste is 75.342 ppm, 6.646 ppm and 8.23%. LIPI-11a2 with the addition of 5000 ppm waste contains carbohydrate, protein and lipid respectively at 261.09 ppm, 5.12 ppm and 3.61%. Kandunga nutrition isolates LIPI-11A8 with the addition of 5000 ppm 436.81 ppm carbohydrates, protein 5.52 ppm and 7.34% lipid.
DAFTAR ISI
ABSTRAK ... i
KATA PENGANTAR ... iii
DAFTAR ISI ... v
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... xi
BAB I PENDAHULUAN ... 1
A. Latar Belakang ... 1
B. Rumusan Masalah ... 3
C. Pertanyaan Penelitian ... 3
D. Batasan Masalah ... 3
E. Tujuan Penelitian ... 4
F. Manfaat Penelitian ... 4
G. Asumsi ... 4
H. Hipotesis ... 4
BAB II PERTUMBUHAN DAN NUTRISI MIKROALGA... 5
A. Mikroalga ... 5
B. Blue-green algae (Cyanobacteria) ... 8
C. Dinamika Pertumbuhan Mikroalga ... 9
vi
E. Beberapa Aplikasi Pemanfaatan Mikroalga ... 12
F. Pemanfaatan Limbah Sagu ... 13
G. Pertumbuhan Mixotrofik ... 14
BAB III METODE PENELITIAN... 16
A. Jenis Penelitian ... 16
B. Waktu dan Tempat penelitian ... 16
C. Alat dan Bahan ... 16
D. Populasi dan Sampel ... 18
E. Pengambilan Sampel ... 19
F. Prosedur Penelitian ... 19
1. Sterilisasi alat dan bahan ... 19
2. Pembuatan media kultur ... 19
3. Pembuatan stok kultur... 20
4. Kultivasi mikroalga ... 21
5. Pengamatan pertumbuhan mikroalga ... 21
6. Pemanenan kultur mikroalga ... 22
7. Pengukuran parameter lingkungan ... 23
8. Pengukuran kandungan karbohidrat (phenol Sulphuric acid method) ... 23
9. Pengukuran kandungan protein (Metode Bradford) ... 24
10. Pengukuran kandungan lipid... 25
G. Alur Penelitian ... 27
vii
BAB IV HASIL DAN PEMBAHASAN ... 29
A. Morfologi Sel Mikroalga yang Digunakan ... 29
B. Pertumbuhan Mikroalga Isolat LIPI-11A1, LIPI-11A2 dan LIPI-11A8 pada Kondisi Pertumbuhan Mixotrofik ... 33
C. Kandungan Nutrisi Mikroalga Isolat LIPI-11A1, LIPI-11A2 dan LIPI-11A8 pada Kondisi Pertumbuhan Mixotrofik ... 42
D. Profil Pertumbuhan dan Nutrisi Mikroalga ... 54
BAB V KESIMPUALAN DAN SARAN ... 62
A. Kesimpulan ... 62
B. Saran ... 62
DAFTAR PUSTAKA ... 64
viii
DAFTAR TABEL
Tabel Halaman
2.1 Klasifikasi mikroalga. ... 11
2.2 Perbandingan (rerata) beberapa sumber biodiesel ... 12
3.1 Daftar alat yang digunakan. ... 16
3.2 Daftar bahan yang digunakan ... 18
3.3 Komposisi media AF-6 dalam 1 liter ... 20
ix
DAFTAR GAMBAR
Gambar Halaman
2.1 Bentuk alga secara umum ... 6
2.2 Karakteristik warna dari kelompok alga yang berbeda.. 7
2.3 Lima fase pertumbuhan dari kultur mikroalga ... 9
2.4 Metabolisme pada pertumbuhan mixotrofik ... 15
3.1 Stok kultur pada volume 5 mL ... 20
3.2 Pemanenan mikroalga LIPI-11A1 menggunakan saringan ... 22
3.3 Pemanenan mikroalga LIPI-11A2 dan LIPI-11A8 menggunakan metode flokulasi FeCl3. ... 23
3.4 Diagram alir penelitian. ... 27
4.1 Morfologi isolat LIPI-11A1... 30
4.2 Morfologi isolat LIPI-11A2... 31
4.3 Morfologi isolat LIPI-11A8... 32
4.4 Perubahan warna saat masa kultivasi ... 34
4.5 Kurva pertumbuhan berdasarkan OD ... 36
4.6 Rerata konsentrasi karbohidrat dari kultur LIPI-11A1, LIPI-11A2 dan LIPI-11A8 ... 41
x
4.8 Rerata konsentrasi lipid (%) dari kultur isolat
LIPI-11A1, LIPI-11A2 dan LIPI-11A8 ... 49
4.9 Profil pertumbuhan dan nutrisi mikroalga isolat
LIPI-11A1 ... 53
4.10 Profil pertumbuhan dan nutrisi mikroalga isolat
LIPI-11A2 ... 55
4.11 Profil pertumbuhan dan nutrisi mikroalga isolat
xi
DAFTAR LAMPIRAN
Lampiran Halaman
1. Kurva pertumbuhan berdasarkan biomassa kering ... 69
2. Tabel kandungan nutrisi ... 70
3. Kurva standar ... 73
4. Tabel hasil uji statistik ... 74
5. Tabel hasil uji statistik ... 75
6. Tabel hasil uji statistik ... 76
7. Tabel hasil uji statistik ... 77
8. Tabel hasil uji statistik ... 78
9. Tabel hasil uji statistik ... 88
10.Tabel hasil uji statistik ... 89
11.Tabel hasil uji statistik ... 90
12.Tabel hasil uji statistik ... 100
13.Tabel hasil uji statistik ... 101
BAB I
PENDAHULUAN
A. Latar Belakang
Mikroalga merupakan pabrik biologis yang menghasilkan banyak bioaktif
atau senyawa yang berguna termasuk sumber energi. Menurut Kong et al. (2011)
mikroalga merupakan sumber yang potensial untuk menghasilkan biodiesel dan
bahan-bahan berguna lainnya (seperti pigmen, protein dan asam lemak).
Mikrolaga seperti Spirullina platensis memiliki kandungan protein tinggi dan
g-linolenic acid (GLA), sedangkan Chlorella vulgaris merupakan sumber asam
lemak (Tokusoglu dan Unal, 2003). Mikroalga juga dapat berperan sebagai agen
bioremediasi yaitu memiliki kemampuan untuk mengkonsumsi nitrogen dan
posfat dari limbah perairan temasuk limbah pertanian (Narasimhan, 2010).
Menurut Robert (2009) Chlorella dan Spirullina berguna sebagai diet makanan
sehat, Dunaliella kaya akan β-karoten dan Haematococcus yang kaya akan
astaxin dan bebarapa jenis mikroalga lain yang dapat digunakan sebagai pakan
ternak.
Sebagai negara maritim yang beriklim tropis, keragaman mikroalga di
Indonesia sangat tinggi. Mikroalga di Indonesia sudah dimanfaatkan sebagai
bioaktif kosmetik, suplemen makanan dan kesehatan, pakan akuakultur dan
bioenergi. Salah satu permasalahan dalam pemanfaatan baik berupa biomassa
maupun metabolit yang barasal dari mikroalga adalah media kultivasi yang cukup
mahal sehingga dibutuhkan inovasi sumber media pertumbuhan baru yang murah,
mudah diperoleh dan tersedia cukup melimpah. Limbah organik merupakan salah
satu media potensial bagi pertumbuhan mikroalga.
Indonesia sebagai negara yang memiliki potensi perkebunan besar memiliki
permasalahan berupa limbah organik yang belum bisa terselesaikan secara
optimal. Salah satunya adalah limbah ampas sagu yang tersedia melimpah karena
Indonesia merupakan negara utama penghasil sagu di dunia. Beberapa daerah
2
produksi 527 ton sagu (McClatchey et al., 2006). Saat ini, pemanfaatan sagu
hanya terfokus pada pati yang terkandung di dalamnya, dan ampas sagu
merupakan produk sampingan dari pengolahan batang tanaman sagu (Metroxylon
sago) menjadi pati atau tepung sagu. Menurut Aziz et al. (2009) ampas sagu dapat
menimbulkan permasalahan lingkungan karena dapat mencemari sungai.
Industri ekstraksi pati sagu menghasilkan tiga jenis limbah, yaitu ampas, kulit
batang sagu dan air buangan. Jumlah kulit batang sagu dan ampas sagu adalah
sekitar 26% dan 14% dari total bobot balak sagu (Singhal et al., 2008). Rasio
kandungan C : N pada ampas sagu yaitu 35 : 1 (Aziz et al., 2009). Kandungan
ampas sagu yang sebagian besar terdiri atas lignin dan selulosa dapat
dimanfaatkan untuk substrat mikroalga karena mengandung molekul-molekul gula
yang dapat dijadikan sebagai sumber karbon untuk meningkatkan kandungan
nutrisi berupa karbohidrat, protein dan lipid pada mikroalga Selama ini
pemanfaatan ampas sagu hanya sebatas untuk pakan ternak dan pupuk kompos
untuk mushroom (Aziz et al., 2009).
Pemanfaatan limbah sagu masih belum banyak dilakukan untuk tujuan
penelitian terutama yang menggunakan mikroalga sebagai agen biologisnya.
Bagian dari limbah sagu yang sudah bayak dimanfaatkan biasanya adalah limbah
cairan dari proses ekstraksi pati. Aziz et al. (2009) limbah cair ekstraksi pati yang
difermentasi menggunakan bakteri anaerobik memiliki rasio C : N : P sebesar 24 :
0,14 : 1 dipakai untuk menumbuhkan Spirullina platensis. Kandungan protein,
karbohidrat, dan lipid dari penelitian tersebut adalah 68 ppm, 23 ppm dan 11%.
Pemanfaatan limbah ampas sagu sebagai substrat mikroalga yang dilakukan
pada penelitian ini merupakan hal baru di Indonesia. Sedangkan di Malaysia
penggunaan limbah ampas sagu sebagai substrat untuk pertumbuhan mikroalga
pernah dilakukan. Malaysia juga merupakan salah satu Negara penghasil sagu di
wilayah Asia Tenggara. Sehingga Malaysia juga memiliki potensi limbah ampas
sagu yang besar. Menurut Aziz et al. (2009) tanaman sagu tumbuh secara
komersial di beberapa Negara Asia seperti Malaysia, Indonesia, Filipina dan
Papua New Guinea. Oleh karena itu penelitian mengenai pemanfaatan limbah
3
antara upaya mengurangi dampak pencemaran lingkungan oleh limbah
agro-industri sekaligus budidaya/ kultivasi mikroalga dengan biaya produksi yang lebih
rendah.
B. Rumusan Masalah
Berdasarkan latar belakang yang telah dikemukakan di atas maka rumusan
masalahnya adalah: Bagaimana profil pertumbuhan dan kandungan karbohidrat,
protein dan lipid mikroalga hijau-biru pada medium AF-6 dengan penambahan
substrat limbah ampas sagu ?
C. Pertanyaan Penelitian
Untuk lebih memfokuskan masalah, maka diajukan beberapa pertanyaan
penelitian sebagai berikut :
1. Isolat manakah yang menghasilkan kandungan karbohidrat, protein dan lipid
tertinggi ?
2. Bagaimanakah pola pertumbuhan isolat mikroalga yang digunakan ?
3. Berapa kandungan karbohidrat, protein, dan lipid mikroalga isolat LIPI-11A1,
LIPI-11A2 dan LIPI-11A8 ?
4. Berapa konsentrasi optimum ampas sagu yang efektif meningkatkan
pertumbuhan dan kandungan nutrisi berupa karbohidrat, protein dan lipid ?
D. Batasan Masalah
Batasan masalah dari peneltian ini adalaha:
1. Isolat yang digunakan berasal dari biakan isolat murni di Laboratorium
Bioenergi dan Bioproses, Pusat Penelitian Bioteknologi LIPI.
2. Isolat yang digunakan yaitu LIPI-11 A1, LIPI-11 A2, dan LIPI-11 A8
3. Konsentrasi limbah ampas sagu yang digunakan adalah 50 ppm, 500 ppm dan
4
E. Tujuan Penelitian
Tujuan penelitian ini adalah :
1. Mengetahui kandungan senyawa karbohidrat, protein dan lipid dari ketiga
isolat mikroalga pada konsentrasi limbah yang berbeda
2. Mencari konsentrasi limbah terbaik yang diberikan pada ketiga isolat
mikroalga dalam menghasilkan karbohidrat, protein dan lipid.
3. Mendapatkan informasi mengenai isolat potensial yang dapat menghasilkan
kandungan karbohidrat, protein dan lipid terbaik dengan penambahan limbah
ampas sagu.
F. Manfaat Penelitian
Manfaat yang dapat diperoleh dari penelitian ini adalah:
1. Sebagai data bahwa mikroalga lokal memiliki kemampuan dalam
memanfaatkan nutrisi limbah ampas sagu dalam jalur metabolismenya
2. Dapat dijadikan informasi bahwa mikroalga lokal memiliki kemampuan
untuk dijadikan agen bioremediasi limbah organik seperti limbah sagu
3. Memberikan informasi bahwa mikroalga isolat LIPI-11 memiliki kandungan
nutrisi yang bernilai ekonomis.
G. Asumsi
Komposisi biokimia mikroalga pada kondisi mixotrofik tidak hanya dapat
meningkatkan produksi biomassa tetapi juga penimbunan kandungan lipid, yang
sangat penting untuk produksi biodiesel dari mikroalga (Xu et al., 2004)
H. Hipotesis
Ada pengaruh dari penambahan limbah sagu yang diberikan terhadap profil
pertumbuhan dan kandungan karbohidrat, protein dan lipid dari mikroalga isolat
BAB III
METODE PENELITIAN
A. Jenis Penelitian
Jenis penelitian yang dilakukan adalah penelitian eksperimen. Penelitian
eksperimen adalah penelitian yang dilakukan dengan mengadakan manipulasi
terhadap objek penelitian serta adanya kontrol (Nazir, 2003). Rancangan
penelitian ini adalah RAL (Rancangan Acak Lengkap).
B. Waktu dan Tempat Penelitian
Penelitian ini dilakukan di Laboratorium Bioenergi dan Bioproses, Bidang
Bioproses, Pusat Penelitian Bioteknologi LIPI, Jalan Raya Bogor KM 46,
Cibinong 16911, Bogor, Jawa Barat. Penelitian ini dilakukan pada bulan Maret
2011 sampai Oktober 2012.
C. Alat dan Bahan
1. Alat
Tabel 3.1 Daftar alat yang digunakan
Alat Spesifikasi Jumlah
Tabung reaksi Pyrex IWAKI 40
Erlenmeyer Pyrex IWAKI 5
Mikroplate 3
Beaker glass Pyrex IWAKI 2
Gelas ukur 1 L dan 25 mL Pyrex IWAKI 2
Sonikator 1
Vortex Fisher Scientific
060119004
1
Sentrifuge HITACHI himac CT
GEL
1
Coolroom 1
Luxmeter 1
Mikrotube (Ependorf) 4
Gunting 1
Pipet Pasteur 20
Spatula 3
17
Botol berukuran 1 L 10
Alat Spesifikasi Jumlah
Botol beruuran 500 mL 10
Autoclave TOMY ES-315 1
Ice maker Scotsman AFE424A-6A 1 Spektrofotometer SHIMADZU UV- 1700 1
Kuvet 3 mL dan 1 mL
Masing-masing 1 pasang
Laminar ESCO 1
Waterbath
Timbangan analitis Sartorius TE 15025 1 Hot plate dan magnetik
stirrer
IKA RH basic 2 1
Objek glass dan cover glass
20
Mikroskop 1
Labu ukur Pyrex IWAKI 1
pH meter 1
pH indikator Secukupnya
Kamera digital Sony DSC-W370 1
Plastik anti panas Secukupnya
Selang plastik Secukupnya
Parafilm PM-992 Secukupnya
Wrap Secukupnya
Tissue Secukupnya
Aluminium foil Secukupnya
Karet gelang Secukupnya
Kapas Secukupnya
Batu aerasi Secukupnya
Saringan 1
Corong plastik 1
Corong kaca 1
18
2. Bahan
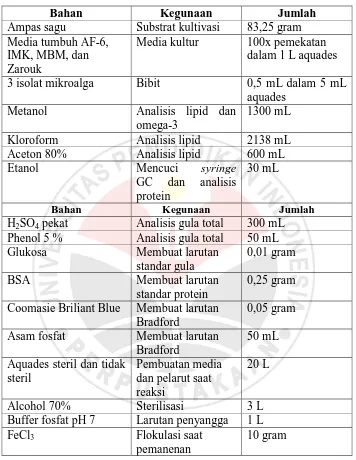
Tabel 3.2 Daftar bahan yang digunakan
Bahan Kegunaan Jumlah
Ampas sagu Substrat kultivasi 83,25 gram Media tumbuh AF-6,
IMK, MBM, dan Zarouk
Media kultur 100x pemekatan dalam 1 L aquades
3 isolat mikroalga Bibit 0,5 mL dalam 5 mL aquades
Metanol Analisis lipid dan omega-3
1300 mL
Kloroform Analisis lipid 2138 mL
Aceton 80% Analisis lipid 600 mL
Etanol Mencuci syringe
GC dan analisis protein
30 mL
Bahan Kegunaan Jumlah
H2SO4 pekat Analisis gula total 300 mL Phenol 5 % Analisis gula total 50 mL
Glukosa Membuat larutan
standar gula
0,01 gram
BSA Membuat larutan
standar protein
0,25 gram
Coomasie Briliant Blue Membuat larutan Bradford
0,05 gram
Asam fosfat Membuat larutan Bradford
50 mL
Aquades steril dan tidak steril
Pembuatan media dan pelarut saat reaksi
20 L
Alcohol 70% Sterilisasi 3 L
Buffer fosfat pH 7 Larutan penyangga 1 L
FeCl3 Flokulasi saat
pemanenan
10 gram
D. Populasi dan Sampel
1. Populasi yang digunakan adalah seluruh mikroalga isolat LIPI-11 di
Laboratorium Bioenergi, Pusat Penelitian Bioteknologi, Bogor.
2. Sampel yang digunakan adalah mikroalga isolat LIPI-11A1, LIPI-11A2 dan
19
E. Pengambilan Sampel
Sampel diambil dari biakan murni mikroalga Cyanobacteria di Laboratorium
Bioenergi dan Bioproses, Bidang Bioproses, Pusat Penelitian Bioteknologi LIPI.
Jumlah isolat yang digunakan berjumlah 3 isolat yaitu LIPI-11A1, LIPI-11A2 dan
LIPI-11A8.
F. Prosedur Penelitian
Penelitian ini dilakukan dalam beberapa tahap, diantaranya sebagai berikut :
1. Sterilisasi alat dan bahan
Aquades dan Media kultur disterilisasi menggunakan autoclave. Media
pertumbuhan dibuat menggunakan aquades sebagai pelarut. Autoclave dijalankan
pada suhu 121oC selama 15 menit.
Sterilisasi alat berbahan gelas, plastik maupun karet juga menggunakan
autoclave suhu 121oC selama 15 menit. Peralatan tersebut sebelumnya dicuci
hingga bersih dan ditiriskan. Setelah kering peralatan yang terbuat dari bahan
gelas ditutup dengan alumunium foil agar uap air tidak bisa masuk selama proses
sterilisasi. Beberapa alat berbahan gelas dibungkus dengan aluminium foil
kemudian dimasukkan ke dalam plastik tahan panas. Sedangkan peralatan plastik
dan karet langsung dibungkus menggunakan plastik tahan panas.
2. Pembuatan media kultur
Aquades yang digunakan dalam pembuatan media kultur disterilisasi
bersamaan dengan bahan-bahan komposisi media kultur yang digunakan.
Penggunaan dalam jumlah yang besar maka media kultur dibuat menjadi
pemekatan tertentu sesuai kebutuhan. Untuk kepentingan pengenceran juga
digunakan aquades steril. Mikrolaga dikultur pada galon berukuran 6 L. Volume
total pengkulturan sebanyak 5 L yang terdiri dari air laut, media dan bibit. Media
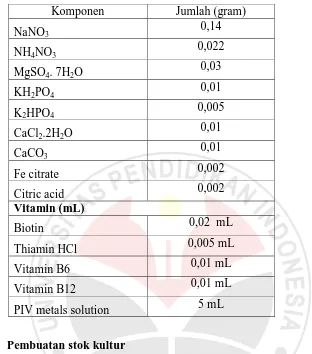
pertumbuhan yang digunakan adalah AF-6. Komposisi media AF-6 dapat dilihat
20
Tabel 3.3 Komposisi media AF-6 dalam 1 liter
Komponen Jumlah (gram)
NaNO3 0,14
NH4NO3 0,022
MgSO4. 7H2O 0,03
KH2PO4 0,01
K2HPO4 0,005
CaCl2.2H2O 0,01
CaCO3 0,01
Fe citrate 0,002
Citric acid 0,002
Vitamin (mL)
Biotin 0,02 mL
Thiamin HCl 0,005 mL
Vitamin B6 0,01 mL
Vitamin B12 0,01 mL
PIV metals solution 5 mL
3. Pembuatan stok kultur
Stok mikroalga LIPI-11A1, LIPI-11A2 dan LIPI-11A8 yang diperoleh dari
Laboratorium Bioproses, Puslit Biotekonologi Indonesia LIPI Cibinong Bogor
dilakukan perbanyakan dengan cara bertingkat. Isolat mikrolaga dikultur pada
21
Kemudian dikultivasi di ruang kultur hingga sekitar 2 minggu (14 hari).
Setelah tumbuh kemudian dikultur kembali di volume lebih besar yaitu 50 mL
hingga 2 minggu (14 hari). Bila telah tumbuh dilakukan lagi pengkulturan pada
volume 500 mL. Begitu seterusnya hingga bibit siap dikultur menjadi volume 5 L.
Pemberian aerasi dilakukan pada tahap kultur volume 500 mL hingga 5 L.
4. Kultivasi mikroalga
Proses kultivasi mikroalga dalam penelitian ini dilakukan selama 30 hari.
Tempat yang digunakan adalah galon berukuran 6 L, namun volume kultur total
hanya 5 L. Bibit yang digunakan sebesar 5% dari volume kultur total. Media
dibuat dalam stok pemekatan 100x maka hanya diperlukan 50 mL media, 4450
mL aquades steril, dan 500 mL bibit siap inokulasi.
Alga yang telah dikultivasi diamati pertumbuhannya berupa kepadatan selnya
dengan cara diukur menggunakan spektrofotometer pada panjang gelombang
680 nm setiap hari di waktu yang sama. Pengambilan sampel untuk uji kandungan
nutrisi di lakukan setiap 5 hari sekali meliputi uji kandungan karbohidrat (gula
total), protein, dan lipid. Uji kandungan karbohidrat (gula total), berat kering,
protein dan lipid diperlukan sampel masing-masing 10 mL.
5. Pengamatan pertumbuhan mikroalga
Pertumbuhan mikroalga diamati setiap hari sampai hari ke-30 menggunakan
spektrofotometer pada absorbansi 680 nm. Sampling dilakukan setiap pagi hari
pukul 08.00 WIB. Volume sampling sebanyak 3,5 mL untuk tiga kali
pengulangan.
Metode lain yang juga dipakai untuk pengamatan pertumbuhan pada
penelitian ini yaitu pengukuran berat biomassa kering. Waktu sampling juga
dilakukan di pagi hari pukul 08.00 WIB dengan volume 10 mL. Sampel kemudian
disaring dengan kertas saring GF/C yang telah diketahui beratnya. Kertas saring
dan hasil panen kemudian dikeringkan di bawah sinar matahari selama 3 hari
kemudian ditimbang sampai konstan. Berat kering mikroalga didapat dari
mengurangi berat kering kertas saring ditambah mikroalga dengan berat kertas
22
6. Pemanenan kultur mikroalga
Pemanenan kultur mikrolaga yang telah selesai dikultivasi dilakukan dengan
dua cara, yaitu penyaringan dan flokulasi. Penyaringan dilakukan dengan
menyaring biomassa secara langsung tanpa ditambahkan zat apapun. Mikrolaga
dalam media langsung dituang ke dalam saringan. Biomassa akan tersaring
disaringan, sedangkan media akan lolos dari saringan. Biomassa yang didapat
dikumpulkan dalam wadah untuk dikeringkan.
Mikroalga yang bisa dipanen menggunakan cara ini biasanya yang bentuk
selnya panjang (filamen) dan di dalam media berkoloni membentuk
serabut-serabut. Pada penelitian ini hanya mikroalga LIPI-11A1 yang bisa dipanen dengan
cara ini.
Gambar 3.2 Pemanenan mikroalga LIPI-11A1 menggunakan saringan
Metode flokulasi menggunakan ferric chloride (FeCl3). Proses flokulasi
menginduksi meningkatnya nilai pH medium yang dapat menambah efisiensi
panen hingga 90% (Zhang et al., 2012). Bahan kimia yang digunakan untuk
koagulasi mikroalga tidak mempengaruhi komposisi dan tidak menghasilkan efek
toksik (Danquah, 2009).
Kultur yang telah selesai diflokulasi kemudian disaring menggunakan kertas
saring. Biomassa yang tersaring dipindah ke tempat lain untuk dikumpulkan.
23
Gambar 3.3 Pemanenan mikroalga LIPI-11A2 dan LIPI-11A8 menggunakan metode flokulasi FeCl3
7. Pengukuran parameter lingkungan
Dalam penelitian ini dilakukan juga pengukuran parameter lingkungan.
Faktor lingkungan berupa faktor abiotik juga ikut berperan dalam menentukan
pertumbuhan mikroalga. Faktor lingkungan yang diukur yaitu temperature air, pH
air dan intensitas cahaya pada pagi, siang dan sore hari. Pengukuran pH dilakukan
dengan menggunakan pH meter Portable HORIBA. Sensor yang ada pada alat
dicelupkan ke dalam air media kemudian akan terlihat nilai pH di dalam layar.
Pengukuran pH dan temperatur dilakukan sekali dalam sehari. Sedangkan untuk
mengukur intensitas cahaya menggunakan luxmeter dilakukan pada pagi, siang
dan sore hari.
8. Pengukuran kandungan karbohidrat (Phenol-Sulphuric acid method)
a. Pembuatan kurva baku standar glukosa
Membuat larutan standar konsentrasi 100 ppm dengan cara menimbang
glukosa sebanyak 0,01 gram/100 mL kemudian dimasukkan ke dalam labu ukur
dan ditambahkan dengan aquades sampai 100 mL. Dihomogenkan dengan cara
dikocok perlahan. Mencampur larutan standar dengan aquades hingga
masing-masing konsentrasi yang diinginkan. Sebanyak 5% fenol dimasukkan ke dalam
larutan yang telah dibuat dan ditambahkan 2,5 mL H2SO4 pekat ke dalam
masing-masing tabung dengan konsentrasi larutan berbeda. Divortex kemudian didiamkan
24
menit menggunakan waterbath. Langkah terakhir adalah diukur menggunakan
spektrofotometer pada panjang gelombang 490 nm. Kemudian dicari nilai
regresinya. Nilai gula total didapat dari persamaan :
Y = ax + b
Keterangan : Y = nilai absorbansi
a dan b = nilai pada persamaan regresi larutan standar
x = kadar gula yang dicari (ppm)
b. Pengukuran kandungan karbohidrat sampel
Pengukuran kadar karbohidrat menggunakan metode Phenol-Sulphuric acid
dilakukan setiap lima hari sekali selama 30 hari masa kultivasi. Metode yang
digunakan adalah metode phenol asam sulfat. Sebanyak 10 mL sampel diambil
kemudian disentrifugasi 6000 rpm selama 10 menit. Supernatan dibuang dan
ditambahkan 10 mL buffer fosfat pH 7. Disonikasi selama 4 x 1 menit. Kemudian
sampel diambil sebanyak 0,5 mL ke dalam tabung reaksi, ditambahkan 0,5 mL
phenol dan 2,5 mL asam sulfat. Divortex agar homogen kemudian didiamkan
selama 10 menit pada suhu ruang. Tabung reaksi di simpan di waterbath suhu
40oC selama 20 menit.
Blangko menggunakan 0,5 mL aquades ditambah phenol dan asam sulfat
dengan jumlah yang sama pada sampel. Kandungan gula total sampel diukur
menggunakan spektrofotometer pada panjang gelombang 490 nm.
9. Pengukuran kandungan protein (Metode Bradford)
a. Pembuatan kurva baku standar protein
Membuat larutan standar konsentrasi 100 ppm dengan cara menimbang BSA
sebanyak 0,25 gram/250 mL kemudian dimasukkan ke dalam labu ukur dan
ditambahkan dengan aquades sampai 100 mL. Dihomogenkan dengan cara
dikocok perlahan. Mencampur larutan standar dengan aquades hingga
masing-masing konsentrasi yang diinginkan. Ditambahkan 1 mL larutan Bradford.
25
Kemudian dicari nilai regresinya. Nilai protein didapat dari persamaan :
Y = ax + b
Keterangan : Y = nilai absorbansi
a dan b = nilai pada persamaan regresi larutan standar
x = kadar protein yang dicari (ppm)
b. Pengukuran kandungan protein sampel
Metode Bradford digunakan untukmenganalisis kadar protein yang dilakukan
setiap lima hari sekali selama 30 hari masa kultivasi. Sampel sebanyak 10 mL
disentrifugasi 6000 rpm 15 menit untuk diambil peletnya. Kemudian dicuci
dengan buffer fosfat pH 7 sebanyak 10 mL dikocok dan disentrifugasi kembali.
Supernatan dibuang, ditambahkan aceton 80% sebanyak 10 mL. sampel
disonikasi (4 x 1 menit). Kemudian disentrifugasi 6000 rpm selama 10 menit.
Ambil 0,1 mL supernatan. Ditambahkan 1 mL larutan Bradford. Divortex untuk
meghomogenkan sampel dan larutan. Didiamkan selama 15 menit dan diukur di spektrofotometer pada 595 nm.
10. Pengukuran kandungan lipid (Metode Bligh and Dyer)
Pengukuran kadar lipid total pada penelitian ini menggunkan metode Bligh
and Dyer, (1959) yang telah dimodifikasi. sampel sebanyak 10 mL disentrifugasi
6000 rpm selama 15 menit. Untuk ekstraksi minyak ditambahkan metanol
sebanyak 3 mL. Disonikasi 4 x 1 menit. Ditambahkan 6 mL kloroform. Shaker
selama 1 jam. Kemudian ditambahkan aquades sebanyak 10 mL dan shaker
kembali selama 15 menit. Hasil shaker tersebut didiamkan sebentar agar terpisah
fase air dan minyaknya. Minyak berada di bagian bawah campuran air dan
kloroform. Perbandingan antara metanol, kloroform dan aquades adalah 1 : 1 : 1.
Minyak mikroalga yang masih bercampur dengan kloroform diambil
menggunakan pipet pasteur ke dalam tabung reaksi yang telah ditimbang
26
menguap dan hanya minyak yang tertinggal. Perhitungan % berat total lipid
menggunakan rumus berikut :
% lipid = (A x B)
C
Keterangan : A = berat minyak (gram)
B = kadar larutan (ml)
27
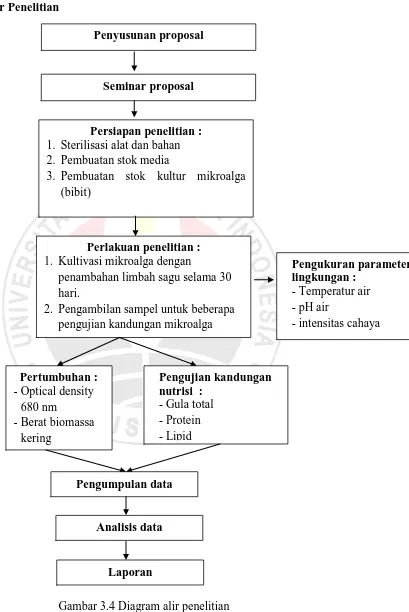
[image:31.595.154.563.114.726.2]G. Alur Penelitian
Gambar 3.4 Diagram alir penelitian Seminar proposal
Persiapan penelitian : 1. Sterilisasi alat dan bahan 2. Pembuatan stok media
3. Pembuatan stok kultur mikroalga (bibit)
Penyusunan proposal
Perlakuan penelitian : 1. Kultivasi mikroalga dengan
penambahan limbah sagu selama 30 hari.
2. Pengambilan sampel untuk beberapa pengujian kandungan mikroalga
Pengukuran parameter lingkungan :
-Temperatur air -pH air
-intensitas cahaya
Pertumbuhan : -Optical density
680 nm
-Berat biomassa kering
Pengujian kandungan nutrisi :
-Gula total -Protein -Lipid
Pengumpulan data
Analisis data
28
H. Analisis Data
Data hasil pengamatan dianalisis dengan menggunakan analisis statistik. data
dianalisis menggunakan ANAVA. Untuk mengetahui beda nyata di antara
perlakuan menggunakan uji Duncans Multiple Range Test (DMRT) pada taraf uji
5%. Anava yang digunakan merupakan two-way ANOVA karena penelitian ini
terdiri dari beberapa variabel bebas.
Data pertumbuhan ketiga isolat yang ditumbuhkan dengan beberapa
konsentrasi ampas sagu (kontrol, 50 ppm, 500 ppm dan 5000 ppm) pada medium
pertumbuhan dilakukan pengukuran dengan dua kali pengulangan sehingga
terdapat sebanyak 56 unit data penelitian. Sedangkan kandungan nutrisi
(karbohidrat, protein dan lipid) pada masing-masing isolat terdiri dari 168 unit
1
BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
Kesimpulan yang didapat dari penelitian ini adalah:
1. Konsentrasi limbah terbaik yang dapat dimanfaatkan oleh isolat mikroalga
dalam pertumbuhan dan menghasilkan nutrisi (karbohidrat, protein dan lipid)
berbeda.
2. Ampas sagu pada konsentrasi tertentu dapat meningkatkan pertumbuhan
ketiga isolat
3. Penambahan ampas sagu dapat menambah jumlah dan biomassa sel
4. Kandungan karbohidrat, protein, dan lipid pada isolat LIPI-11A1+500 ppm
limbah berturut-turut yaitu 75,342 ppm, 6,646 ppm dan 8,23%
5. Kandungan karbohidrat, protein, dan lipid pada isolat LIPI-11A2+5000 ppm
limbah berturut-turut yaitu 261,09 ppm, 5,12 ppm, dan 3,61%
6. Kandungan karbohidrat, protein, dan lipid pada isolat LIPI-11A8+5000 ppm
limbah berturut-turut yaitu 436,81 ppm, 5,52 ppm, dan 7,34%.
7. Isolat yang memiliki kandungan karbohidrat tertinggi yaitu isolat
LIPI-11A8, protein tertinggi yaitu isolat LIPI-11A1 dan lipid tertinggi pada isolat
LIPI-11A2.
B. Saran
Berdasarkan hasil penelitian dan kesimpulan di atas, terdapat saran untuk
lebih mengembangkan pengetahuan dan menambah informasi yang lebih banyak
mengenai penelitian yang terkait, yaitu:
1. Ampas limbah sagu yang siap digunakan (sudah dipretreatmen) sebaiknya
2
3. Perlu dilakukan penelitian dengan tujuan skrining mikroalga yang berpotensi
sebagai penghasil biomassa, karbohidrat, protein dan lipid yang tinggi
4. Perlu dilakukan penelitian proses rekayasa untuk produksi biomassa,
karbohidrat, protein dan lipid yang lebih tinggi.
5. Perlu dilakukan penelitian lanjutan mengenai kandungan zat toksik pada
ketiga isolat bila pemanfaatan utamanya adalah untuk pakan atau suplemen
DAFTAR PUSTAKA
Akmar, P.F dan Kennedy, J.F. 2001. The potential of oil and sago palm trunk wastes as carbohydrate resource. Wood Sci and Technol. 35: 467-473.
Aziz, S.A. Adeni, D.S.A. Bujang, K. Hassan, M.A. 2009. Bioconversion of sago residue into value added products. African Journal of Biotechnology vol. 9 (14), pp. 2016-2021
Barsanti, L. and Gualtieri, P. (2006). Algae: Anatomy, Biochemistry, and
Biotechnology. USA: CRC Press
Bashan, Y. Luz, E. Escalante, F.M.E. Garcia, O.P. 2010. Heterotrophic culture of microalgae: Metabolism and potential products. Review. Water Research 45 (2011) 11-36
Bellinger, E. G. and Sigee, D. C. (2010). Freshwater Algae. UK: Wiley-Blackwell
Bligh, E.G. Dyer, W.J. 1959. A rapid method for total lipid extraction and purification. Journal Biochemical of Physiology. 37 : 911-917
Brennan, L. Owende, P. 2010. Biofuels from Microalgae – A Review of Technologies for Production, Processing, and Extractions of Biofuels and Co-products. In: Renewable and Sustainable Energy Reviews 14/2 (2010), pp. 557–577
Bumbak, F. Cook, S. Zachleder, V. Hauser, S. Kovar, K. 2011. Best practices in heterotrophic high-cell-density microalgal processes: achievements, potential and possible limitations. Applied of Microbiology and
Biotechnol (2011) 91:31–46
65
Chisti, Y. 2007. Biodiesel From Microalgae. Biotechnology Advances (25). 294-306
Danquah, M.K. Harun, R. Singh, M. Forde, G.M., 2009. Bioprocess engineering of microalgae to produce a variety of consumer products. Renewable and
Sustainable Energy Reviews 14 (2010) 1037–1047
Das, P. (2010). Development of Microalgal Biomass for Biodiesel Production. Tesis Master pada National University of Singapore
Endrawati, H. Widianingsih. Manullang, C. 2012. Densitas dan Kandungan Total Lipid Mikroalga Spirulina platensis yang Dikultur pada Tingkatan Perbedaan Fotoperiod. Journal of Marine Research. 1 : 24-28
Food and Agriculture Organization of the United Nation. (1996). Manual On
Production and Use of live food for aquaculture. Rome: FAO
Frac, M. Tys, S.J. Tys, J. 2010. Microalgae for biofuels production and environmental applications: A review. African Journal of Biotechnology . 9, (54), 9227-9236
Garcia, G. Camacho F.G. Miron, A.S. Sevilla, J.M.F. Chisti, Y. Grima, E.M. 2005. Mixotrophic Production of Marine Microalga Phaeodactylum tricornutum. Journal Of Microbiology and Biotechnology. 16 (5) 689-694
Hallenbeck, P.C. (2012). Hydrogen Production By Cyanobacteria. Département de microbiologie et immunologie , Université de Montréal, CP 6128, Succursale Centre-ville , Montréal , Québec H3C 3J7 : Canada
Hermiati, E. Mangunwidjaja, D. Sunati, C.T. Suparno, O. Prasetya, B. 2010. Pemanfaatan Biomassa Lignoselulosa Ampas Tebu untuk Produksi Bioetanol. Jurnal Litbang Pertanian, 29(4), 2010
Ip, Pf. Chen, F. 2005. Production of astaxanthin by the green microalgae Chlorella zofingiensis in the dark. Process Biochemistry 40: 733-738
66
Kawaroe, M. Prartono, T. Wulan, D. Augustine, D. 2010. Fatty Acid Content of Indonesian Aquatic Microalgae. HAYATI Journal of Biosciences. Vol. 17 196-200
Kennedy, J.F, Akmar, P.F. 2001. The Potential of Oil and Sago Trunk Wastes as Carbohydrate Resources. Wood Science and Technology 35 (2001) 467-473
Kiat LJ. 2006. Preparation and characterization of carboxymethyl sago waste and its hydrogel [tesis]. Malaysia: Universiti Putra Malaysia
Kong, W. Xia, C. Song, H. Cao, Y. Yang, H.Hua, S. 2011. The characteristics of
biomass production, lipid accumulation and chlorophyll biosynthesis of
Chlorella vulgaris under mixotrophic cultivation. African Journal of Biotechnology. 10(55), 11620-11630
Kumoro, A.C. Ngoh, G.C. Hasan, M. Ong, C.H. Teoh, E.C. 2008. Conversion of Fibrous Sago (Metroxylon Sagu) Waste into Fermentable Sugar via Acid and Enzymatic Hydrolysis. Asian Journal Scientific Res. 1: 412-420
Larsdotter, K. 2006. Wastewater Treatment With Microalgae – A Literature review. 62: 31-38
Lee, Y.K. (2004) Algal nutrition: heterotrophic carbon nutrition. In: Richmond A (ed) Handbook of microalgal culture: Biotechnology and Applied
Phycology. Blackwell, Oxford, pp 116–124
Liang, y. Sarkany, N. Cui, Y. 2009. Biomass and lipid productivities of Chlorella
vulgaris under autotrophic, heterotrophic, and mixotrophic growth
condition. Biotechnology Lett (31). 1043-1049
Mata, T.M. Martins, A.A. Caetano, N.S. 2009. Microalgae for biodiesel
production and other applications: A review. Renewable and Sustainable
Energy Reviews 14 (2010), 217–232
Narasimhan, A.M. 2010. Microalgal Bioremediation Of Nutrients In Wastewater
And Carbon Dioxide In Flue Gas. Thesis master pada Missouri University
67
Nazir, M. 2003. Metode Penelitian. Jakarta : Ghalia Indonesia
Patil, V. Kallqvist, T. Olsen, E. Vogt, G. Gislerod, H.R. 2007. Fatty acid composition of 12 microalgae for possible use in aquaculture feed. Aquaculture. 15: 1-9
Prasanna, R. Ngangkham, M. Ratha, K.S. Saxena, A.K. Dhar, D.W. Sarika, C. Prasad, R.B.N. 2012. Biochemical modulation of growth, lipid quality andproductivity in mixotrophic cultures of Chlorella sorokiniana.
SpringerPlus (2012), 1: 3
Roberts, M. 2009. Screening and selection of a cyanobacteria for production of
poly-β-hydroxybutyrate in a closed photobioreactor. Thesis master pada
university of Adelaide
Rocha, J.M.S. Garcia, J.E.C. Henriques, M.H.F. 2003. Growth aspects of the marine microalga Nannochloropsis gaditana. Biomolecular Engineering 20, 237-242
Rocha. M.J.F. Chojnacka, K. 2004. Kinetic and Stoichiometric Relationship of the Energy and carbon Metabolism in the Culture of Microalgae.
Biotechnology 3: 21-34
Shimizu, K. Hua, Q. Yang, C. 2000. Energetics and carbon metabolism during growth of mikroalgal cell under photoautotrophic, mixotrophic and cylic light-autotrophic/dark-heterotrophic condition. Biochemical Engineering
journal 6 : 87-102
Singh, M. Bhatnagar, A. Chinnasamy, S. Das, K.C. 2010. Renewable biomass production by mixotrophic algae in the presence of various carbon sources and wastewater. Applied Energy (2011), 1016-1016
Singhal RS, Kennedy JF, Gopalakrishnan SM, Kaczmarek Agnieszka, Knill CJ, dan Akmar PF. 2008. Industrial production, processing, and utilization of sago palm-derived products. Carbohydr Polym 72: 1-20.
68
content, and expression levels of three pathway genes in Chlorella sorokiniana. Applied Microbiology and Biotechnology 91:835–84
Wang, Y.H. Ye, J.Y. Mi, H.L. Li, Y.G. Zhang, C.L. 2000. Relationship between the growth of Synechococcus sp. PCC6803 on medium with glucose and the photosynthetic energy transformation. Acta Bot Sinica 42:1122–1125
Widianingsih. Retno, H. Endrawati, H. Yudiati, E. Iriani, V.R. 2011. Pengaruh Pengurangan Konsentrasi nutrient Fosfat dan Nitrat Terhadap Kandungan Lipid Total Nannochloropsis oculata. Ilmu Kelautan. 16: 24-29
Widjaja, A. Chien, C.C. Ju, H.Y. 2009. Study of increasing lipid production from fresh water microalgae Chlorella vulgaris. Journal of the Taiwan Institute
of Chemical Engineers. 40: 13-20
Xu, F. Cong, W. Cai, Z.L. Ouyang, F. 2004. Effects of organic carbon sources on cell growth and eicosapentaenoic acid content of Nannochloropsis sp.
Journal of Applied Phycology. 16:499–50