5
A. Karakteristik TanamanArtemisia annuaL.
Sistematika tanaman Artemisia annua L. menurut Sugiarso (1996) sebagai berikut :
Divisi : Spermatophyta Sub divisi : Angiospermae Kelas : Dicotyledoneae Bangsa : Asterales
Suku : Asteraceae (Compositae) Marga : Artemisia
Jenis :Artemisia annuaL.
Tanaman artemisia termasuk tanaman semusim yang memiliki tinggi 30-100 cm, selain itu memiliki batang tegak, bulat persegi, berwarna hijau kecokelatan. Daun majemuk berbentuk oval, lonjong, tepi bergerigi, pertulangan daun tegas, warna ungu kehijauan, hijau. Bunga majemuk, bunga tandan, terletak di ujung batangnya yang memiliki panjang mencapai 30 cm, kelopak hijau, berbentuk bintang, berlekuk lima, mahkota halus mengelilingi cawan bunga tempat benang sari dan putik, mempunyai diameter 2-3 mm, warna putih gading. Biji berbentuk lanset, kecil dan berwarna cokelat. Akar serabut berwarna putih kekuningan, biasanya bagian daun tanaman Artemisia digunakan sebagai obat demam (anti piretik) dan dapat juga digunakan sebagai obat anti malaria. Kandungan zat aktif yang terdapat pada tanaman Artemisia seperti saponin, flavonoida, polifenol, dan minyak atsiri (Anonim, 1999).
Tanaman artemisia merupakan tanaman perdu yang berasal dari Cina, tanaman ini dapat tumbuh baik pada ketinggian 1000-1500 m dpl, tanah berpasir atau berlempung yang berdrainase baik dengan pH 5,5-8,5 (pH optimum 6-8) dengan curah hujan 700-1000 mm/tahun. Ketersediaan air merupakan hal yang sangat penting untuk artemisia terutama pada umur 1-2 bulan, tanaman ini berasal dari daerah subtropis oleh karena itu apabila ingin dikembangkan pada daerah tropis perlu diperhatikan beberapa hal untuk menunjang pertumbuhannya seperti
adaptasi lingkungan. Biasanya artemisia ini tumbuh liar di kebun atau di hutan-hutan (Gusmaini dan Nurhayati, 2007).
Pada tahun 1972 senyawa aktifnya sudah dapat diisolasi dan telah diidentifikasi sebagai senyawa sesquiterpen endoperoksida yang biasanya disebut dengan Artemisinin atau Qinghaosu, senyawa tersebut merupakan senyawa aktif dari tanamanArtemisia annuaL. dan juga ada pada beberapa jenis genus tanaman artemisia lainnya (Tang-HQ et al., 2000). Daun artemisia mengandung sekitar 89% dari total Artemisinin yang terkandung pada tanaman tersebar di 1/3 daun bagian atas (41,7%), 1/3 bagian tengah (25%), dan 1/3 bagian bawah (22,2%) (Kardinan, 2008).
Bahan aktif Artemisinindidapatkan dari hasil dari proses metabolik sekunder yang tergolong dalam bahan aktif terpenoid khususnya triterpen, pembentukan bahan aktif ini dipengaruhi oleh proses pembentukan metabolik primer. Pada proses metabolik sekunder akan terbentuk prekursor yang disebut dengan farnesyl pyrophosphate (FPP) yang merupakan pusat molekul di dalam metabolisme tanaman dan berperan sebagai prekusor langsung dari sesquiterpen yang umumnya disintesis langsung didalam sitoplasma dari FPP dan triterpen yang dihubungkan dengan biosintesis monoterpen dan tetraterpen (Gusmaini dan Nurhayati, 2007).
Minyak atsiri yang dihasilkan oleh artemisia dapat menghambat dengan baik pertumbuhan bakteri gram positif Enterococcus, kandungan yang terdapat dalam minyak atsiri yaitu camphor (44%), germacrene D (16%), trans-pinocarveol (11%), beta-selinene (9%), beta-caryophyllene (9%) dan artemisia kartone (3%) (Juteauet al., 2002). Artemisinin merupakan senyawa zat anti malaria yang tidak memiliki efek samping, zat aktif ini dipilih sebagai obat anti malaria karena aktifitasnya dapat melawan strain yang resisten dari Plasmodium falciparum. Bagian yang aktif dariArtemisininadanya jembatan peroksida dengan katalis iron yang merubah sebagian senyawa menjadi senyawa radikal bebas yang elektrofilik. Selanjutnya senyawa tersebut mengasilasi protein yang ada pada parasit tetapi tidak pada host, oleh karena itu jembatan peroksida merupakan aktifitas utama sehingga disintesis beberapa senyawa berdasarkan strukturArtemisinin. Selain itu diketahui pada artemisia bahwa ada mikroba endofit yang membentuk koloni
dalam jaringan didaerah batang hingga akar, dari hasil identifikasi mikroba tersebut yaitu Bacillus polymixa (Simanjuntaket al., 2004).
B. Perbanyakan SecaraIn vitro
Seiring waktu kebutuhan bibit semakin meningkat, dikarenakan usaha dibidang pertanian semakin meningkat. Perbanyakan secara konvensional sangat sulit memenuhi kebutuhan bibit yang sangat banyak untuk itu perlu melakukan perbanyakan secara kultur jaringan, karena dengan metode kultur jaringan ini atau in vitro dapat memenuhi kebutuhan bibit dengan waktu relatif cepat dan tanaman dapat dieksploitasi secara luas (Mariska, 2002). Bioteknologi dapat menjadi alternatif penyediaan kebutuhan bibit, dengan menggunakan teknik tersebut antara lain sangat bergantung pada keberhasilan sistem regenerasi tanaman melalui teknik kultur jaringan. Metodein vitrotanaman dapat dilakukan dengan dua cara yaitu dengan organogenesis dan embriogenesis somatik (Litz dan Gray, 1995).
Bioteknologi kultur jaringan merupakan teknologi yang dapat dimanfaatkan untuk pelestarian plasma nutfah khususnya pada tanaman obat. Penerapan metode in vitro dilakukan dengan beberapa cara yaitu penyimpanan dalam keadaan tumbuh (jangka pendek), penyimpanan pertumbuhan minimal (jangka pendek menengah) dan penyimpanan dengan pembekuan (jangka panjang). Penyimpanan yang dilakukan dalam keadaan tumbuh adalah cara pemeliharaan dengan melakukan pemindahan tanaman (subkultur) yang dilakukan secara rutin pada media yang sama agar tanaman tetap hidup dan hal ini juga dilakukan ketika tanaman mengalami kontaminasi bakteri atau jamur pada medianya. Untuk menghindari terjadinya mutasi dan menjaga viabilitas tanaman maka zat pengatur tumbuh yang digunakan seminimal mungkin. Ketiga teknik penyimpanan tersebut diupayakan penyimpanan dengan pertumbuhan sederhana dan pertumbuhan minimal dengan menggunakan media tumbuh yang sesuai, umunya menggunakan media dasar MS dengan penambahan Benzil Adenin untuk penyimpanan sederhana dan penyimpanan minimal menggunakan paclobutrazol, manitol ABA dan pengurangan unsur makro mikronya (Irawati, 1990).
Tumbuhan yang memiliki sifat totipotency yaitu tanaman yang perkembangbiakannya tidak hanya dari sel telur atau sperma akan tetapi berasal
dari sel-sel akar, daun, batang dan sel tumbuhan lainnya. Apabila perbanyakan dengan menggunakan sel yang berasal dari tumbuhan maka badan tumbuhan keseluruhannya dapat ditumbuhkan kembali, dengan adanya teknik seperti itu maka telah dikenal kultur jaringan atau metode lain seperti cangkok, stek okulasi sehingga dapat dilakukan perbanyakan klon tumbuhan tanpa batas (Radji, 2005).
Media dasar MS paling banyak digunakan untuk perbanyakan berbagai jenis tanaman, karena pada media MS memiliki kandungan hara makro paling tinggi terutama kandungan N. Nutrisi mineral dapat dibagi menjadi tiga yaitu garam mineral nutrisi makro, garam mineral nutrisi mikro dan sumber besi. Garam-garam nutrisi makro dibutuhkan dalam jumlah relatif besar dan jumlah yang dibutuhkan untuk setiap 1 liter media cukup besar sehingga dapat dtimbang dengan cukup teliti dengan menggunakan alat timbangan miligram (Wetherel, 1982).
Cahaya dalam kultur jaringan juga perlu diperhatikan hal ini dilakukan untuk mengatur proses-proses morfogenetik tertentu seperti pembentukan pucuk dan akar, intensitas cahaya optimal yang dibutuhkan oleh berbagai kultur organ dan kultur jaringan berbeda tergantung dari taraf perkembangan dan pertumbuhan in vitro(George dan Sherrington, 1984).
C. Induksi Kalus dan Multiplikasi Tunas
Pada tanaman obat induksi kalus salah satu langkah awal untuk mentukan produksi metabolit sekunder, pengujian ini penting untuk menentukan jenis eksplan yang digunakan, kandungan metabolit sekunder, sifat kalus untuk dikembangkan dalam kultur suspensi sehingga dapat menghasilkan produk yang tinggi dalam skala yang besar (Mahadi, 2008). Perbanyakan kultur jaringan pada tanaman obat lebih cenderung melalui proses pembentukan organogenesis secara tidak langsung, hal ini berkaitan dengan produksi metabolit sekunder karena selalu melibatkan penghasilan agregat-agregat sel yang dikulturkan dalam kultur suspensi sebelum sistem bioreaktor, sehingga kebanyakan sasaran awal adalah untuk mendapatkan kalus (Maharajanet al., 2010).
Kalus merupakan proliferasi massa sel yang belum terdiferensiasi dan terdiri dari sel yang tak beraturan, kultur kalus yaitu sekumpulan sel yang tidak
terorganisir yang berasal dari berbagai jaringan tumbuhan (Rohmah, 2007). Kultur kalus digunakan untuk mendapatkan kalus dari eksplan yang diisolasi dan ditumbuhkan dalam lingkungan terkendali atau steril, pembentukan kalus sendiri adalah menginduksi dari bagian tanaman tertentu dengan memberikan zat pengatur tumbuh (Budiyati, 2002).
Induksi kalus diawali dengan penebalan eksplan pada bagian potongan dan didaerah yang dilakukan pelukaan, penebalan tersebut terjadi karena interaksi eksplan dengan media tumbuh, zat pengatur dan lingkungan tumbuh sehingga eksplan menjadi semakin besar. Biasanya pembekakan pada bagian yang dilukai akan bertambah besar menjadi empat kali lebih besar dari ukuran semula, hal ini terjadi pada tanaman saw palmetto yang sudah dikulturkan selama 2 minggu (Meagher dan Green, 2002).
Pembentukan kalus dari eksplan secara dasar dapat dibagi menjadi tiga yaitu tahap perkembangan induksi, pembelahan sel dan diferensiasi. Selama inisiasi induksi fase metabolisme distimulasi lebih dahulu untuk aktivitas mitosis. Lama fase ini bergantung pada kondisi fisiologi dari eksplan dan juga kondisi kultur. Selanjutnya, fase pembelahan sel aktif, sel-sel eksplan kembali pada tahap meristematik. Fase ketiga meliputi penampilan dari diferensiasi sel dan ekspresi dari metabolik khusus yang penting pada pembentukan produk (metabolit) sekunder (Dodds dan Roberts, 1995).
Keberhasilan dalam menginduksi dan perbanyakan kalus embriogenik harus pula diikuti oleh keberhasilan kalus menjadi planlet, regenerasi tunas dari eksplan kalus merupakan proses kompleks karena hal ini dipengaruhi oleh beberapa faktor seperti faktor genotipe, tipe eksplan, jenis dan taraf zat pengatur tumbuh yang diberikan (auksin dan sitokinin) serta kondisi fisiologi kalus (Gaba, 2005). Kalus yang baru terbentuk akan lebih mudah menghasilkan tunas lebih tinggi dibandingkan dengan kalus yang telah dilakukan subkultur berkali-kali atau mengalami periode kultur yang panjang, hal ini terjadi karena kalus yang baru terbentuk memiliki kandungan poliamin atau senyawa yang berperan dalam sistem regenerasi masih tinggi (Chiatanteet al., 1998; Biswaset al., 2002).
Selain dengan induksi kalus, perbanyakan tanaman secara in vitro juga dilakukan dengan multiplikasi tunas atau penggandaan tanaman. Dengan lamanya
periode kultur akan menurunkan daya tumbuh biakan yang dikulturkan, maka perlu dilakukan upaya untuk memaksimalkan kembali pertumbuhan kultur. Penggunaan zat pengatur tumbuh sitokinin seperti BA (Benzyl Adenin) dan TDZ (Thidiazuron) yang biasanya digunakan untuk menstimulasi pembelahan sel dan multiplikasi tunas. Kombinasi zat pengatur tumbuh BA dengan TDZ dapat meningkatkan jumlah tunas yang terbentuk sekitar satu bulan, konsentrasi TDZ 0,05 mg/l-0,15 mg/l dikombinasikan kedalam media yang berisi BA 0,1 mg/l hasilnya dapat meningkatkan jumah tunas dibandingkan dengan perlakuan kontrol. Hal ini menunjukkan bahwa multiplikasi tunas didapat dari adanya sinergisme antara kedua jenis zat pengatur tumbuh sitokinin yang berbeda, thidiazuron merupakan kelompok sitokinin yang berfungsi dalam menginduksi sel dan poliferasi tunas. Dengan penggunaan dua jenis sitokinin yang berbeda dapat meningkatkan jumah tunas dibandingkan dengan menggunakan satu jenis sitokinin saja (Syahid dan Kristina, 2008).
Prosedur multiplikasi tunas lebih sederhana dan kemungkinan terjadi keragaman somaklonal lebih rendah dibandingkan dengan organogenesis dan embriogenesis karena digunakan eksplan yang sudah terdiferensiasi, selain penggunaan zat pengatur tumbuh sitokinin biasanya untuk multiplikasi tunas dilakukan dengan penambahan auksin. Sivaram dan Mukundan (2003) menggunakan ujung tunas sebagai sumber eksplan dan mendapatkan 11,2 tunas per eksplan pada penambahan BA 2 mg/l + IAA 1 mg/l. Respon tumbuh in vitro pada tahap mutliplikasi berbeda untuk setiap tanaman, untuk beberapa spesies tertentu pada tanaman obat seperti jahe, kunyit, temu hitam dan kencur mampu menghasilkan akar lengkap pada media multiplikasi sehingga tidak perlu perlakuan induksi akar (Kristinaet al., 2010).
D. Peranan Zat Pengatur Tumbuh
Pertumbuhan dan morfogenesis in vitro dipengaruhi oleh adanya interaksi dan keseimbangan antara zat pengatur tumbuh yang ditambahkan pada media tanam (George dan Sherrington, 1984). Kombinasi zat pengatur tumbuh yang ditambahkan dalam media merupakan faktor utama penentu keberhasilan kultur jaringan, zat pengatur tumbuh yang sering digunakan untuk menginduksi kalus yaitu auksin. Diantara golongan auksin yang sering digunakan biasanya 2,4-D,
dikarenakan 2,4-D memiliki sifat lebih stabil yang tidak mudah terurai oleh enzim-enzim yang dikeluarkan oleh sel tanaman atau proses pemanasan akibat sterilisasi (Hendrayono dan Wijayanti. 1994).
Pemberian zat pengatur tumbuh dapat mempengaruhi produksi metabilit sekunder pada tanaman obat, hal ini disebabkan zat pengatur tumbuh yang ditambahkan dapat menyebabkan perubahan fisiologi dan biokimia tumbuhan melalui kerja-kerja enzim. Zat pengatur tumbuh berperan dalam pengikatan membran protein yang berpotensi untuk aktivitas enzim, dari hasil pengikatan ini mengaktifkan enzim tersebut dan mengubah susbtrat menjadi beberapa produk baru. Produk baru yang terbentuk ini menyebabkan deretan reaksi sekunder salah satunya adalah pembentukan metabolit sekunder (Wardani dan Setyawan, 2004).
Zat pengatur tumbuh auksin yang umum digunakan adalah NAA (naftalenacetat), IBA (asam indol butirat), 2,4-D (asam 2,4 diklorofenoksi acetat). Auksin dan BAP (benzylaminopurin). Auksin berperan merangsang pembelahan dan pembesaran sel, pembentukan kalus dan akar, besarnya konsentrasi zat pengatur tumbuh bergantung pada macam jaringan yang digunakan sebagai eksplan (Gamborg, 1981).
Penggunaan auksin jenis 2,4-D diketahui dapat memacu pertumbuhan kalus, hal ini ditunjukkan dengan terjadinya pertambahan ukuran dan berat kering kalus yang tidak dapat balik. Pertumbuhan berkaitan dengan pertambahan volume dan jumlah sel, pembentukan protoplasma baru, pertambahan berat dan juga meningkatkan berat keringnya. Bahan kering tersebut terdiri dari bahan-bahan organik dan mineral yang penting untuk pertumbuhan kalus (Rahayuet al., 2003).
Penelitian yang dilakukan oleh Rosyidah et al., (2014) menyebutkan bahwa dengan kombinasi konsentrasi 1 mg/l 2,4-D dan 1 mg/l BAP berpengaruh terhadap waktu induksi kalus daun tanaman melati (Jasminum sabac) secara in vitro, menghasilkan pertumbuhan kalus yang optimal pada hari ke-6. Selain itu, pada induksi kalus daun nyamplung (Calophyllum inophyllum Linn.) didapatkan hasil kalus dengan berat segar yaitu 197,8 mg dari kombinasi 2,4-D 0,5 ppm dan BAP 2 ppm, hal ini dipengaruhi oleh penggunaan kombinasi antara auksin dan sitokinin yang tepat dan sesuai akan mendukung pertumbuhan kalus secara in vitro(Indah dan Ermavitalini, 2013).
Pemberian NAA mampu memacu pertumbuhan kalus pada daun atsiri nilam (Pogostemon cablin), kalus yang dihasilkan secara umum memperlihatkan pertambahan berat 3 kali lipat dari berat kalus awal sebelum dilakukan perlakuan (Trimulyonoet al., 2004). Pemberian auksin dapat meningkatkan tekanan osmotik, meingkatkan sintesis protein, meningkatkan permeabilitas sel terhadap air dan melunakkan dinding sel, sehingga air dapat masuk ke dalam sel disertai kenaikan volume sel (Sriyanti dan Wijayani. 1994). Berdasarkan penelitian yang sudah dilakukan oleh Mahadi et al., (2014) bahwa adanya pengaruh kombinasi antara NAA 3 mg/l dan BAP 1,5 mg/l dapat membentuk planlet hingga 100% dan dapat membentuk kalus dalam waktu 2 hari setelah kultur dengan tekstur kalus remah (friable) dan berwarna putih.
E. Air Kelapa
Air kelapa mengandung hormon auksin dan sitokinin yang kedua hormon tersebut digunakan untuk mendukung pembelahan sel embrio (Lawalata, 2011). Auksin berperan memacu pembentukan kalus, membentuk klorofil dalam kalus, mendorong proses morfogenesis kalus, membentuk akar dan mendorong proses embriogenesis. Sedangkan peran sitokinin berperan memacu pembelahan sel, proliferasi meristem ujung, menghambat pembentukan akar, dan mendorong pembentukan klorofil pada kalus (Surachman, 2011). Air kelapa salah satu sumber alami hormon tumbuh yang dapat digunakan untuk memacu pembelahan sel serta merangsang pertumbuhan tanaman, endosperm cair buah kelapa yang belum matang mengandung senyawa yang dapat memacu sitokinesis (Salisbury dan Ross, 1995).
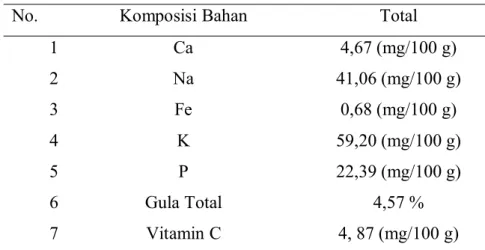
Hasil analisis menunjukkan air kelapa memiliki komposisi unsur hara makro, mikro, gula dan vitamin yang bermanfaat untuk perbanyakan tanaman.
Tabel 1. Komposisi kimia air kelapa
No. Komposisi Bahan Total
1 Ca 4,67 (mg/100 g) 2 Na 41,06 (mg/100 g) 3 Fe 0,68 (mg/100 g) 4 K 59,20 (mg/100 g) 5 P 22,39 (mg/100 g) 6 Gula Total 4,57 % 7 Vitamin C 4, 87 (mg/100 g)
Sumber : Balai Penelitian dan Pengembangan Pascapanen Pertanian (2015) Air kelapa memiliki kandungan kalium cukup tinggi, selain itu juga mengandung vitamin dan mineral (Kristina dan Syahid, 2012). Kandungan hara makro pada air kelapa seperti N, P dan K serta beberapa unsur mikro yang ada pada air kelapa dapat berpeluang dikembangkan lebih lanjut sebagai upaya subsitusi unsur hara makro dan mikro serta sumber karbo seperti sukrosa (Indriani, 2014). Air kelapa merupakan senyawa organik yang sering digunakan untuk aplikasi teknik in vitro, karena air kelapa mengandung 1,3 diphenulurea, zeatin, zeatin gluoksida, dan zeatin ribosida (Arminiet al., 1992). Pada tanaman anggrek (Phalaenopsis ambilis BL.) dengan diberikannya perlakuan tunggal pada konsentrasi 250 ml/L mampu menghasilkan daun dan akar lebih cepat melalui perbanyakan secarain vitro(Beyet al., 2006).
Pada perbanyakan palem putri pemberian air kelapa mampu meningkatkan pertumbuhan bibit pada dengan konsentrasi 50%, dengan pemberian air kelapa menyebabkan berpengaruh nyata terhadap parameter tinggi tanaman, panjang daun, panjang akar dan berat basah bibit palem putri. Hal ini dikarenakan bahwa air kelapa pada konsentrasi 50% dapat meningkatkan jumlah sitokinin yang optimal, sehingga merangsang pembelahan sel (Sujarwatiet al., 2011).
F. Kerangka Berpikir
G. Hipotesis
1. Adanya interaksi antara auksin dan air kelapa terhadap induksi kalus dan multiplikasi tunas tanaman artemisia secarain vitro.
2. Adanya perlakuan paling tepat diantara auksin dan air kelapa untuk menginduksi kalus dan multiplikasi tunas tanaman artemisia secarain vitro. 3. Adanya konsentrasi paling tepat diantara auksin dan air kelapa untuk
menginduksi kalus dan multiplikasi tunas tanaman artemisia secarain vitro. PerbanyakanIn vitro
Artemisia annuaL.
Tanaman obat sebagai alternatif penghasil bahan
Artimisininanti malaria
Kombinasi Auksin dan Air Kelapa Plasmodium falciparum
resisten terhadap tanaman kina
Memacu induksi kalus dan multiplikasi tunas Artemisia annuaL.