PERHITUNGAN KESETIMBANGAN UAP - CAIR
1. Model Persamaan Kesetimbangan Uap-Cair (VLE) Sederhana
Ketika termodinamika diterapkan untuk kesetimbangan uap-cair, tujuannya adalah
menemukan temperature, tekanan, dan komposisi fasa dalam kesetimbangan
dengan perhitungan. Sesungguhnya, termodinamika menyediakan ruang lingkup
kerja matematis untuk hubungan sistematis, ekstensi, generalisasi, avaluasi, dan
interpretasi data. Lebih dari itu, ini berarti dengan prediksi berbagai teori fisika
molekular dan mekanik statistik dapat diterapkan untuk tujuan praktis. Tak satupun
ini dapat diselesaikan tanpa model untuk prilaku sistem dalam kesetimbangan
uap-cair. Dua model yang paling sederhana adalah Hukum Raoult dan Hukum Henry.
Hukum Raoult
Dua asumsi utama yang diperlukan untuk mereduksi perhitungan VLE terhadap
hukum Raoult adalah:
Fasa uap adalah gas ideal
Fasa cair adalah larutan ideal
Asumsi pertama berarti bahwa hukum Raoult dapat diterapkan untuk tekanan
rendah sampai menengah. Penerapan kedua bahwa ini memiliki perkiraan validitas
hanya ketika komponen yang menyusun sistem sama secara kimia. Hanya saja
sebagai gas ideal yang menjalani prilaku seperti prilaku gas nyata pada keadaan
standar yang dapat diperbandingkan, larutan ideal merepresentasikan prilaku
menuju prilaku larutan nyata yang dapat diperbandingkan. Prilaku larutan ideal
sering diperkirakan dengan fasa cair dimana spesies/komponen molekular tidak
Tujuan Instruksional Khusus
:
1. Mahasiswa dapat menjelaskan prinsip-prisip dasar kesetimbangan fasa
uap-cair, aturan fasa dan prilaku kesetimbangan
2. Mahasiswa dapat menggunakan hukum Rault dan hukum Henry dalam
perhitungan titik gelembung dan titik embun
3. Mahasiswa dapat membuat kurva kesetimbangan dua fase sistem biner
dengan hubungan hukum Roult
4. Mahasisiwa dapat menggunkan hubungan nilia K dalam perhitungan
titik gelembung dan titik embun serta perhitungan kilat
terlalu berbeda dalam ukuran dan sifat kimianya sama. Oleh Karena itu, campuran
isomer, seperti
orto
-,
meta
-, dan
para-xylena
, sangat memenuhi terhadap prilaku
larutan ideal. Begitu juga campuran anggota deret homolog seperti,
n-heksan/n-heptan, etanol/propanol, dan benzene/toluen. Contoh lain adalah aseton/asetonitril
dan asetonitril/nitrometan.
Ekspresi matematis yang merefleksikan dua daftar asumsi dan memberi
ekspresi kuantitatif terhadap hukum Raoult adalah:
(1)
dimana
x
i adalah mol fraksi fase cair,
y
iadalah mol fraksi fase uap dan
P
isatadalah
tekanan uap murni spesies
i
pada temperature sistem. Produk
y
iP
pada sisi kiri (1)
dkenal
sebagai tekanan parsial
spesies
i
.
Model sederhana untuk VLE persamaan (1) menyediakan deskripsi realistis
prilaku aktual untuk kelas sistem yang relatif kecil. Namun demikian, ini berguna
untuk menampilkan sistem yang lebih kompleks.
Batasan hukum Raoult adalah bahwa ini dapat diterapkan hanya terhadap spesies
untuk yang tekanan uapnya diketahui dan ini memerlukan bahwa spesies adalah
subkritikal
, yaitu temperature aplikasi di bawah temperature kritis spesies.
Penampakan penting dan berguna hukum Rault adalah bahwa hal ini valid
untuk beberapa spesies yang ada pada kesatuan pendekatan mol fraksi,
menyediakan hanya bahwa fasa gas adalah gas ideal.
Perhitungan
Dewpoint
dan
Bubblepoint
dengan Hukum Raoult
Walaupun masalah VLE dengan kombinasi variabel lain memungkinkan,
ketertarikan teknik memusatkan pada perhitungan titik embun (
dewpoint
) dan titik
gelembung (
bubblepoint
); terdapat empat jenis:
BULP P
;
Menghitung {
y
i}dan
P
, diberikan {
x
i} dan
T
DEW P
;
Menghitung {
x
i}dan
P
, diberikan {
y
i} dan
T
BULP T
;
Menghitung {
y
i}dan
P
, diberikan {
x
i} dan
P
DEW T
;
Menghitung {
x
i}dan
P
, diberikan {
y
i} dan
P
sat i i iP xP
Dalam setiap kasus nama menyarankan kuantitas yang dihitung: salah satu dari
komposisi
BUBL
(uap) atau
DEW
(cair) dan salah satu dari
P
atau
T
. Oleh karena itu
harus tertentu salah satu dari komposisi fasa cair atau fasa uap dan salah satu
T
atau
P
, karena itu penetapan
1 +
(
N – 1
) atau
N
variabel aturan fasa, secara pasti
jumlah derajat bebas
F
dibutuhkan oleh aturan fasa untuk kesetimbangan uap-cair.
Persamaan untuk larutan kuat masalah VLE memiliki fungsionalitas kompleks, dan
kegunaannya untuk menentukan titik gelembung dan titik embun memerlukan
perhitungan iterasi yang kompleks. Pada seksi ini perhitungan dibuat untuk kondisi
dimana penyederhanaan asumsi berlaku. Prosedur umum untuk menyelesaikan
masalah VLE menjadi jelas melalui perhitungan yang relative sederhana. Pertama
kita memfokuskan kepada aplikasi hokum Rault.
Fraksi-fraksi mol dalam tiap fasa berjumlah satu. Karena untuk fasa uap
ii
y
= 1,
persamaan (1) dapat dijumlahkan seluruh spesies menghasilkan:
(2)
Persamaan ini menemukan aplikasi dalam perhitungan
titik gelembung
, dimana
komposisi fasa uap tidak diketahui. Untuk sistem biner dengan
x
2= 1 – x
1,
1
sat 2 1 sat 1x
P
1
-x
P
P
dan plot
P
vs
x
1pada temperature konstan adalah garis lurus yang menghubungkan
pada
x
1= 0 dengan
pada
x
1= 1.
Pers. (1) juga dapat diselesaikan untuk
x
idan menjumlahkan semua spesies .
dengan
ii
x
=1, menghasilkan:
(3)
persamaan tersebut berlaku dalam perhitungan
titik embun
, dimana komposisi fase
cair tidak diketahui.
sat i i i
P
x
P
2 sat 2 1 sat 1x
P
x
P
P
1 sat 2 sat 1 sat 2P
P
x
P
P
sat 2P
P
1sat
i sat i iP
y
1
P
Contoh 1.Sistem biner asetonitril (1)/nitrometana (2) memenuhi hokum Raoult.
Tekanan uap untuk spesies murni diberikan dengan persamaan Antoine berikut:
224
47
,
945
.
2
2724
,
14
ln
C
t
/kPa
P
o sat 1209
47
,
972
.
2
2043
,
14
ln
C
t
/kPa
P
o sat 2(a) Siapkan grafik yang menunjukkanPvsx1danPvsy1untuk temperature 75oC (b) Siapkan grafik yang menunjukkantvsx1dantvsyiuntuk tekanan 70 kPa.
Penyelesaian
(a) Untuk memperoleh hubungan P vs xi diperlukan perhitungan BUBL P. dasarnya adalah bentuk persamaan sistem biner dimana:
1 sat 2 sat 1 sat 2P
P
x
P
P
(A)Pada temperature 75oC, dengan persamaan Antoine diperoleh sat
1
P
= 83,21 kPa danP
2sat= 41,98 kPaPerhitungannya sederhana, kita misalkanx1= 0,6 ; maka nilaiP:
P= 41,98 + (83,21 – 41,98) (0,6) = 66,72 kPa nilaiy1dicari dengan hubungan per.10.1:
=
72
,
66
21
,
83
6
,
0
= 0,7483Hasil ini berarti bahwa pada temperature 75oC campuran cairan 60%mol asetonitril dan 40%
mol nitrimetana adalah dalam kesetimbangan dengan uap yang mengandung 74,83% mol asetonitril pada tekanan 66,72 kPa. Hasil perhitungan untuk 75oC pada sejumlah nila x1
ditabulasikan berikut: x1 y1 p/kPa x1 y1 P/kPa 0,0 0,2 0,4 0,0000 0,3313 0,5692 41,98 50,23 58,47 0,6 0,8 1,0 0,7483 0,8880 1,0000 66,72 74,96 83,21
Hasil yang sama juga ditunjukkan dengan diagram P-x1-y1 Gambar 1. Gambar ini adalah diagram fasa yang mana garis lurus ditandaiP-x1 merepresentasikan keadaan cairan jenuh (saturated liquid); daerah cairansubcoolid(subcoolid liquid) terletak di atas garis ini. Kurva yang ditandaiP-y1merepresentasikan keadaan uap jenuh (saturated vapor); daerah uap superjenuh
P
P
x
y
sat 1 1 1
kesetimbangan. Garis P-x1danP-y1bertemu pada tepi/ujung diagram, dimana cairan jenuh dan uap jenuh spesies murni berada dalam tekanan uap dan
P
2sat.Untuk mengilustrasikan sifat prilaku fasa dalam system biner ini kita mengikuti kursus proses temperature konstan pada diagram P-x1-y1. Bayangkan campuran cairan subcooled 60%mol asetonitril dan 40% nitrometana berada dalam susunan piston pada 75oC.
Keadannya direpresentasikan dengan titikapada gambar 1. Penganbilan piston secara cukup pelan menurunkan tekanan sementara penjagaan sistem pada kesetimbangan pada 75oC.
Karena sistem tertutup, komposisi keseluruhan tetap konstan selama proses, dan keadaan sistem sebagai keseluruhan jatuh pada garis vertikal yang menurun dari titik a. Ketika tekanan mencapai nilai pada titik b, sistem adalah cairan jenuh pada ambang penguapan. Penurunan tekanan yang amat kecil menghasilkan gelembung uap yang direpresentasikan oleh titik b’. Dua titik b dan b’ (x1 = 0,6, P = 66,72 kPa, dan y1 = 0,7483) bersama-sama merepresentasikan keadaan yang ditentukan dengan perhitungan terdahulu. Titik badalah titik gelembung, dan garis P-x1adalah garis titik gelembung.
Sebagaimana tekanan diturunkan, jumlah uap meningkat dan jumlah cairan menurun, dengan kadaan dua fasa mengikuti jalur b’cdan bc’. Garis putus-putus dari titikbke titikc
merepresentasikan keadaan keluruhan sistem dua fasa. Akhirnya, sebagaimana titik c
didekati, fasa cairan, direpresentasikan titikc’, hampir tidak terlihat, dengan hanya tetesan (dew) yang tertinggal. Titik cadalah titik embun, dan kurva P-y1 adalah garis titik embun. Sekali lagi embun telah teruapkan, hanya uap jenuh pada titikcyang tertingggal, penurunan tekanan berikutnya menghasilkn uap superjenuh pada titikd.
Komposisi uap pada titikcadalahy1= 0,6, namun komposisi cairan pada titikc’dan tekanan harus dibaca dari grafik atau dihitung.
Berikut ini adalah perhitunganDEW P, dan pers. 10.3,
sat 2 2 sat 1 1
P
y
P
y
1
P
untuky1= 0,6 dant= 75oC,98
,
41
4
,
0
21
,
83
6
,
0
1
P
= 59,74 kPa dengan persamaan 10.1 =
21
,
83
74
,
59
6
,
0
= 0,4308 ini adalah komposisi cairan pada titikc’.sat 1
P
P
P
y
x
sat 1 1 1
(b) Ketika tekananPditetapkan, temperature berubah sepanjangx1dany1. Untuk tekanan yang diberikan, range temperatur dibatasi oleh temperature dan , temperature yang mana spesies murni mendesak tekanan uap sama dengan P. Untuk system yang ada, temperature ini dihitung dari persamaan Antoine:
untuk P = 70 kPa,
t
1sat = 69,84oC dan sat 2t
= 89,58oC. Cara paling sederhana untukmentiapkan diagramt–x1-y1 adalah memilih nilai t antara kedua temperature, dan evaluasi
x1 dengan pers (A), ditulis
sat 2 sat 1 sat 2 1
P
P
P
P
x
sebagai contoh, pada 78oC, sat 1
P
= 91,76 kPa,P
2sat= 46,84 dan84
,
46
76
,
91
84
,
48
70
1x
= 0,5156 Dengan per. 10.1P
P
x
y
sat 1 1 1
=
70
76
,
91
5156
,
0
= 0,6759hasil perhitungan yang sama untuk P = 70 kPa adalah berikut:
x1 y1 t/oC x1 y1 t/oC 0,0000 0,1424 0,3184 0,0000 0,2401 0,4742 89,58(
t
2sat) 86 82 0,5156 0,7378 1,0000 0,6759 0,7378 1,0000 78 74 69,84 (t
1sat)Gambar (1) adalah diagramt-x1-y1menunjukkan hasil di atas.
Dalam diagram fasa ini digambar untuk tekanan lonstan 70 kPa, kurvat-y1merepresentasikan
keadaan uap jenuh, dengan keadaan uap superjenuh terletak di atasnya. Kurva t-x1 merepresentasikan keadaan cairan jenuh, dengan keadaan cairan subcooled terletak dibawahnya. Daerah dua fasa terletak antara kurva ini.
Dengan referensi Gambar (2) anggaplah proses pemanasan pada tekanan konstan yang dihasilkan dari keadaan cairansubcooledpada titik a menuju keadaan uap superjenuh pada titikd. Jalur yang ditunjukkan pada gambar adalah untuk komposisi konstan keseluruhan 60% mol asetonitril. Temperatur cairan naik sebagai hasil pemanasan dari
sat 1
t
t
2sat i i i sat 1A
ln
P
C
B
t
t =75oC 20 40 60 80 100 0 0,2 0,4 0,6 0,8 1 x1, y1 P /k P a b' c' b a c d P2 sat=41,98 P1 sat=83,21 P-y1 P-x1 cairan subcoolid uap superjenuh
Gambar 1. DiagramPxyuntuk asetronitril (1)/nitrometana (2) pada 75oC
seperti diberikan hukum Raoult
titikake titikb, dimana gelembung uap pertama nampak. Oleh karena itu titikbadalah titik gelembung dan kurvat-x1adalah garis titik gelembung.
P=70 kPa 65 70 75 80 85 90 0 0,2 0,4 0,6 0,8 1 x1, y1 t/ oC b' c' b a c d t2 sat=89,58 t1 sat=89,58 t-y 1 t-x 1 cairan subcoolid uap superjenuh
Gambar 2. Diagramtxyuntuk asetronitril (1)/nitrometana (2) pada 70 kPa seperti diberikan hukum Raoult
Untukx1= 0,6 dan P = 70 kPa,tditentukan dengan perhitunganBUBL T yang memerlukan iterasi. Persamaan (2) ditulis:
2 1 sat 2
x
α
x
P
P
(B)dimana α
P
1satP
2sat . Pengurangan lnP
2satdari lnP
1sat sebagaimana diberikan oleh persamaan Antoin menghasilkan :209
64
,
972
.
2
224
47
,
945
.
2
0681
,
0
ln
t
t
α
(C)Alasan memperkenalkanαadalah bahwa sebagai variable pengontrol ini jauh kurang sensitif terhadap t daripada tekanan uap individual. Nilai awal α ditemukan untuk temperature pertengahan yang berubah-ubah. Iterasi kemudian mengikuti:
Dengan nilai langsungαhitung dengan pers (B). Hitungtdari persamaan Antoine untuk spesies/komponen 2.
209
ln
2043
,
14
64
,
972
.
2
sat 2P
t
Temukan nilai baruαdengan pers. (C)
Kembali ke langkah awal dan iterasi kembali sampai nilai t konvergen (mendekati konstan)
Hasilnya adalaht= 76,42oC, temperature titikbdanb’. Dari persamaan Antoine, = 87,71
kPa, dan dengan persamaan (1) komposisi pada titikb’adalah:
=
70
17
,
87
6
,
0
= 0,7472Penguapan campuran pada tekanan konstan, tidak sepertipenguapan spesies murni, tidak terjadi pada temperature konstan. Sebagaimana proses pemanasan berlanjut diluar titik b, temperature naik, jumlah uap meningkat, dan jumlah cairan menurun. Sepanjang proses ini komposisi fase uap dan fase cair berubah sebagimana didindikasikan dengan jalurb’cdanbc’, sampai titik embun dicapai pada titik c, dimana tetesan cairan tidak nampak. Kurva t-y1 adalah garis titik embun.
Komposisi uap pada titik c adalah y = 0,6 ; karena tekanan juga diketahui (P = 70 kPa), perhitunganDEW Tmemungkinkan. Denganα
P
1satP
2sat persamaan (3) ditulis:
y
y
α
P
P
1sat
1
2Tahap iterasi adalah sebagaimana sebelumnya, namun berdasarkan pada dari pada
sat 2
P
, dengan : sat 2P
sat 1P
P
P
x
y
sat 1 1 1
sat 1P
224
ln
2724
,
14
47
,
945
.
2
sat 1P
t
hasilnya adalaht= 79,58oC, temperetur titikcdanc’. dari pers. Antoine sat 1
P
= 96,53 kPa dan persamaan (1) memberikan komposisi pada titikc’:P
P
y
x
sat 1 1 1
=
53
,
96
70
6
,
0
= 0,4351oleh karena itu tempertur naik dari 76,42 menjadi 79,58oC selama tahap penguapan dari titik
bmenuju titikc. Pemanasan sederhana berlanjut menyuperjenuhkan uap ke titikd.
Hukum Henry
Aplikasi hukum Rault untuk spesies
i
memerlukan nilai
sat iP
pada temperatur
aplikasi, dan oleh karena itu tidak sesuai untuk spesies yang memiliki
temperatur
kritis kurang dari temperatur aplikas
i. Jika suatu sistem udara kontak dengan cairan air
diperkirakan pada kesetimbangan, selanjutnya udara dijenuhkan dengan air. Fraksi
mol uap air dalam udara biasanya ditemukan dari hukum Rault yang diterapkan ke
air dengan asumsi bahwa tidak ada udara yang terlarut dalam fasa cair. Oleh karena
itu, cairan air dianggap murni (
x
2=1) dan hukum Rault untuk air (spesies 2) menjadi
sat 2 2
P
P
y
. Pada 25
oC dan tekanan atmosferik, persamaan ini menghasilkan:
0312
,
0
33
,
101
166
,
3
P
P
y
sat 2 2diamana tekanan dalam satuan kPa dan
sat 2P
dari tabel steam.
Jika kita akan menghitung fraksi mol udara yang terlarut dalam air, hukum
Rault tidak dapat diterapkan,
karena temperatur kritis udara lebih rendah dari 25
oC
.
Permasalahan ini dapat diselesaikan dengan hukum Henry, diterapkan untuk
tekanan cukup rendah yang fasa uapnya dapat diasumsikan sebagai gas ideal.
Untuk spesies yang ada sangat encer dalam fasa cair, hukum Henry kemudian
menyatakan bahwa
tekanan parsial spesies dalam fasa uap adalah perbandingan langsung
terhadap mol fraksi cairannya
. Oleh karena itu;
i iΗ i
P
x
diamana
H
iadalah konstanta Henry. Nilai
H
idiperoleh dari eksperimen, dan pada
Tabel 1 terdaftar nilai pada 25
oC untuk sedikit gas yang terlarut dalam air. Untuk
sistem udara/air pada 25
oC dan tekanan atmosfer, hukum Henry diterapkan
terhadap udara (spesies 1) dengan
y
1= 1 – 0,0312 = 0,9688 menghasilkan:
1 1 1
H
P
y
x
=
1
,
35
x
10
5950
.
72
33
,
101
9688
,
0
Hasil ini membenarkan asumsi yang dibuat dalam aplikasi hukum Rault terhadap
air.
Contoh 2.Asumsikan bahwa air karbonat hanya mengandung CO2dan H2O, tentukan komposisi uap
dan cairan dalam kaleng soda tersegel dan tekanan yang mendorong kaleng pada 10oC.
Konstanta Henry untuk CO2dan air pada 10oC sekitar 990 bar.
Penyelesaian :
Ambil spesies 1 sebagai CO2dan spesies 2 sebagai air. Hukum Henry untuk spesies 1 dan
hukum Rault untuk spesies 2 ditulis:
i iΗ i
P
x
y
y
2P
x
2P
2sat persamaan ini dijumlahkan menghasilkan :sat 2 2 1 1
H
x
P
x
P
Asumsikan untuk sesaat bahwa fraksi mol CO2dalam cairan adalah 0,01. DenganH1= 990 bar dan
P
2sat= 0,01227 bar (dari tabel steam pada 10oC),P = (0,01)(990) + (0,99) (0,01227) = 9,912 bar
Hasil ini digunakan dalam hokum hnery untuk menentukan nilai barux1. Dengany1≈1,
1 1
H
P
x
=0
,
01
990
912
,
9
yang sesuai dengan asumsi awal.Selanjutnya dengan hukum Rault persamaan (1) untuk spesies 2 ditulis,
0012
,
0
912
,
9
01227
,
0
99
,
0
P
P
x
y
sat 2 2 2Selanjuynyay1= 1-y2= 1 – 0,0012 = 0,9988, dan fasa uapmendekati CO2murni, sebagaimana
2. VLE Hukum Rault Termodifikasi
Untuk takanan rendah sampai moderat persamaan lebih realistis untuk hasil VLE
ketika asumsi dasar kedua hukum Rault ditingalkan dan perhitungan diambil
deviasi-deviasi dari keidealan larutan dalam fasa cair dengan faktor yang disisipkan
kedalam hukum Rault,
sat i i i i
P
x
γ
P
y
(
i
= 1,2, …,
N
)
(5)
Faktor
γ
idisebut sebagai koefisien aktivitas. Perhitungan titik gelembung dan titik
embun dibuat dengan persamaan ini hanya sedikit lebih kompleks daripada
perhitungan yang sama yang dibuat dengan Hukum Rault. Koefisien aktivitas
adalah fungsi temperatur dan komposisi fasa cair dan berdasarkan ekperimen.
Karena,
y
1
i i
, persamaan (5) dapat dijumlahkan keseluruhan spesies
menghasilkan:
i sat i i iγ
P
x
P
(6)
secara alternatif persamaan (5) dapat diselesaikan untuk
x
1
i i
, dengan
menjumlahkan spesies menghasilkan:
i sat i i iγ
P
y
1
P
(7)
Contoh 3. Untuk sistem metanol (1)/metil asetat (2), persamaan berikut menyediakan korelasi koefisien aktivitas: 2 2 1
Ax
γ
ln
ln
γ
1
Ax
22 dimanaA
2
,
771
0
,
00523
T
Tambahan pula, persamaan Antoin berikut menyediakan tekanan uap:
424
,
33
31
,
643
.
3
59158
,
16
ln
T
P
1sat dan424
,
53
54
,
6665
.
2
25326
,
14
ln
T
P
2satdimanaTdalam Kelvin dan tekanan uap dalam satuan kPa. Hitunglah: (a) Pdan {yi}, untukT= 318,15 K danx1= 0,25
(b) Pdan {xi}, untukT= 318,15 K dany1= 0,06 (c) Tdan {yi}, untukP= 101,33 kPa danxi= 0,85 (d) Tdan {xi}, untukP= 101,33 kPa danyi= 0,40
Penyelesaian :
(a) PerhitunganBUBL P. untukT= 318,15 K, persamaan antoin menghasilkan
sat 1
P
= 44,51 danP
1sat= 65,64 kPakoefisien aktivitas dihitung dari hubungan persamaan : A = 2,771 –(0,00523) (318,15) = 1,107
2 2 1Ax
γ
exp
= exp
1
,
107
0
,
75
2
= 1,864
2 1 2Ax
γ
exp
= exp
1
,
107
0
,
25
2
= 1,072 tekanan diberikan oleh persamaan (6)P= (0,25)(1,864)(44,51( + (0,75)(1,072)(65,64) = 73,50 kPa Persamaan (5) ditulis,
P
P
γ
x
yi
sat i i i
y1=
50
,
73
51
,
44
864
,
1
25
,
0
= 0,282 dany2= 1- 0,282 = 0,718(b) Perhitungan DEW P. Ddengan T tidak berubah dari (a), nilai untuk T = 318,15 K, persamaan antoin menghasilkan
P
1sat dan A tidak berubah. Namun demikian komposisi uap-cair di sini tidak diketahui, tapi dibutuhkan dalam perhitungan koefisien aktifitas. Prosedur iterasi dilakukan dan nilai awal kita setγ
1
γ
2
1
. Diperlukan tahapan yang dilaksanakan dengan nilaiγ
1danγ
2, sebagi berikut: Hitung P dengan persamaan (7), yang ditulis:
sat 2 2 2 sat 1 1 1
γ
P
y
γ
P
y
1
P
Hitungx1dengan persamaan (5):
sat 1 1 1 1
P
γ
P
y
x
selanjutnyax2= 1-x1 Evaluasi koefisien aktivitas; kembali ke tahap awal; lanjutkan sampai konvergen, Saat dilakukan, proses iterasi menghasilkan nilai akhir:
P= 62,89 kPa, x1= 0,8169,
1
1
,
0378
1
2
,
0935
(c) PerhitunganBUBL T. Nilai awal untuk temperatur yang tidak diketahui diperoleh dari penjenuhan temperatur spesies murni pada tekanan yang diketahui. Persamaan Antoine, yang menyelesaikanT, menjadi :
Aplikasi untuk P = 101,33 kPa, menghasilkan:
sat 1T
337,71 K danT
2sat
330,08 Kfraksi mol terberat rata-rata nilai ini selanjutnya menyediakanTawal: Prosedur iterasi terdiri tahapan berikut:
Untuk nilai T hitung nilai A,γ1, γ2,dan
α
P
1satP
2sat dari persamaan yang diberikan. Dapatkan nilai baru
P
1satdari persamaan (5) yang ditulis :/
α
γ
x
γ
x
P
P
2 2 1 1 sat 1
Dapatkan nilai baru T dari persamaan antoinyang ditulis untuk spesies 1:
1 sat 1 1
C
P
A
B
T
ln
Kembali ke tahap awal, ulangi sampai nilaiT konvergen. Proses iterasi menghasilkan nilai akhir :
T= 331,2 K
P
1sat= 95,24P
2sat= 48,73 kPa A = 1,0388 γ1=1,10236 γ2= 2,1182(d) PerhitunganDEW T. Karena P = 101,33 kPa, penjenuhan temperatur sama seperti bagian (c), dan nilai awal temperatur yang tidak diketahui didapatkan sebagai mol fraksi nilai tersebut:
T = (0,40)(337,71) + (0,60)(330,08) = 333,13 K
Karena komposisi fasa cairan tidak diketahui, koefisien aktivitas diawali dengan γ1=
γ2= 1. Seperti bagian (c) prosedur iterasi adalah:
Evaluasi A,
P
1sat,P
2sat dan
P
1satP
2sat pada nilai T dari persamaan Antoin. Hitungx1dengan persamaan (5);
sat 1 1 1 1
P
γ
P
y
x
selanjutnyax2= 1-x1 Hitung nilaiγ1danγ2persamaan yang berhubungan Dapatkan nilai baru
P
1satdari persamaan (7)
α
γ
y
γ
y
P
P
2 2 1 1 sat 11 sat 1 1
C
P
A
B
T
ln
Kembali ke tahap awal dan ulangi dengan nilai γ1 dan γ2 sampai proses konvergen pada nilai akhirT.
Proses iterasi menghasilkan nilai akhir:
T= 326,7 K
P
1sat= 64,63 kPaP
2sat= 90,89 kPaA= 1,0624 γ1=1,3629 γ2= 1,2523
x1= 0,4602 x2= 0,5398
(e) Pertama kali tentukan apakah keadaan azeotrop terjadi atau tidak pada temperatur yang diketahui. Perhitungan ini didukung dengan definisi kuantitas yang disebut dengan volativitas relatif (relative volativity), yaitu
(8) Pada azeotropy1= x1,y2=x2, danα12= 1. Dengan persamaan (5),
P
P
γ
x
y
i isat i i
Oleh karena itu,
sat 2 2 sat 1 1 12
P
γ
P
γ
α
(9)Hubungan persamaan untuk koefisien aktivitas menunjukkan bahwa ketikax1= 0, γ2= 1, danγ2= exp(A); ketikax1=1,γ1= 1 danγ2= exp(A). Oleh karena itu pada batasan ini,
sat 1 sat 1 0 1 x 12P
A
P
α
exp
dan
A
P
P
α
sat 2 sat 1 1 1 x 12exp
Nilai
P
1sat,P
2sat, dan Air diberikan pada bagian (a) untuk temperatur yang sama. Batasan nilaiα12 adalah sebagai berikut:
64
,
65
107
,
1
exp
15
,
44
0 1 x 12α
= 2,052
107
,
1
exp
64
,
65
51
,
44
1 1 x 12α
= 0,224Karena nilai pada salah satu batas lebih besar dari 1, sementara nilai batas yang lain kurang dari 1, maka kondisi azeotrop terjadi, karena α12merupakan fungsi kontinyu x1
2 2 1 1 12
x
y
x
y
α
sat 2 2 sat 1 1
P
γ
P
γ
=1 = az 1 az 2 az 2 az 1P
P
γ
γ
=51
,
44
65
,
64
= 1,4747Perbedaan antara hubungan persamaan untuk ln γ1 dan ln γ2 menyediaan hubungan umum: 2 1 2 2 2 1
Ax
Ax
γ
γ
ln
=A(x2–x1)(x2+x1) =A(x2–x1) =A(1 – 2x1)Oleh karena itu komposisi azeotrop adalah nilaix1yang cocok untuk persamaan ini dan ketika rasio koefisien aktivitas memiliki nilai azeotrop 1,4747, yang mana:
2 1γ
γ
ln
ln 1,4747 = 0,388 =A(1 – 2x1)penyelesaian persamaan menghasilkan
x
1az= 0,325. Nilaix
2az= 0,675. Nilai koefisien aktivitas,
1az= exp
A
x
2az 2
= exp[(1,107)(0,675)2] = 1,657. Dengan az1
x
=y
1az, persamaan (5) menjadi: sat 1 az 1 azP
γ
P
= (1,657)(44,51) =73,76 kPaOleh karena itu,
P
az
73,76 kPa danx
1az=y
1az= 0,325Contoh 4. Buatlah diagramP-x-yuntuk sistem sikloheksana (1)/benzena (2) pada 40oC. Tekanan uap
untuk spesies murni diberikan dengan persamaan Antoine berikut:
224
47
,
945
.
2
2724
,
14
ln
C
t
/kPa
P
o sat 107
,
220
78
,
773
.
2
8594
,
13
ln
C
t
/kPa
P
o sat 2Dengan persamaan koefisien aktifitas: 2 2 1
0,458x
ln
2 1 20,458x
ln
Penyelesaian: Perrsamaan VLE: sat 1 1P
P
y
1
x
1
sat 2 2P
1
P
y
2
x
1
sat 2 2 sat 1 1P
1
P
P
x
1
x
1
sat 2 2 sat 1 1P
1
P
P
x
1
x
1
sat
2 2 sat 1 1 sat 2 2P
P
P
P
x
1
sat 2 2 2 1 2 1 1 sat 2 2 1P
x
exp
0,548
1
x
exp
0,548x
γ
P
0,548x
exp
P
Hasil perhitungan dari persamaan di atas diperoleh Gambar 3.
T konstan = 40oC 24 25 26 27 28 0 0,2 0,4 0,6 0,8 1
fraksi mol sikloheksana
P (k P a ) P-y 1 P -y 1 P-x 1 P -x 1
Kurva titik gelembung dari hukum Rault
Gambar 3. DiagramPxyuntuk sikloheksana (1)/benzene pada T= 40oC.
5. VLE dari Korelasi Nilai K
Penggunaan utama hubungan kesetimbangan fasa, yaitu dalam pembuatan
proses-proses pemisahan yang bergantung pada kecenderungan zat-zat kimiayang
diberikan untuk mendistribusikan diri, terutama dalam satu atau lain fasa
kesetimbangan. Sebuah ukuran yang nudah terhadap kecenderungan ini berkenaan
dengan VLE yaitu rasio kesetimbangan
K
i, yang dapat dinyatakan sebagai sebuah
fungsi dari variabel-variabel termodinamik melalui :
(10)
i i
y
Manfaat
K
iuntuk mewakili rasio
y
i/x
isangat umum bahwa besaran ini biasanya
disebut sebuah
nilai K
keseimbangan (
K-value
); nama lainnya yaitu
koefisien distribusi
uap/cair. Meskipun pengenalan
nilai K
tidak menambah apa-apa pada pengetahuan
termodinamik kita tentang VLE, sebuah
nilai K
berlaku sebagai ukuran
“keringanan” sebuah komponen, yaitu kecenderungannya untuk terkonsentrasi
dalam fasa uap. Jika
K
ilebih besar dari satu, komponen
i
terkonsentrasi dalam fasa
uap; jika
K
ikurang dari satu, komponen
i
terkonsentrasi dalam fasa cair, dan
dianggap sebagai sebuah komponen berat. Lebih dari itu, penggunaan
nilai K
membuat perhitungan tepat, memungkinkan eliminasi salah satu {
y
i} atau {
x
i} dalam
uap lainnya.
Persamaan (1) menunjukkan bahwa
nilai K
untuk hukum Raoults adalah:
P
P
K
sat i i
(11)
dan menurut persamaan (5) menunjukkan bahwa untuk hukum Rault termodifikasi
persamaan
nilai K
adalah:
P
P
K
sat i i i
(12)
Berdasarkan persamaan (10),
y
i= K
ix
i; karena
i iy
1
, selanjutnya
1
i i ix
K
(13)
Persamaan (13) untuk perhitungan titik gelembung, dimana
x
idiketahui,
permasalahan adalah menemukan
nilai K
yang sesuai dengan persamaan (13).
Alternatif lain persamaan (10) dapat ditulis,
x
i= y
i/K
i; karena
i iy
1
, selanjutnya;
i i iK
y
=1
(14)
Persamaan (14) adalah untuk menghitung titik embun, dimana
y
idiketahui,
masalahnya adalah menemukan
nilai K
yang sesuai persamaan (14)
Persamaan (11) dan persamaan (12) bersama-sama dengan persamaan (10)
merepresentasikan bentuk alternatif hukum Rault dan hukum Rault termodifikasi.
Daya tarik besar hukum rault adalah bahwa hal ini menyatakan
nilai K
hanya
sebagai fungsi
T
dan
P
, tidak tergantung komposisi fasa uap dan cair.
Contoh 5. Untuk campuran 10 % mol metana, 20 % mol etana, dan 70% mol propana pada 50oF.
Tentukan;
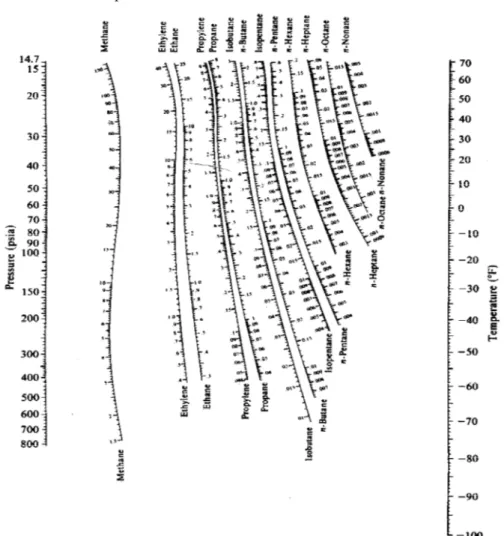
(a) Tekanan titik embun (b) Tekanan titik gelembung Nilai K diberikan pada Gambar 4.
Gambar 4. Nilai K hidrokarbon pda suhu rendah Penyelesaian:
(a) Ketika sistem pada titik embunnya hanya sedikit jumlah cairan yang ada, dan fraksi mol yang diberikan adalah nilaiyi. Untuk temperatur yang diberikan, nilaiKtergantung pada pemilihan P, dan dengan trial kita cari nilai yang sesuai persamaan (14). Hasil untuk beberapa nilaiPdiberikan berikut:
Spesies Metana
P= 100(psia) P= 150(psia) P= 126(psia)
yi Ki yi/Ki Ki yi/Ki Ki yi/Ki
Etana Propana
0,80 0,92 0,761 0,65 1,077 0,762 0,919
∑(yi/Ki) = 0,828 ∑(yi/Ki) = 1,174 ∑(yi/Ki) = 1,000
Hasil yang diberikan pada dua kolom terakhir menunjukkan bahwa persamaan (14) sesuai ketikaP =126(psia). Ini adalah tekanan dewpoint, komposisi dew diberikan oleh nilaixi=yi/Kitertera di kolom terakhir tabel.
(b) Ketika sistem hampir terkondensasi seluruhnya , kondisi ini merupakan titik gelembungnya, dan fraksi mol yang diberikan sebagai nilai xi. Dalam kasusu ini kita mencari dengan trial nilai P yang nilai K-nya sesuai persamaan (13). Hasil untuk beberapaP diberikan pada tabel berikut:
Spesies Metana Etana Propana
P= 380(psia) P= 400(psia) P= 385(psia)
xi Ki Kixi Ki Kixi Ki Kixi 0,10 0,20 0,80 5,60 1,11 0,335 0,560 0,222 0,235 5,25 1,07 0,32 0,525 0,214 0,224 5,49 1,10 0,33 0,549 0,220 0,231 ∑(Kixi) = 1,017 ∑(Kixi) = 0,963 ∑(Kixi) = 1,000
Persamaan (13) sesuai ketika P = 385(psia). Ini adalah tekanan bubbepoint. Komposisi gelembung uap diberikan denganyi=Kixi, ditunjukkan pada kolom terakhir.
Pehitungan Kilat
Teorma Duhem menyatakan bahwa keadaan keseimbangan sebuah sistem
PVT tertutup, yang terbentuk dari jumlah awal tertentu zat kimia yang
dicampurkan, ditentukan sepenuhnya oleh dua sifat sistem sembarang, asalkan dua
sifat ini merupakan variabel bebas pada keseimbangan. Suhu dan tekanan
memenuhi syarat sebagi sifat seperti itu, untuk semua sistem yang terdiri dari lebih
satu komponen. Maka, menurut teorema Duhem, secara prinsip kita dapat
menghitung komposisi fase-fase keseimbangan pada
t
dan
P
tertentu, jika kita tahu
seluruh fraksi mol
z
1,
z
2, …,
z
mdari m komponen. Komputasi jenis ini apabila
dikerjakan untuk sebuah VLE disebut
perhitungan kilat
(
flash calculation
). Istilah ini
lahir dari kenyataan bahwa sebuah campuran cair pada suatu tekanan di atas
tekanan titik gelembungnyaakan “berkilat” atau teruapkan sebagain jika tekanannya
diturunkan sampai suatu harga antara tekanan titik gelembung dan titik embun.
Proses seperti ini dapat dikerjakan terus menerus, jika suatu cairan disemburkan
melalui sebuah lubang ke dalam sebuah tangki yang dijaga pada tekanan yang
sesuai. Fase-fase cair dan uap yang terbentuk di dalam tangki kilat yaitu fase-fasa
keseimbangan yang berada pada
T
dan
P
tertentu.
Nilai
x
idan
y
iyang dihasilkan dari sebuah perhitungan kilat pasti memenuhi
kriteria keseimbangan seperti yang dinyatakan oleh persamaan (10); sebagai
tambahan nilai–nilai itu harus memenuhi syarat-syarat keseimbangan material
tertentu, yang diturunkan sebagai berikut. Pada
T
dan
P
tertentu, satu mol
campuran dengan komposisi
z
1, z
2, . . . , z
N, akan dipisahkan menjadi
L
mol cairan
dengan komposisi
x
1, x
2, . . . , x
N, dan
V
mol uap dengan komposisi
y
1, y
2, . . . , y
N.
Suatu keseimbangan mol menyeluruh menyaratkan bahwa
1 =
L + V
(m)
dan keseimbangan mol komponen yaitu:
z
i= x
iL + y
iV
(
i
= 1, 2, . . . ,
N
)
(15)
Elimiasi
L
antara kedua persamaan menghasilkan :
z
i= x
i(1
– V
)
+ y
iV
(
i
= 1, 2, . . . ,
N
)
Kini dengan mensubtitusikan
x
i= y
i/K
idan menyelesaikan untuk
y
i, kita peroleh:
1
K
V
1
K
z
y
i i i(
i
= 1, 2, . . . ,
N
)
(16)
Karena
1
i i
y
, persamaan (16) dijumlahkan seluruh spesies:
1
1
i i i iK
V
1
K
z
(17)
Dengan analog yang sama eliminasi
V
persamaan (15) diperoleh:
z
i= y
i(
1 – L
)
+x
iL
(
i
= 1, 2, . . . ,
N
)
Kini dengan mensubtitusikan
y
i= K
ix
idan menyelesaikan untuk
x
i, kita peroleh:
L
K
L
z
x
i i i
1
(
i
= 1, 2, . . . ,
N
)
(18)
Karena
1
i i
x
, persamaan (18) dijumlahkan seluruh spesies:
1
1
i i iL
K
L
z
(19)
Contoh 6. Sistem aseton (1)/asetonitril (3) pada 80oC dan tekanan 110 kPa mempunyai komposisi
keseluruhan z1 = 0,45; z2 = 0,35; z3 = 0,2 . Asumsikan bahwa hukum Rault berlaku untuk sistem ini tentukanL, V, {xi} dan {yi}. Tekanan uap komponen murni pada 80oC dalah :
75
,
195
sat 1P
P
1sat
97
,
84
P
1sat
50
,
32
kPaPenyelesaian :
Pertama lakukan perhitungan BULB dengan {zi} = {xi} utnuk menentukan Pbulb. Degan Peraasamaam (2) sat 3 3 sat 21 2 sat 1 1 bubl
x
P
x
P
x
P
P
= (0,45)(197,75) + (0,35)(97,84) + (0,20)(50,32 = 132, 40 kPaKedua lakukan perhitungan DEW dengan {zi} = {yi} untuk menemukan Pdew. Dengan Persamaan (3) : Pdew = sat 3 3 sat 2 2 sat 1 1
P
y
P
y
P
y
1
=)
32
,
50
(
)
20
,
0
(
)
84
,
97
(
)
35
,
0
(
)
75
,
195
(
)
45
,
0
(
1
=101,52 kPaKarena tekanan yang diberikan terletak antara Pdew dan Pbubl, sistem dalam dua fasa dan perhitungan kilat dapat dilakukan .
Dengan persamaan (11),
K
i
P
isatP
; sehingga,K1= 1,7795 K2= 0,8895 K3= 0,4575 Subtitusi persamaan yang diketahui ke persamaan (17)
1
7795
,
0
1
)
4575
,
1
)(
20
,
0
(
1105
,
0
1
)
8895
,
0
)(
35
,
0
(
7795
,
0
1
)
7795
,
1
)(
45
,
0
(
V
V
V
PenyelesaianVdengan trial error menghasilkan: V= 0,7364 mol danL= 1 – 0,7364 = 0,2636. Perasamaan (16) menunjukkan bahwa setiap bagian di sisi kiri persamaan (A) adalah ekspresi untukyi. Evaluasi bagian ini memberikan:
y1= 0,5087 y2= 0,3389 y3= 0,1524
Selanjutnya dengan persamaan (10),xi= yi/KI; sehingga:
x1= 0,2859 x2= 0,2859 x3= 0,2859
Karena
iy
i
i ix
1
. Prosedur contoh ini valid untuk sejumlah spesies yang ada.Contoh 7. Untuk sistem pada contoh 4, berapa fraksi sistem uap ketika tekanan 200 (psia) dan berapa komposisi kesetimbangan fasa uap dan cair.
Tekanan yang diberikan terletak antara tekanan titik embun dan titik gelembung sesuai untuk sistem dalam contoh 4. Oleh karena itu sistem terdiri dua fasa.Nilai K diperoleh dari Gambar 4, prosedur adalah menacari nilaiVdengan trial yang sesuai dengan persamaan (17). Hasil untuk beberapa trial ditunjukkan di tabel berikut. Kolom yang bagianyimemberikan nilai istilah dalam penjumlahan persamaan (17), karena setiap istilah merupakan fakta nilai
yi. Metana Etana Propana xi Ki yiuntuk V =0,35 yiuntuk V =0,35 yiuntuk V =0,35 xi=yi/Kiiuntuk V =0,35 0,10 0,20 0,80 10,1 1,76 0,52 0,241 0,278 0,438 0,308 1,292 0,414 0,289 0,292 0,419 0,029 0,166 0,805 ∑yi= 0,957 ∑yi= 1,018 ∑yi= 1,000 ∑yi= 1,000