VISKOSITAS DAN BERAT MOLEKUL KITOSAN HASIL REAKSI ENZIMATIS KITIN DEASETILASE ISOLAT
Bacillus papandayan K29-141
([Viscosity and Molecule Weight of Enzymatic Reaction Chitosan by Chitin Deacetylase from Bacillus papandayan K29-14 Isolate) Emma Rochima1), Maggy T.Suhartono2), Dahrul Syah2) , Sugiyono 2)
1) Staf Pengajar Fak. Perikanan dan Ilmu Kelautan, UNPAD 2) Staf Pengajar Dept. TPG, Fak. Teknologi Pertanian, IPB
1)Email: emma@unpad.ac.id
ABSTRAK
Penelitian ini bertujuan menganalisis viskositas dan berat molekul kitosan yang dideasetilasi oleh enzim kitin deasetilase termostabil isolat Bacillus papandayan K29-14 hasil presipitasi ammonium sulfat 80% jenuh dengan aktivator MgCl2 1 mM. Larutan kitosan 1% diinkubasi dengan kitin deasetilase
berkekuatan 0.04 U/mg pada 55oC selama 1 jam. Viskositas kitosan diukur dengan viskometer Ubbelohde, dan berat molekul berdasarkan persamaan Mark-Houwink. Hasil penelitian menyimpulkan bahwa deasetilasi enzimatis dapat meningkatkan derajat deasetilasi lebih dari 90% jika derajat deasetilasi awalnya lebih dari 70%. Namun, deasetilasi enzimatis menurunkan viskositas intrinsic dan berat molekul kitosan dari 6.93 ml/g menjadi 4,87 ml/g dan dari 6.06 x 103
menjadi 4.13 x 103 .
Kata kunci: viskositas intrinsic, berat molekul, kitosan ABSTRACT
The objective of the research is to analyse viscosity and molecule weight of chitosan which deacetylated by termostable chitin deacetylase produced by Bacillus papandayan K29-14 which was precipitated by 80% ammonium sulfat with MgCl2 1 mM. Chitin deacetylatilase 0.04 U/mg was added with soluble
chitosan 1%, then incubated at 55o C for 1 hour. Chitosan viscosity was measured by Ubbelohde viskometry and molecule weight based on Mark-Houwink equation. The result of this study concluded that enzymatic deacetylation increased the degree of deacetylation more than 90% if the initial deacetylation degree more than 70%. In the other hand, the enzymatic deacetylation decreased the intrinsic viscosity of chitosan was from 6.93 to 4.87 ml/g and also molecule weight was from 6.05 103 to 4.13 x 103.
Key words: intrinsic viscosity, molecule weight, chitosan
1 Makalah ini disampaikan pada Seminar Nasional dan Kongres Perhimpunan Ahli Teknologi
PENDAHULUAN
Wilayah perairan Indonesia yang sangat luas merupakan sumber daya alam yang tidak habis-habisnya. Belum semua potensi kelautan yang ada telah dimanfaatkan secara maksimal. Pemanfaatan udang untuk keperluan konsumsi menghasilkan limbah dalam jumlah besar yang belum dimanfaatkan secara komersial. Cangkang hewan invertebrata laut, terutama Crustacea mengandung kitin dalam kadar tinggi, berkisar antara 20-60% tergantung spesies. Cumi-cumi mempunyai kandungan kitin paling sedikit, sekitar 20%, sedangkan cangkang kepiting dapat mengandung kitin sampai 70% (Muzzarelli 2000). Lebih dari 80.000 metrik ton kitin diperoleh dari limbah laut dunia per tahun (Patil, 2000), di Indonesia limbah kitin yang belum dimanfaatkan sebesar 56.200 metrik ton per tahun (Departemen Kelautan dan Perikanan, 2000).
Sekitar 35% dari cangkang kering udang mengandung kitin. Dari kitin udang dapat dihasilkan sekitar 80% kitosan (No dan Meyer, 1997). Harga kitosan di pasaran dunia adalah sekitar US$ 7.5/10g untuk kitosan dengan standar baik. Saat ini, 90% pasaran kitosan dunia dikuasai oleh Jepang dengan produksi lebih dari 100 juta ton setiap tahunnya (Tsigos et al., 2000). Indonesia dengan potensi laut lebih luas daripada Jepang mempunyai peluang untuk mengambil bagian dari pasaran kitosan dunia.
Kitin, polimer alami kedua yang paling banyak tersedia di alam setelah selulosa, merupakan polimer aminoglukan dari N-asetil-D-glukosamin yang tidak larut air. Beberapa manfaat yang dapat diambil dari kitin, yaitu di bidang pertanian antara lain dengan memanfaatkan sifat antifunginya untuk melindungi tanaman dari serangan fungi dan sifat antibakterinya terhadap beberapa patogen (Shahidi et al., 1999)
Manfaat tersebut tidaklah sebesar manfaat yang dapat diambil dari turunan kitin, seperti kitosan. Kitosan yang dapat larut dalam asam lemah serta bermuatan positif, diperoleh dari deasetilasi kitin menjadi polimer D-glukosamin. Kitosan dan turunannya telah banyak dimanfaatkan secara komersial dalam industri pangan, kosmetik, pertanian, farmasi pengolahan limbah dan penjernihan air. Dalam bidang pangan, kitosan dapat dimanfaatkan dalam pengawetan pangan,
bahan pengemas, penstabil dan pengental, antioksidan serta penjernih pada produk minuman. Selain itu, kitosan banyak diaplikasikan sebagai pangan fungsional karena dapat berfungsi sebagai serat makanan, penurun kadar kolesterol, antitumor serta prebiotik (Dunn et al. 1997; Shahidi et al. 1999).
Proses deasetilasi kitin menjadi kitosan dilakukan di industri secara termokimia menggunakan alkali kuat pada suhu tinggi. Hasil dari proses ini belum sepenuhnya memuaskan sebab kualitas kitosan yang dihasilkan masih bervariasi dalam berat molekul, viskositas dan derajat deasetilasi. Selain itu, proses termokimia juga membutuhkan energi dalam jumlah besar untuk menghasilkan dan mempertahankan suhu tinggi serta menghasilkan limbah dan produk samping berupa alkali dengan konsentrasi tinggi yang berpotensi menjadi toksik bagi lingkungan. Oleh lkarena itru diperlukan alternatif, proses deasetilasi dapat dilakukan secara enzimatis menggunakan kitin deasetilase (CDA) sehingga diharapkan akan lebih mudah dikendalikan, lebih efisien, spesifik dan meminimalkan produk samping (Tsigos et al. 2000), serta memiliki viskositas dan berat molekul spesifik pula.
Berdasarkan hal tersebut di atas maka tujuan penelitian ini menganalisis viskositas dan berat molekul kitosan hasil aplikasi enzimatis CDA sebagai langkah awal pemanfaatan kitin dan kitosan yang lebih luas baik di industri pangan maupun biomedis.
BAHAN DAN METODE Waktu dan Tempat Penelitian
Penelitian dilaksanakan di Laboratorium Mikrobiologi dan Biokimia PP Bioteknologi Institut Pertanian Bogor mulai bulan Januari sampai dengan Desember 2004.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah: kitin dari limbah pengolahan rajungan asal Cirebon. Untuk produksi kitosan digunakan bahan
papandayan K29-14 hasil skrining koleksi Laboratorium Mikrobiologi dan Biokimia PAU Institut Pertanian Bogor, akuades, buffer borat pH 8, Na-bikarbonat 2%, I mM EDTA, K2HP04, NaCl, (NH4)2SO4, MgS04.7H20, ekstrak
kamir, bacto tripton, bacto agar, glikol kitosan, dan kitin komersial. Untuk pengukuran aktivitas enzim digunakan glikol kitin sebagai substrat, buffer dengan pH optimum, NaNO2 5%, asam asetat 33%, amonium sulfamat 12.5%, HCI 5%,
Indol 0,1%, etanol absolut, glukosamin standar.
Alat yang digunakan adalah inkubator goyang, centrifuge, pH-meter, alat timbang, pipet mikro, bulb, peralatan gelas, evendorph, fraction collector, kolom kromatografi DEAE Sephadex A-50, spektrofotometer FDUV, oven, desikator, viskometer Ubbelohde.
Metode
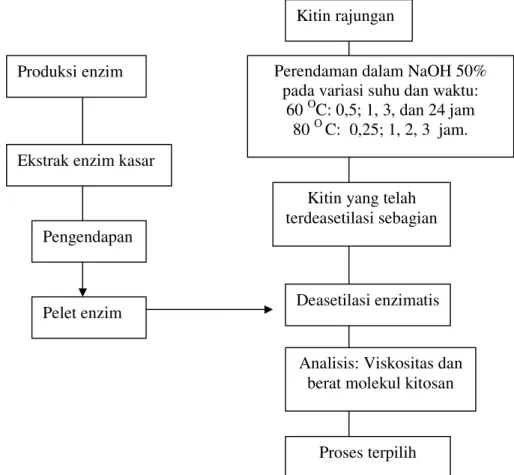
Penelitian dilakukan dalan 2 (dua) tahap yaitu penelitian pendahuluan dan penelitian utama dan dapat dilihat pada Gambar 1 di bawah ini.
Penelitian pendahuluan
Penelitian pendahuluan dimaksudkan untuk menentukan kondisi optimum proses deasetilasi yang menghasilkan kitosan dengan derajat deasetilasi minimal 50% dengan perlakuan perendaman kitin dalam larutan NaOH 50% pada suhu dan waktu perendaman yang bervariasi yaitu perendaman pada suhu 60 O C selama
0,5; 1, 3, dan 24 jam, serta suhu 80 O C selama 0,25; 1, 2, 3 jam. Kitin yang telah
direndam dibilas dengan air sampai pH netral dan dikeringkan kemudian ditentukan derajat deasetilasinya.
Produksi enzim
Kultur Bacillus papandayan K29-14 diinkubasi dalam media termus pada 55o C selama dua hari, hasilnya dipanen dengan disentrifugasi 10.000 rpm selama 20 menit. Filtrat bebas sel diuji unit aktivitas CDA dengan metode Tokuyasu et al. 1996 dan kadar protein dengan metode Bradford 1976..
Penelitian utama
Penelitian utama ini didasarkan atas kondisi terbaik yang dilakukan pada penelitian pendahuluan.
Gambar 1. Tahapan penelitian
Pengendapan dengan amonium sulfat
Amonium sulfat ditambahkan sedikit demi sedikit ke dalam ekstrak kasar enzim sambil distirrer sampai kejenuhan 80% (konsentrasi 50-60% b/v). Campuran diendapkan semalam pada suhu 4oC lalu disentrifugasi pada 8000 rpm
selama 15 menit. Pellet yang diperoleh dilarutkan dalam 0.02 M buffer borat sesuai pH optimum enzim lalu disimpan pada suhu 4oC.
Produksi enzim
Ekstrak enzim kasar
Pengendapan
Pelet enzim
Kitin rajungan
Perendaman dalam NaOH 50% pada variasi suhu dan waktu:
60 OC: 0,5; 1, 3, dan 24 jam
80 O C: 0,25; 1, 2, 3 jam.
Kitin yang telah terdeasetilasi sebagian
Deasetilasi enzimatis
Analisis: Viskositas dan berat molekul kitosan
Deasetilasi enzimatis
Deasetilasi enzimatis menggunakan enzim hasil presipitasi amonium sulfat 80%. Sebanyak 1 ml soluble kitosan 1% diinkubasi dengan enzim sebanyak 0.005 U/ml dengan kekuatan 0.04 U/mg kitosan lalu diinkubasi pada 55 oC selama 24 jam.
Pengukuran Viskositas Kitosan
Viskositas kitosan diukur menggunakan Ubbelohde dilution viscometer. Viskositas terbagi tiga jenis yaitu viskositas spesifik ( sp ), kinematik, dan
intrinsik ( ). Viskositas spesifik dihitung berdasarkan perbandingan antara kecepatan aliran suatu larutan dengan pelarutnya. Caranya dengan membuat variasi konsentrasi mulai 20-100% dalam pelarut asam asetat aqueous 0.1 M dan sodium klorida 0.2 M lalu dimasukkan ke dalam viskometer. Waktu yang dibutuhkan sampel untuk mengalir antara dua level dalam viskometer dicatat. Sebagai blanko, digunakan pelarut asam asetat aqueous 0.1 M dan sodium klorida 0.2 M dengan cara yang sama. Viskositas spesifik dihitung dengan rumus:
sp = t – to to Keterangan:
sp = viskositas spesifik
t = waktu alir larutan sampel satu level to = waktu alir pelarut satu level
Viskositas kinematik diperoleh dengan mempertimbangkan densitas larutan. Viskositas spesifik dan kinematik dipengaruhi oleh konsentrasi larutan. Viskositas intrinsik dihitung dari perbandingan antara viskositas spesifik dengan konsentrasi larutan ( sp/C) yang diekstrapolasi sehingga nilai konsentrasi larutan
mendekati nol. Dengan demikian nilai kelarutan tidak berpengaruh terhadap viskositas intrinsik.
Pengukuran Berat Molekul Kitosan
Berat molekul kitosan diukur berdasarkan viskositas instrinsik ( ). Larutan kitosan dibuat dalam variasi konsentrasi 20-100% dalam pelarut asam asetat aqueous 0.1 M dan sodium klorida 0.2 M lalu dimasukkan ke dalam viskometer. Data yang diperoleh dipetakan pada grafik sp /C terhadap C. Viskositas intrinsik
adalah titik pada grafik yang menunjukkan nilai C=0. Berat molekul ditentukan berdasarkan persamaan Mark-Houwink (Hwang et al, 1997) yaitu:
[ ] = kM Keterangan: [ ] = viskositas intrinsik k = konstanta pelarut = konstanta M = berat molekul
HASIL DAN PEMBAHASAN Derajat Deasetilasi Kitosan Kimiawi
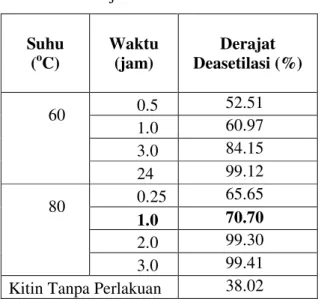
Produksi kitosan secara kimiawi dilakukan dengan penambahan NaOH 50% yang diinkubasi pada suhu dan waktu tertentu. Derajat deasetilasi hasil reaksi kimiawi diukur menggunakan spektrofotometer First Derivative Ultra Violet (FDUV) pada panjang gelombang 201.8 nm. Hasil pengukuran derajat deasetilasi kitosan yang diproduksi secara kimiawi diperlihatkan pada Tabel 1 berikut ini.
Perendaman dalam larutan NaOH bertujuan untuk mengubah konformasi kristalin kitin yang rapat sehingga enzim lebih mudah berpenetrasi untuk mendeasetilasi polimer kitin (Martinou et al. 1995). Akan tetapi perendaman dalam NaOH konsentrasi tinggi ( 40%) akan meningkatkan derajat deasetilasi dan mengakibatkan terjadinya depolimerisasi memutuskan ikatan antara gugus karboksil dengan atom nitrogen (No dan Meyer 1997)
Tabel 1. Derajat deasetilasi kitosan kimiawi
Suhu
(oC) Waktu (jam) Deasetilasi (%) Derajat
0.5 52.51 1.0 60.97 3.0 84.15 60 24 99.12 0.25 65.65 1.0 70.70 2.0 99.30 80 3.0 99.41
Kitin Tanpa Perlakuan 38.02
Selain itu kitin lebih tahan terhadap proses deasetilasi dengan penambahan alkali, yang biasanya menimbulkan masalah pada senyawa bergugus N-asetil. Hal ini disebabkan karena struktur kitin yang tebal dan ikatan hidrogen diantara atom nitrogen sangat kuat serta mempunyai karboksil pada rantai berikutnya. Oleh karena itu perendaman dilakukan pada suhu yang tidak terlalu tinggi dan waktu yang singkat. Hal ini sesuai pula dengan pendapat Martinou, 1995 yang menyatakan bahwa larutan NaOH mampu merubah konformasi kitin yang sangat rapat menjadi renggang sehingga enzim lebih mudah terekspos untuk mendeasetilasi polimer kitin.
Perendaman dalam alkali dilakukan terhadap sampel kitin dalam bentuk tepung. Penepungan dilakukan agar proses deasetilasi dapat berlangsung lebih cepat dan sempurna, karena semakin luasnya permukaan yang dapat diakses oleh larutan alkali (No dan Meyers, 1997). Deasetilasi akan berlangsung mulai dari permukaan kitin, lalu memasuki wilayah amorf dari kitin dan secara bertahap deasetilasi terjadi sampai ke wilayah kristalin kitin (Chang et al. 1997) Rasio larutan NaOH terhadap kitin yang digunakan adalah sebesar 1:10 b/v. Menurut No dan Meyer (1997), rasio 1:10 menghasilkan peningkatan laju deasetilasi lebih cepat, akan tetapi Chang et al (1997) menyatakan bahwa pengaruh rasio larutan NaOH terhadap kitin tidak signifikan pada laju deasetilasi.
Suhu dan lama perendaman pada larutan NaOH yang meningkat mengakibatkan derajat deasetilasi meningkat pula (Tabel 1). Derajat deasetilasi tertinggi setelah direndam NaOH pada 60 oC selama 24 jam dan 80 oC selama 3 jam. Kenaikan suhu sebesar 20 oC (dari 60 oC menjadi 80 oC) dapat meningkatkan derajat deasetilasi sebesar 9,7% (dari 60.97% menjadi 70.70%) pada perendaman 1 jam dan 15% (dari 84.15% menjadi 99.41%) pada perendaman 3 jam. Sedangkan lama perendaman yang semakin tinggi dari 1 jam sampai 3 jam meningkatkan derajat deasetilasi sebesar 23.18% pada 60 oC dan 29% pada 80 oC. Dengan demikian kenaikan derajat deasetilasi lebih dipengaruhi oleh kenaikan suhu daripada perpanjangan waktu. Kolodziejska 2000 menguatkan hal ini bahwa kenaikan derajat deasetilasi sebesar 8% (dari 68% menjadi 76%) dengan memperpanjang lama perendaman NaOH 50% dari 1.5 jam sampai 3 jam pada 60 oC. Suhu dan lama perendaman NaOH berpengaruh terhadap pemecahan rantai molekul kitin. Penggunaan suhu yang terlalu tinggi (di atas 150 oC) menyebabkan pemecahan ikatan polimer (depolimerisasi) rantai molekul kitosan sehingga menurunkan berat molekul kitosan. Sedangkan pada suhu di bawah 100
oC, pemutusan gugus asetil tidak berlangsung sempurna dan membutuhkan waktu
lebih lama (Johson 1982). Berdasarkan hal tersebut di atas, maka kitosan hasil perlakuan 80 oC selama 1 jam dipergunakan untuk deasetilasi enzimatis karena telah mencapai derajat deasetilasi 70%.
Deasetilasi enzimatis
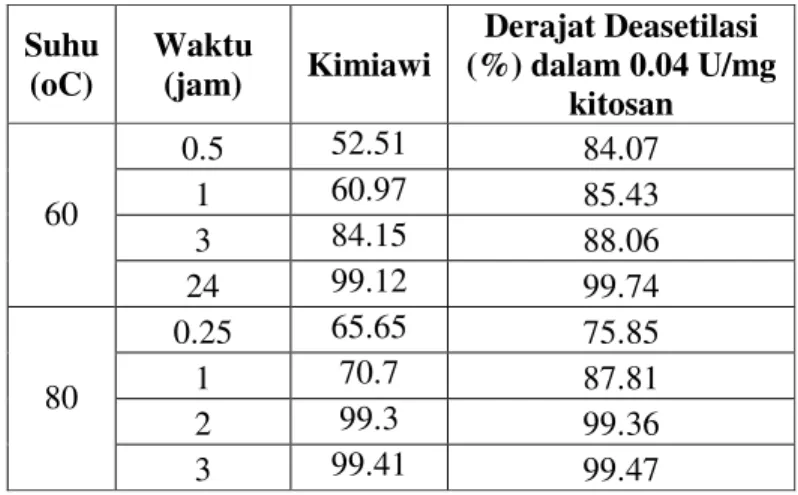
Proses deasetilasi enzimatis meningkatkan derajat deasetilasi 5-30%, tergantung pada derajat deasetilasi awal (Tabel 2). Semakin tinggi derajat deasetilasi awal, semakin kecil peningkatan derajat deasetilasi yang terjadi. Derajat deasetilasi di atas 90% hanya dapat dicapai pada sampel dengan derajat deasetilasi awal di atas 75%. Diduga bahwa semakin lama perlakuan awal secara kimia yang diberikan pada sampel, konformasi sampel akan semakin merenggang sehingga enzim dapat lebih mudah mendeasetilasi.
Tabel 2. Derajat deasetilasi kitosan enzimatis hasil presipitasi Suhu
(oC) Waktu (jam) Kimiawi
Derajat Deasetilasi (%) dalam 0.04 U/mg kitosan 0.5 52.51 84.07 1 60.97 85.43 3 84.15 88.06 60 24 99.12 99.74 0.25 65.65 75.85 1 70.7 87.81 2 99.3 99.36 80 3 99.41 99.47
Derajat deasetilasi awal yang rendah juga menunjukkan masih banyaknya jumlah residu asetil yang belum terpotong. Lebih banyak residu asetil menunjukkan lebih banyak substrat yang tersedia untuk reaksi enzim. Sesuai dengan kinetika enzim, semakin banyak substrat yang tersedia, laju reaksi akan semakin cepat dan akan menurun jika jumlah substrat berkurang (Suhartono 1989). Diduga hal inilah yang menyebabkan peningkatan derajat deasetilasi setelah deasetilasi enzimatis terjadi lebih tinggi pada kitosan dengan derajat deasetilasi awal lebih rendah.
Kitosan hasil kimiawi dilarutkan dalam asam asetat 0.1 M sampai konsentrasi akhir 1% dengan pH 4. Selanjutnya ditambahkan Na-asetat 0.25 M untuk meningkatkan pH menjadi 6. Hal ini dimaksudkan agar larutan tidak mengendap pada pH 4, namun tetap dalam bentuk soluble, juga agar enzim CDA lebih aktif. Kenaikan pH hanya sampai dengan pH 6 walaupun CDA baru bekerja optimum pada pH 8, disebabkan jika pH terlalu tinggi, kitosan akan mengendap kembali. Rahayu et al. (2004) menyatakan bahwa Na-asetat tidak menghambat aktivitas CDA.
Selain itu CDA lebih mudah penetrasi ke dalam substrat berbentuk soluble kitosan daripada bentuk tepung, karena dalam bentuk soluble reaksi menjadi lebih homogen di setiap bagian. Hal ini sesuai dengan Kolodziejska, 2000 yang mendeasetilasi soluble kitosan hingga mencapai derajat deasetilasi
sampai 99%. Namun dengan CDA dari M. rouxii yang diekspos dalam bentuk kristalin dan amorf, kenaikan derajat deasetilasinya masing-masing hanya 0.5% dan 9.5% (Martinou, 1995). CDA dari C.lindemuthianum derajat deasetilasinya meningkat sekitar 0.5% dan 4.5% untuk kitin dalam bentuk yang sama (Tsigos dan Bouriotis, 1995).
Kolodziejska et al (2000) menggunakan CDA ekstrak kasar dari Mucor rouxii sebesar 40 mU/ml soluble kitosan. Deasetilasi enzimatis mampu meningkatkan derajat deasetilasi kitosan mulai 5-30%, semakin tinggi derajat deasetilasi awal maka peningkatan derajat deastilasi semakin rendah. Derajat deasetilasi di atas 90% dapat dicapai pada sampel dengan derajat deasetilasi awal di atas 75%. Hal ini diduga karena reaksi kimiawi pada awal pembuatan kitosan mengakibatkan konformasi semakin merenggang sehingga enzim lebih mudah mendeasetilasi.
Derajat deastilasi juga dipengaruhi oleh jumlah enzim yang ditambahkan. Pada umumnya semakin banyak enzim ditambahkan, maka derajat deasetilasi semakin tinggi, namun kisaran peningkatannya kecil. Hal ini kemungkinan karena kisaran enzim yang digunakan tidak terlalu luas sehingga pengaruhnya belum signifikan.
Viskositas Kitosan Enzimatis
Nilai viskositas dinyatakan dalam viskositas spesifik, kinematik dan intrinsik. Viskositas spesifik ditentukan dengan membandingkan secara langsung kecepatan aliran suatu larutan dengan pelarutnya. Viskositas kinematik diperoleh dengan memperhitungkan densitas larutan. Baik viskositas spesifik maupun kinematik dipengaruhi oleh konsentrasi larutan.
Pengukuran viskositas dilakukan dengan menggunakan viskometer Ubbelohde yang termasuk jenis viskometer kapiler. Untuk penentuan viskometer larutan polimer, viskometer kapiler yang paling tepat adalah viskometer Ubbelohde. Pada viskometer Ubbelohde, pengukuran viskometer dilakukan dengan menentukan waktu yang dibutuhkan oleh sejumlah volume larutan untuk mengalir di antara dua tanda kalibrasi. Waktu alir larutan ini kemudian dibandingkan
dengan waktu alir pelarut murninya. Dengan cara ini akan diperoleh nilai viskositas spesifik, yang tidak mempunyai satuan (Harrington, 1984).
Secara umum, viskositas lebih banyak dinyatakan dengan satuan Poise. Terminologi viskositas yang menghubungkan viskositas dalam Poise dengan viskositas spesifik adalah viskositas kinematik, yang diperoleh dari perkalian viskositas dengan densitas larutan. Viskositas kinematik dihubungkan dengan viskositas spesifik melalui koefisien kinematik yang besarannya tergantung pada viskometer kapiler yang digunakan (Harrington, 1984).
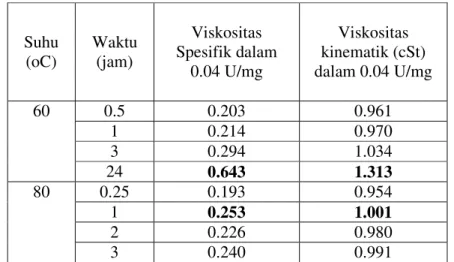
Tabel 3. Pengaruh deasetilasi enzimatis terhadap viskositas kitosan
Suhu
(oC) Waktu (jam)
Viskositas Spesifik dalam 0.04 U/mg Viskositas kinematik (cSt) dalam 0.04 U/mg 0.5 0.203 0.961 1 0.214 0.970 3 0.294 1.034 60 24 0.643 1.313 0.25 0.193 0.954 1 0.253 1.001 2 0.226 0.980 80 3 0.240 0.991
Dalam Tabel 3, nilai viskositas dinyatakan dalam viskositas spesifik dan viskositas kinematik. Walaupun terminologi viskositas kinematik lebih umum digunakan, viskositas spesifik tetap digunakan sebab nilainya diperlukan untuk penentuan viskositas intrinsik dan berat molekul.
Viskositas spesifik dan kinematik larutan kitosan hasil deasetilasi enzimatis cenderung mengalami peningkatan dengan semakin lamanya waktu perendaman secara kimiawi dan meningkatnya suhu. Viskositas spesifik dan kinematik tertinggi diperoleh setelah perendaman dalam larutan NaOH pada 60 oC selama 24 jam dan 80 oC selama 1 jam .
Kenaikan suhu sebesar 20 oC (dari 60 menjadi 80 oC) selama 1 jam menghasilkan peningkatan viskositas spesifik sebesar 3,9% (dari 0.214 menjadi 0.253). Kenaikan suhu 20 oC selama 3 jam menurunkan viskositas spesifik dari
0.294 menjadi 0.240. Lama perendaman yang semakin tinggi dari 1 jam sampai 3 jam menghasilkan fenomena yang sama seperti kenaikan suhu. Pada 60 oC, viskositas spesifik meningkat dengan meningkatnya kekuatan enzim yang digunakan, dan viskositas lebih tinggi (8%). Karenanya, kenaikan viskositas lebih dipengaruhi oleh kenaikan suhu daripada perpanjangan waktu. Peningkatan viskositas diduga karena masih tingginya kandungan asetil dalam kitosan sehingga dengan kenaikan suhu yang semakin tinggi, semakin banyak asetil terlarutkan, sehingga derajat deasetilasi meningkat, dan viskositas meningkat (menjadi lebih kental seperti gel) dengan meningkatnya suhu. Adapun lama waktu deasetilasi berhubungan dengan proses depolimerisasi dimana semakin lama kitosan dideasetilasi maka depolimerisasi semakin tinggi sehingga viskositas menurun (Bastaman 1989).
Nilai kelarutan kitosan sangat dipengaruhi oleh viskositas spesifik dan kinematik namun tidak dipengaruhi oleh viskositas intrinsik. Pengaruh perlakuan kimiawi dan enzimatis dapat ditunjukkan secara lebih jelas oleh viskositas intrinsik. Viskositas intrinsik diperoleh dari kurva rasio antara viskositas spesifik dengan konsentrasi yang diekstrapolasi hingga konsentrasinya mendekati nol. Dengan demikian pengaruh konsentrasi ditiadakan (Hwang et al. 1997).
Hubungan Derajat Deasetilasi, Viskositas Intrinsik dan Berat Molekul Kitosan
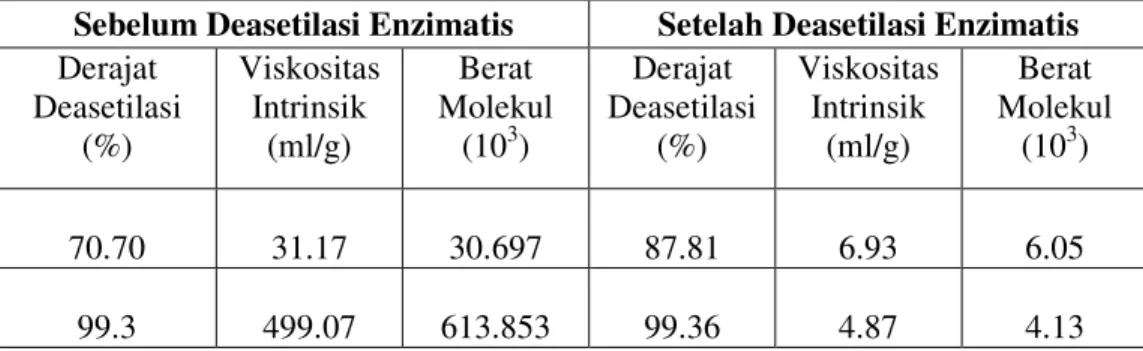
Untuk mengamati hubungan antara perlakuan perendaman dengan NaOH terhadap viskositas dan berat molekul, dipilih dua sampel yaitu kitosan hasil perendaman pada suhu 80 oC dengan waktu 1 dan 2 jam. Kedua sampel dipilih karena derajat deasetilasi yang tinggi (di atas 70%) dan adanya perbedaan yang signifikan antara keduanya dalam hal derajat deasetilasi dan kelarutan (Tabel 4) berikut.
Nilai viskositas intrinsik kitosan sebelum dideasetilasi enzimatis meningkat 16 kali (dari 31.17 menjadi 499.07 ml/g) dengan meningkatnya derajat deasetilasi sebesar 28.6% (dari 70.7% menjadi 99.3%). Nilai viskositas intrinsik
dipengaruhi oleh derajat deasetilasi, konsentrasi, berat molekul, kekuatan ion, pH dan suhu saat pengukuran (Dunn et al. 1997).
Tabel 4. Hubungan derajat deasetilasi kitosan dengan viskositas intrinsik dan berat molekul
Sebelum Deasetilasi Enzimatis Setelah Deasetilasi Enzimatis Derajat Deasetilasi (%) Viskositas Intrinsik (ml/g) Berat Molekul (103) Derajat Deasetilasi (%) Viskositas Intrinsik (ml/g) Berat Molekul (103) 70.70 31.17 30.697 87.81 6.93 6.05 99.3 499.07 613.853 99.36 4.87 4.13
Peningkatan viskositas intrinsik sebelum deasetilasi enzimatis sebesar 16 kali dapat meningkatkan berat molekul sekitar 20 kali (Tabel 4). Berat molekul berhubungan dengan derajat polimerisasi. Polimer rantai lurus seperti kitosan akan menunjukkan peningkatan densitas jika derajat polimerisasi bertambah. Dengan demikian, viskositas intrinsik juga akan meningkat. Wang et al. (1991) menunjukkan hubungan linier antara nilai log viskositas intrinsik dengan nilai log berat molekul, untuk larutan kitosan dengan derajat deasetilasi sama.
Setelah deasetilasi enzimatis, derajat deasetilasi kitosan meningkat (dari 87.81% menjadi 99.36%) tetapi menurunkan viskositas intrinsik (6.93 ml/g menjadi 4.87 ml/g) dan berat molekul (dari 6.05x103 menjadi 4.13x103).
Penurunan viskositas hanya mungkin terjadi jika selama inkubasi dengan enzim terjadi degradasi rantai polimer atau depolimerisasi. Dugaan ini dikonfirmasi oleh nilai berat molekul yang juga menurun selama deasetilasi enzimatis.
Penurunan viskositas setelah deasetilasi enzimatis juga dilaporkan oleh Kolodziejska et al (2000). Viskositas larutan kitosan menurun sebesar satu log setelah inkubasi dengan enzim selama 16 jam. Akan tetapi Kolodziejska et al. (2000) tidak melakukan penentuan berat molekul sehingga tidak dapat dilakukan pembandingan. Enzim CDA yang digunakan telah diberi perlakuan pengendapan pada pH 4.
Depolimerisasi diduga karena adanya enzim-enzim pendegradasi kitin dan kitosan yang lain di dalam ekstrak enzim CDA dari Bacillus K29-14. Rahayu (2000) telah mengisolasi kitinase dari Bacillus K29-14 selain CDA dan mungkin juga terdapat kitosanase. Beberapa protease juga dapat menyebabkan depolimerisasi kitin dan kitosan (Muzzarelli 1997), dan bukan tidak mungkin disekresi juga oleh Bacillus K29-14. Sekresi protease mungkin terjadi karena diinduksi oleh adanya protein dalam medium pertumbuhan, yang dapat berasal dari komponen medium, seperti yeast extract, atau dari enzim-enzim yang disekresi oleh mikroba ke medium untuk memenuhi kebutuhan nutrisinya. Kitosan yang memiliki berat molekul yang lebih besar lebih sensitif terhadap depolimerisasi dan tidak terjadi perubahan struktur selama proses tersebut yang terdeteksi oleh spektrofotometer infra red dan proton nuclear magnetic resonance (Mao et al. 2004).
Variasi waktu dan lama perendaman alkali terhadap kitin dapat menghasilkan kitosan dengan derajat deasetilasi yang berbeda-beda. Proses yang dipilih akan tergantung pada tujuan aplikasi kitosan. Masing-masing bentuk aplikasi membutuhkan kitosan dengan karakteristik yang berbeda-beda. Kitosan dengan derajat deasetilasi tinggi, lebih dari 85%, dan berat molekul rendah dibutuhkan sebagai antibakteri, antifungi, antioksidan, antitumor dan immunoenhancing. Untuk aplikasi sebagai membran dan pengemas dibutuhkan kitosan dengan derajat deasetilasi sekitar 70% dan berat molekul tinggi.
KESIMPULAN
Viskositas intrinsik kitosan menurun dari 6.93 sampai 4.87 ml/g, demikian pula berat molekul kitosan dari 6.05 sampai 4.13 x 103 karena deasetilasi enzimatis oleh kitin deasetilase berkekuatan 0,04 U/mg isolat Bacillus papandayan K29-14. Deasetilasi enzimatis dapat meningkatkan derajat deasetilasi di atas 90% apabila derajat deasetilasi awal di atas 70%.
UCAPAN TERIMAKASIH
Penelitian ini terselenggara atas biaya dari Research Grant Program Hibah Kompetisi B Departemen Teknologi Pangan dan Gizi, Institut Pertanian Bogor tahun 2004.
DAFTAR PUSTAKA
Bastaman S. 1989. Studies on degradation and extraction pf chitin and chitosan from Prawn shells. Dept Mechanical Manufacturing, Aeronautical and Chemical Engineering. Queen’s Univ. Belfast
Bradford M. M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein dye binding. Anal Biochem 72:248-254. Chang KLB., G.Tsai, J. Lee dan W. Fu. 1997. Heterogenous N-deacetylation of
chitin in alkaline solution. Carbohydr Res 303:327-332
[DKP] Departemen Kelautan dan Perikanan Republik Indonesia. 2003. Perkembangan ekspor komoditi hasil perikanan Indonesia 1998-2002. url:
http://www.dkp.go.id/
Dunn, ET., EW. Grandmaison dan MFA. Goosen. 1997. Applications and properties of chitosan. Di dalam MFA. Goosen (ed). Applications of Chitin and Chitosan. Technomic Pub, Basel, p 3-30
Harrington R.E. 1984. Viscosity. Di Dalam D.W. Gruenwedel dan J.R. Whitaker. Food Analysis: Principles and Techniques, Vol 2, Physicochemical Techniques. Marcel Dekker, Inc., New York
Hwang JK, SP Hong, CT Kim. 1997. Effect of molecular weight and NaCl concentration on dilute solution properties of chitosan. J Food Sci Nutr 2: 1-5
Johnson EL. Dan QP. Peniston. 1982. Utilization of shellfish wastes for production of chitin and chitosan. Chemistry and Biochemistry of Marine Food Product. The AVI. Connecticut
Kolodziejska I, Wojtasz-Pajak A, Ogonowska G, and Sikorski Z E. 2000. Deacetylation of chitin in two-stage chemical and enzymatic process. Bull Sea Fish Inst, 150:15-24
Mao S, Shuai X, Unger F, Simon M, Bi D, Kissel T. 2004. The polymerization of chitosan: effects on physicochemical and biological properties. Int J Pharm, 281:45-54
Martinou, A., D. Kafetzopoulos dan V. Bouriotis. 1995. Chitin deacetylation by enzymatic means: monitoring of deacetylation processes. Carbohydr Res 273:235-242
Muzzarelli, RAA. 1997. Depolymerization of chitins and chitosans with hemicellulase, lysozyme, papain, and lipases. Di Dalam RAA. Muzzarelli dan MG Peter (ed). Chitin Handbook. European Chitin Soc, Grottamare No H.K dan S.P. Meyers. 1997. Preparation of chitin and chitosan. Di Dalam
R.A.A. Muzzarelli dan M.G. Peter (ed). Chitin Handbook. European Chitin Soc., Grottamare
Patil, R. S., V. Chormade, and M. V. Desphande. 2000. Chitinolytic enzymes an exploration. Enz Microb Technol 26:473-483.
Rahayu S., Tanuwijaya F., Rukayadi Y., Suwanto A., Suhartono, MT., Hwang JK., Pyun YR. 2004. Study of thermostable chitinase enzymes from Indonesian Bacillus K29-14. J Microbiol Biotech 4:647-652
Shahidi F, Arachchi JKV, and Jeon YJ. 1999. Food applications of chitin and chitosans. Trends Food Sci Technol 10:37-51
Suhartono M.T. 1989. Enzim dan Bioteknologi. Pusat Antar Universitas Bioteknologi, IPB
Tokuyasu, K., M. O. Kameyama, and K. Hayashi. 1996. Purification and characterization of extracellular chitin deacetylase from Colletotrichum lindemuthianum. Biosci Biotech Biochem 10:1598-1603.
Tsigos, I., A. Martinou, Kafetzopoulos and V. Bouriotis. 2000. Chitin deacetylases: New versatile tools in biotechnology. TIBTECH Rev, 18: 305-312.
Tsigos I. dan V. Bouriotis. 1995. Purification and characterization of chitin deacetylase from Colletotrichum lindemuthianum . J Biol Chem, 270:26286 26291
Wang W, S. Bo, S. Li, W. Qin. 1991. Determination of Mark-Houwink equation for chitosans with different degrees of deacetylation. Int J Biol Macromol, 13:281-285