TUGAS AKHIR
Ml~ IK ''E • I .. \ INS TU -_:.,, ·~·· ., SEPULUH - NOPEMBER /
I
STUDI PERBANDINGAN KARAKTERISTIK
SACRIFICIAL ANODES DENGAN
IMPRESSED CURRENT
UNTUK PENCEGAHAN KOROSI BADAN KAPAL
Disusun Oleb
IMRON ROSADI
NRP. 4101109S01l!_s.f? (
6zJ.
-
8lf~
~~
l
-
I
----
~C/03 PERPVSTAKAAN I 1' S L . -'1 1 l. 'T' e r i rn lt /-z, -- ..-
"ZeYD3
Terin1'1 1h1,·ir-/
N;;:;nda
Prp. q ( 'Zi ~JURUSAN TEKNIK
PERKAPALAN
FAKULTASTEKNOLOGIKELAUTAN
INSTITUT TEKNOLOGI SEPULUH NOPEMBER
SURABAYA
STUDI PERBANDINGAN KARAKTERISTIK
SACRIFICIAL ANODES DENGAN IMPRESSED CURRENT
UNTUK PENCEGAHAN KOROSI BADAN KAPAL
TUGAS AKHIR
Diaju.kan guna memenuhi
sebagian
persyaratan memperoleh gelar
Sarjana Teknik PerkapalanPada
Jurusan Teknik Perkapalan
Fakultas Teknologi Kelautan
Institut Teknologi Sepuluh Nopember
Surabaya
Mengetahui!Menyetujui,
SURABAYA
JULI 2003
Dosen Pembimbing ll
Ph.D.
STl
JDI PERBANDINGAN
KARI\KTI!
:
RISTIK
SACRIFICIAL ANODES
DENGAN
I~lPRESSEDCl'RRENT
UNTUK PENCEGAHAN
KOROSI BADAN
KAPAL
TUGASAKHIR
Diajukan guna mcmenuhi sebagian pcrsyaratan mcmpcrolch gclar Sarjana Teknik Perkapalan
Pad a
Jurusan Teknik Perkapalan
Fakultas Teknologi Kelautan
lnstitut Teknologi Sepuluh Nopem brr Surabaya
Mengetahui/Menyetujui,
SlJRABAVA JULI 2003
STUDI
PERBANDINGAN KARAKTERISTIK
SACRIFICIAL ANODES
DENGAN Th1PRESSED
CURRENT
UNTUK
PENCEGAHAN KOROSI BAD
AN KAPAL
TlJGAS AKIIIR
( KP 1701)
Diajukan guna memenuhi sebagian persyaratan memperoleh gelar Sarjana Teknik Perkapalan
Dan
Telah direvisi sesuai dengan hasil Sidang Tugas Akhir Pad a
Jurusan Telrnik Perkapalan Fakultas Teknologi Kelautan Institut Teknologi Sepuluh Nupember
Surabaya Mengetahui/Menyetujui,
-IH \Vil~~~~~~r~a~se~tv~o~A~P~s~~~.,~M~·~l~~t~.~~2 IP. 132 133 972 Dos<:n PemiJimbing 11Nama NRP
INSTITUT TEKNOLOGI SEPULUH NOPEMBER FAKULTASTEKNOLOGIKELAlJTAN
JURUSAN TEKNIK PERKAPALAN
: Irnron Rosadi :4101109 501
Dosen Pembimbing I :Wing Hendro Prasetyo AP, ST, M.Sc.
ll : Ir. Djauhar Manfaat, MSc, Ph.D.
ABSTRAK Sarjana Teknik S 1
STUDI PERBANDINGAN KARAKTERISTIK
SACRIFICIAL ANODES DENGAN IMPRESSED CURRENT
UNTUK PE ·cEGAHAN KOROSI BADAN KAPAL
Secara umum korosi diartikan sebagai suatu proses kerusakan atau keausan material akibat tetjadi reaksi dengan lingkungan. Dalam sebuah kapal korosi merupakan suatu masalah yang tidak kecil, karena dapat menurunkan produktivitas kapal. Salah satu perlindungan badan kapal dari korosi adalah dcngan cara proteksi katodik. Dalam hal ini proteksi katodik dibedakan menjadi dua yaitu metoda SACP (Sacr(flc:ial Anodes Cathodic Protection) atau anoda tumbal dan metoda ICCP (Impressed Current Cathodic Protection) atau a.rus terpasang.
Beberapa hal yang diketjakan dalam tugas akhir ini antara lain adalah melakukan penghitungan zinc anode yang dibutuhkan serta teknis pemasa.ngannya, penghitungan biaya yang dibutuhkan untuk penggunaan sistem anoda tumbal maupun sistem ICCP.
ini dilakukan untuk mengetahui sisi teknis dan ekonomis dari metode tersebut. Dari hasil penghitungan tersebut dapat dibandingkan baik dari sisi teknis maupun ekonomis kedua met ode ini.
Sebagai langkah akhir dari tugas akJ1ir ini adalah mencari metoda cathodtc prorectton paling ekonomis yang dapat digunakan dalam perlindungan korosi pada
badan kapal.
Kata kunci : Korosi badan kapal, sacrificial anodes dan impressed current.
Nama NRP
INSTITUT TEKNOLOGI SEPULUII NO PEMBER
FAKULTASTE~~OLOGI KELAUTA~
JURUSAN TEKNIK PERKAPALAN
: huron Rosadi :4101109 501
Dosen Pembimbing I :Wing Hendro Prasetyo AP, ST. M.Sc. 11 : lr. Djauhar Manfaat, MSc, Ph.D.
ABSTRAK Sarjana Teknik S I
CO~IPARISON STUDY OF SACRIFICIAL ANODES WITH IMPRESED CURRENT CARACTERISTIC
FOR SHIP HULL CORROSION PREVENT
Generally, corrosion is the desrucrive attack of a material with its environment. In a ship corrosion not little problem, cause can be reduce the productivity. One solution of the corrosion prevent ship's hull by cathodic protection methode. The kind of cathodic protection is SACP methode (Sacrificial Anodes Cathodic Protection) and ICCP methode (Impressed Current Cathodic Protection).
Some case will be done in the final project, that's estimation zinc anodes needs with its construction, to know economy and technical SACP and ICCP methode. That's all compare both.
For the last step of this final project is get the most economy cathodic protection methode can be use to corrosion protection.
TUGAS t\KJJIR }\at a (}Jenaa,tar
KATA
PEl\GA~TARTugas Akhir merupakan wahana bagi mahasiswa untuk dapat berpikir dan bertindak serta mampu mempertanggungjawabkan secara ilmiah. Sehingga dapat meningkatkan potensi dan kemampuan dasar mahasiswa. Kami sangat bersyukur kepada Allah SWT atas tersusunnya tugas akhir ini. Namun demikian selaku subyek belajar yang senantiasa akrab dengan kesalahan dan kekurangan, perlu kami ucapkan terima kasih kepada semua pihak yang telah membantu dalam bentuk apapun dan senantiasa mendorong sehingga tersusunlah tugas akhir ini dengan ba1k sehingga diharapkan akan memberikan kemajuan ataupun perubahan ke arah yang lebih ba1k dalam pelaksanaan tugas akhir im.
Pada kesempatan ini penulis ingin mengucapkan terima kasih kepada : I. Bapak Jr. Djauhar Manfaat, M.Sc,Ph.D, selaku Kepala Jurusan Teknik
Perkapalan dan pembimbing dalam penyusunan tugas akhir ini.
2. Bapak Wing l lendroprast::tyu M.Eng, sdaku pt:mbimbing dalam penyusunan tugas akhir ini sekahgus penyedia sarana I referensi yang penulis butuhkan. 3. Bapak lr. Triwilaswandio WP, M.Sc, selaku dosen wali.
4. Segenap sivitas akademika Teknik Perkapalan FTK-ITS.
5. Kedua orang tuaku, abah dan ibu mertua beserta keluarga besar di Tegal yang telah memberikan nasehat, semangat dengan penuh kesabaran bagi penulis demi selesainya tugas akhir ini.
6. Istriku tercinta Faridah Kumiasari dan anakku yang masih dalam rahimnya, doa dan dukungan kalian membuat penulis lebih kuat menghadapi semuanya.
TUGAS AKHIR ]\ata (Pennamar
7. Komunitas Mulyosan BPD Kav. 2C, yang telah membenkan banyak arti hidup (kenangan tni ttdak akan terlupakan).
8. Segenap karyawan PT PAL Indonesia, mas Isya (Kartmi Utama), mas Anam (IT A TS), Fatah, yang telah bersedia meluangkan waktu untuk membantu penulis menyelesaikan tugas akhir ini.
9. Semua teman-teman se-kampus ITS baik yang satu jurusan maupun yang beda jurusan yang tidak bisa disebutkan satu per satu.
10. Semua pihak baik yang langsung maupun yang tidak langsung yang telah turut serta dalam penulisan tugas akhir im.
Akhimya dengan segala harapan semoga tugas akhir mi bemanfaat bagi kemaJuan dan perkembangan ilmu pengetahuan dan teknolog1.
v
Surabaya, Juli 2003 Penyusun,
TUGAS AKHTR Vaftar lsi
D
AFTA
R l
S
I
Hal Halaman Judul ... i Lembar Pengesahan ... .. . ... ... ... ... ... ... ... ... ... . .. ... ... ... ... ... . .. ... . .. ... ... .... ii Abstrak ... iii Kata Pengantar ... iv Daftar lsi . . . viDaftar Gam bar ... vii
Daftar Tabel ... ix
Daftar Notasi... .. . .. . .. . . .. .. . .. . . .. .. . .. . .. . .. . . .. .. . .. . .. . .. . .. . .. . . .. .. . .. . .. . .. . .. . ... x
BABI PENDAHULUAI\
1.1. Latar Belakang ... 1-1 1.2. Tujuan Penelitian ... 1-2 1.3. Tujuan Penelitian ... I-2 1.4. Manfaat Penelitian ... 1-2 1.5. Batasan Masalah ... I-2 1.7. Metodologi Penelitian ... 1-3 1.8. Sistematika Penulisan ... I-5
BAB II TINJAUAN PUSTAKA
2.1. Deft nisi Korosi . .. . . . .. . . . .. . . .. . . .. . . . .. .. . . .. .. .. . . .. . . .. .. . . .. . .. ll-1 2.1.1. Dasar Teori Kimia Terjadinya Korosi ... ll-2 2.1.2. Dasar Teori Listrik Terjadinya Korosi ... U-4 2.1.3. Teori Elektrokimia Pada Proses Korosi... . . 11-4 2.2. Korosi Galvanik ... II-5
2.2. I. Pengertian Korosi Galvanik . . . .. . .. . .. . . .. .. . .. .... . . .. . .. . .. . Il-5 2.2.2. Mekanisme Terjadianya Korosi Galvanik .. . .. . .. . .. . .. . .. . II-6 2.2.3. Deret Galvanik .. . . .. .. . .. . .. . .. . . .. .. . .. . . .. .. . .. . . .. . Il-8 2.2.4. Mekanisme Korosi Oalam Medium Elektrolit .. . ... ... ... 11-10 2.2.5. Faktor-Faktor Yang Mempengaruhi Korosi
Galvanik... ... .. . .. . . .. . . .. .. . . .. .. . 11-12 2.3. Polarisasi ... Il-14
TUG AS AKI HR ([)ajtar lsi
2.5. Pengendalian Korosi ... II-17 2.6. Perlindungan Badan Kapal.. ... ll-18
BAB III KARAKTERISTIK PERLINDUNGAN KA TODIK
3.1. Perlindungan Katodik ... I Il-l 3.2. Metode Anoda Turnbal (Sacrificial Anode Cathodic Protection) III-2 3.2. l. Mekanisme . . . .. . . III-2 3.2.2. Perancangan Anoda. . . . lll-3 3.2.3. Karakteristik Anoda Tumbal . . . .. . . .. . . .. . . .. . . . IIl-5 3.3. Metode Arus Terpasang (ICCP) ... III-8 3.3.1. Mekanisme ... 111-8 3.3.2. Anoda Yang Dapat Dipakai... ... ... ... . . ... . .. .. . ... .. . ... III-9 BAB IV ANALISA TEKNIS
4.1. Metode Anoda Tumbal (SACP). .. ... ... ... ... ... . .. ... ... ... .. IV-I 4.l.l. Faktor-Faktor Penentu Jumlah Anoda .. . . .. .. . .. . ... ... . . IV-1 4.1.2. Penentuan Kebutuhan Jumlah Anoda ... IV-8 4.1.3. Metode Pemasangan . .. ... .. . ... ... .... ... ... ... .. . ... .. ... . IV-25 4.2. Metode Arus Terpasang (ICCP) ... IV-28 4.2.1. Sistem ICCP .. . ... .. . ... ... . .. .... ... . .. ... .. . .. . .. .. . .. . . ... ... IV-28 4.2.2. Komponen-Komponen ICCP ... ... .. . ... .. . .. .. .. . ... .... ... IV-29 4.2.3. Metode Pemasangan .. . .. . ... . .. ... ... ... .. . .. .. .. . .. . .... ... lV-32 BAB V ANALISA EKONOMlS
5. 1. Pendahuluan ... V -1 5.2. Biaya Sistem Anoda Tumbal ... V-2 5.3. Biaya Sistern Arus Terpasang ... V-5 5.4. Perbandingan Biaya ... V-7 BAB VI KESIMPULAN DAN SARAI\
6.1. Kesimpulan ... VI-I 6.2. Saran ... Vl-2 OAFTAR PUST AKA
LAMPIRAN
TUGAS AKIIIR
(0ajtar ~·am oar
D
A
FT
A
R GA
~IBARHal Gambar 1.1. Diagram alir metodologi penelitian ... 1-4 Gam bar 2.1. Sel batere dan sel korosi . .. ... ... .. . ... ... . .. . .. . .. . .. . .. . .. .. .. . 11-4 Gambar 2.2. Proses korosi pada media asam ... ... ... ... ... ... ... ... ... ... . fl-7 Gambar 2.3. Mekanismc clcktrokoimia bcsi dalam larutan NaCI tanpa
aerast ... ... ... . ... ... ... ... . . . ... ... .. ... ... ... .... .. ... . .... ... 11-10 Gam bar 2.4. Diagram evans dari pasangan dwilogam besi dan seng ... 11-14 Gam bar 2.5. Polarisasin aktifasi ... Il-16 Gam bar 2.6. Polarisasi konsentrasi .. .. .. .. .. . .. .. .. . .. .. .. .. . .. . . .. . .. ... .. ... ll-17 Gam bar 3.1. Sel korosi basah . .. . .. .. . .. . .. . .. . .. .. .. . . .. . .. . .. . .. . .. . . .. . .. .... Ill-2 Gam bar 3.2. Beberapa bentuk anoda tumbal .. . .. . .. . ... .. . .. ... .. .. . .. .. .... .. lll-3 Gambar 4.1. Peletakan anoda tumbal pada bagian stern ... JY-26 Gam bar 4.2. Diagram blok sistem ICCP .... ... .. .... ... .. . ... .. . ... ... ... IV-29 Gambar 4.3. Diagram blok rectifier... IV-30 Gam bar 4.4. Pemasangan elektroda referensi .. . . .. . .. . . .. .. . . .. .. .... . ... IV -32 Gam bar 4.5. Penempatan anoda ICCP pada kapal .. . .. . ... .. . ... ... ... ... .. IV-32 Gam bar 5.1. Grafik perbandingan biaya proteksi katodik . . . .. Y-l 4
TtJGAS AKHIR
1Dajtar?a6cf
DAFTAR TABEL
Hal Tabel 2. I. De ret elektromotive logam .. . .. . .. . .. . .. .... .. .. . .. . .. .. .. . .. . .. .. . 11-9 Tabel 2.2. Perubahan berat besi dan seng yang dikopel dan tanpa
dikopel ... II-13 Tabel 2.3. Pcrbandingan beberapa anoda tumbal untuk proteksi katodik 11-23 Tabel 4.1. Konstanta k 1 dan k2 untuk perhitungan faktor coating
breakdown... IV-3 Tabel 4.2. Kerapatan arus dalam Aim~ ... IV-4 Tabel 4.3. Kebutuhan anoda Zn pada kapal Caraka Jaya Niaga Ill ... ... IV-14 Tabel4.4. Kebutuhan anoda AI pada kapal Caraka Jaya Niaga Ill ... IV-15
Tabel4.5. Kebutuhan anoda Zn pada kapal Palu Sipat ... IV-16
Tabel 4.6. Kebutuhan anoda AI pada kapal Palu Sipat .. . .. . .. . . .. . .. .. . ... IV -17 Tabel4.7. Kebutuhan anoda Zn pada kapal DCV ... IV-18 Tabel 4.8. Kebutuhan anoda AI pada kapal DCV . .. . .. .. . .. .. .. . . . .. . . .. . . ... lV -19 Tabel 4.9. Kebutuhan anoda Zn pada kapal OHBC ... ... .. . ... .. . ... ... IV-20 Tabel 4.1 0. Kebutuhan anoda AI pada kapal OHBC .. . . .. . .. .. . ... ... .. .... IV -21 Tabcl 5.1. l3iaya pcmakaian anoda Zn pada Kapal Caraka Jaya Niaga Ill . V-3 Tabel 5.2. Biaya pemakaian anoda AI pada Kapal Caraka Jaya Niaga Ill . V-3 Tabel 5.3. Biaya pemakaian anoda Zn pada Kapal Palu Sipat ... V-3 Tabel 5.4. Biaya pemakaian anoda AI pada Kapal Palu Sipat ... V-4 Tabel 5.5. Biaya pemakaian anoda Zn pada DCV ... V-4 Tabel 5.6. Biaya pemakaian anoda AI pada DCV ... V-4
TUGAS AKIIIR •Dajtar'la6e(
Tabel 5.7. Biaya pemakaian anoda Zn pada OHBC ... V-4 Tabel 5.8. Biaya pemakaian anoda AI pada OHBC ... V-5 Tahel 5.9. Biaya pemakaian anoda Zn pada kapal Caraka Jaya Niaga Ill
dalam 15 tahun ... V-7 Tabel 5.10. Biaya pemakaian anoda AI pada kapal Caraka Jaya Niaga Ill
dalam 15 tahun . . . .. . . Y-8 Tabel 5. I I. Biaya pemakaian anoda Zn pada kapal Palu Sipat dalam
15 tahun ... V-8 Tabel 5.12. Biaya pemakaian anoda AI pada kapal Palu Sipat dalam
15 tahun ... . . . .. . .. . . .. . .. . .. . .. . .. . . .. . .. . .. .. . . Y-9 Tabel 5.13. Biaya pemakaian anoda Zn pada kapal DCY dalam 15 tahun. Y-10 Tabel 5. 14. Biaya pernakaian anoda AI pada kapal DCV dalam 15 tahun. V-I 0 Tabel 5.15. Biaya pemakaian anoda Zn pada kapal OHBC dalam I 5 tahun V-I I Tabel 5.16. Biaya pemakaian anoda aL pada kapal OHBC dalam 15 tahun V-12 Tabcl 5.17. Biaya opcrasi ICCP pada kapal Caraka .laya Niaga Ill
dalam 15 tahun ... Y-13 Tabel 5. I 8. Biaya operasi ICCP pada kapal Palu Sipat dalam
15 tahun ... ... ... ... ... ... ... ... ... ... ... ... ... ... ... ... ... ... ... V-14 Tabel 5.17. Biaya operasi ICCP pada kapal DCY dalam I 5 tahun ... .. . ... Y-15 Tabel 5.17. Biaya operasi ICCP pada kapal OHBCdalam 15 tahun . .. . .. ... V-16 Tabel5.17. Perbandingan biaya proteksi katodik ... V-17
TUGAS AKHIR
(J)ajtar :Notasi
DAFT AR NOTASI
A : Ampere/ampere meter. ? Luas (m-). AI : Alumunium. B : Lebar kapal CA : Kapasitas anoda. CD : Rapat arus.
oc
:
Derajat celcius. d : diameter.OFT : Dry Film Thickness I ketebalan film basah. DNV : Det Norske Veritas
ft.: . faklor t.:oating breakdovm. Fe : Besi.
H : Hidrogen. h : Tinggi.
HCI : Hidrogen clorida. H20 :Air.
: Arus.
ICCP : lmmpresed Current Cathodic Protection I metoda arus terpasang.
L : Panjang.
Lpp : Panjang antara dua garis tegak m :Massa.
NaCI : Natrium clorida.
PE : Propeller efect I efek propeler. R : Tahanan anoda.
SACP :Sacrificial Anode Cathodic Protection I metoda anoda turnbal. SCE : Saturated Calomel Electrode I elektroda kalomeljenuh.
: Tahun. T : Sarat kapal.
TUGAS AKHIR ([)ajtar :Notasi
u : Faktor utilisasi. V : Driving potential.
WSA : Wetted Surface Area /luas pennukaan basah. W : Berat anoda.
w :Lebar. Zn : Zink.
p : Resistivitas air laut.
BAB I
'TUGAS AKHIR <Pefl(faftu{uan 1.1. Latar Belal<ang 1- I BABI
P
E
NDAH
ULUA
N
Pembangunan suatu kapal haruslah mcmcnuhi standar yang ditentukan,
terutama yang berkaitan dengan aspek keamanan dan keselamatan. Merupakan
suatu kenyataan yang kurang menguntungkan berhubung kapal laut yang kebanyakan terbuat dari b~ja harus beroperasi di laut yang merupakan media korosif, sehingga baja akan sangat rentan terhadap serangan korosi. Oleh karena itu untuk menghambat laju korosi ini perlu dilakukan beberapa upaya. Upay a-upaya tersebut meliputi : pcmberian lapisan pelindung (coatmg), anoda tumbal (wcr{/lcwl cmocles), dan pemberian potensial perlindungan katodik (impressed current). Dewasa ini banyak kapal yang mcnggunakan anoda tumbal (sacrificial anode.\) untuk pengendalian korosi badan kapal, padahal selain anoda ttunbal
masih ada metode yang lain yaitu potensial perlindungan katodik (impressed c.:urre111), tapi untuk metode potensial perlindungan katodik jarang digunakan pada kapal yang dirancang di Indonesia. Oleh karcna itu untuk mengctahui metode apa yang lebih ekonomis dan menguntungkan dalam mengendalikan proses korosi
pada badan kapal maka diperlukan analisa dan perbandingan baik dari sisi teknis
maupun dari sisi ekonomis antara anoda tumbal (sacrificwl anode) dengan potensial perlindungan katodik (impressed current) untuk pencegahan proses korosi yang terjadi pada badan kapal.
TUGAS AKHIR Petufafiu(uau
1.2. Tujuan Penclitian
I-2
Tujuan dari tugas akhir ini adalah untuk meningkatkan performansi kapal terutama dalam hal pencegahan korosi badan kapal dengan cara :
melakukan anallsa dan perbandingan antara metode sacr{/tcral anodes dan Impressed current dari sisi teknis.
melakukan analisa dan perbandingan antara metode sacrrjicral anodes dan impressed current dari sisi ekonomis.
1.3. Manfaat Penelitian
Manfaat yang diharapkan dari tugas akhir 1111 adalah mendapatkan informasi sebagai pertimbangan dalam hal pemilihan metode untuk pengendalian
korosi badan kapal yang paling ekonomis antara sacr~ficral anode cathodrc
protect ron dengan unpressed current cathod1c protect ron. 1.4. Permasalahan
Manakah yang lebih ekonomis antara sistem anoda tumbal (SACP) dan sistem
arus terpasang (ICCP) pada pencegahan korosi badan kapal? 1 .5. Bat.asan Masalah
Untuk mencapai tujuan penelitian maka dalam tugas akhir ini dilakukan
batasan masalah yang meliputi :
Kapal yang digunakan adalah Caraka Jaya Niaga lll, Palu Sipat, OCV dan
OHBC.
Dua anoda tumbal yang sudah diklaskan BKI. Satu jenis ICCP.
Satu kategori coating.
TLJGAS AKI IIR ·l'ctu{afiu(ua n
1.(,. ~lctodologi Pcnclitian
1-3
Mctodc pcnclittan yang digunakan dalam tugas akhir ini mcltputi langkah
-langkah scbagai bcrikut :
- /Jemifikus/ ma.,aluh
Yaitu mencntukan masalah apa saja yang timbul di dalam rncncntukan mctodc
yang cocok antara .\acr~fu;w/ anodes dan m1pressed current.
- SruJi literafur
Dalarn hal ini mencari litcratur yang bcrhubungan dengan mctodc sucnjicwl
anode dan metode llll[JresseJ current scrta mctodc - metodc lain yang ada
kaitannya dcngan pcnccgahan korosi pada badan kapal.
- /'ellJ!,WIIjJ/1/UJt dotu
Pcngumpulan data dipcrlukan scbagai pcnunjang di dalam 111\.!ncapm tujuan
pcnclit1an. Sebagai contoh data-data tcrscbut mchputi : Data kapal Caraka Jaya Niaga I II, Palu Sipat.,DCV dan OIIBC, teknik pcmakaian anoda tumbal , teknik pcmakaian lCCP, dan Pcrhitungan JO dan tarip standar yang dimiliki PT. PAL Indonesia.
- Anal is a claw
Dari data yang dikumpulkan kcmudian dilakukan analisa data guna
mcndapatkan faktor yang mcmpcngaruhi pcrbcdaan 1-.araktcristik dan
mcmbandingkan dari scgi ckonomis kcdua mctodc tcrscbut.
- Kesimpulun dun samn
Dari hast! anaiJsa dapat diambil kcputusan pcnycbab pcrbcdaan karaktcnsttk
kedua mctodc pcrlindungan tcrscbut schingga dapat scbagai pcrtimbangan
TUGAS AKHIR QJe II
a
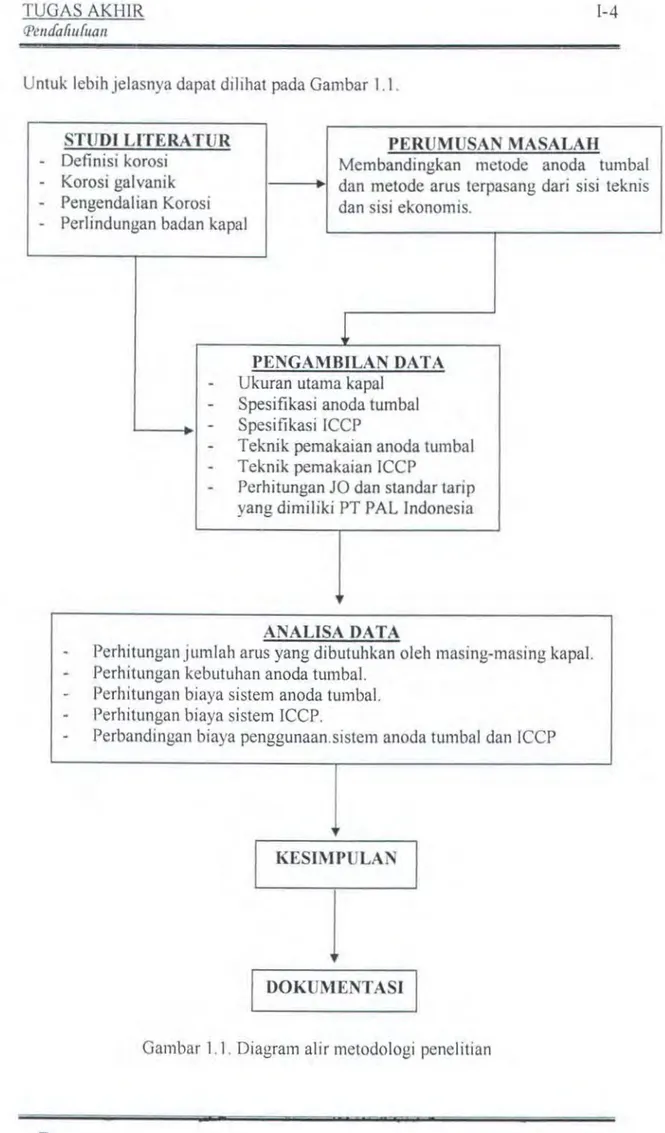
a fi II (u a IIUntuk lebih jelasnya dapat dilihat pada Gam bar 1.1.
l-4
STUDI LITERATUR - Definisi korosi
- Korosi galvanik - Pengendalian Korosi
PERUMUSAN MASALAH
Membandingkan metode anoda tumbal
r---+•1 dan metode arus terpasang dari sisi teknis dan sisi ekonomis.
- Per1indungan badan kapal
PENGAMBILAN DATA - Ukuran utama kapal
- Spesifikasi anoda tumbal .____ _ _ ... - Spesifikasi ICCP
- Teknik pemakaian anoda tumbal
- Teknik pemakaian ICCP
- Perhitungan JO dan standar tarip
yang dimiliki PT PAL Indonesia
ANALISA DATA
Perhitungan jumlah arus yang dibutuhkan oleh masing-masing kapal. Perhitungan kebutuhan anoda tumbal.
Perhitungan biaya sistem anoda tumbal. Perhitungan biaya sistem ICCP.
Perbandingan biaya penggunaan.sistem anoda tumbal dan !CCP
KESIMPULAN
l
DOKUMENTASITUGAS AKI-IIR 'i)waafiu(uan
1.7. Sistcmatika Pcnulisan
. '."'
1-5
Sistcmatika pcnulisan yang digunakan di dalam tugas akhir 111i mcliputi :
- Bab I. Pcndahuluan.
Mcliputi latar bclakang, tujuan pcnclitian, manfaat pcnclitian, butasan masalah,
mctodologi pencliuan, dan sistematika pcnultsan.
- Bab II. Tinjauan Pustaka.
Meliputi teori tcntang korosi, polarisasi, dan mctode yang digunakan dalam
pcngendal ian korosi badan kapal.
- Bah Ill. Karaktcristik Pcrlindungan Katodik.
Mcliputi pcrlindungan katodik. sacrific~al anoda. dan ICCP. - Bab IV. Analisa Tcknis.
Pcnganalisaan tcknis pada mctodc SACP tnaupun JCCP.
- Bab V. Analisa Ekonomis.
Pcnganali~aan ckonom.ts pada mctodc SACP maupun JCCP.
- Bab VI. Kcsimpulan dan Saran.
Pcnarikan kcsimpulan dari analisa yang tcluh dilakukan baik analisa tcknis
maupun analisa ckonomis dan mcmbcrikan saran agar tugas akhir ini bisa dikcmbangkan untuk tujuan yang akan datang.
BAB II
TINJAUAN PUSTAKA
TUGAS AKHIR 'Tinjauatt (]>ustalig 2.1. Definisi Korosi II- I BABII TINJAUAN PUSTAKA
Korosi adalah penurunan mutu logam akibat reaksi elektrokimia dengan
lingkungannya [Chamberlain, 1991]. Korosi berkaitan dengan logam, sedangkan
logam adalah suatu material yang mempunyai jenis ikatan yang khusus yang
membuat logam mempunyai sifat-sifat tersendiri dan berbeda dengan bahan-bahan lain bukan 1ogam.
Penurunan mutu logam tidak hanya me1ibatkan reaksi elektrokimia yaitu
antara bahan-bahan bersangkutan terjadi perpindahan e1ektron. Karena e1ektron
adalah sesuatu yang bermuatan negatif, maka pengangkutannya menimbulkan
arus listrik, sehingga reaksi dipengaruhi oleh potensial1istrik.
Pada umumnya baja karbon akan mengalami korosi pada setiap
lingkungan atmosfer bi1a kelembaban relatif melebihi 60%. Begitu butir-butir air
pada permukaan terbentuk, maka korosi akan terjadi dengan kecepatan yang dipcngaruhi bcbcrapa faktor antara lain : kandungan oksigcn, pi I, scrta kandungan ion-ion agresif.
Lingkungan adalah sebutan paling mudah untuk mewakili semua unsur
sekitar logam terkorosi pada saat reaksi korosi berlangsung. Lingkungan yang dimaksudkan diantaranya adalah lingkungan berwujud gas (-I0°C s.d. +10°C), bahan yang terendam dalam air bebas, tanah dan mineral-mineral yang terlarut
"~~·' !1'\ Ph~t-\151A~.,. ·
tN';; TITU l Tf:,._NrJ! r)l.il
TUGAS AKIIIR
~'[injauan PustaK.g
II- 2
akan mcmbentuk elektrolit yang bersifat menghantarkan arus listrik [Chamberlain, 1991
J.
Proses korosi dapat diterangkan melalui konsep sel korosi sederhana. Pada konsep korosi sel sederhana terdapat empat faktor yang harus ada secara bersamaan, untuk berlangsungnya proses korosi yaitu :
a. Anoda, yang merupakan bagian yang terkorosi dan akan melepaskan elektron-elektron dari atom-atom logam netral membentuk ion-ion. b. Katoda, bagian yang biasanya tidak mengalami korosi walaupun
mungkin menderita kerusakan-kerusakan.
c. Elektrolit, merupakan istilah yang diberikan pada larutan yang
bersifat menghantarkan listrik. Larutan ini biasanya mempunyai
harga konduktivitas tertentu.
d. llubungan listrik, dimana antara katoda dan anoda harus ada
hubungan listrik agar arus didalam sel korosi dapat mengalir. Hubungan secara fisik tidak diperlukan jika anoda dan katoda merupakan bagian dari logam yang sama.
2.1.1. Dasar Teori Kimia Terjadinya Korosi
Dalam reaksi kimia korosi terjadi akibat adanya reaksi reduksi dan oksidasi (redoks) antara material dengan lingkungannya. Media utama adalah air (H20) yang merupakan molekul netral dan bersifat reversihle, dimana kedua jenis atotn yang terkandung didalam molekul air sewaktu-waktu dapat berubah menjadi atom-atom semula, lebih jelasnya dapat dilihat dalam rcaksi 2.1.
TUGAS AKHIR
Tltifauan fPu.staf(st
II- 3
Sebagai contoh adalah reaksi baja di udara terbuka atau yang tercelup
dalam air. Terjadinya korosi pada baja yang dicelupkan air dikarenakan atom-atom togam mengalami pelepasan elektron sehingga terbentuk ion logam.
Fe -7 Fe2+ + 2e· ... 2.2
Reaksi 2.2. disehut reaksi anodik atau oksidasi. Sedangkan apabila baja tersebut
berada pada udara terbuka yang mengandung uap air maka udara dengan air akan
mengalami reaksi katodik yang disebut reaksi oksigen seperti dibawah ini:
02
+
OH + 4e· -7 4 OT-r ... 2.3 Dalam larutan asam, reaksi reduksinya adalah evolusi hidrogenH+ + e· -7 H ... 2.4
1-1 + H -7 H2 ... 2.5 Pada baja-baja yang tecelup dalam air taut, ion-ion Cr dan Na + tidak ikut
bereaksi, sebagai hasil adalah penggabungan reaksi anodik dan katodik adalah
sebagai berikut:
2Fc + 21-hO + 02 -7 2Fe2+ + 401--r -7 2Fc(OH)2 ... 2.6 Senyawa hasit reaksi 2.6. diatas disebut senyawa karat atau garam ferro. Kondisi ini menurut reaksi kirnia tidak akan stabil jika terus mencrus berada di udara
terbuka atau di air taut. Senyawa ini akan bereaksi lebih tanjut membentuk garam ferrit yaitu:
2Fe(OH)2 + 2H20 + 02 -7 2Fe(OH)3 ... 2. 7
Dari reaksi 2. 7. diatas dapat ditarik kesimpulan jika baja mengalami korosi maka
TUGAS AKH!R
IJinjauan Cf'ustak.g
2.1.2. Das~u· Tcori l.istrik Terjad inya Korosi
ll- 4
Semua material mempunyai muatan listrik statis yang besarnya bervariasi.
Bila ada dua benda dengan muatan listrik yang berbeda d1hubungkan secara
elektris, dicelupkan kedalam larutan elektrolit dan dihubungkan dengan konduktor, maka akan terjadi ali ran listrik dan ali ran elektron.
Pada sel batcre kutub positip disebut anoda dan kutub negatip disebut
katoda. Kebalikannya dalam sel korosi, kutub positip disebut katoda dan kutub
negatip disebut anoda,seperti dalam Gambar 2.1.
Aliran elektron AI iran dcktron
Anoda(+) Katoda (-)
Larutan Elektrolit
Anoda (-) Katoda (+)
Gam bar 2.1. Sel batere dan sel korosi
2.1.3. Tcori Elektrokimia Pada Proses Korosi
Reaksi elektrokimia adalah reaksi yang melibatkan arus elektron/arus
listrik atau reaksi yang didalamnya terdapat reaksi redoks. llampir seluruh proses
korosi yang terjadi pada logam melibatkan perpindahan elektron.
Contoh reaksi elektrokimia adalah reaksi antara Zn dan HCI yang ditunjukan pada reaksi 2.8. berikut:
TUGAS AKHfR
Tznjauan &talig
rr-
s
Zinc bereaksi dengan larutan asam membentuk zinc chloride serta membebaskan
gelembung-gelembung gas hidrogen pada permukaan. Bentuk reaksi ioniknya
adalah:
Zn +2ft+ 2Cr -7 Zn2
+ + 2Cr + H2 ... 2.9
Setelah menghilangkan
cr
dari kedua sisi reaksi diperoleh :Zn +· 2ft -7 Zn2+
+
H2 ... 2. I 0Bila diuraikan, reaksi diatas terdiri atas :
Zn -7 Zn2+ + 2e· reaksi anodik ... 2.11 reaksi katodik ... 2.12
Pada reaksi anodik valensi Zn meningkat dari 0 menjadi + l dengan melepaskan
elektron, reaksi ini disebut juga oksidasi. Sedangkan pada reaksi katodik bilangan
oksidasi hidrogen turun dari + 1 menjadi 0 dengan mengkonsumsi elektron, reaksi
ini disebutjuga reaksi reduksi.
2.2. Korosi Galvanik
2.2.1. Pengertian Korosi Galvanik
Korosi Galvanik (Bimetallic Corrosion) atau disebut juga dissimilar metal
adalah suatu proses korosi logam yang tidak sejenis yang tergandeng (coupled)
dan membentuk sebuah sel korosi basah sederhana dalam suatu media elektrolit.
Dan dari proses tersebut, terjadilah korosi yang disebabkan karena perbedaan
potensial dari kedua logam itu [Chamberlain, 1991].
Biasanya kita dapat mengenali daerah-daerah pada permukaan logam yang
terkorosi, dan tempat reaksi-reaksi anoda dan katoda dimana masing-masing
TUGASAKHIR
'IVlj01U11l CJ>usta/(g
II- 6
terkorosi dengan melepaskan elektron-elektron dari atom-atom logam netral untuk membentuk ion-ion yang bersangkutan. Ion-ion ini mungkin tetap tinggal dalam larutan atau beraksi membentuk hasil korosi yang tidak larut.
Sedangkan katoda biasanya tidak mengalami korosi, walaupun menderita kerusakan dalam kondisi-kondisi tertentu. Dua reaksi yang penting dan umum
yang mungkin terjadi pada katoda, tergantung pada pH larutan yang bersangkutan,
seperti contoh dibawah ini [Chamberlain, 1991] :
l. PH < 7: H+ + e-
-7
HH
-7
H2 (gas)2. PH ~ 7 : 2H20 + 02 + 4e-
-7
40H- ... 2.13Perbedaan potensial antara dua Iogam yang berbeda dan berkontak
(terhubung secara kontak listrik) ketika tercelup dalam elektrolit, akan
menyebabkan elektron mengalir diantara kedua logam tersebut, sehingga
terjadilah korosi. Bahan yang mempunyai ketahanan korosi yang rendah akan
lebih rentan terkena korosi dari pada logam yang mcmpunyai ketahanan korosi
yang lebih tinggi. Bahan dengan ketahanan korosi lebih rendah disebut anoda, sedangkan Ia gam dengan kondisi sebaliknya disebut katoda [Chamberlain, 1991].
2.2.2. Mekanisme Terjadinya Korosi Galvanik
Prinsip korosi logam tidak sejenis atau sering disebut korosi galvanik merupakan dasar untuk memahami semua bentuk korosi yang lain. Untuk lebih menjelaskan tentang korosi galvanik tersebut, maka diberikan salah satu bentuk reaksi korosi yang dapat mewakili korosi galvanik, yaitu korosi logam yang
TUGAS AKIIIR Tinjauan Pustaf:g
H- 7
tetjadi pada logam dtkopel dengan korosi logam yang tanpa dtkopel atau bebas dapat dilihat pada Gam bar 2.2.
e Fe Cl "--..
/
Ch
Cl a Fe Zn Cl~ CJ., C l / -Cl~Z
2+ - --... n Z 2+ ---... .. n bGam bar 2.2. Proses korosi pada media asam.
(a) Korosi logam bebas (b) Korosi logam yang dikopel
[Morgan, 1987].
Dari Gambar 2.2 (a) diatas terlhat bahwa sebenamya korosi terjadi pada
logam tunggal, misalnya pada besi (Fe) yang mengalami korosi akibat perbedaan
potensial lokal yang dimilikinya. Perbedaan potensial tersebut dapat berasal dari
batasan dari butiran, 1mpurity, fasa-fasa, dan bagian lainnya. Dengan demikian
terbentuklah suatu anoda dan katoda lokal pada pennukaan logam tersebut, dan
selanjutnya terjadi aliran elektron dari anoda ke katoda diikuti oleh oksidasi dari
anoda lokal. Pada suatu keadaan tertentu besi akan terkorost sampai habis, dan ini
teiJadi hila besi dicelupkan dalam Natrium klorida pekat . Hal ini dimungkinkan karena tak ada bagian-bagian besi yang sama. Apabila suatu anoda lokal habis
terkorosi, maka bagian sisa katoda lokal menjadi anoda dan katoda lokal baru,
demikian proses ini berlangsung terus menerus sampai besi benar-benar habis [Morgan, 1987].
TUGAS AKHIR
'Iinjauan <Pustalig
II- 8
Sedangkan Gambar 2.2.(b) terlihat bahwa besi (Fe) sebagai katoda yang terkopel, dengan seng (Zn) sebagai anoda, aliran elektron tidak hanya terjadi menuju katoda lokal, tetapi lebih besar lagi akan mengalir ke logam katoda. Hal ini disebabkan karena keduanya mempunyai perbedaan potensial yaang besar
akan mengalami reaksi diatas (korosi) apabila kedua logam tersebut diletakan
dalam suatu media elektrolit yang sama dan setempat.
Akibat kenyataan chatas, besi dalam keadaan dikopel dengan seng
(galvanik kopel) akan mengalami ketahanan korosi yang lebih baik dibandingkan
dengan besi yang tidak dikopel.
2.2.3. Deret Galvanik
Deret galvanik mempunyai manfaat praktis yang besar sekali karena
memungkinkan kita untuk memperkirakan secara cepat hambatan korosi pada
suatu gandengan logam yang tidak sejenis.
Deret galvanik menyatakan hubungan antara logam yang satu dengan logam yang lainnya dan dibuat dari hasil perbandingan kualitatif atas aktivitas logam-logam yang memuat infonnasi baik mengenai logam murni maupun
paduan pada kondisi-kondisi temperatur, tekanan dan elel>..'1rolit sembarang
(meskipun tertentu). Dan seperti keterangan diatas, bahwa korosi galvanik timbul
akibat perbedaan potensial yang dimiliki oleh setiap bahan logam. Oleh karena
itu, dibuat tentang standar potensial dari beberapa bahan. Potensial yang digunakan untuk keperluan diatas adalah hidrogen (H2 /W), artinya potensia1
TlJG/\S 1\KIIIR
!Ju~jauan (J)ustak~z
Tabd 2. I. De ret Elcktomoti
r
Logaml
Chandler, 19851.Jon logam pada kcsctimbangan E1cktroda potcnsia1 vs dcktroda
( lJnit/\ktilitas) hidrogl!n normal puda ~5°C, volt
---.-:---t--- -
1\u- Au,... 1 I .~98 Pt Pt2 -j Pb -Pb2 +-S n -S n :!+ Ni - Ni2+ C r -C' r 11 Mg- Mg2' Na- Na+ I I,2 I 0,987 I 0,799 I 0,788 I 0,377 0,000 -0,126 -0,136 -0,250 -0,277 -0,403 -0,440 -0,744 -0,763 -1,662 -2,363 -2,714 -2,925 II- l)TUGAS AKIIIR Tinjauan <Pusta/(g
II- I 0
Pada kenyataan, umumnya korosi galvanik terjadi pada logam-logam
paduan. Oleh karena itu, untuk memperkirakan kehadiran korosi galvanik yang
lebih akurat, diperlukan tabel deret galvanik diatas dengan melihat harga elektroda potcnsial vs clektroda hidrogcn pada suhu 25 °C.
2.2.4. Mekanisme Korosi Dalam ~tedium Elcktrolit
Proses clektrokimia dari suatu proses korosi, scbagai contoh dalam reaksi
besi (Fe) yang dicelup dalam larutan Natrium Klorida (NaCI) seperti ditunjukan pada Gambar 2.3. Local katoda Localanoda Fe
cr
1-r Cl:! Unreated NaCIGam bar 2.3. Mekanisme elektrokimia korosi besi dalam larutan NaCI tanpa aerasi [Chandler, 1981).
.>.,#-TUGAS AKHIR
Tmja~um CJ>usU1~
II- II
Medium elektrolit NaCJ yang diGambarkan dalam contoh ini tidak mengandung oksigen terlarut (unareated). Reaksi ini berlangsung cepat, gas
hidrogen dilepas dan Fe terlarut membentuk FeCh. Reaksi yang dimaksud adalah
sebagai berikut :
Fe2+ + 2NaCI-7 FeCI2+ 2Na ... 2.14
Dengan memperhatikan bahwa ion Cl tidak ikut dalam reaksi, maka persamaan dapat disederhanakan menjadi :
Fe+ 2Na+ -7 Fe2+ + 2Na ... 2.15
Dari persamaan diatas, besi bereaksi dengan ion natrium dalam larutan asam membentuk ion Fe2+ dan atom natrium menjadi endapan natrium. Selain itu
reaksi diatas dapat dibagi menjadi 2 reaksi yaitu reaksi oksidasi besi dan reaksi reduksi ion natrium.
Oksidasi (reaksi anodik): Fe -7 Fe2+ + 2e· ... 2.16
Reduksi (reaksi katodik): Na+ + e·-7 Na ... 2.17
Atom-atom Fe diubah menjadi ion besi dan satu elektron ini dikonsumsi
oleh reduksi ion natrium. Persamaan yang telah disederhanakan diatas
mengungkapkan bahwa reaksi adalah merupakan reaksi pembentukan natrium,
yaitu reaksi membentuk ion natrium dari ion natrium yang bermuatan menjadi atom natrium yang netral. Pada tiap kasus korosi yang terjadi, hanya ion natrium
yang aktif, sedang yang lain tidak terlibat dalam reaksi. Hal ini juga berlaku bagi asam-asam yang lain seperti hidrogen, phospor dan lain-lainnya.
TUGAS AKHfR Ttuja ua 11 CF'us t a fig
2.2.5. Faktor-Faktor Yang Mempengaruhi Proses Korosi Galvanik
Tl-12
Pada percobaan reaksi korosi galvanik atau reaksi korosi antara dua logam
yang berbeda, hasil yang diperoleh kadang-kadang kurang seperti yang
diharapkan, hal tersebut dikarenakan beberapa faktor yang rnempengaruhi pada proses terJadmya korosi tersebut. Demikian juga pada pasangan kopel seperti
diatas, laju korosi logam yang terkopel juga dipengaruhi oleh faktor-faktor yang
tersebut sebagai berikut:
• Efek lingkungan korosif.
• Perbedaan potensial antara logam yang dikopel.
• Etek dan luasan benda yang terkorosi.
Dari ketiga taktor diatas, dapat dijelaskan satu persatu seperti dibawah ini, yaitu sebagai berikut:
a. Efek Lingkungan Korosif
Lingkungan korosif yang senng JUga disebut medium elektrolit, sangat
mempengaruhi laju korrosi pada suatu kasus. Pada medium tertentu, semakin
naik laju korosinya dibandingkan dengan medium pengkorosi lainnya pada
kepekatan (konsentrasi) yang sama. Pada umumnya bahan mempunyai
ketahanan !orosi lebih rendah akan menjadi anoda saat dikopel. Tetapi
kadang-kadang potensial akan menjadi terbalik untuk suatu lingkungan
tertentu. Sebagai contoh pengaruh dari lingkungan ini, dapat dilihat pada
Tabel 2.2 dibawah ini yang menunjukan perubahan berat besi dan seng. Jika
besi ini dikopel dengan seng, maka seng akan terkorosi dan besi akan
terlidungi. Hal ini menunjukan bahwa besi Jebih mulia dibandingkan seng.
TUGAS AKHIR
rrt'njauan Cfustafi.sz
11-13
menjadi terbalik sehingga besi menjadi anoda. Hal ini disebabkan karena produk korosi terjadi sering menutupi seng sehingga hal ini menjadikan permukaan seng menjadi lebih mulia dibandingkan dengan besi. Untuk lebih jelasnya dapat dilihat pada Tabel 2.2 Perubahan berat dari besi dan seng yang
tanpa dikopel dan dikopel.
Tabel 2.2. Perubahan berat besi dan seng yang tanpa dikopcl dan dikopel
I
Fontana, 1991).Uncouple Couple
Media korosi Seng Besi Seng Besi
MgS04 0,05M 0,00 -0,04 -0,05 +0,02
Na2S04 0,05M -0,17 -0,15 -0,48 +0,01
NaCI 0,05M -0,15 -0,15 -0,44 +0,01
NaCI 0,05M -0,06 -0,10 -0,13 +0,02
b. Perbedaan potensial yang dikopel.
Bcsarnya bcda potcnsial antara dua logam yang dikopcl akan sangat mcmpengaruhi Jaju korosi galvanik yang tc~jadi. Scmakin besar beda potcnsialnya, maka akan semakin besar laju korosinya dan sebaliknya.
c. Efek luasan.
Besarnya luasan yang terlibat dalam suatu sistem korosi mempengaruhi besarnya kerapatan arus yang mengalir dalam sistem. Sedangkan harga kerapatan arus akan menentukan laju korosi logam tersebul dalam sistem serta potensial korosinya. Akan tetapi polarisasi suatu logam apalagi yang berada dalam sistem terkopel dengan logam lain tidak dapat dipastikan secara linear. Sehingga akan lebih tepat apabila digunakan harga potensial korosi
TUGAS AKIIIR
I'Jinjnuan Pustal(g
11-14
pengkopelan logam dari hasil percobaan yang dilakukan di laboratorium.
Perlu diingat pula bahwa kerapatan arus yang cukup besar akan merusak
sistem proteksi dcngan lapisan cat. Sebagai contoh sulitnya meramalkan
polarisasi logam, akan dapat dilihat dari pcngkopelan bcsi dcngan seng pada
Gambar 2.4.
p -0,6
Polarisasi katodik besi
0 -0,7
1---t e -0 8 ' n s -0 9 ' If
-1,0 Polarisasi katodik scng V -1 I r---=---~---~s '
c
-1,2 Eh.or
(pasangan) -2,5 -2,0 -I ,5 -I ,0 Log arusGambar 2.4. Diagram Evans dari pasangan dwilogam besi dan seng
Pada Gambar tersebut dapat dilihat bahwa polarisasi besi tidak lineaar seperti
yang diharapkan hal tersebut diakibatkan oleh pembentukan hidrogen dari
sekitar -0,9 V SCE hingga lebih rendah dari -0,9 V SCE.
2.3. Polarisasi
Sejak dahulu peycbab terjadinya korosi galvanik adalah perbcdaan potensial
TUGAS AKHrR
tTzltjauan fPzlSta/{p
fl-15
terjadinya korosi tetapi belum dapat memberikan gambaran tentang laju korosi
yang terjadi.
Laju i<orosi yang terjadi memuat pembahasan dahulu, juga dinyatakan
tergantung pada kerapatan arus yang timbul (current denstty). Semakin tinggi kerapatan arus yang timbul, maka korosi akan semakin hebat dan sebaliknya. Karena kedua kenyataan itulah, fenomena korosi dapat dijelaskan dengan pemakaian diagram tegangan fungsi arus yang selanjutnya disebut teknik polarisasi.
Polarisasi dapat digolongkan menjadi dua, yaitu polarisasi aktifasi dan
polarisasi konsentrasi. Tetapi kedua jenis polarisasi tersebut umumnya terjadi
pada suatu reaksi korosi membentuk polarisasi union.
Polarisas1 aktifasi adalah pengontrolan polarisasi oleh aktifasi reaksi pada pertemuan logam dan elektrolit pengkorosif Dengan kata lain, jenis polarisasi ini
dikontrol oleh aktifasi ion-ion dipermukaan logam yang mengalami proses korosi.
Mekanisme polarisasi dapat dijelaskan dengan acuan Gam bar 2.5.
Dari Gambar 2.5 dibawah dapat terlihat bahwa step pertama polarisasi ini
hanya terjadi jika ion hidrogen (H+) ditempatkan pada permukaan logam, sehingga pada pennukaan logam tersebut terjadi kelebihan muatan positif dan
akibat dari hal tersebut adalah elektron bergerak ke tempat tersebut untuk
menetralkan muatan. Akibat dari bergeraknya elektron ke tempat tersebut akan
mengakibatkan ion H+ tereduksi menjadi atom hidrogen, dan selanjutnya dua atom
TUGAS AKH1R (rit!fauan (]>usta~!l H (I)
~
e H+
( 4) H~ (2)i
(3) Hi
( 4) H+Gambar 2.5. Polarisasi Aktifasi [Fontana, 1991
J.
11-16
Bub1e gas
G)
Sedangkan polarisasi konsentrasi adalah polarisasi yang disebabkan oleh difusi ion akibat perbedaan konsentrasi. Hal ini dapat terjadi bila konsentrasi ion
didekat permukaan logam sangat kecil, akibatnya terjadi difusi ion-ion ke permukaan logam. Selanjutnya akibat terkonsentrasinya ion H+ dipennukaan
tersebut maka elektron bergerak ke daerah ini untuk mereduksi ion 1-1+ membentuk
gas hidrogen. Mekanisme polarisasi tersebut dapat dijelaskan pada Gambar 2.6. Dari uraian di atas dapat dinyatakan bahwa laju reduksi yang sangat besar
akan terjadi bila pada daerah dekat permukaan logam sangat sedikit kandungan
ion HT. Laju reduksi pada keadaan tersebut akan meningkat sampai batas tertentu tergantung pada difusi ion hidrogen di pennukaan logam.
TUGAS AKHIR Tinjauan cpu,staR,sl Il-17 H ...
~II,
G)
e H+/
G)
H+·~H,
G)
H+~
Gam bar 2.6. Polarisai Konsentrasi [Fontana, 1991].
Dari keterangan di atas dapat dijelaskan bahwa akibat polarisasi potensial anoda-katoda yang disambung (dikopel), akan mengakibatkan harga potensialnya mengalami perubahan sampai harga tertentu, dan akan berhenti mengalami perubahan apabila besar potensial antar keduanya sama. Arus yang timbul karena pertemuan potensial anoda-katoda tersebut disebut arus korosi.
2.5. Pengendalian Korosi
Korosi telah didefinisikan sebagai penurunan mutu logam akibat reaksi
elektrokimia dengan lingkungannya. Pada kebanyakan situasi, praktis serangan ini tidak dapat dicegah, kita hanya dapat berupaya mengendalikannya sehingga
TUGAS AKHIR
Ttnjauan Cfustaf<g
ll-18
Pengendalian bisa dilakukan dengan berbagai cara, tetapi yang paling penting adalah [Chamberlain, 1991]:
a. Modifikasi rancangan. b. Modifikasi lingkungan. c. Pemberian lapisan pelindung. d. Pemilihan bahan.
e. Proteksi katodik atau anodik.
Upaya-upaya yang sering dilakukan dalam proses pengendalian korosi yang terjadi pada bangunan kapal, khususnya dibawah garis air, dengan cara:
• Pemberian lapisan pelindung (coatmg).
• Anoda tumbal (.~;acrificial anode.\).
• Pemberian potensial perlindungan katodik (impressed current).
2.6. Perlindungan Badan J(apal
Salah satu perlindungan badan kapal adalah dengan cara proteksi katodik, dimana cara ini dibedakan menjadi dua yaitu:
I. SACP (Sacr"!ficial Anodes Cutlwd1c l)rotectum). 2. ICCP (Impressed Current Ca1hodtc J>rvtectwn).
Pacta metode SACP (.)'acr[ficiul Anodes Cathodic t>rotection), proteksi katodik dilakukan dengan cara galvanic coupling, dimana logam yang akan diproteksi dikopel dengan logam yang lebih anodik. Anoda ini disebut anoda tumbal yang nantinya akan terkorosi lebih dahulu. Dalam hal ini Jogam yang ditumbalkan harus mempunyai potensial yang lebih rendah dari logam utama
TUGAS AKHIR
11njauan <Pustal(p
II-19
sehingga yang terkorosi adalah logam tambahan dan logam utama akan terhambat proses kowsinya.
Pemilihan bahan untuk proteksi katodik didasarkan pada pertimbangan teknis dan ekonomis. Tabel 2.3 di bawah ini menunjukan beberapa anoda tumbal yang biasa digunakan dalam proteksi katodik. Dari beberapa jenis anoda tumbal yang ada, magnesium mempunyai unjuk kerja yang lebih baik, karena eftisicnsinya sekitar 50%, harga potensialnya lebih negatif dan memberikan arus keluaran tinggi. Akan tetapi logam ini jarang digunakan karena logam magnesium sulit didapatkan dipasaran dalam bentuk lempengan dan harganya yang relatif mahal. Logam anoda tumbal yang sering dipakai dalam praktek adalah alumunium dan seng karena mudah dipt!ruleh dipasaran dan harganya relatif lebih murah.
Tabcl 2.3. Perbandingan beberapa anoda tumbal untuk proteksi katodik [Fontana, 1991].
Logam Anoda Tumbal
Magnesium Seng Alumunium
Konsumsi Teoritis 23 9 6,5 (Lb/ampere -tahun) Konsumsi Aktual 18 ?-_.) 16-20 ( Lb/ampcre-tahun) Polensia1 vs Cu/CuS04 (mV SSC) -1,7 -I, 15 -1,3
Pada metode ICCP (Impressed ( 'urrem ( 'athodu.; l'rotectwn) atau arus terpasang, perlindungan diberikan dengan jalan menggunakan sumber arus DC
TUGAS AKHIR
Tinjauan Q>ustafi.sr 11-20
yang dialirkan dari luar sistem. Arus ini dialirkan ke logam yang diproteksi melalui anoda dan elel-.irolit, dimana anodanya bolch tidak terkorosi.
Prinsip dasar ICCP adalah pemberian potcnsial lebih negatif, sehingga kondisi logam akan berpindah ke zona kekebalan. Perbedaaan antara zona korosi dengan zona kekebalan semata-mata hanya berpijak pada definisi. Jadi meskipun logam berada pada zona kekebalan, korosi masih bcrlangsung dengan laju yang lcbih rendah. Semakin negatif potensial yang diberikan akan memperlambat reaksi anodik, sebaliknya reaksi katodik justru semakin cepat, akibatnya logam menjadi lebih katodik.
BAB
III
KARAKTERISTIK
PERLINDUNGAN KATODIK
TOGAS AKHIR III- 1
'J(flrafi.Jeri.stif( <Perfuufungall 'J(fltotfif(
BABlli
KARAKTERJSTIK PERLIN DUNGAN KA TOOIK
3.1. Perlindungan Katodik
Suatu material akan mengalami pengkaratan bila material tersebut sebagai
anoda dalam sel galvanik. Sedang material yang bertindak sebagai katoda tidak
akan mengalami pengkaratan. Oleh karena itu pencegahan pengkaratan dapat
dilakukan dengan cara membuat logam yang akan dilindungi tersebut sebagai katoda. Dengan demikian pencegahan pengkaratan pada badan kapal dapat
dilakukan dengan jalan membuat badan kapal bertindak sebagai katoda. Cara
pencegahan pengkaratan diatas adalah pencegahan pengkaratan dengan
mengggunakan perlindungan katodik atau cathodic protection.
Umumnya proses korosi dimulai dengan terbentuknya ion-ion positip (anoda) dari atom bahan yang bersangkutan, yang kemudian dengan pelepasan
beberapa muatan elektronnya. Hal ini terjadi karena adanya perbedaan potensial
antara satu bagian dengan bagian lain dari bahan tersebut. Namun demikian
proses pelepasan atau pengaliran muatan tersebut tidak akan berlangsung apabila
tidak tersedia media pengantar muatan. Elektron akan mengalir dari butiran
negatip ke positip, pada proses tersebut akan terbentuk atom-atom yang
kehilangan elektron yang disebut ion positip. Butir-butir yang yang bermuatan
listrik positip dikenal sebagai penampung elektron yang disebut cathodic,
sebaliknya butir yang bermuatan negatif dikenal sebagai sumber elektron disebut
anodic.
-
--IN .. ;rnuT rtt<~'-'0•.·-'·_,,
TUGAS AKIIIR
1\flrakjeristif(_cPerfindimgan 1\fltotfik_
III- 2
Perlindungan katodik memerlukan jumlah arus yang sesuai untuk
dapat berfungsi dengan baik. Kebutuhan arus ini tidak bisa diramalkan begitu
saja, karena untuk tiap-tiap keadaan pennukaan yang berbeda akan mempunyai
harga yang berlainan.
3.2. Metode Anoda Tumbal (Sacrificial Anode Cathodic Protection)
3.2.1 Mekanisme
Cara yang paling sederhana untuk menjelaskan proteksi katodik, dengan
anoda tumbal adalah dengan menggunakan konsep set korosi basah, seperti dalam
Gambar 3.1. Yaitu bahwa dalam sel, anodalah yang tcrkorosi sedangkan yang
tidak terkorosi adalah katoda.
Hubungan listrik ali an elektron
Larutan elektrolit
1+---1r--- ka toda
ion-ion(+)
Gambar 3. I. Sel korosi basah.
Dalam sistem seperti diatas, korosi terjadi pada anoda jika antara anoda dan
katoda terdapat selisih senergi bebas.
Dengan memanfaatkan pengetahuan tentang derat galvanik pada Tabel 2. I.
untuk memilih suatu bahan, maka lambung kapal yang terbuat dari baja akan
dengan mudah dicari logam yang berlaku sebagai anoda. Dalam pemilihan logam
TUGAS AKHIR III- 3
1\praf<.Jerirtik_ Perfifl([ungan 1\ptodi(
3.2.2. Perancangan anoda
Dalam merancang kebutuhan anoda tidak sederhana, karena banyak hal
yang harus diperhitungkan. Sebagai contoh : Luas relatif anoda dan katoda, laju korosi seng, kcluaran ants akibat korosi seng yang harus cukup untuk menghambat korosi terhadap besi.
Gambar berikut memperlihatkan berbagai bentuk anoda, diamana bentuk juga berpengaruh terhadap I uasnya.
TUGAS AKHIR fll- 4
'l(flrai{JerirtiR,. <Perfindiwgan 'J(ptotfil{_
Anoda tumbal antara lain diukur berdasarkan kapasitasnya, suatu besaran yang menyatakan banyaknya arus kali jam yang dapat dipasok oleh setiap
kilogram bahan. Parameter lain adalah keluaran arus persatuan luas permukaan
terbuka yang dinamakan pengausan (wastage). Yang menyatakan hilangnya
logam dalam satuan volume maupun satuan massa.
Petaku utama depolarisasi datam air taut adatah oksigen. Banyaknya depolarisasi dan kecepatan kejadiannya dan juga kerapatan arus diperlukan bagi
proteksi katodik, yang tergantung pada kadar kontaknya oksigen pada katoda.
Gerakan relative baja pada air !aut memperbesar tingkat kontak. Berbagai
percobaan dengan memakai kecepatan yang berbeda, menunjukkan bahwa
terdapat perubahan yang sangat besar pada kerapatan arus sebanding dengan
perubahan kecepatan, bahkan sebuah kapat yang berlayar bisa memerlukan dua
kali arus yang diperlukan dalam keadaan diam [Morgan, 1987].
Kerapatan arus yang diperlukan untuk proteksi katodik tergantung pada besarnya luasan atau polarisasi permukaan logam dimana elektrolit (air taut) rendah resistivitasnya, coating pada badan kapal memperbesar tahanan dan arus proteksi katodik akan terpolarisasi pada bagian coating yang cacat
[Morgan, 1987].
Terdapat sejumlah ketentuan dari hubungan antara kecepatan dan arus yang
diperlukan dari badan kapal. Namun terjadi kesulitan apabila diterapkan dalam praktek, dimana pada kapal yang bergerak distribusi arus berubah terhadap
perubahan kecepatan. Jika anoda yang ditempatkan pada lambung kapal
TUGAS AKHIR III- 5
'1(fl ra~ristik.}Per(uufu71ga tL '1(fl todil(.
Pada kapal ada dua faktor penyebab hambatan yaitu hambatan bentuk dan
hambatan permukaan, hambatan bentuk menjadi faktor yang berhubungan dengan
kecepatan kapal, sementara hambatan permukaan berhubungan dengan hambatan
pada bagian badan kapal yang tercelup. Pada tanker berukuran besar umumnya
yang menjadi komponen utama yang menimbulkan hambatan gesekan bagi
lambung adalah hila permukaan kasar akibat korosi fMorgan, 19871.
Total arus yang diperlukan untuk melindungi sebuah kapal tidak hanya
tergantung pada kecepatannya saja, tetapi juga kondisi cat. Disamping itu kapal
juga berlayar pada kondisi peairan yang bervariasi. Sehingga perancangan
proteksi katodik memerlukan pertimbangan teknis yang baik [Morgan, 1987].
Faktor lain yang berpengaruh terhadap penggunaan anoda tumbal adalah
efek throwing power, yaitu efek proteksi sehubungan dengan jarak anoda ke
logam yang dilindungi. Jika jarak itu besar sebagian potensial digunakan untuk
mengatasi hambatan elektrolit.
Pada penyusunan struktur anoda haruslah diusahakan agar distribusi
potensial seragam diseluruh bagian, meskipun faktor seni terkadang lebih
berperan daripada faktor teknik.
3.2.3. Karakteristik anoda tumbal
Anoda tumbal yang populer adalah magnesium, seng dan alumunium,
ketiga anoda tersebut mempunyai karateristik yang berbeda-beda dalam melindungi logam katoda. Berikut adalah karakteristik dari ketiga logam tersebut.
I. Magnesium.
Magnesium mempunyai potensial korosi bebas yan gsangat negatif, artinya
TUGAS AKHIR lfl-6
1(p raf<Jeristik_ Cl'crfil/{fu nga 11 ?(p to ail(.
akan efektif untuk melindungi jalur p1pa yang dikubur dalam tanah, tanki
penyimpanan air tawar atau payau. Magnesium sangat bcrbahaya jika berada
didekat api, ini juga merupakan salah satu kelemahannya.
Spesifikasi paduan magnesium adalah [Trethewey, 1991) :
Kapasitas : 1232 Ah/kg
Effesiensi :60%
Consumption rate :4,1 kg/A-tahun
Massajenis : 1,765 gr/cm3
2. Seng.
Secara komersial seng tersedia dan dapat dipakai karena menghasilkan
suatu keuntungan bahkan dengan beberapa moditikasi sebagai material anoda.
Sifat-sifat dan komposisi seng yang telah digabungkan dipakai dalam anoda
tum bal.
Diantara bahan-bahan paduannya yang paling merusak efek anoda adalah
besi . Kelarutannya dalam seng sedemikian rendah ( < 0,0014%) sehingga kalau
berlebih kelebihan itu akan berupa partikel-partikel terpisah, yang pada gilirannya
membentuk set galvanik lokal yang menghasilkan suatu lapisan seng
hidroksida/seng karbonat yang tidak dapat larut dan tidak dapat menghantarkan
listrik, sehingga anoda tidak akan efck1if. Penambahan alumunium,
menguntungkan karena menyebabkan terbentuknya antar Iogam alumunium/besi
yang lcbih tidak mulia schingga mengungurangi cfek sel-scl korosi lokal.
Seng dapat diaplikasikan didalam lingkungan kapal atau lingkungan
TUGAS AKHIR III- 7 'l(praf.Jeristil{, CferWufutl{Ja1l 'l(ptotfil(_
99.99% seng murni akan memberikan keuntungan didaiam proses instalasi. Seng
dapat dipakai sebagai material anoda dengan tegangan pcmbangkit yang rendah.
Spcsifikasi anoda seng produksi Kartini Utama adalah :
Kapasitas : 782 Ahlkg
Effesiensi :95%
Driving voltage : 0,25 V diukur dengan reverensi Ag I Ag Cl
Consumption rate : 11 ,20 kg/ A -tahun
Massajenis : 7, I gr/cm3
3. Alumunium.
Logam ketiga yang akan bertindak sebaai anoda tumbal terhadap baja
adalah alumunium. Dalam keadaan normal alumunium murni sangat tidak andal
digunakan untuk anoda tumbal, ini diakibatkan oleh lapisan oksida yang selalu
membungkus logam itu ketika masih berada dalam udara bebas. Karena itu, unsur
paduan yang ditambahkan adalah yan gdapat mencegah terbentuknya selaput oksida yang merata, melekat erat dan protektif sehingga kegiatan galvanik terus
berlangsung. Paduan alumunium yang mengandung seng dan indium mempunyai
daya listrik yang yangjauh Iebih besar dari pada paduan seng.
Spesifikasi anoda Alumunium produksi Kartini Utama adalah:
Kapasitas : 2700 Ah/kg
Effesiensi :90%
Driving voltage : 0,3 V diukur dengan reverensi Ag I Ag Cl
Consumption rate : 3,24 kg/A-tahun
TUGAS AKHIR Ill- 8
'/(fl ra f:..r e ris t if(. Per fin dimga II '/(fl tom{(.
3.3. Metode Arus Terpasang (Impressed Current Cathodic Protection)
3.3.1. Mekanisnte
f\:rlindungan badan kapal d~.:ngan m~.:nggunakan protd.si k.atodik sistem
impressed current adalah perlindungan dengan memberikan elektron pada badan
kapal dengan bantuan sumber listrik dari luar. Elektron yang diberikan pada
material berasal dari anode pennanen yang tebuat dari logam.
Sumbcr arus pcmbantu untuk mcmberikan clcktron kc badan kapal dapat
berupa battery, rectifier, generator maupun sumber listrik lainnya. Hubungan
sumber arus baik dengan anoda maupun dengan badan kapal harus merupakan
hubungan yang tepat. Kutub positip sumber arus DC harus dihubungkan dengan
arus anoda scdangkan kutub negatifnya barus dibubungkan dcngan badan kapal.
Hubungan yang terbalik menyebabkan elekton mengalir dengan arab yang
terbalik pula, yaitu dari anoda ke badan kapal. Jadi jelasnya elektron bergerak ke
arab badan kapal yang dilindungi terbadap pengaruh pengkaratan, karena itu
pennukaan badan kapal akan menjadi katode pada scluruh pcngkaratan, dan
dengan demikian potensial dari baja menjadi lebih negatif.
Dengan adanya bantuan sumber arus listrik maka bcsar kecilnya pemberian elektron pada badan kapal tergantung dari besarnya sumber arus tadi.
Arus yang besar akan memberikan arus dalam jumlah yang besar pada badan
k.apal. Perlu diingat bahwa kelebihan arus pada permukaan badan kapal akan
menyebabkan cat yang melekat pada badan kapal akan mengelupas. Maka dari itu
pengoperasian pencegahan pengkaratan dengan sistem JCCP ini memerlukan
operator yang ahli dan mengerti dengan masalah tcrsebut agar dapat melakukan pengontrolan arus sesuai yang dibutuhkan.
TUGAS AKIIIR Ill- 9 7(p ra{Jeristil(_ Perfiwfunga 11 1\.fl todi/(_
Arus yang dibutuhkan oleh struktur akan sama dengan anoda sacraficial
jika lokasi dan penemratnnnya harnpir samn. Kcbutuhan padn generator dari
komponen ohm didalam rangkaian listrik.
3.2.1. Anoda Yang Dapat Dipakai
Anoda yang digunakan dalam sistem ICCP, harus mempunyai elektroda
potensial yang tinggi agar dapat melindungi area yang luas dengan anoda yang
kecil.. Anoda ditempatkan dibagian kanan dan dibagian kiri lambung kapal
I. Grafit.
Anoda permanen yagn pertama kali dibuat adalah grafit dan karbon.
Material tersebut tidak memliki sifat-sifat mekanik dan elektrokomia yang ideal.
Grafit meraupakan material yang cepat rapuh dan keropos. Anoda graflt memiliki
macam-macam tipe dan juga memiliki kualitas yang berbeda-beda. Sebagai contohnya adalah grafit dengan tingkat kemurnian yang cukup tinggi akan memiliki performansi yang tinggi pula.
Ditinjau dari scg1 ckonom1 grafit rclatif' ld11h murah jika dibandingkan biaya
pervolume. Disamping llu pula grafit memiliki konduktivitas yang tinggi.
2. Besi Silikon Tinggi.
Secara ekonomis anoda besi silikon tinggi sama halnya dengan anoda
grafit serta mcmiliki tmgkat kcsulitan pada faktor-faktor tertentu yang juga
dimiliki oleh jenis anoda lain. Kelebihannya efesiensi didalam air tawar dan cepat
beradaptasi dengan elektrolit yang dipakai. 3. Anoda Magnetite.
Anoda magnetite memiliki rumus kimia Fe304 dan merupakan golongan
TUGAS AKIIIR 111-10 7\jJral(jeristif:.. Cf'crfi'ndiwga 11 1(ptocfil(
magnetite metmliki sifat yang sama dengan jenis anoda yang lain dan secara umum dapat ditunjukan sebagai magnetite. Anoda scmacam ini dinamakan ebonite yang berasal dari keramik titanium dioksida yang diperkirakan memiliki karaktcristik elcktrolit yang sama.
4. Platinum dan Campuran Platinum.
Platinum telah dipakai sebagai anoda didalam suatu elektokimia serta dipakai scbagai anoda didalam proses proteksi katoda. Logam ini dapat berfungsi dcngan menggunakan teknik-teknik tertentu. sebagai fungsinya anoda ini memilih.t kekbihan dimana hila anoda ini berada di air laut memillki cfcsicnsi 10
% jika ditambahkan dengan rodium atau palladium.
5. Titanium yang dllaptsl oleh platina.
Jika sebuah lapisan tipis dilapisi oleh sebuah substrat titanium maka platinum dapat berfungsi sebagai anoda dan titanium tersebut dalam proses ini akan membentuk insulation film rnelalui proses anoda. Dalam hal ini platinum memmberikan suatu kelembaban dengan suatu perantaraan dasar agar dipakai sebagai anoda. 13erhubung pemakaian platinum ketika bertindak sebagai anoda didalam elektrolit maka platinum dengan insulatiOn .film akan membutuhkan proses yang sangat panjang.
Dalam prakteknya, sepersepuluh dari 1000 in cukup untuk mcmberikan waktu proses selama I 0 tahun, dengan kerapatan arus sebesar 70 A/sq ft .
BAB IV
TUGAS AKHIR
jlnalisa 'Tefutis
BABIV
ANALISA TEKNIS
4.1. Metode Anoda Tumbal (SACP)
IV- 1
Dalam metodc ini. untuk mencari banyaknya anoda yang dibutuhkan
dapat dilakukan dengan dua cara, yaitu dengan berpatokan pada berat (hy weight)
atau berpatokan pada kebutuhan arus (hy current). Dalam prakteknya, kedua cara
ini di hitung semua dan diambil yang terbesar. Hal ini dilakukan untuk mencari
angka yang paling aman.
4.1.1. Faktor-Fal<tor Penentu Jumlah Anoda
4.1.1.1. Luas permukaan basah badan kapal.
Karena bentuk badan kapal yang komplek tidak sebagaimana
perhitungan pada luasan pennukaan yang sederhana maka fonnula yang
digunaknn ndalah scbagai berikut [DNV, 1974].
WSA pada sarat penuh:
WSA (1,8 X /,pp X 7) + ( Cb X /,pp X R ) . ... 4.1
Dimana
WSA : luas permukaan basah (m\
Lpp panjang kapal antara AP sampai FP (m).
T : sarat kapal pada muatan penuh (m).
.
..Cb · koelisien blok.
TUGAS AKIIIR )f nofzsa Tel{jzis
Luas daun kemudi
A=
TrLpp(
I+
25(~)2
J
(m2) 100 lppT : sarat kapal pada muatan penuh (m). Lpp : panjang kapal (m)
F3 : Iebar kapal (m). 4.1.1.2. Faktor coating breakdown
IV- 1
Faktor coating breakdown menggambarkan suatu rcduksi di dalam kerapatan arus katodik karena adanya aplikasi dari suatu coating insulasi secara elektrik.
Empat kategori pam/ coating telah didefinisikan untuk melengkapi hubungan antara faktor coatmg breakdown terhadap sttat-sitat coatmg ttu sendiri. [ONV,I993]
Kategori I I layer coating primer, kira-kira 50~tm OFT (D1y Film
IY7ickness/ketebalan film basah)
Kategori II I layer coating primer, ditambah I layer minimum coating intennediate kira-kira 150- 250 Jlm OFT.
Kategori III : 1 layer coating primer, ditambah l layer minimum coating intennediate min 300 Jlm OFT.
Kategori IV I layer coating primer, ditambah I layer minimum coating intennediate min 450 Jlm OFT.
TUGAS AKHTR )f rzalisa 'Tetf.Jlis
TV- 3
Tabel 4. I. Konstanta k1 dan k2 untuk perhitungan faktor coating breakdown Coating Category
r
II fii IV Depth (m) (kr =O,I0) (kr = 0,05) (kr - 0,02) (kr = 0,02) k2 k2 k2 k2 U- 3U 0,10 0,03 0,15 0,12 > 30 0,05 0,02 0,12 0,12=
kt ten nul dimana=
tahun 4.1.1.3. Kerapatan arusKerapatan arus menunjukan arus proteksi katodik tiap luasan area. Kcrapatan arus baik yang diawal maupun yang diakhir memberikan suatu
pengukuran terhadap kerapatan arus katodik t,runa mencapai proteksi katodik dari permukaan Jogam dalam waktu yang relatif singkat. Hal itu dapat dipakai untuk menghitung arus awal dan akhir yang nantinya akan menentukan Jumlah dan ukuran dari anoda. [DNV,I993]
Perancangan kerapatan arus awal menunjukan kerapatan arus katodik yang dibutuhkan untuk mempengaruhi polarisasi pada sebuah permukaan logam. Kerapatan arus awal yang dibutuhkan lebih tinggi daripada kerapatan arus
rata-TUGAS AKHIR
.ft na (is a 'Tefuus
IV- 4
rata dan kerapatan arus akhirkarena adanya pengembangan skala perhitungan
selama fase awal yang menimbulkan adanya arus. Perancangan kerapatan arus
awal memungkinkan adanya fonnasi skala protektif dan polarisasi yang efesien.
Pcrancangan kerapatan an1s akhir mcrupakan pcrmukaan logam yang
dihubungkan dengan gerakan kapal dan lapisan yang menyertainya. Hal tersebut
dimasukan dalam kerapatan arus tambahan yang dibutuhkan untuk melakukan
polarisasi u1ang terhadap struktur jika sebagian 1ap1san tersebut terpengruh o1eh
operasi. 11al tersebut dapat dinyatakan dengan perancangan kerapatan arus akhir
lebih besar dari kerapatan arus rata-rata (DNV, 1993).
Pcrancangan densitas arus diawal dan diakhir mengarah pada densitas
arus katodik pada potensia1 sebesar -0,8 V. Rata-rata perancangan densitas suatu
arus merupakan suatu pengukuran dari kerapatan arus katodik [DNV, 1993).
Kerapatan arus untuk awa1 dan akhir memiliki berbagai macam letak
iklim dan kedalaman. Dalam Tabel 4.2 kerapatan arus didasarkan pada range
rata-rata temperatur air permukaan dalam waktu I tahun [DNV, 1993).
Tabcl 4.2. Kerapatan Arus dalam A/m2
Design Current Densities (Initial, Average, Final) in
Nm-Tropical Sub-Tropical Temperate Arctic Depth
(>20°C) ( 12-20°C) (7-12°C) (<7°C)
0-30 0,15 0,07 0,09 0,17 0,08 0, II 0,20 0,10 0,13 r-. - 0,25 0,12 0,17