PENELITIAN
Oleh :
Winata Adie Wicaksono (0631010002)
Rahma Eka Susanti (0631010046)
JURUSAN TEKNIK KIMIA
FAKULTAS TEKNOLOGI INDUSTRI
UNIVERSITAS PEMBANGUNAN NASIONAL “VETERAN”
JAWA TIMUR
Surabaya 60294
KETERANGAN REVISI
Yang Tertulis dibawah ini :
Nama Mahasiswa : Winata Adie Wicaksono.
NPM : 0631010002
Jurusan : Teknik Kimia
Telah mengerjakan revisi Hasil Penelitian dengan judul :
“HIDROLISA PATI BIJI NAGKA MENJADI GLUKOSA DENGAN KATALISATOR H2O, HCl, NaOH, DAN ENZIM α-AMILASE “
Surabaya, November 2010
Dosen Penguji yang memerintahkan revisi :
1. Ir. Retno Dewati., MT ( ………)
2. Ir. Susilowati., MT ( .……….. )
Mengetahui,
Dosen Pembimbing
Surabaya 60294
KETERANGAN REVISI
Yang Tertulis dibawah ini :
Nama Mahasiswa : Rahma Eka Susanti
NPM : 0631010002
Jurusan : Teknik Kimia
Telah mengerjakan revisi Hasil Penelitian dengan judul :
“HIDROLISA PATI BIJI NAGKA MENJADI GLUKOSA DENGAN KATALISATOR H2O, HCl, NaOH, DAN ENZIM α-AMILASE “
Surabaya, November 2010
Dosen Penguji yang memerintahkan revisi :
1. Ir. Retno Dewati., MT ( ………)
2. Ir. Susilowati., MT ( .……….. )
Mengetahui,
Dosen Pembimbing
KATA PENGANTAR ………...……… i
II.2 Landasan Teori II.2.1 Hidrolisia ……….. 12
II.2.2 Enzim ……….. 13
III.3 Variabel - variabel yang Dikerjakan
BAB IV HASIL PENELITIAN DAN PEMBAHASAN IV.1 Tabel Hasil Penelitian ……….. 23
INTISARI
Penelitian ini bertujuan untuk mendapatkan kadar glukosa pada hidrolisa pati
biji nangka menjadi glukosa dengan katalisator H2O, HCl, H2SO4 dan Enzim alfa
amylase dengan peubah yang berpengaruh yaitu katalisator dan waktu
Cara kerja pada penelitian ini yaitu, bahan biji nangka direndam semalam
dengan air, kemudian di blender dan diambil sarinya untuk dipisahkan antara filtrat
dan endapan. Endapan tersebut digunakan sebagai bahan baku pada proses hidrolisa
ini. Pati biji nangka yang sebanyak 15 gram di hidrolisa dengan menambahkan
katalisator sesuai peubah yang di jalankan, pada suhu 90°C dan selama waktu sesuai
peubah yang di jalankan. Setiap waktu diambil cuplikanya untuk di analisa kadar
glukosanya dengan metode luff schrool.
Penelitian ini menghasilkan kadar glukosa terbesar untuk hidrolisis adalah
dengan menggunakan katalisator enzim, waktu proses selama 80 menit didapat kadar
BAB I
PENDAHULUAN
1.1. Latar belakang
Nangka merupakan jenis buah-buahan yang banyak digemari oleh
banyak orang. Buah ini memiliki bau yang sangat khas, selain itu juga
memiliki rasa yang enak.
Buah nangka memiliki beberapa bagaian yaitu biji, daging buah dan
kulit. Pada umumnya hanya daging buah saja yang dapat dikonsumsi,
sedangkan biji biasanya dibuang begitu sajas dan belum ada yang
memanfaatkannya. Oleh karena itu dilakukan upaya pemanfaatan dari
limbah nangka tersebut.
Biji merupakan tempat penyimpanan cadangan makanan bagi
tunbuh-tumbuhan disamping buah, batang, dan akar. Sehingga diantara
keempat kemungkinan itu yang terpakai tergantung pada jenis tanamannya.
Karbohidrat merupakan penyusun utama cadangan makanan pada
tumbuh-tumbuhan.
Salah satu cara pengolahan pati adalah hidrolisis yang dilakukan
dengan bantuan asam atau enzim. Pati penting digunakan dalam industri
1.2. Tujuan penelitian
Tujuan dari penelitian ini adalah untuk mendapatkan kadar glukosa
pada hidrolisa pati biji Nangka menjadi glukosa dengan katalisator H2O,
HCl, NaOH, dan enzim α - amilase dengan peubah yang berpengaruh yaitu
katalisator dan waktu.
1.3. Manfaat penelitian
- Meningkatkan nilai tambah dari biji Nangka dengan memprosesnya
menjadi glukosa.
- Mendapatkan kadar glukosa dari hidrolisis biji nangka dengan katalisator
BAB II
TINJAUAN PUSTAKA
II.1 Tinjauan Umum
Pohon nangka termasuk kedalam suku Maraceae, ialah sejenis
tanaman tropika nama ilmiahnya adalah Artocarpus Heterophyllus. Dalam
bahasa Inggris nangka dikenal sebagai Jackfruit. Nangka berasal dari
India, yakni wilayah Ghats bagian barat, dimana jenis-jenis liarnya masih
didapati tumbuh tersebar di hutan sana. Kini nangka telah menyebar luas
diberbagai daerah tropis terutama di daerah Asia Tenggara.
Pohon nangka umumnya berukuran sedang, sampai sekitar 20
meter tingginya walaupun ada yang mencapai 30 meter. Batang bulat
silinderis sampai sekitar 1 meter, garis tengahnya tajuknya padat dan lebar,
melebar dan membulat. Apabila di tempat terbuka seluruh bagian
tumbuhan mengeluarkan getah putih pekat apabila dilukai. Buah nangka
berbentuk gelondong memanjang seringkali tidak merata, biji nangka
mulai berbunga pada umur 2-8 tahun.
(http.//www.wikipedia.org/wiki/nangka)
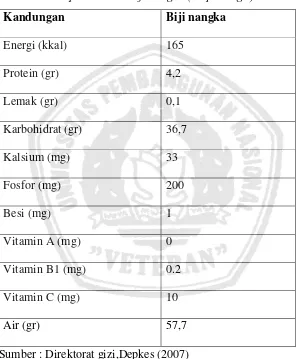
Biji nangka merupakan sumber karbohidrat (36,7 gr/100gr),
protein (4,2 gr/100 gr) dan energi (165 gr/100gr) sehingga dapat
dimanfaatkan sebagai bahan pangan yang potensial. Biji nangka juga
nangka adalah fosfor (200 mg), kalium (33 mg), dan besi (1 mg). Selain
dapat dimakan dalam bentuk utuh biji nangka juga dapat diolah menjadi
tepung selanjutnya dari tepungnya dapat dihasilkan berbagai makanan
olahan. (http.//www.cybernet.cbn.net.id/cbprtl /cybermed).
Tabel 2.1 Komposisi kimia biji nangka ( tiap 100 gr )
Kandungan Biji nangka
Energi (kkal) 165
Protein (gr) 4,2
Lemak (gr) 0,1
Karbohidrat (gr) 36,7
Kalsium (mg) 33
Sumber : Direktorat gizi,Depkes (2007)
II.1.1 Pati
Adalah cadangan makanan utama pada tanaman, pati banyak
terdapat pada beras, singkong, kentang, jagung atau biji-bijian. Sejenis
senyawa ini mempunysi rumus umum (C6H10O5)n, dimana n adalah
Sekitar 20% pati adalah amilosa (larut) dan 80% sisanya amilopektin
(tidak larut).
II.1.2 Amilosa
Molekul amilosa terdiri dari 70 hingga 250 unit, glukosa yang
berikatan membentuk lurus kira-kira 20% dari pati adalah amilosa
Hidrolisis lengkap amilosa menghasilkan hanya D-glukosa, hidrolisis
partial menghasilkan maltosa sebagai satu-satunya disakarida.
Disimpulkan bahwa amilosa adalah polimer linear dari -Dglukosa yang
dihubungkan secara-1,4. (Fessenden.R.J & Fessenden.J.C, 1994)
II.1.3 Amilopektin
Merupakan suatu polisakarida yang jauh lebih besar daripada
amilosa, mengandung 1000 satuan glukosa atau lebih per molekul seperti
rantai dalam amilosa, rantai utama dari amilopektin mengandung 1,4-
-D-glukosa. Tidak seperti rantai dalam amilosa, amilopektin bercabang
sehingga terdapat satu glukosa ujung untuk kira-kira tiap 25 satuan
glukosa. Hidrolisis lengkap amilopektin hanya menghasilkan D-glukosa,
namun hidrolisis tidak lengkap menghasilkan suatu campuran disakarida
maltosa dan iso maltosa. (Fessenden.R.J & Fessenden.J.C, 1994)
II.1.4 Glukosa
Glukosa termasuk dalam monosakarida yang mempunyai rumus
molekul C6H10O6 yang disebut dextrosa atau gula anggur atau gula darah.
Disebut gula anggur karena banyak terdapat dalam buah anggur dan
dari proses penguraian senyawa karbohidrat dan masuk dalam darah untuk
dipergunakan sebagai bahan bakar dalam proses metabolisme.
Glukosa mempunyai 6 buah atom C dengan 5 gugus hidroksil dan
1 buah gugus karbonil di ujung sehingga merupakan gugus aldehid.
Glukosa terdapat dengan jumlah yang bervariasi dalam sayuran dan
buah-buahan. Kadar yang tinggi didapatkan dalam buah-buahan seperti buah
anggur dan dalam jumlah lebih sedikit dijumpai pada sayuran seperti kapri
muda dan wortel. Sirup glukosa atau glukosa komersial bukanlah glukosa
murni tetapi campuran dari glukosa, senyawa karbohidrat lain dan air.
II.1.5 Hidrolisis
Hidrolisis adalah pemecahan kimiawi suatu molekul karena
pengikatan air, menghasilkan molekul-molekul yang lebih kecil.
Hidrolisis ada 5 jenis yaitu:
1. Hidrolisis Murni
Hanya direaksikan dengan aquadest saja. Reaksinya berjalan
sama lambat sehingga jarang digunakan dalam industri dan hanya
digunakan untuk senyawa-senyawa yang sangat reaktif.
(Groggins, 1958)
2. Hidrolisis Dalam Larutan Asam
Dapat menggunakan asam encer atau asam pekat dan biasanya
berfungsi sebagai katalisator, yaitu HCl atau Asam Sulfat. Pada asam
encer umumnya kecepatan reaksi sebanding dengan konsentrasi H+.
3. Hidrolisis Dalam Larutan Basa
Dengan menggunakan basa encer atau pekat untuk tujuan
tertentu misalnya hidrolisis Etil Acetat dengan katalisator NaOH encer
menjadi Natrium Acetat. (Groggins, 1958).
4. Alkali Fusion
Dapat dilakukan dengan atau tanpa menggunakan H2O pada
temperatur tinggi. Hanya digunakan untuk tujuan tertentu, misalnya
dalam proses peleburan dari bahan sellulosa dengan katalisator NaOH
menghasilkan Asam Oksalat dan Asam Acetat. (Groggins, 1958).
5. Hidrolisis Dengan Enzim Sebagai Katalisator. (Groggins, 1958).
Hidrolisis pati dapat dilakukan oleh asam atau enzim, jika pati
dipanaskan dengan asam akan terurai menjadi molekul-molekul yang
lebih kecil secara berurutan dan hasil akhirnya adalah glukosa.
H2O + (C6H12O5)n nC6H12O6
Air Pati Glukosa
Ada beberapa tingkatan dalam reaksi diatas. Molekul-molekul pati
mula-mula pecah menjadi unit rangkaian glukosa yang lebih pendek
yang disebut dekstrin. Dekstrin ini dipecah lebih jauh menjadi maltosa
(2 unit glukosa) dan akhirnya maltosa pecah menjadi glukosa.
Pati Dekstrin Maltosa Glukosa
Pada hidrolisa pati, air akan menyerang ikatan rantai panjang 1,4-
dekstrin atau glukosa, tergantung pada derajat pemecahan rantai
polisakarida dalam pati. (Triwahyuni&Hanik, 1994).
Sirup glukosa komersil dihasilkan dengan jalan menghidrolisa
pati jagung dengan Asam klorida encer. Hidrolisanya tidak sempurna
dan sirup glukosa yang juga dinamakan sirup jagung atau glukosa cair,
merupakan campuran glukosa, maltosa, dekstrin, dan air.
Hidrolisis Pati
Pati merupakan polisakarida paling banyak yang kedua setelah Selulose.
Pati dapat dipisahkan menjadi dua fraksi utama berdasarkan kelarutan bila
dibubur dengan air panas yaitu 20% pati amilosa dan 80% sisanya amilopektin.
(Fessenden.R.J & Fessenden.J.C, 1994)
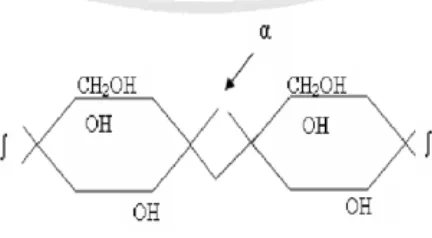
Amilosa mengandung 250 satuan glukosa, hidrolisis lengkap dari amilosa
menghasilkan α-D-glukosa, sedangkan hidrolisis partial menghasilkan maltosa.
Amilosa adalah polimer linier dari α-D-glukosa yang dihubungkan secara 1,4’.
Gambar 2.1 Amilosa
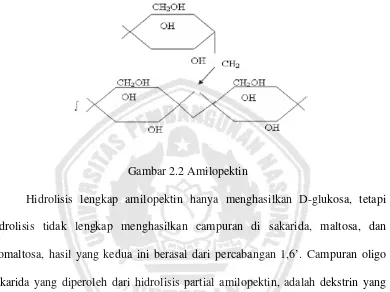
Amilopektin merupakan polisakarida yang jauh lebih besar dari amilosa,
mengandung 1,4’ α-D-glukosa. Bedanya dengan amilosa adalah adanya cabang
pada amilopektin sehingga terdapat 25 satuan glukosa pada ujungnya, ikatan
percabangan adalah 1,6’ α-D-glukosa.
Gambar 2.2 Amilopektin
Hidrolisis lengkap amilopektin hanya menghasilkan D-glukosa, tetapi
hidrolisis tidak lengkap menghasilkan campuran di sakarida, maltosa, dan
isomaltosa, hasil yang kedua ini berasal dari percabangan 1,6’. Campuran oligo
sakarida yang diperoleh dari hidrolisis partial amilopektin, adalah dekstrin yang
digunakan untuk lem, pasta dan kanji pada tekstil.
Reaksinya sebagai berikut :
Amilopektin H2O dekstrin H2O maltosa + iso maltosa H2O D-glukosa
Reaksi pada proses hidrolisis pati, air akan menyerang ikatan rantai
panjang 1,4’ α-D-glukosa menjadi rantai yang lebih pendek, dimana hasilnya
berupa dekstrin atau glukosa, tergantung pada derajat pemecahan rantai
Uji kuantitatif karbohidrat
Metode ini didasarkan pada peristiwa tereduksinya cupri-oksida menjadi
cupro oksida karena adanya gula reduksi. Reagen yang digunakan merupakan
campuran cupri sulfat, Na-karbonat dan asam sitrat (reagen Luff). Pada penentuan
gula cara Luff Schoorl, yang ditentukan bukannya cupro oksida yang mengendap
tetapi dengan menentukan cupri oksida dalam larutan sebelum direaksikan dalam
gula reduksi (titrasi blanko) dan sesudah direksikan dengan sampel gula reduksi
(titrasi sampel). Penentuan dengan menggunakan Na-tiosulfat. Selisih titrasi
blanko dengan titrasi sampel ekuivalen dengan cupro oksida yang terbentuk dan
juga ekuivalen dengan jumlah gula reduksi yang ada dalam bahan atau larutan.
Reaksi yang terjadi selama penentuan karbohidrat cara ini mula-mula cupri oksida
yang ada dalam reagen akan membebaskan ion dari garam K-Iodida. Banyaknya
ion yang dibebaskan ekuivalen dengan banyaknya cupri oksida. Banyaknya ion
dapat diketahui dengan titrasi menggunakan Na-tiosulfat. Untuk mengetahui
bahwa titrasi sudah cukup maka diberikan indikator amilum. Apabila larutan
berubah warnanya dari biru menjadi putih dapat tepat maka penambahan amilum
diberikan pada saat titrasi hampir selesai. Setelah diketahui selisih banyaknya
titrasi blanko dan titrasi sampel kemudian dikonsultasikan dengan tabel yan sudah
tersedia menggambarkan hubungan antara banyaknya Na-tiosulfat dengan
II.1.6 Analisa Glukosa
Banyaknya glukosa yang terdapat dalam suatu bahan dapat
dianalisa secara kuantitatif. Adapun analisa dapat dilakukan dengan
beberapa cara yaitu sebagai berikut:
a. Cara Mulson Walker
Denagan cara Mulson Walker ini penentuan jumlah glukosa
didasarkan pada banyaknya Cu2O yang terbentuk, kemudian dengan
melihat tabel dapat diketahui jumlah glukosanya.(Sudarmaji, 1997)
b. Cara Luff Schrool
Cara ini didasarkan atas selisih antara larutan sebelum
direaksikan dengan sampel glukosa, kemudian kadar glukosa dalam
bahan dapat dicari dengan menggunakan tabel. .(Sudarmaji, 1997)
c. Cara Lane Eynon
Merupakan cara penentuan secara volumetris, dalam hal ini 10
ml atau 25 ml reagen soxhlet direduksi (dfititrasi) dengan larutan
contoh. Jumlah glukosa dapat diketahui dari tabel Lane Eynon
berdasarkan volume larutan contoh yang dibutuhkan untuk titrasi.
(Sudarmaji, 1997)
d. Cara Oksidasi Glukosa
Penenentuan glukosa dengan cara ini adalah secara enzimatis dan
spektrofotometri. Jumlah dapat ditentukan berdasarkan larutan contoh
II.2 Landasan Teori
II.2.1 Hidrolisa
Hidrolisia adalah suatu proses kimia yang menggunakan H2O
sebagai pemecah suatu persenyawaan.
Proses hidrolisis dipengaruhi oleh beberapa faktor, yaitu :
1. Jumlah kandungan karbohidrat pada bahan baku
Jumlah kandungan karbohidrat pada bahan baku sangat berpengaruh
terhadap hasil hidrolisis asam, dimana bila kandungan karbohidrat
sedikit maka jumlah gula yang terjadi juga sedikit, dan sebaliknya bila
suspensi terlalu tinggi mengakibatkan kekentalan campuran akan
semakin meningkat, sehingga tumbukan antara molekul karbohidrat
dan molekul air semakin berkurang, dengan demikian kecepatan
reaksi pembentukan glukosa semakin berkurang. Bahan yang hendak
dihidrolisis diaduk dengan air panas dan jumlah bahan kering
umumnya sekitar 18-22%.
2. pH
pH berpengaruh terhadap jumlah produk hidrolisis. pH ini erat
hubungannya dengan konsentrasi asam yang digunakan. Pada
umumnya pH yang terbaik sekitar 2,3.
3. Waktu
Pada umumnya waktu hidrolisa yang dibutuhkan sekitar 40-50 menit.
Pengaruh suhu terhadap kecepatan hidrolisis karbohidrat akan
mengikuti persamaan Archenius, bahwa semakin tinggi suhunya akan
didapat konversi yang cukup berarti, tetapi kalu suhu terlalu tinggi
konversi yang diperoleh akan menurun. Hal ini disebabkan oleh
adanya glukosa yang pecah menjadi arang, yang ditunjukkan oleh
warnanya yang semakin tua. Disamping itu pada suhu yang tidak
terlalu tinggi (tidak melebihi titik didih air) air sebagai zat
penghidrolisa tetap berada pada fase cair, sehingga terjadi kontak yang
baik antara molekul-molekul serbuk kulit nangka dengan sebagian
besar air. Dengan demikian reaksi dapat berjalan dengan baik. Untuk
hidrolisis yang berlangsung pada tekanan atmosfer (1 atm) titik didih
larutan kira-kira 1000C, sedangkan untuk tekanan yang lebih besar
dapat digunakan suhu yang lebih tinggi dari 1000C. (Soebijanto, 1986)
II.2.2 Enzim
Adalah protein yang berperan sebagai katalisator dalam
metabolisme makhluk hidup. Enzim berperan untuk mempercepat reaksi
kimia yang terjadi di dalam tubuh makhluk hidup,tetapi enzim itu sensiri
tidak ikut bereaksi. Enzim terdiri dari apoenzim dan gugus protestik,
apoenzim adalah bagian enzim yang tersusun atas protein,gugus protestik
dapat dikelompokkan menjadi dua yaitu koenzim (tersusun dari bahan
organik) dan kofaktur (tersusun dari bahan anorganik).
1. Biokatalisator
Enzim mempercepat laju reaksi,tetapi tidak ikut bereaksi.
2. Termolabil
Enzim mudah rusak bila diapnaskan dsampai dengan suhu tertentu.
3. Merupakan senyawa protein
4. Bekerja secara spesifik
Faktor yang mempengaruhi enzim yaitu :
1. Suhu
Semakin tinggi suhu, kerja enzim juga akan meningkat. Tetapi ada
batas maximal untuk hewan misalnya batas tertinggi suhu adalah 40°C,
bila suhu diatas 40°C enzim tersebut akan menjadi rusak sedangkan
untuk tumbuhan batas teringgi suhunya adalah 25°C.
2. pH
Pengaruh pH terhadap suatu enzim bervariasi tergantung jenisnya. Ada
enzim yang bekerja secara optimal pada kondisi asam. Ada juga yang
bekerja secara optimal pada kondisi basa.
3. Konsentrasi substrat
Semakin tinggi konsentrasi substrat, semakin meningkat juga kerja
enzim tetapi akan mencapai titik maximal pada konsentrasi tertentu.
4. Konsentrasi enzim
Semakin tinggi konsentrasi enzim, semakin meningkat juga kerja
5. Adanya aktivator
Aktivasi merupakan zat yang memicu kerja enzim.
www.fionaangelina.com/2008/09/14/enzim
Beberapa macam enzim diantranya Alfa Amilase, lisozim, dan
Lingual Lipase. Enzim-enzim tersebut bekerja secara optimal pada pH 7,4.
Lingual Lipase pada Ph optimum 4.
www.wikipedia.org/wiki/enzim
Reaksi hidrolisa pati :
(C6H10O5)n + nH2O H+ n(C6H12O6 )
A B Produk
2.3. Hipotesa
Hidrolisis pati biji nangka menjadi glukosa yang dipengaruhi oleh
BAB III
PELAKSANAAN PENELITIAN
Penelitian ini dilakukan atas dasar pemikiran bahwa biji nangka
mengandung pati sehingga dapat digunakan sebagai bahan penelitian yang akan
dihidrolisis dengan menggunakan katalisator air,HCl,NaOH, dan enzim alfa
amilase.
III.1 Bahan – Bahan yang Digunakan
- Biji Nangka
Komposisi Biji Nangka
Hasil pengujian dari Laboratorium Instrument, Teknik Kimia UPN
“Veteran” Jawa Timur.
Bahan utama dari penelitian ini ialah biji nangka yang diperoleh dari
daerah Surabaya. Sedangkan untuk bahan yang lain yaitu
- H2O
- Asam Klorida (HCL) 12 N
- Kalium Iodida (KI) 20%
- Asam Sulfat (H2SO4) 1 N
- Natrium Thiosulfat (NaS2O4)
- Indikator Amylum
- NaOH
Alat-alat dari penelitian ini dirangkai sedemikian rupa (seperti
terlihat pada gambar).
Gambar 3.1 Peralatan Hidrolisa
III.3 Variabel yang dijalankan
4
3
2
1
III.3.1. Kondisi tetap
III.4.1. Persiapan Bahan
Biji nangka yang diperoleh dari pasar direndam semalam dengan
air, supaya kulitnya mudah mengelupas. Kemudian biji nangka direndam
semalam dengan air, selanjutnya di blender dan diambil sarinya untuk
dipisahkan antara filtrat dan endapan. Endapan tersebut dikeringkan dan
menjadi tepung, tepung tersebut digunakan sebagai bahan baku dan
selanjutnya di hidrolisa.
Hidrolisis dilakukan dengan labu leher tiga yang bervolume 500
ml yang dilengkapi dengan pengaduk. Dalam penelitian kali ini pati biji
nangka yang digunakan 15 gram dimasukkan dalam labu leher tiga lalu
ditambah variabel yang ditetapakan yaitu air,HCl 10 N sebanyak
200ml,NaOH 1N sebanyak 200ml,dan enzim alfa amilase 3 tetes.
Kemudian aquadest dituangkan sebanyak 300ml, kemudian dipanaskan
pada suhu mencapai 90OC dengan waktu hidrolisis mulai dihitung 60,
65, 70, 75, 80, 85, 90, 95, dan 100 menit setiap waktu diambil
cuplikanya melalui lubang termometer dengan menggunakan pipet lalu
ditambah NaOH sampai netral antara ph 7 kemudian disaring endapan
yang ada dibuang, filtrat diuapkan sehingga terbentuk glukosa pekat lalu
diambil 10 ml. Cuplikan tersebut, kemudian dianalisa kadar glukosanya
yang diperoleh dengan metode Luff-Schoorl.
Metode Analisa (Luff – Schoorl)
1. Diambil hasil hidrolisis sebanyak 10 gram ditambah aquadest hingga
100 ml dikocok.
2. Diambil 10 ml ditambah aquadest 100 ml ditambah larutan Luff 10 ml
dimasukkan erlemeyer hingga 300 ml.
3. Dipasang pendingin tegak diberi batu didih dan dipanaskan 2 menit
(dihitung mulai mendidih).
4. Setelah dingin ditambah 10 ml larutan KI 20 % ditambah 25 ml H2SO4
5. Dititrasi dengan larutan Thio dengan penambahan amylum sampai
warna biru hilang, jumlah penambahan Larutan Thio adalah volume
titrasi untuk sample.
6. Untuk pembuatan blanko mengamati hasil hidrolisis dengan aquadest
sebanyak 25 ml ditambah larutan Luff 25 ml lalu sama dengan cara
diatas.
Misalnya:
a ml larutan Thio dipipet 10 ml larutan Luff ditambah 10 ml KI ditambah 25
ml H2SO4 dititer dengan menggunakn b ml larutan Thio.
Volume (b – a) dicocokkan dengan tabel Luff sehingga diperoleh c mg
glukosa.
SKEMA PENELITIAN
BAB IV
HASIL PENELITIAN Penghalusan
dan pengeringan
Analisa glukosa
Hidrolisis
Netralisasi
+ H2SO4
Penyaringan
Filtrat Endapan
Diuapkan
100 34 30,2 3,8 1,6
IV.2 GRAFIK HASIL PENELITIAN
Grafik 1. Hubungan antara kadar glukosa (%) dan waktu hidrolisa (menit) dengan katalisator H2O.
Dari grafik 1 terlihat bahwa semakin lama waktu yang digunakan maka
kadar glukosa yang diproleh semakin besar yaitu pada waktu 90 menit
dengan kadar glukosa 1,36 % tetapi setelah waktu 90 menit maka kadar
glukosa akan turun. Hal ini disebabkan karena suhu yang terlalu tinggi dan
dalam waktu yang cukup lama dapat menyebabkan glukosa terpecah dan
menjadi arang.
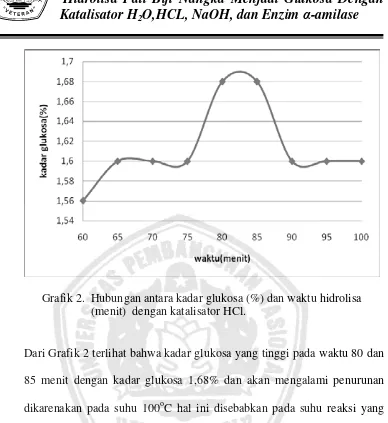
Grafik 2. Hubungan antara kadar glukosa (%) dan waktu hidrolisa (menit) dengan katalisator HCl.
Dari Grafik 2 terlihat bahwa kadar glukosa yang tinggi pada waktu 80 dan
85 menit dengan kadar glukosa 1,68% dan akan mengalami penurunan
dikarenakan pada suhu 100oC hal ini disebabkan pada suhu reaksi yang
tinggi dan waktu reaksi yang lama pati akan berubah menjadi glukosa.
Grafik 3. Hubungan antara kadar glukosa (%) dan waktu hidrolisa (menit) dengan katalisator NaOH
Dari grafik 3 terlihat bahwa semakin lama waktu yang digunakan maka
kadar glukosa yang diproleh semakin besar yaitu pada waktu 70,75,dan
80 menit dengan kadar glukosa 1.64 % tetapi setelah waktu 90 menit
maka kadar glukosa akan turun. Hal ini disebabkan karena suhu yang
terlalu tinggi dan dalam waktu yang cukup lama dapat menyebabkan
glukosa terpecah dan menjadi arang.
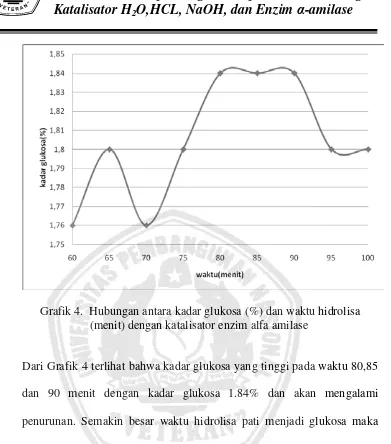
Grafik 4. Hubungan antara kadar glukosa (%) dan waktu hidrolisa (menit) dengan katalisator enzim alfa amilase
Dari Grafik 4 terlihat bahwa kadar glukosa yang tinggi pada waktu 80,85
dan 90 menit dengan kadar glukosa 1.84% dan akan mengalami
penurunan. Semakin besar waktu hidrolisa pati menjadi glukosa maka
semakin meningkat kadar glukosanya, hal ini disebabkan waktu kontak
antara enzim dan pati sangat lama.
Pada penelitian hidrolisa pati biji nangka menjadi glukosa dengan
katalisator H2O, HCl, NaOH, dan enzim alfa amilase dari analisa awal
diperoleh kadar glukosa 12,5 tetapi pada analisa akhir diperoleh kadar
glukosa lebih sedikit. Hal ini mungkin disebabkan waktu yang digunakan
terlalu lama sehingga menyebabkan glukosa banyak yang terbuang.
KESIMPULAN DAN SARAN
V.1. Kesimpulan
Hasil penelitian ini dapat diambil kesimpulan sebagai berikut:
a. Penelitian Hidrolisis pati biji nangka dengan katalisator air, HCl, NaOH
dan Enzim alfa amilase dipengaruhi suhu dan waktu.
b. Pada bahan ini jenis proses hidrolisa yang cocok adalah dengan
menggunakan katalisator enzim. Karena enzim bekerja dengan
menempel pada permukaan zat-zat yang bereaksi dan dengan demikian
dapat mempercepat proses, percepatan proses. Percepatan proses terjadi
karena enzim menurunkan energi pengaktifan yang akan mempermudah
terjadinya reaksi.
c. Keadaan proses dengan peubah waktu dan macam - macam hidrolisa
yang dijalankan di dapat kondisi yang relatif baik adalah pada waktu 80
menit dengan suhu 90OC dengan katalisator enzim Alfa Amilase,
sehingga di dapat kadar glukosa 1.84%.
V.2 . Saran
1. Perlu dipelajari lebih lanjut untuk menggunakan variabel suhu diatas
90OC agar didapat kadar glukosa yang optimal.
2. Perlu pemakaian alat – alat penelitian yang mempunyai ketelitian tinggi.