PENGARUH PLANT GROWTH PROMOTING
RHIZOBACTERIA TERHADAP BIOLOGI DAN STATISTIK
DEMOGRAFI Aphis glycines Matsumura (HEMIPTERA:
APHIDIDAE) PADA TANAMAN KEDELAI
ANGGUN AGUSTINI
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
ABSTRAK
ANGGUN AGUSTINI. Pengaruh Plant Growth Promoting Rhizobacteria terhadap Biologi dan Statistik Demografi Aphis glycines Matsumura (Hemiptera: Aphididae) pada Tanaman Kedelai. Dibimbing oleh HERMANU TRIWIDODO.
Aplikasi Plant Growth Promoting Rhizobacteria (PGPR) pada berbagai tanaman diketahui dapat menekan perkembangan populasi organisme pengganggu tanaman. Penelitian ini dimaksudkan untuk melihat pengaruh PGPR terhadap biologi dan statistik demografi AphisglycinesMatsumura (Hemiptera: Aphididae) pada tanaman kedelai. Penelitian dilakukandi Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor dimulai bulan Januari sampai April 2013. Penggunaan PGPR, yang terdiri dari Bacillus polymyxa dan Pseudomonas fluorescens dapat memperpanjang stadia nimfa instar 2 dan siklus hidup A. glycines. Penggunaan PGPR tersebut juga berpengaruh terhadap statistik demografi A. glycines. Pada tanaman yang diaplikasi dengan PGPR mempunyai laju reproduksi kotor, laju reproduksi bersih dan laju pertumbuhan intrinsik A. glycines lebih rendah dibandingkan dengan tanaman kontrol. Selain itu juga pada tanaman aplikasi PGPR dapat memperpanjang lama generasi dan waktu berlipat ganda A. glycines. Penggunaan PGPR dapat menghambat perkembangan populasi A. glycinespada tanaman kedelai .
Kata kunci: plant growth promoting rhizobateria, Aphis glycines, kedelai, statistik demografi.
ABSTRACT
ANGGUN AGUSTINI. Plant Growth Promoting Rhizobacteria Effect of Biological and Statistic Demographic of Aphis glycines Matsumura (Hemiptera: Aphididae) in Soybean. Supervised by HERMANU TRIWIDODO.
On various plants, Plant Growth Promoting Rhizobacteria (PGPR) application known can suppress the development of plant pest population. This research aimed at PGPR effects against biology and statistic demographic of Aphis glycines Matsumura (Hemiptera: Aphididae) on soybean plant. This research conducted in the Department of Plant Protection, Faculty of Agriculture, Bogor Agricultural University. PGPR application, which consists of Bacillus
polymyxa and Pseudomonas fluorescens can extend second instar nymphs stadia
and life cycle of A. glycines. PGPR application also can effect to statistic demographic of Aphis glycines. The gross reproduction rate, net reproduction rate, and intrinsic growth rate of A. glicines on PGPR application plant is lower than non PGPR application plant. Moreover, PGPR application plant can extend long generation and doubling time of A. glycines. The use of PGPR can inhibits the development of A. glycines population on soybean plant.
Keywords:plant growth promoting rhizobateria, Aphis glycines, soybean, statistic demographic.
© Hak Cipta milik IPB, tahun 2013 Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk apa pun tanpa izin IPB.
PENGARUHPLANT GROWTH PROMOTING RHIZOBACTERIA
TERHADAP BIOLOGI DAN STATISTIK DEMOGRAFI Aphis
glycines Matsumura (HEMIPTERA: APHIDIDAE) PADA
TANAMAN KEDELAI
ANGGUN AGUSTINI
Skripsi
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Pertanian pada Fakultas Pertanian
Institut Pertanian Bogor
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
Judul : Pengaruh Plant Growth Promoting Rhizobacteria terhadap Biologi dan Statistik Demografi Aphis glycines Matsumura (Hemiptera: Aphididae) pada Tanaman Kedelai
Nama Mahasiswa: Anggun Agustini
NIM : A34090047
Disetujui oleh
Dr. Ir. Hermanu Triwidodo, MSc. Dosen Pembimbing
Diketahui oleh
Tanggal disetujui:
Dr. Ir. Abdjad Asih Nawangsih, MSi. Ketua Departemen
Judul Pengaruh Plant Growth Promoting Rhizobacteria terhadap
.. Biologi dan Statistik Demografi Aphis glycines Matsumura
.(Hemiptera: Aphididae) pada Tanaman Kedelai
Nama Mahasiswa Anggun Agustini
NIM A34090047
Disetujui oleh
, '
Dr. Ir. Hermanu Triwidodo, MSc.
Dosen Pembimbing
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 17 Agustus 1991 sebagai anak bungsu dari tujuh bersaudara dari pasangan Dino David dan Maryatis. Penulis menyelesaikan pendidikan Sekolah Menengah Atas di SMAN 27 Jakarta Pusat pada tahun 2009. Pada tahun yang sama penulis diterima di Institut Pertanian Bogor, Fakultas Pertanian, Program Studi Proteksi Tanaman, melalui jalur Undangan Seleksi Masuk IPB.
Selama menjadi mahasiswa, penulis pernah menjadi Penanggung Jawab Kelompok pada masa MPD poempa tahun 2011, Asisten Praktikum Pengendalian Hayati dan Pengelolaan Habitat 2012, Pengajar Bimbingan Belajar di SMP Terbuka 1 Cihideung ilir 2013, Pengajar Mengaji di Pijar Rumpin 2013. Selain itu penulis pernah lolos dalam Program Kreativitas Mahasiswa bidang penelitian mengenai Nematoda Entomopatogen.
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Allah SWT yang atas segala nikmat, rahmat, dan hidayah-Nya penulis dapat menyelesaikan skripsi yang berjudul Pengaruh Plant Growth Promoting Rhizobacteria terhadap Biologi dan Statistik Demografi Aphis glycines Matsumura (Hemiptera: Aphididae) pada Tanaman Kedelai, sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor.
Penulis menghaturkan terima kasih kepada Ayahanda Dino David, Ibunda Maryatis, keenamkakak penulis Novi Sofiyanti, SE., Nova Andraiyani, Nopriyanto Tri Saputra, SE., Fitri Pratiwi, SE., Gina Oktaviyanti, dan Anggi Mirawati, ST., serta keluarga besar yang telah mendoakan dan memberi dukungan kepada penulis.Penulis juga mengucapkan terima kasih sebesar-besarnya kepada Dr. Ir. Hermanu Triwidodo, MSc. selaku dosen pembimbing skripsi dan pembimbing akademik yang telah memberikan masukan, motivasi, dan bimbingan,Dr. Ir. Tri Asmira Damayanti, MAgr. selaku dosen penguji tamu atas saran dan masukan, serta teman-teman seperjuangan di Departemen Poteksi Tanaman Angkatan 46 Khususnya Nisa Rizki Poerwitasari, Enny Elok mawarni, Arini, Eka Wijayanti, Aldila Rachmawati SP, Leni Mariana, Eliana, Pritha Khrisrachmalia, Siti Fathur Racmawati,Kavy shobah, dan Gracia Mediana yang telah membantu penelitian penulis dan juga telah memberikan persahatan dan dukungan. Penulis ucapkan terima kasih kepada Bapak Sodik dan Bapak Dadang yang telah membantu penulis dalam penelitian.
Penulis menyadari bahwa skripsi ini masih banyak kekurangan.Oleh karena itu, penulis mengharapkan saran dan kritik yang insya Allah membangun demi peningkatan yang lebih baik. Semoga skripsi ini bisa bermanfaat bagi pengembangan ilmu pertanian Indonesia dan menjadi acuan untuk penelitian berikutnya. Atas perhatiannya, penulis mengucapkan terima kasih.
Bogor, Juni 2013
DAFTAR ISI
PENDAHULUAN ... Error! Bookmark not defined.
Latar Belakang ... Error! Bookmark not defined.
Tujuan Penelitian ... Error! Bookmark not defined.
Manfaat Penelitian ... Error! Bookmark not defined.
BAHAN DAN METODE ... Error! Bookmark not defined.
Tempat dan Waktu ... Error! Bookmark not defined.
Metode ... Error! Bookmark not defined.
Perbanyakan A. glycines ... Error! Bookmark not defined.
Pemeliharaan Kohort A. glycines ... Error! Bookmark not defined.
Pengamatan Biologi A. glycines ... Error! Bookmark not defined.
Neraca Kehidupan dan Statistik Demografi A. glycines ... Error! Bookmark not defined.
Rancangan Percobaan ... Error! Bookmark not defined.
HASIL DAN PEMBAHASAN ... Error! Bookmark not defined.
Pengaruh Aplikasi PGPR terhadap Biologi A. glycines .... Error! Bookmark not defined.
Pengaruh Aplikasi PGPR terhadap Statistik Demografi A. glycines .... Error! Bookmark not defined.
Pembahasan Umum ... Error! Bookmark not defined.
KESIMPULAN ... Error! Bookmark not defined.
Simpulan ... Error! Bookmark not defined.
Saran ... Error! Bookmark not defined.
DAFTAR PUSTAKA ... Error! Bookmark not defined.
LAMPIRAN ... Error! Bookmark not defined.
DAFTAR GAMBAR
Gambar 1 Tanaman kedelai dalam kurungan untuk perbanyakan A. glycines 3 Gambar 2Tanaman kedelai dalam kurungan kecil untuk penyediaan A. glycines
instar 1 4
Gambar 3Pemeliharaan kohort A. glycines pada tanaman kedelai 5 Gambar 4Morfologi antena(a),abdomen (b), kauda dan kornikel(c)A. glycines 7 Gambar 5Tinggi tanaman kedelai pada tanaman non PGPR (kontrol) dan tanaman
aplikasi PGPR 8
Gambar 6 Jumlah daun tanaman kedelai pada tanaman non PGPR (kontrol) dan
tanaman aplikasi PGPR 8
Gambar 7Peluang hidup dan keperidian harian A. glycines pada tanaman kedelai non PGPR (kontrol) (a) dan tanaman kedelai aplikasi PGPR (b) 12 Gambar 8Peluang hidup A. glycines pada tanaman kedelai non PGPR (kontrol)dan
tanaman kedelai aplikasi PGPR 13
Gambar 9 Keperidianharian A. glycines pada tanaman kedelai non PGPR
(kontrol)dan tanaman kedelai aplikasi PGPR 13
DAFTAR TABEL
Tabel 1 BiologiA.glycines pada tanaman kedelai non PGPR (kontrol) dan
tanaman kedelaiaplikasi PGPR 9
Tabel 2 Statistik demografi A.glycines pada tanaman kedelai non PGPR (kontrol)
dan tanaman kedelai aplikasi PGPR 14
Tabel Lampiran 1Biologi A. glycines pada tanaman kedelai no PGPR (kontrol) 23 Tabel Lampiran 2Biologi A. glycines pada tanaman aplikasi PGPR 24 Tabel Lampiran 3Neraca KehidupanA. glycines pada tanaman kedelai non PGPR
(kontrol) 25
PENDAHULUAN
Latar Belakang
Kedelai merupakan komoditas pertanian yang sangat dibutuhkan di Indonesia baik sebagai bahan pangan manusia, pakan ternak, maupun bahan baku industri. Kebutuhan kedelai dalam negeri dari tahun ke tahun cenderung terus meningkat seiring pesatnya perkembangan industri pangan dan pakan olahan berbahan baku kedelai, namun produksi kedelai dalam negeri mengalami fluktuasi.
Produksi kedelai pada tahun 2010 sebesar 907 031 ton. Sedangkan pada tahun 2011 produksi kedelai menurun menjadi sebesar 851 286 ton, dan data terakhir produksi kedelai tahun 2012 mengalami kenaikan menjadi sebasar 851 647 ton. Berdasarkan hasil produksi kedelai dalam negeri pada tahun 2012 hanya dapat memenuhi sekitar 30% dari kebutuhan nasional (BPS 2012).
Fluktuasinya produksi kedelai disebabkan oleh beberapa hal, diantaranya gangguan hama dan penyakit tanaman. Menurut Soekarno dan Harnoto (1985) salah satu hama utama pada tanaman kedelai yaitu Aphis glycines (Hemiptera: Aphididae). Kerusakan langsung yang disebabkan oleh A. glycines yaitu menghisap daun dan batang tanaman, sehingga menurunkan kualitas dan kuantitas produksi kedelai. Sedangkan kerusakan tidak langsung yang disebabkan oleh A. glycines yaitu menjadi vektor dari beberapa virus penyebab penyakit tanaman, diantaranya Soybean mosaic virus (SMV) dan Soybean dwarf virus (SbDV).
Kehilangan hasil tanaman kedelai yang disebabkan oleh penyakit SMV yang ditularkan oleh A. glycines sekitar 80%, sedangkan kehilangan hasil akibat serangan penyakit SbDV sekitar 40% (Burrows et al. 2005; Harrison et al. 2005). Namun di Indonesia belum diketahui kehilangan hasil yang disebabkan oleh kedua penyakit tersebut, tetapi dilaporkan penyakit tersebut telah menyebar di Indonesia. Tingginya kehilangan hasil tanaman kedelai akibat penyakit yang ditularkan oleh A. glycines, sehingga diperlukan pengendalian terhadap populasi A. glycines sampai batas yang tidak merugikan secara ekonomi.
Langkah tercepat, efektif dan efisien dalam mengendalikan hama A. glycines adalah dengan aplikasi pestisida. Namun penggunaan insektisida yang berlebihan menimbulkan dampak negatif seperti terjadinya resistensi, resurjensi, hama sekunder dan residu. Oleh karena itu, pendekatan lain yang lebih berwawasan lingkungan perlu diupayakan untuk diterapkan dalam pengendalian hama.
Pengendalian hama terpadu merupakan metode pengendalian hama yang berwawasan lingkungan dan telah ditetapkan sebagai kebijakan utama pengendalian hama dan penyakit tanaman di Indonesia, misalnya pengendalian hayati. Pengendalian hayati merupakan metode pengendalian yang memanfaatan agens hayati untuk mengurangi populasi hama sampai di bawah garis ambang ekonomi. Salah satu pengendalian hayati yang sering digunakan untuk menurunkan serangan hama dan penyakit tanaman ialah PGPR (Plant Growth Promoting Rhizobacteria).
PGPR merupakan kelompok bakteri yang dapat dimanfaatkan sebagai pupuk hayati untuk membantu tanaman dalam suplai hara dan memperkuat
2
terhadap serangan hama maupun penyakit tanaman (Soesanto 2008). Kombinasi Bradyrhizobium dan PGPR dapat meningkatkan serapan hara, pertumbuhan vegetatif dan produktif tanaman kedelai (Haino 2009). Telah diketahui beberapa mikroba potensial dapat memacu pertumbuhan tanaman, biokontrol dan pelarut fosfat yaitu Bacillus sp. dan Pseudomonas sp., sehingga PGPR menjadi salah satu pengendalian hayati yang memanfaatkan agens hayati.
Penelitian mengenai PGPR sebagai pengendalian hama dan penyakit tanaman telah lama dilakukan. Menurut hasil penelitian Sentilraja et al. (2012) menyatakan bahwa campuran bioformulasi PGPR yang mengandung P. fluorescens dengan fungi entomopatogen Beauveria bassiana secara signifikan dapat menekan hama leafminer Aproaerema modicella dan penyakit busuk yang disebabkan oleh Sclerotium rolfsii pada kacang tanah. Selain itu pertahanan tanaman terhadap serangga hama dan penyakit tanaman yang diinduksi oleh PGPR juga dapat menurunkan makan kumbang Diabrotica undecimpunctata howardi Barber dan keparahan penyakit layu yang sebabkan Erwinia carotovora pada tanaman mentimun (Zehnder et al. 1997).
PGPR sebagai pengendalian hayati dapat menekan populasi hama dengan menginduksi resistensi pada tanaman (Soesanto 2008). Resistensi adalah sifat ketahanan tanaman yang memberikan pengaruh buruk terhadap hama. Ketahanan terinduksi pada jaringan vegetatif tanaman sehingga dapat mengganggu proses makan dan kehidupan hama. Proses makan yang terganggu akan memberikan dampak negatif terhadap pertumbuhan, perkembangan dan reproduksi hama. Hal ini merupakan salah satu faktor pembatas perkembangan populasi hama.
Kepadatan populasi serangga di suatu tempat mempunyai arti penting karena akan menimbulkan permasalahan hama (Untung 1993). Kepadatan populasi serangga dipengaruhi oleh kecepatan pertumbuhannya. Kecepatan pertumbuhan populasi adalah jumlah organisme yang berkembang dalam populasi persatuan waktu. Price (1997) menyatakan untuk mengetahui pertumbuhan populasi suatu spesies harus diketahui terlebih dahulu jumlah keturunan yang dihasilkan oleh seekor betina pada interval umur hidupnya dan jumlah individu yang dilahirkan pada setiap interval umur tersebut. Pertumbuhan populasi dapat dihitung berdasarkan pertumbuhan betina dalam menghasilkan keturunan.
Pengaruh PGPR terhadap peluang hidup dan kemampuan menghasilkan keturunan (keperidian) A. glycines dapat diketahui dengan merancang suatu neraca kehidupan (life table). Dari data neraca kehidupan akan didapatkan informasi detail mengenai kelahiran, perkembangan, reproduksi, dan kematian setiap individu dalam suatu populasi. Informasi ini merupakan informasi dasar yang dibutuhkan untuk mempelajari berbagai aspek dan perilaku suatu populasi (Wilson dan Bossert 1971; Price 1997).
Tujuan Penelitian
Penelitian ini dilakukan untuk mengetahui pengaruh PGPR terhadap biologi dan statistik demografi A. glycines sebagai hama pada tanaman kedelai.
Manfaat Penelitian
Manfaat yang diharapkan dari penelitian ini yaitu dapat memberikan informasi untuk pengendalian hama A. glycines pada tanaman kedelai.
BAHAN DAN METODE
Tempat dan Waktu
Penelitian dilaksanakan di Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor. Penelitian ini dimulai pada bulan Januari sampai April 2013.
Metode Perbanyakan A. glycines
Benih kedelai varietas Anjasmoro untuk perbanyakan A. glycines ditanam pada 15 polibag ukuran 30 x 30 cm yang diisi media tanam tanah dan kompos (2:1) sebanyak 4 kg/polibag, serta ditambahkan pupuk NPK biru dengan dosis 0.5 g/polibag. Setiap polibag ditanami 6 benih kedelai, kemudian pemeliharaan tanaman dilakukan di dekat Laboratorium Pendidikan.
A. glycines didapat dari tanaman kedelai di lahan petani Megamendung Bogor. A. glycines diinokulasi, dipelihara, dan diperbanyak pada tanaman kedelai yang telah berumur 2 MST (minggu setelah tanam) (Gambar 1). Tanaman kedelai tersebut sebelumnya disungkup dengan plastik mika silindris yang bagian atasnya ditutupi kain kasa. A. glycines dibiarkan berkembang biak sampai jumlahnya mencukupi untuk digunakan pada perlakuan.
Gambar 1 Tanaman kedelai dalam kurungan untuk perbanyakan A. glycines
Pemeliharaan Kohort A. glycines
Sebanyak 240 butir benih kedelai varietas Grobogan untuk perlakuan dicuci dengan air bersih. Kemudian benih ditiriskan pada kertas steril dan dikering anginkan selama 15 menit. Selanjutnya dipisahkan 120 butir untuk perlakuan kontrol dan 120 butir lainnya untuk perlakuan aplikasi PGPR. PGPR yang digunakan yaitu merek dagang Rhizomax dalam bentuk formulasi tepung yang memiliki kandungan B. polymyxa dan P. fluorescens. Suspensi PGPR dibuat dengan mencampurkan 50 gram PGPR ke dalam 5 liter aquades, kemudian diaduk hingga merata. Benih kedelai sebanyak 120 butir direndam ke dalam suspensi PGPR dan 120 butir lainnya direndam ke dalam aquades selama 15 menit.
4
Selanjutnya benih ditiriskan pada kertas steril dan dikering anginkan selama 15 menit. Benih kedelai ditanam pada 60 polibag ukuran 30 x 30 cm yang diisi media tanam, serta ditambahkan pupuk Ponska dengan dosis 0.5 g/polibag, kemudian setiap polibag ditanami 4 benih kedelai.
Suspensi PGPR sisa rendaman disiramkan pada media tanam perlakuan aplikasi PGPR sebanyak 150 ml/polibag, sedangkan pada media tanam kontrol disiramkan dengan air bersih sebanyak 150 ml/polibag. Penyiraman suspensi PGPR Rhizomax pada tanaman aplikasi PGPR dan air bersih pada tanaman kontrol dilakukan juga saat tanaman kedelai umur 2 MST. Selanjutnya tanaman dipelihara di dekat Laboratorium Pendidikan. Dilakukan pengamatan terhadap tinggi tanaman dan jumlah daun tanaman kontrol maupun tanaman aplikasi PGPR. Pengukuran suhu dan kelembaban juga dilakukan setiap hari dengan mengukur suhu normal, suhu minimum, suhu maksimum, dan kelembabannya dengan termohigrometer pada waktu pagi, siang dan sore.
Benih kedelai varietas Grobogan yang akan digunakan untuk makanan imago A. glycines agar melahirkan nimfa instar 1 ditanam pada 25 gelas plastik ukuran 200 ml yang diisi media tanam 200 g/gelas plastik tanah dan kompos (2:1), dan setiap gelas ditanami 2 benih kedelai. Tanaman kedelai umur 7 HST (hari setelah tanam) disungkup dengan plastik mika silindris yang bagian atasnya ditutupi kain kasa (Gambar 2). Kemudian pada tanaman kedelai umur 8 HST diletakkan 2 imago A. glycines, sehingga pada hari berikutnya akan didapatkan A. glycines nimfa instar 1 yang baru dilahirkan oleh imago A. glycines.
Gambar 2 Tanaman kedelai dalam kurungan kecil untuk penyediaan A. glycines instar 1
A. glycines nimfa instar 1 dalam populasi kohort diinokulasi pada tunas
tanaman perlakuan kontrol dan tanaman aplikasi PGPR umur 3 MST yang telah disungkup dengan plastik mika yang bagian atas dan bawahnya ditutupi kain kasa, serta dialasi karton hitam (Gambar 3). Kohort merupakan kelompok individu yang lahir dalam interval waktu yang hampir sama (Begon et al. 2008). Setiap polibag diambil 4 tunas, sehingga terdapat 4 A. glycines nimfa instar 1/polibag pada tanaman kontrol dan tanaman aplikasi PGPR. Inokulasi dilakukan pada tanaman
5
kedelai umur 3 MST karena menurut Rusli (1991) tanaman umur 3 MST memberikan kehidupan yang lebih baik terhadap biologi A. glycines.
Beberapa imago A. glycines diambil dan diawetkan ke dalam alkohol 70% untuk diidentifikasi. Preparat sementara dapat dibuat dengan cara merebus A.
glycines selama 3 menit di dalam alkohol 95%. Setelah itu A. glycines
dimasukkan ke dalam KOH 10% dan direbus hingga transparan, kemudian isi abdomen A. glycines dikeluarkan dengan menusuk-nusuk bagian abdomennya di bawah Mikroskop stereo. Kemudian A. glycines dicuci dengan aquades sebanyak 2 kali dan direndam ke dalam alkohol bertingkat 50%, 80%, 95%, 100%, dan minyak cengkeh masing-masing selama 10 menit. Selanjutnya A. glycines ditempatkan pada gelas objek dan gunakan hoyer untuk menempelkan gelas objek tersebut, kemudian A. glycines dipanaskan ke dalam Hotplane selama 7 hari.
Gambar 3 Pemeliharaan kohort A. glycines pada tanaman kedelai
Pengamatan Biologi A. glycines
Pengamatan dilakukan setiap hari pada masing-masing A. glycines yang masih hidup atau sudah mati, ganti kulit dengan adanya eksuvia, dan jumlah nimfa yang dilahirkan. Siklus hidup A. glycines dihitung sejak nimfa instar 1 diinokulasi ke tanaman perlakuan sampai menjadi imago. Selama perkembangan menjadi imago A. glycines akan mengalami fase nimfa sebanyak 4 stadia instar, perpindahan antar instar dibedakan melalui pergantian kulit. Selanjutnya praoviposisi A. glycines dihitung sejak menjadi imago hingga imago tersebut melahirkan nimfa untuk pertama kalinya. Sedangkan pengamatan lama hidup dilakukan mulai dari A. glycines menjadi imago hingga imago tersebut mati. Dan pengamatan keperidian didapat dari hasil jumlah nimfa yang dilahirkan oleh setiap imago A. glycines selama hidupnya. Berdasarkan hasil pengamatan harian disusun dalam bentuk tabel biologi A. glycines. Pengamatan meliputi lamanya stadia nimfa instar 1, instar 2, instar 3, instar 4, siklus hidup, praoviposisi, lama hidup, dan keperidian pada tanaman kedelai non PGPR (kontrol) maupun tanaman kedelai aplikasi PGPR.
6
Neraca Kehidupan dan Statistik Demografi A. glycines
Jumlah individu yang masih hidup dihitung setiap hari, sehingga diperoleh data peluang hidup (lx) A. glycines pada berbagai umur. Pengamatan keperidian
harian (mx) dilakukan dengan rata-rata jumlah nimfa A. glycines yang dilahirkan
oleh setiap imago untuk berbagai umur (x). Dari data pengamatan peluang hidup dan keperidian harian digambarkan dalam bentuk kurva dan diperoleh neraca kehidupan.
Neraca kehidupan kohort merupakan neraca kehidupan yang mengikuti perkembangan kohort dimulai dari kemunculan individu pertama sampai individu terakhir yang bertahan hidup (Begon et al. 2008). Adapun data mengenai pengamatan kohort A. glycines selama satu generasi disusun dalam bentuk neraca kehidupan (life table). Dari data neraca kehidupan tersebut perhitungan dapat dilanjutkan untuk menentukan parameter-parameter statistik demografi lainnya (Price 1997; Wilson dan Bossert 1971). Statistik demografi serangga oleh Zeng et al. (1983) diartikan sebagai analisis secara kuantitatif populasi serangga dalam hubungannya dengan kelangsungan hidup, keperidian, dan pola pertumbuhan populasi. Seperti,
1. Laju Reproduksi Kotor (GRR) = x
2. Laju Reproduksi Bersih (Ro) = xmx
3. Laju pertambahan intrinsik (rm) = xmx = 1
4. Rerata masa generasi (T) = (ln Ro)/rm
5. Populasi berlipat ganda (DT) = ln(2)/rm
Laju reproduksi bersih (Ro) merupakan rata-rata jumlah keturunan (dari fase pertama dalam suatu siklus hidup) yang dihasilkan oleh setiap imago (Begon et al. 2008). Laju pertumbuhan intrinsik (rm) menggambarkan laju peningkatan populasi
dengan sumberdaya yang tidak terbatas (Price 1997). Rataan lama generasi (T) merupakan rataan waktu yang dibutuhkan sejak nimfa dilahirkan sampai menjadi imago dan melahirkan nimfa untuk pertama kalinya (Price 1997; Begon et al. 2008). Doubling time (DT) yaitu waktu yang dibutuhkan untuk populasi A. glycines menjadi berlipat ganda.
Rancangan Percobaan
Penelitian ini menggunakan 2 perlakuan yaitu tanaman kedelai kontrol dan tanaman kedelai aplikasi PGPR, dengan 65 ulangan pada masing-masing perlakuan. Keragaman data diolah dengan menggunakan Microsoft excel 2007 dan dianalisis dengan program Minitab 16 melalui uji lanjut t pada taraf nyata 5%.
HASIL DAN PEMBAHASAN
Dinamika populasi merupakan fluktuasi populasi serangga dari waktu ke waktu. Tinggi rendahnya populasi serangga ditentukan oleh faktor dalam dirinya sendiri (faktor intrinsik) dan faktor luar (faktor ekstrinsik). Adapun faktor luar yang berpengaruh yaitu makanan dan lingkungan. Beberapa faktor lingkungan seperti suhu udara dan kelembaban udara memiliki kaitan yang sangat erat terhadap iklim mikro perkembangan populasi serangga (Speight et al. 2008).
Berdasarkan hasil pengukuran harian suhu minimal lingkungan berkisar 25.3-31.6 °C, suhu normal berkisar 25.6-33.6 °C, dan suhu maksimal berkisar 28.6-34.7 °C. Namun suhu optimum bagi populasi Aphis sp. berkisar 15-25 °C (Van der goot 1917 dalam Cottier 1953), sedangkan untuk kelembaban minimal berkisar 32-75%, kelembaban normal berkisar 56-99%, dan kelembaban maksimal berkisar 58-99%. Menurut Sunjaya (1970) kelembaban udara optimum bagi serangga pada umumnya berkisar 73-100%.
Beberapa imago A. glycines hasil perbanyakan diidentifikasi menggunakan buku identifikasi Blackmann dan Eastop (2000). Hasil identifikasi menunjukkan bahwa imago tersebut merupakan spesies dari Aphis glycines Matsumura Ordo Hemiptera Famili Aphididae dengan melihat ciri-ciri morfologinya (Gambar 4).
Gambar 4 Morfologi antena (a), abdomen (b), kauda dan kornikel (c) A. glycines
Tubuh A. glycines berwarna hijau kuning dengan 6 ruas antena dan memiliki kauda dengan 8-10 rambut. Selain itu bagian abdomen imago A. glycines terdapat sepasang kornikel yang muncul pada ruas ke lima atau ke enam. Kornikel tersebut berwarna hitam dengan bentuk silindris yang ujungnya meruncing dan sama panjang dengan kauda. Panjang tubuh A.glycines dewasa berkisar 1-1.16 mm dan umumnya tidak bersayap, tetapi kadang yang dewasa mempunyai sayap yang transparan (Borror et al. 1996). Reproduksi A. glycines secara partenogenesis dan vivipar (Kalshoven 1981).
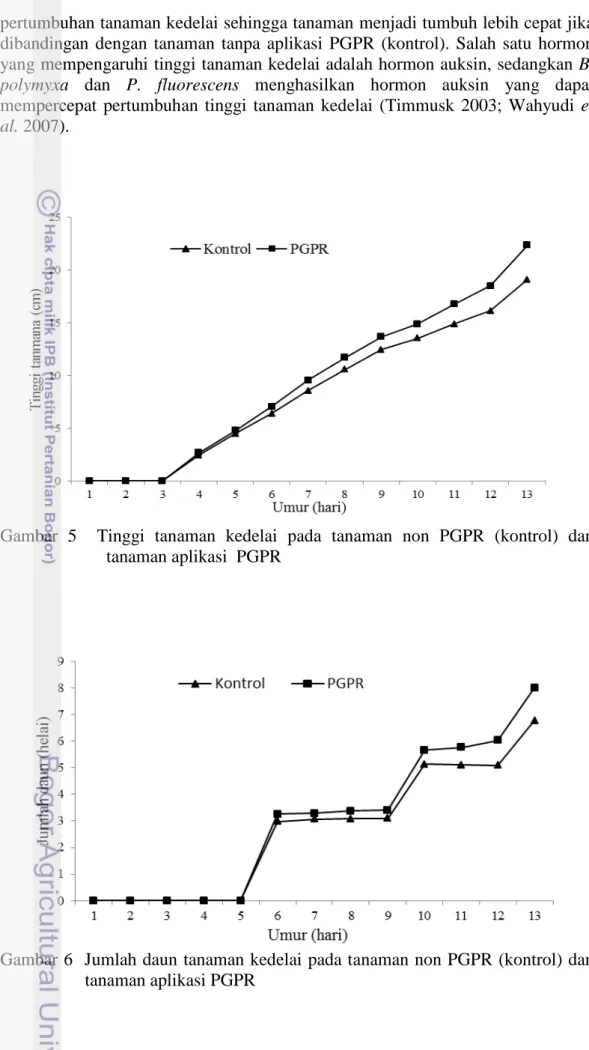
Aplikasi PGPR pada tanaman kedelai mempengaruhi beberapa morfologi tanaman seperti tinggi tanaman dan jumlah daun (Gambar 5). Tanaman aplikasi PGPR secara rata-rata memiliki tinggi tanaman yang lebih tinggi dibandingkan dengan tanaman kontrol sejak awal pertumbuhan setelah benih berkecambah. Hal ini menunjukkan bahwa aplikasi PGPR memberikan dampak positif terhadap
Antena Abdomen Kauda Kornikel a b c Kornikel Kauda
8
pertumbuhan tanaman kedelai sehingga tanaman menjadi tumbuh lebih cepat jika dibandingan dengan tanaman tanpa aplikasi PGPR (kontrol). Salah satu hormon yang mempengaruhi tinggi tanaman kedelai adalah hormon auksin, sedangkan B.
polymyxa dan P. fluorescens menghasilkan hormon auksin yang dapat
mempercepat pertumbuhan tinggi tanaman kedelai (Timmusk 2003; Wahyudi et al. 2007).
Gambar 5 Tinggi tanaman kedelai pada tanaman non PGPR (kontrol) dan tanaman aplikasi PGPR
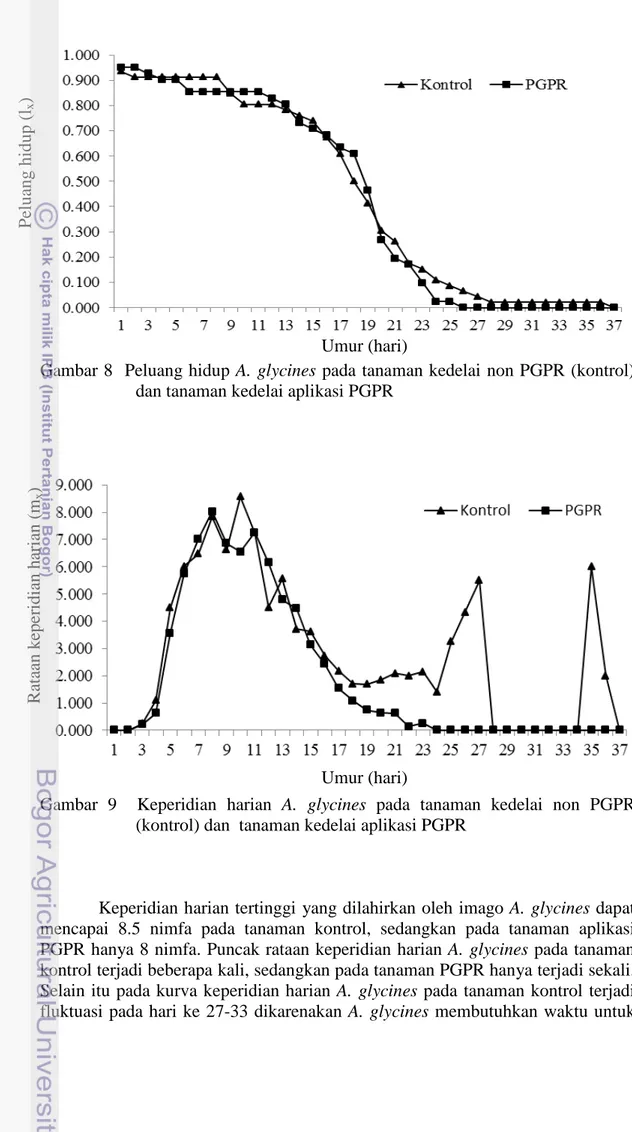
Gambar 6 Jumlah daun tanaman kedelai pada tanaman non PGPR (kontrol) dan tanaman aplikasi PGPR
9
Tanaman kedelai aplikasi PGPR juga menunjukkan jumlah daun yang lebih banyak dari awal pengamatan dibandingkan dengan tanaman non PGPR (kontrol) (Gambar 6). Jumlah daun yang banyak pada tanaman aplikasi PGPR akan meningkatkan kemampuan tanaman untuk berfotosintesis, sehingga akan mempengaruhi terhadap produksi polong yang dihasilkan oleh tanaman kedelai. Umumnya pertambahan jumlah daun akan menambahkan jumlah kutudaun A. glycines karena rimbunnya tanaman. Namun hal tersebut tidak terjadi pada hasil penelitian Wirianti (2006) bahwa pada tanaman cabai yang diberikan perlakuan PGPR dengan pertambahan jumlah daun tidak diikuti dengan penambahan kutu kebul Bemisia tabaci. Hal tersebut mendukung bahwa banyaknya jumlah daun belum tentu akan meningkatkan kutudaun A. glycines.
Pengaruh Aplikasi PGPR terhadap Biologi A. glycines
Siklus hidup adalah selang waktu sejak nimfa dilahirkan hingga menjadi imago, dapat dilihat pada Tabel 1. Berdasarkan penelitian Mardiana (1991) siklus hidup A. glycines pada kondisi yang sesuai berkisar 5-8 hari dengan rataan 6.28±0.09 hari. Hasil tersebut menunjukkan bahwa lamanya siklus hidup hasil penelitian Mardiana berbeda dengan hasil penelitian ini dikarenakan adanya perbedaan lingkungan dan varietas tanaman yang digunakan pada penelitian. Penelitian yang dilakukan oleh Mardiana (1995) menggunakan varietas kedelai ialah Lokon, sedangkan penelitian ini menggunakan varietas Grobogan. Sunjaya (1970) mengemukakan bahwa kualitas makanan yang mengandung dapat menentukan pertumbuhan, perkembangan, kesuburan, mortalitas dan keperidian serangga.
Tabel 1 Biologi A. glycines pada tanaman kedelai non PGPR (kontrol) dan tanaman kedelai aplikasi PGPR
Stadia Kontrol (hari) PGPR (hari) Instar 1 1.217 ± 0.088 a 1.344 ± 0.096 a Instar 2 1.130 ± 0.072 a 1.375 ± 0.087 b Instar 3 1.087 ± 0.060 a 1.063 ± 0.043 a Instar 4 1.087 ± 0.060 a 1.125 ± 0.059 a Siklus Hidup 4.522 ± 0.106 a 4.906 ± 0.082 b Praoviposisi 0.391 ± 0.104 a 0.219 ± 0.074 a Lama hidup 14.609 ± 1.059 a 14.094 ± 0.715 a Keperidian 66.565 ± 7.077 a 65.344 ± 3.908 a
Keterangan : Angka pada baris yang sama yang diikuti dengan huruf yang sama tidak berbeda nyata berdasarkan pada uji t pada taraf nyata 5%.
Hasil penelitian menunjukkan siklus hidup A. glycines berbeda nyata antara tanaman kontrol dengan tanaman aplikasi PGPR. Siklus hidup A. glycines pada tanaman aplikasi PGPR mengalami perkembangan lebih lambat dibandingkan pada tanaman kontrol. Hal tersebut dapat disebabkan bahwa tanaman dengan aplikasi PGPR dapat menunda atau memperlambat siklus hidup A. glycines.
10
Lambatnya siklus hidup atau perkembangan A. glycines menjadi imago dewasa akan berkorelasi terhadap terhambat waktu reproduksi, dimana reproduksi merupakan salah satu faktor yang penting dalam keberhasilan serangga untuk menyerang tanaman. Sehingga dengan adanya aplikasi PGPR terhadap tanaman akan berdampak positif terhadap lambatnya waktu reproduksi A. glycines di pertanaman. Kozlowski (1992) menyatakan bahwa tertundanya waktu reproduksi akan berdampak terhadap peningkatan mortalitas sebelum reproduksi, penurunan masa reproduksi, penurunan output reproduksi dan waktu generasi menjadi lebih lama.
A. glycines mengalami 4 kali ganti kulit (4 stadia instar nimfa) selama perkembangan menjadi imago. Lama stadia nimfa instar 2 A. glycines pada tanaman kontrol berbeda nyata dengan tanaman aplikasi PGPR. A. glycines pada tanaman aplikasi PGPR mengalami lama stadia nimfa instar 2 lebih lambat dibanding dengan tanaman kontrol. Hal ini menunjukkan bahwa aplikasi PGPR pada tanaman dapat memperlambat lamanya stadia nimfa instar 2 A. glycines, sehingga akan memperlambat siklus hidup maupun perkembangan A. glycines menjadi imago dewasa. Hal ini sejalan dengan penelitian Wirianti (2006) bahwa PGPR dengan kandungan B. polymyxa dan P. fluorescens mampu menghambat perkembangan nimfa B. tabaci. Penundaan waktu perkembangan nimfa dalam dinamika populasi memberikan efek yang menguntungkan terhadap pengendalian hama.
Begon et al. (2008) menyatakan bahwa laju perkembangan yang cepat dapat meningkatkan kebugaran serangga dan mempercepat inisiasi reproduksi. Inisiasi reproduksi lebih awal dapat diartikan sebagai mempercepat siklus hidup suatu generasi. Siklus hidup suatu generasi selesai dalam waktu singkat akan memperkecil kesempatan musuh alami untuk menekan hama tersebut. Kondisi ini akan menjadi faktor pembatas dalam pemanfaatkan musuh alami sebagai salah satu bentuk pengendalian hayati.
Aplikasi PGPR pada tanaman kedelai dapat memperlambat stadia nimfa instar 2 A. glycines karena pada stadia nimfa instar 1 A. glycines yang baru dilahirkan masih dalam masa pencarian tempat tinggal dan nutrisi yang didapat dari induknya mampu mencukupi perkembangan stadia nimfa instar 1. Namun pada stadia nimfa instar 2 A. glycines berada dalam masa pencocokan dan penghisapan cairan tanaman sehingga dengan aplikasi PGPR pada tanaman dapat memberi dampak negatif terhadap penghambatan cairan tanaman yang diperoleh A. glycines untuk memenuhi nutrisinya. Sedangkan pada stadia nimfa instar 3 dan instar 4 A. glycines berada pada masa beradaptasi sehingga aplikasi PGPR tidak memberi pengaruh yang nyata pada masa stadia nimfa A. glycines tersebut.
Keperidian imago A. glycines diperoleh dari jumlah nimfa yang dilahirkan oleh setiap imago hingga imago tersebut mati. Sedangkan praoviposisi merupakan waktu sejak A. glycines menjadi imago hingga dapat melahirkan nimfa untuk pertama kalinya. A. glycines selama hidupnya tidak melahirkan setiap harinya, biasanya hari-hari tanpa melahirkan terjadi menjelang kematian. Menurut Cottier (1953) menyatakan bahwa dalam keadaan lingkungan yang optimal A. glycines dapat menghasilkan sebanyak 60 nimfa.
Keperidian dan masa praoviposisi A. glycines tidak berbeda nyata antara tanaman kontrol dan tanaman aplikasi PGPR. Menurut Chapman (1982) Reproduksi serangga dipengaruhi oleh nutrisi protein yang dikonsumsinya.
11
Sedangkan kedelai memiliki kandungan protein tertinggi diantara komoditas pertanian lainnya (Suprapti 2005). Tingginya kadar protein dalam tanaman kedelai mengakibatkan aplikasi PGPR belum mampu mempengaruhi keperidian A. glycines.
Lama hidup merupakan waktu sejak A. glycines menjadi imago hingga imago tersebut mati, tertera pada Tabel 1. Lama hidup A. glycines lebih cepat pada tanaman aplikasi PGPR dibanding dengan tanaman kontrol walaupun tidak berbeda nyata. Kurangnya nutrisi yang dibutuhkan oleh A. glycines karena sulitnya penghisapan cairan tanaman untuk memperoleh makanan, sehingga A. glycines tersebut menjadi tidak mampu hidup lebih lama pada tanaman aplikasi PGPR. Hal tersebut sejalan dengan hasil penelitian Zehnder et al. (1997) bahwa PGPR dapat menurunkan konsumsi makan kumbang Diabrotica undacimpunctata howardi Barber pada tanaman mentimun, karena adanya sistem pertahanan tanaman yang diinduksi oleh PGPR. Sehingga hal Ini akan juga menunjukkan bahwa tanaman aplikasi PGPR dapat mempercepat kematian A. glycines. Hal tersebut dapat berkorelasi terhadap pendeknya waktu keperidian A. glycines. Menurut Natawigena (1990) semakin lama umur imago betina maka akan semakin lebih lama kesempatan bertelur atau melahirkan.
Pengaruh Aplikasi PGPR terhadap Statistik Demografi A. glycines
Setiap organisme mempunyai variasi jangka hidup yang terbatas, yang menentukan karakteristik kelangsungan hidupnya di dalam suatu populasi. Hasil pengamatan menunjukkan peluang hidup (lx) dan keperidian harian (mx) A.
glycines pada tanaman kontrol dan tanaman aplikasi PGPR dapat dilihat pada Gambar 7.
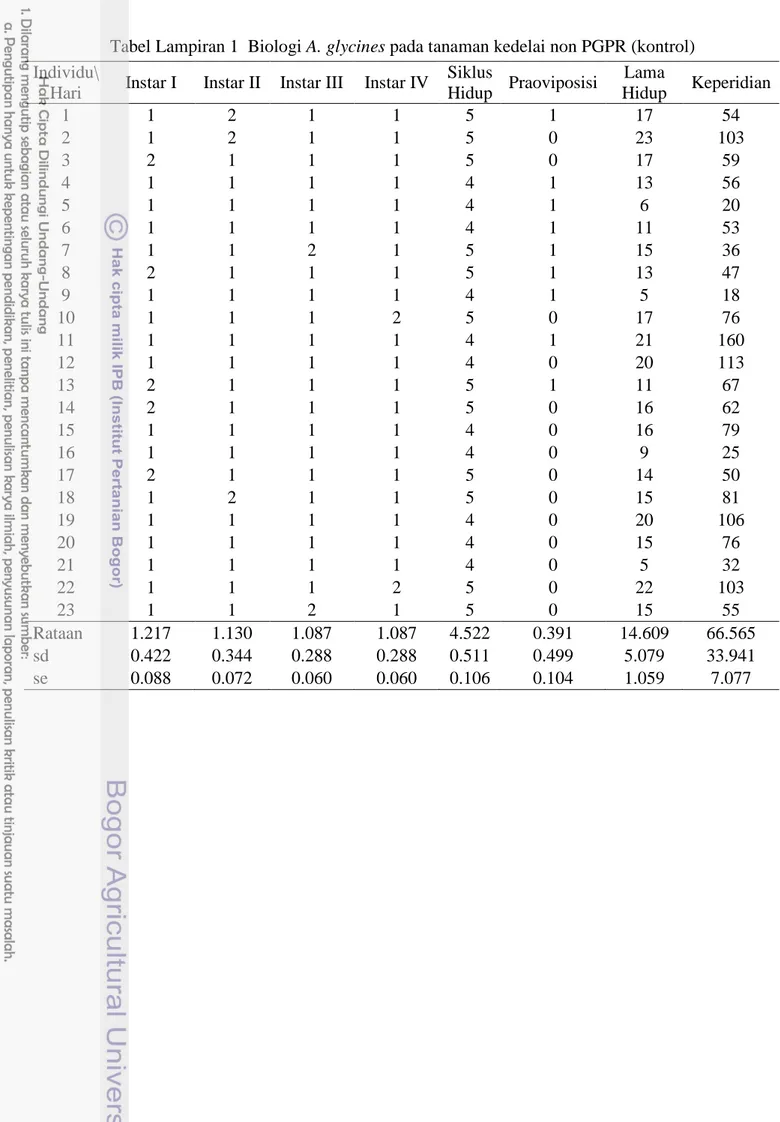
Peluang hidup A. glycines menunjukkan pola yang hampir sama antara tanaman kontrol dan tanaman aplikasi PGPR termasuk tingkat mortalitas yang terjadi selama perkembangan nimfa dan imago. Mortalitas beberapa A. glycines telah terjadi pada saat stadia nimfa instar 1. Kurva peluang hidup A. glycines menunjukkan peningkatan laju mortalitas secara bertahap yang terjadi selama fase perkembangan, namun tingginya tingkat mortalitas terjadi saat A. glycines sudah melewati fase nimfa. Imago A. glycines mengalami mortalitas setiap hari satu per satu sampai tidak ada yang tersisa karena batas fisiologi.
Agar memperjelas perbandingan peluang hidup A. glycines pada tanaman kontrol dengan tanaman aplikasi PGPR dapat dilihat pada Gambar 8. A. glycines paling lama hidup pada tanaman kontrol hingga 37 hari, sedangkan pada tanaman aplikasi PGPR hanya 25 hari. Hal tersebut dikarenakan adanya pertahanan tanaman yang diinduksi oleh PGPR sehingga membuat A. glycines menjadi tidak mampu hidup lebih lama karena sulit memperoleh cairan tanaman. Hal ini menunjukkan bahwa PGPR menginduksi pertahanan pada tanaman yang dapat mempercepat kematian A. glycines. Sesuai dengan pernyataan Naranjo dan Ellsworth (2005) bahwa tanaman inang merupakan salah satu faktor biotik yang dapat mempengaruhi aspek biologi dan kelangsungan hidup suatu organisme.
Speiht et al. (2008) menjelaskan bahwa kemampuan bertahan hidup (survivorship) merupakan laju kematian organisme pada saat proses pertumbuhan suatu generasi berlangsung. Tipe bertahan hidup A. glycines pada tanaman kontrol dan tanaman aplikasi PGPR (Gambar 8) memperlihatkan pola yang dikenal dengan tipe I. Menurut Price (1997) kurva tipe I adalah kematian organisme
12
dalam jumlah yang sedikit ketika umur muda dan kematian dalam jumlah besar sewaktu organisme tersebut lebih tua, kurva tipe II menunjukkan laju kematian yang konstan, sedangkan tipe III memperlihatkan kematian yang besar terjadi di waktu awal.
Gambar 7 Peluang hidup dan keperidian harian A. glycines pada tanaman kedelai non PGPR (kontrol) (a) dan tanaman kedelai aplikasi PGPR (b)
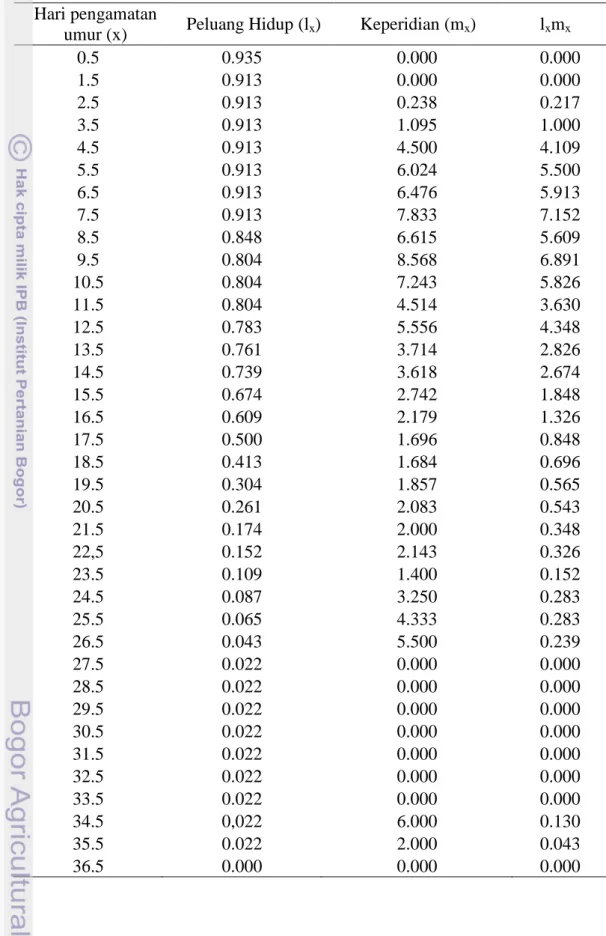
Banyaknya nimfa yang dilahirkan setiap hari digambarkan dalam bentuk kurva mx (keperidian harian) dapat dilihat pada Gambar 9. Ada beberapa A.
glycines pada hari ke-3 saat masih dalam fase perkembangan nimfa sudah dapat melahirkan pada tanaman kontrol maupun tanaman aplikasi PGPR. Kelimpahan makanan merupakan salah satu faktor ekstrinsik yang dapat menyebabkan kecepatan perkembangan dan reproduksi serangga. Kurva keperidian harian (mx)
meningkat secara drastis sesaat setelah A. glycines menjadi imago.
P el ua ng hi dup ( lx ) R at aan ke pe ri di an ha ri an ( mx ) Umur (hari)
13
Gambar 8 Peluang hidup A. glycines pada tanaman kedelai non PGPR (kontrol) dan tanaman kedelai aplikasi PGPR
Gambar 9 Keperidian harian A. glycines pada tanaman kedelai non PGPR (kontrol) dan tanaman kedelai aplikasi PGPR
Keperidian harian tertinggi yang dilahirkan oleh imago A. glycines dapat mencapai 8.5 nimfa pada tanaman kontrol, sedangkan pada tanaman aplikasi PGPR hanya 8 nimfa. Puncak rataan keperidian harian A. glycines pada tanaman kontrol terjadi beberapa kali, sedangkan pada tanaman PGPR hanya terjadi sekali. Selain itu pada kurva keperidian harian A. glycines pada tanaman kontrol terjadi fluktuasi pada hari ke 27-33 dikarenakan A. glycines membutuhkan waktu untuk
P el ua ng hi dup ( lx ) Umur (hari) R at aan ke pe ri di an ha ri an ( mx ) Umur (hari)
14
memenuhi nutrisinya agar dapat melakukan reproduksi kembali. Hal ini menunjukkan bahwa aplikasi PGPR dapat mengurangi tingkat dan banyaknya puncak keperidian harian A. glycines.
Berdasarkan data peluang hidup dan keperidian harian A. glycines, maka diperoleh data statistik demografi yang tertera pada Tabel 2. Nilai Ro memperlihatkan bahwa generasi A.glycines berikutnya yang dipelihara pada tanaman kontrol akan meningkat sebanyak 63.326 kali dari generasi yang sebelumnya. Nilai tersebut lebih tinggi dibanding dengan tanaman aplikasi PGPR yang hanya meningkat sebanyak 57.780 kali.
Tabel 2 Statistik demografi A.glycines pada tanaman kedelai non PGPR (kontrol) dan tanaman kedelai aplikasi PGPR
No Parameter Perlakuan
Kontrol PGPR 1. Laju reproduksi kotor (GRR) 104.861 71.834 2. Laju reproduksi bersih (Ro) 63.326 57.780 3. Laju pertumbuhan intrinsik (rm) 0.586 0.557
4. Rataan lama generasi (T) 7.084 7.287 5. Doubling time (DT) 1.184 1.245
Rendah tingginya Nilai GRR dan Ro serangga memperlihatkan tingkat kesesuaian hidup pada suatu organisme di pertanaman. Hal tersebut dikarenakan dampak positif yang diberikan PGPR terhadap tanaman yang memberikan efek negatif terhadap perilaku makan dan kurangnya nutrisi bagi reproduksi A. glycines, sehingga akan berdampak terhadap rendahnya laju reproduksi kotor maupun laju reproduksi bersih A. glycines. Hal ini menunjukkan bahwa aplikasi PGPR pada tanaman kedelai berpengaruh terhadap rendahnya nilai GRR dan Ro, sehingga dapat mengurangi peningkatan populasi A. glycines pada generasi berikutnya.
Nilai rm yang diperoleh ditentukan oleh berbagai aspek yang berhubungan
dengan kehidupan organisme yaitu kematian, kelahiran, dan waktu perkembangan. Neraca kehidupan dengan data rm dapat memberikan pengetahuan
lebih mendalam mengenai karakteristik pola kehidupan spesies yang diamati (Gill
et al. 1989). Nilai rm yang tinggi dapat diartikan bahwa populasi suatu organisme
memiliki kemungkinan untuk terus tumbuh.
Diperoleh nilai rm pada tanaman kontrol sebesar 0.586 nimfa per hari pada
kondisi lingkungan yang optimum dan sumberdaya tak terbatas. Sedangkan nilai rm pada tanaman aplikasi PGPR sebesar 0.557. Ini menunjukkan bahwa nilai rm A.
glycines pada tanaman kontrol lebih tinggi dibanding dengan tanaman aplikasi PGPR, dikarenakan pengaruh buruk yang diberikan PGPR terhadap proses makan A glycines. Hal ini sejalan dengan hasil penelitian yang dikemukan oleh Pineda et al. (2012) bahwa PGPR dengan kandungan bakteri P. fluorescens memberikan efek negatif terhadap proses makan serangga Myzus percisae yang juga dapat memperlambat laju pertumbuhan intrinsiknya.
15
A. glycines yang dipelihara pada tanaman aplikasi PGPR membutuhkan waktu perkembangan generasi yang lebih lama dibandingkan dengan tanaman kontrol. Waktu lama generasi dipengaruhi oleh lamanya siklus hidup suatu organisme, dimana siklus hidup A. glycines yang hidup pada tanaman aplikasi PGPR memiliki waktu yang lebih panjang sehingga perkembangan menjadi imago dewasa menjadi lebih lambat pula dibandingkan dengan tanaman kontrol. Lambatnya lama generasi akan berdambak terhadap lambat laju pertumbuhan intrinsik A. glycines.
Menurut Southwood dan Henderson (2000) pertumbuhan populasi tergantung dengan lama generasi yang berkaitan dengan laju pertumbuhan. Semakin lama waktu yang dibutuhkan satu generasi untuk berkembang semakin lambat pertumbuhan populasi tersebut. Hal tersebut dimungkinkan karena ada bakteri PGPR yang dapat memperlambat lama generasi A. glycines pada tanaman kedelai.
Nilai rm dan DT berguna untuk menunjukkan pertumbuhan populasi pada
kondisi lingkungan pertumbuhan yang konstan dan sumberdaya yang tidak terbatas (Price 1997; Southwood dan Henderson 2000). A. glycines pada tanaman aplikasi PGPR membutuhkan waktu yang lebih lama untuk melipat gandakan populasinya dibandingkan dengan tanaman kontrol. Hal tersebut diduga adanya pertahanan tanaman yang diinduksi oleh PGPR memberikan pengaruh yang buruk terhadap kehidupan A. glycines. Hal ini akan berkorelasi terhadap panjangnya waktu yang dibutuhkan populasi A. glycies untuk berlipat ganda dan laju pertumbuhannya. Menurut Birch (1948) cepatnya waktu berlipat ganda pada suatu organisme maka akan mempercepat penurunan sumberdaya makanan dan lingkungan, dan juga akan mempengaruhi nilai laju pertumbuhan intrinsik (rm).
Pembahasan Umum
Beberapa mekanisme pertahanan tanaman dengan adanya PGPR yang memiliki kandungan B. polymyxa dan P. fluorescens untuk perlawanan terhadap serangan hama dan penyakit tanaman. Mekanisme pertahanan tanaman yang diberikan kedua bakteri tersebut saling berkombinasi membentuk pertahanan yang kompeten. Pertahanan tersebut melindungi tanaman kedelai terhadap serangan hama dan penyakit tanaman, sehingga mengurangi resiko kehilangan hasil dan meningkatkan produksi tanaman kedelai. Hasil penelitian Hunt et al. (2009) menyatakan bahwa PGPR berpengaruh secara tidak langsung menekan hama Myzus percisae, tetapi meningkatkan secara signifikan terhadap hasil produksi buah lada secara kualitas dan kuantitas.
Mekanisme pertahanan tanaman dengan adanya bakteri P. fluorescens yaitu, pertama menghasilkan hormon sitokinin, auksin, giberelin dan etilen yang mempengaruhi pertumbuhkan dan perkembangan tanaman kedelai. Menurut Wahyudi et al. (2007) Pseudomonas sp. dapat menghasilkan indol acetic acid (IAA). IAA merupakan hormon auksin pertama pada tumbuhan yang mengendalikan berbagai proses fisiologi penting meliputi pembelahan dan perkembangan sel, diferensiai jaringan, respon terhadap cahaya dan grafitasi. Kedua, P. fluorescens menghasilkan antibiotik sebagai pengendalian dari beberapa penyakit tanaman yang sebabkan oleh fungi patogen. Menurut Parjono (2008) bahwa P. fluorescens dapat menekan beberapa penyakit yang disebabkan oleh cendawan Rhizoctonia solani penyebabkan penyakit hawar, cendawan
16
Sclerotium rolfsii penyebabkan penyakit busuk batang dan cendawan Fusarium
oxysporum penyabab penyakit layu fusarium pada tanaman kedelai. Ketiga, P.
fluorescens juga membantu meningkatkan ketersediaan unsur hara makro yang dibutuhkan oleh tanaman diantaranya nitrogen dan fosfat.
Mekanisme pertahanan tanaman dengan adanya B. polymyxa, secara tidak langsung menghasilkan antiobiotik, melindungi tanaman dengan mengkoloni permukaan akar tanaman sehingga mempersulit masuknya patogen ke dalam akar, dan berkompetisi dengan patogen tanah dalam mendapatkan nutrisi maupun tempat di dalam tanah. Bakteri B. polymyxa menghasilkan metabolik sekunder berupa polymiksin sebagai perlawanan terhadap infeksi bakteri patogen pada tanaman. B polymyxa juga menghasilkan enzim kitinase yang dapat menghidroslis dan melisiskan dinding sel cendawan patogen yang berada didalam tanam diantara Erwinia carotovora penyebab penyakit busuk dan Colletotrichum capsici penyabab penyakit antraknosa pada polong kedelai. Selain itu, kemampuan B. polymyxa dapat meningkatkan pertumbuhan tanaman karena memproduksi hormon auksin dan sitokinin disamping dapat memfiksasi nitrogen dan melarutkan fosfat (Timmusk 2003).
Fosfat (P) merupakan salah satu unsur hara makro yang penting untuk pertumbuhan tanaman. Namun unsur hara P mudah difiksasi oleh Al dan Fe pada tanah masam, sedangkan pada tanah alkalin P difikasasi oleh Ca. Tingginya tingkat fiksasi tersebut mengakibatkan penambahan pupuk P ke dalam tanah menjadi tidak efisien. Penggunaan PGPR yang mengandung mikroba pelarut P tersebut mempunyai keunggulan yaitu mampu meningkatkan kelarutan P. Mikroba yang memiliki kemampuan melarutkan P antara lain B. polymyxa dan P. fluorescens (Taha et al. 1969).
Berdasarkan penelitian Timmusk (2003) menunjukkan bahwa B. polymyxa mampu menfiksasi nitrogen dan melarutkan fosfat. Selain itu Setiawati (1998) melaporkan bahwa P. fluorescens juga mampu meningkatkan kelarutan P dari fosfat alam dan AlPO4, serta meningkatkan ketersediaan P di dalam tanah.
Pelarutan fosfat oleh mikroba didahului dengan sekresi asam-asam organik diantaranya asam sitrat, glutamat, suksinat, laktat, oksalat, glioksalat, malat, fumarat. Hasil sekresi tersebut akan berfungsi sebagai katalisator, pengkelat dan memungkinkan asam-asam organik tersebut membentuk senyawa komplek dengan kation-kation Ca2+, Fe2+,dan Al2+ sehingga terjadi pelarutan fosfat dalam bentuk yang tersedia dan dapat diserap oleh tanaman (Beaucamp dan Hume 1997).
Menurut Soepardi (1983) menyatakan bahwa peranan P pada tanaman sangat penting, salah satunya memperkuat daya tahan terhadap hama dan penyakit tanaman. Hal ini sejalan dengan hasil penelitian Rukmowati dan Estiyanti (2009) menunjukkan bahwa pemupukan P dapat menekan populasi Aphis sp. dengan memperpanjang trikomata dan mempertebal kutikula daun kedelai yang dapat menghambat proses penghisapan cairan tanaman. Hal tersebut akan berkolerasi dengan terhambatnya penyerapan nutrisi bagi A. glycines. Nutrisi merupakan salah satu faktor penting yang mempengaruhi kehidupan serangga. Ketersediaan nutrisi dipengaruhi oleh faktor fisik dan kimia tanaman. Faktor-faktor tersebut bekerja secara bersama-sama membentuk suatu sistem pertahanan tanaman, sehingga kebutuhan nutrisi bagi serangga menjadi terhambat (Wiseman 1985).
17
Dinamika populasi suatu organisme dengan keperidian yang tinggi tidak menjamin akan terjadinya peningkatan populasi organisme tersebut. A. glycines pada tanaman kontrol memiliki keperidian yang hampir sama dengan tanaman aplikasi PGPR. Namun nilai rm A. glycines pada tanaman kontrol lebih tinggi
dibanding dengan tanaman aplikasi PGPR. Tingginya nilai rm A. glycines pada
tanaman kontrol akan mempercepatan pertumbuhan populasinya dibanding dengan tanaman aplikasi PGPR. Pertumbuhan populasi A. glycines yang tinggi akan mempercepat terjadinya ledakan A. glycines di pertanaman, sehingga dengan aplikasi PGPR sebagai pengendalian hayati dapat memperlambat pertumbuhan populasi A. glycines.
Laju pertumbuhan populasi dipengaruhi secara langsung oleh lama generasi. Hasil penelitian ini memperlihatkan bahwa aplikasi PGPR pada tanaman kedelai dapat memperpanjang lama generasi A. glycines sehingga laju pertumbuhan pun menjadi lebih lambat. Pertumbuhan populasi yang lambat maka akan memperlambat terjadi ledakan populasi A. glycines di pertanaman. Selain itu, pertumbuhan yang lambat juga akan meningkatkan kemungkinan peluang agens biokontrol lain seperti predator atau parasitoid untuk menekan populasi A. glycines. Oleh karena itu, aplikasi PGPR pada tanaman kedelai sebagai pengendalian hayati memberi pengaruh terhadap populasi A. glycines di pertanaman.
KESIMPULAN
Simpulan
Aplikasi PGPR yang mengandung B. polymyxa dan P. fluorescens dapat memberikan pengaruh yang nyata pada beberapa parameter biologi A. glycines yaitu lama periode nimfa instar 2 dan siklus hidup. Hasil pengamatan harian memperlihatkan dengan aplikasi PGPR dapat mengurangi peluang hidup, tingkat keperidian harian, dan memperpendek lama hari keperidian A. glycines. Neraca kehidupan dan statistik demografi kohort A. glycines menunjukkan bahwa Aplikasi PGPR dapat mengurangi laju reproduksi kotor (Grr) dan laju reproduksi bersih (R0). Selain itu juga memperlambat laju pertumbuhan instrinsik (rm) dengan
memperpanjang lama generasi (T) dan doubling time (DT) A. glycines dipertanaman (sumber daya yang tidak terbatas). Berdasarkan data yang didapat menunjukkan bahwa aplikasi PGPR dengan kandungan bakteri B. polymyxa dan P. florescens sebagai pengendalian hayati dapat menekan ledakan populasi A. glycines.
Saran
Penelitian lebih lanjut dibutuhkan untuk mengetahui mekanisme perpanjangan trikomata dan penebalan kutikula daun maupun batang kedelai setelah aplikasi PGPR dengan kandungan B. polymyxa dan P. fluorescens. Pemahaman mengenai mekanisme ketahanan tanaman setelah aplikasi PGPR untuk mengembangkan PGPR menjadi salah satu pengendalian hayati A. glycines di pertanaman kedelai.
DAFTAR PUSTAKA
Beauchamp EG, Hume DJ. 1997. Agricultural soil manipulation: The use of Bacteria, manuring and plowing. Didalam: Elsas JDV, Trevors JT, Wellington EMH, editor. Modern Soil Microbiology. New York (US): Macel Dekker. hlm 643-664.
Begon M, Townsend CR, Herper JL. 2008. Ecology: From Individuals to Ecosystems. 4th edition. Oxford (GB): Blackwell Puslishing.
Birch LC. 1948. The intrinsic rate of natural increase of an insect population. Journal Animal Ecology. 17:15-26.
Blackmann RL, Eastop VF. 2000. Aphids On The World’s Crops: An
Identification And Information Guide. 2th ed. New York (US): John Wiley &
Sons.
Borror DJ, Johnson NF, Triplehorn CA. 1996. Pengenalan Pelajaran Serangga. Ed ke-6. Partosoedjono S, penerjemah. Yogyakarta (ID): Gadjah Mada University Press. Terjemahan dari: An Introduction to the Study of Insect. [BPS] Badan Pusat Statistik. 2012. Produksi Tanaman Kedelai. Jakarta (ID):
Badan Pusat Statistika.
Burrows MEL, Boerboom CM, Gaska JM, Grau CR. 2005. The relationship between Aphis glycines and Soybean mosaic virus incidence in different pest management systems. Plant Disease. 89(9):926-934.
Chapman RF. 1982. The Insects Structure and Function. 3th ed. Cambridge (US): Harvard University Press.
Cottier.1953. Aphids of New Zealand. Zellington Bull. 6:183-187.
Gill JS, Sidhu AS, Sigh J. 1989. A study to determine innate capacity for increase in numbers of Earias insulana (Boisd) on cotton. Journal of Insect Science. 2(1):289-295.
Haino L. 2009. Efektivitas kombinasi bakteri pemacu tumbuh, Bradyrhizobium dan sumber nutrisi terhadap pertumbuhan vegetatif dan reproduktif kedelai [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Harrison B, Steinlage TA, Domier LL, D’Arcy CJ. 2005. Incidence of Soybean dwarf virus and identification of potential vektor in illinois. Plant Disease. 89(1):28-32.
Hunt CB, Smart CD, Thaler J, Nault BA. 2009. Impact of plant growth promoting rhizobacteria and natural enemies on Myzus persicae (Hemiptera: Aphididae) infestation in pepper. Journal of Economic Entomology. 102(6)2183-2191.
Kalshoven LGE. 1981. The Pests of Crops in Indonesia. Laan PA van der, penerjemah. Jakarta (ID): Ichtiar Baru-van Hoeve. Terjemahan dari: De Plagen van de Cultuurgewassen in Indonesie.
Kozlowski J. 1992. Optimal allocation of resources to growth and reproduction implications for age and size at maturity. Trends in Ecology & Evolution. 7(1):15-19.
Mediana D. 1995. Biologi dan statistika demografi Aphis glycines Matsumura (Homptera: Aphididae) pada tanaman kedelai [skripsi]. Bogor (ID): Institut Pertanian Bogor.
20
Naranjo SE, Ellsworty PC. 2005. Mortality dinamic and population regulation in Bemisia tabaci. Entomologia exsperimentalalis et aplicata. 116(2):93-108. Natawigena H. 1990. Entomologi Pertanian. Bandung (ID): PT. Orba Sakti
Bandung.
Parjono. 2008. Pseudomonas sp. sebagai pemacu pertumbuhan dan pengendalian hayati fungi patogen akar tanaman kedelai [tesis]. Bogor (ID): Institut Pertanian Bogor.
Pineda A, Zheng SJ, Loon JJV, Dicke M. 2012. Rhizobacteria modity plant-aphid interactions: a case of induced systemic susceptibility. Plant Biology. 14(Suppl 1):83-90.
Price PW. 1997. Insect Ecology. 3th ed. New York (US): John Wiley & Sons. Rukmowati RR, Estiyanti S. 2009. Pemupukan fosfat untuk meningkatkan
produksi dan ketahanan tanaman kedelai terhadap Aphis sp. Di dalam: editor. Strategi Perlindungan Tanaman Menghadapi Perubahan Iklim Global dan sistem Perdagangan bebas. Prosiding seminar Nasional
Perlindung tanaman: 2009 Aug 5-6; Bogor. Bogor (ID): Pusat Kajian
Pengendalian Hama Terpadu Institut Pertanian Bogor. hlm 63-70.
Rusli R. 1991. Biologi Aphis glycines Matsumura (Homoptera: Aphididae) pada beberapa tingkat umur tanaman kedelai (Glycine max (L) Merrill). Jurnal Natur Indonesia. 11(1):80-84.
Senthilraja G, Anand T, Kennedy JS, Raguchander T, Samiyappan R. 2012. Plant growth promoting rhizobacteria (PGPR) and entomopathogenic fungus bioformulation enhance the expression of defense enzymes and pathogenesis-related protein in groundnut plant against leafminer insect and collar rot pathogen. Physiological and Molecular Plant Pathology. 82:10-19.
Setiawati TC. 1998. Efektifitas mikroba pelarut P dalam meningkatkan ketersediaan P dan pertumbuhan tembakau Besuki Na-Oogst (Nicotiana tabacum L.) [tesis]. Bogor (ID): Institut Pertanian Bogor.
Soekarno dan Harnoto. 1985. Pengendalian hama kedelai. Di dalam: Somaatmadja S, editor. Kedelai. Bogor (ID): Pusat Penelitian dan Pengembangan Tanaman Pangan Bogor. hlm 319-330.
Soepardi G. 1983. Sifat dan Ciri Tanah. Bogor (ID): Institut Pertanian Bogor. Soesanto L. 2008. Pengantar Pengendalian Hayati Penyakit Tanaman. Jakarta
(ID): PT Rajagrafindo Persada.
Southwood TRE, Henderson PA. 2000. Ecological Method. 3thed. Oxford (GB): Blackwell Science.
Speight MR, Hunter MD, Watt AD. 2008. Ecology of Insect: Concept and Application. 2th ed. Oxford (GB): John Wiley & Sons.
Sunjaya PI. 1970. Dasar-dasar Ekologi Serangga. Diktat tidak dipublikasikan. Bogor (ID): Institut Pertanian Bogor.
Suprapti ML. 2005. Pembuatan Tahu. Yogyakarta (ID): Kanisius.
Taha SM, Mahmoud SAZ, El-Damaty AH, El-hafez AMB. 1969. Activity of phosphate dissolving bacteria in Egyptian soils. Plant Soils. 31(1):149-160. Timmusk S. 2003. Mechanism of action of the plant growth promoting
rhizobacterium Paenibacillus polymyxa [dissertation]. Sweden (SD): Uppsala University.
21
Untung K. 1993. Pengantar Pengelolaan hama Terpadu. Yogyakarta (ID): Andi Offset.
Wahyudi AT, Nawangsih AA, Saraswati R, Yuliarti E. 2007. Pseudomonas sp rhizobacteri pemacu pertumbuhan tanaman yang berpotensi sebagai pengendali penyakit akar tanaman kedelai. Laporan Penelitian KKP3T. Bogor (ID). Departemen Pertanian.
Wilson EO, Bossert WH. 1971. A Primer of Population Biology. Sunderland (US): Sinauer Associates.
Wirianti DA. 2006. Pengaruh penggunaan rhizobacteri pemacu pertumbuhan tanaman terhadap perkembangan populasi kutu kebul Bemisia tabaci (GENNADIUS) (Hemiptera: Aleyrodidae) pada tanaman cabai [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Wiseman BR. 1984. Type and mechanisms of host plant resistence to insect attack. Insect science and its application. 6(3):239-248.
Zehnder G, Kloepper J, Tuzun S, Yao C, Wei G, Chambliss O, Shelby R. 1997. Insect feeding on cucumber mediated by rhizobacteria-induced plant resistance. Entomologia Experimentalis et Applicata. 83:81-85.
Zeng F, Pederson G, Ellsbury M, Davis F. 1983. Demographic statistic for pea aphids (Homoptera: Aphididae) on resistant and susceptible red clovers. Journal of Economic Entomology. 86:1852-1856.
23
Tabel Lampiran 1 Biologi A. glycines pada tanaman kedelai non PGPR (kontrol) Individu\
Hari Instar I Instar II Instar III Instar IV
Siklus Hidup Praoviposisi Lama Hidup Keperidian 1 1 2 1 1 5 1 17 54 2 1 2 1 1 5 0 23 103 3 2 1 1 1 5 0 17 59 4 1 1 1 1 4 1 13 56 5 1 1 1 1 4 1 6 20 6 1 1 1 1 4 1 11 53 7 1 1 2 1 5 1 15 36 8 2 1 1 1 5 1 13 47 9 1 1 1 1 4 1 5 18 10 1 1 1 2 5 0 17 76 11 1 1 1 1 4 1 21 160 12 1 1 1 1 4 0 20 113 13 2 1 1 1 5 1 11 67 14 2 1 1 1 5 0 16 62 15 1 1 1 1 4 0 16 79 16 1 1 1 1 4 0 9 25 17 2 1 1 1 5 0 14 50 18 1 2 1 1 5 0 15 81 19 1 1 1 1 4 0 20 106 20 1 1 1 1 4 0 15 76 21 1 1 1 1 4 0 5 32 22 1 1 1 2 5 0 22 103 23 1 1 2 1 5 0 15 55 Rataan 1.217 1.130 1.087 1.087 4.522 0.391 14.609 66.565 sd 0.422 0.344 0.288 0.288 0.511 0.499 5.079 33.941 se 0.088 0.072 0.060 0.060 0.106 0.104 1.059 7.077
24
Tabel Lampiran 2 Biologi A. glycines pada tanaman aplikasi PGPR Individu\
Hari Instar I Instar II Instar III Instar IV
Siklus Hidup Praoviposisi Lama Hidup Keperidian 1 1 2 1 1 5 0 17 74 2 1 2 1 2 6 0 13 40 3 1 2 1 1 5 0 9 51 4 1 2 1 1 5 0 9 24 5 3 1 1 1 6 0 11 61 6 1 2 1 1 5 0 15 95 7 1 1 1 1 4 1 15 74 8 1 1 1 1 4 1 20 125 9 1 1 1 1 4 1 2 2 10 1 2 1 1 5 0 14 62 11 1 2 1 1 5 0 15 66 12 1 2 1 1 5 0 14 58 13 2 1 1 1 5 0 13 76 14 2 1 1 1 5 0 15 63 15 2 1 1 1 5 0 7 31 16 2 1 1 1 5 0 21 106 17 1 1 1 1 4 1 15 79 18 2 1 1 1 5 0 10 69 19 2 1 1 1 5 0 8 52 20 1 2 1 1 5 0 16 74 21 1 1 2 1 5 1 18 64 22 1 1 1 2 5 0 14 68 23 1 1 1 2 5 0 15 66 24 1 2 1 1 5 1 15 62 25 1 1 1 2 5 0 15 65 26 2 1 1 1 5 0 18 82 27 1 2 1 1 5 0 19 69 28 2 1 1 1 5 0 15 70 29 1 1 1 1 4 1 16 61 30 1 2 1 1 5 0 12 62 31 1 1 2 1 5 0 19 77 32 2 1 1 1 5 0 16 63 Rataan 1.344 1.375 1.063 1.125 4.906 0.219 14.094 65.344 sd 0.545 0.492 0.246 0.336 0.466 0.420 4.043 22.108 se 0.096 0.087 0.043 0.059 0.082 0,074 0.715 3.908
25
Tabel Lampiran 3 Neraca Kehidupan A.glycines pada tanaman kedelai non PGPR (kontrol)
Hari pengamatan
umur (x) Peluang Hidup (lx) Keperidian (mx) lxmx
0.5 0.935 0.000 0.000 1.5 0.913 0.000 0.000 2.5 0.913 0.238 0.217 3.5 0.913 1.095 1.000 4.5 0.913 4.500 4.109 5.5 0.913 6.024 5.500 6.5 0.913 6.476 5.913 7.5 0.913 7.833 7.152 8.5 0.848 6.615 5.609 9.5 0.804 8.568 6.891 10.5 0.804 7.243 5.826 11.5 0.804 4.514 3.630 12.5 0.783 5.556 4.348 13.5 0.761 3.714 2.826 14.5 0.739 3.618 2.674 15.5 0.674 2.742 1.848 16.5 0.609 2.179 1.326 17.5 0.500 1.696 0.848 18.5 0.413 1.684 0.696 19.5 0.304 1.857 0.565 20.5 0.261 2.083 0.543 21.5 0.174 2.000 0.348 22,5 0.152 2.143 0.326 23.5 0.109 1.400 0.152 24.5 0.087 3.250 0.283 25.5 0.065 4.333 0.283 26.5 0.043 5.500 0.239 27.5 0.022 0.000 0.000 28.5 0.022 0.000 0.000 29.5 0.022 0.000 0.000 30.5 0.022 0.000 0.000 31.5 0.022 0.000 0.000 32.5 0.022 0.000 0.000 33.5 0.022 0.000 0.000 34.5 0,022 6.000 0.130 35.5 0.022 2.000 0.043 36.5 0.000 0.000 0.000
26
Tabel Lampiran 4 Neraca Kehidupan A.glycines pada tanaman aplikasi PGPR Hari pengamatan
umur (x) Peluang Hidup (lx) Keperidian (mx) lxmx
0.5 0.951 0.000 0.000 1.5 0.951 0.000 0.000 2.5 0.927 0.211 0.195 3.5 0.902 0.622 0.561 4.5 0.902 3.568 3.220 5.5 0.854 5.743 4.902 6.5 0.854 7.029 6.000 7.5 0.854 8.029 6.854 8.5 0.854 6.857 5.854 9.5 0.854 6.543 5.585 10.5 0.854 7.257 6.195 11.5 0.829 6.147 5.098 12.5 0.805 4.788 3.854 13.5 0.732 4.467 3.268 14.5 0.707 3.138 2.220 15.5 0.683 2.429 1.659 16.5 0.634 1.538 0.976 17.5 0.610 1.080 0.659 18.5 0.463 0.737 0.341 19.5 0.268 0.636 0.171 20.5 0.195 0.625 0.122 21.5 0.171 0.143 0.024 22.5 0.098 0.250 0.024 23.5 0.024 0.000 0.000 24.5 0.024 0.000 0.000 25.5 0.000 0.000 0.000 26.5 0.000 0.000 0.000 27.5 0.000 0.000 0.000 28.5 0.000 0.000 0.000 29.5 0.000 0.000 0.000 30.5 0.000 0.000 0.000 31.5 0.000 0.000 0.000 32.5 0.000 0.000 0.000 33.5 0.000 0.000 0.000 34.5 0.000 0.000 0.000 35.5 0.000 0.000 0.000 36.5 0.000 0.000 0.000