PENGARUH ASAM HUMUS TERHADAP INTERAKSI
RADIONUKLIDA-BENTONIT:
PENGARUH pH LARUTAN PELINDI
Budi Setiawan
Pusat Teknologi Limbah Radioaktif - BATAN
ABSTRAK
Telah dilakukan percobaan pengaruh pH larutan terhadap desorpsi Cs-137 oleh asam humus dari bentonit. Bentonit digunakan sebagai bahan penyangga pada sistem penyimpanan limbah radioaktif dan juga akan berfungsi sebagai penyerap radionuklida yang terlepas ke air tanah dari fasilitas penyimpanan. Adanya material organik seperti asam humus diperkirakan akan meningkatkan lepasan radionuklida ke air tanah. Keasaman air tanah juga diperkirakan akan mempengaruhi besar radionuklida yang lepas dari bentonit ke air tanah. Tujuan percobaan ini adalah menyediakan informasi peran asam humus yang ada di air tanah terhadap interaksi radionuklida-bentonit. Dari hasil kinetika sorpsi Cs-137 ke bentonit diperoleh bahwa keadaan setimbang diperoleh setelah pengocokan sample mencapai 7 hari. Nilai Kd pada kondisi pH: 4 lebih kecil dibandingkan dengan yang lainnya. Hasil ini menunjukkan adanya pengaruh pH larutan terhadap kemampuan asam humus untuk mempengaruhi interaksi antara bentonit dan Cs-137.
ABSTRACT
Experiment of pH solution effect on the desorption of Cs-137 from bentonite has been done. Bentonite is used as buffer material on radwaste disposal system and also has a role as an absorber of radionuclide release from disposal facility. Existence of organic matter such as humic acid is predicted to enhancing of radionuclide release into groundwater. Acidity of groundwater also is predicted to give an effect of radionuclide release from bentonite into groundwater. Objective of the experiment is to provide information of role of humic acid existing in groundwater to the interaction of radionuclide-humic acid. From the result of sorption kinetic of Cs-137 into bentonite was shown that equilibrium conditions were obtained after 7 days contacted. Distribution of Cs-137 on pH 4 condition was smaller than other values. The result showed that the effects of pH solution to humic acid performance were exists to give an affect to interaction of bentonite-Cs-137.
PENDAHULUAN
Pada fasilitas penyimpanan limbah radioaktif (termasuk pada sistem tanah dangkal) digunakan sistem keselamatan berlapis untuk meminimalisir adanya dampak sebaran radionuklida ke lingkungan. Salah satu dari material yang digunakan adalah lempung bentonit. Secara prinsip, bentonit digunakan sebagai penyangga (buffer) untuk menunda terjadinya kontak antara air tanah dan paket limbah, juga dapat berperan sebagai penyerap radionuklida (RN) yang “lepas” dari paket limbah bersama dengan aliran air tanah. Adanya intrusi air tanah ke dalam sistem penyimpanan limbah radioaktif yang berisi paket limbah dapat menyebabkan wadah paket/drum menjadi rusak sehingga menyebabkan RN yang ada di paket limbah akan larut dan ikut hanyut bersama air tanah ¨keluar¨ ke lingkungan. Bentonit sebagai salah satu penghalang buatan yang diletakkan disekeliling paket limbah akan berperan untuk menghalangi penyebaran RN ke lingkungan secara sorpsi agar RN yang terlepas tersebut tidak ikut menyebar ke lingkungan bersama air tanah.
Di air tanah selain RN dan ion-ion logam yang terlarut juga dapat dijumpai adanya material organik seperti asam humus. Asam humus mempunyai sifat yang mudah larut di air tanah, eksis pada rentang konsentrasi yang luas serta berkemampuan ikat yang kuat terhadap ion logam/RN. Pada konsentrasi yang cukup tinggi, asam humus diperkirakan akan menarik dan melepas RN yang terikat di batuan/tanah sepanjang aliran air tanah sehingga menyebabkan RN akan kembali hanyut bersama air tanah [1-4]. Dengan sifatnya yang seperti ini, asam humus ditengarai cukup berperan penting pada migrasi RN ke lingkungan sehingga material ini sangat penting untuk diteliti. Adanya konsentrasi asam humus di air tanah diperkirakan akan mengganggu peran penghambatan RN oleh bentonit di sistem penyimpanan limbah. Penelitian ini akan dilakukan secara eksperimen laboratorium tentang pengaruh asam humus terhadap interaksi RN dengan bentonit.
Parameter-parameter yang diperkirakan akan mempengaruhi kemampuan asam humus “mengganggu” interaksi radionuklida-bentonit adalah pH, kekuatan ion (I, ionic strength) dan konsentrasi ion logam/RN, dimana pada penelitian kali ini telah dilihat pengaruh pH larutan pelindi. Hasil akhir yang akan diperoleh dari percobaan ini adalah tersedianya informasi peran asam humus terhadap interaksi radionuklida-bentonit, kemudian dari sini akan dapat diketahui karakter AH saat berinteraksi RN-bentonit. Informasi ini selanjutnya dapat digunakan untuk mendukung pengkajian keselamatan fasilitas penyimpanan limbah, dan hasilnya dapat digunakan pada pembuatan konsep disain penyimpanan limbah di masa yang akan datang.
BAHAN DAN METODE Bahan
Kegiatan ini dilakukan dalam skala laboratorium dengan menggunakan cara pengocokan manual/batch. Bahan yang dibutuhkan: lempung Na-bentonit, NaCl, CsCl, asam humus dari Aldrich Chem. Co. dan radionuklida Cs-137.
Prosedur
Pada tahap persiapan dilakukan pembuatan Na-bentonit dari tepung Ca-bentonit secara pemanasan dengan furnace dan pencampuran dengan NaCl 3 M [5]. Asam humus juga disiapkan dengan cara dimurnikan seperti pada pustaka [6,7]. Setelah bahan Na-bentonit telah siap, kemudian dilakukan percobaan kinetika sorpsi RN Cs-137 dengan Na-bentonit. Percobaan kinetika sorpsi dengan cara mengontakkan antara bentonit-larutan, ratio 1:100 dan CCs = 5 x 10-8 M, I(ionic strength) =
0,1 M. Campuran tersebut dikocok dan dicuplik secara berkala sampai diperoleh kondisi setimbang antara CsCl yang ada di larutan dengan yang di bentonit. Dilakukan pemisahan fasa padat-cair, 1 ml larutannya diambil untuk diukur aktivitas
γ
-nya dengan menggunakan detektor NaI(Tl) jenis sumuran. Larutan sisanya digunakan untuk mengukur pH larutan.Botol yang tersisa diberi larutan asam humus + larutan buffer untuk mengatur pH, kemudian campuran kembali dikocok sampai diperoleh kondisi setimbang. Dilakukan pemisahan padat-cair, 1 ml larutannya diambil untuk diukur aktivitas
γ
-nya dengan menggunakan detektor NaI(Tl) jenis sumuran. Dari hasil pengukuran aktivitas Cs-137 kemudian dapat dihitung nilai Kd untuk Cs-137. Larutan yang tersisa digunakan untuk mengukur pH larutan. Koefisien distribusi Cs-137 ditulis sebagai,T eq d eq
A
A V
K
A
m
−
=
(1)HASIL DAN PEMBAHASAN
Penentuan Kapasitas Tukar Kation dari Asam Humus
Sebelum dilakukan percobaan pengaruh pH larutan, terlebih dahulu perlu diketahui kapasitas penukaran kation (CEC, cation exchange capacity) dari asam humus terhadap ion logam/RN. Asam humus merupakan polimer yang mempunyai rantai molekul panjang serta gugus fungsionalnya yang beragam. Panjangnya rantai molekul menyebabkan asam humus memerlukan waktu yang cukup untuk dapat berdisosiasi secara sempurna karena reaksi disosiasi asam humus berjalan dengan lambat. Untuk mengetahui jumlah total gugus fungsional asam humus yang akan berinteraksi dengan ion logam dilakukan penentuan kapasitas penukaran kationnya secara titrasi. Pekerjaan titrasi dilakukan dengan menggunakan alat titrasi otomatis yang dilengkapi dengan burette otomatis. Penggunaan peralatan otomatis membuat fluktuasi perubahan potensial asam humus pada setiap penambahan volume basa kuat/NaOH yang diberikan dapat selalu terkontrol.
Total konsentrasi gugus fungsional yang akan berinteraksi dengan ion logam disimbolkan dengan CR, dimana CR didapat dari perhitungan kurva hasil titrasi dan derajat disosiasi (α) dari asam
humus diperoleh dengan cara membandingkan antara [R] dan CR. Untuk dapat menghitung
konsentrasi disosiasi gugus fungsionalnya, asam humus diasumsikan seperti sebuah monomer sehingga persamaan netralisasi muatannya sebagai berikut,
[H] + Cb = [OH] + [R] (2)
VT = Vsampel+ VNaOH + Vasam (3)
karena
CbVT = CNaOHVNaOH – CasamVasam (4)
maka persamaan (2) dapat diubah menjadi [8],
[H]VT + CNaOHVNaOH - CasamVasam = [OH]VT + [R]VT (5)
([H] – [OH])VT + (CNaOHVNaOH – CasamVasam) = [R] VT (6)
di mana [H+] = 10-pH, [OH-] = 10pKw – pH and pKw = 13,78 dan 13,79 masing-masing untuk kekuatan ion
(ionic strength, I) 0,1 dan 1,0 M [9]. Bila CR adalah total konsentrasi gugus fungsional yang terdisosiasi
dari 1 g asam humus, maka
[R] VT = (CR) Wα (7)
W(g) adalah berat asam humus yang ditambahkan dan α adalah derajat disosiasinya. Dari persamaan (6) dapat diperoleh nilai CR dan [R], sedangkan nilai α pada setiap kondisi pH diperolah dari
perbandingan antara [R] dan CR.
[R] = CRα (8)
sehingga konstanta pembentukan komplek dari
β
α=
[
ML]
[
M
][R
]
(9) menjadiβ
α=
[
ML
]
[
M][
R]
=
[
ML
]
[
M]
C
Rα
(10)Cara yang sama juga dilakukan untuk memperoleh nilai CR dan α pada kondisi kekuatan ion
yang berbeda. Penambahan larutan NaOH ke dalam tabung pencampur yang berisi asam humus dikontrol secara otomatis dengan menggunakan titrator TOA AUT-3000, burette otomatis ABT-1000 dan pH larutan diukur dengan elektrode glas GST-5311C. Suhu operasi dijaga sekitar 25 + 0,5 oC
dengan menggunakan circulation water bath. Sebelum digunakan, konsentrasi larutan NaOH terlebih dahulu distandarisasikan dengan 0,1 M asam sulfamik, dan larutan HCl distandarkan dengan larutan NaOH.
Penggunaan metode titrasi ini dapat secara langsung menentukan nilai total konsentrasi gugus fungsional/kapasitas pertukaran kation asam humus. Plotting pH versus basa yang ditambahkan per-gram asam humus ditunjukkan pada Gambar 1. Terlihat bahwa titik akhir titrasi asam humus ditunjukkan sebagai titik-titik yang semakin renggang yang mengindikasikan bahwa disosiasi gugus fungsional pada asam humus masih terus berlangsung dalam fraksi yang semakin mengecil. Titik-titik ini menggambarkan banyaknya gugus COOH dan OH yang bereaksi dengan NaOH. Banyak gugus COOH dan OH pada asam humus berperan sangat penting sebagai penentu jumlah site aktif pertukarannya.
-1 0 1 2 3 4 5 6 7 8 2 4 6 8 10 12 p H
P enam bahan N aO H (m l)
Gambar 1. Kurva titrasi asam humus dengan 0,1 M NaOH, I = 0,1 M NaCl
Nilai CR dan [R] akan dapat diperoleh dengan menggunakan persamaan (6). Nilai [R] sangat
dipengaruhi oleh derajat disosiasi gugus fungsional (α) dan α dipengaruhi oleh kondisi pH larutan. Dari pekerjaan titrasi asam humus ini telah diperoleh nilai total konsentrasi disosiasi gugus fungsional 4,95 meq/g pada kondisi kekuatan ion 0,1 M NaCl.
2
3
4
5
6
7
8
9
10
1
2
3
4
5
6
[R ] (m e q / g ) pHI
: 0,1 M NaCl: 0,4 M
: 1,0 M
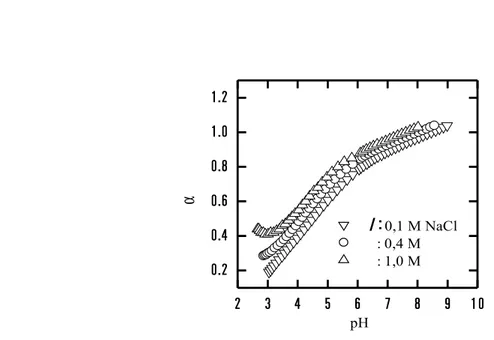
Gambar 2. Perubahan nilai [R] vs pH pada berbagai kondisi kekuatan ion
Pada Gambar 2 ditunjukkan perubahan nilai [R] pada berbagai kondisi pH larutan dengan kondisi kekuatan ion yang berbeda (0,1; 0.4 dan 1.0 M NaCl). Terlihat bahwa total konsentrasi disosiasi gugus fungsional asam humus cenderung meningkat bersamaan dengan meningkatnya kekuatan ion di larutan. Dari hasil perhitungan asam-basa kurva titrasi telah diperoleh nilai total konsentrasi gugus fungsional (CR)/kapasitas pertukaran kation asam humus adalah 4,95, 5,09 dan 5,13
meq/g masing-masing pada kondisi I = 0,1, 0,4 dan 1,0 M NaCl.
Derajat disosiasi (α) diperoleh dengan membandingkan antara nilai [R] dan CR seperti pada
2 3 4 5 6 7 8 9 10 0.2 0.4 0.6 0.8 1.0 1.2
α
pHI :
0,1 M NaCl: 0,4 M
: 1,0 M
Gambar 3. Nilai disosiasi (α) pada berbagai kondisi kekuatan ion
Nilai α cenderung meningkat pada kondisi kekuatan ion yang semakin tinggi, hal ini disebabkan karena adanya kompetisi antara ion-ion Na+ di larutan dengan ion H+ di gugus fungsional. Kompetisi yang
terjadi akan berpengaruh pada pembentukan disosiasi gugus karboksilik pada asam humus. Adanya kuasi pertukaran ion menyebabkan makromolekul asam humus seolah diselimuti dengan muatan negatif, dan ini akan memudahkan asam humus untuk melakukan interaksi dengan ion-ion logam yang ada di larutan.
Kinetika sorpsi Cs-137 dan Na-bentonit
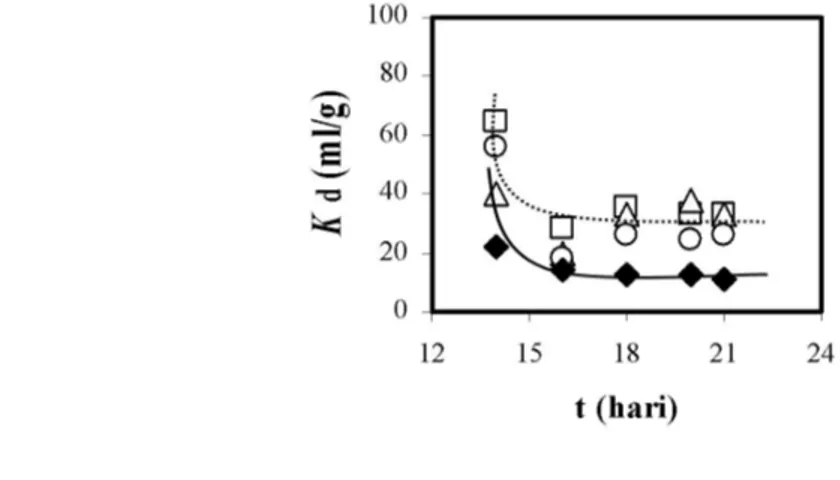
Percobaan kinetika sorsi di tunjukkan pada Gambar 4 (dengan notasi ). Terlihat bahwa keadaan setimbang diperoleh setelah pengocokan sample mencapai 7 hari. Ini terlihat dari mendatarnya kurva Kd yang diperoleh setelah pengocokan sample mencapai hari ke 7, artinya setelah pengocokan selama 7 hari lamanya banyaknya Cs-137 yang ”keluar” dan ”masuk” bentonit dari larutan telah konstan/stabil. Dari hasil kinetika sorpsi ini kemudian dilanjutkan dengan percobaan pengaruh asam humus, atau dengan kata lain bahwa percobaan pengaruh asam humus terhadap interaksi Cs-137-bentonit pada kondisi larutan pH yang berbeda baru dapat dilaksanakan setelah percobaan kinetika sorpsi mencapai hari ke-7.
Pengaruh asam humus terhadap interaksi Cs-137-bentonit pada kondisi pH larutan berbeda
Hasil percobaan ditunjukkan pada Gambar 5. Setelah dicapai keadaan setimbang, larutan yang berisi Cs-137 dan bentonit diberi asam humus dan larutan buffer sebagai pengubah pH larutan. Kondisi pH larutan yang berbeda diberi notasi Δ dan .
Hasil desorpsi Cs-137 dari bentonit ke larutan terlihat memberikan hasil yang beragam satu dengan lainnya, terutama antara notasi Δ dan . Hal ini disebabkan kondisi pH larutan yang terjadi pada Δ, diperoleh pH: 0,24 – 0.65. Sedangkan pada notasi , pH larutan sekitar 4. Pada kondisi keasaman larutan yang seperti ini (pH: 0,24 – 0.65) asam humus sama sekali tidak berperan untuk me¨lepas¨ Cs-137 dari bentonit ke larutan karena pada kondisi pH dibawah 2,5 gugus fungsional asam humus belum aktif/terdisosiasi [10] sehingga desorpsi Cs-137 ke larutan hanya disebabkan oleh adanya gangguan perubahan volume larutan. Sedang pada kondisi pH: 4 telah terbentuk gugus fungsional pada asam humus, akan tetapi karena konsentrasi asam humus yang kecil maka kemampuan menarik Cs-137 dari bentonit juga tidak besar. Walaupun begitu hasil yang diperoleh menunjukkan bahwa nilai Kd pada kondisi pH: 4 lebih kecil dibandingkan dengan yang lainnya. Hasil ini telah menunjukkan adanya pengaruh pH larutan terhadap kemampuan asam humus untuk mempengaruhi interaksi antara bentonit dan Cs-137, walaupun hasil yang diperoleh belum maksimal.
Gambar 5. Pengaruh pH larutan terhadap desorpsi Cs-137 oleh asam humus dari bentonit
Dari hasil titrasi asam-basa dapat diketahui bahwa pada kisaran pH antara 4 sampai 7 pH dari larutan/air tanah akan sangat mempengaruhi peran dari asam humus untuk berinteraksi dengan RN karena pada kisaran tersebut gugus fungsional dari asam humus telah menjadi aktif. Sehingga pada rentang pH seperti ini terlihat adanya kecenderungan dari asam humus untuk berinteraksi dengan dengan RN. Akibatnya adalah nilai Kd RN di bentonit akan menurun/berkurang dibandingkan dengan kondisi sebelum adanya asam humus di larutan. Hasil dari interaksi ini akan mengikat RN yang ada di larutan maupun yang ada di batuan, sehingga asam humus akan ”menarik” RN yang telah terserap oleh bentonit kembali ke air tanah dan sekaligus asam humus dapat berperan sebagai pengemban RN ke biosfer [11].
KESIMPULAN
Telah dilakukan percobaan pengaruh pH larutan terhadap desorpsi Cs-137 oleh asam humus dari bentonit. Dari perhitungan hasil titrasi asam-basa telah diperoleh nilai CR/kapasitas pertukaran
kation asam humus adalah 4,95, 5,09 dan 5,13 meq/g masing-masing pada kondisi I = 0,1, 0,4 dan 1,0 M NaCl. Kemudian dari hasil kinetika sorpsi Cs-137 ke bentonit diperoleh bahwa keadaan setimbang antara bentonit-RN/Cs-137 diperoleh setelah pengocokan sample mencapai lebih dari 7 hari. Pada kondisi pH: 4 nilai Kd yang didapat lebih kecil dibandingkan dengan yang lainnya, karena adanya asam humus di larutan. Hasil ini menunjukkan adanya pengaruh pH larutan terhadap kemampuan asam
UCAPAN TERIMA KASIH
Ucapan terima kasih kepada Bapak Drs. Heru Umbara, Sdr. Drs. Heni Suseno M.Si., Sdri. Wahyu Retno P., A.Md. dan Sdr. Hendra A. Pratama S.Si. dari PTLR-BATAN atas bantuan analisis Cs-137 dan preparasi contoh bentonit.
DAFTAR PUSTAKA
1. Buffle, J (990) Complexation Reactions in Aquatic System: An Analytical Approach, Ellis Horwood, New York.
2. Choppin, G.R (1992) The Role of Natural Organics in Radionuclide Migration in Natural Aquifer System”. Radiochim. Acta 58/59, 113
3. Kim, JL (1991)Actinide Colloid Generation in Groundwater”. Radiochim. Acta 52/53, 71.
4. Weber, J. H (1998) Humic Substance and Their Role in the Environment, John Wiley and Sons, Inc., New York.
5. Lumingkewas, S (1996) Konversi Bentonit-Ca Menjadi Bentonit-Na Melalui Teknik Pertukaran Ion, Tesis Magister Sain, Universitas Gadjahmada, Yogyakarta
6. Choppin, GR (1998) Humics and Radionuclide Migration, Radiochim. Acta 44/45, 23-28.
7. Bertha, E., Choppin, G.R (1978) Interaction of humic and Fulvic Acids with Eu(III) and Am(III), J.Inorg. Nucl. Chem., 40: 655-658
8. Mc Callum, C., Midgley, D (1975) Linear Titration Plots for The Potentiometric Determination of Mixtures of Strong and Weak Acids, Anal.Chem. Acta 78: 171-181.
9. Martell, A.E., Smith, R.M., Motekaitis, R.J (2001), NIST Critically Selected Stability Constants of Metal Complexes Database Ver. 6.0, Texas A&M University.
10. Setiawan, B (2003) karakterisasi Asam Humus Secara Titrasi: Penentuan Konsentrasi Gugus Fungsional (CR) Total dan Derajat Disosiasi. , J. Teknol. Pengelolaan Limbah, 6(2):38,
P2PLR-BATAN.
11. Warren, d.r., Sebestyen, S.D., Josephson, D.C., Lepak, J.M. Kraft, C.E (2005) Acidic Groundwater Discharge and In-situ Egg Survival in Redd of Lake-Spawning Brook Trout, Trans. The Am. Fisheries Soc. 134: 1193-1201
![Gambar 2. Perubahan nilai [R] vs pH pada berbagai kondisi kekuatan ion](https://thumb-ap.123doks.com/thumbv2/123dok/3309275.2366485/4.918.197.658.560.820/gambar-perubahan-nilai-pada-berbagai-kondisi-kekuatan-ion.webp)