1
UJI VIABILITAS PROBIOTIK ASAL SALURAN PENCERNAAN ITIK PEDAGING Anas domesticus YANG DIENKAPSULASI DENGAN
METODE CROSS LINK
VIABILITY TEST FROM DIGESTIVETRACT OF BROILER DUCKS Anas domesticus ENCAPSULATED WITH CROSS LINKS METHOD
Nur Onayanti1, Risco G.Budji2, Sartini3
1. Mahasiswa Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Hasanuddin, Makassar, 90915
2. Dosen Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Hasanuddin, Makassar, 90915
3. Dosen Jurusan farmasi, Fakultas Farmasi, Universitas Hasanuddin, Makassar, 90915 E-mail: [email protected]
ABSTRAK
Telah dilakukan penelitian uji viabilitas probiotik asal saluran pencernaan itik pedaging Anas domesticus yang dienkapsulasi dengan metode cross link. Penelitian ini bertujuan untuk mengetahui viabilitas mikrokapsul probiotik asal saluran pencernaan itik pedaging Anas domesticus yang dienkapsulasi dengan metode cross link dengan penyimpanan pada suhu kulkas (4oC) dan suhu ruang (28oC). Proses enkapsulasi isolat probiotik (isolat C) dilakukan dengan menggunakan bahan penyalut yaitu kombinasi alginat 3% dan kitosan 0,4% serta bahan tambahan berupa glycerol dan susu skim 10% dan dikeringkan dengan alat pengeringan beku (freeze drying). Pengujian viabilitas probiotik terenkapsulasi dilakukan selama 6 minggu dengan interval waktu 1 minggu pada penyimpanan suhu kulkas (4oC) dan suhu ruang (28oC) serta pengujian ketahanan terhadap garam empedu dan pH rendah. Hasil pengujian viabilitas menunjukkan bahwa mikrokapsul probiotik dengan penyimpanan pada suhu kulkas (4oC) memiliki viabilitas yang tinggi hingga minggu ke-enam dengan jumlah populasi probiotik sekitar 1,2 x 1010 cfu/gram sedangkan pada penyimpanan suhu ruang (28oC) viabilitas mikrokapsul probiotik hanya bertahan hingga minggu pertama yaitu sekitar 1,0 x 1010 cfu/gram dan pada pengujian minggu selanjutnya mengalami penurunan. Selanjutnya pada pengujian terhadap ketahanan garam empedu dan pH rendah menunjukkan probiotik yang telah dienkapsulasi masih mampu bertahan hidup pada kondisi medium dengan pH rendah dan ditambahkan garam empedu sehingga dapat digunakan sebagai bahan tambahan pakan ternak (feed additive).
Kata Kunci : Probiotik, enkapsulasi, viabilitas, cross link, freeze drying. ABSTRACT
The research probiotic viability test from digestive tract of broiler ducks Anas domesticus encapsulated with cross links method had been done. The aim of this research was to study viability of microcapsul probiotic from digestive tract of broiler ducks Anas domesticus by cross link with storage at refrigerator temperature (4°C) and room temperature (28oC) . Probiotic encapsulation process isolates ( isolate C ) was performed using the coating material is a combination of 3 % alginate, 0.4 % chitosan, glycerol and 10 % skim milk with dried by freeze drying ( freeze drying ). Probiotic viability test conducted for 6 weeks with intervals 1 week at refrigerator temperature (4°C ) and room temperature ( 28oC ), and then testing of resistance to bile salts and low pH . Yield of research was the viability of microcapsul probiotics with storage at refrigerator temperature (4°C) showed a high viability until six weeks with all probiotic population approximately 1.2 x 1010 cfu / g , while the storage room temperature (28oC) showed the viability of microcapsul probiotics only survive until one week which is about 1.0 x 1010 cfu / g and in the test next week declined . Furthermore, testing of resistance to bile salt and low pH showed that encapsulated probiotics have been able to survive in conditions of medium with low pH and increase of bile salt, so it can be used as animal feed additives ( feed additive ) .
2 PENDAHULUAN
Probiotik adalah mikroorganisme hidup yang bila dikonsumsi dalam jumlah tertentu dapat meningkatkan kesehatan manusia ataupun ternak dengan cara menyeimbangkan mikroflora dalam saluran pencernaan jika dikonsumsi dalam jumlah yang cukup. Probiotik mempunyai kemampuan untuk menurunkan kadar kolesterol serum darah (Kusumawati et al., 2003).
Penggunaan probiotik pada ternak telah dilaporkan mampu menurunkan kadar kolesterol (Depson, 2012), sebagai zat pemacu tumbuh, meningkatkan konversi pakan, control kesehatan atau pencegahan mikroba pathogen terutama ternak usia muda (Havenaar et al., 1992 dalam Purwadaria et al.,2003).
Efektivitas probiotik dapat bertahan jika mikroorganisme tersebut dapat aktif dalam berbagai kondisi lingkungan yang berbeda dan tetap hidup dalam berbagai bentuk. Mikroba tersebut harus memenuhi beberapa kriteria, antara lain: (1) dapat diproduksi secara massal; (2) tetap stabil dan viable dalam waktu lama dalam kondisi penyimpanan dan di lapangan; (3) dapat bertahan hidup (akan lebih baik jika dapat tumbuh) di dalam saluran pencernaan; dan (4) memberikan dampak yang menguntungkan pada inang. Salminen et al. (1998) menjelaskan pentingnya viabilitas probiotik, yaitu preparasi mikroba hidup yang bermanfaat bagi kesehatan. Jumlah mikroba hidup harus cukup untuk memberikan efek positif bagi kesehatan dan mampu berkolonisasi sehingga dapat mencapai jumlah yang diperlukan selama waktu tertentu. Untuk menjaga viabilitas bakteri maka perlu usaha melindungi bakteri, salah satunya dengan metode enkapsulasi.
Enkapsulasi adalah suatu proses pembungkusan (coating) suatu bahan inti, dalam hal ini adalah bakteri probiotik sebagai bahan inti dengan menggunakan bahan enkapsulasi tertentu, yang bermanfaat untuk mempertahankan viabilitasnya dan melindungi probiotik dari kerusakan akibat kondisi lingkungan yang tidak menguntungkan (Wu et al., 2000). Penelitian tentang enkapsulasi probiotik sebelumnya sudah dilakukan oleh beberapa peneliti dengan berbagai variasi bahan enkapsulasi dan kultur yang dienkapsulasi, diantaranya : enkapsulasi Bifidobacteria dan Lactobacillus dengan alginat – pati (Sultana et al. 2000), Lactobacillus casei dengan alginat - tepung polard dan terigu (Widodo
et al. 2003), Bifidobacteria dengan whey protein (Picot dan Lacroix 2004), Lactobacillus spp. dengan kalsium alginate (Chandramouli et al. , 2004). Pacifico et al. (2001) menyatakan bahwa untuk komponen yang bersifat peka seperti mikroorganisme, dapat dienkapsulasi untuk meningkatkan viabilitas dan umur simpannya. Enkapsulasi merupakan teknik penyalutan suatu bahan sehingga bahan yang disalut dapat dilindungi dari pengaruh lingkungan. Enkapsulasi pada bakteri dapat memberikan kondisi yang mampu melindungi mikroba dari pengaruh lingkungan yang tidak menguntungkan, seperti panas dan bahan kimia. Enkapsulasi dapat dilakukan dengan metode spray drying menggunakan panas dengan penyalut gum arab dicampur maltodekstrin dengan konsentrasi 20 % atau dengan metode tautan silang (crosslink) tanpa pemanasan (Sheu dan Marshall, 1991, 1993; Truelstrup – Hansen et al, 2002).
Bahan yang umum digunakan untuk enkapsulasi adalah berbagai jenis polisakarida dan protein seperti pati, alginat, gum arab, gelatin, karagenan, albumin dan kasein. Penggunaan bahan untuk enkapsulasi perlu dipertimbangkan, karena masing-masing bahan mempunyai karakter yang berbeda dan belum tentu cocok dengan bahan inti yang akan dienkapsulasi (Desmond et al., 2002). Untuk diaplikasikan dalam bidang industri, teknik dan bahan enkapsulasi yang tepat sangat diperlukan untuk menghasilkan produk yang siap dipasarkan.
Metode pengawetan kultur yang biasa digunakan adalah pengeringan semprot (spray drying), pembekuan (freezing) dan pengeringan beku (freeze drying) (Fu dan Etzel,1995). Freeze drying merupakan teknik yang umumnya digunakan untuk mengawetkan kultur dan untuk produksi konsentrat kultur starter. Kerusakan sel bakteri asam laktat akibat proses freeze drying dapat diminimumkan dengan penambahan bahan penyalut tertentu sebelum proses pembekuan dan pengeringan dilakukan (Tamime,1981).
Faktor penyimpanan mempengaruhi viabilitas bakteri asam laktat karena menyebabkan kematian sel yang akan bertambah dengan semakin lamanya waktu penyimpanan (Thunnell, 1996). Lamanya waktu penyimpanan susu acidophilus akan menyebabkan sel-sel yang sudah stres menjadi sublethal dan lethal karena semakin sensitifnya membran dan dinding sel
3 (Porubcan and Sellars,1975). Adhikari et al., (2000) menyatakan bahwa suhu penyimpanan 3-4ºC dapat mengontrol terjadinya over acidity oleh bakteri asam laktat dan suhu yang lebih rendah dapat merusak sel.
Pada penelitian ini akan dilakukan uji viabilitas probiotik asal saluran pencernaan itik pedaging Anas domesticus yang dienkapsulasi dengan metode cross link yang bertujuan untuk mengetahui viabilitas mikrokapsul probiotik asal saluran pencernaan itik pedaging Anas domesticus yang dienkapsulasi dengan metode cross link dengan penyimpanan pada suhu kulkas (4oC) dan suhu ruang (28oC).
METODE PENELITIAN Alat
Alat yang digunakan pada penelitian ini adalah freeze drying, erlenmeyer, inkubator, oven, neraca analitik, pipet tetes, tabung reaksi, cawan petri, jarum ose, gelas objek, hot plate, corong, batang pengaduk, tabung durham, lemari pendingin, penjepit tabung, rak tabung reaksi, spoit, autoklaf, dan kamera.
Bahan
Bahan yang digunakan dalam penelitian ini adalah isolat murni probiotik (isolat C) asal saluran pencernaan itik pedaging Anas domesticus (koleksi Laboratorium Mikrobiologi), sodium alginate, kitosan, susu skim, asam asetat glacial, CaCl2, MRSA (Man Ragosa Sharpe Agar), MRSB (Man Ragosa Sharpe Broth), aquadest, alkohol 70%, NaCl fisiologis, garam empedu sintetik (ox bite) dengan konsentrasi 1% dan 5%, minyak emersi, kapas, kertas lakmus, dan aluminium foil.
Penyiapan Bakteri Probiotik
Stok bakteri probiotik hasil isolasi dari usus itik diremajakan dalam media MRS Agar dengan waktu inkubasi 24 – 48 jam pada suhu 37 oC.
Pengukuran Kurva Pertumbuhan Probiotik Sebelum dilakukan pembuatan biomassa sel, maka harus diketahui terlebih dahulu bagaimana kurva pertumbuhan kultur bakteri asam laktat yang akan digunakan. Kurva pertumbuhan dibuat dengan cara menginokulasikan kultur yang berumur 24 jam pada media MRSB dan diinkubasikan selama 24
jam pada suhu 37oC. Pada awal inkubasi (jam ke-0) dan setiap interval waktu 4 jam dilakukan pengukuran jumlah bakteri dengan menggunakan spektrofotometer pada γ 600 nm.
Perbanyakan Bakteri Probiotik
Bakteri probiotik hasil peremajaan diinokulasi ke dalam 50 ml media MRS broth diinkubasi selama 24 jam pada suhu 37 OC , kemudian diinokulasi ke dalam 100 mL media MRS Broth dan diinkubasi selama 24 jam pada suhu 37 OC.
Setelah masa inkubasi bakteri probiotik diendapkan dari media MRS Broth dengan cara disentrifugasi pada kecepatan 10000 rpm.
Pembuatan Mikrokapsul dengan metode Cross link
Dalam pembuatan mikrokapsul dilakukan beberapa tahapan yaitu :
A. Pembuatan larutan yang akan digunakan a) Pembuatan Larutan Asam Asetat pH 6,00
Asam asetat glacial sebanyak 1,2 ml ditambahkan ke dalam 320 ml aquadest steril. Larutan asam asetat dicek pH-nya menggunakan alat pH meter hingga diperoleh pH 6,0. Kemudian dicukupkan volumenya dengan air suling hingga 400 ml.
b) Pembuatan Larutan CaCl2 0,2 M
Kalsium klorida dihidrat ditimbang sebanyak 14,70 gram kemudian dimasukkan ke dalam labu ukur 500 ml dan dilarutkan dengan aquadest secukupnya. Kemudian ditambahkan aquadest hingga garis batas dan dihomogenkan. c) Pembuatan Larutan Kitosan
Kitosan sebanyak 1,6 gram didispersikan dalam 400 ml larutan asam asetat pH 6,0 hingga larutan homogen. Diperoleh larutan kitosan 0,4%. d) Pembuatan larutan susu skim
Susu skim ditimbang sebanyak 10 gram kemudian dilarutkan dalam 100 ml aquadest lalu ditambahkan glycerol 5 % dan CaCO3 sebanyak 0,1 gram kemudian dipasteurisasi.
Pembuatan Mikrokapsul
Sel dari 100 ml MRSB dilarutkan pada 100 ml larutan yang terdiri dari 10% susu skim bubuk, 5% glycerol dan 0,1 % CaCO3 kemudian dituang kedalam larutan sodium alginat steril 3% dan dilakukan pengadukan konstan selama 45 menit. Campuran tersebut diteteskan pada CaCl2 (0,1 M) menggunakan alat tetes (spoid) untuk mengkompakkan struktur gel dinding butiran probiotik terenkapsulasi hasil dari penetesan.
4 Setelah satu jam gel yang terbentuk dipindahkan ke dalam aquadest steril dan diaduk secara perlahan menggunakan shaker selama satu jam untuk menghilangkan residu CaCl2. Mikrokapsul yang terbentuk dibilas kembali dengan aquadest.
Mikrokapsul alginat yang telah terbentuk kemudian dilakukan penyalutan dengan kitosan. Mikrokapsul alginate ditambahkan ke dalam larutan kitosan 0,4% dengan kecepatan pengadukan 600 rpm selama 15 menit hingga permukaan mikrokapsul tersalut. Kemudian disaring dengan kertas saring dan mikrokapsul dibilas dengan aquadest. Mikrokapsul yang telah diperoleh dikeringkan dengan freeze dryer.
Penyimpanan Mikrokapsul Probiotik
Probiotik yang sudah dienkapsulasi (mikrokapsul) dimasukkan ke dalam botol steril dan disimpan pada suhu rendah (4oC) dan suhu kamar (28oC) selama enam minggu untuk pengujian viabilitas probiotik.
Evaluasi Mikrokapsul Probiotik
Uji Ketahanan Terhadap Garam Empedu Medium MRSB ditambahkan dengan garam empedu sintetik (ox bite), dengan konsentrasi 1% dan 5%. Sebanyak 0,1 gram probiotik terenkapsulasi ditumbuhkan dalam medium MRSB lalu diinkubasi selama 1x24 jam, selanjutnya diambil 1 ml kultur probiotik cair dan diinokulasikan ke dalam medium MRSB-garam empedu, lalu inkubasi selama 2-3 x24 jam pada suhu 37OC (Djide dan Wahyuddin, 2008). Hasil diperoleh dari perbandingan jumlah koloni bakteri yang tumbuh sebelum dan sesudah inkubasi. Uji pH Optimum
Medium MRSB ditambahkan dengan HCl 0,1 N disimpan dalam 2 tabung Erlenmeyer untuk membuat pH 3 dan 2,5. Sebanyak 1 ml probiotik terenkapsulasi yang diambil dari hasil pengenceran mikrokapsul diinokulasikan pada masing-masing medium MRSB-HCl, lalu inkubasi selama 2-3 x24 jam pada suhu 37OC. Hasil positif apabila terjadi pertumbuhan bakteri pada medium dan hasil negatif apabila tidak terjadi pertumbuhan bakteri pada medium.
Uji viabilitas mikrokapsul probiotik
Pengujian viabilitas sel bakteri asam laktat sebelum dan sesudah pengeringan beku (freeze dryer) dilakukan pada media MRS agar dengan metode tuang (plate count) dengan beberapa seri pengenceran. Sebanyak 1 mL kultur sebelum dikeringbekukan dan 0,1 gram kultur kering, kemudian diencerkan sampai pengenceran 10-9, sebanyak 1 ml hasil pengenceran ditanam ke dalam cawan petri steril dan dituang media MRS agar diatasnya, digoyang-goyangkan sampai merata dan selanjutnya diinkubasi pada suhu 370C selama 48 jam. Total bakteri asam laktat sebelum dan sesudah proses enkapsulasi dibandingkan dan dilakukan evaluasi dengan interval waktu 1 bulan. HASIL DAN PEMBAHASAN
Karakteristik Isolat Bakteri Probiotik
Isolat bakteri probiotik yang digunakan dalam penelitian ini merupakan isolat koleksi Laboratorium Mikrobiologi FMIPA UNHAS yang telah diisolasi oleh Anas (2013) dari saluran pencernaan itik pedaging Anas domesticus.
Berdasarkan hasil karakterisasi yang telah dilakukan diperoleh bahwa bakteri probiotik isolat C yang digunakan menunjukkan karakteristik yaitu bersifat gram positif dan berbentuk batang (basil) sehingga tergolong dalam genus Lactobacillus. Menurut Leeson dan Summers (1996), salah satu bakteri yang berperan sebagai probiotik adalah bakteri asam laktat yang merupakan bakteri gram positif yang mampu mengubah karbohidrat menjadi asam laktat. Dari sekian banyak mikroorganisme, Lactobacillus merupakan mikroba yang paling banyak berperan menjaga kesehatan fungsi salura cerna, sehingga genus ini paling banyak digunakan dalam pengembangan produk probiotik.
Selain karakteristiknya yang bersifat gram positif dan berbentuk batang (basil), isolat C juga menunjukkan pertumbuhan yang optimal di dalam media cair yang telah ditambahkan garam empedu sintetik 1% dan 5% serta mampu tumbuh pada pH 2,5 – 3. Hal ini membuktikan isolat C tersebut mampu untuk melewati asam lambung dan saluran pencernaan dimana terdapat garam empedu yang disekresikan oleh hati.
5 Kurva Pertumbuhan Isolat Bakteri Probiotik
Penentuan kurva pertumbuhan isolat bakteri probiotik dilakukan untuk mengetahui kapan fase pertumbuhan sel bakteri memasuki fase logaritmik yaitu fase saat bakteri dapat berkembang secara maksimal, dan jumlahnya mengikuti kurva logaritmik sehingga diketahui masa inkubasi yang tepat sebelum dilakukan pemanenan (Fardiaz, 1992). Adapun hasil pengukuran kurva pertumbuhan isolat bakteri probiotik dapat dilihat pada gambar dibawah ini.
,
Gambar 1. Kurva pertumbuhan bakteri probiotik isolat C
Pada kurva pertumbuhan bakteri probiotik isolat C ini tidak terdapat fase adaptasi atau fase lag karena kultur yang digunakan dalam pengukuran kurva pertumbuhan merupakan kultur antara (prakultur) yang ditumbuhkan sebelum dilakukan pengukuran dengan media yang sama sehingga mengurangi waktu adaptasi dalam pengukuran kurva pertumbuhan. Dalam skala industri fase lag sangat dihindari karena akan memakan waktu dan biaya dengan penggunaan media dimana pada fase lag tidak ada pertambahan populasi, sel mengalami perubahan dalam komposisi kimiawi dan bertambahnya ukuran, terjadi sintesis enzim oleh sel yag diperlukan untuk metabolism metabolit serta mengalami pertambahan substansi intraseluler (Mangunwidjaja, et al.,1994)
Pada kurva terlihat bahwa pertumbuhan probiotik isolat C langsung memasuki fase logaritmik (eksponensial) dimana reproduksi seluler mulai berlangsung. Konsentrasi seluler atau biomassa meningkat sehingga massa sel menjadi dua kali lipat dengan laju sama dimana sel akan mengalami pembelahan dengan laju konstan (Pelczar, et al.,2005). Fase logaritmik berlangsung mulai jam ke-2 atau T1 sampai jam ke- 16 atau T4.
Probiotik isolat C yang digunakan memasuki fase akhir logaritmik pada jam ke-16 sampai jam ke-20 inkubasi. Selanjutnya memasuki fase stasioner pada jam ke-20 (T5) hingga jam ke- (T7) . Menurut Mangunwidjaja
(1994), pada saat memasuki fase stasioner, konsentrasi biomassa menjadi maksimal, jumlah sel cenderung stabil, pertumbuhan berhenti dan menyebabkan terjadinya modifikasi struktur biokimiawi sel. Dari kurva pertumbuhan tersebut dapat ditentukan waktu panen untuk produksi biomassa sel yaitu sekitar jam ke-8 (T2) sampai jam ke-12 (T3) inkubasi (pada saat puncak fase logaritmik)
Bakteri probiotik dapat mengalami fase kematian yang disebabkan oleh beberapa faktor seperti ketersediaan nutrisi pada media berkurang, energi cadangan dalam sel habis, adanya penumpukan asam dan metabolit lainnya. Perubahan pH medium dan metabolit dapat menurunkan jumlah sel-sel yang tumbuh pada fase berikutnya, kecepatan pembelahan menjadi menurun. Pertumbuhan bakteri asam laktat dapat terus berlangsung bila karbohidrat, asam amino, dan nutrient lainnya tersedia, komponen penghambat atau racun dihilangkan, didegradasi atau diencerkan serta konsentrasi ion hydrogen diatur dibawah level toleransi spesies tersebut (Hutkins dan Nannen, 1993).
IV.3 Viabilitas Bakteri Probiotik Hasil Enkapsulasi dengan Metode
Cross Link
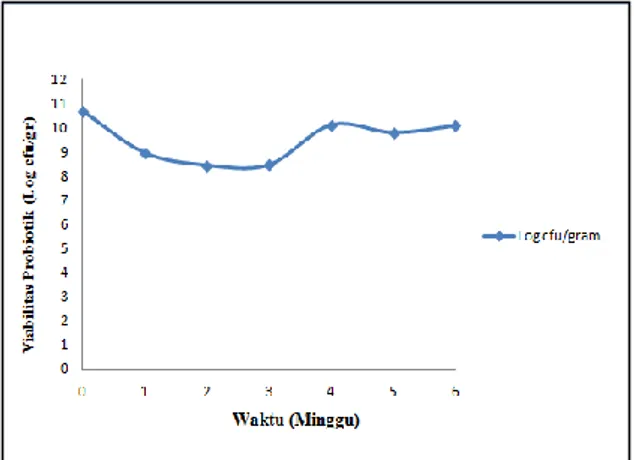
Uji ketahanan (viabilitas) bakteri probiotik terenkapsulasi dilakukan dengan membandingkan jumlah total bakteri probiotik sebelum dan setelah proses enkapsulasi dan setelah proses pengeringan beku ( freeze drying). Viabilitas bakteri probiotik pada penyimpanan suhu kulkas (4oC) disajikan pada Gambar 2.
Gambar 2. Grafik hubungan viabilitas bakteri probiotik terenkapsulasi dengan masa penyimpanan 6
minggu pada inkubasi suhu kulkas (4oC)
Gambar diatas menunjukkan grafik hubungan viabilitas bakteri probiotik isolat C
6 yang diinkubasi pada suhu kulkas (4OC) selama waktu penyimpan 6 minggu dan dilakukan pengujian dengan interval waktu 1 minggu. Jumlah populasi kultur bakteri probiotik isolat C sebelum proses enkapsulasi sebesar 1,3 x 1010 cfu/gram dan setelah proses enkapsulasi serta proses pengeringan beku (freeze drying) jumlah total bakteri probiotik yaitu 5 x 1010 cfu/gram. Hal ini menunjukkan bahwa jumlah populasi bakteri probiotik setelah proses enkapsulasi dan freeze drying masih tetap stabil. Menurut Tamime dan Robinson (1989), metode pengeringan beku (freeze drying) paling banyak digunakan karena metode ini menghasilkan viabilitas dan persentase mikroba hidup selama penyimpanan yang lebih tinggi dibandingkan dengan pengeringan lainnya, sehingga diharapkan penurunan jumlah populasi dapat terjadi sekecil mungkin.
Pengujian viabilitas bakteri probiotik setelah penyimpanan 1 minggu mengalami penurunan kurang lebih log 2 dari To (sebelum penyimpanan) yaitu 5 x 1010 cfu/gram (10,69 log
10 cfu/gram) turun hingga 9,1 x 108 cfu/gram (8,91 log 10 cfu/gram) pada T1 (minggu ke-1).
Penurunan viabilitas sebanyak log 2 dinilai wajar dan merupakan hal yang biasa pada mikroba yang sensitif (Snell 1991). Pada pengujian selanjutnya (minggu ke-2) didapatkan viabilitas probiotik terenkapsulasi yang dapat bertahan hingga pengujian setelah penyimpanan 3 minggu dengan jumlah berturut – turut yaitu T2 (minggu ke-2) sebesar 2,7 x 108 cfu/gram, T3 (minggu ke-3) sebesar 2,8 x 108 cfu/gram. Selanjutnya pada pengujian minggu ke-4 mengalami kenaikan hingga 1,3 x 1010 cfu/gram, pada minggu ke-5 mengalami penurunan hingga 6,1 x 109 cfu/gram dan pada pengujian minggu ke-6 viabilitasnya meningkat menjadi 1,2 x 1010 cfu/gram. Hasil yang didapatkan dari pengujian viabilitas ini menunjukkan jumlah populasi kultur probiotik yang mengalami fluktuasi dari minggu ke minggu selama waktu penyimpanannya. Adapun penyebab menurunnya tingkat pertumbuhan yaitu karakteristik mikrokapsul hasil freeze drying yaitu memiliki tingkat kadar air yang cukup tinggi, karena jika kadar air suatu produk pangan terlalu tinggi akan menyebabkan produk mudah ditumbuhi kapang dan khamir (Krasaekooptet al., 2003). Sehingga pada saat pengukuran viabilitas hasil enkapsulasi mengalami fluktuasi tiap minggunya dikarenakan kontaminasi pada media pertumbuhan yang berpengaruh pada hasil pengujian viabilitas serta faktor tingkat pengenceran pada saat perhitungan jumlah
populasi probiotik terenkapsulasi yang berubah dari pengujian minggu sebelumnya sehingga berpengaruh terhadap hasil yang diperoleh.
Selain itu, penurunan jumlah bakteri probiotik terjadi karena adanya akumulasi dari asam laktat. Vinderolla et al., (2002) menyatakan bahwa selama penyimpanan adanya akumulasi hasil-hasil metabolisme yang mungkin beracun dapat membahayakan bagi viabilitas mikroba starter. Bakteri asam laktat mampu mengubah 95% glukosa substrat menjadi asam laktat (Nighwonger, 1996), tetapi selama dalam penyimpanan suhu dingin, metabolit seperti asam laktat merupakan senyawa yang dapat memberi efek negatif terhadap viabilitas kultur starter, karena asam-asam organik menghambat mikroba dengan cara masuk ke dalam sel dalam bentuk tidak terdisosiasi dan kemudian terdisosiasi dalam sel (Fuller, 1992). Penambahan bahan – bahan penyalut lain sebagai zat pelarut saat enkapsulasi juga membuat konsentrasi atau total padatan massa sel bakteri probiotik isolat C dalam media enkapsulasi semakin berkurang.
Di samping faktor diatas, penurunan ketahanan sel probiotik setelah proses freeze drying kemungkinan disebabkan oleh proses pembekuan dan pengeringan. Proses pembekuan menyebabkan sel kehilangan kestabilannya, sehingga menjadi mudah rusak selama pengeringan. Faktor utama penyebab kerusakan akibat pengeringan sel bakteri kemungkinan karena shock osmotik dengan kerusakan membran dan perpindahan ikatan hidrogen yang berpengaruh terhadap sifat-sifat makromolekul hidrofilik dalam sel (Ray, 1993).
Populasi probiotik setelah penyimpanan 6 minggu dapat dipertahankan sebesar 1,2 x 1010 cfu/gram. Jumlah ini masih sangat memenuhi persyaratan jumlah kultur starter probiotik yang harus mempunyai viabilitas atau jumlah sel-sel yang aktif ≥ 6 log 10 koloni/ml (Suscovic et al.,2001). Jumlah rataan populasi probiotik yang terenkapsulasi yang dilakukan oleh Sultana et al.(2000) sekitar ≥ 1,0 x 107 cfu/gram dengan menggunakan alginat dan gliserol sebagai krioptekan. Selain itu, jumlah populasi bakteri probiotik isolat C pada penyimpanan suhu kulkas (4oC) setelah menjadi produk biokapsul sudah sesuai dengan standar FAO/WHO bahwa standar untuk jumlah populasi bakteri yang harus ada dalam kultur starter sekitar 106 – 107 cfu/gram. Meskipun jumlah bakteri mengalami penurunan namun jumlah tersebut masih melebihi standar minimal jumlah bakteri dalam suatu probiotik.
7 Svensson (1999) dan Vinderolla et al. (2000) menyatakan bahwa suatu medium pembawa probiotik minimal mengandung mikroba probiotik sebanyak 106–108 cfu/ml atau 108–1010 cfu/gr (preparat kering).
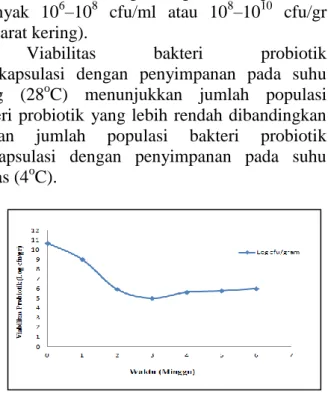
Viabilitas bakteri probiotik terenkapsulasi dengan penyimpanan pada suhu ruang (28oC) menunjukkan jumlah populasi bakteri probiotik yang lebih rendah dibandingkan dengan jumlah populasi bakteri probiotik terekapsulasi dengan penyimpanan pada suhu kulkas (4oC).
Gambar 3. Grafik hubungan viabilitas bakteri probiotik terenkapsulasi dengan masa penyimpanan 6
minggu pada inkubasi suhu ruang (28oC) Grafik diatas menunjukkan viabilitas bakteri probiotik isolat C terenkapsulasi yang diinkubasi pada suhu ruang (28oC) selama waktu penyimpan 6 minggu dan dilakukan pengujian dengan interval waktu 1 minggu. Jumlah populasi kultur bakteri probiotik isolat C sebelum proses enkapsulasi sebesar 1,3 x 1010 cfu/gram dan setelah proses enkapsulasi dan proses pengeringan beku (freeze drying) jumlah total bakteri probiotik yaitu 5 x 1010 cfu/gram. Hal ini menunjukkan bahwa jumlah populasi bakteri probiotik setelah proses enkapsulasi dan freeze drying masih tetap stabil.
Pengujian viabilitas bakteri probiotik setelah penyimpanan 1 minggu (T1) masih stabil yaitu sekitar 1,0 x 1010 cfu/gram (9 log10 cfu/gram). Selanjutnya pada pengujian viabilitas minggu ke-2 (T2) mulai mengalami penurunan jumlah populasi hingga 8,1 x 105 cfu/gram (5,9 log10 cfu/gram) atau mengalami penurunan sekitar log 4 dan jumlah populasi ini bertahan dari pengujian minggu ke-3 hingga pengujian minggu ke-6 dengan jumlah populasi masing-masing T3 (minggu ke-3) yaitu 1,0 x 105 cfu/gram, T4 (minggu ke-4) yaitu 4,1 x 105 cfu/gram, T5 (minggu ke-5) yaitu 5,6 x 105
cfu/gram dan pada T6 (minggu ke-6) sekitar 9,4 x 105 cfu/gram.
Populasi probiotik setelah penyimpanan 6 minggu pada suhu ruang (28oC) bertahan hingga 9,4 x 105 cfu/gram namun jumlah ini tidak memenuhi persyaratan jumlah kultur starter probiotik yang harus mempunyai viabilitas atau sekitar 106 – 107 cfu/gram.
Penurunan jumlah populasi pada pengujian viabilitas bakteri probiotik setelah proses enkapsulasi yang disimpan pada suhu ruang (28oC) disebabkan karena kondisi temperatur penyimpanan mikrokapsul yang tidak sesuai dengan suhu optimal untuk pertumbuhan probiotik dalam mikrokapsul sehingga banyak sel yang terenkapsulasi tidak mampu bertahan. Pada penelitian yang dilakukan Nighswonger (1996), diketahui bahwa Lb. acidophilus yang dienkapsulasi, masih memiliki ketahanan pada sel yang mampu tumbuh pada 1x 105 cfu/gram setelah lama penyimpanan 21 hari pada suhu 70C. Adhikari et al., (2000) menyatakan bahwa suhu penyimpanan 3-4ºC dapat mengontrol terjadinya over acidity oleh bakteri asam laktat dan suhu yang lebih rendah dapat merusak sel.
Enkapsulasi probiotik menggunakan alginat umumnya dilakukan untuk melindungi probiotik dari kondisi lingkungan ekstrim yang dapat menyebabkan ketahanan probiotik menurun. Membran kalsium alginat yang menyelubungi sel memberikan perlindungan terhadap sel sehingga tidak terjadi kontak langsung dengan lingkungan. Beberapa penelitian untuk meningkatkan ketahanan membran kalsium alginat, diantaranya adalah menambahkan prebiotik (Hi-maize) (Sultana et al. 2000) dan Chitosan (Krasaekoopt et al. 2003). Membran kalsium alginat mudah terdegradasi dengan cepat pada pH rendah dan kehilangan kestabilannya jika terdapat senyawa pengkelat seperti fosfat, laktat dan sitrat (Krasaekoopt et al. 2003). Terdegradasinya kalsium alginat dapat menyebabkan sel keluar (release) ke lingkungan. Probiotik terenkapsulasi yang penggunaannya ditujukan sebagai starter susu fermentasi, keluarnya sel (release) serta terjadinya difusi laktosa dan metabolit merupakan kondisi yang diharapkan terjadi, sehingga media (susu) dapat terfermentasi. Sel probiotik harus mampu melepaskan selnya dengan cepat dari membran kalsium alginat, sehingga proses fermentasi dapat berjalan dengan cepat.
Jumlah populasi dapat dipertahankan pada kisaran jumlah populasi 1,2 x 1010 cfu/gram dikarenakan beberapa perlakuan yang
8 bertujuan menjaga viabilits probiotik, diantaranya penambahan skim yang melindungi dinding sel bakteri pada saat proses pengeringan, laktosa dan gliserol sebagai bahan yang mepertahankan viabilitas probiotik saat proses mikroenkapsulasi, penggunaan alginat dan kitosan sebagai bahan penyalut probiotik serta pemilihan metode pengeringan yang tepat yaitu freeze dry (pengeringan beku).
Uji Ketahanan terhadap pH Rendah dan Garam Empedu
Bakteri probiotik terenkapsulasi dapat diaplikasikan misalnya sebagai bahan tambahan pakan ternak (feed additive) apabila memiliki viabilitas yang tinggi dan juga memiliki ketahanan terhadap pH rendah dan garam empedu sehingga mampu melewati saluran pencernaan. Oleh karena itu, dilakukan pengujian ketahanan pH dan garam empedu.
Dari hasil uji terhadap kadar keasaman (pH), terlihat bahwa bakteri probiotik terenkapsulasi masih mampu tumbuh pada medium yang memiliki derajat keasaman (pH) 2,5-3. Hal ini terlihat dari koloni bakteri yang tumbuh pada dasar tabung reaksi dan kondisi media yang keruh. Namun pertumbuhan bakteri probiotik terenkapsulasi pada medium yang memiliki derajat keasaman (pH) 2,5-3 mengalami penurunan bila dibandingkan hasil uji yang dilakukan sebelum enkapsulasi dimana terdapat banyak endapan pada dasar dan medium berubah menjadi sangat keruh.Pertumbuhan bakteri probiotik terenkapsulasi pada medium dengan pH rendah juga memiliki perbedaan antara probiotik dari mikrokapsul dengan penyimpanan pada suhu kulkas (4oC) yang menunjukkan lebih banyak endapan dan media lebih keruh jika dibandingkn dengan hasil uji yang dilakukan menggunakan mikrokapsul dengan penyimpanan pada suhu ruang (28oC). Hal ini disebabkan karena sifat bakteri yang mudah mengalami degradasi oleh panas, cahaya, kelembapan dan oksigen sehingga produk probiotik harus disimpan di pendingin
untuk dijaga agar bakteri tetap hidup dan aktif (Tensiska, 2008).
Menurut Khan dan Wiyana (2011), nilai pH rendah (pH 2,5-3) memiliki sifat merusak yang sangat kuat terhadap bakteri probiotik yang terenkapsulasi. Hal ini ditunjukkan dari penurunan pertumbuhan jumlah sel setelah diinkubasi pada pH 2,5 dan pH 3 selama 1 x 24 jam. Penghambatan asam terhadap pertumbuhan sel bakteri terjadi melalui efek denaturasi enzim-enzim yang ada di permukaan sel, kerusakan lipopolisakarida dan membran luar serta penurunan pH sitoplasma melalui peningkatan permeabilitas membran. Selain itu sel bakteri telah mengalami stress yang cukup kuat karena pengaruh pengeringan dan pembekuan.
Asam lambung (HCL) termasuk asam kuat yang terdisosiasi dalam medium dan mampu menurunkan pH eksternal tetapi tidak dapat menembus membrane sel. Adaptasi struktur membran luar merupakan mekanisme resistensi bakteri terhadap asam yang tergolong asam kuat. Adaptasi dapat berupa perubahan komposisi asam lemak dan fosfolipid membran. Hal yang serupa juga ditunjukkan dari hasil penelitian yang dilakukan Puspawati (2010) dimana proses freeze drying dapat menurunkan ketahanan kultur kering terhadap pH rendah seperti pada kultur kering L.rhamnosus yang mengalami penurunan jumlah bakteri hingga 4,96 log cfu/gram serta pada L.brevis mengalami penurunan hingga 5,26 log cfu/gram.
Bakteri probiotik mampu
mempertahankan pH intraseluler lebih alkali daripada pH ekstraseluler, tetapi penurunan pH intraseluler tetap berlangsung seiring dengan menurunnya pH ekstraseluler yang mendukung toleransinya terhadap asam (Siegumfeldt et al., 2000). Bakteri dapat menurunkan pH intraseluler menjadi netral pada saat pH ekstraseluler turun, tetapi akan menggunakan banyak energi karena perbedaan gradien proton yang besar dan mengakibatkan terjadinya akumulasi anion asam organik dalam sitosol yang beracun bagi sel (Russel, 1992).
Untuk menguji potensi bakteri probiotik yang telah dienkapsulasi, bakteri probiotik dalam mikrokapsul tidak hanya harus tahan terhadap pH rendah, akan tetapi juga harus tahan terhadap garam empedu. Menurut Russel (1992), ketahanan terhadap derajat keasaman dan garam empedu merupakan ciri yang penting bagi bakteri probiotik sebab menentukan aktivitasnya dalam saluran pencernaan, terutama di saluran usus
9 bagian atas tempat empedu disekresikan. Kemampuan kultur probiotik meningkatkan kolonisasi laktobasili pada bagian atas usus dapat mengendalikan pertumbuhan patogen usus yang memasuki sistem pencernaan.
Berdasarkan hasil pengujian ketahanan probiotik terenkapsulasi terhadap garam empedu sintetik, setelah inkubasi 1x24 jam terlihat adanya endapan pada dasar tabung dan medium menjadi lebih keruh. Hal ini menandakan bahwa terjadi pertumbuhan bakteri pada medium MRSB yang telah ditambah garam empedu sintetik 1% dan 5%, seperti terlihat pada gambar di bawah ini.
Seperti halnya pada pengujian pH, hasil yang didapatkan menunjukkan lebih banyak endapan yang terbentuk di dasar tabung yang berisi probiotik terenkapsulasi dengan penyimpanan pada suhu kulkas (4oC) dibandingkan pada tabung yang berisi probiotik terenkapsulasi denga penyimpanan suhu ruang (28oC).
Dari hasil pengujian ketahanan terhadap keasaman (pH rendah) dan garam empedu menunjukkan bahwa bakteri probiotik yang telah dienkapsulasi dan disimpan selama 6 minggu masih mampu bertahan hidup pada kondisi medium dengan pH rendah dan ditambahkan garam empedu. Hal ini berarti bahwa probiotik terenkapsulasi tersebut mampu melewati saluran pencernaan dimana terdapat garam empedu yang disekresikan oleh hati dan kondisi keasaman asam lambung sehingga dapat digunakan sebagai bahan tambahan pakan ternak (feed additive).
KESIMPULAN DAN SARAN Kesimpulan
Berdasarkan hasil penelitian yang dilakukan dapat disimpulkan bahwa viabilitas bakteri probiotik yang telah dienkapsulasi dengan metode cross link menggunakan penambahan
penyalut alginat 3% dan kitosan 0,4% serta bahan tambahan berupa glycerol dan susu skim 10% menghasilkan mikrokapsul probiotik yang memiliki viabilitas tinggi hingga masa penyimpanan 6 minggu pada suhu kulkas (40C) dan pada penyimpanan suhu ruang (28oC) viabilitasnya bertahan selama 1 minggu.
Saran
Dari hasil penelitian ini, disarankan sebaiknya dilakukan pengujian langsung dengan memanfaatkan probiotik terenkapsulasi ini pada pada pakan ternak.
DAFTAR PUSTAKA
Adhikari, K., A. Mustapha, I.U. Grun and L. Fernando. 2000. Viability of Microencapsulated Bifidobacteria in Set Yoghurt During Refrigerated Storage. J. Dairy Sci. 83:1946-1951. Chandramouli, V., K. Kailasapathy , P. Peiris and
M.Jones. 2004. An Improved Method of Microencapsulation and its Evaluation to Protect Lactobacillus spp. in Simulated Gastric Condition. J of Microbiol Methods 56:27–35.
Desmond, C. C. Stanton, G.F.K. Collins and R.P. Ross. 2002. Improved survival of Lactobacillus paracasei NFBC 338 in spray dried powders containing gum acacia. J of Appl Microbiol 93:1003-1012. Fardiaz, S. 1992. Mikrobiologi Pangan 1. PT
Gramedia Pustaka Utama, Jakarta.
Fu W, Etzel MR.,1995. Spray Drying of Lactococcus lactis sp.lactis C2 and Cellular injury.J.Food Sci.60:195-200. Havenaar, R., B. T. Brink, and J. H. J. Huis IN’T
Veld. 1992. Selection of Strains for Probiotics Use. In: Probiotics the Scientific Basis. R. Fuller (Ed).Chapman & Hall, London. pp. 209-224.
Krasaekoopt,W, B., H. Bhandari and H. Deeth. 2003. Evaluation of Encapsulation Techniques of Probiotics for Yoghurt. Int. Dairy J. 13:3-13.
Kusumawati, N; Bettysri, L J; Siswa S; Ratihdewanti dan Hariadi. 2003. Seleksi Bakteri Asam Laktat Indigenous sebagai Galur Probiotik dengan Kemampuan Menurunkan Kolesterol.
10 Journal Mikrobiologi Indonesia. Vol. 8(2): 39-43.
Leeson, S. and J.D. Summer. 1996. Commercial Poultry Nutrition. 2nd Ed. University Books. University of Guelph. Guelph, Ontario, Canada.
Mangunwidjaja D. Suryani A.1994. Teknologi Biproses Penebar Swadaya. Jakarta Nighswonger, B.D. Brashears and S.E. Gilliland.
1996. Viability of Lactobacillus acidophilus and Lactobacillus casei In fermented Milk Products During Refrigerated Storage. Journal of Dairy Science. 79:212-219.
Pasifico, C.J., W. Wu and M. Fraley. 2001. Sensitivesubstance encapsulation. US Patent 6 281 478.
Pelczar, M. J. dan E. C. S. Chan. 2005. diterjemahkan oleh Ratna H.,S. Dasar-Dasar Mikrobiologi. Cetakan 1 Jilid 2. Jakarta. Penerbit Universitas Indonesia (UI- Press).
Purwandhani SN, Suladra M dan Rahayu ES. 2007. Stabilitas Thermal Agensia Probiotik L.acidophilus SNP 2 Terenkapsulasi Metode Ekstrusi dan Emulsi. Prosiding Seminar Nasional Teknologi, 24 November 2007, Yogyakarta, E1 – E6.
Ray B. 1993. Sublethal Injury, Bacteriocins and Food Microbiology. ASM News 59, 288-291.
Russel, J. B., 1992, Another Explanation for The Toxicitry of Fermentation Acid at Low pH : Anion Accumulation versus Uncoupling, J. Appl. Bacterial 73 : 363 – 370.
Salminen, S and A.V. Wright. 1998. Lactic Acid Bacteria. Marcell Dekker Inc. New York. Sultana K, G. Godward, N. Reynolds, R.
Arumugaswamy, P. Peiris and K. Kailasapathy. 2000. Encapsulation of Probiotic Bacteria with Alginate-Starch and Evaluation of Survival in Simulated Gastro Intestinal Condition and in Yoghurt. Int. J. Food Microbiol. 62:47– 55.
Tamime AY., 1981. Microbiology of Culture Structure. Dairy Microbiology Vol II. Appl.Sci Publ. London
Wu W, W.S. Roe, V.G. Gimino, V. Seriburi, D.E. Martin and S.E. Knapp. 2000. Low Melt Encapsulation with High Laurate Canola Oil. US. Patent 6 153 326.