perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
i
KARAKTERISTIK MORFOLOGI PERMUKAAN
DAN SIFAT MAGNETIK LAPISAN NiFe
HASIL ELEKTRODEPOSISI
Disusun Oleh :
PRIHANTO HSBR
NIM. M0206058
SKRIPSI
Diajukan Untuk Memenuhi sebagian
persyaratan mendapatkan gelar Sarjana Sains
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SEBELAS MARET
SURAKARTA
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
ii
HALAMAN PENGESAHAN
Skripsi dengan judul :
KARAKTERISTIK MORFOLOGI PERMUKAAN DAN SIFAT MAGNETIK KOMPOSISI LAPISAN NiFe HASIL ELEKTRODEPOSISI
Yang ditulis oleh :
Nama : Prihanto HSBR
NIM : M0206058
Telah di uji dan dinyatakan lulus oleh dewan penguji pada
Hari :
Tanggal :
Halaman Pengesahan :
1. Dra. Riyatun, M.Si. (Ketua) ...
NIP. 19680226 199402 2 001
2. Dr. Eng. Risa Suryana, S.Si., M.Si. (Sekretaris).………....
NIP. 19710831 200003 1 005
3. Dr. Eng. Budi Purnama, S.Si., M.Si. (Anggota/Pembimbing Utama) ...
NIP. 19731109 200003 1 001
4. Candra Purnawan, S.Si, M.Sc. (Anggota/Pembimbing Pendamping) ..…...
NIP. 19800630 200501 1 001
Disahkan oleh Ketua Jurusan Fisika
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sebelas Maret Surakarta
Ahmad Marzuki, M.Si, Ph.D
perpustakaan.uns.ac.id digilib.uns.ac.id
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
iii
PERNYATAAN
Dengan ini saya menyatakan bahwa skripsi saya yang berjudul “KARAKTERISTIK MORFOLOGI PERMUKAAN DAN SIFAT MAGNETIK LAPISAN NiFe HASIL ELEKTRODEPOSISI” adalah hasil kerja saya atas arahan pembimbing dan sepengetahuan saya hingga saat ini, isi skripsi tidak berisi materi yang telah dipublikasikan atau ditulis oleh orang lain atau materi yang telah diajukan untuk mendapat gelar kesarjanaan di Universitas Sebelas Maret atau di Perguruan Tinggi lainnya, jika ada maka telah dituliskan di daftar pustaka skripsi ini dan segala bentuk bantuan dari semua pihak telah ditulis di bagian ucapan terima kasih. Isi skripsi ini boleh dirujuk atau difotokopi secara bebas tanpa harus memberitahu penulis.
Surakarta, 20 Januari 2011
perpustakaan.uns.ac.id digilib.uns.ac.id
2.2. Teori Proses Deposisi Logam Secara Elektrolisis ... 9
2.3. Faktor-Faktor Yang Berpengaruh Pada Elektroplating ... 12
2.3.1. Rapat arus (Current Density) ... 12
2.3.2. Tegangan (voltase) ... 13
2.3.3. Konsentrasi Elektrolit ... 13
2.3.4. Suhu ... 14
2.3.5. Senyawa Tambahan (Aditif) ... 14
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
xi
2.3.7. Perbandingan (Rasio) Luas Anosa-Katoda ... 14
2.3.8. Distribusi Arus ... 15
2.3.9. Daya Lontar Ion/Daya Tembus (Throwing Power) ... 15
2.3.10. Epitaxy dan leveling ... 15
2.3.11. Perlakuan Awal (Pretreatment) Sebelum Elektroplating ... 16
2.4. Striking ... 17
2.5. Lapisan Tipis NiFe... 19
2.6. X-Ray Fluorescence (XRF) Spectrometry... 19
2.7. Hukum Faraday... 2.8. Material Magnetik... 23 23 2.3.1. Material Diamagnetik………... 24
2.3.2. Material Paramagnetik... 25
2.3.3. Material Feromagnetik... 26
2.9. Histerisis... ... 30 BAB III METODOLOGI PENELITIAN
3.1. Metode Penelitian... 3.2. Tempat dan Waktu Penelitian... 3.3. Alat dan Bahan...
3.3.1. Alat untuk Pembuatan Lapisan Tipis NiFe ... 3.3.2. Alat untuk Karakterisasi Lapisan Tipis NiFe ... 3.3.3. Bahan untuk Pembuatan Lapisan Tipis NiFe ... 3.4 Prosedur Percobaan ...
3.4.1. Persiapan Substrat ... 3.4.1.1. Pemotongan Plat Tembaga ... 3.4.1.2. Pemolesan Plat Tembaga Secara Mekanik
(Mechanical Polishing) ...
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
xii
3.4.2.1. Pembuatan Larutan Elektrolit dan Proses
Elektroplating NiFe ... 3.4.3. Karakterisasi ... 3.4.4. Analisa ... 3.5 Teknik Pengumpulan dan Analisa Data ... 3.5.1. Teknik Pengumpulan Data ... 3.5.2. Teknik Analisa Data ...
34 36 38 38 38 38 39 BAB IV HASIL PENELITIAN DAN PEMBAHASAN
4.1. Pre-treatment ... 40
4.2. Laju elektrodeposisi ……….….………. 42
4.3. Analisis Komposisi NiFe... 46
4.4. Tekstur Morfologi Permukaan Lapisan NiFe... 49
4.4. Hasil Karakterisasi Magnetik…………... 54
BAB V PENUTUP 5.1. Kesimpulan ... 57
5.2. Saran ... 57
DAFTAR PUSTAKA ... 58
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
xiii
DAFTAR TABEL
halaman Tabel 2.1. Kemungkian Paduan-paduan yang Terbentuk dari Elemen
Ni dan Fe ... 24 Tabel 3.1. Formula Bak Sulfat Desain untuk Elektrolit Copper Strike ... 35
Tabel 3.2. Formula Bak Elektroplating NiFe ... 36 Tabel 4.1. Karakter Tekstur Permukaan Hasil Copper-copper Srike Plating
pada Suhu 27C, t = 2 menit ... 41
Tabel 4.2. Data Berat Lapisan NiFe pada Beberapa Variasi Arus pada Suhu 27°𝐶, t=25 Menit ... 43 Tabel 4.3. Data Hubungan antara Rapat Arus dengan Laju Deposisi ... 43 Tabel 4.4. Hasil Perhitungan Komposisi Kandungan Ni dan Fe pada
Lapisan NiFe ... 46 Tabel 4.5. Karakter Tekstur Permukaan Hasil Elektroplating NiFe pada
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
xiv
DAFTAR GAMBAR
halaman Gambar 2.1. Skema Sel Elektrolisis untuk Deposisi Logam Cu dari Bak Sulfat 9 Gambar 2.2. Teori Deposisi Ion Logam ... 10 Gambar 2.3. Ilustrasi Karakter Leveling Deposit Elektroplating ... 16
Gambar 2.4. Loncatan Elektron ... 20 Gambar 2.5. Alat XRF ... Gambar 2.6. Induksi magnetik (H) dan momen magnet material iiiiiiiiiiiiiiiiiiiii ………diamagnetik saat a)Tanpa medan luar; b) diberi medan luar...
Gambar 2.7. Orientasi momen magnet material paramagnetik bila tidak dikenai
medan luar medan luar………
Gambar 2.8. Orientasi momen magnet material paramagnetik bila dikenai medan luar……… Gambar 2.9. Arah domain material feromagnetik tanpa medan luar……… Gambar 2.10. Pengaruh suhu terhadap sifat bahan feromagnetik………. Gambar 2.11. Arah momen magnet material feromagnetik saat B = 0 dan saat
diberi medan magnet luar B……….. Gambar 2.12. Konfigurasi elektron pada sub kulit 3d untuk besi (Fe)…………. Gambar 2.13. Konfigurasi elektron pada sub kulit 3d untuk nikel (Ni)………... Gambar 2.14. Liku Histerisis Material Feromagnetik……….. Gambar 3.1. Gambar Alur Penelitian ...
22 Gambar 4.1. Hasil Fotografi Bentuk Fisik Permukaan Copper-copper Strike
plating untuk Beberapa Variasi Rapat Arus ... 41
Gambar 4.2. Kurva Hubungan antara Rapat Arus dengan Laju Deposit NiFe 44 Gambar 4.3. Grafik Laju Deposisi V Sebagai Fungsi Massa Tambahan Bahan
Aditif Vanilin ……... 45 Gambar 4.4. Grafik Laju Deposisi V Versus Prosentase Komposisi Ni Pada
perpustakaan.uns.ac.id digilib.uns.ac.id
Gambar 4.10. Hasil Penggambaran STM Permukaan Lapisan Tipis NixFe1-x
(x=0,51) Hasil Elektrodeposisi dengan J = 6 mA/cm2... 51
Gambar 4.11. Tipikal Morfologi Permukaan Lapisan Tipis NiFe Hasil Scan
STM untuk Sampel dengan Variasi Rapat Arus...………...…….. 52 Gambar 4.12. Tipikal Perubahan Morfologi Permukaan Lapisan Tipis Hasil
Scan STM untuk Perlakuan dengan Penambahan Bahan Aditif
Vanilin ………. 53
Gambar 4.13. Kurva Hysteresis Lapisan Tipis NiFe dengan Variasi
(a) Komposisi dan (b) Rapat Arus J………. 55
Gambar 4.14. Medan Koersif Hc Sebagai Fungsi
(a) Prosentase Ni dan (b) Rapat Arus J ………
Gambar 4.15. Magnetisasi Jenuh ms Sebagai Fungsi (a) Prosentase Ni dan (b)
Rapat Arus J ………
55
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
xvi
DAFTAR LAMPIRAN
halaman LAMPIRAN I. Data Pengukuran Berat Lapisan NiFe ...
LAMPIRAN II. Foto fisik Lapisan NiFe ... LAMPIRAN III. Foto fisik Lapisan NiFe dengan Tambahan Zat Aditif..
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
iv
KARAKTERISTIK MORFOLOGI PERMUKAAN DAN SIFAT
MAGNETIK LAPISAN NiFe HASIL ELEKTRODEPOSISI
PRIHANTO HSBR
Jurusan Fisika Fakultas Matematika dan Ilmu Pengetahuan Alam
Universitas Sebelas Maret
ABSTRAK
Telah dilakukan fabrikasi lapisan NiFe dengan metode elektroplating di atas substrat PCB. Platina digunakan sebagai elektroda pada proses elektrodeposisi. Sebelum lapisan NiFe ditumbuhkan, dilakukan perlakuan pendahuluan Cu striking. Hasil lapisan NiFe dikarakterisasi komposisi, morfologi
permukaan dan sifat magnetik. Analisis lapisan NiFe dengan x-ray fluorescence
memperlihatkan modifikasi resep bahan elektrolit elektroplating efektif untuk memperoleh variasi komposisi yang berbeda. Sedangkan hasil analisis morfologi permukaan lapisan NiFe dengan scanning tunnelling microscopy (STM)
memperlihatkan proses penumbuhan lapisan dipengaruhi oleh rapat arus (J),
komposisi NiFe dan bahan aditif. Akhirnya karakterisasi magnetik dengan
vibrating sample magnetometer (VSM) menegaskan karakteristik magnetik
lapisan tipis yang terbentuk sangat dipengaruhi komposisi dan rapat arus (J)
ketika preparasi sampel.
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
v
MORPHOLOGICAL CHARACTERISTICS SURFACE
AND MAGNETIC PROPERTIES OF NiFe LAYERS OF
ELECTRODEPOSITING RESULT
PRIHANTO HSBR
Physics Department of Mathematics and SciencesFaculty
Sebelas Maret University
ABSTRACT
A fabrication of the NiFe layers by the electroplating method has been done on the PCB substrate. Platinum is used as an electrode in the electrodepositing process. Prior to NiFe layers were grown, the pretreatment of Cu striking was performed. The results of NiFe layers characterized composition, surface morphology and magnetic properties. Analysis of a layer of NiFe with x-ray fluorescence shows the modification recipes electroplating electrolyte materials effective to obtain the variation of different composition. While the results of the surface morphology analysis of NiFe layer with scanning tunneling microscopy (STM) shows that the process of growing a layer is affected by the current density (J), the NiFe composition and additives element. Finally, magnetic characterization by vibrating sample magnetometer (VSM) confirmed the magnetic characteristics of the layer that be formed greatly influenced by the composition and current density (J) when the sample preparation.
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
vi
MOTTO
Lebih Baik Bertindak Daripada Berencana
Inginkanlah sesuatu yang besar dan lakukanlah
mulai dari hal-hal kecil dengan ikhlas
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
vii
KATA PENGANTAR
Puji syukur kepada Allah SWT atas segala limpahan nikmat dan karuniaNya, sehingga penulis dapat menyelesaikan penulisan skripsi.Sholawat dan salam senantiasa penulis hanturkan kepada Rosulullah SAW sebagai pembimbing seluruh umat manusia.
Skripsi yang penulis susun sebagai bagian dari syarat untuk mendapatkan gelar sarjan sarjana sains ini penulis beri judul "Karakteristik Morfologi Permukaan Dan Sifat Magnetik Lapisan Nife Hasil Elektrodeposisi". Terselesaikannya skripsi ini adalah suatu kebahagiaan bagi saya. Setelah sekitar dua semester penulis harus berjuang untuk bisa menyelesaikan skripsi ini tepat waktu. Dengan segala suka dan dukanya, pada akhirnya skripsi ini terselesaikan juga. Kepada berbagai pihak yang telah membantu penulis menyelesaikan skripsi ini penulis ucapkan terima kasih. Atas bantuannya yang sangat besar selama proses pengerjaan skripsi ini, ucapan terima kasih secara khusus penulis sampaikan kepada :
1. Bapak Dr. Eng. Budi Purnama, S.Si.,selaku pembimbing I, yang telah mendampingi selama penelitian dan memberikan bimbingan dalam penyusunan skripsi.
2. Bapak Candra PurnawanS.Si, M.Sc selaku pembimbing II,yang telah sabar memberikan bimbingan dan saran dalam penyelesaian skripsi.
3. Bapak Mohtar Yunianto, S.Si, M.Si selaku pembimbing akademik yang selalu memberikan motivasi dan memberikan saran dalam penyelesaian skripsi.
4. Mas hadi, Gunawan, Hana W, Suryono terima kasih untuk semua bantuannya.
5. Semua teman fisika angkatan 2006 seperjuangan yang senantiasa membantudan memberi motivasi.
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
viii
Semoga segala bantuan dan keikhlasan yang telah diberikan kepada penulis, mendapatkan balasan yang lebih baik dari Allah SWT. Penulis menyadari bahwa masih banyak kekurangan dalam penulisan skripsi ini. Semoga hasil penelitian ini mampu bermanfaat bagi pembaca guna penelitian selanjutnya.
Surakarta, 15 Desember 2011 Penulis
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
ix
PESEMBAHAN
Dengan penuh rasa syukur yang tulus,
sebagai ungkapan terima kasih,
karya ini kupersembahkan kepada:
Allah SWT, atas rahmat yang Engkau berikan.
Rosulullah Muhammad SAW, penyampai kebenaran yang hakiki.
Bapak dan Ibu, atas kasih sayang dan pengorbanannya.
Doa’ka
n putramumenjunjung nama keluarga dan berhasil meraih
cita-cita, serta bermanfaat bagi sesama. Amin
Kakakku Heri Dieqi R dan Adikku Ismail Dika R.
Sahabat OG
Bapak/ Ibu Dosen yang saYa hormati.
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
1
BAB I
PENDAHULUAN
1.1. Latar Belakang Masalah
Seiring dengan berkembangnya ilmu dan teknologi berbagai macam penelitian dilakukan untuk memenuhi kebutuhan manusia. Salah satunya adalah penelitian mengenai pembuatan lapisan tipis magnetik, yaitu lapisan tipis yang memiliki sifat-sifat magnetik. Salah satu bahan feromagnetik adalah paduan antara Ni dan Fe. Secara umum, paduan NiFe memiliki sifat yang unggul yaitu karakter koefisien ekspansi termal rendah, suhu Curie tinggi dan memiliki magnetostriksi rendah (Jiles, 1998).
Karakter utamanya, NiFe merupakan material soft magnetic dengan medan
koersif kecil dan memiliki permeabilitas besar sehingga mampu merespon gelombang dengan frekuensi tinggi. Lapisan NiFe dengan komposisi 45/45, akhir-akhir ini banyak dikaji peneliti karena berpotensi sebagai bahan dasar mikro induktoryang menjadi kata kunci transfer data nirkabel pada teknologi informasi.
Banyak ragam metode penumbuhan lapisan tipis yang telah diketahui, antara lain evaporator, sputtering, maupun elektroplating. Pada penelitian ini
elektroplating dipilih sebagai metode penumbuhan lapisan tipis karena kemudahan metodenya dan murah dibandingkan metode lainnya. Sedangkan karakteristik lapisan tipis yang terbentuk, seperti komposisi, ukuran butiran, kehalusan, kekerasan dan sebagainya, dapat ditentukan dengan mengatur parameter-parameter elektrodeposisi (Giorudi, 2004). Dewasa ini, elektroplating juga diaplikasikan dalam produksi lapis tipis alloy (material paduan dua logam
atau lebih) (Giorudi, 2004).
Pada penelitian ini, akan dikaji penumbuhan lapisan tipis paduan NiFe dengan metode elektrodeposisi pada substrat lempeng Cu printed circuit board
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
2
microscopy (STM). Akhirnya, karakteristik magnetik lapisan yang terbentuk
menggunakan vibrating sample magnetometer (VSM).
1.2. Rumusan Masalah
Rumusan masalah pada penelitian ini adalah bagaimanakah morfologi mikrostuktur dan karakteristik magnetik lapisanpaduan NiFe hasil elektrodeposisi pada substrat PCB?
1.3. Batasan Masalah
Masalah yang ditentukan pada penelitian ini adalah tentang morfologi dan sifat magnetik NiFe hasil elektrodeposisi paada suhu kamar.
1.4. Tujuan Penelitian
Tujuan dari penelitian ini adalahsebagai berikut:
1. Memperoleh lapisan NiFe dengan cara metode elektrodeposisi. 2. Menentukan komposisi lapisan NiFe yang terbentuk.
3. Menentukan mikrostruktur permukaan lapisan NiFe yang terbentuk. 4. Menentukan karakteristik magnetik lapisan NiFe hasil elektroplating.
1.5. Manfaat Penelitian
Hasil dari penelitian ini diharapkan dapat memberikan manfaat sebagai berikut :
1. Menguasai teknologi tahap awal untuk menghasilkan material yang mempunyai sifat-sifat unggul dalam sifat-sifat kemagnetan.
2. Membuka jalan penelitian lebih lanjut mengenai lapisan NiFe hasil
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
3
1.6. Sistematika Penulisan
Laporan tugas akhir ini disusun dengan sistematika sebagai berikut:
BAB I PENDAHULUAN, berisi latar belakang masalah, perumusan masalah, pembatasan masalah, tujuan penelitian, manfaat penelitian dan sistematika penulisan.
BAB II DASAR TEORI, berisi teori-teori dasar yang digunakan sebagai landasan penelitian.
BAB III METODOLOGI PENELITIAN, berisi metode penelitian, waktu dan tempat pelaksanaan penelitian, alat dan bahan yang diperlukan serta langkah-langkah dalam penelitian.
BAB IV HASIL PENELITIAN DAN PEMBAHASAN, berisi hasil penelitian dan pembahasan yang akan dibahas sesuai dengan acuan dasar teori yang berkaitan dengan penelitian.
perpustakaan.uns.ac.id digilib.uns.ac.id
Elektrolisis didefinisikan sebagai suatu proses yang menyebabkan terjadinya reaksi oksidasi-reduksi non spontan, dengan cara pemberian arus listrik dari (sumber) luar (http://www.glenore.150m.com/aplab23.pdf://). Ketika arus
listrik diberikan dalam sel elektrosis, elektron memasuki larutan melalui kutub negatif (katoda) menuju kutub positif (anoda). Unsur tertentu didalam larutan akan menyerap elektron dari katoda mengalami reduksi. Sementara itu, unsur yang lain melepaskan elektron dari anoda dan mengalami oksidasi. Terdapat banyak aplikasi dari elektrolisis, salah satunya adalah elektroplating, yaitu proses pengendapan (deposisi) suatu logam secara elektrolisis, dimana deposit (endapan) logam tersebut melekat pada suatu elektroda, dengan tujuan untuk melindungi dan melapisi permukaan elektroda dengan sifat dan dimensi yang berbeda (ASTM B 374-96).
Potensial sel elektrokimia sangat berhubungan dengan nilai aktivitas suatu produk ataupun reaktan, dan secara tidak langsung berhubungan dengan konsentrasi molar. Karena hubungan aktivitas dan konsentrasi ditunjukkan persamaan berikut:
a
x=γ
x[X]... (2.1)Keterangan :
a
x = nilai aktivitas suatu zat Xγ
x = koefisien aktivitas suatu zat X[X] = konsentrsai molar zat X
Namun,dalam beberapa kasus, akan lebih baik jika diasumsikan
koefisien aktivitas mendekati nilai satu (
γ
x≈ 1), sehingga didapat nilai aktivitassama dengan nilai molaritas. Sehingga Persamaan (2.1) menjadi :
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
5
ketika larutan encer,
γ
x adalah koefisien aktivitas, yang nilainya bergantung padakekuatan ion atau ionic strenght (μ). Harga μ ditentukan oleh persamaan dibawah:
μ = 1
2 (M1Z1
2
+ M2Z22 + M3Z33 + ...) ... ...(2.3)
Simbol M1, M2, M3 menunjukkan konsentrasi molar berbagai ion yang terdapat
dalam sistem larutan; sedangkan Z1, Z2, Z3 adalah muatan (lisrik) masing-masing ion. Persamaan (2.3) selanjutnya digunakan dalam menentukan nilai koefisien aktivitas, sebagaimana dirumuskan dalam persamaan Debye-Huckel berikut :
- log
γ
x =Berikut contoh yang menunjukkan nillai aktivitas reaktan dan produk mempengaruhi potensial elektroda, sebagaimana diilustrasikan oleh persamaan (2.6) reaksi berikut:
2 AgCl + H2(g) 2 Ag(s) + 2Cl- + 2H+...(2.6)
Konstanta K kesetimbangan untuk persamaan reaksi (2.6) adalah :
K =𝑎𝐻+ .
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
6
Nilai aktivitas padatan (solid) murni dalam keadaan berlebih adalah satu, sehingga
aAg = 𝑎2AgCl=1, maka persamaan (2.7) menjadi :
Merupakan hal yang juga penting untuk menentukan nilai Q kedua, berdasarkan kasus pada Persamaan (2.8) di atas, maka akan diperoleh persamaan berikut :
Q = (𝑎𝐻+
2 )
𝑖 .𝑎 2𝑐𝑙−
(𝑃𝐻2+)𝑖 ...(2.9)
Tanda ipada Persamaan (2.9), menunjukkan bahwa kondisi tersebut merupakan
nilai aktivitas seketika bukan aktivitas kesetimbangan. Nilai Q tidak konstan,
melainkan akan selalu berubah hingga mencapai kondisi setimbang (sehingga nilai Q berubah menjadi K).
Secara termodinamika, perubahan energi bebas (∆G) untuk reaksi suatu
sel elektrokimia, ditunjukkan oleh persamaan berikut:
∆G = RT ln Q-RT ln K ...(2.10)
Keterangan : R = tetapan gas, harga R= 8.314 Jmol-1K-1. T = suhu dalam satuan Kelvin (K).
Q= kuantitas aktivitas yabg terlibat dalam reaksi. K = konstanta kesetimbangan reaksi.
Sedangkan hubungan antara energi bebas dengan potensial sel ditunjukkan oleh persamaan berikut :
∆G = nFEsel...(2.11)
Keterangan :
F = bilangan Faraday, harga F = 96487 Coulomb/mol
n = jumlah elektron yang terlibat (diserah-terimakan) dalam reaksi redoks.
Jika persamaan (2.11) disubstitusikan kedalam Persamaan (2.10) maka menjadi :
-nFEsel = RT ln Q – RT ln K Esel =𝑅𝑇
𝑛𝐹𝑙𝑛 𝐾 − 𝑅𝑇
𝑛𝐹𝑙𝑛 𝑄 ... (2.12)
perpustakaan.uns.ac.id digilib.uns.ac.id potensial standar sel Eosel yang nilainya konstan, sebagaimana ditunjukkan oleh persamaan berikut:
Eosel=
2,303 𝑅𝑇
𝑛𝐹 Log K ...(2.14)
Apabila persamaan (2.14) disubstitusikan kedalam persamaan (2.13), maka akan diperoleh persamaan berikut:
Esel=Eosel
-maka potensial sel dari persamaan reaksi tersebut dirumuskan sebagai berikut:
Esel = Eosel
−
0,0592 𝑛 log
(𝑎𝐺)𝑔(𝑎𝐻)ℎ………
(𝑎𝐴)𝑎(𝑎𝐵)𝑏……… ... (2.17)
Persamaan reaksi sel (2.6) diasumsikan terdiri dari dua buah reaksi setengah sel, sebagaimana ditunjukkan persamaan berikut:
2 AgCl(s) + 2e 2 Ag(s) + 2 Cl- ... (2.18)
dan
2 H+ + 2e H2(g) ... (2.19)
dengan demikian, potensial sel juga merupakan susunan dari kedua potensial setengah reaksi di atas. Potensial sel didefinisikan sebagai beda (selisih) dari kedua potensial setengah reaksi,potensial katoda dikurangi potensial anoda, ditunjukkan oleh persamaan berikut:
Esel= Ekatoda - Eanoda...(2.20)
Keterangan: Esel = Potensial sel total (V)
Ekatoda = Potensial setengah sel pada katoda (V)
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
8
Untuk menghasilkan suatu arus balik pada sel galvani maupun sel elektrolisis, dibutuhkan suatu gaya dorong (driving force) untuk mengatasi
hambatan (resistansi) ion-ion ketika melaju menuju anoda dan katoda. Gaya ini mematuhi hukum ohm, sering juga disebut dengan istilah ohmic potential atau IR drop, sehingga potensial sel (2.20) menjadi:
Esel= Ekatoda - Eanoda– IR ...(2.21)
Keterangan: I = kuat arus yang melewati sistem larutan (A)
R = hambatan (resistansi) larutan (Ω)
Berdasarkan hukum ohm pada persamaan (2.21), seharusnya kurva hubungan arus voltase (potensial) berupa suatu garis lurus (linier). Namun dalam prakteknya (percobaan electrodaliytical) terdapat penyimpangan (bukan berupa
garis linier).Hal ini dapat disebabkan karena katoda atau anoda (salah satu maupun keduanya) mengalami polarisasi.
Derajat polarisasi suatu elektroda dinyatakan dengan overvoltage
(tegangan tambahan) dengan simbol η. Overvoltage merupakan perbedaan antara
potensisal nyata dengan potensial teoritis (termodinamika), yang dirumuskan oleh persamaan berikut:
η = E - Eq...(2.22)
Nilai E (potensial nyata) selalu lebih kecil daripada Eq (potensial
Iequilibrium/kesetimbangan termodinamika), sehingga η akan selalu bertanda
negatif. Dengan kata lain, overvoltage selalu mengurangi nilai potensial
termodinaika (Eq) suatu sel. Keberadaan overvoltage ini menyebabkan persamaan
potensial sel (2.21) menjadi :
Esel= Ekatoda - Eanoda+ ηtotal– IR ...(2.23)
Dimana overvoltage tersebut dapat disebabkan oleh polarisasi konsentrasi maupun
polarisasi kinetik, sehingga Persamaan (2.23) dapat dijabarkan sebagai berikut:
Esel= Ekatoda - Eanoda+ (ηcc+ ηck+ ηac+ ηak) – IR ...(2.24)
Keterangan :
ηcc (cathodic concetration) = overvoltage akibat polarisasi konsentrasi pada kanoda
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
9
ηac (anodic concetration) = overvoltage akibat polarisasi konsentrasi pada anoda
ηak (anodic kinetic) = overvoltage akibat polarisasi kinetik pada anoda
Jika nilai Esel bertanda negatif, menunjukkan reaksi berjalan non spontan (tidak serta-merta), artinya perlu pemberian energi listrik dari luar agar dapat terjadi reaksi oksidasi-reduksi. Di dalam sel elektrolisis, istilah Esel pada persamaan (2.24) lebih tepatnya sering diganti dengan istilah Eappl, yaitu potensial (dari sumber luar) yang diberikan pada sebuah sel elektrolisis sehingga arus listrik dapat melewati resistensi (hambatan) sistem sel tersebut (Skoog dkk., 1995).
2.2. Teori Proses Deposisi logam
Elektroplating sering juga disebut dengan istilah elektrodeposisi (electrodeposition), bentuk singkatan dari electrolytic deposition. Proses tersebut
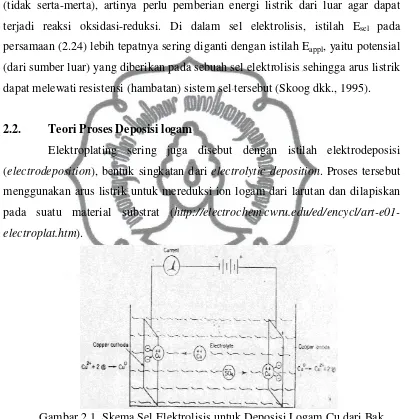
menggunakan arus listrik untuk mereduksi ion logam dari larutan dan dilapiskan pada suatu material substrat ( http://electrochem.cwru.edu/ed/encycl/art-e01-electroplat.htm).
Gambar 2.1. Skema Sel Elektrolisis untuk Deposisi Logam Cu dari Bak Sulfat(http://electrochem.cwru.edu/ed/encycl/art-e01 electroplat.htm).
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
10
direduksi dan terdeposisi sebagai logam Cu0 pada permukaan katoda, ditunjukkan persamaan reaksi berikut:
Katoda: Cu2+ + 2e = Cu0... (2.25)
Sementara Cu dari anoda larut kedalam larutan untuk menjaga netralitas, ditunjukkan persamaan reaksi berikut:
Anoda : Cu = Cu2+ + 2e ...(2.26)
Namun jika anoda yang digunakan berasal dari logam mulia (misal platina), maka reaksi pada anoda merupakan reaksi oksidasi air, ditunjukkan persamaan reaksi berikut:
2H20 = 4H+ + O2 + 4e ...(2.27)
Dalam kondisi seperti itu, seiring bertambahnya durasi elektrolisis konsentrasi ion sulfat tidak mengalami perubahan, sementara konsentrasi ion Cu 2+akan menurun dan konsentrasi ion H + akan meningkat (http://electrochem.cwru.edu/ed/encycl/ art-e01-electroplat.htm).
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
11
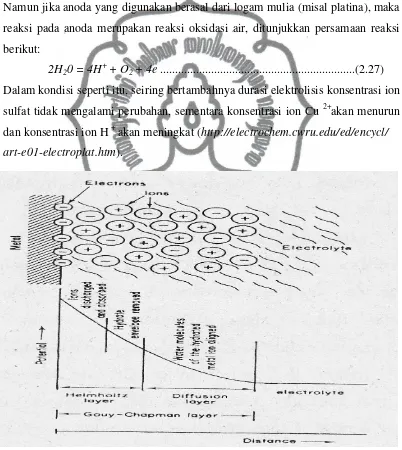
Reaksi yang terjadi didalam praktek elektrodeposisi tidaklah sesederhana seperti pada Gambar 2.1, melainkan lebih rumit. Di bawah pengaruh potensial (yang diberikan), ion-ion akan tertata ulang didekat permukaan elekroda yang menghasilkan suatu zona electrical double layer yang disebut dengan istilah helmholtz double layer, kemudian diikuti oleh pembentukan difusi lapisan
sebagaimana ditunjukkan Gambar 2.2.
Penjelasan proses deposisi logam terjadi menurut Gambar 2.2. adalah :
a. Ion-ion metal-hydrate didalam larutan bermigrasi dari bulk menuju zona gouy chapman layer. Proses ini disebut istilah mass transfer, yang dipengaruhi oleh
3 faktor:arus (gaya elektrostatik), difusi konsentrasi, dan konveksi (misal: jika diberi perlakuan pengadukan).
b. Ketika ion metal- hydratememasuki zona difusi (difussion layer), maka
molekul air dari ion hidrat terebut bersekutu. Kemudian setelah itu metaltersebut terlepas dari hydrate-nya, dan memasuki daerah helmholtz double layer.
c. Ion-ion yang telah kehilangan molekul airnya (dehydranted ions) kemudian
dinetralkan/dirduksi dan selanjutnya teradsorp pada permukaan katoda.
d. Atom yang teradsorp kemudian bermigrasi atau berdifusi menuju titik pertumbuhan pada permukaan katoda.
(http://electrochem.cwru.edu/ed/encycl/art-e01-electroplat.htm).
Berdasarkan teori elektrodeposisi, pergerakan ion logam menuju katoda dipengaruhi oleh kontituen-konstituen yang terdapat dalam bak elektroplating, diantaranya:anion, senyawa ligan, molekul hydrate, surfaktan maupun brightener
(dari persenyawaan organik). Semakin banyak konsentrasi ion ligan kompleks/hydrate/anion/surfaktan/brightener di dalam larutan, maka pergerakan
ion logam menuju katoda akan semakin lambat. Ketika pergerakan deposisi ion logam menjadi lambat (tidak terlalu cepat), akan dihasilkan deposit yang baik (fine grain) dan cerah. Dengan kata lain, konsentrasi ion logam yang rendah di
dalam bak elektropating dibutuhkan untuk memproduksi kristal kecil (fine grain)
dan lembut (smooth), sehingga lapisan plating akan terlihat cerah
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
12
2.3. Faktor-Faktor yang Berpengaruh Pada Elektroplating
Faktor-faktor yang dapat mempengaruhi proses elektroplating antara lain:
2.3.1. Rapat arus (Current Density)
Dalam praktek elektroplating besaran yang perlu diperhatikan adalah rapat arus yaitu arus per satuan luas permukaan benda kerja, biasanya dinyatakan dalam ampere/dm2 (A/dm2) atau ampere/cm2 (A/cm2) atau ampere/foot (A/ft2).
Rapat arus dinyatakan dengan rumus sebagai berikut:
I J =
A ... (2.28)
Keterangan: J= Rapat arus (current density) I = Arus listrik
A= Luas permukaan
Rapat arus antara anoda dan katoda besarnya berbeda dan rapat arus katoda merupakan besaran yang perlu diperhatikan agar kualitas endapan pada katoda berkualitas baik (Purwanto dkk, 2005 dalam Najmus, 2010).
Rapat arus terlalu rendah menyebabkan pelepasan ion menjadi lambat, idealnya laju pertumbuhan deposit permulaan (initial stage deposition) lebih cepat
daripada laju pembentukan deposit baru (deposisi berikutnya). Maka pada kondisi tersebut, kemungkinan deposit berupa kristal yang kasar (karena deposisi permulaan belum sempurna selesai tetapi sudah disusul deposisi berikutnya). Sedangkan ketika rapat arus mulai dinaikkan, maka laju pembentukan kristal deposit (nuclei) permulaaan mulai mengalami peningkatan, sehingga
kemungkinan deposit menjadi lebih fine-grained (berbentuk butiran yang bagus)
(Glastone, 1962).
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
13
terbakar dengan ditandai warna yang menghitam (Purwanto dkk, 2005 dalam Najmus, 2010). Hukum Joule berikut ini :
V .i .t = m.c .∆t
E listrik = E panas (konversi energi)... (2.29)
t adalah selang waktu deposisi,∆tadalah kenaikan suhu pada larutan makin
tinggi i maka kenaikan suhu semakin tinggi.
2.3.2. Tegangan (Voltage)
Tegangan yang diperlukan untuk proses elektroplating tergantung dari jenis, komposisi dan kondisi elektrolit. Rapat arus dapat dinaikkan dengan menaikkan tegangan, akan tetapi hal ini dapat menyebabkan terjadinya polarisasi dan tercapainya tegangan batas. Pada keadaan tegangan batas, tidak terjadi aliran arus melalui elektrolit, dan bila tegangan dinaikkan akan terjadi elektrolisis air yang menghasilkan gas hidrogen dan oksigen (Purwanto dkk, 2005 dalam Najmus, 2010).
2.3.3. Konsentrasi Elektrolit
Konsentrasi elektrolit selama proses elektroplating berlangsung akan mengalami perubahan, dapat disebabkan oleh pengendapan ion logam dari larutan menuju katoda ataupun karena penguapan. Pada umumnya kelebihan kadar logam akan menyebabkan menurunnya kekilapan dan kerataan lapisan dan juga mengakibatkan terjadinya pemborosan bahan. Apabila kadar logam rendah terjadi penurunan konduktivitas sehingga proses plating menjadi lambat (Purwanto dkk, 2005 dalam Najmus, 2010).
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
14
2.3.4.Suhu
Suhu berpengaruh terhadap konduktivitas.Jika suhu semakin tinggi menyebabkan konduktivitas larutan semakin besar sehinnga mempercepat hantaran arus listrik.Pada suhu tinggi dapat diperoleh rapat arus yang besar. Akan tetapi, setiap jenis plating masing-masing mempunyai rentang suhu operasi
optimum, yang berkaitan dengan sifat deposit logam pada benda kerja ataupun sifat senyawa aditif jika diberikan (Purwanto dkk, 2005 dalam Najmus, 2010).
2.3.5. Senyawa Tambahan (Aditif)
Keberadaan senyawa aditif (misal: surfaktan, brightener, materi koloid,
atau senyawa organik lainnya) sengaja diberikan untuk mengatur pertumbuhan kristal deposit sehingga diperoleh kualitas yang baik meliputi: kecerahan atau kekliapan (bright), kerataan (leveling) lapisan dan kekerasan (hard) (Purwanto
dan Huda, 2005). Kebutuhan senyawa aditif tersebut biasanya hanya dalam jumlah yang sangat kecil (misal sekitar 0.05 g/l), namun mampu memberikan perubahan, menghasilkan deposit mikrokristal yang lembut dan butiran yang tidak kasat (fine-grained) (Glasstone, 1962).
2.3.6. Jarak Anoda-Katoda
Jarak anoda-katoda menentukan hantaran arus listrik dan sangat berpengaruh terhadap keseragaman tebal lapisan.Besarnya hantaran berbanding terbalik dengan jarak.Apabila jarak anoda-katoda kecil, maka hambatan menjadi kecil dan konduktifitas besar sehingga untuk mendapatkan rapat arus yang besar diperlukan tegangan yang lebih rendah (Purwanto dkk, 2005 dalam Najmus, 2010).
2.3.7. Perbandingan (Rasio) Luas Anoda-Katoda
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
15
2.3.8. Distribusi Arus
Lintasan arus dari anoda ke katoda tidak semuanaya berupa lintasan lurus, tetapi terdapat juga lintasan melengkung, mirip seperti kontur garis medan magnet. Keadaan ini menyebabkan rapat arus pada ujung-ujung katoda menjadi lebih besar karena mendapatkan arus dari lintasan lurus dan melengkung, sehingga deposit pada ujung-ujung katoda cenderung lebih tebal (Purwanto dkk, 2005 dalam Najmus, 2010).
Distribusi arus pada permukaan elektroda terbagi menjadi 3 yaitu: primer, sekunder, tersier. Disribusi arus primer (utama) melibatkan geometri sistem plating dengan potensial konstan didaerah permukaan elektroda dan pengaruh polarisasi dapat diabaikan.Distribusi arus sekunder melibatkan aktivasi
overpotential (ηa), kinetika elektroda, dan konduktivitasa larutan. Distribusi
arustersier melibatkan konsentrasi overpotential (ηa), difusi (perbatasan) lapisan,
dan agitasi larutan yang mempengaruhi migrasi ion (mass transport) (http://www.tau.ac.il/~chemlaba/Files/1.pdf).
2.3.9. Daya Lontar Ion/Daya tembus (Throwing Power)
Throwing Power atau tepatnya disebut dengan istilah macrothrowing power didefinisikan sebagai kemampuan proses elektrolitik untuk menutup
katoda dengan lapisan seseragam mungkin. Throwing power dipengaruhi oleh
pengaturan geometri anoda-katoda, jenis elektrolit dan berbagai parameter proses lainnya. Letak geometri anoda-katoda menentukan distribusi arus utama sehingga mempengaruhi keseragaman distribusi deposit pada katoda (Purwanto dkk, 2005 dalam Najmus, 2010).
2.3.10. Epitaxy dan leveling
Istilah epitaxy ditujukan pada hasil lapisan deposit yang mengikuti bentuk
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
16
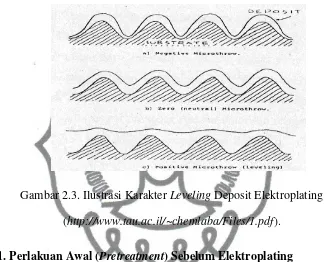
Leveling dapat juga disebut dengan istilah microthrowing power.
Pengertian leveling merupakan kebalikan dari epitaxy, yaitu kemampuan deposit
untuk menutupi dan meratakan bagian-bagian benda kerja yang tidak rata (cekung). Pemberian senyawa aditif tertentu dapat berfungsi sebagai leveling agent (Purwanto dkk, 2005 dalam Najmus, 2010).
Gambar 2.3. Ilustrasi Karakter Leveling Deposit Elektroplating
(http://www.tau.ac.il/~chemlaba/Files/1.pdf).
2.3.11. Perlakuan Awal (Pretreatment) Sebelum Elektroplating
Umumya sebelum proses elektroplating dikerjakan, substrat (logam dasar) yang akan dilapisi diberi perlakuan-perlakuan awal yang dikenal dengan istilah
pretreatment elektroplating, dengan tujuan untuk memberikan tampilan akhir
yang baik pada hasil pelapisan (Brimi et.al, 1965), serta kelekatan yang baik
antara deposit dan substrat (ASTM B 322-85, Reapproved 1994).
Benda kerja yang akan dilapisi kebanyakan masih kotor, berkerak, berminyak, maupun terdapat bahan-bahan lainya yang melekat pada permukaannya. Pembersihan sangat diperlukan agar lapisan plating dapat melekat erat pada benda kerja dan tidak mudah keropos maupun terkelupas (Purwanto dkk, 2005 dalam Najmus, 2010). Namun terkadang pembersihan saja tidak cukup memberikan kelekatan yang kuat antara substrat dan deposit, maka benda kerja diberikan perlakuan striking didalam rangkaian siklus pretreatmentelektroplating.
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
17
deposit, bahkan dalam beberapa kasus dianggap sebagai jaminan atas keberhasilan elektroplating (http://www.pronline.com/).
Adapun jenis-jenis pretreatment tersebut dikategorikan atas pretreatment
fisika dan kimia..Pretreatment fisika bertujuan untuk membersihkan permukaan
substrat yang akan dilapisi secara fisik/mekanik dan menghaluskan permukaan benda kerja, sementara pretreatment kimia bertujuan untuk membersihkan
permukaan substrat secara kimiawi serta mengaktifkan permukaan substrat yang akan dilapisi. Prosedur-prosedur pembersihan (cleaning) harus didasarkan pada
pengetahuan tentang sifat-sifat masing-masing logam yang akan dibersihkan, serta pengetahuan tentang kotoran yang akan dihilangkan. Sehingga pada kasus-kasus tertentu praktek cleaning menyimpang dari prinsip-prinsip umum, dan beberapa
logam tertentu mempunyai standar cleaning sendiri yang berbeda dengan logam
lainnya (ASTM B322-85, Reapproved 1994).
2.4. Striking
Istilah striking berasal dari kata strike, yang mempunyai arti suatu proses
pelapisan elektrolitik untuk menghasilkan lapisan yang sangat tipis dengan menggunakan waktu pelapisan yang cukup singkat, kemudian akan diikuti oleh pelapisan lainnya diatas permukann strike tersebut (ASTM B 374-96). Istilah strike juga sering disebut dengan kata flash tersebut. Maksimum tebal deposit strike berada pada interval 0,05 s.d 0,10 mil (http://www.pronline.com/).
Lapisan strike hanya bertindak sebagai lapisan pelindung untuk plating
selanjutnya. Karena lapisan strike dapat meningkat yang disebabkan naiknya gaya
adesi, dan sebagai lapisan penyambungan antara deposit dan subtrat. Bahkan dalam beberapa kasus dianggap sebagai jaminan atas keberhasilan elektroplating (http://www.pronline.com/). Perlakuan strikingdapat mencegah terjadinya deposisi
galvani merugikan ketika, yang juga dapat menyebabkan kekuatan adesi antara deposit dan substrat menjadi rendah (Brimi et.al., 1965).
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
18
tersebut prlu diberi perlakuan pembersihan (cleaning) untuk memperbaiki daya
kelekatannya. Namun terkadang pembersihan saja tidak cukup memberikan kelekatan yang kuat antara substrat dan deposit, maka didalam rangkaian siklus
pretreatment elektroplating, benda kerja perlu diberikan perlakuan striking
(http://www.pronline.com/).
Logam pelapis yang telah dikembangkan untuk striking antara lain:
tembaga (copper strike), nikel (nickel strike), perak (silver strike), dan emas (gold strike) (ASTM B 322-85, reapproved 1994). Metode striking dapat juga
digunakan di antara lapisan-lapisan plating dari jenis logam yang berbeda. Sebgai contoh ketika menginginkan untuk mealpisi suatu substrat dengan suatu deposit yang lebih tahan korosi, namun sayangnya deposit logam tersebut terikat (melekat) secara lemah terhadap substrat, maka pretreatment strike
dapatdikerjakan terlebih dahulu dengan memperhatikan kecocokan antara substrat dan logam deposit. Salah satu contohnya: Ni akan memberikan kelekatan (adesi) yang rendah ketika dilapiskan di atas logam Zn, maka dalam kasus ini copper strike yang akan dipilih sebagai pelapis awal, karena copper strike memberikan
kelekatan yang baik antara kedua logam tersebut.
Ciri khas formula bak striking biasanya mengandung logam utama dengan
konsentrasi yang lebih rendah dari pada konstituen anion pendampingnya. Contohnya adalah formula bak copper-cyanide strike,dengan konsentrasi logam
Cu yang lebih rendah dibanding konsentrasi sianidanya. Berbicara tentang formula copper strike, sejauh ini dalam beberapa literatur tidak ada keterangan
yang menyebutkan bahwa bak sulfat dapat digunakan sebagai bak striking.
Melainkan hanya menyebutkan bahan bak sulfat digunakan untuk formula plating tembaga secara umum yang dikenal dengan istilah formula general acid copperplating.Sementara itu, elektrolit yang sering digunakan untuk copper strike
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
19
2.5. Lapisan Tipis Ni-Fe
Lapisan tipis Ni-Fe merupakan bahan paduan magnetik dari unsur-unsur logam transisi yaitu nikel (Ni) & besi (Fe) yang merupakan unsur-unsur yang bersifat ferromagnetik.
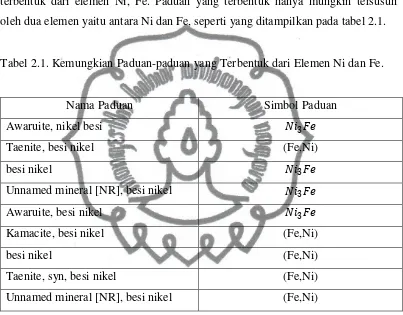
Berdasarkan JCPDS ada beberapa kemungkinan paduan lapisan tipis yang terbentuk dari elemen Ni, Fe. Paduan yang terbentuk hanya mungkin tersusun oleh dua elemen yaitu antara Ni dan Fe, seperti yang ditampilkan pada tabel 2.1.
Tabel 2.1. Kemungkian Paduan-paduan yang Terbentuk dari Elemen Ni dan Fe.
Nama Paduan Simbol Paduan Awaruite, nikel besi 𝑁𝑖3𝐹𝑒 Taenite, besi nikel (Fe,Ni)
besi nikel 𝑁𝑖3𝐹𝑒
Unnamed mineral [NR], besi nikel 𝑁𝑖3𝐹𝑒 Awaruite, besi nikel 𝑁𝑖3𝐹𝑒 Kamacite, besi nikel (Fe,Ni)
besi nikel (Fe,Ni)
Taenite, syn, besi nikel (Fe,Ni) Unnamed mineral [NR], besi nikel (Fe,Ni)
2.6. X-ray Fluorescence (XRF) Spectrometry
Spektroskopi XRF adalah teknik analisis unsur yang membentuk suatu materialdengan dasarinteraksi sinar-X dengan material analit. Teknik ini banyak digunakan dalam analisa batuan karena membutuhkan jumlah sampel yang relative kecil (sekitar 1 gram). Teknik ini dapat digunakan untuk mengukur unsur-unsur yang tertutama banyak terdapat dalam batuan atau mineral. Sampel yang digunakan biasanya berupa serbuk hasil penggilingan atau pengepressan menjadi bentuk film yang banyak digunakan menggunakan beberapa prinsip.
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
20
ditinggalkan tadi menghasilkan sinar-X dengan panjang gelombang yang karakteristik bagi unsurtersebut(perhatikan Gambar 2.4.).
Gambar 2.4. Loncatan Elektron (Mulvane, 2005)
Apabila terjadi eksitasi sinar-X primer yang berasal dari tabung X ray mengenai sampel, sinar-X dapat diabsorpsi atau dihamburkan oleh material. Proses dimana sinar-X diabsorpsi oleh atom dengan mentransfer energinya pada elektron yang terdapat pada kulit yang lebih dalam disebut efek fotolistrik. Selama proses ini, bila sinar-X primer memiliki cukup energi, elektron pindah dari kulit yang di dalam menimbulkan kekosongan. Kekosongan ini menghasilkan keadaan atom yang tidak stabil. Apabila atom kembali pada keadaan stabil, elektron dari kulit luar pindah ke kulit yang lebih dalam dan proses ini menghasilkan energi sinar-X yang tertentu dan berbeda antara dua energi ikatan pada kulit tersebut.
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
21
mengidentifikasi unsur dalam sampel (analisis kualitatif), sementara intensitas puncak menyediakan konsentrasi unsur yang relevan dan mutlak (analisis kuantitatif dan semi kuantitatif). XRF terdiri dari sumber radiasi primer (biasanya radioisotop atau tabung sinar-X) dan peralatan untuk mendeteksi sinar-X sekunder.
Pada umumnya kulit K dan L terlibat pada deteksi XRF. Sehingga sering
terdapat istilah Kα dan Kβ serta Lα dan Lβ pada XRF. Jenis spektrum X ray dari sampel yang diradiasi akan menggambarkan puncak-puncak pada intensitas yang berbeda.
Pada teknik difraksi sinar-X suatu berkas elektron digunakan, sinar-X dihasilkan dari tembakan berkas elektron terhadap suatu unsur di anoda untuk menghasilkan sinar-X dengan panjang gelombang yang diketahui.Peristiwa ini terjadi pada tabung sinar-X. Pada teknik XRF, kita menggunakan sinar-X dari tabung pembangkit sinar-X untuk mengeluarkan elektron dari kulit bagian dalam untuk menghasilkan sinar-X baru dari sampel. Seperti pada tabung pembangkit sinar-X, elektron dari kulit bagian dalam suatu atom pada sampel analit menghasilkansinar-X dengan panjang-panjang gelombang karakteristik dari setiap atom di dalam sampel. Untuk setiap atom di dalam sampel, intensitas dari sinar-X karakteristik tersebut sebanding dengan jumlah (konsentrasi) atom di dalam sampel. Dengan demikian, jika kita dapat mengukur intensitas sinar-X karakteristik dari setiap unsur, kita dapat membandingkan intensitasnya dengan suatu standar yang diketahui konsentrasinya, sehingga konsentrasi unsur dalam sampel bisa ditentukan.
Instrumen yang digunakan untuk melakukan pengukuran tersebut dinamakan X-Ray Fluorescence Spektrometer. Peralatan ini terdiri dari tabung
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
22
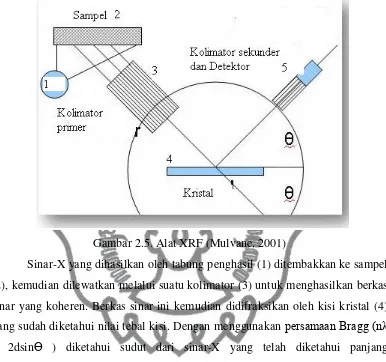
Gambar 2.5. Alat XRF (Mulvane, 2001)
Sinar-X yang dihasilkan oleh tabung penghasil (1) ditembakkan ke sampel (2), kemudian dilewatkan melalui suatu kolimator (3) untuk menghasilkan berkas sinar yang koheren. Berkas sinar ini kemudian didifraksikan oleh kisi kristal (4) yang sudah diketahui nilai tebal kisi. Dengan menggunakan persamaan Bragg (nλ
= 2dsinӨ ) diketahui sudut dari sinar-X yang telah diketahui panjang gelombangnya. Kemudian kristal dan detektor (5) diatur untuk mendifraksikan panjang gelombang tertentu.
Intensitas sinar-X karakteristik untuk setiap unsur yang sedang diselidiki ditentukan dengan cara merotasikan kristal dan detektor pada sudut yang dibutuhkan untuk mendifraksi panjang gelombang karakteristik tersebut. Intensitas sinar-X kemudian diukur untuk setiap unsur dan setiap unsur pada standar yang telah diketahui konsentrasinya.
Kelebihan dari metode XRF adalah 1. Akurasi yang tinggi.
2. Dapat menentukan unsur dalam material tanpa adanya standar.
3. Dapat menentukan kandungan mineral dalam bahan biologik maupun dalam tubuh secara langsung.
5 2
3
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
23
Kelemahan dari metode XRF adalah
1. Tidak dapat mengetahui senyawa apa yang dibentuk oleh unsur-unsur yang terkandung dalam material yang akan kita teliti.
2. Tidak dapat menentukan struktur dari atom yang membentuk material itu.
2.7. Hukum Faraday
Pelapisan dengan metode elektrodeposisi mengikuti hukum Faraday. Hukum Faraday menyatakan hubungan antara arus yang digunakan dengan massa zat yang dihasilkan. Secara matematis hukum Faraday dapat dinyatakan sebagai berikut (Hartomo, 1992):
𝑚
=
𝑒.𝑖.𝑡𝐹 (2.30)
Dimana m : adalah massa lapisan tipis (gr)
i : arus yang mengalir melalui larutan elektrolit (A) t : lama proses elektrodeposisi (detik)
e : massa ekuivalen kimia logam pelapis (gr)
F : konstanta Faraday ( 1 Faraday = 96.500 Coulomb/mol)
2.8. Material Magnetik
Sebuah elektron dalam orbitnya serupa dengan sebuah sosok arus kecil (arusnya berlawanan dengan arah gerak elektron) dan dapat mengalami torka dalam medan magnetik eksternal, torka ini cenderung untuk menjajarkan medan magnetik yang ditimbulkan oleh elektron, yang memeri kontribusi pada momen magnetik atom hanyalah spin elektron dalam kulit yang tidak lengap. Kontribusi yang ketiga pada momen sebuah atom ditimbulkan oleh spin nuklir, tetapi pengaruh dari faktor ini biasanya dapat diabaikan.
Medan magnet digambarkan dengan dua vektor yang berlainan: induksi magnet B atau intensitas medan magnet H . Hubungan antara B dan H adalah (Omar, 1993)
0
=
perpustakaan.uns.ac.id digilib.uns.ac.id
merupakan permeabilitas ruang hampa.
Ketika bahan material ditempatkan dalam medan magnet akan mengalami magnetisasi. Magnetisasi disimbulkan dengan vektor M , yaitu momen dipol per satuan volume. Induksi magnet dalam bahan diberikan dalam persamaan.
0 0 0
xmerupakan suseptibilitas magnetik bahan. M sebanding dengan H ,
medan luar. Suseptibilitas magnet besarnya kontribusi yang diberikan suatu bahan yang berada dalam pengaruh medan magnet terhadap seluruh rapat fluks magnet yang ada.
Berdasarkan arah dan nilai suseptibilitas magnetnya material magnetik dapat dikelompokkan menjadi tiga, yaitu material paramagnetik, diamagnetik dan feromagnetik (Omar, 1993).
2.8.1. Material Diamagnetik
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
25
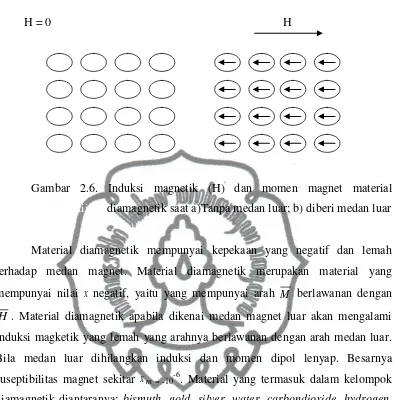
H = 0 H
Gambar 2.6. Induksi magnetik (H) dan momen magnet material iiiiiiiiiiiiiiiiiiiii diamagnetik saat a)Tanpa medan luar; b) diberi medan luar
Material diamagnetik mempunyai kepekaan yang negatif dan lemah terhadap medan magnet. Material diamagnetik merupakan material yang mempunyai nilai x negatif, yaitu yang mempunyai arah M berlawanan dengan
H. Material diamagnetik apabila dikenai medan magnet luar akan mengalami
induksi magketik yang lemah yang arahnya berlawanan dengan arah medan luar. Bila medan luar dihilangkan induksi dan momen dipol lenyap. Besarnya suseptibilitas magnet sekitar xm = -10-6. Material yang termasuk dalam kelompok
diamagnetik diantaranya: bismuth, gold, silver, water, carbondioxide, hydrogen, copper (Griffiths, 1993).
2.8.2. Material Paramagnetik
Material paramagnetik mempunyai kepekaan yang positif dan kecil terhadap medan magnet. Material paramagnetik merupakan material yang sedikit tertarik terhadap suatu medan magnet dan mempunyai nilai x positif yaitu untuk
M parallel H . Material paramagnetik mempunyai momen dipol magnet
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
26
oksigen, sodium, aluminium, tungsten, gadolinium, platinum, titanium (Omar, 1993).
Skema momen magnet pada material paramagnetik bila tidak diberi medan luar seperti terlihat pada gambar 2.7. Bila material paramagnetik diberi pengaruh medan magnet, maka momen magnetnya akan berubah sebagian mengikuti arah medan. Bila medan magnet yang diberikan dihilangkan, maka arah momen magnet akan kembali acak.
Gambar 2.7. Orientasi momen magnet material
paramagnetik bila tidak dikenai medan luar
Gambar 2.8. Orientasi momen magnet material paramagnetik bila dikenai medan luar
2.8.3. Material Feromagnetik
Material feromagnetik merupakan material yang mengalami gejala magnetisasi secara spontan tanpa adanya medan magnet dari luar. Bahan feromagnetik mempunyai kepekaan yang positif dan besar terhadap medan
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
27
magnet eksternal. Material feromagnetik mempunyai momen dipol yang sangat kuat yang berasal dari spin elektron.
Dalam bahan feromagnetik, masing-masing atom memiliki momen dwikutub yang relatif besar, yang terutama ditimbulkan oleh momen spin elektron
yang tak terkompensasi. Gaya antara atom menyebabkan momen ini mempunyai arah yang sejajar dalam suatu daerah yang terdiri dari banyak atom. Daerah ini disebut domain, bentuk serta ukurannya dapat bermacam-macam berkisar dari
ukuran satu mikrometer sampai beberapa sentimeter.
Tanpa adanya medan luar orientasi domain acak, sehingga jumlah
magnetisasi secara makroskopik adalah nol. Domain merupakan daerah yang mempunyai momen dipol sama. Diawah temperatur Curie, bahan feromagnetik terbagi dalam beberapa domain. Domain-domain tersebut termagnetisasi dalam
arah yang berbeda seperti yang di tunjukkan dalam gambar 2.9. Domain-domain
tersebut dipisahkan oleh dinding domain yang mengalami peralihan arah
magnetisasi.
Gambar 2.9. Arah domain material feromagnetik tanpa medan luar
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
28
Gambar 2.10. Pengaruh suhu terhadap sifat bahan feromagnetik (Omar, 1993)
Diatas temperatur Curie momen dipol berorientasi secara acak sehingga magnetisasinya nol. Pada daerah ini material berubah menjadi bersifat paramagnetik.
Pemberian medan magnet membuat domain tumbuh mendesak domain
yang lain karena migrasi batas domain. Sehingga seluruh spesimen mengalami
meagnetisasi (Omar, 1993). Nilai magnetisasi bergantung pada besar medan magnet luar yang diberikan. Magnetisasi akan mencapai nilai maksimum jika momen magnetik atom sudah sejajar seluruhnya. Nilai maksimum ini disebut magnetisasi jenuh (Ms).
Gambar 2.11. menunjukkan arah momen magnet pada material feromagnetik saat berada dalam pangeruh medan magnet.
Gambar 2.11. Arah momen magnet material feromagnetik saat B = 0 dan saat diberi medan magnet luar B
Paramagnetik Ms
Feromagnetik
Tc
T(K)
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
29
a. Besi (Fe)
Besi murni adalah logam yang berwarna putih mengkilat dan relatif lunak. Besi merupakan logam yang reaktif dan mudah terkorosi dalam udara lembab. Besi mudah dicampurkan dengan zat-zat lain. Sehingga menjadi bahan yang keras dan tidak mudah berkarat.
Gambar 2.12. Konfigurasi elektron pada sub kulit 3d untuk besi (Fe) (Smith, 1993)
Besi mempunyai nomor atom 26 dan empat elektron yang tidak berpasangan pada sub kulit 3d, hal ini menyebabkan besi mempunyai momen magnet yang tidak nol. Momen magnet ini disebabkan karena karena adanya pergerakan elektron yang mengelilingi inti dan berputar pada sumbunya. Setiap elektron yang berputar mempunyai momen dipol magnet yang biasa disebut dengan magneton Bohr yang nilainya = 9,27 x
10-24 Am2 (Smith, 1993).
b. Nikel (Ni)
Nikel merupakan logam yang berwarna putih mengkilat, keras dan tahan korosi. Sifat-sifat seperti itu dapat dimanfaatkan untuk melapisi barang yang terbuat dari besi, baja atau tembaga, sehingga barang-barang itu terlindungi dari korosi. Nikel juga biasa digunakan sebagai paduan logam seperti stainless steel, monel ( Ni, Cu, dan sedikit Fe), nikrom (Ni, Fe, dan Cr), alniko (Al, Ni, Fe, dan Co), dan paduan NiFe.
Nikel mempunyai nomor atom 28 dan dua elektron yang tidak berpasangan pada sub kulit atom 3d.
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
30
Gambar 2.13. Konfigurasi elektron pada sub kulit 3d untuk nikel (Ni) (Smith, 1993)
2.9. Histerisis
Menurut teori elektromagnetik tenaga yang terdesipasi sebagai panas persatuan volume akan sebesar H-dB. Ini sama dengan luasan yang dibatasi oleh
liku histerisis dan sumbu H pada grafik liku histeris.
Berbeda dengan gejala pragmatik, maka dalam feromagnetik medan magnet yang dikenakan menjadi sangat kuat. Selain itu hubungan antara induksi magnet (B) dan kuat medan magnet (H) tidak tetap, melainkan tergantung pada
proses perubahannya. Gambar 2.16 memperlihatkan liku histeris dari material feromagnetik.
Gambar 2.14. Liku Histerisis Material Feromagnetik (Peter Soedarjo, 1985)
Liku histerisis pada Gambar 2.16. menunjukkan adanya keterlambatan atau tidak serentaknya perubahan B mengikuti perubahan H. Anak panah tersebut
pada gambar menunjukkan urutan perubahan H = 0 di titik 0. Pada titik A terjadi
kejenuhan akan B, yaitu apabila H dinaikkan maka tidak akan menaikkan B. Jika
harga H di titik A diperkecil, Lintasan liku tidak lagi membalik melalui lintasan A0, melainkan melewati lintasan lain yaitu dari A ke Br, ke Hc, dan seterusnya.
28Ni
-H H
B A
Br
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
31
Hal ini menunjukkan bahwa B masih tersisa atau mempunyai nilai
meskipun H sudah bernilai 0, dan bahan feromagnetik masih bersifat sebagai
magnet. Pada saat B = Br, untuk H = 0 sisa harga Br disebut remanen magnetik.
Untuk menghilangkan sisa kemagnetan Br, diperlukan medan magnet yang
arahnya berlawanan dan kuat medannya sebesar Hc. Kuat medan Hc disebut
perpustakaan.uns.ac.id digilib.uns.ac.id
Penelitian dilakukan dengan metode eksperimental laboratoris. Dalam penelitian ini dilakukan pelapisan elektroplating NiFe pada PCB atau CuPCB, di mana sebelumnya substrat tersebut diberikan pretreatment copper strike sebagai
lapisan tahap awal dan untuk mengaktifkan permukaan substrat guna memberikan kelekatan yang baik antara substrat dan deposit NiFe. Elektrolit yang digunakan berasal dari bak sulfat, dalam rangka mengembangkan komposisi alternatif bak sulfat yang dapat digunakan untuk formula copper strike. Serangkaian
karakterisasi terhadap lapisan NiFe dikerjakan menggunakan instrumen XRF ( X-Ray fluoresence) untuk menentukan komposisi kristal dari lapisan NiFe yang
terbentuk dan STM easy scan untuk melihat morfologi lapisan NiFe yang
terbentuk. Akhirnya, karakteristik magnetik lapisan yang terbentuk menggunakan
vibrating sample magnetometer (VSM) untuk melihat bahwa lapisan yang
terbentuk memiliki sifat magnet.
3.2. Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Sub Lab. Kimia dan Fisika Laboratorium Pusat F MIPA, Universitas Sebelas Maret mulai dari bulan Februari sampai dengan bulan Desember 2011.
3.3. Alat dan Bahan Penelitian
3.3.1. Alat untuk Pembuatan Lapisan NiFe
Peralatan yang digunakan adalah sebagai berikut :
a. Electrolityc analyzer, Model: AES-2D,Yanaco 1 buah
b. Magnetic Stirrer and Hot Plate, Model: 4658, Cole Parmer 1 buah
c. Magnetic Bar 1 buah
d. Anoda Platina 1buah
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
33
f. PH meter, Model: Combo, Hanna 1 buah
g. Statif dan Holder 1set
h. Multimeter, Model : DT 9205, Excel 1buah i. Neraca analitis max =310 g; d=0,001 g, Model : BP 3103, Sartorius1buah
j. Stopwatch, Hanhart 1buah k. Jangka sorong, Pitutoyo 1buah
l. Gergaji besi 1buah m. Peralatan Gelas 1set
3.3.2. Alat untuk Karakterisasi Lapisan NiFe
Peralatan yang digunakan adalah sebagai berikut :
a. X-Ray Fluoresence (XRF) 1set
b. Scanning Tunneling Microscopy(STM) Model: nano surf 1 set
c. Vibrating Sample Magnetometer (VSM) 1 set
3.3.3. Bahan untuk Pembuatan Lapisan NiFe
Bahan kimia yang digunakan di antaranya sebagai berikut :
a. 𝐹𝑒𝑆𝑂4.7𝐻2O p.a., Merck 50gr
b. 𝑁𝑖𝑆𝑂4.6𝐻2O p.a., Merck 50gr
c. 𝐻3𝐵𝑂3.p.a., Merck 75gr
d. 𝐶𝑢𝑆𝑂4.5𝐻2O p.a., Merck 50 gr
e. 𝐻2𝑆𝑂4 p.a., Merck 10 ml
f. 𝐷𝑒𝑡𝑒𝑟𝑗𝑒𝑛𝑏𝑢𝑏𝑢𝑘 secukupnya
g. Akuades 10 lt
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
34
3.4. Prosedur Percobaan
Gambar 3.1. Gambar Alur Penelitian
3.4.1. Persiapan
Persiapan substrat memiliki beberapa tahapan proses yaitu :
3.4.1.1. Pemotongan Plat Tembaga
Pemotongan plat tembaga dilakukan dengan menggunakan gergaji besi dan gergaji mika. Plat tembaga yang digunakan berbentuk strip, dipotong
kecil-kecil dengan dimensi (1,5 × 3) cm2, (2,5 × 3) cm2, (2,5 × 4) cm2.
3.4.1.2. Pemolesan Plat Tembaga Secara Mekanik (Mechanical Polishing)
Pemolesan secara mekanik merupakan salah satu pretreatment fisika
sebelum benda kerja (substrat) siap untuk dielektroplating. Perlakuan tersebut bertujuan untuk menghilangkan kotoran-kotoran atau lemak yang terdapat pada permukaan substrat (plat tembaga). Tingkat keberhasilan pemolesan ditunjukan oleh permukaan tembaga terlihat semakin mengkilap. Papan PCB printed circuit board yang akan digunakan diolesi dengan autosol yang kemudian digosok
dengan kertas tissue.
Persiapan Preparasi Sampel
Elektrodeposisi
Karakterisasi
Struktur, komposisikristal dan karakteristik magnet
Analisa
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
35
3.4.1.3. Perlakuan Awal (Pretreatment Elektroplating) Plat Tembaga iSecara
Kimiawi Sebelum Elektroplating NiFe
Selain Pretreatment fisika, plat tembaga (substrat) juga perlu diberi pretreatment kimia agar permukaannya lebih bersih dan siap (permukaannya telah
aktif) untuk dielektroplating, oleh karena kebersihan dan kesiapan permukaan substrat dapat mempengaruhi hasil akhir pelapisan dan kelekatan substrat-deposit, pretreatment untuk substrat (logam dasar) tembaga yaitu :
a. Pembilasan b. Copper Strike;
c. Pembilasan.
Setelah tahapan pretreatment di atas maka plat tembaga siap untuk
dielektroplating.
Keterangan prosedur kerja tahapan pretreatment di atas adalah sebagai berikut
1) Pembilasan
Seluruh proses pembilasan menggunakan akuades. Setelah plat tembaga dibilas, lalu dikeringkan menggunakan tisu dan lap bersih.
2) Prosedur Copper Strike
a) Penyiapan Larutan Copper Strike
Formula copper strike yang diusulkan adalah sebagai berikut :
Tabel 3.1. Formula Bak Sulfat Desain untuk Elektrolit Copper Strike
Bahan Konsentrasi
𝐶𝑢𝑆𝑂46𝐻2O 0,04 M
𝐻2𝑆𝑂4 0,10 M ditetesi
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
36
b) Prosedur Kerja Copper Strike
Sebelum pengerjaan copper strike, plat tembaga dipasangi isolasi
listrik (electrical tape) terlebih dahulu dengan tujuan menutup bagian yang
tidak ingin diplating, sehingga suatu ukuran luasan 2,5 cm × 4 cm, 2,5 cm × 3 cm, 1,5 cm × 3 cm. Ukuran tersebut merupakan ukuran yang akan dipakai sebagai acuan pemberian arus.
Proses copper strike menggunakan prinsip elektrolis sistem dua
elektroda yang terdiri dari satu buah anoda dan satu buah katoda. Posisi anoda dan katoda saling berhadapan. Logam yang dilapisi (sebagai katoda) adalah Cu. Sedangkan anodanya adalah Pt (2,5 cm × 2,5 cm). Jarak antar elektroda adalah 3 cm. Elektrolis setiap pengerjaan copperstrike
membutuhkan 100 ml campuran larutan pada Tabel 3.1.
3.4.2. Elektrodeposisi
3.4.2.1. Pembuatan Larutan Elektrolit dan Proses Elektroplating NiFe
a. Penyiapan Larutan Elektroplating NiFe
Formula bak elektroplating NiFe yang digunakan adalah sebagaimana yang dilakukan dalam penelitian Bedir et.al. (2006) adalah
sebagai berikut:
Tabel 3.2. Formula Bak Elektroplating NiFe (Bedir et.al, 2006).
Bahan Kuantitas
𝐹𝑒𝑆𝑂4 5,257 gram (0,02 M) 𝑁𝑖𝑆𝑂4 5,560 gram (0,02 M) 𝐻3𝐵𝑂3 24,732 gram (0,4 M)
𝐻2𝑆𝑂4 1 M 1 ml (sehingga pH campuran ± 3) Akuedes (sebagai pelarut) Hingga 1 liter
Catatan : campuran formula di atas memiliki pH ± 3.
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
37
b. Prosedur Kerja Elektroplating NiFe
Sebelum pengerjaan elektroplating NiFe, spesimen copper-copper strike plating (plat tembaga setelah di-pretreament copper strike)
dipasangi isolasi listrik terlebih dahulu dengan tujuan untuk menutup bagian yang tidak ingin diplating, sehingga didapat luasan 2,5 × 4 cm, 2,5 cm × 3 cm, 1,5 × 3 cm yang akan dipakai untuk acuan pemberian arus.
Selanjutnya plat tersebut ditimbang beratnya sebelum dielektroplating. Setiap akan mengerjakan proses elektroplating NiFe,
spesimen copper-copper strike plating diolesi dengan autosol.
Proses Elektroplating NiFe menggunakan prinsip elektrolis sistem dua elektroda, yang terdiri dari satu buah anoda dan satu buah katoda. Posisi anoda dan katoda saling berhadapan. Logam yang dilapisi (sebagai Katoda) adalah Cu sedangkan anodanya adalah Pt. Jarak antar elektroda adalah 3 cm. Elektrolisis dikerjakan selama 25 menit, tanpa pengadukan. Dibutuhkan 100 ml campuran larutan pada Tabel 3.1. (yang disiapkan selalu dalam keadaan fresh) untuk setiap pengerjaan elektroplating NiFe.
Alat elektroplating yang digunakan ditunjukan oleh Gambar 3.1.