Isolasi dan Karakterisasi Gen Penyandi Protein Permukaan
VP28 White Spot Syndrome Virus (WSSV) pada
Udang Windu (Penaeus monodon Fabricius, 1798)
Asmi Citra Malina
1, Andi Aliah Hidayani
1dan Andi Parenrengi
21Fakultas Ilmu Kelautan dan Perikanan, Universitas Hasanuddin, Makassar 2Balai Penelitian dan Pengembangan Budidaya Air Payau, Maros
email: citra@unhas.ac.id; citramalina@gmail.com
Abstract
Asmi Citra Maliuna, Andi Aliah Hindayani dan Andi Perenrengi. 2013. Isolation and Characterization of Surface Protein Genes encoder VP28 of White Spot Syndrome Virus (WSSV) in Tiger Shrimp (Penaeus monodon Fabricius, 1798). Konferensi Akuakultur Indonesia 2013. White Spot
Syndrome (WSS) is a viral disease which affects most of the commercially cultivated marine shrimp species all over the world causing significant losses. White spot syndrome virus (WSSV) envelope protein VP28 gene is widely used because its ability to bind to the surface of shrimp epithelial cells and might promote innate immune recognition of WSSV. Its recombinant protein was expressed in various expression systems and used as recombinant vaccine or immunostimulant to increase shrimp survival against WSSV. This research was aimed to isolate and characterize gene encoding envelope protein VP28 WSSV from black tiger shrimps (Penaeus monodon Fabr). The genomic of DNA were isolated from pleopods, periopods and tails of black tiger shrimp using DTAB-CTAB method. Isolation of gene encoding envelope protein VP28 WSSV ws successfully performed with the results of the length of DNA fragment was 672 bp. The results of homology analysis using BLASTn homology suggested that these isolates genes from Takalar have closest relationship with isolates from India.
Keywords: Disease; Tiger shrimps; VP28; WSSV
Abstrak
Penyakit merupakan kendala terbesar yang dihadapi dalam budidaya udang windu (Penaeus monodon). White Spot Syndrome Virus (WSSV) merupakan patogen yang paling serius menyerang udang windu dan telah menghancurkan industri udang windu di berbagai negara. Pencegahan penyakit udang windu termasuk WSS dapat dilakukan melalui penggunaan immunostimulan dan vaksin. Protein dari WSSV dalam hal ini Viral Protein (VP) 28 diketahui terlibat dalam infeksi sistemik pada udang dan dapat menstimulasi munculnya sistem kekebalan pada udang windu sehingga dapat digunakan sebagai vaksin rekombinan maupun imunostimulan. Penelitian ini bertujuan untuk mengisolasi dan mengkarakterisasi gen penyandi protein struktural VP28 WSSV pada udang windu. Genom DNA diisolasi dari kaki renang, kaki jalan dan ekor menggunakan metode DTAB-CTAB. Isolasi gen penyandi protein permukaan VP 28 berhasil dilakukan dengan hasil panjang fragmen 672 bp. Hasil homologi antar sampel yang memiliki kekerabatan terdekat yaitu 99,406%. Hasil analisis homologi dengan gene bank menggunakan kesejajaran lokal pada BLASTn menunjukkan bahwa homologi sampel gabungan memiliki kekerabatan yang paling dekat dengan isolat dari India.
Kata kunci: Penyakit; Udang windu; VP28; WSSV
Pendahuluan
Budidaya udang di Indonesia mulai dilakukan secara intensif pada periode tahun 1980-an. Udang yang dibudidayakan saat itu adalah udang windu (Penaeus monodon). Pada akhir tahun 1990-an terjadi kegagalan panen yang cukup besar di berbagai tambak di Indonesia. Penyebab utama kegagalan panen tersebut adalah serangan penyakit viral yang disebabkan antara lain oleh
monodon baculo virus (MBV) dan white spot syndrome virus (WSSV) (Sukenda, 2009).
WSSV merupakan patogen yang paling serius menyerang udang windu dan telah menghancurkan industri udang windu di berbagai negara. Virus ini sangat ganas dan sangat sulit dihentikan. WSSV pertama kali muncul di Taiwan pada tahun 1992. Kemudian menyebar dengan
cepat ke daerah-daerah utama produsen udang dan menyerang populasi udang alam di Asia, Amerika Selatan, Amerika Tengah, dan negara-negara bagian selatan Amerika Serikat (Rajendran
et al., 1999).
Udang yang terserang penyakit ini menunjukkan tanda adanya bercak putih di seluruh tubuhnya, dari karapas hingga pangkal ekor. Penyebab penyakit bercak putih viral adalah WSSV, yang termasuk keluarga Nimaviridae (Murdjani, 2007). Beberapa pencegahan dalam penyakit udang windu termasuk WSSV, yaitu penggunaan immunostimulan dan penggunaan vaksin. Diketahui beberapa gen mayor yang terdapat pada virus WSSV adalah VP15, VP19, VP24, VP26, dan VP28. Protein dari virus dalam hal ini VP28 diketahui terlibat dalam infeksi sistemik pada udang dan dapat menstimulasi munculnya sistem kekebalan pada udang windu. VP 28 juga dilaporkan berada pada permukaan virion dan terlibat dalam keterikatan ke dalam sel (Sriwulan dan Irmawati, 2006).
Viral protein 28 diketahui merupakan protein yang terlibat dalam infeksi organ-organ penting udang sehingga protein ini dapat digunakan sebagai vaksin untuk meningkatkan ketahanan tubuh udang terhadap WSSV. Hingga saat ini produksi vaksin rekombinan VP28 WSSV belum pernah dilakukan di Indonesia. Oleh karena itu penelitian mengenai isolasi dan karakterisasi gen penyandi protein permukaan VP28 WSSV pada udang windu sangat diperlukan sebagai bahan informasi dasar dalam pembuatan imunostimulan dan vaksin sebagai usaha pencegahan penyakit virus WSSV.
Tujuan penelitian ini adalah untuk mengisolasi dan mengkarakterisasi gen penyandi protein struktural VP28 WSSV pada udang windu yang berasal dari daerah Kab. Takalar, Sulawesi Selatan.
Materi dan Metode
a) Pengambilan sampel
Sampel yang digunakan dalam penelitian ini adalah udang windu (P.monodon). Jumlah sampel yang digunakan tiga sampel, yaitu: sampel A (kode sampel 25 dengan bobot 7g), sampel B (kode sampel 26 dengan bobot 15 g) dan sampel C (kode sampel 30 dengan bobot ± 10 g). Bagian yang diambil adalah kaki renang, kaki jalan dan sebagian ekor. Sampel ini diperoleh dari Instalasi Tambak Percobaan Balai Penelitian Perikanan Budidaya Air Payau di Takalar. Selanjutnya sampel dibawa ke Laboratorium Bioteknologi Balai Penelitian dan Pengembangan Budidaya Air Payau (BPPBAP).
b)
Ekstraksi DNA udang windu yang terinfeksi WSSVEkstraksi genom DNA udang windu diisolasi mengacu pada metode DTAB – CTAB adalah sebagai berikut :
- Sampel udang windu yang digunakan adalah campuran bagian kaki renang, kaki jalan dan ekor. Kaki renang, kaki jalan dan ekor ditimbang sekitar 20 mg kedalam tube berukuran 2 µL berisi 0,6 µL solution.
- Sampel yang berada didalam tube kemudian ditumbuk.
- Selanjutnya sampel diinkubasi pada water bath bersuhu 75oC selama 5 menit kemudian didinginkan pada suhu ruang.
- Sampel divortex sebentar kemudian tambahkan 0,7 µL kloroform, vortex lagi sekitar 20 detik dan disentrifuse pada kecepatan 12.000 rpm selama 5 menit.
- Selanjutnya bagian atas dipindahkan ke tube baru ukuran 2 µL, setelah itu ditambahkan 100 µL larutan CTAB solution dan 900 µL ddH2O, vortex sebentar, kemudian inkubasi dalam water bath bersuhu 75oC selama 5 menit.
- Sampel didinginkan pada suhu ruang dan disentrifuse pada kecepatan 12000 rpm selama 10 menit.
- Supernatant kemudian dipindahkan dengan hati-hati, campurkan pellet dengan 150 µL larutan Dissolve solution, inkubasi pada suhu 75oC selama 5 menit kemudian dinginkan pada suhu ruang.
- Sampel kemudian disentrifuse pada kecepatan 12000 rpm selama 5 menit. Lalu lapisan bening dipindahkan ke tube baru berukuran 0,5 µL dengan 300 µL ethanol 95%
- Vortex sebentar, sampel kemudian disentrifuse pada kecepatan 12000 rpm selama 5 menit, kemudian pellet dicuci dengan menambahkan 200 µL ethanol 70%, homogenkan, keringkan pellet selama kurang lebih 2–3 jam atau sampai dikira betul-betul kering dan terakhir tambahkan TE buffer sebanyak 100 µL.
- Sampel di simpan dalam lemari pendingin bersuhu -20oC.
c) Setelah proses ekstraksi, maka dilakukan PCR. Proses PCR dilakukan sebanyak 2 kali, yaitu
PCR pertama dan PCR lanjutan. Adapun langkah-langkahnya yaitu : 1) PCR Pertama (First PCR)
Denaturasi : 94oC 30 detik; 62oC 30 detik; 72oC 30 detik, selama 5 siklus, kemudian annealing : 94oC 15 detik; 62oC 15 detik; 72oC 20 detik selama 15 siklus, selanjutnya extension: 72oC 30 detik; 20oC 30 detik; dan extansion akhir pada suhu 4oC.
2) PCR Lanjutan (Nested PCR)
94oC 20 detik; 62oC 30 detik; 72oC 30 detik selama 25 siklus, tambahkan 72oC 30 detik; 20oC 30 detik diakhir siklus.
d) Setelah proses PCR dilakukan proses elektroforesis agarosa 2% dengan komposisi sampel
sebanyak 7 µL dan loading dye sebanyak 3 µL. elektroforesis ini menggunakan marker 100bp sebanyak 1 µL dan kontrol positif dan kontrol negatif. Hasil elektroforesis diamati dibawah UV transilluminator.
e) Penentuan konsentrasi DNA
Konsentrasi DNA hasil ekstraksi dapat diketahui dengan metode spektrofotometer dengan menggunakan alat Genequant pada panjang gelombang A260/280 nm. Kemurnian DNA dikatakan murni jika angka pada gelombang A260/280 berada diantara 1,8–2,0. Selain itu kualitas DNA yang telah diekstraksi dilihat melalui analisis eletroforesis gel agarosa.
f) Amplifikasi PCR
Isolasi VP28 virus WSSV dilakukan dengan menggunakan teknik PCR. Adapun langkah-langkahnya adalah sebagai berikut :
- Sampel yang telah diPCR dan bahan-bahan lain disiapkan.
- Kemudian beads,1 µL primer VP28-F, 1 µL primer VP28-R, 1,5 genom (template) udang windu dan 21,5 µL aquamilliQ dicampur kedalam tube.
- Sampel disentrifuse cepat selama kurang lebih 10–15 detik.
- Lalu sampel dimasukkan ke dalam mesin PCR. Adapun profil untuk PCR tersebut adalah pre-denaturasi 94oC 5 menit sebanyak 1 siklus; denaturasi: 94oC 30 detik; annealing 53oC 30 detik; extansion 72oC 30 detik sebanyak 35 siklus; final extansion 72oC 7 menit kemudian tambahkan 4oC diakhir siklus.
g) Elektroforesis agarosa
- Penyiapan gel agarosa 2%, dimana agarosa ini terdiri dari agarosa sebanyak 0,6 g dan TBE sebanyak 30 mL. Agarosa kemudian dipanaskan menggunakan microwave selama 2 sampai 3 menit sampai agarosa menyatu sepenuhnya dengan TBE. Setelah itu ditambahkan gel red sebanyak 1 µL dan dituangkan ke dalam cetakan.
- Setelah agar mengeras dan mulai buram kemudian dilakukan elektroforesis, dengan komposisi sampel sebanyak 3 µL dan loading dye 1 µL. Elektroforesis ini menggunakan marker 100bp plus sebanyak 1 µL. elektroforesis ini dilakukan selama 1 jam atau lebih. - Hasil elektroforesis diamati dibawah UV transilluminator.
Setelah proses amplifikasi PCR dilakukan, selanjutnya sampel dikirim ke laboratorium First Base Singapura untuk dilakukan penderetan sekuen nukleotida. Metode sekuen yang digunakan adalah metode sanger.
i) Analisis data
Sekuen hasil penderetan dianalisis dengan menggunakan program Genetyx Version 7 untuk mendapatkan konsensus sekuen dari sekuen forward dan reverse. Untuk mengetahui kemiripan (similaritas) sekuen yang dihasilkan, sekuen VP-28 disejajarkan (alignment) dengan sekuen yang telah ada di dalam Bank Gen dengan menggunakan program BLAST-N (basic local alignmen
search tool-nucleotide). Hasil analisis ditujukan dengan pohon filogenetika.
Hasil dan Pembahasan
Ekstraksi udang windu yang terinfeksi WSSV
Proses ekstraksi udang windu yang terinfeksi WSSV dilakukan dengan metode DTAB – CTAB. Ukuran udang windu yang digunakan adalah udang windu kecil, udang windu
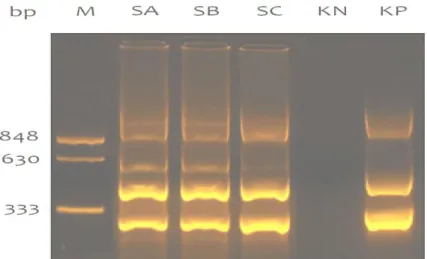
besar dan . Bagian yang digunakan dari udang adalah campuran kaki renang, kaki jalan, dan ekor. Setelah proses ekstraksi dilakukan maka selanjutnya dilakukan proses PCR. Setelah diPCR kemudian sampel dielektroforesis, proses elektroforesis ini bertujuan untuk melihat apakah udang diektraksi adalah udang yang positif atau negatif terinfeksi WSSV. Adapun hasil elektroforesis udang windu dapat dilihat pada Gambar 1.
Gambar 1. Hasil elektroforesis udang windu yang terinfeksi WSSV setelah proses ekstraksi dengan menggunakan metode DTAB – CTAB.
Keterangan, SA=Sampel A; SB=Sampel B; SC=Sampel C.
Dari Gambar diatas dapat dilihat bahwa sampel A, B, dan C positif terinfeksi virus WSSV. Hal ini ditandai dengan band pada sampel sesuai dengan kontrol positif yaitu 333 bp, 630 bp, dan 848 bp. Diagnosis penyakit yang paling mudah adalah apabila telah terjadi infeksi akut, terlihat dengan timbulnya bercak putih pada bagian cephalothorax. Pada infeksi dini dapat dilakukan dengan pemeriksaan menggunakan teknik Polymerase Chain Reaction (PCR) menggunakan primer spesifik untuk WSSV (Mukhlis, 2010).
Ekspresi gen WSSV dibagi kedalam dua fase yaitu: 1) fase awal (early phase) yang terjadi sebelum DNA virus bereplikasi; 2) Fase lanjut (late phase) terjadi ketika inisiasi replika DNA virus atau setelahnya gen-gen WSSV yang ditranskripsikan pada fase awal meliputi RR1,RR2, PK, TK-TMK, dan DNA pol, sedangkan gen-gen yang menyandikan protein-protein struktural utama WSSV yaitu VP28, VP26, VP24, VP19, dan VP15 (Mukhlis, 2010).
Pengukuran kemurnian dan konsentrasi DNA genom
Tabel 1. Kemurnian dan konsentrasi DNA udang windu asal Takalar
NO Sampel ABS ABS A260/A280
Konsentrasi (μg/mL)
A260 A280 DNA
1 Sampel A (7g) 0.876 0.475 1.844 43.80
2 Sampel B (15g) 0.800 0.444 1.802 40.00
3 Sampel C (10g) 0.703 0.324 2.170 35.15
Jumlah 5.816 213
Rata-rata 2.326,4 426
Dari Tabel 1 dapat dilihat bahwa hasil kemurnian dan konsentrasi DNA udang windu asal Takalar menunjukkan hasil yang berbeda-beda, dimana sampel A dan B memiliki kemurnian DNA yang murni yaitu 1.844 dan 1.802, sedangkan sampel C memiliki kemurnian DNA yang menunjukkan adanya kontaminan senyawa berat molekul berupa protein yaitu 2.170. Kemurnian yang rendah ini diduga disebabkan oleh protein yang tercampur pada DNA yang dihasilkan. Sambrook et al. (1989) menjelaskan bahwa rasio OD akan lebih besar atau lebih kecil dari nilai 1,8–2,0 jika ditemukan kontaminasi dari protein atau fenol.
Metode spektofotomektrik digunakan untuk melihat kemurnian dan konsentrasi DNA dimana DNA memiliki nilai absorbansi maksimal pada panjang gelombang 260 nm (λ 260 nm) sedangkan protein memiliki absorbansi maksimal pada panjang gelombang 280 nm (λ 280 nm). Kemurnian DNA diketahui dari nilai rasio absorbansi DNA pada λ 260 nm dengan λ 280 nm (A260/A280). Nilai rasio untuk DNA untai ganda murni yaitu 1,8 – 2,0. Nilai rasio dibawah 1,8 menunjukkan adanya kontaminan senyawa berat molekul besar misalnya protein. Nilai rasio diatas 2,0 menunjukkan adanya kontaminan senyawa berat molekul kecil misalnya RNA.
Gambar 2. Elektroforesis hasil sekuen PCR DNA, M adalah marker 100bp plus, 1, 2, 3 adalah sampel/ Angka di sebelah kiri gambar adalah ukuran fragmen marker DNA. Tanda kepala panah () di sebelah kanan gambar menunjukkan DNA target dari hasil PCR.
Amplifikasi PCR dan analisis elektroforesis agarosa
Panjang fragmen DNA hasil amplifikasi PCR menggunakan primer forward VP28 F
5’-GTTCGATAAAGAAAAAAACTCG-3′ dan primer reverse VP28 R 5’-CCCTATCTATATAAAAAGCACG-3’ dengan cetakan DNA genomik udang windu dewasa
tinggi, yang dapat terlihat dari pita yang jelas dan bersih. Pita sampel PCR DNA yang bersih tanpa latar belakang mengindikasikan tingkat kemurnian DNA yang baik (DNA tidak terdegredasi serta terkontaminasi). Hasil elektroforesis dari amplifikasi PCR dapat dilihat pada Gambar 2.
Keberhasilan pengujian sampel dengan metode PCR dipengaruhi oleh beberapa hal, seperti faktor kontaminasi silang, umur reagen atau enzim yang dipakai, jumlah enzim yang dipakai, ketelitian saat proses ekstraksi, serta kondisi larutan buffer dan larutan etidium bromina yang dipakai.
Penderetan urutan nukleotida VP 28
Untuk memastikan apakah fragmen DNA tersebut adalah target VP28 yang diingankan, maka fragmen DNA dipurifikasi dari gel agarosa kemudian dilakukan pembacaan nukleotidanya atau dikenal dengan istilah sekuensing. Hasil sekuens terdiri dari 3 hasil sampel, yaitu sampel A, B dan C. Sekuens A (Gambar 3), sekuens B (Gambar 4) dan sekuens C (Gambar 5).
CNT CCC TAT CTT
ATA TAA AAA GCA CGA TTT
ATT
33
TAC TCG GTC TCA GTG CCA GAG TAG GTG ACG TGC
66
ACG TAC ATG TCG AAA AGA TTT CCA CCG GCG GTA
99
GCT GCA ATT GGT GCG CCA AAG GTG GTA CCA CAC 132
ACA AAG GTG CCA ACT TCA TCC TCA TCA ATA GAG 165
ACG GGG GTG AAG GAG GAG GTG TTG GAG CTA CCG 198
ACA AAG GCC TTT GAT GGG TTA ATC TTT GGC ACC 231
ATC TGC ATA CCA GTG ATG TTG ATC TTT CTT GAT 264
GTG TTG TTC CAC ACC TTG AAT GTT CCC TCA AAG 297
GTG AGA TTC TGC CCC ACA GTC ACT TCG AGT GCT 330
CGG CCC TCC ACG GGA GTG ATG ACA AGA TCC GCA 363
TCT TCT TCC TTC ATC TGT GCA TCA GAC TTT CCA 396
TTG CGG ATC TTG ATT TTG CCC AAG GTG TCG CTG 429
TCA AAG GAC ACA TCA GTC ATC TTG AAG TAG CCT 462
GAT CCA ACC TCA GCA GTC ACA GGA ATG CGG AGG 495
TTT TCA TCC ATG TTT GTC TCG ATA TTG TCT GTG 528
TGG GTT TCG ATG GTC TTG GTC ACA GTG TTG TGA 561
TAC CTA AAA ATC ACA ATA AAT ACA GCA ATC ACA 594
GCA GTG ATG GCG AGG ATG GCC GAC ACG ACC GAA 627
AGA GTG AAA GAA ATA ACC CTG ACG AGT TTT TTT
660
CTT TAT CGA ACA
672
Gambar 3. Hasil sekuen viral-protein 28 WSSV udang windu (Penaeus monodon) sampel A.
TTC CCT TTC CCT ATC TTA TAT AAA AAG CAC GAT
33
TTA
TTT CGG TCT CAG TGC CAG AGT CGG TCT CAG
66
AGG TGA CGT GCA ACA TGT CGA AAA GAT TTC ACA
99
CAC CGG CGG TAG CAA TTG GTG CGC CAA AGG CAA 132
TGG TAC CAC ACA CAA AGG TGC CAA CTT CAT CCT 165
CAT CAA TAG AGA CGG GGG TGA AGG AGG AGG TGT 198
TGG AGC TAC CGA CAA AGG CCT TTG ATG GGT TAA 231
TCT TTG GCA CCA TCT GCA TAC CAG TGA TGT TGA 264
TCT TTC TTG ATG TGT TGT TCC ACA CCT TGA ATG 297
TTC CCT CAA AGG TGA GAT TCT GCC CCA CAG TCA 330
CTT CGA GTG CTC GGC CCT CCA CGG GAG TGA TGA 363
CAA GAT CCG CAT CTT
CTT CCT TCA TCT GTG CAT 396
CAG ACT TTC CAT TGC GGA TCT TGA TTT TGC CCA 429
AGG TGT CGC TGT CAA AGG ACA CAT CAG TCA TCT 462
TGA AGT AGC CTG ATC CAA CCT CAG CAG TCA CAG 495
GAA TGC GGA GGT TTT
CAT CCA TGT TTG TCT CGA 528
TAT TGT CTG TGT GGG TTT CGA TGG TCT TGG TCA 561
CAG TGT TGT GAT ACC TAA AAA TCA CAA TAA ATA 594
CAG CAA TCA CAG CAG TGA TGG CGA GGA TGG CCG 627
ACA CGA CCG AAA GAG TAA ACC CGA CGA GTT
TTT 660
TTC ATC GAA CAA
672
Gambar 4. Hasil sekuen viral-protein 28 WSSV udang windu (Penaeus monodon) sampel B.
TTG
TTC
GAT AAA GAA AAA AAC TCG TCC CTA TCT
33
TTA TAA AAA GCA CGA TTT
ATT TAC TCG GTC TCA
66
GTG CCA GAG TAG GTG ACG TGC ACG TAC ATG TCG
99
AAA AGA TTT
CCA CCG GCG GTA GCT GCA ATT GGT 132
GCG CCA AAG GTG GTA CCA CAC ACA AAG GTG CCA 165
ACT TCA
TCC
TCA TCA ATA GAG ACG GGG GTG AAG 198
GAG GAG GTG TTG GAG CTA CCG ACA AAG GCC TTT 231
GAT GGG TTA
ATC
TTT GGC ACC ATC TGC ATA CCA 264
GTG ATG TTG
ATC
TTT
CTT GAT GTG TTG
TTC CAC 297
ACC TTG AAT GTT CCC TCA AAG GTG AGA TTC TGC 330
CCC ACA GTC ACT TCG AGT GCT CGG CCC TCC ACG 363
GGA GTG ATG ACA AGA TCC GCA TCT
TCT
TCC
TTC 396
ATC TGT GCA TCA GAC TTT CCA TTG CGG ATC TTG 429
ATT TTG
CCC AAG GTG TCG CTG TCA AAG GAC ACA 462
TCA GTC ATC
TTG AAG TAG CCT GAT CCA ACC TCA 495
GCA GTC ACA GGA ATG CGG AGG TTT TCA TCC ATG 528
TTT GTC TCG ATA TTG
TCT GTG TGG GTT TCG ATG 561
GTC TTG
GTC ACA GTG TTG TGA TAC CTA AAA ATC 594
ACA ATA AAT ACA GCA ATC ACA GCA GTG ATG GCG 627
AGG ATG GCC GAC ACG ACC GAA AGA GTG AAA GAA 660
ATA ACC CGG ACG
672
Gambar 5. Hasil sekuen viral-protein 28 WSSV udang windu (Penaeus monodon) sampel C.
Setelah dianalisis maka dapat diketahui panjang fragmen sampel A adalah 674 bp, sampel B yaitu 677 bp dan sampel C sebesar 695 bp. Kemudian dengan menggunakan software Genetyx Version 7, allignment sekuens parsial viral protein-28 dengan sampel berupa udang windu dengan nomor sampel A, B, dan C ditunjukkan pada Gambar 6. Dari hasil alignment diketahui bahwa posisi dari elemen-elemen penting tersebut adalah conserved yaitu urutan yang mirip atau identik seperti dengan sekuensnya yang terjadi dalam asam nukleotida. Start kodon ditandai dengan ATG dan stop kodon ditandai dengan TAA. Hal ini memperkuat dugaan bahwa hasil isolasi merupakan viral protein-28 dari virus WSSV dari sampel udang windu.
Gambar 6. Allignment sekuen viral protein-28 antar beberapa sampel WSSV yang menginfeksi udang windu (no sampel a, b dan c) dengan panjang gen target yaitu 674, 677, dan 695 bp. Start Kodon ditanda dengan ATG dan Stop Kodon ditandai dengan TAA. Nomor pada awal dan akhir nukleotida menunjukkan urutan nukleotida, A=adenina, C=citosina, G=guanina, dan T=timinina.
Dari hasil homologi gabungan dari sampel A, B dan C maka didapatkan 3 hasil perbandingan analisis urutan nukleotida, yaitu sampel A dan B sebesar 99,108% (Gambar 7) dan sampel A dan C sebesar 99,406% (Gambar 8) dan sampel B dan C sebesar 98,95% (Gambar 9).
Gambar 7. Hasil homologi gabungan sampel A dan sampel B. Sampel A Sampel B Sampel A Sampel B Sampel A Sampel B Sampel A Sampel B Sampel A Sampel B Sampel A Sampel B Sampel A Sampel B Sampel A Sampel B Sampel A Sampel B Sampel A Sampel B Sampel A Sampel B Sampel A Sampel B
Gambar 8. homologi gabungan sampel A dan sampel C. Sampel A Sampel C Sampel A Sampel C Sampel A Sampel C Sampel A Sampel C Sampel A Sampel C Sampel A Sampel C Sampel A Sampel C Sampel A Sampel C Sampel A Sampel C Sampel A Sampel C Sampel A Sampel C Sampel A Sampel C
Gambar 9. homologi gabungan sampel B dan sampel C.
Selanjutnya masih dengan menggunakan program Genetyx version 7 maka didapatkan hasil dendogram bahwa sampel A dan C menunjukkan kekerabatan yang lebih dekat dibandingkan dengan sampel B (Gambar 10).
Gambar 10. Dendogram sampel A, B dan C. Sampel B Sampel C Sampel B Sampel C Sampel B Sampel C Sampel B Sampel C Sampel B Sampel C Sampel B Sampel C Sampel B Sampel C Sampel B Sampel C Sampel B Sampel C Sampel B Sampel C Sampel B Sampel C Sampel B Sampel C Sampel A Sampel C Sampel B
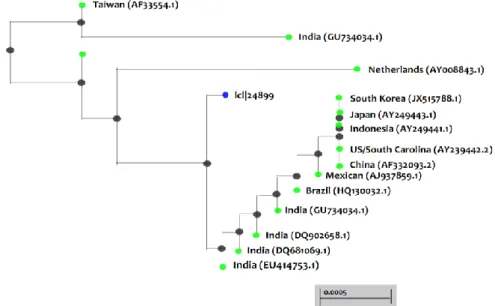
Berdasarkan hasil analisis menggunakan kesejajaran lokal (local alignment) (BLASTn)
VP28 menunjukkan kedekatan dengan Shrimp White Spot Syndrome Virus Strain SDDL2/2008 VP28 gen, complete cds yang merupakan isolat dari India (EU414753.1) yaitu 100%. Pohon
filogenetika yang menunjukkan kekerabatan isolat ini dengan beberapa VP28 yang ada dibasis data dapat dilihat pada gambar 11. Hasil tersebut menunjukkan bahwa gen VP 28 yang ada di Indonesia khususnya Takalar memiliki kemiripan yang identik dengan negara lain, ini berarti isolat dari Indonesia identik dengan isolat dari India.
Gambar 11. Pohon filogenetika VP28 yang menunjukkan kekerabatan dengan beberapa VP28 yang ada di Gen Bank.
Kesimpulan
Kesimpulan yang didapat dari penelitian ini adalah sebagai berikut :
1. Isolasi gen penyandi protein permukaan VP 28 berhasil dilakukan dengan hasil panjang fragmen yaitu 672 bp.
2. Hasil homologi antar sampel yang memiliki kekerabatan terdekat yaitu 99,406%
3. Hasil analisis homologi dengan gene bank menggunakan kesejajaran lokal pada BLASTn menunjukkan bahwa homologi sampel gabungan memiliki kekerabatan yang paling dekat dengan isolat dari India.
Daftar Pustaka
Mukhlis, A. 2010. Pengklonan gen VP28 Penyandi Viral Protein-28 dari virus White Spot Syndrome sebagai
langkah awal produksi vaksin rekombinan udang penaeid. Laporan penelitian Institut Pertanian Bogor, Bogor.
Murdjani, M. 2007. Penerapan Best Management Practices (BMP) Pada Budidaya Udang Windu (Penaeus Monodon Fabricius) secara Intensif, Departemen Kelautan Dan Perikanan, Direktorat Jenderal Perikanan Budidaya Balai Besar Pengembangan Budidaya Air Payau. Jepara.
Mavichaak, R., H. Kondo, I. Hirono dan T. Aoki. The Utilization of VP28 Gene to Protect Penaeid
Shrimps from white spot syndrom virus disease: a review. Diseases in Aquaculture VII, 157-169.
Sriwulan, Irmawati. 2006, Karakterisasi Dan Kloning Gen Pengode VP28 White Spot Syndrome Virus
(WSSV) Isolat Indonesia Sebagai Kandidat Vaksin Rekombinan Untuk Pengendalian Penyakit Bintik Putih Pada Udang Windu (Penaeus Monodon). Laporan penelitian Fakultas Ilmu Kelautan dan Perikanan, Makassar.
Sukenda. 2009, Keberadaan White Spot Syndrome Virus (WSSV), Taura Syndrome Virus (TSV) Dan
Infectious Hypodermal Haematopoitic Necrosis Virus (IHHNV) Di Tambak Intensif Udang Vaname Litopenaeus Vannamei Di Bakauheni, Lampung Selatan. Jurnal Akuakultur Indonesia, 8(2):1-8.