LAPORAN RESMI
PRAKTIKUM DASAR TEKNIK KIMIA I
Materi :
ARGENTOMETRI DAN GRAVIMETRI
Oleh :
Nama :Rizky Adhi Prabowo
NIM : 21030113130113
Kelompok : IV/Selasa Siang
Laboratorium Dasar Teknik Kimia I
Jurusan Teknik Kimia Fakultas Teknik
Universitas Diponegoro
Semarang
Laboratorium Dasar Teknik Kimia I
ii
HALAMAN PENGESAHAN1. Judul Praktikum : Argentometri-Gravimetri 2. Anggota
1. Nama Lengkap : Sherly Zagita Listyani Nurhatta
NIM : 21030113120023
Jurusan : Teknik Kimia
Universitas : Universitas Diponegoro 2. Nama Lengkap : Rizky Adhi Prabowo
NIM : 21030113130113
Jurusan : Teknik Kimia
Universitas : Universitas Diponegoro
3. Nama Lengkap : Raden Nugroho Hutomo Santoso
NIM : 21030113130134
Jurusan : Teknik Kimia
Universitas : Universitas Diponegoro
Semarang, 20 Desember 2013 Asisten Laboratorium PDTK I
Retno Nanda Saputri NIM : 21030111120006
Laboratorium Dasar Teknik Kimia I
iii
PRAKATAPuji syukur kami panjatkan kepada Tuhan Yang Maha Esa berkat rahmat dan hidayah-Nya sehingga kami dapat menyelesaikan laporan resmi Praktikum Dasar Teknik Kimia 1 dengan lancar dan sesuai dengan harapan kami.
Ucapan terima kasih juga kami ucapkan kepada koordinator asisten laboratorium PDTK 1 Puji Lestari, Retno Nanda Saputri sebagai asisten laporan praktikum argentometri-gravimetri kami, dan semua asisten yang telah membimbing sehingga tugas laporan resmi ini dapat terselesaikan. Kepada teman-teman yang telah membantu baik dalam segi waktu maupun motivasi apapun kami mengucapkan terima kasih.
Laporan resmi praktikum dasar tekinik kimia 1 ini berisi materi tentang argentometri-gravimetri. Argentometri-gravimetri merupakan salah satu bentuk titrasi berdasarkan reaksi antara zat titran dan zat yang akan dititrasi. Laporan resmi ini merupakan laporan resmi terbaik yang saat ini bisa kami ajukan, namun kami menyadari pasti ada kekurangan yang perlu kami perbaiki. Maka dari itu kritik dan saran yang sifatnya membangun sangat kami harapkan.
Semarang, 20 Desember 2013
Laboratorium Dasar Teknik Kimia I
iv
DAFTAR ISIHALAMAN PENGESAHAN ... i
PRAKATA ... iii
DAFTAR ISI ... iv
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... ix
INTISARI ... x
SUMMARY ... xi
ARGENTOMETRI BAB I PENDAHULUAN ... 1
I.1. Latar Belakang ... 1
I.2. Tujuan Percobaan ... 1
I.3. Manfaat Percobaan ... 1
BAB II TINJAUAN PUSTAKA ... 2
II.1. Analisis Argentometri ... 2
II.2. Metode Mohr... 2
a) Untuk mengendapkan ion Cl- ... 2
b) Untuk mengendapkan ion CrO42- ... 3
II.3. Metode Fajans ... 3
II.4. Fisis dan Chemist Reagen ... 5
II.5. Fungsi Reagen ... 7
Laboratorium Dasar Teknik Kimia I
v
III.1. Bahan ... 8
III.2. Alat ... 8
III.3. Gambar Alat... 8
III.4. Keterangan Alat ... 9
III.5. Cara Kerja ... 9
BAB IV HASIL PERCOBAAN DAN PEMBAHASAN ... 11
IV.1. Hasil Percobaan ... 11
IV.1.1. Standarisasi AgNO3 dengan NaCl 0,05 N ... 11
IV.1.2. Penetapan Kadar Cl- dengan Metode Mohr (sampel I) ... 11
IV.1.3. Penetapan Kadar Cl- dengan Metode Fajans (sampel II) ... 11
IV.2. Pembahasan ... 11
IV.2.1. Metode Mohr ... 11
IV.2.2. Metode Fajans ... 13
IV.2.3. Aplikasi Argentometri dalam Dunia Industri ... 13
a) Analisis Kandungan Klorida pada Limbah Cair ... 13
b) Analisis Kandungan Klorida dalam Air Minum Isi Ulang ... 14
c) Analisis Kandungan Klorida dalam Air Hasil Industri Sabun ... 14
BAB V PENUTUP ... 15 V.1. Simpulan ... 15 V.2. Saran ... 15 DAFTAR PUSTAKA ... 16 GRAVIMETRI INTISARI ... 17
Laboratorium Dasar Teknik Kimia I
vi
SUMMARY ... 18
BAB I PENDAHULUAN ... 19
I.1. Latar Belakang ... 19
I.2. Tujuan Percobaan ... 19
I.3. Manfaat Percobaan ... 19
BAB II TINJAUAN PUSTAKA ... 20
II.1 Landasan Teori yang Mendukung ... 20
II.2 Aplikasi Analisa Gravimetri ... 20
II.3 Keuntungan Gravimetri ... 20
II.4 Teori Kopresipitasi, Peptisasi, Post Presipitasi ... 21
II.5 Fisis dan chemist ... 22
BAB III METODE PERCOBAAN ... 23
III.1. Bahan ... 23
III.2. Alat ... 23
III.3 Gambar Alat... 23
III.4. Keterangan Alat ... 24
III.5. Cara Kerja ... 24
BAB IV HASIL PERCOBAAN DAN PEMBAHASAN ... 25
IV.1. Hasil Percobaan ... 25
IV.2. Pembahasan ... 25
IV.2.1. Mengapa Kadar Ba2+ yang ditemukan lebih kecil ... 25
Laboratorium Dasar Teknik Kimia I
vii
b) Pembakaran tidak sempurna ... 25
c) Pencucian tidak sempurna ... 25
d) Terjadinya peptisasi ... 26
IV.2.2. Kopresipitasi, peptisasi, dan post-presipitasi ... 26
a) Kopresiptasi... 26 b) Peptisasi ... 26 c) Pascapengendapan... 26 BAB V ... 28 V.1. Simpulan ... 28 V.2. Saran ... 28 DAFTAR PUSTAKA ... 29 LAMPIRAN A. Laporan Sementara B. Lembar Perhitungan
C. Lembar Perhitungan Grafik D. Referensi
Laboratorium Dasar Teknik Kimia I
viii
DAFTAR TABELARGENTOMETRI
Tabel 4.1. Hasil Percobaan sampel I dengan Metode Mohr ... 11 Tabel 4.2. Hasil Percobaan sampel II dengan Metode Fajans ... 11 GRAVIMETRI
Laboratorium Dasar Teknik Kimia I
ix
DAFTAR GAMBARARGENTOMETRI
Gambar 3.1. Alat-alat Praktikum Argentometri ... 8 Gambar 4.1. Grafik Hubungan Volume Titran dengan pCa pada Sampel I ... 12 Gambar 4.2. Grafik Hubungan Volume Titran dengan pCa pada Sampel II ... 13 GRAVIMETRI
Laboratorium Dasar Teknik Kimia I
x
INTISARIPengendapan adalah salah satu metode untuk menghitung kadar dalam sampel. Perhitungan memanfaatkan reaksi pengendapan dengan cara memisahkan suatu sampel menjadi komponen-komponennya. Proses tersebut melibatkan proses pemisahan zat untuk membentuk suatu endapan padat. Penerapannya telah digunakan secara meluas dalam kimia analisis, khususnya dalam metode argentometri dan gravimetri.
Dalam pemakaiannya, argento memiliki dua cara, yaitu Mohr dan Fajans. Metode mohr digunakan untuk menetapkan kadar ion halogen dalam suasana netral dengan indikator K2CrO4 , sedangkan metode Fajans menggunakan indikator Fluoroseins untuk mendeteksi titik akhir titrasi. Dalam pemakaiannya, argentometri digunakan untuk menentukan kadar Cl- , sedangkan gravimetri digunakan untuk menghitung kadar Ba2+. Perhitungan gravimetri dengan menimbang zat dengan kelarutan kecil, disaring, dan dibakar.
Percobaan pertama yang kami lakukan adalah standardisasi AgNO3 dengan NaCl 0,05N 10 ml. Tambahkan 0,4 ml K2CrO4, titrasi dengan AgNO3 sampai timmbul warna merah pertama. Lanjutkan dengan metode Mohr dengan memasukkan 10 ml sampel ke dalam erlenmeyer, tambahkan 0,4 ml K2CrO4, lalu titrasi sampai timbul warna merah pertama yang tidak hilang pada pengocokan. Metode Fajans dilakukan dengan mengambil 10 ml sampel, teteskan 10 tetes indikator fluorosein, atur ph 7-9, panaskan sampai 83o C, lalu titrasi dalam keadaan panas, sampai warna merah muda pertama yang tidak hilang pada pengocokan.
Hasil percobaan yang kami dapat, kadar Cl- yang kami temukan pada sampel I dengan metode Mohr adalah 522,98 ppm, lebih rendah daripada kadar asli yang sebesar 710 ppm dengan persen eror sebesar 22% dikarenakan ph terlalu asam ataupun basa. Kadar Cl- yang kami temukan pada sampel II dengan metode Fajans adalah 914,52 ppm, lebih besar dari kadar aslinya yaitu 887,5 ppm dengan persen eror sebesar 3% karena ion-ion FI- tidak dapat tertarik ke permukaan partikel-partikel bermuatan positif. Argentometri dapat digunakan dalam analisis klorida pada limbah cair, analisis kandungan klorida dalam air minum isi ulang, dan penetapan kadar klorida pada air hasil industri sabun.
Simpulan yang kami dapat, kadar Cl- yang kami temukan pada sampel I dengan metode Mohr adalah 522,98 ppm, lebih rendah daripada kadar asli yang sebesar 710 ppm dengan persen eror sebesar 22%. Kadar Cl- yang kami temukan pada sampel II dengan metode Fajans adalah 914,52 ppm, lebih besar dari kadar aslinya yaitu 887,5 ppm dengan persen eror sebesar 3. Sebagai saran, pertahankan ph sampel agar tetap 7-9, dan usahakan partikel-partikel AgCl tidak mengental menjadi partikel-partikel besar.
Laboratorium Dasar Teknik Kimia I
xi
SUMMARYDeposition is one of the methods to calculate the concentration in the sample. Calculations utilizing the precipitation reaction by separating a sample into its components. The process involves the separation of a substance to form a solid precipitate. Its application has been used extensively in analytical chemistry, especially in argentometry and gravimetric methods.
In use, argento has two ways, namely Mohr and Fajans. Mohr method used to establish levels of halogen ions in neutral with K2CrO4 indicator, while the Fajans method using Fluoroseins indicator to detect the end point of the titration. In use, argentometry used to determine the levels of Cl-, whereas gravimetric used to calculate the levels of Ba2+. The calculation of the gravimetric weighing substances with small solubility, filtered, and burned.
The first experiment we did was standardized 0.05 N AgNO3 with NaCl 10 ml. Add 0.4 ml K2CrO4, titration with AgNO3 until the first red timmbul. Continue with the Mohr method by inserting the sample into a 10 ml erlenmeyer, add 0.4 mL of K2CrO4, then titration until the first red appear not lost in the shuffle. Fajans method performed with 10 ml sample, drop 10 drops of indicator fluorosein, adjust pH 7-9, preheat to 83o C, then titration in hot conditions, until the first pink color that is not lost on the shuffle.
The results of our experiments, Cl- levels that we found in the first sample by Mohr method is 522.98 ppm, lower than the original level of 710 ppm with a percent error of 22% due to the alkaline pH is too acidic. Cl- levels that we found in the second sample with Fajans method was 914.52 ppm, larger than the original level is 887.5 ppm with a percent error of 2,85% for FI- ions can not be attracted to the surface of the particles positively charged. Argentometry can be used in the analysis of chloride in wastewater, analysis of the content of chloride in drinking water refill, and the determination of chloride levels in the water from the soap industry.
Conclusion that we got, Cl- levels that we found in the first sample with the Mohr method is 522.98 ppm, lower than the original level of 710 ppm with a percent error of 22%. Cl- levels that we found in the second sample with Fajans method was 914.52 ppm, larger than the original level is 887.5 ppm with an error of 2,85 percent. As a suggestion, keep the sample pH to keep it 7-9, and try not AgCl particles coagulate into larger particles.
Laboratorium Dasar Teknik Kimia I
1
BAB IPENDAHULUAN
I.1 Latar Belakang
Pengendapan merupakan metode yang sangat berharga dalam memisahkan suatu sampel menjadi komponen-komponennya. Proses yang dilibatkan adalah proses dimana zat yang akan dipisahkan digunakan untuk membentuk suatu endapan padat.
Reaksi pengendapan telah digunakan secara meluas dalam kimia analitis, khususnya dalam metode argentometri dan gravimetri. Argentometri merupakan analisa kuantitatif volumetrik dengan larutan standar AgNO3
berdasarkan pengendapan. Argentometri digunakan untuk menentukan kadar suatu unsur dalam titrasi yang melibatkan garam perak dengan indikator yang sesuai. Kegunaan analisa argentometri ini adalah menentukan kadar halogenida, misalnya Cl-, yang terkandung dalam sampel sehingga berguna untuk oseanografi, pangan, dan industri.
I.2 Tujuan Percobaan
A. Menganalisis kadar Cl- dengan metode Mohr B. Menganalisis kadar Cl- dengan metode Fajans
I.3 Manfaat Percobaan
A. Mahasiswa dapat menganalisis kadar Cl- dalam sampel murni dengan metode titrimetrik.
B. Mahasiswa dapat menerapkan metode argentometri untuk sampel praktis.
Laboratorium Dasar Teknik Kimia I
2
BAB IITINJAUAN PUSTAKA
II.1 Analisis Argentometri
Argentometri adalah analisa kuantitatif volumetri untuk menentukan kadar halogen dalam sampel dengan menggunakan larutan standar AgNO3.
Pada argentometri titik akhir titrasi ditentukan oleh terbentuknya larutan berwarna atau timbulnya kekeruhan yang pertama.
II.2 Metode Mohr
Digunakan untuk menetapkan kadar ion halogen yang dilakukan dalam suasana netral dengan indikator K2CrO4 dan larutan standar AgNO3.
Ion kromat akan bereaksi dengan ion perak membentuk endapan merah coklat dari perak kromat.
Reaksi: Ag+ + Cl- → AgCl(s) (endapan putih)
2Ag+ + CrO42- → Ag2CrO4(s) (endapan merah coklat)
Dasar titrasi dengan metode ini adalah suatu pengendapan bertingkat dari AgCl dan setelah semua mengendap baru terjadi endapan Ag2CrO4.
Untuk lebih jelasnya kita dapat melihat contoh berikut.
Misal dalam larutan NaCl 0,1 M terdapat adanya indikator K2CrO4
yang mempunyai konsentrasi 0,01 M, maka konsentrasi Ag+ untuk mengendapkan ion Cl- dan CrO42- dapat dihitung.
A. Untuk mengendapkan ion Cl-
Pada saat ini terjadi titik kesetaraan. Baik ion klorida maupun ion perak tak ada yang berlebih, dan masing-masing konsentrasi adalah kuadrat (dari) Ksp. Pada kurva titrasi titik ini disebut titik ekivalen (TE), yaitu titik pada kurva yang menunjukkan jumlah gram ekivalen titran sama dengan jumlah gram ekivalen zat yang dititrasi.
Ksp AgCl = 1,0 x 10-10 [Ag+] = [Cl-]
[Ag+]2 = 1,0 x 10-10 [Ag+] = 1,0 x 10-5
Laboratorium Dasar Teknik Kimia I
3
B. Untuk mengendapkan ion CrO42-Ksp Ag2CrO4 = 2 x 10-12
[Ag+]2 [CrO42-] = 2 x 10-12
[Ag+]2 [10-2] = 2 x 10-12 [Ag+]2 = 2 x 10-10 [Ag+] = 1,4 x 10-5
Dari contoh di atas dapat dilihat bahwa banyaknya ion perak yang dibutuhkan untuk mengendapkan ion kromat lebih besar dari yang dibutuhkan untuk mengendapkan ion klorida. Jadi pada saat TAT terjadi, ion klorida praktis telah mengendap semua, sehingga perak kromat baru mengendap setelah semua ion klorida mengendap membentuk perak klorida.
Hal-hal yang diperhatikan dalam penggunaan metode Mohr:
1 Baik untuk menentukan ion klorida dan bromida tetapi tidak cocok untuk ion iodida dan tiosianida.
2. Titrasi dalam suasana netral atau sedikit alkalis, pH 7 – 10,5.
3. Tidak cocok untuk titrasi larutan yang berwarna, seperti CuCl2
(biru), CaCl2 (perak), NiCl (hijau) karena akan menyulitkan pengamatan
saat TAT.
4. Tidak bisa untuk garam-garam Cl dan Br yang terhidrolisa, karena terbentuk endapan yang tak diharapkan. Misal garam Cl atau Br dengan kation Al, Fe, Bi, Sn, Sb, dan Mg.
5. Larutan tidak boleh mengandung CO3 2-, SO4 2-, PO43- , C2O42- karena akan mengendap dengan Mg.
6. Larutan tidak boleh mengandung ion Pb2+ dan Ba2+ karena akan mengendap sebagai garam kromat yang berwarna. Dihilangkan dengan penambahan Na2CO3 jenuh.
II.3 Metode Fajans
Dalam metode ini digunakan indikator adsorpsi. Bila suatu senyawa organik yang berwarna diadsorpsi pada permukaan suatu endapan, dapat terjadi modifikasi struktur organiknya, dan warna itu dapat sangat diubah dan dapat menjadi lebih tua. Gejala ini dapat digunakan untuk mendeteksi titik
Laboratorium Dasar Teknik Kimia I
4
akhir titrasi pengendapan garam perak.Mekanisme bekerjanya indikator semacam itu berbeda dari mekanisme apapun yang telah dibahas sejauh ini. Fajans menemukan fakta bahwa fluoresein dan beberapa fluoresein tersubstitusi dapat bertindak sebagai indikator untuk titrasi perak. Bila perak nitrat ditambahkan ke dalam suatu larutan natrium klorida, partikel perak klorida yang sangat halus itu cenderung memegangi pada permukaannya (mengadsorpsi) sejumlah ion klorida berlebihan yang ada dalam larutan itu. Ion-ion klorida ini dikatakan membentuk lapisan teradsorpsi primer dan dengan demikian menyebabkan partikel koloidal perak klorida itu bermuatan negatif. Partikel negatif ini kemudian cenderung menarik ion-ion positif dari dalam larutan untuk membentuk lapisan adsorpsi sekunder yang terikat lebih longgar.
(AgCl) . Cl- M+
Lapisan Primer Lapisan Sekunder Klorida Berlebih
Jika perak nitrat terus menerus ditambahkan sampai ion peraknya berlebih, ion-ion ini akan menggantikan ion klorida dalam lapisan primer. Maka partikel-partikel menjadi bermuatan positif, dan anion dalam larutan ditarik untuk membentuk lapisan sekunder.
(AgCl) . Ag+ X
-Lapisan Primer Lapisan Sekunder Perak Berlebih
Fluoresein merupakan asam organik lemah yang dapat dilambang -kan dengan HFI. Bila fluoresein ditambahkan ke dalam labu titrasi, anionnya, FI-, tidaklah diserap oleh perak klorida koloidal selama ion-ion klorida masih berlebih. Tetapi bila ion-ion perak berlebih, ion-ion FI- dapat ditarik ke permukaan partikel yang bermuatan positif, seperti
(AgCl) . Ag+ FI
-Agregat yang dihasilkan akan berwarna merah muda, dan warna itu cukup kuat untuk digunakan sebagai indikator visual.
Macam-macam indikator yang biasa digunakan antara lain: 1. Fluoresein untuk ion klorida, pH 7-8 / diklorofluoresein dengan pH 4 2. Eosin untuk ion bromida, iodida, dan tiosianida, pH 2
Laboratorium Dasar Teknik Kimia I
5
Hal-hal yang diperhatikan dalam penggunaan metode Fajans:1. Larutan jangan terlalu encer agar perubahan warna dapat diamati dengan jelas.
2. Ion indikator harus bermuatan berlawanan terhadap ion penitran.
3. Endapan yang terjadi sebaiknya berupa koloid sehingga luas permukaan penyerap besar. Boleh ditambahkan zat pencegah koagulasi seperti dextrin yang membuat endapan tetap terdispersi.
4. Indikator tidak boleh teradsorpsi sebelum ion utama mengendap sempurna (sebelum TE) tapi harus segera teradsorpsi setelah TE terjadi.
5. Indikator yang terserap oleh endapan ikatannya tidak boleh terlalu kuat karena ion indikator akan teradsorpsi oleh endapan sebelum TE tercapai. 6. Pemanasan hingga suhu ± 80ºC baru dititrasi sehingga menunjang hasil
pengamatan.
II.4 Fisis dan Chemist Reagen 1. NaCl
a. Fisis
BM= 58,45; BJ= 2,163 gr/cc; TD= 141,3ºC; TL= 800,4ºC Kristal, tidak berwarna, kubik
Kelarutan dalam 100 bagian air panas= 39,8 Kelarutan dalam 100 bagian air dingin= 25,7 b. Chemist
Dengan AgNO3 terbentuk endapan yang tidak larut dalam air. Reaksi:
AgNO3 + NaCl → NaNO3 + AgCl(s)
2. AgNO3
a. Fisis
BJ= 4,35 g/cc; BM= 168,8; n= 1,744; TL= 213ºC; TD= 244ºC Larutan tidak berwarna
Kelarutan dalam 100 bagian air panas= 95,2 Kelarutan dalam 100 bagian air dingin= 22,2 b. Chemist
Dengan H2SO4 bereaksi membentuk cincin coklat.
Laboratorium Dasar Teknik Kimia I
6
Dengan H2S dalam suasana asam / netral membentuk endapan Ag2SReaksi: 2AgNO3 + H2S → Ag2S + HNO3
Dengan Na2CO3 membentuk endapan Ag2CO3 putih kekuningan.
Reaksi: 2AgNO3 + Na2CO3 → Ag2CO3 + 2NaNO3
3. NH4CNS
a. Fisis
BM= 76,12; n= 1,685; TL= 147,6ºC; TD= 170ºC Larutan tak berwarna
Kelarutan dalam 100 bagian air panas= 170 Kelarutan dalam 100 bagian air dingin= 122 b. Chemist
Dengan CuSO4 bereaksi membentuk endapan Cu(CNS)2
Reaksi: 2CNS- + Cu2+ → Cu(CNS)2
Dengan Mg(NO3)2 membentuk endapan putih Mg(CNS)2 Reaksi: 2CNS- + Mg2+ → Mg(CNS)2
Dengan FeCl3 → berwarna merah darah
Reaksi: 3CNS- + Fe3+ → Fe(CNS)3 merah darah
4. HNO3
a. Fisis
BM= 63,02; n= 1,502; BJ= 1,42 g/cc Larutan tidak berwarna
b. Chemist
Merubah lakmus biru menjadi merah Ditambah basa menjadi garam dan air
Reaksi: HNO3 + NaOH → NaNO3 + H2O
Dengan garam nitrat larut 5. K2CrO4
a. Fisis
BM = 126; BJ = 2,732 gr/cc; TL = 97,5ºC Kelarutan dalam 100 bagian air panas= 75,6 Kelarutan dalam 100 bagian air dingin= 52 b. Chemist
Laboratorium Dasar Teknik Kimia I
7
Dengan BaCl2 bereaksi membentuk endapan kuning muda yangtidak larut dalam air tetapi larut dalam asam mineral encer. Reaksi: CrO42- + Ba2+ → BaCrO4(s)
Dengan AgNO3 membentuk endapan merah coklat yang larut
dalam asam nitrat.
Reaksi: CrO42- + 2Ag+ → Ag2CrO4(s)
Dengan Pb asetat membentuk endapan kuning yang tidak larut dalam asam asetat, tapi larut dalam HNO3.
Reaksi: Pb2+ + CrO42- → PbCrO4(s)
II.5 Fungsi Reagen
A. NaCl : untuk menstandarisasi larutan AgNO3
B. AgNO3 : untuk menstandarisasi larutan NH4CNS dan untuk
mengendapkan Cl
-C. NH4CNS : untuk menitrasi sampel pada percobaan metode Volhard
D. HNO3 : untuk memberikan suasana asam pada larutan
sehingga mencegah hidrolisa garam ferri menjadi ferri hidroksida yang warnanya mengganggu pengamatan TAT E. K2CrO4 : sebagai indikator
Laboratorium Dasar Teknik Kimia I
8
BAB III METODOLOGI PERCCOBAAN III.1 Bahan 1. Larutan NaCl 0,05 N 2. Larutan AgNO3 3. Larutan NH4CNS 4. Larutan HNO3 6 N5. Larutan Ferri amonium sulfat 6. Indikator K2CrO4 5%
7. Indikator Fluoresein 8. Dekstrin
III.2 Alat
1. Buret, Statif, dan Klem 6. Kertas Saring
2. Corong 7. Labu Takar
3. Erlenmeyer 8. Pipet Volume 4. Beaker Glass 9. Pipet Ukur 5. Gelas Ukur 10.Pipet Tetes
III.3 Gambar Alat
Laboratorium Dasar Teknik Kimia I
9
III.4 Keterangan Alat1. Buret, Statif,dan Klem : Rangkaian alat yang digunakan dalam proses titrasi.
2. Corong : Untuk memindahkan zat ke tempat sempit 3. Erlenmeyer : Tempat mereaksikan zat dengan titran 4. Beaker Glass : Tempat mencampurkan zat
5. Gelas Ukur : Tempat menentukan volume fluida 6. Kertas Saring : Kertas untuk menyaring endapan setelah 7. Labu Takar : Tempat untuk mengencerkan larutan 8. Pipet Volume : Untuk menggambil zat dengan suatu
volume
9. Pipet Ukur : Untuk mengukur volume larutan 10. Pipet Tetes : Untuk mengambil sedikit cairan
III.5 Cara Kerja
1. Standarisasi AgNO3 dengan NaCl 0,05 N
a. Ambil 10 ml larutan standar NaCl 0,05 N, masukkan dalam erlenmeyer. b. Tambahkan 0,4 ml K2CrO4
c. Titrasi dengan AgNO3 sampai timbul warna merah pertama yang tak
hilang pada pengocokan. Catat kebutuhan titran AgNO3.
Perhitungan : N AgNO3 =
V.N NaCl V.N Ag NO3
2. Menetapkan kadar Cl- dengan metode Mohr
a. Masukkan 10 ml larutan sampel ke dalam erlenmeyer b. Tambahkan 0,4 ml K2CrO4
c. Titrasi dengan AgNO3 sampai timbul warna merah pertama yang tak
hilang pada pengocokan. Catat kebutuhan titran AgNO3.
Perhitungan : Cl (ppm) = V.N Ag NO3 .BM Cl
−1000
v yang dititrasi fp
fp = faktor pengenceran
3. Menetapkan kadar Cl- dengan metode Fajans
a. Ambil 10 ml sampel dan masukkan dalam erlenmeyer.
Laboratorium Dasar Teknik Kimia I
10
sampai ±80ºC. (atau tambahkan dekstrin)c. Titrasi dengan AgNO3 sampai timbul warna merah muda pertama yang
tak hilang pada pengocokan. Catat kebutuhan titran. Perhitungan : Cl (ppm) = V.N Ag NO3 .BM Cl
−1000
v yang dititrasi fp
Laboratorium Dasar Teknik Kimia I
11
BAB IVHASIL PERCOBAAN DAN PEMBAHASAN
IV.1 Hasil Percobaan
IV.1.1 Standarisasi AgNO3 dengan NaCl 0,05N V AgNO3 = 5,4 ml N AgNO3 = V.N NaCl V AgNO 3 = 10 x 0,05 5,4 = 0,0926 N
IV.1.2 Penetapan Kadar Cl- dengan Metode Mohr (sampel I)
No. Praktikan V AgNO3 (ml) Cl- (ppm)
1. Sherly Zagita Listyani 1,6 491,54
2. Rizky Adhi Prabowo 1,8 552,98
3. Raden Nugroho Hutomo 2 614,42
Tabel 4.1 Tabel Hasil Percobaan sampel I Rata-rata kadar Cl- = 491,54+552,98+614,42
3 = 552,98 ppm
Kadar Cl- teoritis = 710 ppm Presentase eror = 710−552,98
710 x100% = 22%
IV.1.3 Penetapan Kadar Cl- dengan Metode Fajans (sampel II)
No. Praktikan V AgNO3 (ml) Cl- (ppm)
1. Sherly Zagita Listyani 2,9 882,43
2. Rizky Adhi Prabowo 3 912,86
3. Raden Nugroho Hutomo 3,1 948,28
Tabel 4.2 Tabel Hasil Percobaan sampel II Rata-rata kadar Cl-= 882,43+912,86+948,28 3 = 914,52 ppm Kadar Cl- teoritis = 887,5 ppm Presentase eror = 887,5−914,52 887,5 x100% = 2,85% IV.2 Pembahasan
Laboratorium Dasar Teknik Kimia I
12
Kadar Cl- yang ditemukan pada sampel I dengan metode Mohr adalah 552,98 ppm, lebih kecil dari kadar teoritis yaitu sebesar 710 ppm. Hal ini dikarenakan pH yang terlalu asam atau basa. Seharusnya, titrasi Mohr dilakukam pada ph 7-9. Karena kadar yang didapatkan lebih kecil/tidak sesuai, maka dapat dikatakan bahwa pada saat titrasi, sampel yanng diujidalam keadaan pH di luar 7-9. Bila pH berada di kisaran 7-9 seharusnya hasil yang didapat jauh lebih akurat.Jika pH terlalu kecil/asam, maka kesetimbangan kromat dikromat akan menurunkan kepekaan [CrO42-] sehingga menghambat pengendapan AgCrO4. Dalam
suasana asam akan terjadi reaksi : 2CrO42- + 2H+ Cr2O72- +H2O
Jika pH terlalu tinggi/basa, maka akan membentuk endapan Ag2O.
Dalam larutan basa akan terjadi reaksi : Ag+ + OH- 2AgOH Ag2O +H2O
Dalam larutan asam, jumlah[CrO42-] turun sehingga hanya HCrO4
-yang terionisasi karena reaksi akan berlangsung sebagai berikut : CrO42- + 2H+ 2HCrO4- Cr2O72- +H2O
Jika [CrO42-] terlalu rendah, akan memerlukan [Ag+] berlebih untuk
mengendapkan Ag2CrO4.
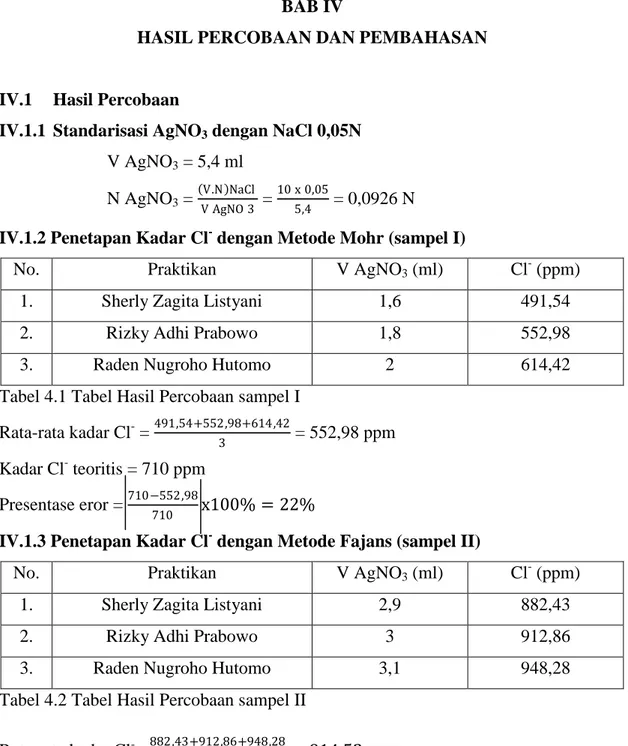
Gambar 4.1. Hubungan antara volume titran (AgNO3) dan pCa pada sampel I
0 1 2 3 4 5 6 0 0,5 1 1,5 2 2,5 p Cl Volume AgNO3 (ml)
Grafik
p Cl vs V AgNO
3 sampel I (Mohr) p Cl Kadar asli p Cl Kadar ditemukanLaboratorium Dasar Teknik Kimia I
13
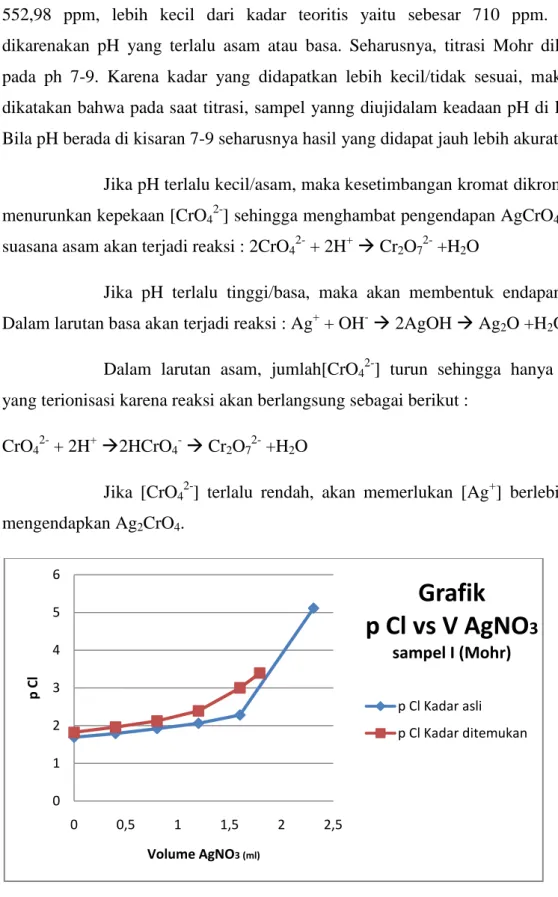
IV.2.2 Metode FajansKadar Cl- yang ditemukan pada sampel II dengan metode Fajans adalah sebesar 914,52 ppm, lebih besar dibanding kadar teoritisnya yang sebesar 887,5 ppm. Pada metode Fajans ini, partikel-partikel koloid dan AgCl bermuatan negatif akibat adanya ion Cl- dari larutan sebelum titik ekivalen. Partikel-partikel ini menarik ion postif dari larutan untuk membentuk lapisan sekunder yang lebih longgar keadaannya. Pada titik ekivalen, AgCl menngental menjadi partikel-partikel yang lebih besar dan hal ini akan mengurangi permukaan yang tersedia untuk adsorbsi dari indikator, di mana dalam kasus ini ion-ion FI- tidak dapat tertarik ke permukaan partikel-partikel bermuatan positif secara optimal. Hal ini lah yang menyebabkan kadar yang ditemukan lebih besar dibandingkan kadar teoritisnya.
Gambar 4.2. Grafik hubungan antara volume titran (AgNO3) dan pCa pada sampel II
IV.2.3 Aplikasi Argentometri dalam Dunia Industri
a) Analisis Kandungan Klorida pada Limbah Cair
Limbah cair adalah cairan yang tidak terpakai lagi dan merupakan hasil dari suatu produksi atau kegiatan manusia. Salah satu zat kimia yang terkandung di dalam air dan air limbah adalah klorida yang bersifat toksik terhadap lingkungan. Untuk itu perlu dilakukan analisis klorida menggunakan metode argentometri. Pada
0 0,5 1 1,5 2 2,5 3 3,5 4 4,5 5 0 1 2 3 4 p Cl Volume AgNO3 (ml)
Grafik
p Cl vs V AgNO
3 sampel II (Fajans) p Cl Kadar asli p Cl Kadar ditemukanLaboratorium Dasar Teknik Kimia I
14
metode argentometri digunakan metode titrasi yang menggunakan AgNO3 danindikator K2CrO4.
b) Analisis Kandungan Klorida dalam Air Minum Isi Ulang
Klorida dalam bentuk Cl- adalah anion anorganik yang banyak terdapat dalam air. Adanya klorida dalam air minum dapat menyebabkan adanya gangguan pada sifat fisis air, gangguan pipa logam, dan gangguan kesehatan. Kadar klorida dalam air minum isi ulang ditetapkan dengan metode argentometri Mohr yaitu dengan menggunakan larutan standar AgNO3 dan indikator K2CrO4. Titik akhir
titrasi ditandai dengan terbentuknya endapan warna merah bata Ag2CrO4. Hasil
pemeriksaan yang telah dilakukan di laboratorium analisis makanan dan minuman menunjukkan bahwa kandungan klorida yang ada dalam air minum isi ulang memenuhi persyaratan.
c) Analisis Kandungan Klorida dalam Air Hasil Industri Sabun
Air limbah hasil industri sabun memiliki kandungan klorida yang cukup tinggi sehingga diperlukan analisis kadar klorida. Natrium klorida dalam pembuatan sabun berfungsi untuk mengendapkan sabun dari campuran reaksi.
Laboratorium Dasar Teknik Kimia I
15
BAB VPENUTUP
V.1 Simpulan
1. Kadar Cl- yang ditemukan pada sampel I dengan metode Mohr adalah 552,98 ppm, lebih rendah dari kadar teoritisnya yang sebesar 710 ppm dengan persen eror 30% karena pH terlalu asam atau basa.
2. Kadar Cl- yang ditemukan pada sampel II dengan metode Fajans adalah 914,552 ppm, lebih besar dari kadar teoritisnya yang sebesar 887,5 ppm dengan persen eror 0,5% karena ion dari FI- tidak dapat tertarik ke permukaan partikel-partikel bermuatan positif.
3. Argentometri dapat digunakan dalam analisis klorida pada limbah cair, analisis kandungan klorida dalam air minum isi ulang, dan penetapan kadar klorida pada air hasil industri sabun.
V.2 Saran
1. Pertahankan pH sampel agar tetap 7-9.
2. Usahakan partikel-partikel AgCl tidak mengental menjadi partikel-partikel yang lebih besar.
Laboratorium Dasar Teknik Kimia I
16
DAFTAR PUSTAKAAgung, Titis Utami.2009. dikutip dari
http://repository.usu.ac.id/bitstream/123456789/13905/1/09502375.pdf diakses pada 14 November 2013 pukul 16.40
Anonim.2012. dikutip dari http://fly.cantabile.blogspot.com/2012/05/v-behaviour/defaultvmlo.05.html diakses pada 14 November 2013 pukul 11.20
Anonim.2013. dikutip dari http://www.slideshare.net/IMur/Argentometri diakses pada 14 November 2013 pukul 13.00
Perry,R.H. dan C.H.Dikson.1985.Chemical Engineering Handbook 6th ed.New York : MC Graw Hill Book Company.Inc
Susanti, Lina dan veronica Renny H.2012. dikutip dari
http://kimiateknologi.setiabudi.ac.id/index.php?option=com_content&view=article& id=127:analisis-kandungan-klorida-dalam-air-minum-isi-ulang-secara-argentometri-mohr-di-kelurahan-sewu&catid=75:nomor-02-juni-2010 diakses pada 14 November 2013 pukul 12.17
Underwood, A.I. and Day R.A..1983.Analisis Kimia Kuantitatif 5th ed. Diterjemahkan oleh R.Soendoro.Jakarta:Erlangga
Vogel A.I.Buku Teks Anorganik Kualitatif Makro dan Semimakro. Diterjemahkan oleh Ir. Sutiono dan Dr. A. Hadyono Pudjaatmaka.Jakarta : Penertbit PT Kalman Media Pustaka
Laboratorium Dasar Teknik Kimia I
17
INTISARIPengendapan merupakan metode yang amat berharga dalam memisahkan suatu sampel menjadi komponen-komponennya. Proses yang dilibatkan adalah proses dimana suatu zat yang akan dipisahkan digunakan untuk membentuk endapan padat. Gravimetri adalah analisis yang menggunakan reaksi pengendapan.
Analisis gravimetri adalah suatu metode pengukuran berat dengan memisahkan analit dari semua komponen lainnya sehingga dapat ditentukan kadar suatu zat dengan menggunakan faktor gravimetri. Suatu analisis gravimetri biasanya berdasarkan reaksi : aA + bB AaBb dengan ketentuan a molekul A bereaksi dengan b molekul B. Persyaratan yang harus dipenuhi dalam metode gravimetri adalah pemisahan harus sempurna dan zat yang ditimbang harus murni.
Alat yang digunakan pada percobaan adalah kertas saring whatman, beaker glass, corong, gelas ukur, dan pipet tetes. Cara yang harus dilakukan adalah menimbang kertas saring whatman dan menggunakannya untuk menyaring sampel. Lakukan pencucian pada kertas saring whatman dengan H2SO4 encer setiap kali selesai menyaring. Tahap terakhir adalah mengeringkan kertas saring whatman lalu ditimbang. Selisih berat kertas saring awal dengan berat setelah dilakukan penyaringan adalah massa analit.
Dari percobaan ditemukan bahwa berat analit adalah 0,09 gram. Konsentrasi analit yang ditemukan adalah 4208 ppm, sedangkan konsentrasi teoritisnya adalah sebesar 10000 ppm. Persen eror pada percobaan ini mencapai 57,92%. Penyebab kadar yang ditemukan lebih kecil adalah karena sulfat yang mudah tereduksi oleh karbon, pembakaran kurang sempurna, pencucian kurang sempurna, dan terjadinya peptisasi.
. Berdasarkan hasil percobaan, dapat kami simpulkan bahwa kadar kadar Ba2+ yang ditemukan lebih kecil dari seharusnya. Penyebabnya adalah karena asam sulfat yang mudah tereduksi oleh karbon, terjadinya peptisasi, dan pencucian yang kurang sempurna. Sebagai saran, jangan terlalu banyak menambah H2SO4 0,1N pada sampel karena sedikit saja sudah membentuk endapan. Lakukan penyaringan sebanyak mungkin agar larutan yang disaring benar-benar murni, dan lakukan pengeringan kertas saring dengan sempurna agar tidak terlalu panas sehingga kertas saring hangus.
Laboratorium Dasar Teknik Kimia I
18
SUMMARYDeposition is a very valuable method of separating a sample into its components. The involved process is the process whereby a substance to be separated is used to form a solid precipitate. Gravimetric is an analysis which using precipitation reactions.
Gravimetric analysis is a method of weight measurement by separating the analyte from all other components so that the levels of a substance can be determined by using gravimetric factors. A gravimetric analysis is usually based on the reaction: aA + bB AaBb with the provisions of a molecule A reacts with b molecule B. Requirements that must be met in the gravimetric method is the separation must be perfect and pure substances should be weighed.
The tools used in the experiment is whatman filter paper, glass beaker, funnel, measuring cup, and a Pasteur pipette. How to do is weigh the whatman filter paper and use it to filter the sample. Perform washing the filter paper whatman with dilute H2SO4 after each filter. The last stage is to dry Whatman filter paper and weighed. Difference in weight of the filter paper with the weight after the initial screening is the mass of analyte.
From the experiments it was found that the weight of the analyte is 0.09 grams. Analyte concentration found was 4208 ppm, while the concentration of 10000 ppm is theoretical. Percent error in this experiment reached 57.92%. The cause of the levels found are smaller due to the easy sulfate reduced by carbon, imperfect combustion, leaching less than perfect, and the peptizing.
Based on the experimental results, we can conclude that the Ba2+ concentration levels were found to be smaller than it should be. The reason is because sulfuric acid is easily reduced by carbon, the peptizing, and leaching is less than perfect. As a suggestion, do not add too much H2SO4 0.1 N in the sample, because little has been formed precipitate. Perform filtering as much as possible so that the solution is filtered completely pure, and do a perfect drying with filter paper that is not too hot so that the filter paper hangus.Penyebab found lower levels is due to the easy sulfate reduced by carbon, burning less than perfect, less leaching perfect, and the peptizing.
Laboratorium Dasar Teknik Kimia I
19
BAB IPENDAHULUAN
I.1 Latar Belakang
Pengendapan merupakan metode yang sangat berharga dalam memisahkan suatu sampel menjadi komponen-komponennya. Proses yang dilibatkan adalah proses dimana zat yang akan dipisahkan digunakan untuk membentuk suatu endapan padat.
Reaksi pengendapan telah digunakan secara meluas dalam kimia analitis, khususnya dalam metode argentometri dan gravimetri. Gravimetri juga merupakan bagian dari analisa kuantitatif yang berhubungan dengan pengukuran berat dengan memisahkan analis dari semua komponen lainnya sehingga dapat ditentukan kadar suatu zat. Di samping zat-zat anorganik, senyawa organik juga telah dianalisis dengan teknik gravimetri, sebagai contohnya penetapan kadar kolesterol dalam sereal dan laktosa dalam produk susu.
I.2 Tujuan Percobaan
Menentukan kadar Ba2+ dalam sampel.
I.3 Manfaat Percobaan
Dapat mengetahui kadar Ba2+ dalam suatu sampel dengan prosedur gravimetri.
Laboratorium Dasar Teknik Kimia I
20
BAB IITINJAUAN PUSTAKA
II.1 Landasan Teori yang Mendukung
Analisa gravimetri adalah suatu metode pengukuran berat dengan memisahkan analit dari semua komponen lainnya sehingga dapat ditentukan kadar suatu zat dengan menggunakan faktor gravimetri. Suatu analisa gravimetri biasanya berdasarkan reaksi:
aA + bB → AaBb
Dengan ketentuan a adalah analit A bereaksi dengan b molekul B. Hasil AaBb biasanya merupakan zat dengan kelarutan kecil sehingga dapat ditimbang dalam bentuk itu setelah dikeringkan atau dibakar menjadi senyawa lain yang susunannya diketahui dan kemudian ditimbang. Suatu pereaksi B ekses biasanya ditambahkan untuk menekan kelarutan endapan, contohnya pada penentuan Ca2+.
Ca2++C2O42-→CaC2O4
CaC2O4 → CaO + CO2 + CO
Persyaratan yang harus dipenuhi dalam metode gravimetri adalah: 1) Pada pemisahan harus cukup sempurna sehingga kuantitas analit yang tidak
mengendap secara analit tidak ditentukan.
2) Zat yang ditimbang harus punya susunan tertentu dan harus murni. Jika tidak hasil tidak dapat diperoleh.
II.2 Aplikasi Analisa Gravimetri
Gravimetri dapat dilakukan terhadap zat-zat organik seperti penentuan kolesterol pada padi-padian. Selain itu analisa unsur dan senyawa organik biasanya juga dilakukan dengan cara ini. Misalnya C dalam senyawa organik dapat ditentukan dengan membakar sampel dalam oksigen dan menyerap CO2 dan H2O yang dihasilkan pada absorpsi yang cocok. Tabung
absorbsi ditimbang sebelum dan sesudah pembakaran untuk memperoleh CO2
dan H2O yang dihasilkan.
Laboratorium Dasar Teknik Kimia I
21
Walaupun gravimetri telah digantikan dari segi rutinnya dengan instrumental, namun gravimetri sebenarnya lebih cepat dan teliti daripada instrumen yang perlu dikalibrasi. Alat pada umumnya memberikan hanya pengukuran relatif dan harus dikalibrasi atas dasar cara gravimetri atau titimetri klasik. Jika analit merupakan suatu konstata pertama (> 1%) ketelitian dari berbagai bagian perseribu dapat diharapkan, jika contoh tak terlalu kompleks. Jika analit minoritas kurang dari 1%, cara gravimetri biasanya tidak digunakan.II.4 Teori Kopresipitasi, Peptisasi, Post Presipitasi
Kopresipitasi adalah proses membawa serta turun suatu zat yang biasanya terlarut sewaktu pengendapan dari endapan yang dikehendaki. Misalkan ion nitrat pada pengendapan barium sulfat menyebabkan endapan mengandung barium nitrat sehingga dikatakan nitratnya mengalami kopresipitasi dengan sulfat atau akibat adsorpsi ion ketika proses pengendapan. Pada kejadian ini zat penyebab ketidakmurnian masuk ke dalam sisi kristal dan ion-ion yang terserap terseret ke bawah pada waktu koagulasi.
Prosedur yang digunakan untuk mengurangi kopresipitasi:
1. Cara penentuan 2 pereaksi ini dapat digunakan untuk mengendalikan konsentrasi zat pengatur dan muatan listrik yang dibawa oleh partikel primer endapan dalam dikendalikan dengan menggunakan pH yang sesuai.
2. Pemuaian dengan gumpalan dan gelatin harus dengan larutan elektrolit dalam larutan pencuci untuk menghindari presipitasi.
3. Pencemaran ini merupakan manfaat besar endapan kristalin, manfaat yang cukup besar bagi endapan bergumpal tetap tidak digunakan untuk gelatin.
4. Pengendapan ulang apabila endapan dengan mudah dapat dilarutkan kembali terutama untuk oksidasi hidrolisi dan garam kristalin asam lemak.
Laboratorium Dasar Teknik Kimia I
22
5. Pemisahan zat pengotor dapat dipisahkan/ sifat kimianya diubahdengan suatu pencuci sebelum endapan terbentuk.
Penggunaan persyaratan yang menuju ke partikel lebih besar, yaitu jika pengendapan cukup perlahan.
II.5 Fisis dan chemist H2SO4
Fisis :
− Berat molekul = 98,08 gr/mol − Berat jenis = 1,83 gr/cc − Titik didih = 3400°C − Titik leleh = 10,440°C
− Kelarutan dalam 100 bagian air dingin = 80 − Kelarutan dalam 100 bagian air panas = 59 Chemist :
− Merupakan asam kuat
− Jika ditambah basa membentuk garam dan air
−
Dengan Pb2+ membentuk PbSO42- Pb2+ + SO4 → PbSO4
− Dengan Ba2+
membentuk BaSO42- Ba2+ + SO4 → BaSO4
Laboratorium Dasar Teknik Kimia I
23
BAB III METODOLOGI PERCOBAAN III.1 Bahan : 1. H2SO4 0,1 N 2. H2SO4 sangat encer 3. Aquadest III.2 Alat :1. Kertas saring Whatman 2. Pengaduk
3. Corong 4. Beaker glass 5. Gelas ukur 6. Pipet tetes
III.3 Gambar Alat :
Laboratorium Dasar Teknik Kimia I
24
III.4 Keterangan Alat :1. Kertas saring Whatman : Menyaring endapan BaSo4
2. Pengaduk : Mempermudah terjadinya reaksi 3. Corong : Memindahkan fluida ke tempat lain 4. Beaker glass : Tempat mencampurkan dan mereaksikan 5. Gelas ukur : Menentukan volume fluida
6. Pipet tetes : Mengambil fluida sedikit demi sedikit
III.5 Cara Kerja :
1. Menimbang kertas saring Whatman
2. Ambil 10 ml sampel yang mengandung Ba2+ (volume sampel yang diambil untuk diendapkan tergantung konsentrasi sampel).
3. Tambahkan H2SO4 0,1 N dan diaduk.
4. Endapan BaSO4 putih yang terbentuk disaring dengan kertas saring
Whatman yang diletakkan dalam corong. Tampung filtrat dalam beaker glass.
5. Cuci endapan dengan H2SO4 sangat encer dan air cucian dijadikan satu
dengan filtrat untuk kemudian ditambahkan H2SO4 0,1 N lagi
6. Ulangi seperti langkah 4 dan 5 sampai penambahan H2SO4 tidak
menimbulkan endapan lagi.
7. Keringkan endapan dalam oven 100-110ºC tapi jangan sampai kertas saring hangus.
8. Ditimbang berat kertas saring bersama endapan yang telah kering. Perhitungan : Ba2+ (ppm) = W 2 − W 1 .BMBa .1000 .1000
Laboratorium Dasar Teknik Kimia I
25
BAB IVHASIL PERCOBAAN DAN PEMBAHASAN
IV.1 Hasil Percobaan
Pengamatan Percobaan
Massa kertas saring whatman
Awal 0,98 gram Akhir 1,07 gram
Massa BaSO4 Asli -
Percobaan 0,09 gram Kadar Ba2+ (ppm) Asli 10000
Percobaan 4208 Tabel 4.1. Hasil Percobaan Analisis Gravimetri Presentase eror = 10.000−4.208
10.000 𝑥 100% = 57,92%
IV.2 Pembahasan
IV.2.1 Mengapa kadar Ba2+ yang ditemukan lebiih kecil a. Sulfat yang mudah tereduksi oleh karbon
Dalam penentuan kadar Ba2+ dengan metode gravimetri, barium sulfat yang telah disaring dengan kertas saring whatman dan ditetesi serta dicuci menggunakan larutan asam sulfat dimasukkan ke dalam oven untuk dikeringkan pada suhu 100-110o C. Dalam pengeringan tesebut, terjadi reaksi antara sulfat dan karbon yang berasal dari kertas saring tersebut.
BaSO4 + 4C BaS + 4CO
Karena sulfat mudah tereduksi oleh karbon, sehingga hasil endapan yang dihasilkan pun rendah dan biasanya kecermatan menjadi berkurang. Hal inilah yang menyebabkan kadar yang ditemukan lebih rendah dari kadar aslinya.
b. Pembakaran tidak sempurna
Pada proses pembakaran atau pemijaran kadang terjadi pelepasan air yang ridak sempurna atau sifat zat yang diendapkan mudah menguap (volatil). Zat volatil tersebut adalah H2O dan CO2. Jadi ketika pembakaran, terjadi
penguapan endapan sehingga kadar yang didapat lebih rendah. c. Pencucian tidak sempurna
Laboratorium Dasar Teknik Kimia I
26
Pada proses pemurnian (pencucian endapan), dengan pencucian bukan hanya zat pengotor saja yang larut tetapi zat yang dianalisis juga ikut terlarut, mesikupun kelarutannya jauh lebih kecil. Dengan demikian, penggunaan pencuci harus sedemikian kecil sehingga kehilangan zat yang dianalisis masih dapat diabaikan, artinya masih lebih kecil daripada sensitivitas timbangan. d. Terjadinya peptisasiKoagulasi dispersi-dispersi koloid bisa dilakukan oleh ion-ion dari endapan itu sendiri. Ketika terjadi koagulasi suatu koloid, ion-ion yang berkoagulasi tersebut bisa diseret ke bawah ion-ion tersebut. Ion-ion yang berkoagulasi tersebut larut ketika endapan dicuci sehingga partikel-partikel akan kembali masuk ke dispersi koloid dan menembus filter. Hal ini menyebabkan Ba2+ yang ditemukan menjadi lebih kecil.
IV.2.2 Kopresipitasi, peptisasi, dan post-presipitasi a. Kopresipitasi
Zat-zat yang normalnya mudah larut dapat diturunkan selama pengendapan zat yang diinginkan dengan suatu proses adalah kopresipitasi. Misalnya, bila asam sulfat ditambahkan ke larutan barium klorida yang mengandung sejumlah kecil ion nitrat, endapan barium sulfat yang diperoleh mengandung barium nitrat, maka dikatakan bahwa nitrat tersebut terkopresipitasi dengan sulfat.
b. Peptisasi
Koagulasi dispersi-dispersi koloid bisa dilakukan oleh ion-ion selain ion dari endapan itu sendiri. Ketika terjadi koagulasi suatu koloid, ion-ion yang berkoagulasi bisa diseret ke bawah oleh endapan tersebut. Jika ion-ion ini larut ketika endapan dicuci, partikel-partikel tersebut akan kembali masuk ke dispersi koloid dan menembus filter. Proses dispersi material tak larut ke dalam suatu cairan seperti koloid ini disebut peptisasi dan harus dihindari dalam prosedur-prosedur kuantitatif
c. Pascapengendapan
Proses dengan mana suatu pengotoran diendapkan setelah pengendapan zat yang diinginkan disebut pascapengendapan (post-precipitation). Proses ini berbeda dari kopresipitasi pada hakikatnya dalam fakta bahwa banyaknya
Laboratorium Dasar Teknik Kimia I
27
pengotoran meningkat dengan makin lamanya endapan yang diinginkan dibiarkan bersentuhan dengan larutan induk. Bila ada kemungkinan terjadi pascapengendapan, disarankan untuk menyaring setelah endapan yang diinginkan tersebut terbentuk.Laboratorium Dasar Teknik Kimia I
28
BAB VPENUTUP
V.1 Simpulan
1. Kadar Ba2+ yang ditemukan dalam sampel sebesar 4.208 ppm. Kadar asli sampel adalah 10.00 ppm sehingga presentase eror percobaan sebesar 57,92% 2. Penyebab kadar yang ditemukan lebih kecil adalah karena sulfat yang mudah tereduksi oleh karbon, pembakaran kurang sempurna, pencucian kurang sempurna, dan terjadinya peptisasi.
3. Kopresipitasi adalah zat yang normalnya mudah larut dapat ditturunkan selama pengendapan zat yang diinginkan dengan suatu proses.
4. Peptisasi adalah proses dispersi material tak larut ke dalam suatu cairan seperti koloid.
5. Pascapengendapan adalah proses di mana suatu pengotoran diendapkan setelah pengendapan zat yang diinginkan.
V.2 Saran
1. Jangan terlalu banyak menambahkan H2SO4 0,1 N pada sampel karena sedikit
saja sudah bisa membentuk endapan.
2. Lakukan penyaringan sebanyak mungkin agar endapan yang didapat benar-benar murni.
3. Lakukan pengeringan kertas saring menggunakan oven dengan sempurna, sering dicek agar tidak terlewat sehingga keras saring hangus.
Laboratorium Dasar Teknik Kimia I
29
DAFTAR PUSTAKAAnonim.2011. dikutip dari
aprilawiguna27.files.wordpress.com/2011/02/gravimetri2.pdf diakses pada 14 November pukul 17.05
Perry,R.H. dan C.H.Dikson.1985.Chemical Engineering Handbook 6th ed.New York : MC Graw Hill Book Company.Inc
Puteri, Fransiska.2011. dikutip dari http://www.slideshare.net/fransiskaputeri/acara-iv-gravimetri diakses pada 22 November 2013 pukul 10.15
Underwood, A.I. and Day R.A..1983.Analisis Kimia Kuantitatif 5th ed. Diterjemahkan oleh R.Soendoro.Jakarta:Erlangga
Vogel A.I.Buku Teks Anorganik Kualitatif Makro dan Semimakro. Diterjemahkan oleh Ir. Sutiono dan Dr. A. Hadyono Pudjaatmaka.Jakarta : Penertbit PT Kalman Media Pustaka
Laboratorium Dasar Teknik Kimia I
A
- 1
LAPORAN SEMENTARAPRAKTIKUM DASAR TEKNIK KIMIA I
Materi :
ARGENTOMETRI-GRAVIMETRI
Oleh :
Kelompok : IV / Selasa Siang
Anggota : Sherly Zagita L.N. NIM : 21030113120023 Rizky Adhi P. NIM : 21030113130113 Raden Nugroho H.S. NIM : 21039113130134
LABORATORIUM DASAR TEKNIK KIMIA I TEKNIK KIMIA FAKULTAS TEKNIK
UNIVERSITAS DIPONEGORO SEMARANG
Laboratorium Dasar Teknik Kimia I
A
- 2
I. TUJUAN PERCOBAAN
A. Menganalisis kadar Cl- dengan metode Mohr B. Menganalisis kadar Cl- dengan metode Fajans
II. PERCOBAAN
a) Bahan Yang Digunakan
Larutan AgNO3
Larutan NaCl 0,05 N
Larutan HNO3 6 N
Larutan ferri amonium sulfat
Indikator K2CrO4 5%
Indikator fluoroseins
H2SO4 0,1 N
H2SO4 encer
Akuades b) Alat Yang Dipakai
Buret, statif, klem
Corong
Erlenmeyer
Beaker glass
Gelas ukur
Kertas saring
Kertas saring whatman
Labu takar
Pipet volume
Pipet tetes
Pengaduk c) Cara Kerja
i) Standarisasi AgNO3 dengan NaCl 0,05 N
(1) Ambil 10 ml larutan standar AgNO3 dan masukkan ke dalam
erlenmeyer.
Laboratorium Dasar Teknik Kimia I
A
- 3
(3) Titrasi dengan AgNO3 sampai timbul warna merah pertama yang takhilang pada pengocokan. Catat kebutuhan titran AgNO3.
Perhitungan : N AgNO3 =
V.N NaCl V.N Ag NO3 ii) Menetapkan kadar Cl- dengan metode Mohr
(1) Masukkan 10 ml larutan sampel ke dalam erlenmeyer (2) Tambahkan 0,4 ml K2CrO4
(3) Titrasi dengan AgNO3 sampai timbul warna merah pertama yang tak
hilang pada pengocokan. Catat kebutuhan titran AgNO3.
Perhitungan : Cl (ppm) = V.N Ag NO3 .BM Cl
−1000
v yang dititrasi fp
fp = faktor pengenceran
iii) Menetapkan kadar Cl- dengan metode Fajans
(1) Ambil 10 ml sampel dan masukkan dalam erlenmeyer.
(2) Tambahkan 10 tetes indikator fluoresein, atur pH 7-8, panaskan sampai ±80ºC. (atau tambahkan dekstrin)
(3) Titrasi dengan AgNO3 sampai timbul warna merah muda pertama
yang tak hilang pada pengocokan. Catat kebutuhan titran. Perhitungan : Cl (ppm) = V.N Ag NO3 .BM Cl
−1000
v yang dititrasi fp
fp = faktor pengenceran iv) Menentukan kadar CaO
(1) Menimbang kertas saring Whatman
(2) Ambil 10 ml sampel yang mengandung Ba2+ (volume sampel yang diambil untuk diendapkan tergantung konsentrasi sampel).
(3) Tambahkan H2SO4 0,1 N dan diaduk.
(4) Endapan BaSO4 putih yang terbentuk disaring dengan kertas saring
Whatman yang diletakkan dalam corong. Tampung filtrat dalam beaker glass.
(5) Cuci endapan dengan H2SO4 sangat encer dan air cucian dijadikan
satu dengan filtrat untuk kemudian ditambahkan H2SO4 0,1 N lagi
(6) Ulangi seperti langkah 4 dan 5 sampai penambahan H2SO4 tidak
Laboratorium Dasar Teknik Kimia I
A
- 4
(7) Keringkan endapan dalam oven 100-110ºC tapi jangan sampai kertassaring hangus.
(8) Ditimbang berat kertas saring bersama endapan yang telah kering. Perhitungan : Ba2+ (ppm) = W 2 − W 1 .BMBa .1000 .1000
BM BaSO 4 .V yang diambil
d) Hasil Peercobaan
i) Standarisasi AgNO3 dengan NaCl 0,05 N Volume AgNO3 dibutuhkan = 5,4 ml
N AgNO3 =
V.N NaCl V.N Ag NO3 =
10 x 0,05
5,4 = 0,0926 N
ii) Menetapkan kadar Cl- dengan metode Mohr Volume titran = 1,8 ml Cl (ppm) = V.N Ag NO3 .BM Cl −1000 v yang dititrasi fp = 1,8 x 0,09 x 35,5 x 1000 10 1 = 552,98 ppm Kadar teoritis = 710 ppm Presentase eror =710−552,98 710 x 100% = 22,11%
iii) Menetapkan kadar Cl- dengan metode Fajans Volume titran = 3 ml Cl (ppm) = V.N Ag NO3 .BM Cl −1000 v yang dititrasi fp = 3 x 0,09 x 35,5 x 1000 10 1 = 912,86 ppm Kadar teoritis = 887,5 ppm Presentase eror = 912,86−887,5 887,5 x 100% = 2,85%
iv) Menentukan kadar CaO W1 = 0,98 gram
W2 = 1,07 gram
Ba2+ (ppm) = W 2 − W 1 .BMBa .1000 .1000
BM BaSO 4 .V yang diambil =
1,07 −0,98 .137.1000 .1000
233 .10 = 4208 ppm
Kadar teoritis = 10000 ppm Presentase eror = 10000 −4208
10000 x 100% = 57,92%
PRAKTIKAN MENGETAHUI ASISTEN
Laboratorium Dasar Teknik Kimia I
B
- 1
LEMBAR PERHITUNGANi) Standarisasi AgNO3 dengan NaCl 0,05 N Volume AgNO3 dibutuhkan = 5,4 ml
N AgNO3 =
V.N NaCl V.N Ag NO3 =
10 x 0,05
5,4 = 0,0926 N
ii) Menetapkan kadar Cl- dengan metode Mohr Volume titran = 1,8 ml Cl (ppm) = V.N Ag NO3 .BM Cl −1000 v yang dititrasi fp = 1,8 x 0,09 x 35,5 x 1000 10 1 = 552,98 ppm Kadar teoritis = 710 ppm Presentase eror =710−552,98 710 x 100% = 22,11%
iii) Menetapkan kadar Cl- dengan metode Fajans Volume titran = 3 ml Cl (ppm) = V.N Ag NO3 .BM Cl −1000 v yang dititrasi fp = 3 x 0,09 x 35,5 x 1000 10 1 = 912,86 ppm Kadar teoritis = 887,5 ppm Presentase eror = 912,86−887,5 887,5 x 100% = 2,85%
iv) Menentukan kadar CaO W1 = 0,98 gram
W2 = 1,07 gram
Ba2+ (ppm) = W 2 − W 1 .BMBa .1000 .1000
BM BaSO 4 .V yang diambil =
1,07 −0,98 .137.1000 .1000
233 .10 = 4208 ppm
Kadar teoritis = 10000 ppm Presentase eror = 10000 −4208
Laboratorium Dasar Teknik Kimia I
C
- 1
LEMBAR PERHITUNGAN GRAFIK Kadar asli sampel I metode Mohr [Cl -]=710 ppm 710 10000 x 35,5= 0,02 N NAgNO3= 10.0,05 5,4 = 0,09 N V AgNO3 Cl- = V.N Ag NO3 .BM Cl −1000 v yang dititrasi fp 710 = V.0,09 35,5.1000 10 1 V = 2,31 ml 1. Penambahan 0 ml AgNO3 Cl- = 10,4x0,02 −(0x0,09) 10,4 =0,02 pCl = 1,69 2. Penambahan 0,4 ml AgNO3 Cl- = 10,4x0,02 −(0,4x0,09) 10,4+0.4 =0,0159 pCl = 1,79 3. Penambahan 0,8 ml AgNO3 Cl- = 10,4x0,02 −(0,8x0,09) 10,4+0,8 =0,0123 pCl = 1,92 4. Penambahan 1,2 ml AgNO3 Cl- = 10,4x0,02 −(1,2x0,09) 10,4+1,2 =0,0086 pCl = 2,06 5. Penambahan 1,6 ml AgNO3 Cl- = 10,4x0,02 −(1,6x0,09) 10,4+1,6 =0,0053 pCl = 2,28 6. Penambahan 2,31 ml AgNO3 Cl- = 10,4x0,02 −(2,31x0,09) 10,4+2,31 = 0,0000078 pCl = 5,11
Kadar yang ditemukan pada percobaan sampel I metode Mohr [Cl -]=552,98 ppm 552,98 10000 x 35,5= 0,015 N NAgNO3= 10.0,05 5,4 = 0,09 N V AgNO3 = 1,8 ml
Laboratorium Dasar Teknik Kimia I
C
- 2
1. Penambahan 0 ml AgNO3 Cl- = 10,4x0,015 −(0x0,09) 10,4 =0,015 pCl = 1,82 2. Penambahan 0,4 ml AgNO3 Cl- = 10,4x0,015 −(0,4x0,09) 10,4+0,4 =0,011 pCl = 1,96 3. Penambahan 0,8 ml AgNO3 Cl- = 10,4x0,015 −(0,8x0,09) 10,4+0,8 =0,0075 pCl = 2,12 4. Penambahan 1,2 ml AgNO3 Cl- = 10,4x0,015 −(1,2x0,09) 10,4+1,2 =0,004 pCl = 2,39 5. Penambahan 1,6 ml AgNO3 Cl- = 10,4x0,015 −(1,6x0,09) 10,4+1,6 =0,001 pCl = 3 6. Penambahan 1,8 ml AgNO3 Cl- = 10,4x0,015 −(1,8x0,09) 10,4+1,8 =0,0004 pCl = 3,39 Kadar asli sampel II metode Fajans [Cl -]= 887,5 ppm 887,5 10000 x 35,5= 0,025 N NAgNO3= 10.0,05 5,4 = 0,09 N V AgNO3 = 2,91 ml 1. Penambahan 0 ml AgNO3 Cl- = 10,4x0,025 −(0x0,09) 10,4 =0,025 pCl = 1,60 2. Penambahan 0,4 ml AgNO3 Cl- = 10,4x0,025 −(0,4x0,09) 10,4+0,4 =0,021 pCl = 1,68 3. Penambahan 0,8 ml AgNO3 Cl- = 10,4x0,025 −(0,8x0,09) 10,4+0,8 =0,0117 pCl = 1,77 4. Penambahan 1,2 ml AgNO3 Cl- = 10,4x0,025 −(1,2x0,09) 10,4+1,2 =0,013 pCl = 1,87 5. Penambahan 1,6 ml AgNO3
Laboratorium Dasar Teknik Kimia I
C
- 3
Cl- = 10,4x0,025 −(1,60x0,09) 10,4+1,6 =0,009 pCl = 2,05 6. Penambahan 2 ml AgNO3 Cl- = 10,4x0,025 −(2x0,09) 10,4+2 =0,006 pCl = 2,22 7. Penambahan 2,91 ml AgNO3 Cl- = 10,4x0,025 −(2,91x0,09) 10,4+2,91 =0,000045 pCl = 4,35 Kadar yang ditemukan pada percobaan sampel II metode Fajans [Cl -]= 914,52 ppm 914,52 10000 x 35,5= 0,025 N NAgNO3= 10.0,05 5,4 = 0,09 N V AgNO3 = 2,91 ml 1. Penambahan 0 ml AgNO3 Cl- = 10,4x0,025 −(0x0,09) 10,4 =0,025 pCl = 1,60 2. Penambahan 0,4 ml AgNO3 Cl- = 10,4x0,025 −(0,4x0,09) 10,4+0,4 =0,021 pCl = 1,68 3. Penambahan 0,8 ml AgNO3 Cl- = 10,4x0,025 −(0,8x0,09) 10,4+0,8 =0,0117 pCl = 1,77 4. Penambahan 1,2 ml AgNO3 Cl- = 10,4x0,025 −(1,2x0,09) 10,4+1,2 =0,013 pCl = 1,87 5. Penambahan 1,6 ml AgNO3 Cl- = 10,4x0,025 −(1,60x0,09) 10,4+1,6 =0,009 pCl = 2,05 6. Penambahan 2 ml AgNO3 Cl- = 10,4x0,025 −(2x0,09) 10,4+2 =0,006 pCl = 2,22 7. Penambahan 3 ml AgNO3 Cl- = 10,4x0,025 −(3x0,09) 10,4+3 =0,006 pCl = 2,22
Laboratorium Dasar Teknik Kimia I
D
- 1
REFERENSIhttp://www.slideshare.net/IMur/argentometri
ARGENTOMETRI – MOHR Titrasi Mohr digunakan untuk menentukan kadar halida atau pseudohalida di dalam larutan. Kromat (CrO42- ) sbg indikator titik akhir karena membentuk endapan Ag2CrO4 berwarna merah saat bereaksi dengan ion perak. Ksp Ag2CrO4= 1,2 . 10 -12 mol 3 .L -3 Ksp AgCl = 1,82 . 10 -10 mol 2 .L -2 [ Perhatikan satuan stoikiometrinya ] Meskipun tetapan hasilkali kelarutan (Ksp)AgCrO 4 hampir sama dengan Ksp perak (pseudo)halida, tetapi kelarutan kedua garam perak tsb berbeda.
Titrasi Mohr dilakukan pada pH 7-9 (netral hingga basa lemah). Jika pH terlalu kecil (asam) kesetimbangan kromat-dikromat akan menurunkan kepekaan [CrO42- ] shg menghambat pembentukan endapan Ag2CrO4. Jika pH terlalu besar (larutan basa) akan terbentuk endapan Ag 2 O.
Ag2CrO4(p) merah Kelarutan Ag 2 CrO 4 AgCl (p) Ag + + CrO42- 11. Ag + + Cl - > Kelarutan AgCl (8,4 x 10 -5 M) (1,35 x 10 -5 M) Jika larutan Ag + ditambahkan ke dalam larutan Cl - yang mengandung sedikit CrO42- , maka AgCl akan mengendap lebih dulu, sementara itu Ag2CrO4belum terbentuk, dan [Ag + ] naik hingga hasilkali kelarutan melampaui Ksp Ag2CrO4(2,0 x 10 -12 ) sehingga terbentuk endapan merah.
Pada TE : pAg = pCl = 5,00 [Ag+][CrO42- ] = 2,00 x 10 -12 [ CrO42- ] = 2,00x10 -12 / (1,0x10 -5 ) 2 = 0,02 M Konsentrasi tersebut terlalu tinggi karena warna kuning CrO42- akan mengganggu pengamatan terbentuknya endapan Ag2CrO4(merah). Dalam praktek biasanya digunakan 0,005 s/d 0,01 M supaya kesalahan titrasi diperkecil, dan masih bisa dikoreksi dengan titrasi blanko indikator, atau dengan membakukan AgNO 3 terhadap suatu garam klorida yang murni (titrasi dilakukan dalam kondisi yang sama dengan titrasi sampel).
Titrasi Mohr terbatas pada pH 6-10 (atau 7-9). Dalam larutan basa akan terjadi reaksi : Ag+ + OH- -> 2AgOH -> Cr2O72- + H2O (kromat) (dikromat) Jika [CrO42-] terlalu rendah ( 2HCrO4- Ag2O + H2O Dalam larutan asam, jumlah [CrO4 ]2- turun sehingga hanya sedikit HCrO4- yang terionisasi, karena reaksi akan berlanjut sbb : 2H+ + CrO42- < 0,005 M) akan memerlukan penambahan [Ag+ ] yang berlebih untuk mengendapkan Ag2CrO4 ; hal itu akan menjadi sumber kesalahan titrasi. Cr2O7 2-tidak dapat digunakan sebagai indikator argentometri karena Ag2Cr2O7 mudah larut. Metode Mohr dapat digunakan untuk titrasi Br- dan CN- dalam larutan basa lemah, sedangkan untuk I- dan CNS- tidak feasible karena akan terjadi adsorpsi oleh endapan. Ag+ tidak dapat dititrasi langsung oleh Cl- menggunakan indikator CrO42- , karena Ag2CrO4 akan terbentuk lebih awal dan melarut lambat menjelang TE. Untuk
Laboratorium Dasar Teknik Kimia I
D
- 2
hal tsb dapat digunakan teknik titrasi balik : Ag+ ditambah Cl- baku (berlebih), kemudian Cl- sisa dititrasi dengan larutan Ag+ baku menggunakan indikator CrO42- . http://fly-cantabile.blogspot.com/2012/05/v-behaviorurldefaultvmlo_05.htmlAir limbah industri umumnya terjadi sebagai akibat adanya pemakaian air dalam proses produksi . Di Industri fungsi dari air antara lain :
a. Sebagai air pendingin . Berfungsi untuk memindahkan panas yang terjadi dari proses .
b. Untuk mentransportasikan produk atau bahan baku .
c. Sebagai proses , misalnya sebagia umpan pada pabrik minuman . Untuk mencuci dan membilas produk atau gedung serta instalasi . (Ricki , 2005) .
Dalam air hasil pengolahan industri sabun mengandung kadar khlorida yang cukup tinggi sehingga diperlukan analisa kadar khlorida . Natrium khlorida dalam
pembuatan sabun berfungsi untuk mengendapkan sabun dari campuran reaksi. Khlorida (Cl-) adalah salah satu senyawa umum yang terdpat pada perairan alam . Senyawa-senyawa khlorida tersebut mengalami proses diasosiasi dalam air
membentuk ion . Ion khlorida pada dasarnya mempunyai pemgaruh kecil terhadap sifat-sifat kimia dan biologi perairan . Kation dari garam-garam khlorida dalam air terdapat dalam keadaan mudah larut
Laboratorium Dasar Teknik Kimia I
D
- 3
http://kimiateknologi.setiabudi.ac.id/index.php?option=com_content&view=article& id=127:analisis-kandungan-klorida-dalam-air-minum-isi-ulang-secara-argentometri-mohr-di-kelurahan-sewu&catid=75:nomor-02-juni-2010
ABSTRAK
Klorida dalam bentuk ion Cl- adalah anion anorganik yang banyak terdapat dalam air. Adanya klorida yang berlebihan dalam air minum dapat menyebabkan gangguan pada sifat fisis air, gangguan pipa logam, dan gangguan kesehatan. Pemeriksaan klorida pada air minum isi ulang dilakukan untuk mengetahui seberapa besar kadar kandungan klorida dalam air minum isi ulang sesuai persyaratan air minum yang diperbolehkan dalam KEPMENKES.RI.NO 907/MENKES/SK/VII/2002. Kadar klorida dalam air minum isi ulang ditetapkan dengan metode Argentometri Mohr yaitu dengan menggunakan larutan standar AgNO3 dan indikator K2CrO4, titik akhir titrasi ditandai dengan terbentuknya endapan warna merah bata dari Ag2CrO4. Hasil Pemeriksaan yang telah dilakukan di Laboratorium Analisa Makanan dan Minuman, menunjukkan bahwa kandungan klorida yang ada dalam air minum isi ulang telah memenuhi persyaratan sesuai dengan KEPMENKES.RI.NO907/MENKES/SK/VII/2002 karena kadarnya tidak lebih dari 250 mg/liter.
Laboratorium Dasar Teknik Kimia I
D
- 4
Laboratorium Dasar Teknik Kimia I
E-1
LEMBAR ASISTENSI DIPERIKSA KETERANGAN TTD NO. TANGGAL 1. 2. 19 Des 2013 19 Des 2013 Cek Cover Cek halaman pengesahan
Nomor halaman jangan italic
Perbaiki format lembar asistensi
Lembar asistensi gunakan header-footer
Cek cover