KARBOHIDRAT
Muhammad Alwin Azhari (G84130075)1, Rosliana PD2, Syaefudin3
1
Mahasiswa Praktikum, 2Asisten Praktikum, 3Dosen Praktikum Metabolisme
Departemen Biokimia
Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor
2015
ABSTRAK
Karbohidrat merupakan makromolekul yang berperan sebagai sumber energi utama makhluk hidup. Kelainan pada tubuh terkait karbohidrat dapat dideteksi dengan pengukuran kadar glukosa darah. Glikogen adalah karbohidrat yang disimpan di otot dan hati oleh manusia dan hewan. Hidrolisis glikogen dapat dilakukan secara enzimatis dan kimiawi (asam). Tujuan percobaan ini adalah mengukur kadar glukosa darah, mengisolasi glikogen dari hati, dan menghidrolisis glikogen secara enzimatis dan asam. Metode yang dilakukan ialah Folin Wu, sentrifugasi bertingkat, dan spektrofotometri. Kadar glukosa darah ayam yang diukur adalah 9.272 mmol/L. Glikogen yang berhasil diisolasi dari homogenat hati sapi adalah sebesar 0.0433 gram. Hidrolisis glikogen dengan enzim menghasilkan glukosa sebanyak 1.0124 µmol/mg, sedangkan secara asam menghasilkan glukosa sebanyak 0.0207 µmol/mg. Seharusnya kadar glukosa yang dihasilkan secara asam lebih besar daripada enzimatis. Hasil tersebut tidak sesuai diakibatkan adanya kesalahan dalam menjalankan prosedur percobaan.
Kata kunci : Amilase, asam, glikogen, glukosa, hidrolisis.
PENDAHULUAN
Karbohidrat merupakan salah satu makromolekul yang berperan penting bagi makhluk hidup. Secara definisi, karbohidrat adalah polihidroksialdehida, polihidroksiketon, atau zat yang dapat menghasilkan senyawa itu jika dihidrolisis. Karbohidrat tersusun atas unsur-unsur karbon, oksigen, dan hidrogen. Karbohidrat memiliki fungsi sebagai sumber energi utama, cadangan makanan, dan zat pembangun struktur jaringan tubuh. Karbohidrat dapat diubah menjadi ATP melalui metabolisme dalam sel dan energi ATP tersebut digunakan untuk beraktivitas. Beberapa jenis karbohidrat dijadikan sebagai cadangan makanan, seperti pati pada tumbuhan dan glikogen pada hewan dan manusia. Selain itu, karbohidrat juga digunakan sebagai zat penyusun struktur jaringan tertentu, seperti selulosa dan kitin yang menyusun jaringan tumbuhan (Purawisastra dan Sahara 2010).
Karbohidrat dapat diklasifikasikan berdasarkan kriteria tertentu. Berdasarkan strukturnya, karbohidrat dapat dibedakan menjadi polisakarida, oligosakarida, dan monosakarida. Polisakarida merupakan gabungan dari ratusan hingga ribuan monosakrida dan biasanya identik. Oligosakarida adalah gabungan dari dua atau lebih monosakrida. Oligosakarida yang tersusun atas dua monosakrida disebut disakarida. Monosakarida merupakan gula sederhana yang menjadi monomer bagi oligosakrida dan polisakarida. Monosakarida juga dapat dikelompokkan berdasarkan kriteria tertentu. Berdasarkan jumlah atom karbon, monosakarida dapat dibagi menjadi triosa (3 atom C), tetrosa (4 atom C), pentosa (5 atom C), heksosa (6 atom C), dan seterusnya. Adapun berdasarkan jenis gugus karbonilnya, karbohidrat dibagi menjadi aldosa (gugus aldehid) dan ketosa (gugus keton). Contoh monosakarida antara lain glukosa, fruktosa, dan galaktosa. Contoh disakrida adalah maltosa, sukrosa, dan laktosa. Adapun contoh polisakarida ialah amilum, selulosa, kitin, dan sebagainya (McMurry 2008)
Karbohidrat dapat disimpan di dalam tubuh makhluk hidup, baik pada tumbuhan, bakteri, maupun hewan. Pada tumbuhan, karbohidrat disimpan dalam bentuk pati atau amilum. Pati merupakan polisakarida yang terdiri atas fraksi amilum dan fraksi amilopektin. Fraksi amilum berupa rantai linier dari 50-300 unit D-glukosa dengan ikatan α-1,4-glikosidik. Fraksi amilopektin berupa rantai sangat bercabang dengan 300-5000 unit D-glukosa dengan rantai linier dari 25-50 unit D-glukosa yang bertautan α-1,4-glikosidik dan dihubungkan pada titik cabang lewat tautan α-1,6-glikosidik (Nelson dan Cox 2002). Pada bakteri, hewan, dan manusia, karbohidrat disimpan dalam bentuk glikogen. Glikogen merupakan polisakarida cadangan pada hati dan otot hewan dan manusia. Glikogen tersusun atas D-glukosa yang dihubungkan dengan ikatan α-1,4-glikosidik dan percabangan pada ikatan α-1,6-glikosidik (Gambar 1). Glikogen memiliki bobot molekul yang lebih besar daripada pati dan percabangan pada glikogen lebih banyak, yaitu 1 cabang per 8-12 unit glukosa (McMurry 2008). Tujuan percobaan ini adalah mengukur kadar glukosa dalam darah, mengisolasi glikogen, dan menganalisis perbedaan antara hidrolisis glikogen dengan enzim dan asam.
METODE
Tempat dan Waktu
Praktikum ini dilaksanakan pada hari Jumat tanggal 27 November dan 4 Desember 2015 pukul 13.00 - 15.30 WIB di Laboratorium Pendidikan Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Alat dan Bahan
Alat yang digunakan pada praktikum ini antara lain neraca analitik, sentrifus Beckman J-21, tabung sentrifus, tabung reaksi, pipet Mohr, penangas air, pipet tetes, cawan petri, kertas saring, corong kaca, erlenmeyer, dan gelas piala. Adapun bahan yang digunakan antara lain darah, akuades, Na-wolframat 10 %, H2SO4 0.67 N, standar glukosa, kupritartrat, fosfomolibdat, homogenat hati,
larutan TCA 10 %, etanol 95 %, NaCl, etil eter, bufer K-fosfat 0.5 M pH 6.9, NaCl 0.2 M, larutan enzim amilase, HCl 4 N, dan K2HPO4 1 M.
Prosedur Percobaan Penentuan Glukosa Darah (Metode Folin Wu)
Darah sebanyak 1 mL dipipet ke dalam erlenmeyer dan ditambahkan dengan 7 mL akuades, 1 mL Na-wolframat 10 %, dan 1 mL H2SO4 hingga warna
kecoklatan. Larutan campuran didiamkan selama 10 menit dan kemudian disaring dengan kertas saring. Tabung reaksi bersih dan kering disiapkan dan diberi label tabung a, b dan c. Tabung a diisi dengan 1 mL filtrat dan 1 mL kupritartrat. Tabung b diisi dengan 1 mL standar glukosa dan 1 mL kupritartrat. Tabung c diisi dengan 1 mL akuades dan 1 mL kupritartrat. Ketiga tabung dididihkan tepat 8 menit dan didinginkan kembali. Masing-masing tabung diencerkan dengan 7 mL akuades dan ditambahkan 1 mL fosfomolibdat. Intensitas warna pada setiap tabung diukur dengan spektrofotometer pada panjang gelombang 660 nm.
Isolasi Glikogen
Homogenat hati sebanyak 15 mL diambil dan ditambahkan dengan 19 mL TCA 10 %. Campuran diaduk dan disentrifugasi dengan kecepatan 3000 rpm selama 5 menit. Setelah itu supernatan didekantasi dan pada ekstrak TCA ditambahkan etanol 95 % sebanyak dua kali volume ekstrak TCA. Campuran dibiarkan hingga endapannya berflokulasi dan apabila tidak terjadi penggumpalan, sebutir NaCl ditambahkan dan dipanaskan hingga terbentuk endapan. Suspensi dipindahkan ke dalam tabung sentrifus dan disentrifugasi dengan kecepatan 3000 rpm selama 3 menit. Supernatan yang dihasilkan dibuang dan pelet dilarutkan dalam 5 mL akuades. Etanol 96 % ditambahkan sebanyak 10
mL dan campuran disentrifugasi lagi dengan kecepatan 3000 rpm selama 3 menit. Endapan yang tebentuk dicuci dengan 3 mL etanol absolut dan 3 mL etil eter. Kemudian endapan dikeringkan dalam cawan petri dan ditimbang. Ekstrak glikogen yang didapat disimpan.
Hidrolisis Glikogen dengan Enzim
Glikogen yang telah diisolasi ditimbang dan dilarutkan ke dalam 5 mL akuades. Larutan glkoken yang telah jadi dipipet sebanyak 2 mL ke dalam gelas kimia dan ditambahkan dengan 1 mL K-fosfat 0.5 M pH 6.9 dan 1 mL NaCl 0.2 M. Setelah itu campuran diencerkan dengan akuades sebanyak 14 mL. Larutan diinkubasi pada suhu 37 oC selama 5 menit dan setelah inkubasi selesai, larutan ditambahkan dengan larutan enzim amilase sebanyak 2 mL dan dihomogenkan, lalu larutan dididihkan. Larutan diambil sebanyak 0.5 mL dan dididihkan kembali sebagai menit ke-0. Setelah itu, larutan tersebut ditambahkan dengan akuades sebanyak 4.5 mL. Perlakuan ini dilakukan pada menit ke 0, 3, 6, 12 dan 15. Blanko dibuat dengan 2 mL akuades sebagai pengganti larutan glikogen dengan keseluruhan perlakuan sama. Setelah semua selesai, masing-masing larutan ditentukan kadar glukosa dengan metode Folin Wu.
Hidrolisis Glikogen dengan Asam
Larutan glikogen sebanyak 2 mL dipipet ke dalam tabung reaksi dan ditambahkan dengan larutan HCl 4 N sebanyak 2 mL serta dihomogenkan. Larutan kemudian diambil 0.5 mL ke dalam tabung reaksi yang berbeda dan ditambahkan dengan 2.5 mL K2HPO4. Larutan campuran diencerkan dengan
menambahkan akuades sebanyak 7 mL dan larutan didihkan selama 1 menit. Pengambilan larutan pertama tersebut adalah sampel pada menit ke 0. Perlakuan yang sama dilakukan pada menit ke 15, 30 dan 45. Blanko dibuat dengan 2 mL akuades sebagai pengganti larutan glikogen dengan keseluruhan perlakuan sama. Setelah perlakuan pada semua sampel selesai, masing-masing sampel ditentukan kadar glukosa dengan metode Folin Wu.
HASIL DAN PEMBAHASAN
Pengukuran kadar glukosa darah pada percobaan ini dilakukan secara kuantitatif menggunakan metode Folin Wu. Glukosa dioksidasi oleh ion kupri membentuk kupro, dan mengendap menjadi kupro oksida (Cu2O) yang akan
dioksidasi kembali oleh larutan asam fosfomolibdat membentuk warna biru gelap karena adanya oksida Mo. Jumlah kupro oksida yang terbentuk akan berbanding lurus dengan jumlah glukosa dalam darah (Bintang 2010). Metode Folin Wu menggunakan beberapa pereaksi tambahan, yaitu Na-wolframat dan H2SO4. Na-
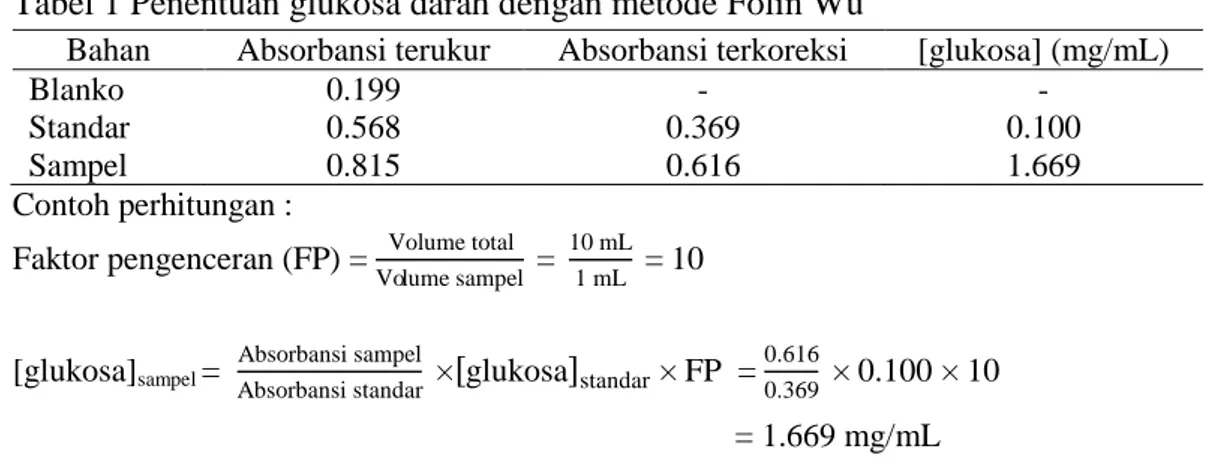
Tabel 1 Penentuan glukosa darah dengan metode Folin Wu
Bahan Absorbansi terukur Absorbansi terkoreksi [glukosa] (mg/mL)
Blanko 0.199 - -
Standar 0.568 0.369 0.100
Sampel 0.815 0.616 1.669
Contoh perhitungan :
Faktor pengenceran (FP) = Volume total
Volume sampel = 10 mL
1 mL = 10
[glukosa]sampel =
Absorbansi sampel
Absorbansi standar × glukosa standar × FP = 0.616
0.369 × 0.100 × 10
= 1.669 mg/mL
wolframat berfungsi sebagai pengendap protein agar tidak mengontaminasi glukosa darah. H2SO4 berfungsi sebagai katalis yang dapat mempercepat
terjadinya pengendapan protein dengan menghambat aktivitas antikoagulan pada darah (Wilson dan Walker 2000). Adapun hasil pengukuran kadar glukosa darah dengan metode Folin Wu tertera pada Tabel 1.
Darah pada manusia dan hewan berperan dalam transpor oksigen dan nutrisi ke seluruh jaringan tubuh. Darah mengalir melalui pembuluh darah dan dipompa oleh jantung untuk mengedarkan oksigen yang diikat hemoglobin ke seluruh jaringan. Oksigen tersebut akan digunakan untuk reaksi oksidasi dan menghasilkan energi. Selain oksigen, darah juga mengangkut sumber energi atau nutrisi bagi tubuh dalam bentuk glukosa (Konita et al. 2015). Kadar glukosa darah normal pada orang dewasa dipertahankan sebesar 4.5 – 5.5 mmol/L. Saat kelaparan, kadar glukosa darah menurun hingga 3.3 – 3.9 mmol/L, sedangkan saat setelah mengonsumsi karbohidrat, kadar glukosa darah mencapai 6.5 - 7.2 mmol/L. Kadar glukosa darah pada unggas lebih tinggi daripada manusia, yaitu mencapai 14.0 mmol/L. Kadar glukosa pada hewan memamahbiak lebih rendah daripada manusia, yaitu sebesar 2.2 mmol/L pada domba dan 2.3 mmol/L pada hewan ternak (Murray et al. 2014).
Tabel 1 menunjukkan bahwa kadar glukosa darah pada sampel yang diuji sebesar 1.669 mg/mL atau sekitar 9.272 mmol/L. Sampel darah yang digunakan pada percobaan ini berupa darah ayam. Kadar glukosa darah yang diperoleh berada di bawah kadar glukosa darah unggas yang tercantum pada Murray et al. (2014), yaitu 14.0 mmol/L. Hal tersebut mengindikasikan bahwa ayam atau unggas tersebut mengalami hipoglikemia, yaitu salah satu kelainan pada kadar glukosa darah. Kelainan yang dapat terjadi terkait dengan kadar glukosa darah adalah hiperglikemia dan hipoglikemia. Hiperglikemia adalah kondisi kadar glukosa dalam darah sangat tinggi atau jauh di atas normal. Hipoglikemia adalah kondisi kadar glukosa dalam darah sangat rendah atau berada di bawah kadar normal (Trisnawati dan Setyorogo 2013).
Selain dengan metode Folin Wu, Kadar glukosa darah juga dapat diukur dengan metode Somogyi-Nelson, Luff-Schoorl, dan Dinitrosalisilat (DNS). Pada
metode Somogyi-Nelson, protein diendapkan oleh ZnSO4 dan Ba(OH)2. Kupri
oksida dioksidasi oleh larutan tembaga alkali membentuk Cu2O yang akan
dioksidasi kembali oleh asam arsen molibdat dan membentuk kompleks berwarna biru. Metode Luff-Schoorl menentukan glukosa pada sampel dengan titrasi iodometri dari kelebihan Cu. Metode Dinitrosalisilat memanfaatkan gugus aldehid glukosa yang dapat dioksidasi menjadi karboksil oleh 3,5-dinitrosalisilat menghasilkan asam 3-amino-5-salisilat pada suasana basa 90 – 100 oC. Senyawa tersebut dideteksi dengan spektrofotometer pada panjang gelombang 540 nm (Bintang 2010).
Glikogen merupakan cadangan karbohidrat pada hewan dan manusia yang disimpan di dalam organ hati. Glikogen akan dimetabolisme dalam tubuh menjadi glukosa melalui proses glikogenolisis ketika tubuh kekurangan asupan glukosa. Glikogenolisis terjadi melalui 2 tahap, yaitu pengubahan glikogen menjadi fosfat oleh enzim glikogen fosforilase, dan pengubahan glukosa-1-fosfat menjadi glukosa-6-glukosa-1-fosfat dengan enzim fosfoglukomutase. Glukosa-6-fosfat tersebut akan masuk ke lintasan glikolisis untuk menghasilkan energi. Ketika tubuh kelebihan asupan glukosa, glukosa tersebut akan disimpan dalam bentuk glikogen melalui proses glikogenesis. Glikogenesis terjadi melalui 4 tahap, yaitu pembentukan glukosa-6-fosfat dari glukosa dengan enzim heksokinase I dan II (otot) atau heksokinase IV dan glukokinase (hati), pengubahan glukosa-6-fosfat menjadi glukosa-1-fosfat dengan enzim fosfoglukomutase, pembentukan UDP-glukosa dengan enzim UDP UDP-glukosa fosforilase, dan pembentukan glikogen dengan enzim glikogen sintase (Murray et al. 2014).
Isolasi glikogen yang dilakukan pada percobaan ini menggunakan hati sapi. Glikogen diisolasi dengan sentrifugasi bertingkat dan penambahan beberapa pereaksi. Pereaksi yang digunakan dalam isolasi glikogen dari hati sapi ialah TCA dan etanol 95 %. TCA berfungsi menghambat aktivitas enzim yang terdapat di dalam organ hati. Etanol 95 % berfungsi sebagai pengendap glikogen sehingga glikogen mudah dipisahkan dari fraksi lain (Wilson dan Walker 2000). Adapun hasil isolasi glikogen dari hati sapi tertera pada Tabel 2. Tabel 2 menunjukkan bahwa glikogen yang berhasil diisolasi dari hati sapi adalah sebesar 0.001665 g/mL. Kadar glikogen dalam hati sapi dapat memengaruhi pH dan laju glikolisis. Kadar glikogen hati yang rendah menyebabkan laju glikolisis juga rendah, dan pH absolut akan naik (Merthayasa et al. 2015). Glikogen yang berhasil diisolasi akan diuji reaksi hidrolisisnya dengan enzim amilase dan asam.
Tabel 2 Isolasi glikogen dari hati sapi
Bahan Jumlah
Glikogen terisolasi 0.0433 gram
Filtrat homogenat hati 26 mL
Contoh perhitungan :
Massa glikogen total (/mL homogenat) = Glikogen terisolasi
Filtrat homogenat hati= 0.0433
Sapi ataupun hewan memamahbiak (ruminansia) lainnya, memiliki metabolisme karbohidrat yang khas. Ruminansia mengonsumsi makanan yang mengandung selulosa. Selulosa merupakan polisakarida yang sangat sulit dicerna oleh hewan lain dan manusia. Akan tetapi, sapi dapat mencerna selulosa karena memiliki mikrob-mikrob yang dapat memfermentasi selulosa tersebut. Hasil fermentasi selulosa akan diubah menjadi glukosa melalui lintasan glukoneogenesis. Tidak hanya mencerna selulosa, keberadaan mikrob di dalam lambungnya menyebabkan ruminansia juga menyebabkan hewan ini dapat mensintesis asam amino dan vitamin sendiri (Nelson dan Cox 2000).
Glikogen dapat dihidrolisis menjadi karbohidrat yang lebih sederhana melalui pemutusan ikatan glikosidiknya. Reaksi pemutusan ikatan glikosidik tersebut tergolong reaksi hidrolisis. Hidrolisis secara enzimatik dilakukan dengan menambahkan sejumlah enzim amilase pada larutan glikogen. Hidrolisis glikogen dengan enzim amilase bersifat spesifik, yaitu hanya memotong pada ikatan α-1,4-glikosidik (Yandri dan Wulandari 2009). Hidrolisis secara kimiawi dilakukan dengan menambahkan sejumlah asam kuat pada larutan glikogen. Hidrolisis glikogen dengan asam bersifat tidak nonspesifik, yaitu memotong semua ikatan glikosidik pada glikogen, baik ikatan α-1,4 maupun ikatan α-1,6-glikosidik. Dengan demikian, produk hasil hidrolisis dengan asam akan jauh lebih banyak daripada enzimatis (Devita et al. 2015).
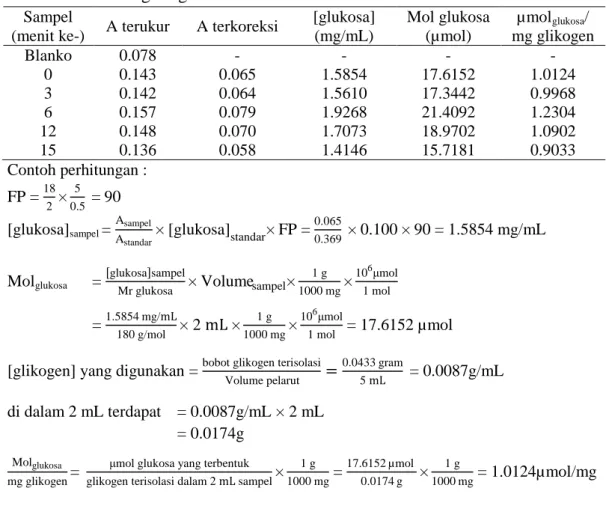
Tabel 3 Hidrolisis glikogen oleh enzim
Sampel
(menit ke-) A terukur A terkoreksi
[glukosa] (mg/mL) Mol glukosa (µmol) µmolglukosa/ mg glikogen Blanko 0.078 - - - - 0 0.143 0.065 1.5854 17.6152 1.0124 3 0.142 0.064 1.5610 17.3442 0.9968 6 0.157 0.079 1.9268 21.4092 1.2304 12 0.148 0.070 1.7073 18.9702 1.0902 15 0.136 0.058 1.4146 15.7181 0.9033 Contoh perhitungan : FP = 18 2 × 5 0.5 = 90 [glukosa]sampel = Asampel Astandar × [glukosa]standar× FP = 0.065 0.369 × 0.100 × 90 = 1.5854 mg/mL Molglukosa = glukosa sampel
Mr glukosa × Volumesampel× 1 g 1000 mg× 106μmol 1 mol = 1.5854 mg/mL 180 g/mol × 2 mL × 1 g 1000 mg× 106μmol 1 mol = 17.6152 µmol
[glikogen] yang digunakan = bobot glikogen terisolasi
Volume pelarut = 0.0433 gram 5 mL = 0.0087g/mL di dalam 2 mL terdapat = 0.0087g/mL × 2 mL = 0.0174g Molglukosa mg glikogen=
μmol glukosa yang terbentuk glikogen terisolasi dalam 2 mL sampel×
1 g 1000 mg = 17.6152 µmol 0.0174 g × 1 g 1000 mg = 1.0124µmol/mg
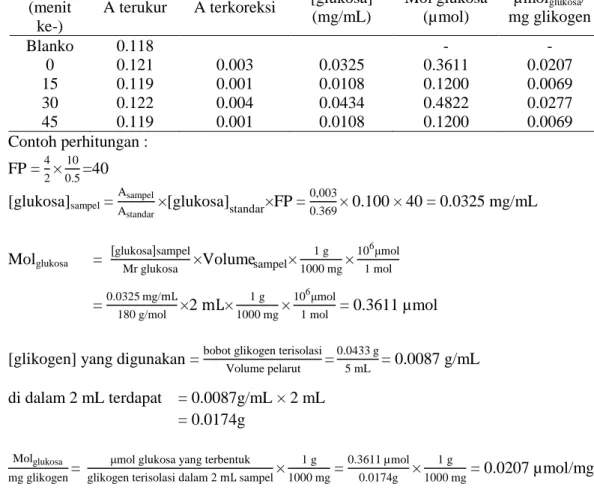
Tabel 4 Hidrolisis glikogen oleh asam Sampel
(menit ke-)
A terukur A terkoreksi [glukosa]
(mg/mL) Mol glukosa (µmol) µmolglukosa/ mg glikogen Blanko 0.118 - - 0 0.121 0.003 0.0325 0.3611 0.0207 15 0.119 0.001 0.0108 0.1200 0.0069 30 0.122 0.004 0.0434 0.4822 0.0277 45 0.119 0.001 0.0108 0.1200 0.0069 Contoh perhitungan : FP = 4 2× 10 0.5=40 [glukosa]sampel = Asampel
Astandar×[glukosa]standar×FP = 0,003
0.369× 0.100 × 40 = 0.0325 mg/mL
Molglukosa =
glukosa sampel
Mr glukosa ×Volumesampel× 1 g 1000 mg× 106μmol 1 mol = 0.0325 mg/mL 180 g/mol ×2 mL× 1 g 1000 mg× 106μmol 1 mol = 0.3611 µmol
[glikogen] yang digunakan = bobot glikogen terisolasi
Volume pelarut = 0.0433 g 5 mL = 0.0087 g/mL di dalam 2 mL terdapat = 0.0087g/mL × 2 mL = 0.0174g Molglukosa mg glikogen=
μmol glukosa yang terbentuk glikogen terisolasi dalam 2 mL sampel×
1 g 1000 mg = 0.3611 µmol 0.0174g × 1 g 1000 mg = 0.0207 µmol/mg
Tabel 3 dan 4 merupakan hasil hidrolisis glikogen secara enzimatik dan asam. Tabel 3 menunjukkan bahwa konsentrasi glukosa hasil hidrolisis glikogen yang diperoleh adalah sebesar 1.0124 µmol/mg. Tabel 4 menunjukkan bahwa konsentrasi glukosa yang diperoleh dari hasil hidrolisis glikogen dengan asam adalah sebesar 0.0207 µmol/mg. Kedua data tersebut menunjukkan bahwa hasil hidrolisis secara enzimatik jauh lebih besar daripada hidrolisis dengan asam. Hal tersebut tidak sesuai dengan penelitian Devita et al. (2015). Hal ini dapat terjadi akibat adanya kesalahan dalam menjalankan prosedur percobaan, seperti kesalahan saat membuat larutan, mengukur dengan spektrofotometer, atau penggunaan asam yang konsentrasi tidak cukup kuat untuk menghidrolisis glikogen.
SIMPULAN
Karbohidrat sebagai sumber energi utama tubuh sangat penting peranannya. Berbagai penyakit terkait konsumsi karbohidrat dapat dideteksi melalui pengukuran glukosa darah. Glikogen dapat diisolasi dari organ hati karena glikogen merupakan cadangan karbohidrat yang disimpan di otot dan hati.
Hidrolisis glikogen dengan asam seharusnya memberikan produk hasil hidrolisis yang lebih banyak daripada hidrolisis secara enzimatis, tetapi hasil percobaan tidak sesuai dengan literatur. Hal tersebut dapat diakibatkan adanya kesalahan dalam menjalankan prosedur percobaan.
DAFTAR PUSTAKA
Bintang M. 2010. Biokimia Teknik Penelitian. Jakarta (ID) : Erlangga.
Devita C, Pratjojo W, Sedyawati SMR. 2015. Perbandingan metode hidrolisis enzim dan asam dalam pembuatan sirup glukosa ubi jalar ungu. Indo. J.
Chem. Sci. 4(1): 15-19.
Konita S, Azmi S, Erkadius. 2015. Pola tekanan darah pada lansia di posyandu lansia Kelurahan Padang Pasir Padang Januari 2014. Jurnal Kesehatan
Andalas. 4(1): 269-273.
McMurry J. 2008. Organic Chemistry 8th edition. New York (US): W.H. Freeman
and Company.
Merthayasa JD, Suada IK, Agustina KK. 2015. Daya ikat air, pH, warna, bau, dan tekstur daging sapi bali dan daging wagyu. Indonesia Medicus Veterinus. 4(1): 16-24.
Murray RK, Bender DA, Botham KM, Kennelly PJ, Rodwell VW, Weil PA. 2014. Biokimia Harper Edisi 29. Manurung LR, Mandera LI, penerjemah. Jakarta (ID): Penerbit Buku Kedokteran EGC. Terjemahan dari: Harper’s
Illustrated Biochemistry, 29th Ed.
Nelson DL, Cox MM. 2002. Lehninger Principles of Biochemistry 4th edition.
New York (US): W.H. Freeman and Company.
Purawisastra S, Sahara E. 2010. Isolasi galaktomanan ampas kelapa rumah tangga dan bungkil industri minyak kelapa. Jurnal Puslitbang Gizi dan Makanan. 33(1): 23-29.
Trisnawati SK, Setyorogo S. 2013. Faktor risiko kejadian diabetes melitus tipe II di puskesmas Kecamatan Cengkareng Jakarta Barat tahun 2012. Jurnal
Ilmiah Kesehatan. 5(1): 6-11.
Wilson K, Walker J. 2000. Principles and Techniques of Practical Biochemistry
5th Edition. Cambridge (AU): Cambridge University Press.
Yandri AS, Wulandari P. 2009. Pengaruh penambahan sorbitol terhadap stabilitas termal enzim α-amilase dari Rhizopus oryzae. J. Sains MIPA. 15(2): 111-118.