Malang, 26 Maret 2016
1205
VARIASI STOMATA DARI POPULASI MINI GRAFTING JERUK SIAM MEDANA (citrus nobilis) YANG DIREGENERASIKAN DARI KULTUR
ENDOSPERMA
Stomata variation of mini grating population from citrus nobilis var Medan derived from endosperm culture
Mia Kosmiatin1), Ali Husni1) dan Chaireni Martasari2) 1)
Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya Genetik Pertanian, Jalan Tentara Pelajar no 3A, Bogor
2)
Balai Penelitian Jeruk dan Buah Sub tropis lainnya, Jalan Raya Tlekung, Batu
Abstrak
Peningkatan kualitas jeruk di Indonesia dialakukan untuk merakit tanaman jeruk yang dapat menghasilkan buah tanpa biji. Peningkatan kualitas diupayakan dengan merakit tanaman jeruk triploid yang dapat menghasilkan buah tanpa biji. Tanaman triploid yang sudah berhasil diperoleh dari kultur endosperma dan telah disambungkan pada batang bawah. Keragaman populasi jeruk yang dirgenerasikan dari jaringan endosperma dikelompokkan berdasarkan marka morfologi stomata (densitas dan rasio panjang/lebar stomata) yang dapat menentukan tingkat ploidi secara tidak langsung. Pengelompokkan menggunakan cluster analisis untuk karakter densitas dan rasio panjang lebar stomata dengan metode ward. Metode ini memiliki konsep meminimumkan variasi pada data hasil pengamatan. Hasil pengelompokkan ini kemudian dibandingkan dengan hasil penentuan tingkat ploidi secara langsung dengan menghitung jumlah kromosom. Setelah dibandingkan, pada tingkat kehomogenan 75% terdapat 2 kelompok dengan tingkat ploidi hampir seluruh anggota kelompok adalah tanaman triploid sedang kelompok yang lain hampir seluruhnya merupakan tanaman diploid. Apabila pengelompokkan dilakukan pada tingkat homogenitas 90% kelompok tanaman triploid terbagi menjadi 2 kelompok. Hal ini menunjukkan bahwa meskipun tingkat ploidinya sama ternyata ada keragaman. Keragaman ini diduuga berasal dari keragaman sel-sel endosperma yang di induksi untuk beregenerasi membentuk tanaman.
Keywords :Citrus nobilis, tanaman triploid, Analisi kluster, karakter stomata
Abstract
Increasing of local citrus quality should be done to develop citrus which seedless production. Quality increase can be done by develop of triploid citrus that produce a seedless fruit. Triploid citrus had been gained from endosperm culture and had been grafting by citrus rootstock. Variation of citrus population derived from endosperm culture clustered by stomata morphology character (stomata density and length-width ratio) that can be indirect determining of ploidy level. Clustering based on density and length-width ratio using Ward cluster analysis.Concept of this method is minimized of observation data variation. The grouping result compared with direct determining of ploidy level by chromosome counting. After than, at the 75% homogeneity are 2 groups with level ploidi almost all members of group is a plant triploid and the other is almost entirely a plant diploid. When grouping at 90 % homogeneity, a group of plants triploid divided into 2 groups.This indicates that although at the same ploidy level, there are variation of triploid plant.These variations may be derived from variation in cells endosperm that induce to plants regenerate.
Malang, 26 Maret 2016
1206
PENDAHULUAN
Sampai saat ini jeruk lokal Indonesia menghadapi gempuran dari jeruk impor bahkan saat ini sudah ada kecenderungan untuk mengganti pertanaman jeruk lokal dengan bibit jeruk impor. Impor buah jeruk segar, terutama keprok, sangat tinggi, bahkan setelah adanya kebijakan pemerintah untuk melakukan pembatasan impor. Tingginya angka impor tersebut dikarena produksi jeruk lokal yang masih musiman dengan kualitas yang lebih rendah dari jeruk impor. Salah satu penentu kualitas buah jeruk adalah jumlah biji dalam buah (Karp, 2007), dimana sampai saat ini belum ada jeruk lokal bernilai ekonomi yang memiliki sifat tersebut. Meskipun banyak jenis jeruk lokal yang rasa dan warnanya menarik seperti jeruk impor, tetapi jumlah biji per buahnya masih banyak. Pemuliaan jeruk lokal harus segera dilakukan untuk menyelamatkan jeruk lokal Indonesia sekaligus menghemat devisa.
Pemuliaan pada tanaman berkayu tidak semudah dan secepat tanaman semusim, siklus hidup yang panjang dan sistem reproduksi yang unik seringkali menyulitkan perolehan hasil sesuai dengan yang diharapkan (Byrne, 2012). Jeruk adalah tanaman buah berkayu dengan siklus hidup lebih dari 10 tahun dengan sifat apomiksis dan poliembrionik yang tinggi (Byrne, 2012; Liang et al., 1999). Hal ini menyulitkan dalam pemuliaan melalui persilangan seksual. Pemuliaan in vitro dapat membantu pemuliaan jeruk baik dengan peningkatan keragaman gnetik (mutagenesis in vitro, hidbridisasi somatik, variasi somaklonal) maupun meregenerasikan sel-sel khusus yang terdapat pada tanaman.
Perakitan tanaman yang dapat menghasilkan buah tanpa biji dapat dilakukan melalui pembentukan tanaman triploid (Hoshino et al., 2011; Miyashita et al., 2009; Thomas dan Chatuverdi, 2008; Chatuverdi et al., 2003). Tanaman triploid sulit membentuk biji karena terjadi ketidakseimbangan perpasangan kromosom saat gametogenesis. Dengan teknik in vitro dapat diregenerasikan sel-sel endosperma yang secara alami bersifat triploid (Berger et al., 2008). Regenerasi sel-sel endosperma jeruk siam medan sudah berhasil dilakukan di Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya Genetik Pertanian, Kementan (Kosmiatin, 2013) dan sudah berhasil disambung dengan teknik shoot tip grafting pada batang bawah JC di Balai Penelitian Jeruk dan Buah Sub tropis, Batu Jawa Timur (Kosmiatin et al., 2015).
Penentuan tingkat ploidi tanaman dapat dilakukan baik secara langsung maupun tidak langsung. Pengamatan secara langsung dilakukan dengan menghitung jumlah kromosom pada sel-sel muda yang aktif membelah atau mengukur kandungan DNA pada inti sel somatik tanaman (Tel-Zura et al., 2011). Teknik penentuan langsung memerlukan keahlian khusus dan biaya yang tidak sedikit. Penentuan tingkat ploidi secara tidak langsung dapat dilakukan dengan mengamati karakter anatomi (stomata) dan morfologi tanaman (Ukuran daun, bunga dan buah). Meskipun tidak selalu sama pada setiap tanaman akurasi penentuan ini cukup tinggi akurasinya dapat mencapai 80% (Yuan et al., 2009; Ye
et al., 2010; Głowacka et al., 2010). Penentuan tingkat ploidi perlu dilakukan untuk
memisahkan tanaman yang triploid dengan yang bukan triploid sehingga pemeliharaan dan induksi buah dapat dilakukan dengan lebih optimal. Validasi penentuan ini dapat dilakukan dengan analisis cluster/pengelompokkan yang didasarkan pada kemiripan atau kedekatan sifat anggota dalam satu kelompok (Johson dan Wichern 2007). Salah satu teknik pengelompokkkan yang dapat digunakan adalah dengan metode Ward‘s, pada
Malang, 26 Maret 2016
1207
metode ini pengelompokkan dilakukan pada kehomogenan yang maksimal dari obyek-obyek yang diamati. Pengelompokkan metode ward‘s adalah meminimum kan peningkatan criteria error sum of square (ESS). Dua klaster yang memiliki peningkatan ESS paling minimum akan berkelompok. Pada penelitian ini Metode Wards akan digunakan untuk melihat apakah pengelompokkan berdasarkan karakter anatomi stomata akan memberikan hasil yang sama dengan pengelompokkan jumlah kromosom. Apabila terlihat korelasinya, maka penentuan tingkat ploidi pada jeruk siam Medan dapat ditentukan secara tidak langsung dengan mengamati karakter anatomi stomata.
METODE PENELITIAN
Bahan Tanaman. Bahan yang digunakan dalam penelitian adalah populasi shoot tip grafting jeruk siam Medan. Tunas batang atas (scion) berasal dari populasi tunas in vitro jeruk siam medan yang diregenerasikan dari kultur endosperma yang sudah
disambungkan dengan teknik shoot tip grafting pada batang bawah selama 16 minggu. Batang bawah (rootstock) yang digunakan adalah bibit muda batang bawah Japansche citroen-JC.
Anatomi stomata. Pengamatan pada stomata dilakukan pada bagian bawah lamina
daun dewasa (daun yang sudah berhenti tumbuh). Pengambilan sampel stomata dilakukan dengan mengoleskan tipis-tipis cat kuku tidak berwarna (bening), kemudian diangkat dengan selotipe bening dan ditempelkan pada gelas objek (microscope slide). Pengamatan dilakukan dengan bantuan mikroskop medan terang pada perbesaran 10X40.
Penghitungan jumlah kromosom. Penghitungan jumlah kromosom dilakukan
pada mesristem tunas samping dari batang atas pada populasi Shoot tip grafting. Penghitungan jumlah kromosom dilakukan dengan metode squash. Pengamatan dilakukan dengan bantuan mikroskop medan terang pada perbesaran 10X100.
Analisis data. Data hasil pengamatan stomata kemudian dianalisis cluster dan
dikelompokk dengan metode Ward‘s. Hasil pengelompokkan ini kemudian dibandingkan dengan hasil penghitungan jumlah kromosom pada meristem pucuk scion.
HASIL DAN PEMBAHASAN
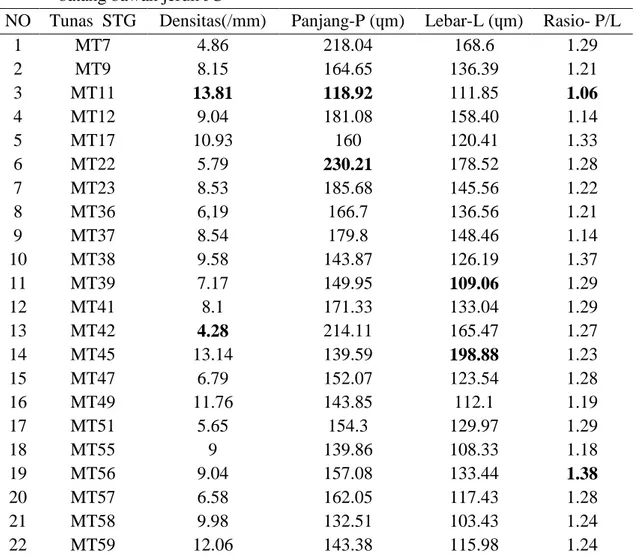
Hasil pengamatan menunjukkan keragaman yang cukup tinggi baik pada parameter densitas, maupun panjang dan lear stomata dari populasi Shoot tip grafting.. Densitas stomata terendah terdapat pada daun dari tanaman nomor MT 42 sementara tertinggi terdapat pada daun tanaman no 11. Pada tanaman no MT 11 juga ukuran stomatanya paling kecil yang ditandai dengan rasio yang paling kecil dengan ukuran panjang stomata terpendek. Ukuran stomata terbesar diperoleh dari daun tanaman no MT 56 (Tabel 1).
Malang, 26 Maret 2016
1208
Tabel 1. Rataan densitas dan ukuran stomata pada populasi Shoot tip grafting dengan scion berasal dari kultur endosperma yang berumur 16 minggu setelah disambung pada batang bawah jeruk JC
NO Tunas STG Densitas(/mm) Panjang-P (ɥm) Lebar-L (ɥm) Rasio- P/L
1 MT7 4.86 218.04 168.6 1.29 2 MT9 8.15 164.65 136.39 1.21 3 MT11 13.81 118.92 111.85 1.06 4 MT12 9.04 181.08 158.40 1.14 5 MT17 10.93 160 120.41 1.33 6 MT22 5.79 230.21 178.52 1.28 7 MT23 8.53 185.68 145.56 1.22 8 MT36 6,19 166.7 136.56 1.21 9 MT37 8.54 179.8 148.46 1.14 10 MT38 9.58 143.87 126.19 1.37 11 MT39 7.17 149.95 109.06 1.29 12 MT41 8.1 171.33 133.04 1.29 13 MT42 4.28 214.11 165.47 1.27 14 MT45 13.14 139.59 198.88 1.23 15 MT47 6.79 152.07 123.54 1.28 16 MT49 11.76 143.85 112.1 1.19 17 MT51 5.65 154.3 129.97 1.29 18 MT55 9 139.86 108.33 1.18 19 MT56 9.04 157.08 133.44 1.38 20 MT57 6.58 162.05 117.43 1.28 21 MT58 9.98 132.51 103.43 1.24 22 MT59 12.06 143.38 115.98 1.24
Keragaman ini menunjukkan bahwa ternyata sel-sel pada endosperma cukup beragam. Menurut Berger et al .(2008), sel induk endosperma merupakan hasil fusi antara satu inti sperma (gamet jantan) dengan 2 inti polar dari gamet betina. Hal ini menyebabkan secara alami jaringan endosperma yang merupakan hasil dari pembelahan sel induk endosperma akan memiliki tingkat ploidi triploid. Dengan penghitungan jumlah kromosom diketahui bahwa pada 22 tanaman shoot tip grafting dengan batang atas berasal dari regenerasi jaringan endosperma diketahui sebagian menunjukkan tingkat ploidi triploid (Tabel 2) dengan jumlah kromosom 27. Jumlah kromosom tanama jeruk siam Medan diploid adalah 18. Percampuran ini disebabkan oleh embrio nuselar, yang diketahui sifatnya cukup tinggi pada buah jeruk (Kepiro dan Roose, 2007), ikut terkulturkan pada saat mengkulturkan jaringan endosperma (Kosmiatin, 2013)
Malang, 26 Maret 2016
1209
Tabel 2. Jumlah kromosom pada tunas batang atas yang erasal dari regenerasi jaringan endosperma pada populasi shoot tip grafting
No Tunas Shoot Tip Grafting Jumlah kromosom
1 MT7 18 2 MT9 18 3 MT11 18 4 MT12 27 5 MT17 27 6 MT22 27 7 MT23 9 8 MT36 27 9 MT37 18 10 MT38 27 11 MT39 27 12 MT41 27 13 MT42 Belum jelas 14 MT45 18 15 MT47 27 16 MT49 18 17 MT51 27 18 MT55 27 19 MT56 27 20 MT57 27 21 MT58 18
Data hasil pengamatan anatomi stomata pada lamina daun dari populasi shoot tip
grafting kemudian dianalisis cluster dan dikelompokkan dengan metode Ward‘s. Hasil
analisis dan pengelompokkan dapat dilihat pada gambar 1.
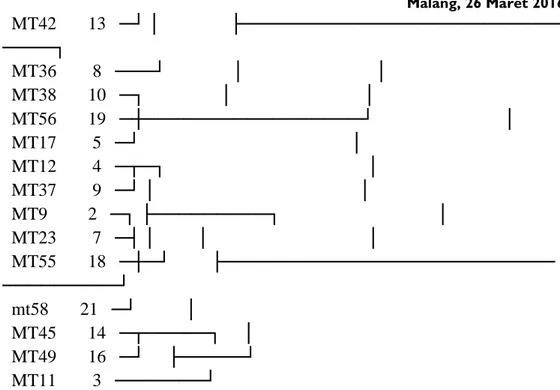
Hasil Cluster Stomata
Rescaled Distance Cluster Combine C A S E 0 5 10 15 20 25 Label Num +---+---+---+---+---+ MT47 15 ─┐ MT57 20 ─┤ MT39 11 ─┼─┐ MT41 12 ─┘ │ MT22 6 ─┐ ├───────────────┐ MT51 17 ─┼─┤ │ MT7 1 ─┤ │ │
Malang, 26 Maret 2016 1210 MT42 13 ─┘ │ ├───────────────────────── ────┐ MT36 8 ───┘ │ │ MT38 10 ─┐ │ │ MT56 19 ─┼─────────────────┘ │ MT17 5 ─┘ │ MT12 4 ─┬─┐ │ MT37 9 ─┘ │ │ MT9 2 ─┐ ├─────────┐ │ MT23 7 ─┤ │ │ │ MT55 18 ─┼─┘ ├────────────────────────── ─────────┘ mt58 21 ─┘ │ MT45 14 ─┬─────┐ │ MT49 16 ─┘ ├─────┘ MT11 3 ───────┘
Gambar 1. Dendogram hasil pengelompokan dari variabel densitas stomata dan rasio ukuran stomata (P/L) dengan Metode Ward‘s
Pengelompokkan menggunakan cluster analysis untuk karakter densitas dan rasio panjang-lebar stomata dilakukan dengan metode Wards. Metode ini memiliki konsep meminimumkan variasi pada data hasil pengamatan. Hasil pengelompokkan ini kemudian dibandingkan dengan hasil penentuan tingkat ploidi secara langsung dengan menghitung jumlah kromosom. Hal ini dilakukan untuk mengetahui apakah karakter anatomi stomata dapat digunakan sebagai penentu tingkat ploidi secara tidak langsung. Pada beberapa tanaman seperti Dendranthema nankingense (Liu et al., 2011), Lagerstroemia indica L. (Ye et al., 2010), Labu (Guo dan Wang, 2004), anggur (Zhang, 2005). Penentuan tingkat ploidi secara tidak langsung dengan mengamati karakter stomata dapat digunakan untuk seleksi awal pada populasi hasil regenerasi jaringan endosperma (triploid), gamet (haploid) dan populasi hasil penggandaan kromoson (poliploid) karena relative lebih mudah dan murah dibandingkan dengan penentuan secara langsung baik dengan menghitung kromosom, maupun tingkat ploidi.
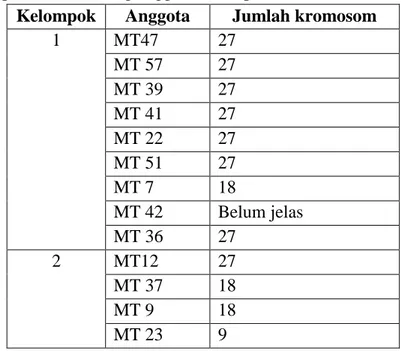
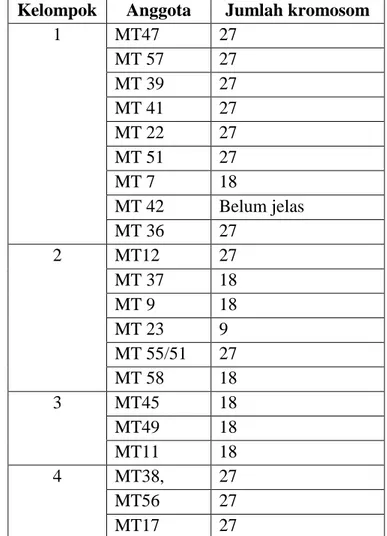
Pada pengelompokkan dengan tingkat kehomogenan 75% untuk karakter densitas stomata dan rasio panjang-lebar stomata terdapat 2 kelompok (Tabel 3). Pengelompokkan pada tabel 3 kemudian dibandingkan dengan jumlah kromosomnya (Tabel 4) dan terlihat bahwa sebagian besar anggota kelompok 1 merupkan tanaman dengan tingkat ploidi triploid. Pada kelompok 2, hampir seluruhnya merupakan tanaman diploid, hanya 3 dari 9 tanaman anggota kelompok yang tidak diploid.
Malang, 26 Maret 2016
1211
Tabel 3. Anggota masing-masing kelompok pada pembagian menjadi 2 kelompok dengan
tingkat homogenitas 75%
Cluster Anggota
1 MT47, MT57, MT39, MT41, MT22, MT51, MT7, MT42, MT36, MT38, MT56, MT17
2 MT12, MT37, MT9, MT23, MT55, MT58, MT45, MT49, MT11
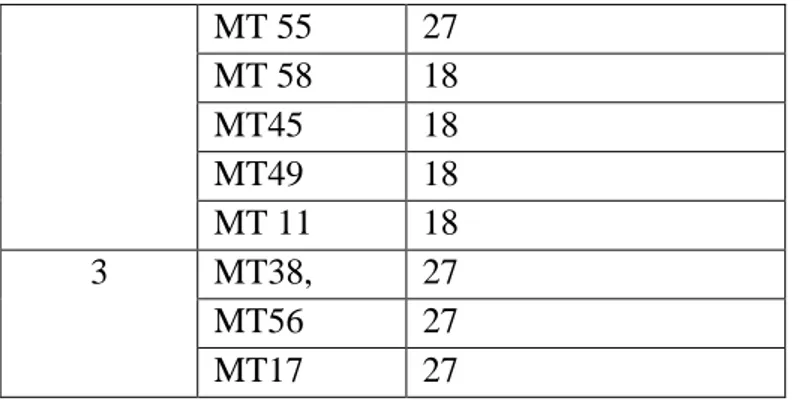
Tabel 4. Pembandingan pengelompokan Wards pada tingkat homogenitas 75% dengan tingkat ploidi dari masing anggota kelompok
Kelompok Anggota Jumlah kromosom 1 MT47 27 MT 57 27 MT 39 27 MT 41 27 MT 22 27 MT 51 27 MT 7 18 MT 42 Belum jelas MT 36 27 38 27 56 27 17 27 2 MT12 27 MT 37 18 MT 9 18 MT 23 9 MT 55 27 MT 58 18 MT45 18 MT49 18 MT 11 18
Karakteristik dari anggota kelompok 1 dan 2 dengan tingkat kesamaan 75%, dapat dilihat pada Tabel 5. Nilai mean tertinggi pada variabel densitas adalah pada kelompok 2 dengan nilai 10,20, sedangkan pada kelompok 1 memiliki nilai mean sebesar 7,08. Pada variabel rasio panjang dan lebar stomata, nilai mean tertinggi adalah pada kelompok 1 dengan nilai sebesar 1,30, sedangkan pada kelompok 2 sebesar 1,18. Nilai stdev dan range dari pengelompokkan dengan tingkat kehomogenitas 75% akan lebh tinggi dibandingkan pengelompokkan dengan tingkat homogenitas lebih tinggi (90% Tabel 8; 95% Tabel 11)
Pada kelompok 1 variabel densitas memiliki nilai stdev sebesar 1,99 dan range 6,62, pada kelompok 2 nilai stdev sebesar 2,13 dan range 5,65 (Tabel 5). Hal ini menunjukkan keragaman yang tinggi pada karakter densitas stomata pada pada kedua
Malang, 26 Maret 2016
1212
kelompok tersebut. Pada karakter rasio panjang-lebar stomata, kedua kelompok memiliki nilai stdev dan range yang kecil, sehingga keragaman rasio panjang-lebar stomatanya kecil.
Tabel 5. Karakteristik masing-masing kelompok pada tingkat homogenitas 75% Kelompok Variabel Mean StDev Minimum Maximum Range
1 Densitas 7,08 1,99 4,28 10,90 6,62 Rasio 1,30 0,05 1,21 1,38 0,17 2 Densitas 10,20 2,13 8,15 13,80 5,65 Rasio 1,18 0,06 1,06 1,24 0,18
Pada pengelompokkan dengan tingkat homogenitas lebih tinggi, 90%, terdapat tiga kelompok (Tabel 6). Setelah dibandingkan dengan jumlah kromosom, ternyata 3 anggota kelompok 1 pada tabel 3, berpisah membentuk kelompok baru (Tabel 7). Pada kelompok 1 tabel 3 hampir seluruh anggotanya memiliki tingkat ploidi triploid, Pemisahan kelompok kelompok ini memperlihatkan bahwa pada populasi tanaman dengan tingkat ploidi triploid yang berasal dari kultur endosperma terdapat keragaman meskipun tidak terlalu tinggi. Hal ini dimungkinkan karena tanaman-tanaman triploid tersebut berasal dari jaringan endosperma jeruk siam medan yang berbeda biji meskipun berasal dari buah yang sama (Kosmiatin, 2013).
Tabel 6. Anggota masing-masing kelompok pada pembagian menjadi 3 kelompok dengan
tingkat homogenitas 90%
Cluster Anggota
1 MT47, MT57, MT39, MT41, MT22, MT51, MT7, MT42, MT36 2 MT12, MT37, MT9, MT23, MT55, MT58, MT45, MT49, MT11 3 MT38, MT56, MT17
Tabel 7. Pembandingan pengelompokan Ward dengan tingkat homogenitas 90% dengan tingkat ploidi dari masing anggota kelompok
Kelompok Anggota Jumlah kromosom
1 MT47 27 MT 57 27 MT 39 27 MT 41 27 MT 22 27 MT 51 27 MT 7 18 MT 42 Belum jelas MT 36 27 2 MT12 27 MT 37 18 MT 9 18 MT 23 9
Malang, 26 Maret 2016 1213 MT 55 27 MT 58 18 MT45 18 MT49 18 MT 11 18 3 MT38, 27 MT56 27 MT17 27
Perbedaan pengelompokkan pada tabel 3 dan 6, adalah perubahan keragaman pada kelompok 1, dimana StDev pada densitas dan rasio panjang-lebar stomata menurun (Tabel 8). Hal ini menunjukkan bahwa pada kelompok satu dan tiga, anggotanya menjadi lebih homogen.
Tabel 8.Karakteristik masing-masing kelompok pada tingkat homogenitas 90% Kelompok Variabel Mean StDev Minimum Maximum Range
1 Densitas 6,16 1,17 4,28 8,10 3,82 Rasio 1,28 0,03 1,21 1,29 0,08 2 Densitas 10,20 2,13 8,15 13,80 5,65 Rasio 1,18 0,06 1,06 1,24 0,18 3 Densitas 9,84 0,96 9,04 10,90 1,86 Rasio 1,36 0,03 1,33 1,38 0,05
Kehomogenan anggota kelompok yang lebih tinggi lagi, terlihat apabila pengelompokkan dilakukan pada tingkat kesamaan 95%, dimana kelompok yang terbentuk menjadi 4 kelompok (Tabel 9). Pada pengelompokkan ini kelompok 2 (Tabel 3 dan 6) terbagi menjadi 2 kelompok, dimana satu kelompok terdiri dari tanaman diploid saja (Tabel 10). Pemisahan kelompok ini diduga karena tanaman diploid anggota kelompok 3 berasal embrio nuselar, sementara kelompok 2 berasal dari variasi somaklonal yang terjadi pada embrio nuselar atau sel-sel endosperma karena dalam kelompok ini anggota kelompoknya memiliki tingkat ploidi yang berbeda.
Tabel 9. Anggota masing-masing kelompok pada pembagian menjadi 3 kelompok dengan
tingkat homogenitas 95% Cluster Anggota 1 MT47, MT57, MT39, MT41, MT22, MT51, MT7, MT42, MT36 2 MT12, MT37, MT9, MT23, MT55, MT58, 3 MT45, MT49, MT11 4 MT38, MT56, MT17
Malang, 26 Maret 2016
1214
Tabel 10. Anggota masing-masing kelompok pada pembagian menjadi 4 kelompok
dengan tingkat homogenitas 95%
Kelompok Anggota Jumlah kromosom
1 MT47 27 MT 57 27 MT 39 27 MT 41 27 MT 22 27 MT 51 27 MT 7 18 MT 42 Belum jelas MT 36 27 2 MT12 27 MT 37 18 MT 9 18 MT 23 9 MT 55/51 27 MT 58 18 3 MT45 18 MT49 18 MT11 18 4 MT38, 27 MT56 27 MT17 27
Homogenitas yang tinggi dalam kelompok homogenitas 95% ditunjukkan dengan rendahnya nilai StDev pada karakter densitas dan rasio panjang-lebar stomata (Tabel 11) dibandingkan StDev pada pengelompokkan dengan homogenitas 75% (Tabel 5) dan 90% (Tabel 8).
Tabel 11. Karakteristik masing-masing kelompok pada tingkat homogenitas 95% Kelompok Variabel Mean StDev Minimum Maximum Range
1 Densitas 4.58 1,17 4,28 8,10 3,82 Rasio 1,28 0,13 1,21 1,29 0,08 2 Densitas 8,87 0,64 8,15 9,98 1,83 Rasio 1,19 0,04 1,14 1,24 0,10 3 Densitas 12,87 1,07 11,70 13,80 2,10 Rasio 1,16 0,09 1,06 1,23 0,17 4 Densitas 9,84 0,96 9,04 10,90 1,86 Rasio 1,36 0,03 1,33 1,38 0,05
Pada analisis cluster/pengelompokkan Ward,s, jumlah kelompok yang ingin dibentuk tergantung pada tujuan atau kepentingan dari dari penelitian, namun semakin
Malang, 26 Maret 2016
1215
banyak pengelompokkan menunjukkan bahwa karakteristik yang ada pada masing-masing kelompok memiliki kehomogenan semakin tinggi. Pada pengelompokkan karakter densitas dan rasio panjang lebar stomata ditujukan untuk mengetahui apakah ada korelasi antara karakter stomata dengan tingkat ploidinya. Pada populasi shoot tip grafting dengan batang atas diperoleh dari regenerasi jaringan endosperma terlihat bahwa pengelompokkan karakter stomata (densitas dan rasio panjang-lebar stomata) dapat menunjukkan tingkat ploidi. Densitas yang rendah dan rasio panjang-lebar stomata tinggi menunjukkan tingkat ploidi yang lebih tinggi. Selanjutnya karakter stomata pada jeruk dapat digunakan untuk menapis tanaman jeruk yang berasal dari regenerasi jaringan gamet (haploid), endosperm (triploid) dan jaringan yang sudah diperlakukan poliploidisasi.
PENUTUP Kesimpulan
Dari penelitian ini dapat disimpulkan bahwa :
- Terdapat keragaman karakter anatomi stomata (densitas dan ukuran /rasio panjang lebar stomata pada populasi shoot tip grafting dengan batang atas berasal dari regenerasi jaringan endosperma jeruk siam Medan
- Pada populasi shoot tip grafting dengan batang atas berasal dari regenerasi jaringan endosperma jeruk siam Medan diketahu tingkat ploidinya tidak seragam tetapi diperoleh tanaman triploid dan diploid
- Berdasarkan pengelompokkan karakter stomata dengan teknik pengelompokkan Wards, diketahui bahwa karakter stomata dapat mengelompokkan sesuai dengan tingkat ploidinya, sehingga pengamatan karakter stomata dapat digunakan untuk penapisan dini populasi yang diregenerasikan dari jaringan poliploid jeruk dengan pembanding tanaman diploidnya.
Saran
Hasil penelitian ini dilakukan pada populasi tanaman jeruk siam medan, apabila dilakukan penelitian yang sama pada jeruk keprok (Citrus reticulata) dengan hasil yang relative sama, maka teknik ini dapat digunakan untuk jeruk-jeruk lainnya, yang pada dasarnya merupakan turunan dari C. reticulata.
DAFTAR PUSTAKA
Berger, F., Y. Hamamura, M. Ingouff, and T. Higashiyama. 2008. Double fertilization – caught in the act. Trends in Plant Sci. Vol. 13, No. 8: 437- 443.
Byrne, D. H. 2012. Trends in Fruit Breeding. Pp. 3-36. In M. L. Badenes and D H Byrne (Eds). Fruit Breeding. Springer New York Dordrecht Heidelberg London.
Chaturvedi, R, M K Razdan and S S Bhojwani.2003. An efficient protocol for the production of triploid plants from endosperm callus of neem, Azadirachta indica A. Juss.. Plant Physiol., 160(5): 557-564
Głowacka, K, S. Jez˙owski, Z. Kaczmarek. 2010. In vitro induction of polyploidy by colchicine treatment of shoots and preliminarycharacterisation of induced polyploids in two Miscanthus species. Industrial Crops and Products, 32: 88–96
Malang, 26 Maret 2016
1216
Guo Y Q, Wang J S. 2004. Study onmethods forploidy determination in regenerated plant from unpollinated ovules of cucurbita pepo. Acta Agriculturae Boreali-Sinica, 19, 80-83.
Hoshino, Y., T. Miyashita, and T.D. Thomas. 2011. In vitro culture of endosperm and its application in plant breeding: Approaches to polyploidy breeding. Sci Hort. Vol. 130, No. 1: 1-8.
Johnson, R.A. &Wichern, D.W. 2007. Appied multivariate Analysis, Sixth Edition. New Jersey: Prentice Hall Inc.
Karp, D. 2007. Mandarins growing nears Bakersfield, Calif. Marisorpa, Calif
Kepiro, J L and M L Roose. 2007. Nuceller embryony. Pp. 141-149. In J.A. Khan IA, editor. Citrus Genetics Breeding and Biotechnology. CAB International. Oxfordshire
Kosmiatin, M, A Purwito, Y S Purba, C Martasari dan A Husni. 2015. Pengembangan jeruk siam Medan triploid untuk produksi buah tanpa biji. Laporan Hasil Penelitian. Program KKP3N. Badan Penelitian dan Pengembangan Pertanian.
Kosmiatin, M. 2013. Pembentukan Tanaman Triploid Jeruk Siam Simadu (Citrus nobilis Lour) melalui Kultur Endosperma. Disertasi. Sekolah Pascasarjana. Institut Pertanian Bogor. Bogor.
Liang, S.Q., W X Zhu, D W T Xiang. 1999. Precocious trifoliate orange (Poncirus
trifoliate L. Raf.) biology characteristic and its stock experiment. Zhe Jiang Citrus,
16:2-4.
Miyashita, T. , T. Ohashi, F. Shibata, H. Araki and Y. Hoshino. 2009. Plant regeneration with maintenance of the endosperm ploidy level by endosperm culture in Lonicera
caerulea var. emphyllocalyx. Plant Cell Tissue Organ Cult., 98 : 291–301.
Tel-Zura, N, M Dudaib, E Ravehc, Y Mizrahib. 2011. In situ induction of chromosome doubling in vine cacti (Cactaceae). Scientia Horticulturae, 129: 570–576
Thomas, T.D., and R. Chaturverdi. 2008. Endosperm culture: A novel method for triploid plant. Plant Cell Tissue Organ Cult. Vol. 93, No. 1:1-14.
Ye, Y.M., Tong, J., Shi, X.P., Yuan, W., Li, G.R., 2010. Morphological and cytological studies of diploid and colchicine-induced tetraploid lines of crape myrtle (Lagerstroemia indica L.). Sci. Hortic. 124: 95–101.
Yuan, S X, Y M Liu, Z Y Fang, L M Yang, M Zhuang, Y Y Zhang, P T Sun. 2009. Study on the Relationship Between the Ploidy Level of Microspore-Derived. Plants and the Number of Chloroplast in Stomatal Guard Cells in Brassica oleracea. Agricultural Sciences in China, 8(8): 939-946
Zhang L Y, Guo Q G, Li X L, Zeng H, Tan J M, Liang G L. 2005. Study on the relationship between the number of Chloroplast in stomata guard cell and the ploidy of loguat cultivars. Journal of Fruit Science, 22, 229-233.