Buku teks ini disusun berdasarkan menempatkan siswa lebih sebagai pusat kegiatan pembelajaran (Student Center). Semoga buku ajar ini dapat bermanfaat bagi kita semua khususnya mahasiswa mata kuliah di lingkungan FFS UHAMKA.
PEMBAHASAN
- Pengertian Materi
- Sifat dan Perubahan Materi
- Perubahan Materi
- Klasifikasi Materi
- Wujud Materi
- Hukum-Hukum Tentang Materi
Ini adalah zat yang tidak dapat diuraikan menjadi zat yang lebih sederhana dengan cara kimia. Ini adalah satu jenis zat yang dapat dipisahkan menjadi dua atau lebih unsur melalui proses kimia.
CONTOH SOAL
Jika unsur karbon yang bereaksi sebanyak 1,5 gram, tentukan massa oksigen yang bereaksi dan massa karbon dioksida yang terbentuk. Unsur adalah suatu zat yang tidak dapat dipisahkan lagi menjadi zat yang lebih sederhana secara kimia.
Definisi
Partikel Penyusun Atom
Penemuan Elektron, Proton, Dan Neutron
Pada tahun 1897, melalui serangkaian penelitian, Joseph John Thomson dari Inggris mampu membuktikan partikel yang dimaksud Stoney dengan nama elektron. Dengan ditemukannya elektron, para ilmuwan sangat yakin bahwa di dalam atom, jika terdapat partikel bermuatan negatif, maka pasti ada partikel bermuatan positif untuk menyeimbangkan atom tersebut.
Perkembangan Model Atom
Pada tahun 1903, Philipp Lenard membuktikan melalui eksperimennya bahwa teori atom Thomson, yang menyatakan bahwa elektron terdistribusi secara merata dalam muatan positif sebuah atom, tidaklah benar. Kemudian Rutherford mengajukan teori atom sebagai berikut: Atom terdiri atas inti atom yang bermuatan positif sebagai pusat massanya dan dikelilingi oleh elektron yang bermuatan negatif.
Penentuan Bilangan Kuantum Utama, Azimut, Magnetik, Dan Spin
Dari tabel di atas dapat disimpulkan bahwa untuk subkulit s terdapat 1 orbital, subkulit p memiliki 3 orbital, subkulit d memiliki 5 orbital dan subkulit f memiliki 7 orbital. Arah putaran elektron bisa searah jarum jam (clockwise) atau berlawanan arah jarum jam (counterclockwise).
Konfigurasi Elektron
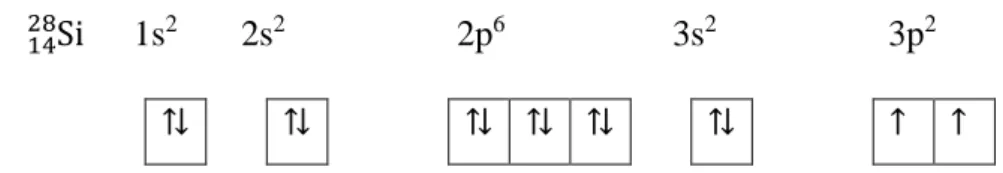
Untuk menyatakan sebaran elektron dalam orbital pada subkulit, konfigurasi elektron dapat ditulis dalam bentuk diagram orbital. Dua elektron dengan bilangan pokok, azimuth, dan kuantum magnetik yang sama dalam satu orbital pasti mempunyai spin yang berbeda.
Isotop, Isobar, Isoton
Atau dapat disingkat menggunakan atom Ne dengan nomor atom 10, sehingga konfigurasinya dapat ditulis = [Ar] 3s2 3p5. Dari konfigurasi elektron aturan Hund di atas terlihat terdapat 2 elektron yang tidak berpasangan.

PERIODIK UNSUR
- Perkembangan Sistem Periodik Unsur
- Penentuan Periode dan Golongan Unsur dalam Sistem Periodik
- Sifat Periodik Unsur
- Konfigurasi Elektron pada Ion
Unsur-unsur dalam satu lajur menegak ialah unsur-unsur kumpulan, terdapat lapan kumpulan utama dan lapan kumpulan peralihan. a) Kumpulan I A dipanggil kumpulan alkali (kecuali H), yang terdiri daripada unsur: H, Li, Na, K, Rb, Cs, Fr. A dipanggil kumpulan alkali tanah dan terdiri daripada unsur: Be, Mg, Ca, Sr, Ba, Ra. c) Kumpulan III. A dipanggil kumpulan baron aluminium dan terdiri daripada unsur-unsur: B, Al, Ga, In, Ti, Uut. d) Kumpulan IV.
A disebut golongan oksigen-belerang yang terdiri dari unsur-unsur: O, S, Se, Te, Po, Uuh. 36. g) Kelompok VII. Unsur lantanida berada pada periode 6 golongan IIIB, dan unsur aktinida berada pada periode 7 golongan IIIB. Sifat-sifat unsur oksida (seperti yang dicontohkan oleh oksida amfoter) ditunjukkan oleh unsur-unsur yang terletak di tengah suatu periode.
Di antara unsur-unsur 12P, 16Q, 19R, 34S dan 53T yang terletak pada golongan yang sama dalam sistem periodik unsur.
- Peranan Elektron Dalam Pembentukan Ikatan Kimia
- Teori Lewis
- Pembentukan Ikatan
- Kepolaran Ikatan dan Senyawa
Atom yang tidak mungkin memenuhi aturan oktet (H, He, Li) cenderung stabil hanya dengan dua elektron (Duplet) pada kulit terluarnya. Namun, karena tidak mungkin membedakan elektron dalam atom yang terikat, hanya simbol yang akan digunakan untuk struktur Lewis berikut. Ikatan kovalen terbentuk ketika pasangan elektron yang digunakan bersama hanya berasal dari salah satu atom yang berikatan (disebut donor), sedangkan atom lainnya menyediakan tempat itu sendiri.
Senyawa yang memiliki ikatan hidrogen mempunyai titik didih dan titik leleh yang lebih tinggi meskipun Mr (berat molekul relatif) kecil. D. Senyawa yang memiliki ikatan Van der Waals mempunyai titik didih yang rendah. d.4 Polaritas senyawa dan senyawa a. Hal ini dikarenakan kedua atom yang berikatan mempunyai sifat yang sama sehingga daya tariknya terhadap elektron juga sama.
Berdasarkan kedua hal di atas, dapat dikatakan bahwa ikatan kovalen polar terjadi pada molekul-molekul yang tersusun dari atom-atom yang mempunyai derajat keelektronegatifan yang berbeda-beda. B.
PENGERTIAN SENYAWA KOMPLEKS, ATOM PUSAT DAN LIGAN
- Senyawa Kompleks
- Ikatan Kovalen Koordinasi Dan Bilanagan Koordinasi
- Penamaan Kompleks
- Teori Ikatan Valensi Dan Bentuk Kompleks
Dinyatakan dalam bentuk ion diikuti nama dan nomor ligan, nama atom pusat dan muatan ion kompleks ditulis dalam angka arab. Contoh: Ion tembaga(II) tetraamina atau ion tembaga(2+) tetraamina. 2) Nama kompleks anion dinyatakan dengan ion diikuti nama dan nomor ligan, nama atom pusat dalam bahasa latin dengan akhiran -um atau -ium diganti -at dan bilangan oksidasi pusatnya atom. ditulis dengan angka romawi. Pembentukan senyawa kompleks berdasarkan teori ikatan valensi, ada yang tidak melibatkan proses eksitasi dan ada pula yang melibatkan proses eksitasi.
Tuliskan konfigurasi elektronik atom pusat setelah sumbangan pasangan elektron bebas dari ligan. Sifat diamagnetik kompleks [Ag(CN)2] ditunjukkan oleh pasangan semua elektron pada atom pusat. 2) Dalam menjelaskan pembentukan senyawa kompleks atau kompleks yang melibatkan proses eksitasi. Tuliskan konfigurasi elektron atom pusat setelah sumbangan pasangan elektron bebas (PEB) dari ligan.
Sifat paramagnetik ion [Fe(NH3)6]3+ ditunjukkan dengan adanya elektron tidak berpasangan pada orbital 3d atom pusat.
Latihan Soal
Reaksi terjadi karena ion Cl- bereaksi dengan ion Ag+ yang berarti tidak terdapat ligan Cl pada ion kompleks tersebut. Ligan adalah molekul netral atau anion yang memiliki pasangan elektron bebas yang digunakan untuk membentuk ikatan koordinasi dengan atom pusat. Ion kompleks adalah ion yang terdiri dari ion pusat (atom pusat) yang dikelilingi oleh molekul atau ion (ligan).
- Pengertian Stoikiometri
- Bilangan Avogrado
- Massa Atom Relatif dan Massa Molekul Relatif
- Konsep Mol
- Rumus Molekul dan Rumus Empiris
- Penentuan Reaksi Pembatas
- Hasil Teoritis, Hasil Nyata dan Persen Hasil
- CONTOH SOAL DAN PEMBAHASANNYA
Jadi, bilangan alpukat adalah “faktor penggandeng A” antara jumlah mol suatu zat dengan jumlah partikel yang dikandung zat tersebut. Massa 1 mol atom disebut massa molar, misalnya 1 mol atom kalor mempunyai massa molar; 35,435 g Cl/mol Cl. Rumus yang tidak hanya menyatakan jumlah relatif atom setiap unsur, tetapi juga menunjukkan jumlah sebenarnya atom setiap unsur penyusun suatu molekul senyawa.
Jumlah produk reaksi yang dihitung dari jumlah reaktan yang ada sejak awal reaksi disebut hasil teoritis suatu reaksi. Pada reaksi senyawa organik, sebagian besar hasil reaksi (hasil aktual) lebih kecil dibandingkan hasil teoritis. Hal ini disebabkan karena reaksi tidak berjalan sempurna, terdapat reaksi-reaksi bersaing yang dapat menurunkan hasil reaksi atau dapat pula terjadi kehilangan zat pada saat penanganan.
Jawaban: persentase adalah perbandingan antara massa unsur-unsur penyusun yang ada dengan massa rumus (massa molekul) senyawa tersebut.
- Konsep-Konsep Dasar Redoks
- Penyetaraan Reaksi Redoks
- Komponen Sel Elektronik
- CONTOH SOAL DAN PEMBAHASAN
Yaitu elektroda yang mengandung logam yang berada dalam kesetimbangan dengan larutan ion, misalnya Cu | elektroda Cu2+. Yaitu elektroda yang mengandung gas yang berada dalam kesetimbangan dengan ion-ion dalam larutan, misalnya elektroda Pt | H2(g) | H+(aq). Jika suatu logam dicelupkan ke dalam air, maka akan terjadi beda potensial antara batang logam dengan air, yang disebut potensial elektroda.
Diperlukan elektroda pembanding yang mempunyai nilai potensial elektroda nol, sehingga nilai potensial elektroda lainnya dapat ditentukan dengan voltmeter. Potensial sel yang dihasilkan oleh elektroda dengan elektroda hidrogen disebut potensial elektroda dan diberi simbol E. Bila diukur pada kondisi standar (250 C, dengan konsentrasi 1 M dan tekanan gas 1 atm), disebut potensial elektroda standar dan diberi simbol E0.
Elektroda yang lebih mudah direduksi dibandingkan dengan elektroda hidrogen mempunyai potensial elektroda yang bertanda positif, sedangkan elektroda yang lebih sulit direduksi dibandingkan dengan elektroda hidrogen mempunyai potensial elektroda yang bertanda negatif.
Pengertian
Penentuan Laju Reaksi Kimia
Jadi reaksinya adalah orde kedua untuk NO, orde pertama untuk H2, dan untuk semua reaksi, orde ketiga adalah Aseton, CH3COCH3, bereaksi dengan yodium dalam suasana asam. Orde ke-nol iofium, mis. laju hp mengandung [I₂] nol pangkat = 1, sehingga laju reaksi tidak bergantung pada konsentrasi I2. Dengan menggunakan metode integral dapat ditunjukkan bahwa hukum laju orde 1 melalui hubungan antara N₂O₅ dan waktu adalah sebagai berikut: I [N2O5]1.
Persamaan ini memungkinkan untuk menghitung konsentrasi N₂O₅ setiap saat, jika konsentrasi awal dan konstanta laju diketahui dan dapat diketahui. Reaksi orde nol biasanya terjadi dengan zat pada permukaan logam atau enzim yang dilakukan dalam reaksi tersebut.
Faktor Yang Mempengaruhi Kecepatan Reaksi
Hubungannya dengan laju reaksi adalah semakin besar molaritas suatu zat maka semakin cepat pula reaksi berlangsung. Karena persamaan laju reaksi didefinisikan dalam konsentrasi reaktan, maka seiring bertambahnya konsentrasi, laju reaksi juga meningkat. Artinya semakin tinggi konsentrasi maka semakin banyak pula molekul reaktan yang tersedia, sehingga kemungkinan terjadinya tumbukan akan semakin besar sehingga laju reaksi semakin besar.
Laju reaksi dinyatakan sebagai berkurangnya jumlah reaktan per satuan waktu atau bertambahnya jumlah produk reaksi per satuan waktu. Alat yang digunakan untuk mengukur volume H₂ adalah gelas ukur yang dicelupkan ke dalam gelas kimia berisi air. Gas yang dihasilkan yaitu gas H₂ akan mengisi ruang pada gelas ukur yang berisi air, yang kemudian menimbulkan ruang kosong yang volumenya diukur.
Laju reaksi rata-rata setiap interval waktu didasarkan pada gas AB3 yang dihasilkan (tiga angka kecil di bawah).
- Perbedaan Reaksi Kimia Biasa dengan Kimia Inti
- Stabilitas Inti dan Peluruhan Inti
- Jenis Sinar Radioaktif
- Kesetimbangan Radio Aktif
- Jenis Reaksi Inti, Fisi, dan Fusi
- Dampak Negatif dan Positif dari reaksi inti
Cahaya ini ditemukan bersamaan dengan ditemukannya fenomena radioaktivitas, yaitu penguraian inti atom yang terjadi secara spontan, tidak terkendali dan menghasilkan radiasi. Sinar gamma merupakan radiasi gelombang elektromagnetik yang dipancarkan oleh inti atom dengan energi sangat tinggi yang tidak memiliki massa atau muatan. Peluruhan nuklir adalah kumpulan berbagai proses di mana inti atom yang tidak stabil mengeluarkan partikel subatom (partikel radiasi).
Reaksi fisi adalah reaksi di mana inti atom berat terpecah menjadi dua inti atom yang lebih ringan sehingga menghasilkan energi yang sangat besar. Neutron yang tercipta akan bertabrakan dengan inti atom berat lainnya sehingga menimbulkan reaksi fisi baru. Reaksi fusi adalah reaksi di mana dua inti atom ringan digabungkan untuk membentuk inti atom lain yang lebih berat, sehingga melepaskan energi.
Inti atom berada dalam keadaan tidak stabil ketika jumlah proton jauh lebih besar daripada jumlah neutron.
- Sifat Unsur Gas Mulia
- Sifat Unsur Transisi
- Sifat Unsur Halogen
- Sifat Unsur Oksigen, Hydrogen, Carbon, Belerang, dan Antimon
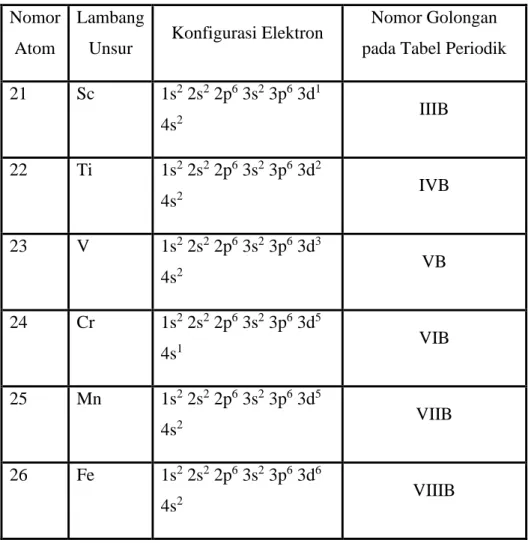
Hal ini dikarenakan konfigurasi elektronik unsur transisi menempati subkulit d, elektron pada orbital d yang tidak penuh memungkinkannya berpindah tempat. Kecuali unsur Cr dan Cu, semua unsur transisi pada periode keempat memiliki elektron pada kulit terluar 4s2, sedangkan Cr dan Cu memiliki elektron pada subkulit 4s1. Pada pengisian d terdapat kombinasi orbital d dan s, sedangkan pada pengisian f terdapat kombinasi f dan s, dan terkadang tambahan d. Unsur transisi periode keempat, dalam upaya mencapai konfigurasi gas mulia, akan melepaskan elektron dalam subkulit s dan dnya.
Hal ini ditunjukkan dengan tren nilai energi ionisasi yang umumnya meningkat dari Sc ke Zn. 4) Bilangan oksidasi. Bilangan oksidasi tertinggi sejumlah logam transisi penting seperti kobalt (Co), nikel (Ni), tembaga (Cu), dan seng (Zn) lebih rendah dibandingkan bilangan oksidasi atom-atom yang hilang semuanya ( n-1) d dan ns elektron. Oleh karena itu, unsur transisi dimulai pada periode keempat dalam tabel periodik, yang sesuai dengan bilangan kuantum utama terbesar (4s 3d).
Hidrogen memiliki jari-jari atom yang sangat kecil (0,037 nm), sehingga mampu menembus antar partikel unsur transisi tanpa merusak struktur kristal sehingga menghasilkan hidrida interstisial.