GANGGUAN PSIKOTIK PADA PENGGUNAAN GANJA (Cannabis)
Penulis :
Dr. Luh Nyoman Alit Aryani SpKJ(K)
PROGRAM PENDIDIKAN DOKTER SPESIALIS I BAGIAN/SMF PSIKIATRI FK UNUD/RSUP SANGLAH
DENPASAR 2017
i
KATA PENGANTAR
Puji syukur penulis panjatkan kepada Tuhan Yang Maha Esa, atas berkat rahmat-Nya tinjauan pustaka ini dapat diselesaikan. Tinjauan pustaka ini disusun untuk sebagai suatu upaya untuk terus mencari dan menambah ilmu pengetahuan yang kiranya dapat memberi manfaat bagi penulis sendiri maupun para pembaca lainnya.
Akhir kata penulis menyadari bahwa tinjauan pustaka ini jauh dari sempurna sehingga memerlukan bimbingan, kritik dan saran yang membangun dari para senior maupun teman-teman residen lainnya. Atas masukannya penulis mengucapkan banyak terima kasih.
Hormat saya, Penulis
ii
KATA PENGANTAR ... i
DAFTAR ISI ... ii
DAFTAR TABEL ... iii
DAFTAR GAMBAR ... iv
DAFTAR SINGKATAN ... v
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Batasan Masalah ... 2
1.3 Tujuan dan Manfaat ... 2
BAB II TINJAUAN PUSTAKA ... 4
2.1 Profil Ganja (Cannabi ... 4
2.2 Epidemiologi Ganja (Cannabis) ... 6
2.3 Dampak Penggunaan Ganja (Cannabis) ... 7
2.4 Neurofarmakologi Ganja (Cannabis) ... 9
2.5 Gangguan Psikotik Akibat Penggunaan Ganja (Cannabis) ... 16
BAB III RINGKASAN ... 24
DAFTAR PUSTAKA ... 26
iii
DAFTAR TABEL
Tabel 1. Efek samping penggunaan marijuana jangka pendek dan
jangka panjang atau pengguna berat ... 9 Tabel 2. Pengaruh ganja terhadap fungsi eksekutif ... 19
iv
Gambar 1. Ganja (Cannabis) ... 5 Gambar 2. Pengaturan neurotransmitter sistem reward mesolimbik ... 13 Gambar 3. Dopamin sebagai pusat sistem reward ... 14
v
DAFTAR SINGKATAN
BNN : Badan Narkotika Nasional
CAM : Complementary Alternative Medicine CB1 : Cannabinoid 1 reseptor
CB2 : Cannabinoid 2 reseptor CBD : Cannabidiol
COMT : Catechol-O-methyltransferase
DA : Dopamin
GABA : Gamma-Aminobutyric Acid GSK-3 : Glikogen Sintase Kinase
NAPZA : Narkotika, Psikotropika dan Zat Adiktif lainnya PFC : Prefrontal Cortex
SSP : Sistem Saraf Pusat THC : Tetrahidrokanabinol VTA : Ventral Tegmental Area WHO : World Health Organization Δ9-THC : Delta-9-tetrahydrocannabinol
1 BAB I PENDAHULUAN
1.1 Latar Belakang
Ketergantungan dan penyalahgunaan zat bukan merupakan masalah baru di Indonesia. Dewasa ini, diperkirakan di Indonesia terdapat peningkatan jumlah penyalahgunaan Narkotika, Psikotropika dan Zat Adiktif lainnya (NAPZA) dari tahun ke tahun (Husin & Siste, 2013).
NAPZA yaitu singkatan dari narkotik, psikotropik dan zat adiktif lain.
Sebutan yang mirip di masyarakat adalah “narkoba”. NAPZA ada yang semata- mata berasal dari tumbuh-tumbuhan (natural, alami) seperti : ganja, ada yang sintetis (shabu) dan ada pula yang semi sintetis (putau). NAPZA didefinisikan sebagai setiap bahan kimia/zat yang bila masuk ke dalam tubuh akan mempengaruhi fungsi tubuh secara fisik dan psikologis (Husin & Siste, 2013).
Ganja (kanabis, marijuana) termasuk golongan zat adiktif. Pemanfaatanya sebagai obat telah dikenal sejak kurang lebih 5000 tahun yang lalu di negeri Cina (Depkes, 2000).
Di Indonesia terdapat antara 2-3juta orang yang pernah menghisap ganja (di Amerika Serikat 5 juta orang pernah menggunakan ganja sepekan sekali).
Pengguna pemula ganja terutama dikalangan anak usia muda, meningkat tajam selama 4-5 tahun terakhir karena ganja mudah diperoleh dimana-mana (produk lokal) (Husin & Siste, 2013).
2
Berdasarkan hasil penelitian Badan Narkotika Nasional (BNN) bekerjasama dengan Puslitkes UI Tahun 2011 tentang Survei Nasional Perkembangan Penyalahgunaan Narkoba di Indonesia, diketahui bahwa angka prevalensi penyalahgunaan Narkoba di Indonesia telah mencapai 2% atau sekitar 4,2 juta orang dari total populasi penduduk (berusia 10 - 59 tahun). Tahun 2015 jumlah penyahguna Narkoba diproyeksikan ± 2,8% atau setara dengan ± 5,1 - 5,6 juta jiwa dari populasi penduduk Indonesia (BNN, 2015).
Penggunaan ganja dapat memicu timbulnya gejala psikotik. Biasanya timbul bila takaran pemakaian sangat berlebihan dengan akibat timbulnya paranoid dan halusinasi visual yang bersifat sementara. Kajian retrospektif pada pemakai ganja berat di India ditemukan tingkah laku aneh, kekerasan dan panik yang berlangsung sementara.
1.2 Batasan Masalah
Tinjauan Pustaka ini akan membahas tentang profil ganja, epidemiologi, dampak penggunaan ganja, neurofarmakologi ganja dan gangguan psikotik yang ditimbulkan ganja beserta faktor-faktor yang mempengaruhinya.
1.3 Tujuan dan Manfaat
Tujuan penulisan ini adalah untuk membahas bagaimana terjadinya gangguan psikotik yang ditimbulkan dari penggunaan ganja (Cannabis) dan mengetahui faktor-faktor yang mempengaruhi sehingga dapat menjadi acuan
untuk mencegah bahaya penggunaan ganja. Dengan mengetahui efek yang ditimbulkannya diharapkan dapat menjadi kajian pustaka untuk mengatasi masalah yang terjadi pada pasien di dalam praktek sehari-hari.
4
BAB II
TINJAUAN PUSTAKA
2.1 Profil Ganja (Cannabis)
Ganja (Cannabis) adalah nama singkatan untuk tanaman Cannabis sativa.
Istilah ganja umumnya mengacu kepada pucuk daun, bunga dan batang dari tanaman yang dipotong, dikeringkan dan dicacah dan biasanya dibentuk menjadi rokok. Nama lain untuk tanaman ganja adalah marijuana, grass, weed, pot, tea, Mary jane dan produknya hemp, hashish, charas, bhang, ganja, dagga dan sinsemilla (Camellia, 2010).
Tanaman semusim ini tingginya dapat mencapai dua meter. Berdaun menjari dengan bunga jantan dan betina ada di tanaman berbeda. Ganja hanya tumbuh di pegunungan tropis dengan elevasi di atas 1.000 meter di atas permukaan air laut (BNN, 2015).
Ada tiga jenis ganja yaitu Cannabis sativa, Cannabis indica, dan Cannabis ruderalis. Ketiga jenis ganja ini memiliki kandungan tetrahidrokanabinol (THC) berbeda-beda (BNN, 2015). Kandungan THC didalam Charas dan hashish sekitar 7- 8% dalam rentang sampai 14%. Ganja dan Sinsemilla berasal dari bahan kering dan ditemukan pada pucuk tanaman betina, dimana kandungan THC rata-rata sekitar 4- 5% (jarang diatas 7%). Bhang sediaan tingkat rendah diambil dari tanaman sisa kering, kandungan THC sekitar 1%. Minyak hashish, suatu cairan pekat dari penyulingan hashish, mengandung THC sekitar 15-70% (Camellia, 2010).
Gambar 1. Ganja (Cannabis) (Wikipedia, 2015).
Ganja (Cannabis) digunakan untuk tujuan pengobatan, ritual atau rekreasional. Senyawa ini juga menghasilkan konsekuensi merugikan yang tidak diinginkan yaitu Cannabinoids. Konsentrasi tertinggi dari kanabinoid psikoaktif ditemukan pada puncak bunga dari kedua jenis tanaman jantan (male) dan betina (female). Kannabinoid pada dasarnya berasal dari tiga sumber: (a) Fitokannabinoid adalah senyawa kannabinoid yang diproduksi oleh tanaman Cannabis sativa atau Cannabis indica; (B) Endocannabinoids adalah neurotransmiter yang diproduksi di otak atau di jaringan perifer, dan bekerja pada reseptor kannabinoid; (C) Kannabinoid sintetis, yang disintesis di laboratorium, secara struktural analog dengan fitokannabinoid atau endokannabinoid dan bekerja dengan mekanisme biologis yang serupa (Madras, 2015).
6
2.2 Epidemiologi Ganja
Dari jenis narkotika, secara global, narkoba jenis ganja yang paling banyak digunakan. Prevalensi penyalahgunaan ganja berkisar 2,9%-4,3% per tahun dari populasi penduduk dunia yang berumur 15-64 tahun. Tren legalisasi ganja telah diberlakukan Amerika Serikat di New York dan Colorado, Belanda, Jerman (kepemilikan 6 gram), Argentina, Siprus (15 gram), Ekuador, Meksiko (5 gram), Peru (8 gram), Swiss (4 Batang), Belgia (3 gram), Brazil, Uruguay, Paraguay (10 gram), Kolombia (20 gram), dan Australia (BNN, 2015).
Menurut World Health Organization (WHO), sekitar 25% (147 juta) populasi orang dewasa di seluruh dunia menggunakan ganja untuk alasan rekreasi atau lainnya. Bila digunakan untuk tujuan pengobatan, ganja dianggap sebagai pengobatan alternatif dan komplementer (CAM) karena ini bukan terapi konvensional. Sekitar 40% orang dewasa dengan epilepsi menggunakan CAM membaik karena kurangnya kemanjuran terapi standar, karena efek sampingnya, atau karena alasan lain. Meskipun mayoritas CAM adalah nonfarmakologis (misalnya, meditasi, teknik relaksasi, atau manajemen stres), penggunaan tumbuhan menjadi perhatian khusus. Salah satu tumbuhan yang digunakan oleh pasien epilepsi adalah ganja atau preparat lainnya termasuk minyak hashis (Szaflarski & Bebin, 2014).
2.3 Dampak Penggunaan Ganja (Cannabis)
Penggunaan ganja memilki pengaruh yang buruk terhadap kesehatan fisik maupun psikis (mental). Dari segi fisik ganja dapat menyebabkan kanker paru karena asap ganja mengandung banyak karsinogen sama dengan asap tembakau (Halla &
Degenhardt, 2014). Perokok ganja juga terkait dengan radang pada saluran nafas yang besar, peningkatan hambatan jalan nafas, hiperinflasi paru, perokok ganja lebih cenderung mengalami gejala bronkitis kronis daripada bukan perokok, peningkatan tingkat infeksi pernafasan dan pneumonia (Volkow, et al., 2014).
Penggunaan ganja juga dikaitkan dengan kondisi vaskular yang meningkatkan risiko infark miokard, stroke, dan serangan iskemik transien selama intoksikasi ganja.
Mekanisme yang mendasari efek ganja pada sistem kardiovaskular dan serebrovaskular rumit dan tidak sepenuhnya dipahami. Namun, dampak langsung kannabinoid pada berbagai target reseptor (yaitu reseptor CB1 di pembuluh darah arteri) dan efek tidak langsung pada senyawa vasoaktif dapat membantu menjelaskan efek merugikan ganja pada resistensi vaskular dan mikrosirkulasi koroner (Volkow, et al., 2014).
Ganja juga mempengaruhi fungsi kognitif, defisit dalam pembelajaran verbal, penurunan daya ingat (memori) dan perhatian hal ini dilaporkan pada pengguna ganja berat dan dikaitkan dengan durasi penggunaan, frekuensi penggunaan, dan dosis kumulatif THC. Perubahan struktur otak dilaporkan terjadi di hippocampus, prefrontal cortex (PFC), dan serebellum pada pengguna ganja kronis. Yücel dkk. melaporkan terjadinya pengurangan volume hippocampal dan amigdala dalam 15 pengguna jangka
8
panjang yang telah mengisap 5 atau lebih sehari selama 10 tahun atau lebih.
Pengurangan ini meningkat seiring dengan lamanya pemakaian. Selain menyebabkan masalah fisik ganja juga mempengaruhi kesehatan mental, seperti gangguan bipolar, bunuh diri, depresi, kecemasan dan psikotik (Halla & Degenhardt, 2014).
Dalam dosis intoksikasi yang biasa, ganja menghasilkan rasa nyaman, relaksasi, rasa keramahan, kehilangan kesadaran sementara, termasuk sulit membedakan masa lalu dengan saat ini, memperlambat proses berpikir, penurunan ingatan jangka pendek. Pada dosis tinggi, ganja dapat menyebabkan panik, delirium toksik, dan psikosis (Stahl, 2013).
Tabel 1. Efek samping penggunaan marijuana jangka pendek dan jangka panjang atau pengguna berat (Volkow, et al., 2014).
2.4 Neurofarmakologi Ganja (Cannabis)
Komponen utama ganja adalah Delta-9-tetrahydrocannabinol (Δ9-THC).
Tanaman ganja mengandung lebih dari 400 bahan kimia, dimana sekitar 60 secara kimia berhubungan dengan Δ9-THC. Pada manusia, Δ9-THC diubah dengan cepat menjadi 11-hidroksi-Δ9-THC, metabolit yang aktif di sistem saraf pusat (SSP).
10
Reseptor kannabinoid, kelompok reseptor G-protein-linked, terkait dengan protein G (Gi) inhibitor, yang terkait dengan Adenilat Siklase dengan cara penghambatan.
Reseptor kannabinoid ditemukan konsentrasi tertinggi pada ganglia basalis, hippocampus, dan serebelum, dengan konsentrasi yang lebih rendah di korteks serebral. Reseptor ini tidak ditemukan di batang otak, fakta yang konsisten dengan efek minimal ganja pada fungsi pernapasan dan jantung (Sadock, et al., 2015).
Setidaknya ada dua reseptor kannabinoid yang diidentifikasi, CB1 (di otak, digabungkan melalui protein G dan dimodulasi Adenylate Siklase dan saluran ion) dan CB2 (terutama dalam sistem kekebalan tubuh), keduanya merupakan protein metabotropik yang digabungkan dengan G protein. CB1 dan CB2 terlokalisasi terutama masing-masing di otak dan di perifer. CB1 adalah reseptor protein G-G berpasangan yang didistribusikan di SSP, di mana mereka terutama terletak secara presinaptik.
Aktivasi mereka menghambat pelepasan neurotransmitter lain seperti gamma- aminobutyric acid (GABA) dan glutamat. Kedua reseptor tersebut diyakini mengatur waktu dan pelepasan GABA. Relevan dengan psikosis, di korteks serebral dan hipokampus, di mana jumlahnya melimpah, CB1 memodulasi pelepasan GABA di dalam jaringan cholesistokinin yang mengandung interneuron GABAergic. Namun, ganja mengandung lebih dari 70 kannabinoid selain THC, termasuk cannabidiol (CBD), cannabigerol, cannabichromene, cannabidivarin, tetrahydrocannabivarin, dan terpenoid. Banyak dari senyawa ini memiliki efek farmakologis yang berbeda dari THC. THC menghasilkan efek psikoaktifnya melalui kerja di CB1, di mana ia
berfungsi sebagai agonis parsial dengan afinitas sederhana [inhibisi konstan (Ki) = 35- 80 nmol] dan aktivitas intrinsik rendah. CBD penyumbang utama ganja yang tidak menghasilkan euforia, mungkin memiliki efek ansiolitik dan antipsikotik pada studi praklinis dan manusia. Kandungan CBD dari ganja bervariasi dan tingkat CBD yang lebih rendah pada ganja telah dikaitkan dengan tingkat psikosis yang lebih tinggi.
Misalnya, varian ganja Afrika Selatan yang hampir tanpa CBD dikaitkan dengan tingkat psikosis yang lebih tinggi. Dari catatan, CBD telah terbukti dapat menghambat efek psikotimimetik THC. Terakhir, ini menjamin bahwa jumlah kannabinoid sintetis yang merupakan agonis CB1 umumnya lebih tinggi saat digunakan oleh sejumlah besar individu (Wilkinson, et al., 2014).
Bila ganja diisap, efek euforia muncul dalam hitungan menit, puncaknya sekitar 30 menit, dan 2 sampai 4 jam terakhir. Beberapa efek kognitif dan motorik berlangsung 5 sampai 12 jam. Ganja juga bisa dikonsumsi secara oral saat disiapkan dalam makanan, seperti brownies dan kue. Sekitar dua sampai tiga kali lebih banyak ganja harus dikonsumsi secara oral untuk menjadi sekuat ganja yang dikonsumsi dengan menghirup asapnya. Banyak variabel mempengaruhi sifat psikoaktif ganja, termasuk potensi ganja yang digunakan, rute pemberian, teknik merokok, efek pirolisa terhadap kandungan kannabinoid, dosis, pengaturan, dan pengalaman masa lalu, harapan, dan harapan pengguna serta kerentanan biologis yang unik terhadap efek kannabinoid (Sadock, et al., 2015).
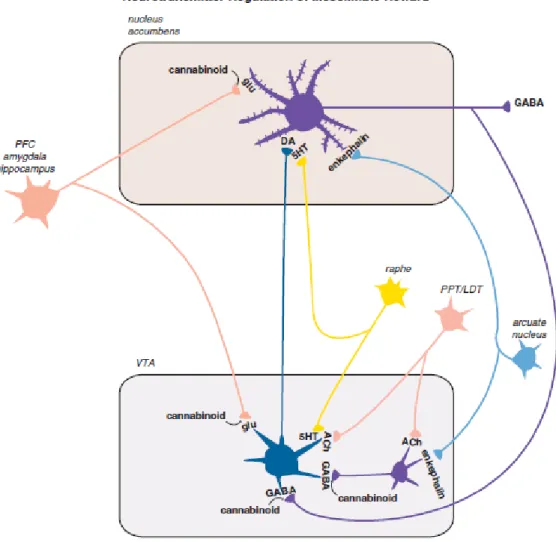
Kerja ganja dan bahan aktifnya Δ9-tetrahydrocannabinol (THC) pada rangkaian reward ada pada reseptor kannabinoid, yang ditunjukkan pada gambar 2,
12
Yang merupakan tempat di mana kannabinoid endogen dimanfaatkan secara alami sebagai neurotransmiter retrograde. Ganja dihisap untuk mengantarkan kannabinoid yang berinteraksi dengan reseptor kannabinoid otak sendiri untuk memicu pelepasan dopamin dari sistem reward mesolimbik (Gambar 2). Reseptor CB1 bisa menjadi perantara tidak hanya sifat penguat ganja, tapi juga alkohol dan sampai batas tertentu sifatnya zat psikoaktif yang lain (termasuk mungkin beberapa makanan). Anandamide adalah salah satu endokannabinoid dan kelompok kimia neurotransmiter yang bukan monoamina, bukan asam amino, dan bukan peptida. Anandamide adalah lipid, khususnya kelompok asam lemak etanolamida. Anandamida memiliki sebagian besar tapi tidak semua sifat farmakologis THC, karena kerjanya reseptor kannabinoid pada otak tidak hanya oleh THC namun sebagian antagonis oleh kannabinoid otak selektif antagonis reseptor CB1 (Stahl, 2013).
Gambar 2. Pengaturan neurotransmitter sistem reward mesolimbik (Stahl, 2013).
Jalur sistem reward akhir umum di otak dihipotesiskan melalui jalur dopamin mesolimbik. Jalur ini dimodulasi oleh banyak zat alami di otak untuk memberi penguatan normal pada perilaku adaptif (seperti makan, minum, seks) dan dengan demikian menghasilkan "natural highs” seperti perasaan gembira atau prestasi.
Neurotransmiter ini masuk ke sistem reward meliputi morfin / heroin otak sendiri (yaitu endorfin seperti enkephalin), ganja/ganja otak (yaitu anandamide), nikotin otak sendiri
14
(yaitu asetilkolin), dan kokain otak sendiri/amfetamin (yaitu, dopamin itu sendiri).
Banyak penyalahgunaan obat psikotropika yang terjadi di jalur bypass neurotransmiter otak sendiri dan secara langsung merangsang reseptor otak dalam sistem reward, yang menyebabkan pelepasan dopamin dan konsekuen "artificial high". Jadi alkohol, opioid, stimulan, ganja, benzodiazepin, hipnotik sedatif, halusinogen, dan nikotin semuanya mempengaruhi sistem dopaminergik mesolimbik ini (Stahl, 2013).
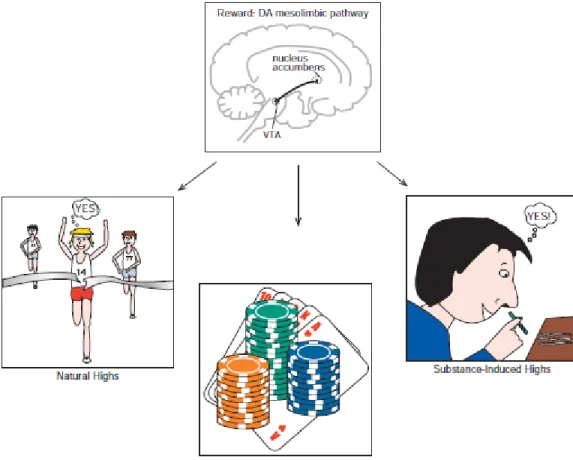
Gambar 3. Dopamin sebagai pusat sistem reward (Stahl, 2013).
Dopamin (DA) telah lama dikenal sebagai pemain utama dalam pengaturan penguatan dan penghargaan (reward). Secara khusus, jalur mesolimbik dari daerah tegmental ventral (VTA) ke nukleus accumbens nampaknya sangat penting untuk
sistem reward. Aktivitas yang menguntungkan secara alami, seperti mencapai prestasi besar atau menikmati makanan enak, dapat menyebabkan peningkatan cepat dan kuat di DA di jalur mesolimbik. Penyalahgunaan obat juga menyebabkan pelepasan DA di jalur mesolimbik. Sebenarnya, obat-obatan dari penyalahgunaan seringkali dapat meningkatkan dopamin dengan cara yang lebih eksplosif dan menyenangkan daripada yang terjadi secara alami. Sayangnya, tidak seperti peningkatan alami, aktivasi yang disebabkan oleh penyalahgunaan obat pada akhirnya dapat menyebabkan perubahan pada sirkuit reward yang terkait dengan lingkaran setan preokupasi, kecanduan, ketergantungan, dan withdrawl. Konsep ini memiliki kesamaan dengan banyak gangguan kompulsif impulsif seperti judi patologis. Artinya, individu dengan gangguan ini mengalami ketegangan dan gairah dalam mengantisipasi perilaku dan mood disforik (tapi tidak ada penarikan fisiologis) bila dicegah melakukan perilaku tersebut. Selain itu, kesenangan dan kepuasan yang pada awalnya dialami saat melakukan perilaku tampaknya berkurang seiring berjalannya waktu, mungkin memerlukan peningkatan "dosis" (misalnya, perjudian dengan jumlah dolar lebih tinggi) untuk mencapai efek yang sama (mirip dengan toleransi) (Stahl, 2013).
Disfungsi dopaminergik terkait dengan ketergantungan obat dan psikosis.
Peningkatan kapasitas sintesis dan pelepasan dopamin telah dilaporkan pada pasien psikotik, obat-obatan yang meningkatkan pelepasan dopamin dapat menyebabkan atau memperburuk psikosis, dan peningkatan kapasitas sintesis dopamin telah dilaporkan secara yang jujur oleh orang-orang yang berkembang menjadi gangguan psikotik.
16
Pasien dengan psikosis akibat ganja memiliki metabolit dopamin perifer yang lebih tinggi, dan sebuah laporan kasus menemukan terdapat pelepasan dopamin striatal dan gejala eksaserbasi pada pasien skizofrenia setelah penggunaan ganja. Dengan demikian, ganja telah diusulkan untuk meningkatkan risiko psikosis dengan menyebabkan hiperdopaminergia striatal (Murray, et al., 2014). Pengguna ganja reguler yang peka terhadap efek ganja akan menunjukkan peningkatan kapasitas sintesis dopamin yang meningkat, dan ini akan terkait langsung dengan tingkat keparahan gejala psikotik seperti ganja (Bloomfield, et al., 2014).
2.5 Gangguan Psikotik akibat Penggunaan Ganja (Cannabis)
Etiologi kelainan psikotik, seperti skizofrenia, tetap sulit dipahami. Meskipun tidak mungkin ada satu penyebab skizofrenia, sejumlah faktor genetik dan lingkungan telah diidentifikasi dapat menyebabkan risiko psikosis. Salah satu faktor lingkungan yang mendapat perhatian karena berkontribusi terhadap risiko gangguan psikotik adalah terpapar ganja. Perlu dicatat bahwa sebagian besar individu yang terpapar ganja tidak berkembang menjadi psikosis dan kebanyakan individu dengan gangguan psikotik mungkin tidak pernah terpapar ganja. Dengan demikian, ganja tidak perlu dan tidak cukup untuk menyebabkan skizofrenia. Kemungkinan besar, ganja dapat berkontribusi menyebabkan psikosis pada individu yang rentan (Wilkinson, et al., 2014).
Gangguan psikotik akibat cannabis didiagnosis dengan adanya psikosis akibat cannabis. Gangguan psikotik cannabis jarang terjadi; ide paranoid transien lebih sering terjadi. Florid psychosis agak umum terjadi di negara-negara di mana beberapa orang memiliki akses jangka panjang ke ganja dengan potensi tinggi. Episode psikotik kadang-kadang disebut sebagai “hemp insanity" penggunaan ganja jarang menyebabkan pengalaman "bad-trip", yang sering dikaitkan dengan intoksikasi halusinogen. Bila gangguan psikotik ganja tidak terjadi, hal itu mungkin berkorelasi dengan gangguan kepribadian yang sudah ada sebelumnya pada orang yang terkena dampak (Sadock, et al., 2015).
Gejala Positif
Ekstrak ganja mengandung sejumlah THC yang dapat menghasilkan gejala positif transien, yang secara kualitatif mirip dengan gejala positif skizofrenia. Gejala ini termasuk kecurigaan, paranoid dan waham kebesaran, disorganisasi konseptual, pemikiran yang terfragmentasi dan perubahan persepsi. Selain itu ganja dan THC juga mengakibatkan depersonalisasi, derealisasi, perubahan dalam persepsi sensorik dan perasaan tak nyata. Efek ini secara konsisten telah ditunjukkan oleh rokok ganja, ekstrak ganja oral/THC (dosis 5-20mg), THC intravena (kisaran dosis 0,015-0,03 mg/kg) dan melalui saluran pernapasan dengan vaporizer (Radhakrishnan, et al., 2014).
18
Gejala Negatif
Delta-9-tetrahydrocannabinol juga menghasilkan berbagai efek yang sama dengan gejala negatif skizofrenia, termasuk afek tumpul, penarikan emosional diri, retardasi psikomotor, kurangnya spontanitas dan berkurangnya interaksi. Morrison et al menunjukkan bahwa efek dari THC pada gejala negatif tidak bergantung pada efek sedasi (Radhakrishnan, et al., 2014).
Salah satu komplikasi penggunaan jangka panjang adalah "sindrom amotivasional"
pada pengguna yang berat. Sindrom ini terlihat terutama pada pengguna sehari-hari yang berat dan ditandai dengan munculnya dorongan dan ambisi yang menurun, sehingga "amotivasional." Hal ini juga terkait dengan gejala gangguan sosial dan pekerjaan lainnya, termasuk rentang perhatian yang singkat, penilaian yang buruk, gangguan kemampuan komunikasi, introversi dan berkurangnya efektivitas dalam situasi interpersonal. Kebiasaan pribadi bisa memburuk, dan mungkin ada kehilangan wawasan, dan bahkan perasaan depersonalisasi (Stahl, 2013).
Penurunan Kognitif
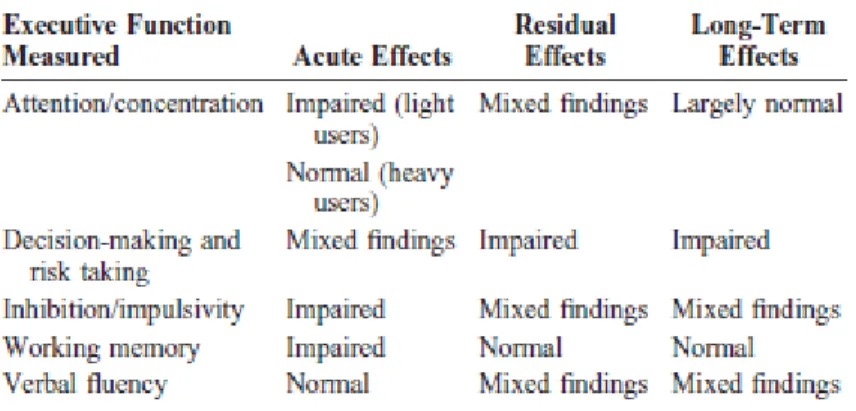
Kannabis, THC dan kannabinoid sintetis lainnya juga menyebabkan gangguan kognitif sementara, yang berhubungan dengan dosis, terutama pada pembelajaran verbal, memori jangka pendek, fungsi eksekutif, kemampuan abstrak, pengambilan keputusan, perhatian dan konsentrasi (Radhakrishnan, et al., 2014). Penggunaan ganja akut umumnya menyebabkan gangguan pada aspek perencanaan dan pengambilan
keputusan, misalnya kecepatan respons, akurasi, dan latency. Beberapa penelitian juga menemukan peningkatan risiko dengan dosis ganja yang lebih tinggi. Efek akut menunjukkan 0-6 jam setelah penggunaan ganja terakhir; Efek residu menunjukkan 7 jam sampai 20 hari setelah pemakaian ganja terakhir; Dan efek jangka panjang menunjukkan 3 minggu atau lebih lama setelah penggunaan ganja terakhir (Crean, et al., 2011).
Tabel 2. Pengaruh ganja terhadap fungsi eksekutif (Crean, et al., 2011)
Sollowij dan Battisti menyimpulkan bahwa penggunaan ganja berat dan kronis dikaitkan dengan gangguan memori yang berlangsung diluar periode intoksikasi akut dan terkait dengan frekuensi, durasi, dosis dan usia onset dari penggunaan ganja (Radhakrishnan, et al., 2014).
Sebuah studi menunjukkan tidak adanya defisit persisten neuropsikologi pada pengguna ganja jangka panjang setelah 28 hari abstinen, penelitian lain menunjukkan durasi untuk pemulihan penuh mulai dari seminggu sampai 28 hari, untuk 3 bulan
20
abstinen dengan beberapa penelitian menunjukkan pemulihan setelah rata-rata 2 tahun abstinen (Radhakrishnan, et al., 2014).
Terdapat beberapa faktor yang memperngaruhi hubungan antara ganja dengan terjadinya psikotik, antara lain :
a. Lamanya paparan
Penggunaan ganja secara teratur telah dikaitkan dengan gejala psikotik seperti pemikiran tidak teratur (disorganized), halusinasi, dan delusi. Bukti epidemiologis menunjukkan bahwa semakin muda terpapar ganja, semakin besar resiko terjadinya psikotik. Drag et al menunjukkan bahwa usia yang lebih muda pada onset pengunaan ganja dikaitkan dengan gejala awal dari kecemasan, penarikan diri, derealisasi, gangguan memori dan kesulitan konsentrasi. Ganja dapat memperngaruhi proses perkembangan dan pematangan otak (Radhakrishnan, et al., 2014).
Sebuah penelitian melakukan follow up selama 15 tahun dari 50.465 wajib militer pria Swedia menemukan bahwa mereka yang telah mencoba ganja pada usia 18 tahun memilki kemungkinan 2-4 kali didiagnosis skizofrenia daripada mereka yang tidak. Mereka yang telah menggunakan ganja 10 kali atau lebih pada usia 18 tahun 2-3 kali lebih mungkin didiagnosis skizofrenia daripada mereka yang tidak melakukannya (Wilkinson, et al., 2014).
b. Riwayat keluarga dan genetik
Studi awal menunjukkan bahwa riwayat keluarga positif skizofrenia dapat meningkatkan resiko gangguan psikotik yang diinduksi ganja. Faktor genetik
memaparkan tentang kerentanan psikotik oleh karena paparan ganja yaitu interakti gen-lingkungan. Secara khusus Catechol-O-methyltransferase (COMT) dan AKT1 telah terlibat dalam menyebabkan kerentanan psikosis (Radhakrishnan, et al., 2014).
Catechol-O-methyltransferase (COMT)
Enzim COMT memainkan peran penting dalam pemecahan dopamine di prefrontal cortex (PFC), berbeda dengan striatum dimana dopamine (DA) dibersihan dengan transporter. Gen COMT mengkodekan enzim catechol-O-methyltransferase, yang berperan penting dalam degradasi dopamin di otak, dan mengandung polimorfisme fungsional (COMTVal158Met) yang menghasilkan dua varian umum enzim (Val dan Met). Varian Val dikaitkan dengan aktivitas COMT yang meningkat, yang menghasilkan kombinasi penurunan neurotransmfikasi dopamin di korteks prefrontal dan peningkatan kadar dopamin di daerah mesolimbik.
Individu yang membawa genotipe Met/Met homozigot memiliki aktivitas COMT terendah Val/Val homozigot memiliki tingkat dopamine terrendah dan heterozigot dianggap sebagai aktivitas intermediate, karena kedua alel tersebut bersifat codominant (Alemany, et al., 2014).
COMT memiliki kesamaan polimorfisme pada manusia, yang menghasilkan aktivitas enzim 40% lebih tinggi dan degradasi dopamine lebih cepat ketika Valin diganti dengan Metionin (Met) di lokus 158/108.; Rendahnya kadar dopamin kortikal pada individu homozigot untuk polimorfisme Val (158) terkait dengan kinerja kognitif yang buruk dan prekortikal yang tidak berfungsi efisien. Terdapat
22
bukti bahwa individu dengan polimorfisme Val gen COMT (Val158Met) memiliki kesempatan tinggi untuk menjadi psikotik akut dalam merespon paparan THC (Radhakrishnan, et al., 2014).
AKT1
AKT1 adalah gen lain yang memainkan peran dalam hubungan antara ganja dengan gangguan psikotik. Fungsi AKT1 untuk menonaktifkan glikogen sintase kinase (GSK-3) dengan fosforilasi. Interaksi AKT1 dan GSK-3 berperan dalam sejumlah proses seluler penting yaitu, proliferasi sel, apoptosis dan transkripsi.
Penelitian in vitro telah menunjukkan bahwa kannabinoid mampu merangsang jalur AKT1 melalui reseptor CB1 dan CB2. Pada studi postmortem menunjukkan penurunan kadar AKT1 di PFC pasien skizofrenia (Radhakrishnan, et al., 2014).
c. Riwayat Child Abuse
Beberapa penelitian menunjukkan hubungan yang signifikan antara penggunaan ganja dengan child abuse yang berkembang menjadi gejala psikotik (Radhakrishnan, et al., 2014). Dalam konteks ini, penggunaan ganja dan kesulitan masa kanak-kanak telah dikaitkan dengan peningkatan risiko menjadi psikosis pada sampel klinis dan non-klinis. Namun, tidak semua orang yang terpapar kesulitan masa kecil berkembang menjadi gejala psikotik di kemudian hari.
Demikian pula, hanya sebagian kecil pengguna ganja yang menjadi psikotik yang menunjukkan implikasi faktor lain dalam kaitan ini. Dalam hal ini, beberapa penelitian telah menunjukkan bahwa keterpaparan bersama terhadap dua faktor lingkungan, penggunaan ganja dan kesulitan masa kecil, dapat meningkatkan
kemungkinan gejala psikotik sampai tingkat yang lebih tinggi daripada risiko yang diharapkan untuk setiap faktor yang bekerja secara independen (Alemany, et al., 2014).
Secara neurobiologis hal ini masuk akal, karena pengalaman stres dan delta-9- tetrahydrocannabinol (THC), mampu meningkatkan sinyal dopaminergik dalam sistem mesolimbik, yang menghasilkan peningkatan risiko delusi dan halusinasi.
Sebuah bukti menunjukkan bahwa sensitivitas diferensial terhadap stres lingkungan disebabkan oleh polimorfisme Val158Met gen gen katekol-O metiltransferase (COMT), mungkin dalam interaksi dengan faktor-faktor lain, mungkin merupakan risiko psikosis yang mendasarinya (Alemany, et al., 2014).
24 BAB III RINGKASAN
Ketergantungan dan penyalahgunaan zat bukan merupakan masalah baru di Indonesia. Dewasa ini, diperkirakan di Indonesia terdapat peningkatan jumlah penyalahgunaan Narkotika, Psikotropika dan Zat Adiktif lainnya (NAPZA) dari tahun ke tahun. Dari jenis narkotika, secara global, narkoba jenis ganja yang paling banyak digunakan. Prevalensi penyalahgunaan ganja berkisar 2,9%-4,3% per tahun dari populasi penduduk dunia yang berumur 15-64 tahun.
Ganja (Cannabis) adalah nama singkatan untuk tanaman Cannabis sativa.
Istilah ganja umumnya mengacu kepada pucuk daun, bunga dan batang dari tanaman yang dipotong, dikeringkan dan dicacah dan biasanya dibentuk menjadi rokok. Nama lain untuk tanaman ganja adalah marijuana, grass, weed, pot, tea, Mary jane dan produknya hemp, hashish, charas, bhang, ganja, dagga dan sinsemilla
Penggunaan ganja memilki pengaruh yang buruk terhadap kesehatan fisik (pada saluran pernafasan dan kardiovaskuler) maupun psikis (mental). Ganja juga mempengaruhi fungsi kognitif, defisit dalam pembelajaran verbal, penurunan daya ingat (memori), dan perhatian. Selain menyebabkan masalah fisik ganja juga mempengaruhi kesehatan mental, seperti gangguan bipolar, bunuh diri, depresi, kecemasan dan psikotik (Halla & Degenhardt, 2014).
Komponen utama ganja adalah Delta-9-tetrahydrocannabinol (Δ9-THC), setidaknya ada dua reseptor cannabinoid yang diidentifikasi, CB1 (di otak, digabungkan melalui protein G dan dimodulasi Adenylate Siklase dan saluran ion) dan CB2 (terutama dalam sistem kekebalan tubuh). Aktivasi mereka menghambat pelepasan neurotransmitter lain seperti gamma-aminobutyric acid (GABA) dan glutamat. Kedua reseptor tersebut diyakini mengatur waktu dan pelepasan GABA.
Relevan dengan psikosis, di korteks serebral dan hipokampus, di mana jumlahnya melimpah, CB1 memodulasi pelepasan GABA di dalam jaringan cholesistokinin yang mengandung interneuron GABAergic.
Sejumlah faktor genetik dan lingkungan dapat menyebabkan risiko psikotik telah diidentifikasi misalnya terpapar ganja. Sebagian besar individu yang terpapar ganja tidak berkembang menjadi psikosis dan kebanyakan individu dengan gangguan psikotik mungkin tidak pernah terpapar ganja. Kemungkinan besar, seperti diulas di bawah ini, ganja dapat berkontribusi menyebabkan psikosis pada individu yang rentan.
Faktor yang memperngaruhi hubungan antara ganja dengan terjadinya psikotik, antara lain lamanya paparan (semakin muda terpapar ganja, semakin besar resiko terjadinya psikotik), riwayat keluarga dan genetik (Catechol-O-methyltransferase (COMT) dan AKT1 telah terlibat dalam menyebabkan kerentanan psikosis), riwayat Child Abuse (pengalaman stres dan delta-9-tetrahydrocannabinol (THC), mampu meningkatkan sinyal dopaminergik dalam sistem mesolimbik, yang menghasilkan peningkatan risiko delusi dan halusinasi).
26
DAFTAR PUSTAKA
Alemany, S. et al., 2014. Psychosis-inducing effects of cannabis are related to both childhood abuse and COMT genotypes. Acta Psychiatrica Scandinavica, 129(1).
Bloomfield, M. et al., 2014. Dopaminergic Function in Cannabis Users and Its Relationship to Cannabis-Induced Psychotic Symptoms. Biological Psychitry, 75(6).
BNN, 2015. Badan Narkotika Nasional. [Online]
Available at:
http://dedihumas.bnn.go.id/read/section/artikel/2012/04/02/354/ulasan- tentang-ganja
[Accessed 13 Juni 2017].
BNN, 2015. portal Badan Narkotika Nasional. [Online]
Available at:
http://www.bnn.go.id/portal/_uploads/post/2014/08/19/Jurnal_Data_P4GN_20 13_Edisi_2014_Oke.pdf
[Accessed 13 Juni 2017].
Camellia, V., 2010. Gangguan Sehubungan Kanabis. Medan: Departemen Psikiatri FK USU.
Crean, R. D., Crane, N. A. & Mason, B. J., 2011. An Evidence-Based Review of Acute and Long-Term Effects of Cannabis Use on Executive Cognitive Functions.
Journal of Addiction Medicine, 5(1).
Depkes, 2000. Pedoman Terapi Pasien Ketergantungan Narkotika dan Zat Adiktif Lainnya. Jakarta: Departemen Kesehatan Republik Indonesia.
Halla, W. & Degenhardt, L., 2014. The adverse health effects of chronic cannabis use.
Drug Testing and Analysis, 6(1), pp. 1-2.
Husin, A. B. & Siste, K., 2013. Gangguan Penggunaan Zat. In: S. D. Elvira & G.
Hadisukanto, eds. Buku Ajar Psikiatri. Jakarta: Badan Penerbit FKUI, p. 143.
Madras, B. K., 2015. Update of Cannabis and its medical use. World Health Organization.
Murray, R. M., Mehta, M. & Forti, M. D., 2014. Different Dopaminergic Abnormalities Underlie Cannabis Dependence and Cannabis-Induced Psychosis. Biological Psychiatry, 75(6).
Radhakrishnan, R., Wilkinson, S. T. & D’Souza, D. C., 2014. Gone to pot – a review of the association between cannabis and psychosis. Frontier in Psychiatry, 5(54).
Sadock, B. J., Sadock, V. A. & Ruiz, P., 2015. Substance Use and Addictive Disorders.
In: C. S. Pataki & N. Sussman, eds. Synopsis Of Psychiatry : Behavioral Sciences / Clinical Psychiatry. New York: Wolters Kluwer, p. 644.
Stahl, S. M., 2013. Stahl’s Essential Psychopharmacology : Neuroscientific Basis and Practical Application. 4 ed. New York: Cambridge University Press.
Szaflarski, J. P. & Bebin, E. M., 2014. Cannabis, cannabidiol, and epilepsy — From receptors to clinical response. Epilepsy & Behavior, Volume 41.
Volkow, N. D., Baler, R. D., Compton, W. M. & Weiss, S. R., 2014. Adverse Health Effects of Marijuana Use. The new england journal of medicine, 370(23).
Wikipedia, 2015. Wikipedia. [Online]
Available at: https://en.wikipedia.org/wiki/Cannabis_and_religion [Accessed 13 Juni 2017].
28
Wilkinson, S. T., Radhakrishnan, R. & D’Souza, D. C., 2014. Impact of Cannabis Use on the Development of Psychotic Disorders. Springer International Publishing, Issue 1, p. 115–128.