VERIFIKASI METODE BIOANALISIS ASAM SALISILAT DALAM PLASMA DARAH DENGAN MENGGUNAKAN LC-MS/MS
OLEH
FRANSISKUS HARRY SUBAGYO NPM P2.48.40.4.21.042
JURUSAN ANALISIS FARMASI DAN MAKANAN POLITEKNIK KESEHATAN KEMENKES JAKARTA II
2024
VERIFIKASI METODE BIOANALISIS ASAM SALISILAT DALAM PLASMA DARAH DENGAN MENGGUNAKAN LC-MS/MS
Karya Tulis Ilmiah Ini Diajukan sebagai Syarat Untuk Memperoleh Gelar Ahli Madya Analis Farmasi dan Makanan
OLEH
FRANSISKUS HARRY SUBAGYO NPM P2.48.40.4.21.042
JURUSAN ANALISIS FARMASI DAN MAKANAN POLITEKNIK KESEHATAN KEMENKES JAKARTA II
2024
LEMBAR PERSETUJUAN
Karya Tulis Ilmiah dengan judul
“Verifikasi Metode Bioanalisis Asam Salisilat dalam Plasma Darah Menggunakan LC-MS/MS”
Disusun oleh : Fransiskus Harry Subagyo
NPM P2.84.04.21.042
Telah disetujui untuk dipertahankan di hadapan Tim Penguji Karya Tulis Ilmiah Jurusan Analisis Farmasi dan Makanan Politeknik Kesehatan Kementerian Kesehatan Jakarta II dalam rangka Ujian Akhir Program untuk memenuhi syarat guna memperoleh Gelar Ahli Madya Analis Farmasi dan Makanan.
Jakarta, Juni 2023
Pembimbung Utama, Pembimbing Pendamping,
Joko Sulistiyo, S.T., M.Si.
NIP 196811221989031002
Patimah, S.Si., M.Farm., Apt NIP
LEMBAR PENGESAHAN
Karya Tulis Ilmiah dengan Judul
“Verifikasi Metode Bioanalisis Asam Salisilat dalam Plasma Darah Menggunakan LC-MS/MS”
Disusun Oleh : Fransiskus Harry Subagyo
NPM P2.84.04.21.042
Telah dipertahankan di hadapan Tim Penguji Karya Tulis Ilmiah Jurusan Analisis Farmasi dan Makanan Politeknik Kesehatan Kementerian Kesehatan Jakarta II dalam rangka Ujian Akhir Program untuk memenuhi syarat guna memperoleh Gelar Ahli Madya Analis Farmasi dan Makanan.
Ketua
Dodi Irwandi, M.Si NIP 198102112006041005
Jakarta, Juni 2023 Tim Penguji :
Anggota :
1. Joko Sulistiyo, S.T., M.Si.
NIP
196811221989031002
2. Patimah, S.Si., M.Farm., Apt NIP
ABSTRACT
Fransiskus Harry Subagyo “Verification of Bioanalysis Method of Salicylic Acid in Blood Plasma by Using LC-MS/MS”, under the guidance of Joko Sulistiyo, S.T., M.Si. and Patimah, S.Si., M.Farm., APT., 2024.
Aspirin is a non-steroidal anti-inflammatory drug which also has antiplatelet effects for stroke prevention. Aspirin in the body breaks down very easily into salicylic acid as the main metabolite. Verification of a bioanalysis method for drugs in blood plasma needs to be carried out for reconfirmation so that the resulting data remains valid. This test aims to verify the Salicylic Acid Bioanalysis method for routine testing which refers to the Europan Medicine Agency in 2011. This test method uses the Protein Precipitation Extraction method with an organic solvent, namely acetonitrile in 0.1% formic acid as a precipitator and diluted with acetonitrile. This test uses an Agilent Poroshell 120 EC-C18(2.7µm) 3.0mm x 50.0mm LC-MS/MS column instrument, mobile phase Acetonitrile and Ammonium Acetate (75:25) with isotactic isolation, column temperature 35°C, flow rate 0.20 mL/Minute, and Celecoxib as Internal standard. Mass detection was carried out with Electrospray Ionization (ESI) type TQ-S Micrp LC in Multiple Reaction Monitoring (MRM) electrode (ESI+) mode. Salicylic Acid was detected at 137.00 93.00 and Celecoxib was detected at 379.93 316.00. The verification parameters tested were accuracy and precision with results of % Dev 7.34% Low Limit of Quantification (LLOQ), 3.56% Quality Control Low (QCL), 3.02% Quality Control Medium (QCM), 0.97% Quality Control High (QCH) and % CV results 6.56% Low Limit of Quantification (LLOQ), 2.03% Quality Control Low (QCL), 5.72% Quality Control Medium (QCM), 3.39% Quality Control High (QCH) so it can be concluded that the Salicylic Acid bioanalysis method meets the requirements based on the 2011 Europan Medicines Agency (EMA) and can be used for routine analysis.
Keywords: salicylic acid, analytical method, bioequivalence, blood plasma, method verification, LC-MS/MS
ABSTRAK
Fransiskus Harry Subagyo “Verifikasi Metode Bioanalisis Asam Salisilat dalam Plasma Darah dengan Menggunakan LC-MS/MS”, dibawah bimbingan Joko Sulistiyo, S.T., M.Si. and Patimah, S.Si., M.Farm., APT., 2024
Aspirin merupakan obat antinflamasi non steroid yang juga mempunyai efek antiplatelet untuk pencegahan stroke. Aspirin di dalam tubuh, sangat mudah terurai menjadi asam salisilat sebagai metabolit utama. Verifikasi suatu metode bioanalisis obat dalam plasma darah perlu dilakukan untuk konfirmasi ulang sehingga data yang dihasilkan tetap valid.
Pengujian ini bertujuan untuk memverifikasi metode Bioanalisis Asam Salisilat untuk pengujian rutin yang mengacu pada Europan Medicine Agency tahun 2011. Metode Pengujian ini menggunakan metode Ekstraksi Pengendapan Protein dengan pelarut organik yaitu asetonitril dalam asam format 0,1% sebagai pengendap dan diencerkan dengan asetonitril. Pengujian ini menggunakan instrument LC-MS/MS kolom Agilent Poroshell 120 EC-C18(2.7µm) 3.0mm x 50.0mm, fase gerak Asetonitril dan Amonium Asetat (75:25) dengan isolusi isokraktik, suhu kolom 35°C, laju alir 0.20 mL/Menit, dan Celecoxib sebagai Internal standar. Deteksi massa dilakukan dengan Electrospray Ionization (ESI) tipe TQ-S Micrp LC dalam mode Multiple Reaction Monitoring (MRM) elektroda (ESI+). Asam Salisilat terdeteksi pada 137,00 93,00 dan Celecoxib terdeteksi pada 379,93 316,00. Parameter verifikasi yang diuji yaitu akurasi dan presisi dengan hasil % Dev 7,34% Low Limit of Quantification (LLOQ), 3,56% Quality Control Low (QCL), 3,02% Quality Control Medium (QCM), 0,97% Quality Control High (QCH) dan hasil % CV 6,56% Low Limit of Quantification (LLOQ), 2,03% Quality Control Low (QCL), 5,72% Quality Control Medium (QCM), 3,39% Quality Control High (QCH) sehingga dapat disimpulkan metode bioanalisis Asam Salisilat memenuhi syarat berdasarkan Europan Medicines Agency (EMA) tahun 2011 dan dapat digunakan untuk analisis rutin.
Kata Kunci: asam salisilat, metode analisis, bioekivalensi, plasma darah, verifikasi metode, LC-MS/MS
KATA PENGHANTAR
Puji dan syukur penulis panjatkan kehadirat Allah SWT, yang telah melimpahkan rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan Karya Tulis Ilmiah (KTI) ini. Adapun judul KTI ini adalah “JUDUL”.
Karya Tulis Ilmiah ini dibuat untuk memenuhi salah satu syarat kelulusan untuk memperoleh gelar Ahli Madya Kesehatan di Poltekkes Kemenkes Jakarta II Jurusan Analisis Farmasi dan Makanan.
Pada kesempatan kali ini penulis menyampaikan terimakasih terutama kepada:
1. Kedua orang tua penulis Bapak Sentot Prawiro Subagyo dan Ibu Mintju yang selalu memberikan kasih sayang, do’a, dan motivasi dalam setiap langkah hidup penulis.
2. Ibu Ai Emalia Sukmawati, S.Farm., M.Si selaku Ketua Jurusan Analisis Farmasi dan Makanan.
3. Bapak Joko Sulistiyo, S.T., M.Si. selaku pembimbing utama dan Ibu Patimah, S.Si., M.Farm., Apt. selaku pembimbing pendamping yang banyak meluangkan waktu untuk memberikan arahan dan membantu penyusunan Karya Tulis Ilmiah ini.
4. Bapak Andi Darmawan S.I.Kom selaku pembimbing Praktik Kerja Lapangan dan seluruh Kakak-kakak analis yang telah memberikan banyak ilmu dan pengetahuan kepada penulis beserta staff di PT. Biometrik Riset Indonesia.
5. Bapak/Ibu Dosen dan Staf Jurusan Analisis Farmasi dan Makanan Politeknik Kesehatan Kemenkes Jakarta II.
6. Semua pihak yang tidak bisa penulis sebutkan namanya satu per satu yang telah berperan dalam membantu dan selalu memberikan doa, semangat, dan motivasi kepada penulis.
Penulis menyadari bahwa dalam penulisan KTI ini masih banyak kekurangan, untuk itu saran dan kritik yang membangun sangat penulis harapkan.
Akhir kata penulis berharap semoga pengujian ini dapat bermanfaat bagi penulis maupun rekan-rekan lainnya.
Jakarta, Febuari 2024
i
Penulis
LEMBAR PERSETUJUAN LEMBAR PENGESAHAN ABSTRACT
ABSTRAK
DAFTAR ISI Halaman
KATA PENGHANTAR ... i
DAFTAR ISI ... iii
DAFTAR TABEL ... iii
DAFTAR GAMBAR ... iv
DAFTAR LAMPIRAN ... v
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Pembatasan Masalah ... 3
1.4 Tujuan ... 3
1.4.1 Tujuan Umum ... 3
1.4.2 Tujuan Khusus ... 3
1.5 Manfaat ... 3
1.5.1 Bagi Mahasiswa ... 3
1.5.2 Bagi Masyarakat ... 3
BAB II TINJAUAN PUSTAKA ... 4
BAB III METODE PENGUJIAN ... 22
BAB IV HASIL PENGUJIAN DAN PEMBAHASAN ... 34
BAB V SIMPULAN DAN SARAN ... 44
5.1 Simpulan ... 44
5.2 Saran ... 44
DAFTAR PUSTAKA ... 45
LAMPIRAN ... 47
DAFTAR TABEL
No. Nama Tabel Halaman
iii
DAFTAR GAMBAR
DAFTAR LAMPIRAN
No. Nama Lampiran Halaman
BAB I PENDAHULUAN 1.1 Latar Belakang
Obat analgetik antipiretik sering digunakan dalam pengobatan sendiri untuk mengatasi rasa nyeri dan demam. Analgetik yang sering dikenal dengan obat pereda nyeri merupakan obat yang memiliki kemampuan untuk meredakan nyeri pada tubuh, sedangkan antipiretik merupakan obat yang sering digunakan untuk menurunkan demam dari suhu tubuh yang tinggi ke suhu tubuh yang normal.
Namun jika obat analgetik dan obat antipiretik dikonsumsi secara tidak tepat (tidak rasional), mungkin dapat memiliki resiko efek samping yang negatif seperti reaksi hemodinamik termasuk hipotensi, penurunan fungsi hati dan ginjal yang terjadi dengan penggunaan jangka panjang. Selain efek samping analgetik dapat mengganggu fungsi hati, ginjal, saluran cerna, pankreas, dan memicu reaksi hipersensitivitas pada beberapa orang.(pendahuluan as 5).
Obat golongan salisilat merupakan salah satu obat yang paling sering digunakan karena mempunyasi sifat analgesic, antipiretik, antiinflamasi, antireumatik, dan yang paling mutakhir adalah sebagai antiagregasi trombosit (antitrombotik) atau antiplatelet. Salisilat tersedia dalam berbagai bentuk sediaan obat, diantaranya topical, tablet, serbuk, dan supositoria. Selain bentuk regular, salisilat juga tersedia dalam bentuk tablet salut selaput yang diharapkan akan mengalami disolusi dalam usus halus.(penahuluan asam salisilat 2)
Obat golongan asam salisilat yang paling banyak digunakan adalah aspirin (asam asetil salisilat). Sampai saat ini obat ini masi merupakan analgesic- antipiretik dan antiinflamasi yang paling banyak diresepkan dan menjadi standar untuk pembanding atau evaluasi antiinflamasi lainnya. .(penahuluan asam salisilat 2)
Aspirin merupakan golongan obat antiinflamasi non steroid (AINS) yang memiliki efek analgesik, antipiretik, dan antiinflamasi. Indikasinya yaitu nyeri (ringan-sedang), antiplatelet pada terapi kardiovaskular dan stroke, rheumatoid artritis, osteoarthritis, dan gout.3,4,5 Mekanisme kerja dari aspirin yaitu menghambat enzim siklooksigenase (COX) terutama siklooksigenase-1 (COX-1) sehingga terjadi penghambatan biosintesis prostaglandin dan tromboksan dari asam arakhidonat.(spendahuluan salisilat4)
Aspirin dalam pengunaannya untuk analgesik, anti inflamasi dan antipiretik yang sangat luas penggunaannya. Dalam dosis rendah, aspirin digunakan sebagai
6
zat antitrombosis untuk mencegah agregasi penghambatan enzim platelet melalui siklooksigenase. Aspirin diabsorpsi secara cepat di saluran pencernaan bagian atas, terutama di bagian pertama duodenum.1,2 Setelah pemberian secara oral, aspirin terhidrolisis secara cepat di dalam tubuh menghasilkan asam salisilat sebagai metabolit utama.3 Bioavailabilitas aspirin rendah akibat first pass effect metabolism dan hidrolisis menjadi salisilat di dinding usus.4 Banyak penelitian melaporkan bioavailabilitas aspirin dalam bentuk asam salisilat.5 Oleh karena itu, pemantauan asam salisilat sebagai metabolit utama dalam darah bersama-sama aspirin sangat diperlukan untuk menentukan profil farmakokinetik aspirin.
(pendahuluan asam salisilat 1)
Therapeutic Drug Monitoring (TDM) sering juga disebut Therapy Monitoring yang merupakan suatu cara untuk mengukur konsentrasi obat dalam plasma sekaligus mengetahui interprestasinya. Pada dasarnya, TDM merupakan salah satu upaya menginterprestasikan ilmu farmakokinetika dan farmakodinamika, dengan mengukur kosentrasi obat dalam plasma untuk mengoptimalkan dan malakukan individualisasi dosis sehingga sesuai untuk pasien. Hasil dari TDM ini dimanfaatkan untuk mengevaluasi derajat respon terapi suatu obat, memberikan informasi yang bermanfaat mengenai kesesuain terapi obat, evaluasi kepatuhan pasien terhadap dosis yang diberikan, mendeteksi kemungkinan efek samping dan toksisitas suatu obat, mengkonfirmasi kemungkinan adanya ineteraksi obat, serta untuk penyesuaian dosis obat.
Berdasarkan Peraturan Kepala Badan Pengawas Obat dan Makanan Republik Indonesia Nomor HK.00.05.3.1818 tahun 2005 tentang Pedoman Uji Bioekivalensi, salah satu parameter mutu yang dibutuhkan untuk produk obat
"copy" adalah bioekivalensi dengan produk obat inovator sebagai produk pembanding. Obat copy merupakan produk obat yang mempunyai ekuivalensi farmaseutik atau merupakan alternatif farmaseutik dengan produk obat inovator/pembandingnya dan dapat dipasarkan dengan nama dagang. Untuk mendapatkan nilai bioekivalensi perlu dilakukan uji bioekivalensi. Uji bioekivalensi adalah uji bioavailabilitas komparatif untuk menunjukkan bioekivalensi antar produk obat uji dengan obat pembanding (8).
Dalam melakukan uji bioekivalensi digunakan metode bioanalisis yaitu pemeriksaan kadar obat dalam plasma darah karena pada pengujian ini senyawa Asam Salisilat terdapat dalam plasma darah. Uji bioekivalensi harus dilakukan dengan metode yang telah divalidasi dan diverifikasi. Pada pengujian ini, metode 7
yang digunakan bersumber dari perpaduan European Medicine Agency (EMA) tahun 2011 dan beberapa jurnal yang telah divalidasi. Namun metode tersebut sudah lama tidak digunakan dalam laboratorium sehingga diperlukan uji verifikasi untuk memastikan kembali bahwa metode uji yang akan digunakan menghasilkan data yang valid. Parameter verifikasi metode yang diuji dalam pengujian ini adalah akurasi dan presisi yang dianalisis menggunakan LC-MS/MS, LC- MS/MS yang merupakan teknik umum yang digunakan dalam penentuan konsentrasi obat dalam matriks biologis karena mampu menganalisis senyawa dalam sampel pada konsentrasi rendah secara spesifik.
1.2 Perumusan Masalah
Perumusan masalah dari pengujian ini adalah apakah hasil dari verifikasi metode bioanalisis Asam Salisilat dalam plasma darah dengan menggunakan LC- MS/MS memenuhi syarat atau tidak berdasarkan dengan Europen Medicine Agency (EMA) tahun 2011.
1.3 Pembatasan Masalah
Pengujian ini dibatasi hanya pada verifikasi metode bioanalisis Asam Salisilat dalam plasma darah dengan menggunakan LC-MS/MS dengan menggunakan parameter akurasi dan presisi.
1.4 Tujuan
1.4.1 Tujuan Umum
Tujuan umum dari pengujian ini yaitu melakukan verifikasi terhadap metode bioanalisis Asam Salisilat dalam plasma darah dengan menggunakan LC-MS/MS yang digunakan untuk pengujian rutin.
1.4.2 Tujuan Khusus
Tujuan khusus ini hanya pada verifikasi metode bioanalisis Asam Salisilat dalam plasma darah dengan menggunakan LC-MS/MS dengan parameter akurasi dan presisi.
1.5 Manfaat
1.5.1 Bagi Mahasiswa
Karya tulis ini diharapkan dapat dijadikan acuan, dan pengujian ini dimasukkan untuk menambah wawasan, pengetahuan, dan pengalaman yang berlaku pada praktik laboratorium yang sesuai.
1.5.2 Bagi Masyarakat
Karya tulis ilmiah ini untuk masyrakat diharapkan dapat memberikan manfaat untuk memberika informasi mengenai verifikasi metode bioanalisis Asam Salisilat yang digunakan di laboratorium bioanalisa atau bioekivalensi.
8
BAB II
TINJAUAN PUSTAKA 2.1 Landasan Teori
Asam Salisilat
Asam salisilat (asam ortohidroksibenzoat) merupakan asam yang bersifat iritan lokal, yangdapat digunakan secar atopikal. Terdapat berbagai turunan yang digunakan sebagaiobat luar, yang terbagi atas 2 kelas, ester dari asam salisilat dan ester salisilat dari asam organik. Disamping itu digunakan pula garam salisilat. Turunannya yang paling dikenal asalah asam asetilsalisilat. Asam salisilat merupakan turunan dari senyawa aldehid. Senyawa ini juga biasa disebuto-hidroksibensaldehid, o-formilfenol atau 2-formilfenol. Senyawa ini stabil, mudah terbakardan tidak cocok dengan basa kuat, pereduksi kuat, asam kuat, dan pengoksidasi kuat.Turunan yang terpenting dari asam salisilat ini adalah asam asetil salisilat yang lebih dikenalsebagai asetosal atau aspirin.Berbeda dengan asam salisilat, asam asetil salisilat memilikiefek analgesik antipiretik dan anti inflamasi yang lebih besar jika dibandingkan dengan asamsalisilat. Penggunaan obat ini sangat luas di masyarakat dan digolongkan ke dalam obat bebas. Selain sebagai prototip, obat ini juga digunakan sebagai standar dalam menilai efekobat sejenis.
Farmakokinetik
Penyerapan aspirin dari saluran cerna (GI) bergantung pada keadaan formulasinya. Ketika dikonsumsi sebagai sediaan cair, obat ini cepat diserap dibandingkan dengan tablet. Hidrolisisnya menghasilkan asam salisilat. Asam salisilat memiliki jendela terapeutik yang sempit. Jika dipertahankan dalam kisaran sempit tersebut, ia memberikan efek anti-inflamasi yang sesuai. pKa aspirin adalah 3,5. Kebanyakan aspirin sebagian besar diserap di perut. Penyerapan aspirin sensitif terhadap pH di tingkat usus kecil.
Eliminasi salisilat terjadi melalui dua jalur melalui pembentukan asam salisilat dan salisilat fenolik glukuronida. Asam salisilat dibersihkan melalui ginjal, yang dapat ditingkatkan dengan meningkatkan pH urin. Obat-obatan seperti antasida dapat meningkatkan pembersihan ginjal karena meningkatkan pH urin. Itu bisa melewati penghalang darah-plasenta. Itu juga diekspresikan dalam ASI.
Farmakodinamik
9
Hampir 90% penghambatan COX dapat dicapai dengan pemberian aspirin 160 hingga 325 mg. Efek ini berlangsung sekitar 7 hingga 10 hari yang biasanya sesuai dengan umur trombosit. Penghambatan prostasiklin dapat dicapai dengan penggunaan dosis yang lebih tinggi. Penghambatan ini terjadi pada sel endotel pembuluh darah.
Dampak Buruk
Aspirin telah melalui beberapa metaanalisis, yang menunjukkan bahwa aspirin mengurangi risiko kejadian buruk kardiovaskular pada pasien diabetes tanpa penyakit kardiovaskular dan juga menyebabkan kecenderungan tingkat perdarahan dan komplikasi gastrointestinal yang lebih tinggi. [9] [10] [11] [12]
Efek samping aspirin yang paling umum adalah gangguan gastrointestinal mulai dari maag hingga perdarahan gastrointestinal. [13]
Hipersensitivitas
Hipersensitivitas terhadap NSAID umum terjadi pada masyarakat umum.
Tarifnya sekitar 1% hingga 2%. Gejalanya bisa ringan seperti ruam hingga angioedema, dan anafilaksis. Pada pasien asma atau rinosinusitis kronis, prevalensi gejala alergi ini bisa mencapai 26%. Jika disertai polip hidung dan radang saluran pernapasan dengan eosinofil, disebut triad aspirin. Penyakit pernapasan yang diperburuk NSAID (NERD) adalah istilah baru yang dikaitkan dengan sindrom ini akibat peradangan mukosa saluran pernapasan atas dan bawah.
Sindrom Reye
Sindrom Reye, dinamai menurut ahli patologi Australia Dr. RD Reye pertama kali dijelaskan pada tahun 1963. Ini adalah kondisi yang jarang namun fatal dengan perkiraan angka kematian antara 30% hingga 45%. Ini adalah bentuk ensefalopati akibat perubahan lemak pada hati yang sehat. Gambaran klinis sindrom Reye adalah infeksi virus saluran pernapasan atas pada anak-anak dan pemberian aspirin secara bersamaan untuk pengobatan demam. Diperkirakan bahwa cedera mitokondria akibat penyakit virus sebelumnya merupakan dampak pertama pada hati dan otak. Aspirin atau senyawa serupa memberikan serangan kedua yang melengkapi sindrom ini. Angka kejadiannya telah menurun drastis karena kesadaran yang lebih baik dan penggunaan asetaminofen untuk mengatasi demam pada anak- anak dibandingkan aspirin. [14]
Meskipun terdapat hubungan antara aspirin dan sindrom Reye, beberapa penulis berpendapat bahwa pada saat diagnosis, kadar salisilat tidak diperiksa secara rutin,
10
biopsi tidak dilakukan, dan kesalahan metabolisme genetik/bawaan tidak dapat dikesampingkan.
Perdarahan Intraserebral
Aspirin meningkatkan risiko perdarahan intrakranial (RR = 1,65; 95% CI, 1,06 hingga 5,99) dibandingkan plasebo.
Darah
Darah merupakan cairan yang terdapat di dalam pembuluh darah yang memiliki fungsi mengatur keseimbangan asam dan basa, mentransportasikan O2, karbohidrat, dan metabolit, mengatur suhu tubuh dengan cara konduksi atau hantaran, membawa panas tubuh dari pusat produksi panas (hepar dan otot) untuk didistribusikan ke seluruh tubuh, dan pengaturn hormon dengan membawa dan mengantarkan dari kelenjar ke sasaran. Jumlah dalam tubuh bervariasi, tergantung dari berat badan seseorang. Pada orang dewasa, 1/13 berat badan atau kira-kira 4,5- 5 liternya adalah darah. Faktor lain yang menentukan banyaknya darah adalah usia, pekerjaan, keadaan jantung, dan pembuluh darah.
Darah seperti yang telah didefinisikan dan yang dapat dilihat, adalah suatu cairan tubuh yang berwarna merah dan kental. Kedua sifat utama ini, yaitu warna merah dan kental, yang membedakan darah dari cairan tubuh lainnya. Kekentalan ini disebabkan oleh banyaknya senyawa dengan berat molekul yang berbeda, dari yang kecil sampai yang besar seperti protein, yang terlarut didalam darah. Warna merah, yang memberi ciri yang sangat khas bagi darah, disebabkan oleh senyawa berwarna merah yang terdapat dalam sel-sel darah merah yang tersuspensi dalam darah.
Darah merupakan komponen esensial makhluk hidup, hewan dan manusia.
Darah selalu berada dalam pembuluh darah sehingga dapat menjalankan fungsinya sebagai pembawa O2 (oxygen 6 carrier), mekanisme pertahanan tubuh terhadap infeksi, dan mekanisme hemostasis.
Karakteristik Darah
Menurut Karakteristik umum darah meliputi warna, viskositas, pH, volume, dan komposisinya. Darah arteri berwarna merah muda karena banyak O2 yang berkaitan dengan hemoglobin dalam sel darah merah. Darah vena berwarna merah gelap/tua karena kurang O2, dibandingkan dengan darah arteri. Viskositas darah ¾ lebih tinggi dari pada viskositas air yaitu sebesar 1.048-1.006. pH darah bersifat alkaline dengan pH 7.35-7.45 (netral 7.00).
11
Pada orang dewasa volume darah sekitar 70-75 ml/kg BB, sekitar 4-5 liter.
Menurut Sadikin (2002) secara garis besar dapat dikatakan, bahwa fungsi darah ialah sebagai sarana transpor, alat homeostasis, dan alat pertahanan.
Komponen Darah a. Plasma Darah
Plasma darah tersusun atas 90% air dan 10% bahan-bahan terlarut yang terdiri dari 7% protein, 1% garam-garam mineral, dan 2% lemak. Fungsi dari plasma darah antara lain:
Sebagai bahan pelarut bahan-bahan kimia
Membawa mineral-mineral terlarut, glukosa dan asam amino, vitamin karbondioksida (sebagai ion hidrogen karbonat) dan bahan-bahan buanagn
Menyebarkan panas dari organ yang lebih hangat ke organ yang lebih dingin
Menjaga keseimbangan antara cairan di dalam sel dan cairan di luar sel.
Plasma mengandung protein-protein penting, seperti fibrinogen, globulin, albumin¸ dan lipoprotein. Fibrinogen berfungsi dalam pembekuan darah. Globulin berperan dalam pertahanan tubuh. Sementara itu, albumin berperan membantu aliran darah dan membantu tekanan osmotic darah. Protein-protein tersebut dapat dipisahkan dari plasma dan membentuk cairan yang disebut serum.
b. Butir-butir Darah
1. Sel Darah Merah (Eritosit)
Fungsi eritrosit untuk mengangkat oksigen dari paru-paru untuk diedarkan ke seluruh tubuh. Eritrosit mampu mengikat oksigen karena memiliki hemoglobin (Hb). Hemoglobin merupakan suatu protein khusus yang mengandung zat besi yang mampu mengikat oksigen.
Dalam setiap eritrosit terdapat sekitar 25 juta molekul Hb. Tiap molekul Hb dapat membawa empat molekul oksigen, hal itu berarti setiap kali eritrosit keluar dari paru-paru, ia membawa sekitar satu miliar oksigen.
2. Sel Darah Putih (Leukosit)
Leukosit merupakan sel yang memiliki fungsi khusus untuk pertahanan tubuh dari serangan mikroorganisme. Leukosit merupakan sel yang memiliki sifat seperti amoeba, yaitu dapat berubah-ubah. Leukosit dapat bergerak bebas, bahkan dapat keluar dari pembuluh darah dan masuk ke dalam jaringan lain yang terinfeksi mikroorganisme
12
3. Keping-keping Darah (Trombosit)
Trombosit atau keping-keping darah memiliki bentuk tidak teratur, tidak memiliki inti sel dan berukuran sangat kecil. Jumlahnya di dalam darah sekitar 150-400 ribu/ul. Trombosit berperan dalam pembekuan darah apabila terjadi luka dalam pembuluh darah, dengan demikian darah tidak banyak tebuang. Trombosit beredar didalam darah dan dibentuk oleh sel-sel besar yang ada di dalam sumsum tulang
2.1.1.1 Fungsi Darah (21)
a. Sebagai alat transportasi, misalnya :
1) Alat transpor makanan, yang diserap dari saluran cerna dan diedarkan ke seluruh tubuh.
2) Alat transport O2, yang diambil dari paru-paru untuk dibawa keseluruh tubuh.
3) Alat transpor bahan buangan dari jaringan ke alat-alat ekskresi untuk diteruskan ke empedu dan saluran cerna sebagai tinja.
4) Sebagai alat transport antar jaringan dari bahan-bahan yang dibutuhkan oleh suatu jaringan dibuat oleh jaringan lain.
5) Mepertahankan homeostasis dalam tubuh, termasuk didalamnya adalah mempertahankan suhu tubuh, mengatur keseimbangan distribusi air dan mempertahankan keseimbangan asam-basa sehingga pH yang dimiliki darah dan cairan tubuh lainnya tetap dalam keadaan yang seharusnya. Mempertahankan tubuh dari agresi benda atau seyawa asing yang umumnya dianggap mempunyai potensi menimbulkan ancaman
6) Sebagai obat jika darah tersebut sehat, seperti hemodialisa dan trnasfusi darah.
LC – MS/MS (Liquid Chromatography – Mass Spectrometry)
Kromatografi Cair Kinerja Tinggi (HPLC) adalah salah satunya teknik analisis yang paling umum digunakan dalam bidang farmasi industri untuk penentuan dan kuantifikasi zat obat dan zat terkaitnya. Karena reproduktifitas dan akurasi yang tinggi, HPLC secara rutin digunakan dalam bidang farmasi, kimia dan pestisida industri. Liquid Chromatography – Mass Spectrometry (LC-MS) adalah teknik analisis tanda hubung yang merupakan kombinasi dari Kromatografi Cair (LC) dan Spektrometri Massa (MS). HPLC (LC) memisahkan komponen-komponen campuran
13
dengan melewatinya kolom kromatografi. Umumnya komponen dipisahkan tidak dapat diidentifikasi secara positif LC saja. Spektrometri Massa juga digunakan untuk identifikasi senyawa yang tidak diketahui, senyawa yang diketahui dan untuk menjelaskan strukturnya. Spektrometri massa tidak sendirian baik untuk mengidentifikasi campuran karena campuran spektrum massa sebenarnya kompleks spektrum yang tumpang tindih dari individu yang terpisah komponen. Sulitnya menghubungkan Kromatografi cair (LC) dengan Spektrometri massa (MS). Hubungan digunakan untuk mentransfer eluen cair dari LC ke MS. LC-MS lebih banyak digunakan dalam mengundang studi disolusi, bioavailabilitas, bioekivalensi dan farmakodinamik . Sistem LC-MS preparatif dapat digunakan untuk pemurnian zat tertentu secara massal dan cepat dari zat tersebut campuran yang penting dalam penelitian dasar, farmasi, agrokimia, makanan dan industri lainnya.
Kromatografi Cair (LC) adalah kromatografi cair kinerja tinggi yang pemisahan komponen campuran dapat dilakukan dengan menggunakan fase diam bergerak cair dan fase diam padat. Ada berbagai jenis kromatografi seperti kromatografi cair fase normal, Terbalik kromatografi fasa, kromatografi cair penukar ion, Pemisahan kiral dan kromatografi cair afinitas. Dengan menggunakan pengepakan kolom yang berbeda dengan efisiensi tinggi dalam jumlah kecil campuran kompleks dapat dipisahkan.
Komponen LC – MS/MS a. Pompa
Terdiri dari bahan yang bersifat inert pelarut atau komposisi campuran buffer berair dan Pelarut organik. Ini memberikan peningkatan fase seluler dalam jumlah besar hingga 10mL/menit. Ada tiga jenis pompa utama yang digunakan yaitu pompa reciprocating, pompa Syringe dan tekanan konstan pompa.
b. Sampel Injektor
Ini digunakan untuk memperkenalkan volume sampel ke dalam sistem kromatografi. Umumnya volume sampel dari 1µL hingga 100µL dapat disuntikkan. Volume injeksi bisa ditingkatkan dengan loop injektor hingga volume 2mL. Ada dua jenis injektor utama yang digunakan yaitu injektor otomatis dan Injektor manual. Injektor otomatis lebih nyaman dan ramah pengguna serta lebih akurat dan tepat dibandingkan ke injektor manual
14
c. Kolom
Merupakan fasa diam yang terdiri dari silika bahan dalam kombinasi dengan rantai karbon. Umumnya panjang kolom yang digunakan sekitar 50mm hingga 300mm. Kolom yang digunakan dalam HPLC terdiri dari Octadecyl (C18), Octyl (C8), Cyano, Amino, pengepakan Phenyl. Kolom digunakan berdasarkan sifat senyawa yang akan dipisahkan
d. Detektor dan Recorder
Detektor adalah yang paling penting bagian dari HPLC. Ada berbagai jenis detektor yang digunakan Detektor UV-Visible, Detektor PDA, Indeks Bias (RI) detektor, Detektor elektrokimia, Detektor fluoresensi dan detektor konduktivitas.
Sinyal diterima dari detektor dapat direkam sebagai puncak dan masing-masing data dapat disimpan dalam perangkat lunak
Prinsip LC – MS/MS
Setelah sampel dipisahkan dengan kromatografi cair, masing-masing komponen masuk ke detektor spektrometer massa secara bergantian, dan setiap komponen terionisasi pada sumber ion, menghasilkan ion dengan muatan tertentu dan nomor massa yang berbeda. Ion terionisasi pada sumber ion untuk menghasilkan ion dengan muatan dan nomor massa yang berbeda. Ion-ion dipisahkan oleh penganalisis massa menurut rasio massa-ke-muatan yang berbeda (m/z), dan spektrum massa diperoleh dalam urutan rasio massa-ke-muatan. Hasil kualitatif dan kuantitatif sampel dapat diperoleh dengan pengolahan analitik spektrum massa.
Kelebihan LC-MS/MS
Menurut (26) Liquid Chromatography-tandem Mass Spectrometry (LC- MS/MS) merupakan satu-satunya teknik kromatografi cair dengan detektor spektrometer massa. Penggunaan LC-MS/MS untuk penelitian bio-analisis dimulai pada akhir 1980-an. Kelebihan dari teknologi LC-MS/MS meliputi:
a. Spesifitas. Hasil Analisis yang khas dan spesifik diperoleh dari penggunaan spectrometer massa sebagai detector.
b. Aplikasi yang luas dengan sistem yang praktis Berbeda dengan GC-MS sebagai spektrometer musa "klasik", penerapan LC-MS/MS tidak terbatas untuk molekul volatil (biasanya dengan berat molekul dibawah 500 Da). Mampu mengukur analit yang sangat polar, selain itu persiapan sampel cukup sederhana tanpa adanya teknik derivatisasi.
15
c. Fleksibilitas. Pengujian yang berbeda dapat dikembangkan dengan tingkat fleksibilitas yang tinggi dan waktu yang singkat.
d. Kaya Informasi. Sejumlah data kuantitatif maupun kualitatif dapat diperoleh. Hal ini disebabkan seleksi ion yang sangat cepat dengan banyak parameter,
Spektrofotometer Massa
Spektrofotometer massa bekerja dengan molekul pengion yang kemudian akan memilah dan mengidentifikasi ion menurut massa, sesuai rasio fragmentasi mereka.
Dua komponen kunci dalam proses ini adalah sumber ion (ion source) yang akan menghasilkan ion, dan analisis massa (mass analyzer) yang menseleksi ion . Menurut Komponen dari spektrometri massa yaitu :
1) Ion Source (Sumber Pengion)
Ada berbagai macam teknik ionisasi yang digunakan pada spektrometri massa. Hal yang harus dipertimbangkan dalam pemilihan teknik ionisasi antara lain energi internal yang dipindahkan pada saat proses ionisasi dan sifat fisikokimia dari analit yang dapat diionisasi. Metode ionisasi yang berkembang antara lain; electrospray ionization (ESI), atmospheric pressure chemical ionization (APCI), Atmospheric pressure photo-ionization (APPI), dan matrix-assisted laser desorption/ionization (MALDI).
a. Electrospray ionization (ESI)
Ionisasi dengan ESI melalui 3 tahap; produksi tetesan bermuatan, pengurangan ukuran tetesan bermuatan dan fase gas pembentukan ion. Tahap pertama, analit bersama dengan eluen dari Kromatografi cair dipompa masuk menuju kapiler. Di dalam kapiler terdapat anoda (kutup negatif) pada taylor cone dan katoda (kutup negatif) pada kapiler. Kutup ini berfungsi agar muatan yang berkumpul pada taylor cone adalah muatan positif sehingga nantinya saat terjadi penyemprotan dan terbentuk droplet (tetesan) tidak bergabung menjadi tetesan yang lebih besar lagi. Didalam kapiler yang sangat sempit dan bertegangan tinggi akan terjadi nebulasi, analit berinteraksi dengan lapisan permukaan pelarut menghasilkan tetesan
16
bermuatan positif/negatif. Tahap kedua, tetesan bermuatan ini akan mengalami pengurangan ukuran karena menguapnya pelarut, meningkatnya kerapatan muatan pada partikel sehingga meningkatkan tegangan permukaan dan tetesan akan pecah menjadi tetesan-tetesan lebih kecil (a. Analit dengan satu muatan dan beberapa muatan (analit ion), b. Satu analit bersama solven yang diliputi muatan positif, c. Beberapa analit bersama beberapa solven diliputi beberapa analit). Tahap terakhir, analit ion akan masuk ke dalam cone dimana di sisi kiri dan kanannya sudah mengalir gas nitrogen, gas ini berfungsi agar analit yang terbentuk stabil dan tidak terganggu oleh gas oksigen. Tetesan tersebut ditransfer melalui lubang kapiler penganalisis massa.
b. Atmospheric pressure chemical (APCI)
Teknik ionisasi yang menggunakan reaksi fase gas ion-molekul pada tekanan atmosfer. Secara umum digunakan untuk senyawa polar dan relatif non polar, dengan berat molekular sedang sekitar 1500 Da dan memberikan ion muatan tunggal. Analit dalam larutan dimasukkan ke dalam nebulizer, larutan dirubah menjadi uap tipis oleh nitrogen berkecepatan tinggi. Kemudian diteruskan ke korona dan terjadi ionisasi, ion-ion dari sumber ion bereaksi dengan analit dan mengionisasi melalui transfer muatan.
c. Atmospheric Pressure Photoionization (APPI)
APPI Merupakan salah satu perkembangan terakhir dari sumber ion yang memanfaatkan tekanan atmosferik. Prinsipnya adalah dengan menggunakan foton untuk mengionisasi molekul fase gas. Sampel dalam larutan diuapkan dengan pemanasan nebulizer mirip dengan metode pada APCI. Setelah penguapan, analit berinteraksi dengan foton yang dipancarkan oleh lampu pelepas. Foton ini memicu rangkaian reaksi fase gas yang mengarah pada proses ionisasi molekul sampel. Perbedaan dari metode APCI adalah adanya penggunaan lampu pemancar foton. Manfaat dari metode ini adalah metode ini mempunyai potensi untuk mengionisasi senyawa non-polar, efisien untuk analisis senyawa kelas flavonoid, steroid, pestisida, hidrokarbon poliaromatik.
17
2) Mass Analyzer (penganalisis massa)
Setelah terbentuk ion fase gas, maka ion-ion dipisahkan berdasarkan massa masing-masing, sifat fisika ion yang diukur oleh mass analyzer adalah rasio massa terhadap muatan (m/z). Karenanya, untuk ion bermuatan ganda, nilai m/z adalah bagian farksional dari massa aktual. Mass analyzer yang umum digunakan meliputi quadrupole, ion trap, time-of-flight (TOF), fourier transform-ion cyclotron resonance (FT-ICR).
a. Quadrupole
Sebuah analisis massa quadrupole terdiri dari empat batang paralel diatur dalam persegi. Ion analit diarahkan ke bagian tengah persegi. Tegangan yang dialirkan pada batang menghasilkan bidang elektromagnetik. Bidang ini menentukan rasio masa yang dapat melewati filter pada waktu tertentu.
Quadrupoles cenderung merupakan analisis massa yang paling sederhana dan paling murah.
b. Time-of-Flight (TOF)
Pada analisis massa time-of-flight (TOF), sebuah gaya elektromagnetik yang seragam diterapkan untuk semua ion pada waktu yang sama. Hal ini menyebabkan ion akan dipercepat menyusuri tabung penerbangan. Ion yang lebih ringan berjalan lebih cepat dan tiba pada detektor paling awal, sehingga rasio fragmentasi ion / itentukan oleh waktu kedatangan mereka. Analisis massa (TOF) memiliki kisaran massa yang luas dan sangat akurat pada pengukuran massa suatu senyawa.
c. Perangkap Ion
Analisis massa perangkap ion massa terdiri dari elektroda melingkar cincin dua penutup di kedua ujungnya yang bersama-sama membentuk sebuah ruang. Ion memasuki ruang dan terjebak oleh medan elektromagnetik. Bidang lain digunakan untuk mengeluarkan dengan selektif dari dalam perangkap.
Perangkap ion memiliki kelebihan dapat melakukan beberapa tahapan pengukuran spektrometer massa tanpa analisis massa tambahan.
d. Fourier transform-ion cyclotron resonance (FT-ICR)
Analisis massa FT-ICR merupakan jenis lain dari analisis massa perangkap ion. Ion memasuki ruangan dan terjebak dalam lingkaran orbit oleh medan listrik dan medan magnet yang kuat. Ketika terjadi eksitasi oleh
18
frekuensi radio (RF) pada medan listrik, ion menghasilkan arus yang bergantung pada waktu. Arus ini dikonversi oleh fourier menjadi frekuensi orbital dari ion yang sesuai dengan rasio muatan massa senyawa. Seperti perangkap ion, analisis massa FT-ICR dapat melakukan beberapa tahapan spektrometri massa tanpa analisis massa tambahan. FT-ICR juga memiliki rentang massa yang lebar dan resolusi massa yang sangat baik. FT-ICR merupakan analisis massa termahal diantara yang lain.
3) Detektor
Detektor merupakan alat penting spektrometer massa itu menghasilkan arus yang sebanding dengan jumlah ion serang itu. Setelah ion-ion terbentuk dilewatkan dari analisa yang dimilikinya untuk dideteksi dan diubah menjadi sinyal. Terdapat dua jenis detektor yang umum digunakan. Detektor Kolektor Ion Titik Dalam hal ini pengumpul ion ditempatkan pada titik massa yang tetap spektrometer. Semua ion terfokus pada detektor yang terletak pada satu titik. Kedatangan ion dapat dicatat dengan aliran arus listrik dan data dapat direkam. Arus listrik aliran sebanding dengan ion yang tiba di titik detektor ion. Detektor Array Detektor Array adalah kumpulan pengumpul titik yang ditempatkan di dalamnya pesawat. Ion-ion tersebut tiba pada suatu titik atau melintasi bidang secara berurutan detektor. Ion- ion dengan nilai massa terhadap muatan (m/z) dipisahkan dan direkam sepanjang bidang menggunakan pengumpul ion titik. Secara spasial ion-ion yang terdiferensiasi dengan rentang massa terdeteksi secara bersamaan pada saat yang sama di detektor array.
19
BAB III
METODE PENGUJIAN 3.1 Waktu dan Lokasi Pengujian
3.1.1 Waktu Pengujian
Pengujian dilakukan pada tanggal 11 – 12 Maret 2024 3.1.2 Lokasi Pengujian
Pengujian ini dilakukan di Laboratorium Bioavailabilitas dan Bioekuivalensi PT. Biometrik Riset Indonesia yang berada di Ruko Brickhouse, Jlan Raya Bogor Km 31, No.52 Unit H dan I, Cisalak, Kecamatan Sukmajaya, Kota Depok, Jawa Barat, 16416.
3.2 Prosedur Pengujian 3.2.1 Prinsip Pengujian
Verifikasi metode Asam Salisilat parameter akurasi dan presisi dalam plasma darah dengan menggunakan liquid chromatography-mass spectrometry (LC- MS/MS).
3.2.2 Metode Pengujian
Liquid Chromatography-Mass Spectrometry 3.2.2.1 Sistem Kromatografi
a. Sistem LC : Waters, Acquity BSM J16BUR9377G; Acquity Sample Manager-FL J16UFL871M; Xevo TQ-S Micro QEA0531
b. Software Pengujian : MassLynx V4.1
c. Kolom : Agilent Poroshell 120 EC-C18 (2.7µm) 3.0mm x 50.0mm d. Laju Alir : 0,20 mL/Menit
e. Fase Gerak : Acetonitrile : Ammonium Acetate 5mM (75 : 25) f. Suhu Kolom : 35°C
g. Suhu autosampler : 10°C h. Volume injeksi : 10 µL
3.1.1.1 Preparasi Standar Kerja
a. Pembuatan Larutan Stock Standar
20
Dibuat Larutan Stock Standar Asam Salisilat 1000000 μg/mL akan disiapkan dengan menimbang setara 5,00 mg Asam Salisilat ke dalam labu volumetrik 5 mL, larutkan dalam 3 ml 0,10% Asam Format dalam Asetonitril, disonikasi.
Tambahkan 0,10% Asam Format dalam Asetonitril ke dalam volume hingga tanda batas dan homogenkan.
Dibuat larutan Working Standard Solution (WSS-A) dengan mengencerkan larutan stok standar dengan 0,10% Asam Format dalam Asetonitril hingga diperoleh konsentrasi 100.000 ng/ mL.
Tabel 2 Pembuatan Larutan Working Standard Solution (WSS-A) Konsentrasi
Larutan Awal (μg/mL)
Pemipetan Labu yang digunakan (mL)
Konsentrasi Akhir (ng /
mL)
Etiket
1000000 100 5 100.000 WSS-A
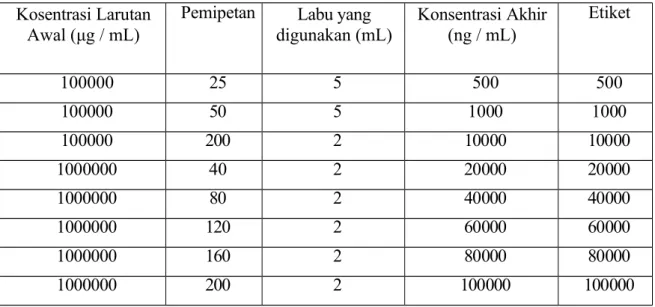
b. Pembuatan Larutan Standar Kerja (Working Standar)
Dibuat larutan kerja 1 – 4 dengan mengencerkan larutan Working Standard Solution (WSS-A) dengan 0,10% Asam Format dalam Asetonitril hingga konsentrasi berturut- turut 50; 1000; 10000; 20000 ng / mL dan Larutan kerja 5 - 8 dengan mengencerkan larutan Stock Standard (LSS) dengan 0,10% Asam Format dalam Asetonitril hingga konsentrasi berturut- turut 40000; 60000;
80000; 100000 ng / mL.
Tabel 3 Pembuatan Larutan Kerja 1 – 8 Kosentrasi Larutan
Awal (μg / mL)
Pemipetan Labu yang
digunakan (mL) Konsentrasi Akhir (ng / mL)
Etiket
100000 25 5 500 500
100000 50 5 1000 1000
100000 200 2 10000 10000
1000000 40 2 20000 20000
1000000 80 2 40000 40000
1000000 120 2 60000 60000
1000000 160 2 80000 80000
1000000 200 2 100000 100000
c. Pembuatan Larutan Stock Standar QC
21
Dibuat Larutan stok QC dari Asam Salisilat 1000000 μg/mL akan disiapkan dengan menimbang setara 5,00 mg Asam Salisilat ke dalam labu volumetrik 5 mL, dilarutkandalam 3 ml 0,10% Asam Format dalam Asetonitril; disonikasi.
Tambahkan 0,10% Asam Format dalam Asetonitril ke dalam volume dan homogenkan.
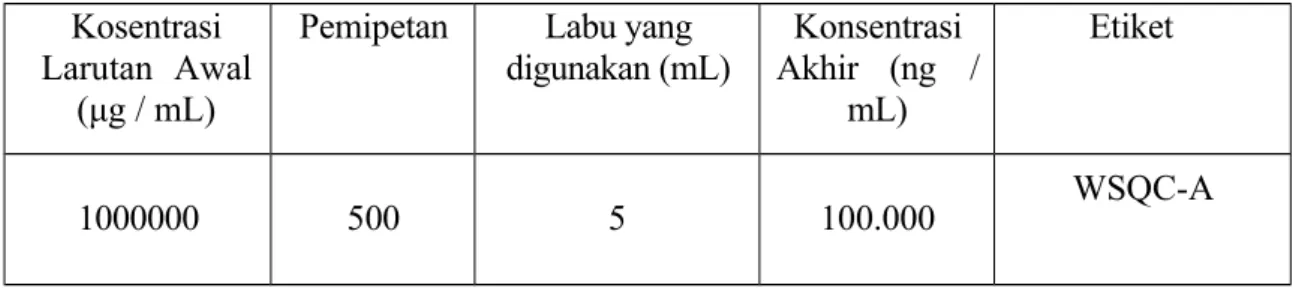
Dibuat larutan Working Standard Solution (WSQC-A) dengan mengencerkan larutan stok standar QC dalam 0,10% Asam Format dalam Asetonitril hingga diperoleh konsentrasi 100.000 ng/mL.
Tabel 4 Pembuatan larutan Working Standard Solution Kosentrasi
Larutan Awal (μg / mL)
Pemipetan Labu yang
digunakan (mL) Konsentrasi Akhir (ng /
mL)
Etiket
1000000 500 5 100.000 WSQC-A
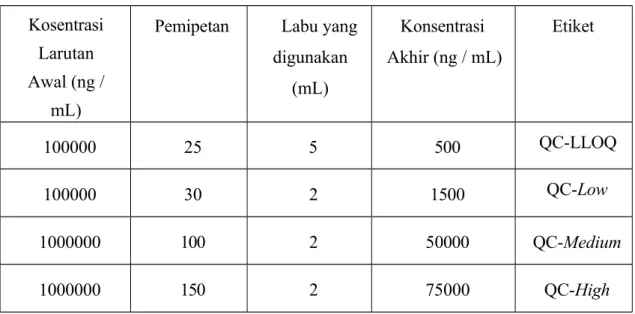
Dibuat larutan kerja sampel QC dengan mengencerkan larutan Working Standard Solution (WSQC-A) dalam 0,10% Asam Format dalam Asetonitril untuk konsentrasi 1500 ng/mL; 2250 ng/mL dan diencerkan kerja QC B untuk membuat sampel QC konsentrasi 5 ng/mL; 10 ng/mL.
Tabel 5 Pembuatan Larutan Kerja QC Kosentrasi
Larutan Awal (ng /
mL)
Pemipetan Labu yang digunakan
(mL)
Konsentrasi Akhir (ng / mL)
Etiket
100000 25 5 500 QC-LLOQ
100000 30 2 1500 QC-Low
1000000 100 2 50000 QC-Medium
1000000 150 2 75000 QC-High
d. Pembuatan Larutan Stock Internal Standar
Dibuat Larutan stok Standar Internal Celecoxib 1000000 μg / mL akan disiapkan dengan menimbang setara 5,00 mg Celecoxib ke dalam labu volumetrik 5 mL, larutkan dalam 3 ml metanol; disonikasi. Tambahkan metanol ke dalam volume dan homogekan.
22
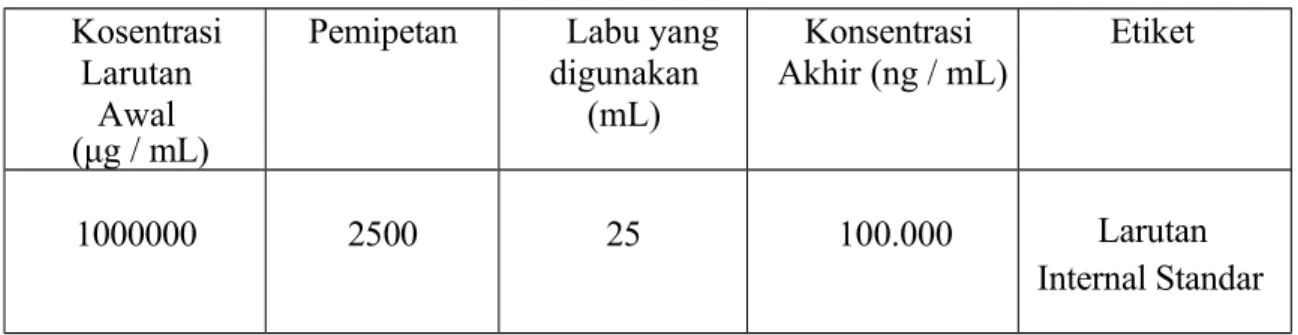
Dipipet 2500 μL larutan stok standar internal Celecoxib 1000000 μg/mL ke dalam labu volumetrik 25 mL dan diencerkan dengan metanol hingga tanda batas dan homogenkan (Celecoxib 1000000 ng/mL).
Tabel 6 Pembuatan Larutan Stok Internal Standar Kosentrasi
Larutan (μg / mL)Awal
Pemipetan Labu yang digunakan
(mL)
Konsentrasi Akhir (ng / mL)
Etiket
1000000 2500 25 100.000 Larutan
Internal Standar
3.1.1.2 Preparasi Sampel
200 μL plasma yang mengandung Asam Salisilat ke dalam microtube.
Tambahkan 20 μL standar internal (Celecoxib 100.000 ng/mL), homogenkan dengan menggunakan vortex selama 20 detik, kemudian sampel akan ditambahkan 800 μL 0,10% Asam Format dalam Asetonitril, divortex selama 5 menit dan disentrifugasi pada 14000 rpm selama 10 menit pada suhu 5°C. Pindahkan supernatan ke dalam vial LC-MS yang bersih.
3.1.1.3 Kondisi Spektrometri Massa
Spektrometri massa (Micromass Quattro Micro LC) yang dilengkapi dengan ionisasi electrospray (ESI) menggunakan elektroda penghitung aliran silang dijalankan dalam mode positif (ESI+), dan diatur dalam Multiple Reaction Monitoring (MRM), memantau transisi 137,00 93,00 untuk Asam Salisilat dan 379,92 316,00 untuk IS (Celecoxib).
Tegangan kapiler, waktu tinggal, tegangan cone, dan laju alir gas adalah 1.5 kV, 0.20 detik, 5 V, 650 L/Jam, energi tumbukan 20 eV. Akuisisi dan analisis data dilakukan dengan menggunakan perangkat lunak MassLynx 4.1 dari waters Crp., Milford, MA, USA.
3.1.2 Skema Kerja
1. Pembuatan Larutan Sampel a. Larutan Blanko
Dipipet sebanyak 300 µL plasma darah
23
b. Larutan Blanko + Larutan Internal Standar
Gambar 5 Larutan Blanko + Internal Standar c. Larutan Kurva Kalibrasi 1-8
d. Larutan LLOQ (Low Limit of Quantification)
Dimasukkan ke dalam microtube yang bersih dan kering
Gambar 3 Larutan Blanko
Dipipet sebanyak 200 µL plasma darah
Ditambahkan 20 µL larutan kerja internal standar 1000000 ng/mL
Dimasukkan ke dalam microtube yang bersih dan kering
Disiapkan sebanyak 8 microtube yang baru dan bersih, diberikan etiket
Dipipet masing-masing sebanyak 180 µL plasma darah
Dimasukkan ke dalam masing-masing microtube sesuai etiket
Ditambahkan 20 µL larutan WS 1 ke dalam microtube KK 1, WS 2 ke dalam microtube KK 2, dan seterusnya sampai WS 8
Ditambahkan 20 µL larutan kerja internal standar 100.000 ng/mL, masukkan ke dalam masing-masing microtube
Gambar 6 Larutan Kurva Kalibrasi
Dipipet sebanyak 180 µL plasma darah, dimasukkan ke dalam microtube yang bersih dan kering
Ditambahkan 20 µL larutan kerja internal standar 100000 ng/mL, masukkan ke dalam microtube yang sama
Dibuat 5 kali pengulangan larutan LLOQ
Gambar 7 Larutan LLOQ
24
e. Larutan QC-L (Quality Control Low)
f. Larutan QC-M (Quality Control Medium)
Ditambahkan 20 µL larutan WS 1 ke dalam microtube KK 1, WS 2 ke dalam microtube KK 2, dan seterusnya sampai WS 8
Ditambahkan 20 µL larutan WS 1, dimasukkan ke dalam microtube yang sama
Ditambahkan 20 µL larutan kerja internal standar 100000 ng/mL, masukkan ke dalam microtube yang sama
Dipipet sebanyak 180 µL plasma darah, dimasukkan ke dalam microtube yang bersih dan kering
Ditambahkan 20 µL larutan QC-L, dimasukkan ke dalam microtube yang sama
Ditambahkan 20 µL larutan kerja internal standar 100000 ng/mL, masukkan ke dalam microtube yang sama
Dibuat 5 kali pengulangan larutan QC-L
Gambar 8 Larutan QCL
Dipipet sebanyak 180 µL plasma darah, dimasukkan ke dalam microtube yang bersih dan kering
Ditambahkan 20 µL larutan QC-M, dimasukkan ke dalam microtube yang sama
Ditambahkan 20 µL larutan kerja internal standar 100000 ng/mL, masukkan ke dalam microtube yang sama
25
g. Larutan QC-H (Quality Control High)
2. Preparasi Larutan Sampel
Dibuat 5 kali pengulangan larutan QC-M
Gambar 9 Larutan QCM
Dipipet sebanyak 180 µL plasma darah, dimasukkan ke dalam microtube yang bersih dan kering
Ditambahkan 20 µL larutan QC-H, dimasukkan ke dalam microtube yang sama
Ditambahkan 20 µL larutan kerja internal standar 100000 ng/mL, masukkan ke dalam microtube yang sama
Dibuat 5 kali pengulangan larutan QC-H
Gambar 10 Larutan QCH
Dikocok larutan blanko, larutan blanko+IS, larutan kurva kalibrasi, larutan LLOQ, larutan QC-L, larutan QC-M, dan larutan QC-H
selama 10 detik
Disentrifugasi selama 10 menit pada suhu 5֩c dengan kecepatan putaran 14.000 rpm
Ditambahkan 800 µL 0,10% Asam Format dalam Asetonitril tiap masing- masing larutan sampel, lalu dikocok selama 5 menit
Dipindahkan supernatan yang bening ke dalam vial LC-MS yang kering dan bersih
Diukur larutan dalam instrument LC-MS/MS
26
3.2 Alat dan Bahan 3.2.1 Alat
a. Instrument Xevo TQ-S Micro Watters LC – MS/MS b. Timbangan Analitik ( Mettler Toledo)
c. Mikropipet (Eppendrof, Socorex)
d. Ultrasonic cleaner (Bransonic PC620E-2) e. Voretx Mixer (Vortex Genie 2)
f. Centrifuge (Hettich Micro 220R)
g. Pemurni air (Arium 611UV Ultrapure water system) h. Alat-alat gelas
3.2.2 Bahan
a. Plasma darah b. Asam Salisilat c. Celecoxib d. Metanol
e. 0,10% Asam Format dalam Asetonitril 3.2.2.1 Data Baku
Tabel 7 Data Baku Asam Salisilat
Data Keterangan
Nama Asam Salisilat
No.Batch R153JO
Exp. Date -
Kemurnian Baku 99,90%
Tabel 8 Data Penimbangan Baku Asam Salisilat
Keterangan Bobot (mg)
Asam Salisilat 5
3.2.2.2 Data Internal Standar
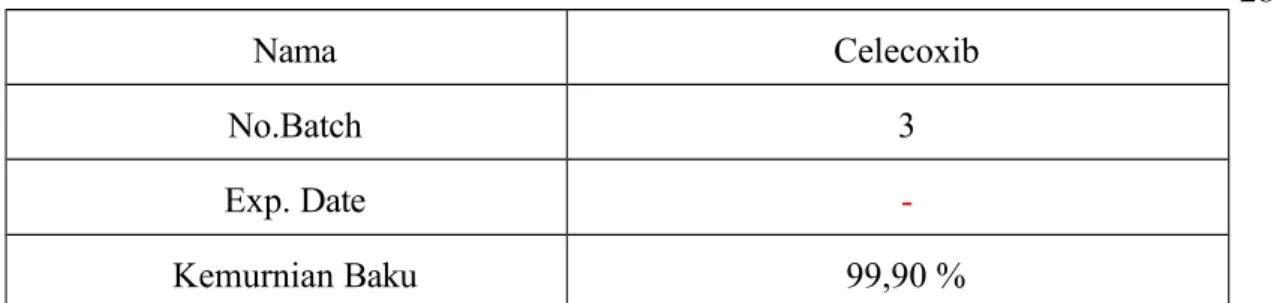
Senyawa yang digunakan sebagai Internal Standar (IS) adalah Etoricoxib Tabel 9 Data Internal Standar Celecoxib
Data Keterangan
Disentrifugasi selama 10 menit pada suhu 5֩c dengan kecepatan putaran 14.000 rpm
27
Nama Celecoxib
No.Batch 3
Exp. Date -
Kemurnian Baku 99,90 %
Tabel 10 Data Penimbangan Internal Standar Celecoxib
Keterangan Bobot (mg)
Celecoxib 4
28
BAB IV
HASIL PENGUJIAN DAN PEMBAHASAN 4.1 Hasil Pengujian
4.1.1 Organoleptik
Sampel yang digunakan adalah cairan plasma yang di dapatkan dari Palang Merah Indonesia (PMI) yang diproduksi pada dengan golongan darah.
Tabel 12 Data Organoleptik Plasma
Pemerian Hasil Pengamatan
Bentuk Cair
Warna Kuning
Bau -
Rasa -
4.1.2 Data Verifikasi
a. Data Kurva Kalibrasi
Pada pengujian ini, kurva kalibrasi dibuat sebanyak 8 titik kurva dengan konsentrasi 50 ng/mL; 100 ng/mL; 1000 ng/mL; 2000 ng/mL; 4000 ng/mL; 6000 ng/mL; 8000 ng/mL; 10000 ng/mL. Tabel 13 Data
Pengukuran Kurva Kalibrasi
34
Calibration Curve
Cons. (ng/mL)
Std Cons. (ng/mL)
% Dev Curve
50 52,68 5,4
100 90,05 -9,9
1000 892,62 -10,7
2000 2048,95 2,4
4000 4167,10 4,2
6000 5857,34 -2,4
8000 8140,51
10000 10932,08
r² 0,9939
8000 8140,51 1,8
10000 10932,08 9,3
r² 0,9939
b. Data Akurasi dan Presisi
Tabel 14 Data Pengukuran Akurasi dan Presisi
Statistical Variable
Standard Concentration (ng/mL)
LLOQ QC LOW QC MED QC High
49,90 149,70 4990,02 7485,03
Measured Data
47,84 146,25 4739,63 7128,78
56,67 159,36 5517,97 7043,28
36,07 133,16 5236,77 7618,48
43,45 151,56 5243,81 7746,00
47,14 131,50 4966,00 7523,29
Within day Mean
46,234 144,366 5140,836 7411,966 Within day (%CV)
6,56 2,03 5,72 3,39
Within day (%Dev)
7,34 3,56 3,02 0,97
4.2 Perhitungan 4.2.1 Penimbangan
a. Penimbangan Asam Salisilat BP= 100 %
Kemurnian bakux Bobot Prosedur SA
BP= 100 %
99,90 %x5mg
BP=5,00mg
b. Penimbangan Celecoxib BP= 100 %
Kemurnian bakux Bobot Prosedur CLX
BP= 100 %
99,90 %x5mg
30
BP=5mg
4.2.2 Persamaan Regresi Liniear X
Ar ea PN
Z Ar ea is
Xi (C on s)
Yi (Res pons e)
Wi (1/X
^2) Xi*
Wi Xi- XW, mean
Yi*
Wi Yi- YW, mea n
Swx y
Swx
x CSS
Yi pred
= axi+
b Yi-
Yi predi
c RSS
17 3,7 6
14 48 0,1
8 50 0,011
9998 508
0,00 040 000
0,0 200 00
- 14,10 82021 90
0,000 0047 999
- 0,001 1416 997
0,00 0006 443
0,07 9616 548
0,000 00000 0521
0,011 7322 880
0,000 2675 628
0,0000 00000 0286
23 5,9
14 99 3,4 1
10 0
0,015 7335 790
0,00 010 000
0,0 100 00
35,89 17978 10
0,000 0015 734
0,002 5920 284
0,00 0009 303
0,12 8822 115
0,000 00000 0672
0,016 7267 677
- 0,000 9931 887
0,0000 00000 0986 12
45, 61
12 98 8,4 8
10 00
0,095 9011 370
0,00 000 100
0,0 010 00
935,8 91797 810
0,000 0000 959
0,082 7595 864
0,00 0077 454
0,87 5893 457
0,000 00000 6849
0,106 6274 020
- 0,010 7262 650
0,0000 00000 1151
32 55
15 39 6,8 9
20 00
0,211 4063 295
0,00 000 025
0,0 005 00
1935, 89179 7810
0,000 0000 529
0,198 2647 789
0,00 0095 955
0,93 6919 263
0,000 00000 9827
0,206 5169 958
0,004 8893 337
0,0000 00000 0060 84
39, 66
19 95 2,5
0 40 00
0,422 9875 955
0,00 000 006
0,0 002 50
3935, 89179 7810
0,000 0000 264
0,409 8460 450
0,00 0100 819
0,96 8202 765
0,000 00001 0498
0,406 2961 833
0,016 6914 123
0,0000 00000 0174 10
33 0,7 8
17 45 5,8
2 60 00
0,591 8243 887
0,00 000 003
0,0 001 67
5935, 89179 7810
0,000 0000 164
0,578 6828 381
0,00 0095 417
0,97 8744 762
0,000 00000 9302
0,606 0753 707
- 0,014 2509 821
0,0000 00000 0056 99
14, 87
12 09 2,9
4 80 00
0,819 8891 254
0,00 000 002
0,0 001 25
7935, 89179 7810
0,000 0000 128
0,806 7475 748
0,00 0100 035
0,98 4037 166
0,000 00001 0169
0,805 8545 582
0,014 0345 672
0,0000 00000 0031 17
37 3,6 3
15 81 2,3 8
10 00 0
1,098 7359 272
0,00 000 001
0,0 001 00
9935, 89179 7810
0,000 0000 110
1,085 5943 766
0,00 0107 863
0,98 7219 458
0,000 00001 1785
1,005 6337 457
0,093 1021 815
0,0000 00000 0867 Su
m
0,00 050 137
0,0 321 42
0,000 0065 887
3,163 3455 285
0,00 0593 29
5,93 9455 535
0,000 00005 9625
0,0000 00000 3611 Me
an
64, 108 202
0,013 1415 506
l 15 Perhitungan Persamaan Garis Linear dan Koefisien Korelasi 4.2.2.1Nilai Slope (b)
b=Swxy Swxx b= 0,00059329
5,939455535 b=0,000099890 4.2.2.2Nilai Intersep (a)
a=Yw ,mean−Gradient x Xw ,mean
a=0,0131415506−(0,000099890.64,108202) a=0,0131415506−0,006403768
a=¿ 0,006737808
31
4.2.2.3Nilai Koefisien Korelasi (r) R2=(CSS−RSS)
CSS
R2=(0,000000059625−0,0000000003611) 0,000000059625
R2=0,993943
4.2.3 Akurasi (% Deviasi) Kurva Kalibrasi
% Dev KK 1 = (52,68−50)
50 x100 %=5,4 %
% Dev KK 2 ¿(90,05−100)
100 x100 %=−9,9 %
% Dev KK 3 ¿(892,62−1000)
1000 x100 %=−10,7 %
% Dev KK 4 ¿(2048,95−2000)
2000 x100 %=2,4 %
% Dev KK 5 ¿(4167,10−4000)
4000 x100 %=4,2 %
% Dev KK 6 ¿(5857,34−6000)
6000 x100 %=−2,4 %
% Dev KK 7 ¿(8140−8000)
8000 x100 %=1,8 %
% Dev KK 8 = (10932,08−10000)
10000 x100 %=9,3 % Low Limit of Quantification (LLOQ)
% Dev LLOQ ¿(46,234−49,90)
49,90 x100 %=−7,34 % Quality Control Low
% Dev QCL ¿(144,366−149,70)
149,70 x100 %=−3,56 % Quality Control Medium
% Dev QCM ¿(5140,836−4990,02)
4990,02 x100 %=3,01 % Quality Control High
% Dev QCH ¿(7411,966−7485,03)
7485,03 x100 %=−0,97 %
32
4.2.4 Presisi
Simpangan Baku (SD) SD =√ ∑ (𝑥−𝑥̅)²𝑛−1
Koefisien Variasi (%CV)
% CV = 𝑆�
% 𝑟𝑎𝑡𝑎−𝑟𝑎𝑡𝑎 𝑥 100%
33
Low Limit of Quantification (LLOQ)
Tabel 16 Data Presisi LLOQ
Perlakukan Konsentari (ng/mL) |� − �̅| |� − �̅|²
1 0,012 0,0008 0,00000064
2 0,012 0,0008 0,00000064
3 0,010 0,0012 0,00000144
4 0,011 0,0002 0,00000004
5 0,011 0,0002 0,00000004
� 0,056 0,0032 0,00000216
𝑥̅ 0,0112 0,00064 0,000000432
SD=
√
0,000002164 %CV=0,00073480,0112 x100 %¿
√
0,00000054 ¿6,56 % = 0,0007348Quality Control Low (QCL)
Tabel 17 Data Presisi QCL
Perlakukan Konsentari (ng/mL) |� − �̅| |� − �̅|²
1 0,021 0,0002 0,00000004
2 0,023 0,00018 0,0000000324
3 0,020 0,00012 0,0000000144
4 0,022 0,0008 0,00000064
5 0,020 0,00012 0,0000000144
� 0,106 0,00142 0,0000007412
𝑥̅ 0,0212 0,000284 0,00000014824
SD=
√
0,00000074124 %CV=0,000430464
0,0212 x100 %
¿
√
0,0000001853 ¿2,03 % = 0,000430464Quality Control Medium (QCM)
Tabel 18 Data Presisi QCM
Perlakukan Konsentari (ng/mL) |� − �̅| |� − �̅|²
34