【試題.答案】依據大考中心公布內容
出 版 / 民國一〇四年七月
發行所 / 7 0 2 4 8 臺南市新樂路 76 號 編輯部 / 7 0 2 5 2 臺南市新忠路 8 - 1 號 電 話 /(06) 2619621 # 314
E @
發行人 / 陳炳亨 總召集 / 周耀琨 總編輯 / 蔣海燕 主 編 / 簡玉蘭 校 對 / 施舜文
NO.00843
化學考科
名 師 / 謝志仁 老師
名 師 / 張 立 老師
名 師.謝志仁 老師
化 學 考 科 試 題 分 析
一 前 言
根據大考中心統計,今年(104)指考報名人數為5萬7千多人,是自 91年大 學指考舉辦以來的新低人數,推測除少子化影響外,應是各大學甄選入學名額逐年增 加,藉由甄選入學管道進入大學的考生變多,相對的指考報名人數也變少。大考中心 也統計出約有2萬3千多名考生報名參加指考化學考科考試,雖然應考人數較往年更 少,但分析本年(104)指定科目考試化學考科試題仍是一件有意義的工作。
自102 年開始,指定科目考試「化學考科」依據99學年度實施之「普通高級中 學課程綱要」(簡稱「99 課綱」)來命題。本年度(104)的考試為99 課綱實施後的 第三年之指定科目考試。
對於104年指考化學考科試題,個人認為「整份試題中間偏難,題型靈活,尤 其部分題目設計以實驗數據為主軸,彰顯實驗課程的重要;試卷中的計算題不多但稍 繁複,雖有生活化的題材入題(低鈉鹽、天燈上升原理、兒茶素、防晒乳等),但整 體難度較去年稍高,預估頂標、高標、均標會較去年稍低」。
本文試著對 104年指考化學考科試題依題型配分、章節配分、試題與解題技巧 做分析與討論,最後對準備指考化學考科提出建議,期能提供莘莘學子未來應考時之 參考。
二 試卷分析
一、試題題型配分
本年度(104)的指考化學考科試題題型,共分兩大部分。第一部分選擇題占84 分,其中單選題有16題(占48分),而多選題有9題(占36分);第二部分非選擇 題占16分,有兩大題各有4小題(每小題2分)。
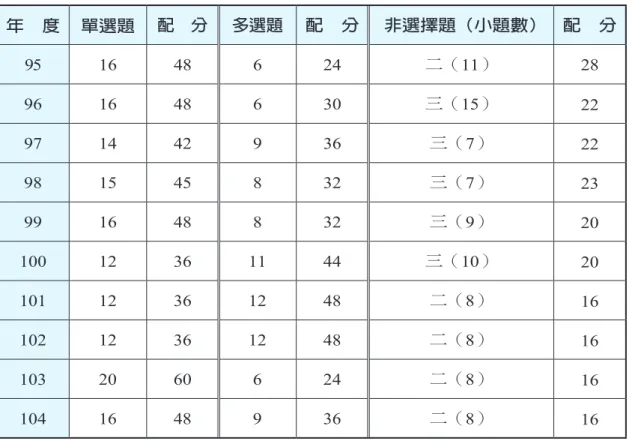
分析過去十年來的指考題型分布,今年指考化學考科試題單選題和多選題的題 數與以往歷屆試題(103 年試題除外)的題數和分布比例相當,本年度(104)試題 的選擇題題數為25題,非選擇題則是維持兩大題8小題的形式,相信未來指考化學 考科題型題數也應會維持這種題型與題數的安排;至於近十年來單、多選題題數比例 相差最多的103年試題,應是特例。
整理近十年指考化學考科之題型題數與配分表,如表1。透過表1的分析可比較 出104年指考題型題數與歷屆指考題型題數分布之異同與變化趨勢。
化學考科
表 1 近十年指考化學考科之題型題數與配分表
年 度 單選題 配 分 多選題 配 分 非選擇題(小題數) 配 分
95 16 48 6 24 二(11) 28
96 16 48 6 30 三(15) 22
97 14 42 9 36 三(7) 22
98 15 45 8 32 三(7) 23
99 16 48 8 32 三(9) 20
100 12 36 11 44 三(10) 20
101 12 36 12 48 二(8) 16
102 12 36 12 48 二(8) 16
103 20 60 6 24 二(8) 16
104 16 48 9 36 二(8) 16
二、試題章節配分比例
分析依 99 課綱命題的102 ∼104 年指考化學考科試題與基礎化學、選修化學 各課程單元分布比例、配分表,如表2。本年度(104)的化學考科試題除少數單元
(如物質的構造與特性、化學與能源、無機化合物等)未有考題外,其餘各單元均有 考題,尤其是基礎化學(三)、選修化學部分幾乎各章都有相關的考題出現。
其中屬基礎化學(三)課程內容的氣體、化學反應速率、化學平衡各單元均有 考題,尤其是化學反應速率單元部分相關的考題就有三題(5.、7.、25.),配分達10 分,再加上氣體、化學平衡單元的考題共有四題(2.、6.、15.及非選擇二、(4)),總 配分高達21分,是近三年來配分比例數最高的一年。
表 2 102 ~ 104 年指考化學考科試題單元分布比例、配分表
冊 次 章 次
102 年 103 年 104 年
單選題 多選題 非選題 配 分 單選題 多選題 非選題 配 分 單選題 多選題 非選題 配 分
基 礎 化 學
(一)
第1章
物質的組成 7. 3 3. 3
第2章
原子結構與性質 4. 3
一、
(1)(2) (3)
6
一、
(1)(2) (3)
6
第3章 化學反應
1.
、
8. 13. 一、
(1) 12 1.
、
2. 6 1. 3
第4章
常見的化學反應 9. 18. 7 13. 3 11.
、
12. 18. 10
基 礎 化 學
(二)
第1章 物質的構造與特性
第2章 有機化合物
11.
、
12. 23. 10 18.
、 19.
一、
(4) 8 22. 4
第3章 化學與能源
第4章
化學與化工 14. 25. 7
基 礎 化 學
(三)
第1章 氣 體
一、
(2)(3) (4)
6 11. 3 2.
、
6. 6
第2章 化學反應速率
5.
、
7. 25. 10
第三章
化學平衡 3. 3 15.
二、
(4) 5
化學考科
冊 次 章 次
102 年 103 年 104 年
單選題 多選題 非選題 配 分 單選題 多選題 非選題 配 分 單選題 多選題 非選題 配 分
選 修 化 學
(上)
第1章 原子構造
21.
、
22. 8 8. 3
第2章
化學鍵結 14. 4 20. 3 9.
17.
、
19. 11
第3章 液體與溶液
4.
、
5. 6 10. 3
第4章 水溶液中酸、鹼、
鹽的平衡
10. 3
二、
(2)(1) (3)(4)
8 14.
二、
(2)(3) 7
第5章
氧化還原反應 16. 4 9. 3 21.
一、
(4) 6
選 修 化 學
(下)
第6章
無機化合物 6.
15.
、 20.
二、
(1)(2) (3) (4)
19 6.
、 7.
、 12.
26. 13
第7章
有機化學 3.
17.
、
22. 11 10. 23. 7 16. 20.
、
24. 11
第8章 化學的應用與
發展
21.
、
24. 8 17. 3 13. 3
實驗 實驗課程 、2.
5. 19. 10
8.
、 15.
、 16.
24. 13 4. 23. 二、
(1) 9
※試題中某些題目為跨章節的考題,在歸類上以試題所涉及的核心概念作為歸類的依據。
進一步分析 102 ∼ 104年指考化學考科試題配分與化學考科課程內容,如表 3,可知非學測範圍的課程內容,包含基礎化學(三)、選修化學(上)及選修化學
(下)等皆是相當重要的課程內容,今年的化學試卷中就占74分(含實驗),對於未 來準備參加指考的同學,要特別注意高三課程的分量對指考而言是相當重要的,今年
(104)試卷中屬選修化學(上)、(下)課程的考題就達48分(含相關實驗考題)。 尤其是當同學在高三下學期忙著準備甄選入學資料與甄試之際,千萬不可輕忽高三相 關課程的學習,也為將來進入大學修習相關課程奠定良好基礎。
表 3 102 ~ 104 年指考化學考科試題與化學考科課程內容配分分布 課程區分 102 年 103 年 104 年
化學考科 課程內容
1. 學測範圍 考題配分
基礎化學(一) 25
35分 15
30分 22
26分 基礎化學(二) 10 15 4
2. 非學測範圍 考題配分
基礎化學(三) 6
55分 6
57分 21
65分
28 30
選修化學(上) 11
23 14
選修化學(下) 38 3. 實驗課程
考題配分 實驗部分 10 10分 13 13分 9 9分
試題與解題討論 三
一、圖形試題的解法:掌握圖形解題關鍵
【解題關鍵】分析歷屆指考化學考科試題,一般而言,圖形或表格化呈現之試題皆是 以實驗數據為主軸所發展出的考題,這類考題是因應紙筆化的測驗,將 實驗的觀察或數據呈現於題目中,用以評量考生對該實驗數據之結果分 析、實驗原理與應用推理的能力,因此面對這類考題,考生閱讀完題目 後應立刻連結該考題是評量課程中所屬單元的概念,並據以回答。
r 圖3是碳酸鈉溶液用0.1000 M鹽酸滴定的滴定曲線。圖中灰色區塊代表指示劑 變色範圍。圖中各點的滴定體積(VHCl,mL)為甲
0、乙 10.00、丙 25.00、丁40.00、戊48.00、己 48.00、庚 50.00、辛55.00。試問在滴定的過程中,
於何處的溶液具有緩衝性質?
A只有丙 B只有戊 C乙與丙
D乙與丁 圖3
化學考科
【答案】 D
【試題分析】本題主要評量的概念為在滴定過程中,何種狀態的溶液具有緩衝性質,
故讀完題目後立刻連結到──緩衝溶液的組成與滴定過程中之溶液組 成物質的變化之相關概念,即可解題。以0.1000 M鹽酸滴定碳酸鈉溶 液,該溶液組成變化為 CO32- HCl HCO3- HCl H2CO3,又滴定達當 量點時,溶液的pH值在滴定曲線圖中會有劇烈變化,而在達當量點前 的溶液組成具緩衝性質,故由滴定曲線圖中可知,丙、庚是在pH值有 劇烈變化的位置,應接近當量點,而乙、丁(在當量點前)的溶液具有 緩衝性質。
g 王同學在25nC及1大氣壓下,量測反應 X→2Y+Z的反應速率。圖6與7是 反應進行中所量測到的反應物 X的濃度與時間的關係。下列有關該反應的敘 述,哪些正確?
圖6 圖7 A此反應為結合反應
B此反應為零級反應
C反應物X的初始濃度為0.067 M
D在反應過程中,反應物X分子之間必須互相碰撞,反應才會發生 E在反應後期,反應物X的濃度不再變化,是因為 X停止反應所造成
【答案】 CD
【試題分析】1 本題主要評量為反應速率的相關概念,由 [X]與 1
[X] 對時間的圖形 可知,當 1
[X] 對時間作圖時,在前6秒為直線(等差數列),符合 二級反應的數據特徵:若反應時間的間隔相等,而一反應物的濃度 以調和數列(倒數成等差)遞增,則此反應中,其反應物的反應級 數為二級。
2 選項分析:
A 錯誤;此反應為分解反應。
B 錯誤;此反應為二級反應。
C 正確;將題圖7直線向前( 1
[X] 軸)延伸,可知在反應初始(0 秒)時, 1
[X] =15,[X]00.067(M) D 正確。
E 錯誤;是因為此反應已達平衡。
二、複雜或較陌生試題的解法:掌握題旨與訊息關鍵
7 某一化學反應經過下列三步驟才完成:
步驟1:H3O+(aq)+HOOH(aq)→HOOH2+
(aq)+H2O(aq) 步驟2:HOOH2+(aq)+Br-(aq)→HOBr(aq)+H2O(aq)
步驟3:HOBr(aq)+HOOH(aq)→Br-(aq)+H3O+(aq)+O2(g)
在此化學反應中,下列對各步驟中的物質所扮演的角色,哪一敘述正確?
AH3O+(aq)是中間物 BHOBr(aq)是產物 CBr-(aq)是催化劑 DHOOH2+(aq)是反應物 EH2O(aq)是中間物
【答案】 C
【試題分析】1 本題在歸類上應屬反應機構的概念,但因試題中主要是評量在步驟 中的各物質所扮演的角色,僅需由反應步驟中觀察各物質所扮演的 角色,而非推論其速率方程式(速率定律),但反應機構非屬化學科 99課綱的內容,故在歸類上本題應屬課綱內容邊緣的考題;又題目 中H2O的狀態應以() 表示較佳。
2 觀察各步驟中的物質變化可知,Br-(aq) 參與反應,最後又以Br-(aq)的 形式出現,故Br-(aq)應是催化劑。
e 異戊二烯學名為2-甲基-1,3-丁二烯,可經由加成聚合產生聚異戊二烯。下列聚 合物中,哪一選項不是由異戊二烯聚合而得?
A B C
D E
化學考科
【答案】 C
【試題分析】異戊二烯(2-甲基-1,3-丁二烯)的結構式為 ,進行加 成聚合產生聚異戊二烯時,其結構中的主鏈應為 4 個C,而甲基應位在 支鏈位置,故不會產生C選項的產物。
三、典型實驗試題的解法:掌握歷屆實驗試題的練習
二、氯化鉛的溶度積常數,可以利用離子交換法測定。實驗步驟如下:
步驟1. 將 25.00毫升的飽和氯化鉛水溶液倒入一個填有以酸處理過的陽離子
交換樹脂的管柱。讓溶液往下流動,進行陽離子交換,並用一個250 毫升的燒杯(甲)承接自管柱流出的溶液。
步驟2. 再從管柱上方加入50毫升純水,可將經離子交換過後的所有離子全部 以同一個甲燒杯收集。
步驟3. 將收集的溶液稀釋成100.00毫升水溶液(乙溶液)。
步驟4. 自乙溶液中取出25.00毫升並加入幾滴酚酞指示劑,以0.0100 M的氫 氧化鈉溶液滴定。當滴入 20.00毫升時達滴定終點。
根據上述實驗,回答下列問題:
1 寫出步驟1和2中所收集到的陽離子和陰離子的化學式。
2 寫出在步驟3,要將收集到的溶液稀釋至100.00毫升水溶液時,必須要使 用的容器名稱;及寫出滴定到達滴定終點時,溶液呈現的顏色。
3 計算乙溶液中氫離子濃度為何?
4 以滴定所得數據,計算氯化鉛的溶度積常數。
【答案】1 H+與Cl-
2 容量瓶,淡紅或粉紅色 3 8*10-3 M
4 1.64*10-5
【試題分析】本題雖與課綱的溶度積相關實驗內容不同,但本題實屬舊課綱之常見試 題,涵蓋了離子交換法、酸鹼滴定及溶度積計算等概念,屬實驗綜合 題,依題意敘述逐步拆解,即可解題。
※ 類題觀摩
為了測定氯化鉛的溶度積Ksp,將25.0 毫升PbCl2的澄清飽和溶液通過足量之強酸 型陽離子交換樹脂(RH)管柱,再以純水沖洗該管柱。從該管流出的溶液及洗液
以0.03 M 氫氧化鈉溶液滴定,達滴定終點時滴入26.5毫升氫氧化鈉溶液,則PbCl2
【答案】 A
【試題分析】1 由酸鹼中和反應求出HCl莫耳數,並推得PbCl2的莫耳數。
2 氯化鉛的溶解平衡為PbCl2(s)Pb2+(aq) +2Cl-(aq)
測定氯化鉛飽和溶液中,PbCl2 之溶解度、鉛離子的濃度,即可推 算其Ksp=4s3=[Pb2+][Cl-]2=4[Pb2+]3
再代入PbCl2 之溶度積常數(Ksp)與溶解度的計量關係式求解。
【解析】1 由酸鹼中和反應得:
HCl莫耳數=NaOH莫耳數=0.03*26.5=0.795(毫莫耳)
2 PbCl2 的澄清飽和溶液通過足量之強酸型陽離子交換樹脂(RH)管柱,
該反應為 PbCl2+2RH → PbR2+2HCl,故 PbCl2的莫耳數=1
2*(HCl莫 耳數)=1
2 *0.795=0.3975(毫莫耳)
3 [PbCl2]= 0.3975
25.0 01.6×10
-2(M),則: Ksp=4s3=4*(1.6*10-2)301.6*10-5
四、其他試題:偶然還是巧合的類似題
【奇妙的巧合】繼103年指考非選擇題一、的1∼3小題和103年自然學測的I、O 題類似後,今年(104)指考的q、w題和104年自然學測的9、0 題也類似。在歷屆的學測與指考之試題中,已連續兩年發生該年的學 測自然考科化學試題與同一年的指考化學考科試題類似情況,真的要 問這是「偶然還是巧合」安排?
q、w題為題組
濃度均為0.1 M的五種水溶液:AgNO3、NaBr、HCl、Na2S、Na2CO3,有如圖2所 示的相互反應關係,亦即將圖中每條連線兩端的溶液等量混合,都會有明顯可辨認 的化學反應。試推演每一種溶液在圖中的位置後,回答題q、w。
圖2 q 下列哪一化學式是溶液丁的溶質?
AAgNO3 B NaBr C HCl D Na2S E Na2CO3 w 下列哪一化學式是溶液乙的溶質?
AAgNO3 B NaBr C HCl D Na2S E Na2CO3
化學考科
【答案】 qC;wA
【試題分析】q、w題是屬基礎化學(一)水溶液中的沉澱反應單元,由題目中給定 的AgNO3、NaBr 、HCl、Na2S、Na2CO3等五種水溶液,配合此五種溶 液彼此間的關係圖(如題圖 2)。先找出乙溶液皆可與其他溶液發生化 學反應,據此判斷乙溶液應為AgNO3水溶液;而甲溶液僅可與乙溶液 發生化學反應,與其他溶液皆不反應,據此可判斷甲溶液應為NaBr水 溶液;而丙和戊兩者不互相反應,可判斷丙、戊應為Na2S、Na2CO3兩 者其一,故丁應為HCl。
※ 104年學測
9、0題為題組
濃度均為 0.1 M 的五種水溶液,其溶質為 KI、HCl、 BaCl2、Na2CO3、Pb(NO3)2。這五種溶液彼此間的關係如 圖 2。圖中每條連線表示兩端的溶液可以發生化學反應,
產生沉澱或氣體,均以肉眼就可辨識。請先確定代號 1∼5 是什麼溶液後,回答9與0題。
9 已知與溶液 2 的反應,可以產生氣體或沉澱,則溶液 2 的溶質是什麼化合物?
A KI B HCl C BaCl2 D Na2CO3 E Pb(NO3)2
0 已知與溶液 4 的反應皆為沉澱反應,且其中有一種沉澱的顏色為黃色,則溶液 4 的溶質是什麼化合物?
A KI B HCl C BaCl2 D Na2CO3 E Pb(NO3)2
【答案】 9D;0E
【試題分析】9、0題亦屬基礎化學(一)水溶液中的沉澱反應單元,同學需先由題 目中給定的 KI、HCl、BaCl2、Na2CO3、Pb(NO3)2 等五種水溶液,配合 此五種溶液彼此間的關係圖(如題圖 2)。找出編號 4 的溶液皆可與其 他溶液發生化學反應,據此判斷編號 4 的溶液應為 Pb(NO3)2 水溶液;
再找出編號 5 的溶液僅可與 Pb(NO3)2 水溶液發生化學反應,據此判斷 編號 5 的溶液應為KI水溶液;而剩餘的三種溶液中,Na2CO3 水溶液皆 可與 HCl、BaCl2 反應,故編號 2 的溶液應為 Na2CO3 水溶液,而編號 1、3 的溶液應為HCl水溶液或 BaCl2水溶液。
圖 2
【奇妙的巧合】今年(104)指考非選擇題一、的1∼3小題是有關元素之原子序、
電子排序及週期表的規律性等相關概念,本題和 103 年指考非選擇題 一、的1∼3小題、103 年自然學測的I、O題、102 年自然學測的 S、D題、101 年自然學測的O、P題類似,還是要問這是「偶然還 是巧合」安排?
一、四種非金屬元素,其代號為:W、X、Y、Z,在元素週期表上均屬不同週期,
僅X與Y在同族,而族數與原子序均以Z為最大。已知:
1 W在第一週期。
2 四元素的原子序相加的和為78。 3 由W、X、Y三元素可組成化合物Q。 4 Q有6個原子及42個質子,分子量為82。 5 Z2在常溫、常壓為有色固體,具有昇華的性質。
6 Z2在含有Z-離子的水中,溶解度大增,可得有色離子Z3-。 回答下列四子題:
1 寫出W及Z的元素符號。
2 寫出由X與Y兩種元素組成的兩種穩定化合物的化學式。
3 寫出Q的化學式。
4 在0.1 M的Z3-水溶液中加0.1 M的 Q水溶液,則溶液立即褪為無色。寫 出該氧化還原的化學反應式。(不需要標出物質的狀態)
【答案】 1 W為H,Z為I 2 SO2與SO3
3 H2SO3
4 H2SO3+I3-+H2O → SO42-+3I-+4H+
【試題分析】1 本題須配合試卷所附的週期表參考資料,依題意W 在第一週期且 W、X、Y 三元素可組成化合物Q,故W不可能為He,W應為H。 2 因Z2 在常溫、常壓為有色固體,具有昇華的性質,且 Z2 在含有Z-
離子的水中,溶解度大增,可得有色離子Z3-
,依元素特性可推得Z 應為I。
3 因W、X、Y、Z四元素的原子序相加的和為78,且僅X與Y在同 族,又已知W為 H(原子序1),Z為I(可由週期表中推得原子序 為 53),可知 X與Y的原子序和為24,且X與Y為同族元素,配 合參考資料中的週期表數據,可得僅第16 族的O、S,兩者的原子 序和為24,故X、Y應為O、S兩者之一。依上述推理,可得各小 題答案。
化學考科
※ 103年指考
一、甲、乙、丙三元素在週期表的位置相接鄰而且均在前三週期,其中有一元素與 另一元素同週期,同時又與第三元素同族。試回答下列問題:
1 已知該三元素的原子序為甲小於乙,乙小於丙。試在答案卷的方格紙上,
劃出甲、乙、丙在週期表上可能的四種相對位置圖。
2 設甲的原子序為Z,其最外層的電子數為n,而該三元素的原子序總和是該 三元素的各原子最外層電子數總和的2倍加1。寫出該三元素的原子序。
3 參考題本封面的週期表,寫出該三元素的元素符號。
4 以通式寫出由原子序Z與原子序(Z-5)兩元素所構成的化合物 2 類,以 通式表示之。
【答案】 1 可能的相對位置圖如下:
甲 乙
丙 甲 乙
丙 甲
乙 丙 甲 乙 丙 2 原子序:6、7、14
3 6C、7N、14Si 4 CnH2n與CnH2n+2
※ 103年學測
I、O題為題組
元素週期表之前三週期的最後元素分別為氦、氖、氬,而其對應原子序為 2、 10、18,已知甲、乙、丙是週期表上相鄰的三種元素,甲與乙是同週期的元素,乙 與丙是同主族的元素。
I 該三種元素的原子序之和為 27,則甲、乙、丙在週期表中的相對位置,最多有 幾種可能?
A1 B2 C3 D4 E5
O 承上題,若此三種元素均為金屬,則甲、乙、丙在週期表中的相對位置,最多 有幾種可能?
A1 B2 C3 D4 E5
【答案】 IB;OA
四 結 語
就 104年指考化學考科試卷來看,整體而言,試題中間偏難,題型靈活,注重 基本概念的理解與應用,尤其部分題目設計以實驗數據為主軸,彰顯實驗課程的重 要;跨章節整合的試題與實驗課程的試題明顯增加,試卷中的計算題不多但稍繁複,
雖有生活化的題材入題,但整體難度較去年稍高。因為是指考試題,所以基礎化學
(三)與選修化學課程相關的內容試題比重高達七成左右(含實驗課程),對於未來 要參加指考的同學來說,一定要確實準備基礎化學(三)與高三的課程內容(選修化 學上、下)。
同學在準備指考時,可先從了解指考化學考科的測驗目標、測驗範圍與測驗內 容入手,並由化學考科五標與答題估算中建立信心,配合使用指考化學考科重要概念 檢核表的複習方式,做有效適當的複習規畫,再由指考化學考科的測驗目標與化學考 科試題題型分析呼應,即可明瞭指考命題的形式與準備方向。(相關資料可於“翰林 我的網”網頁下載,網址: http://www.worldone.com.tw/publish.do?ecId=12)
此外,在 99 課網中,因實驗課程獨立成 1 學分,故在這三年的考題中都彰顯出 實驗課程的重要性,提醒同學應熟悉每個實驗的目的及步驟、各項器材的名稱及操作 方法、實驗數據的處理分析、實驗圖表的判讀與實驗結果的討論等,並多練習相關的 考題(含歷屆實驗試題)。
整理近年考題發現:今年(104)指考非選擇題一、的1∼3小題和 103 年指考 非選擇題一、的1∼3小題、103 年自然學測的I、O題、102 年自然學測的S、D 題、101 年自然學測的O、P題類似,都是有關元素週期表中的元素原子序與電子排 序及其規律性之相關考題,這類考題似乎是目前熱門的題型,同學一定要熟悉這類考 題的推理與解法。
若行有餘力,可進一步練習相關化學競賽的考題(如清華盃、鍾靈化學競賽、
全國或各分區化學實驗能力競賽等)及大陸考題,從中培養、訓練出解題的思考能力 與熟悉各種不同的考題,相信必能在指考中獲取高分。 F
化學考科
名 師.張 立 老師
化 學 考 科 試 題 解 析
參考資料
說明:下列資料,可供回答問題之參考 一、元素週期表(1~36號元素)
大學入學考試中心
102 學年度指定科目考試試題
化學考科
-作答注意事項-
考試時間: 80 分鐘 作答方式:
˙選擇題用 2B 鉛筆在「答案卡」上作答;更正時,應以橡皮 擦擦拭,切勿使用修正液(帶)。
˙非選擇題用筆尖較粗之黑色墨水的筆在「答案卷」上作答;
更正時,可以使用修正液(帶)。
˙未依規定畫記答案卡,致機器掃描無法辨識答案;或未使用 黑色墨水的筆書寫答案卷,致評閱人員無法辨認機器掃描後 之答案者,其後果由考生自行承擔。
˙答案卷每人一張,不得要求增補。
參考資料
說明:下列資料,可供回答問題之參考 一、元素週期表(1~36號元素)
1 H 1.0
2 He 4.0 3
Li 6.9
4 Be 9.0
5 B 10.8
6 C 12.0
7 N 14.0
8 O 16.0
9 F 19.0
10 Ne 20.2 11
Na 23.0
12 Mg 24.3
13 Al 27.0
14 Si 28.1
15 P 31.0
16 S 32.1
17 Cl 35.5
18 Ar 40.0 19
K 39.1
20 Ca 40.1
21 Sc 45.0
22 Ti 47.9
23 V 50.9
24 Cr 52.0
25 Mn 54.9
26 Fe 55.8
27 Co 58.9
28 Ni 58.7
29 Cu 63.5
30 Zn 65.4
31 Ga 69.7
32 Ge 72.6
33 As 74.9
34 Se 79.0
35 Br 79.9
36 Kr 83.8
二、理想氣體常數 R 0 08205 L atm K mol= . −1 −1=8 31 J K mol. −1 −1 莫耳體積=22.4升(STP)
三、甲基紅的變色範圍:pH4.2~pH6.3
四、AgCl Ksp =1.8 10× −10 Hg Cl K2 2 sp =1.4 10× −18 五、Ag(aq)+ +2NH3(aq) ⇌ Ag(NH )3 2(aq)+ K 1.7 10= × 7
二、理想氣體常數R=0.08205 L atm K-1mol-1=8.31 J K-1mol-1 三、酚酞變色範圍:pH=8.2∼10.0,酸型為無色,鹼型為粉紅色 四、log2=0.30,log3=0.48
第壹部分:選擇題(占 84 分)
一、單選題(占 48 分)
說明:第1題至第y題,每題有5個選項,其中只有一個是正確或最適當的選項,
請畫記在答案卡之「選擇題答案區」。各題答對者,得3分;答錯、未作答 或畫記多於一個選項者,該題以零分計算。
1 推廣低鈉鹽飲食的營養師建議:每人每天的飲食中,鈉的含量應低於2400毫 克。若將2400 毫克的鈉換算成實際攝取的食鹽(克),則最接近下列哪一數 值?
A 0.5 B 1 C 3 D 6 E 10
D
基礎化學(一)第3章 化學反應
食鹽NaCl的式量為23.0+35.5=58.5,2400 毫克的鈉相當於2.4克,
則由 2.4 23.0=
x
58.5,x06(克)
難 易 度 中
類 似 題 《指考關鍵60天.化學》第95頁第7題。
《指考週複習.化學》第 7頁第19題、第11頁第8題。
2 平溪放天燈已是國際知名的節慶活動。在天燈下方點火後,即可冉冉上升。下 列有關天燈上升的主要原因,哪一敘述正確?
A因燃燒時耗去氧氣,氣體量減少
B因燃燒升溫,氣體膨脹噴出燈口的反作用力 C因燃燒升溫,氣體變成理想氣體
D因燃燒升溫,氣體膨脹,密度變低 E因燃燒升溫,氣體碰撞燈壁頻率增加
D
基礎化學(三)第1章 氣體
測驗學生是否能夠利用查理定律來解釋天燈上升的原理
天燈利用燃燒來加熱天燈內的空氣,又天燈為開放系統,天燈內的壓 力會等於大氣壓,加熱會使天燈內氣體膨脹而流向天燈外,使天燈內 的氣體密度小於外界而產生浮力,讓天燈上升。
難 易 度 易
類 似 題 《指考關鍵60天.化學》第48頁第2題。
《指考週複習.化學》第 47頁第 16題。
命 中 題 《指考週複習.化學》第46頁第11題、第47頁第17題。
3 若2.0 升的X2氣體與1.0 升的Y2氣體完全反應,兩者均無剩餘,產生 2.0 升 的R氣體,則下列哪一選項是R的化學式?(假設氣體均為理想氣體,且反應 前、後均在同溫、同壓的條件)
A XY B XY2 C XY3 D X2Y E X3Y D
基礎化學(一)第1章 物質的組成
測驗學生是否了解亞佛加厥定律與道耳頓的原子說與其應用
由亞佛加厥定律可知,在同溫、同壓下,氣體的莫耳數與體積成正比,
則依題意可知該反應為2X2(g)+Y2(g)→ 2R(g);再依據道耳頓原子說,化 學反應只涉及原子的重新排列組合,原子本身不會消滅,也不會產生新 原子,可得知R為X2Y。
命中
化學考科
難 易 度 易
類 似 題 《指考關鍵60天.化學》第47頁範例4。
《指考週複習.化學》第16頁第 3題、第52頁第15題、
第106頁第9題。
4 王同學在實驗室配製濃度為0.100 M 的氫氧化鈉水溶液,用來滴定一未知濃度 的鹽酸溶液。在此實驗過程中,最不可能使用下列哪一玻璃器材?
A B C D E
C
基礎化學(一)第1章 物質的組成
選修化學(上)第4章 水溶液中酸、鹼、鹽的平衡
測驗學生是否熟悉配製體積莫耳濃度溶液,以及酸鹼滴定的實驗操作
1配製0.100 M 的 NaOH 水溶液過程如下:
1 以電子天平準確稱取所需質量的NaOH,並置入「E燒杯」中,
再加入適量蒸餾水溶解。
2 將上述溶液完全倒入適當大小的「A容量瓶」中,為避免溶液外 漏,可在容量瓶口放上「D漏斗」,再加入蒸餾水至刻度處。
2 再將裝在滴定管的 NaOH水溶液,滴定已加有適當指示劑、裝在
「B錐形瓶」中未知濃度的 HCl溶液。
故可知此實驗過程中,並不會用到C圓底燒瓶。
難 易 度 易
類 似 題 《指考關鍵60天.化學》第158頁第14題。
命 中 題 《指考週複習.化學》第16頁第1題。
5 下列有關化學反應速率的敘述,哪一項正確?
A放熱反應的反應速率比吸熱反應的反應速率快
B催化劑會改變反應途徑,也可能造成反應級數的改變
C對氣體反應物而言,降低反應物的分壓,則可增加反應速率 D反應速率的快慢與活化能有關,而活化能會隨溫度升高而降低
E定溫下,對一級反應而言,其反應速率常數會隨反應時間增加而減小 B
命中
A 化學反應速率的快慢與活化能有關,而與反應熱為放熱或吸熱無關。
C 對氣體反應物而言,降低反應物的分壓,意即降低反應物的濃度,
由碰撞學說可知,會降低反應速率。
D 活化能會因加入催化劑而降低,但不受溫度影響。
E 在定溫下,一級反應的反應速率常數為定值,不會隨反應時間增加 而減小。
難 易 度 中
類 似 題 《指考關鍵60天.化學》第53頁第10題。
命 中 題 《指考週複習.化學》第51頁第6題、第52頁第16題、
第53頁第20題、第59頁第17題。
6 王同學在以氣閥連接的兩個密閉容器內,分別裝入2.0大氣壓的NH3(g)與1.6大 氣壓的HCl(g),如圖1。之後打開氣閥讓兩氣體充分反應,發現容器內生成白色 固體。若反應後氣體的溫度由27nC升高至87nC,則容器內的壓力,最接近 下列哪一數值(大氣壓)?(連接氣閥的管子體積可忽略不計)
圖1
A 0.20 B 0.24 C 0.40 D 0.48 E 1.8
B
基礎化學(三)第1章 氣體
測驗學生是否了解道耳頓分壓定律在氣體會發生反應時的處理,以及氣 體壓力和絕對溫度的變化關係
1先由波以耳定律可得:
2.0*1.0=PNH3*(1.0+1.0),PNH3=1.0(大氣壓)
1.6*1.0=PHCl*(1.0+1.0),PHCl=0.8(大氣壓)
又由理想氣體方程式 PV=nRT,當 V、T 相同時,Pµn,則:
HCl(g) + NH3(g) → NH4Cl(s) 反應初 0.8 1.0
反應 -0.8 -0.8 生成 反應後 0 0.2
2由理想氣體方程式 PV=nRT,當 V、n 相同時,PµT,則:
0.2 27+273=
P
87+273 ,P=0.24(大氣壓)
命中
化學考科
難 易 度 中
類 似 題 《指考關鍵60天.化學》第152頁第5題。
《指考週複習.化學》第 59頁第 19題、第 60頁非選第1題。
命 中 題 《指考週複習.化學》第49頁非選第1題、第105頁第2題。
7 某一化學反應經過下列三步驟才完成:
步驟1:H3O+(aq)+HOOH(aq)→HOOH2+(aq)+H2O(aq) 步驟2:HOOH2+
(aq)+Br-(aq)→HOBr(aq)+H2O(aq)
步驟3:HOBr(aq)+HOOH(aq)→Br-(aq)+H3O+(aq)+O2(g)
在此化學反應中,下列對各步驟中的物質所扮演的角色,哪一敘述正確?
AH3O+(aq)是中間物 BHOBr(aq)是產物 CBr-(aq)是催化劑 DHOOH2+(aq)是反應物 EH2O(aq)是中間物
C
基礎化學(三)第2章 化學反應速率
測驗學生是否了解反應機構中,反應物、催化劑、反應中間物及產物的 定義
將此化學反應的三個步驟相加可得全反應:
步驟1:H3O+(aq)+HOOH(aq)→HOOH2+(aq)+H2O()
步驟2:HOOH2+(aq)+Br-(aq)→HOBr(aq)+H2O()
+)步驟 3:HOBr(aq)+HOOH(aq)→Br-(aq)+H3O+(aq)+O2(g) 全反應:2HOOH(aq)→O2(g)+2H2O()
故反應物為HOOH,催化劑為 H3O+和 Br-,反應中間物為HOOH2+和 HOBr,產物為 O2和 H2O。
b:題目中,H2O 的狀態應為()非(aq)。
難 易 度 中
類 似 題 《指考週複習.化學》第51頁第8題、第60頁第22題。
8 下列關於S2-、Cl-、Ar、K+和Ca2+等五種原子或離子,哪一敘述錯誤?
A電子數相等
BS2-的總電子數為16
C最外層電子所在的軌域相同
D半徑大小為S2->Cl->Ar>K+>Ca2+
ECl(g)→Cl-(g)所需要的能量為電子親和力,其數值在所有元素中最大 命中
B
基礎化學(一)第2章 原子結構與性質 選修化學(上)第1章 原子構造
測驗學生是否了解原子的構造、電子組態、半徑大小和電子親合力的觀 念
AB S2-、Cl-、Ar、K+和 Ca2+的電子數相等,均為 18 個。
C S2-、Cl-、Ar、K+和 Ca2+的基態電子組態均為1s22s22p63s23p6,最 外層電子所在的軌域相同。
D 電子數相同的原子或離子中,質子數愈多,則核電荷愈大,半徑愈 小。
E 電子親和力最大的元素為 Cl。 b:99課綱應不涉及電子親和力。
難 易 度 中
類 似 題 《指考關鍵60天.化學》第160頁第10題。
《指考週複習.化學》第 102頁第23題。
命 中 題 《指考週複習.化學》第5頁第3題。
9 由H、N、O三種元素可以組成多種化合物。下列敘述何者正確?
(甲)由 2H2O2→2H2O+O2,可知 H2O2具有自身氧化還原能力。
(乙)N2H4具有兩對孤電子對,且沒有雙鍵。
(丙)NO、N2O以及NO2三者是同分異構物。
(丁)NH3與H2O具有分子間氫鍵,但兩者均不具極性。
A只有甲 B只有乙 C甲與乙 D乙與丙 E丙與丁
C
基礎化學(一)第3章 化學反應
基礎化學(二)第1章 物質的構造與特性 選修化學(上)第2章 化學鍵結
選修化學(上)第5章 氧化還原反應
測驗學生是否了解自身氧化還原反應的定義、分子的結構式、同分異構 物的定義,以及分子的極性與形成氫鍵的條件
(甲)2H2O2→2H2O+O2,由氧化數的變化可知,本反應為自身氧化還 -1 -2 0
原反應,即H2O2 具有自身氧化還原能力。
(乙) N2H4的結構式為 ,分子結構中有兩對孤電子對,且沒 有雙鍵。
命中
化學考科
(丙)同分異構物的定義:分子式相同,但結構式不同的化合物,故 NO、N2O 以及 NO2三者不是同分異構物。
(丁)NH3與 H2O 均具有分子間氫鍵,且兩者均為極性分子。
難 易 度 中
類 似 題 《指考關鍵60天.化學》第360頁第3題、第116頁第2題。
《指考週複習.化學》第 78頁第 1題。
命 中 題 《指考週複習.化學》第64頁第14題、第81頁第20題。
0 若用葡萄糖(甲)、溴化鎂(乙)、氯化鈉(丙)、醋酸(丁)等四種化合物,在 25nC製備相同滲透壓且等體積的溶液時,所需質量由大至小排序,則下列哪 一選項的排序正確?
A甲>乙>丙>丁 B乙>甲>丁>丙 C甲>丁>丙>乙 D乙>甲>丙>丁 E甲>乙>丁>丙
E
選修化學(上)第3章 液體與溶液
測驗學生是否了解滲透壓與電解質的依數性質 由π*V=n*R*T*i=W
M*R*T*i,其中π為滲透壓、V 為溶液體 積、W為溶質質量、M為溶質式量或分子量、T為絕對溫度、i為凡特 荷夫因子,則在等滲透壓、同體積且同溫下,Wµ M
i ,則:
甲:葡萄糖 C6H12O6分子量為 180.0,i=1,M i =
180.0
1 =180.0 乙:溴化鎂 MgBr2 式量為 184.1,i=3,M
i =
184.1
3 061.37 丙:氯化鈉 NaCl 式量為 58.5,i=2,M
i = 58.5
2 =29.25
丁:醋酸 CH3COOH 分子量為 60.0,因CH3COOH為弱電解質,故 1<i<2,M
i = 60.0
i ,介於 30.0 ∼60.0 之間。
故所需質量由大至小排序為甲>乙>丁>丙
難 易 度 中
類 似 題 《指考關鍵60天.化學》第100頁範例3。
命 中 題 《指考週複習.化學》第67頁第6題、第80頁第15題、
命中
命中
q、w題為題組
濃度均為0.1 M的五種水溶液:AgNO3、NaBr、HCl、Na2S、Na2CO3,有如圖2所 示的相互反應關係,亦即將圖中每條連線兩端的溶液等量混合,都會有明顯可辨認 的化學反應。試推演每一種溶液在圖中的位置後,回答題q、w。
圖2 q 下列哪一化學式是溶液丁的溶質?
AAgNO3 B NaBr C HCl D Na2S E Na2CO3
C
基礎化學(一)4-2 水溶液中的沉澱反應
基礎化學(一)示範實驗 常見化學反應的型態
測驗學生是否了解常見離子化合物的溶解性,即沉澱表的記憶與應用,
碳酸鹽和硫化物與酸反應可生成二氧化碳和硫化氫氣體 由下表分析與題圖各物質發生的反應數目可判斷出:
甲為 NaBr(aq),僅有 1 個反應;乙為 AgNO3(aq),有 4 個反應;丁為 HCl(aq), 有 3 個反應;丙和戊均有 2 個反應,因無沉澱顏色或氣體味道的資訊,
無法分辨為 Na2S(aq)或 Na2CO3(aq)。
其中 HCl(aq)與其他物質發生的3個反應為:
HCl(aq)+AgNO3(aq)→ AgCl(s)+HNO3(aq) 2HCl(aq)+Na2S(aq) → H2S(g)+2NaCl(aq)
2HCl(aq)+Na2CO3 (aq)→ CO2(g)+H2O()+2NaCl(aq)
AgNO3 NaBr HCl Na2S Na2CO3
AgNO3 AgBr↓
(淡黃)
AgCl↓
(白)
Ag2S↓
(黑)
Ag2CO3↓
(白)
NaBr AgBr↓
(淡黃) - - -
HCl AgCl↓
(白) - H2S↑ CO2↑ Na2S Ag2S↓
(黑) - H2S↑ -
Na2CO3 Ag2CO3↓
(白) - CO2↑ - b:CO2沒有味道,H2S則有臭雞蛋的味道。
化學考科
難 易 度 中
類 似 題 《指考關鍵60天.化學》第18頁第4題。
命 中 題 《指考週複習.化學》第11頁第9題、第15頁非選第2題、
第111頁第4題。
w 下列哪一化學式是溶液乙的溶質?
AAgNO3 B NaBr C HCl D Na2S E Na2CO3 A
基礎化學(一)4-2 水溶液中的沉澱反應
基礎化學(一)示範實驗 常見化學反應的型態
測驗學生是否了解常見離子化合物的溶解性,即沉澱表的記憶與應用,
碳酸鹽和硫化物與酸反應可生成二氧化碳和硫化氫氣體 其中 AgNO3(aq)與其他物質發生的 4 個反應為:
AgNO3(aq)+NaBr(aq)→AgBr(s)+NaNO3(aq) AgNO3(aq)+HCl(aq)→AgCl(s)+HNO3(aq)
2AgNO3(aq)+Na2S(aq)→Ag2S(s)+2NaNO3(aq) 2AgNO3(aq)+Na2CO3(aq)→Ag2CO3(s)+2NaNO3(aq)
難 易 度 中
類 似 題 《指考關鍵60天.化學》第18頁第4題。
命 中 題 《指考週複習.化學》第11頁第9題、第15頁非選第2題、
第111頁第4題。
e 異戊二烯學名為2-甲基-1,3-丁二烯,可經由加成聚合產生聚異戊二烯。下列聚 合物中,哪一選項不是由異戊二烯聚合而得?
A B C
D E
命中
命中
C
選修化學(下)第8章 化學的應用與發展
測驗學生是否了解加成聚合反應中,聚合物與單體之間的結構關係 常見的加成聚合反應有:
1 ,如選項ABC。
2 ,如選項DE。
異戊二烯(2-甲基-1,3-丁二烯),經由加成聚合的聚合物有下列4種:
C 單體為1,3-戊二烯( )。
難 易 度 中
類 似 題 《指考關鍵60天.化學》第131頁範例3。
《指考週複習.化學》第 89頁第 22題、第 97頁非選第2題。
命 中 題 《指考週複習.化學》第87頁第17題。
命中
化學考科
r 圖3是碳酸鈉溶液用0.1000 M鹽酸滴定的滴定曲線。圖中灰色區塊代表指示劑 變色範圍。圖中各點的滴定體積(VHCl,mL)為甲
0、乙 10.00、丙 25.00、丁40.00、戊48.00、己 48.00、庚 50.00、辛55.00。試問在滴定的過程中,
於何處的溶液具有緩衝性質?
A只有丙 B只有戊 C乙與丙 D乙與丁 E乙與庚
D
選修化學(上)第4章 水溶液中酸、鹼、鹽的平衡 測驗學生是否了解緩衝溶液的組成,以及多元鹼的滴定 1 由於碳酸根在水中會發生水解反應而呈鹼性:
CO32-(aq)+H2O()→ HCO3-(aq)+OH-(aq) HCO3-(aq)+H2O()→ H2CO3(aq)+OH-(aq) 故可將其視為二元鹼。
2 以鹽酸來滴定碳酸鈉溶液,由題圖可以判斷出當加入鹽酸25.00 mL 時為第一當量點,此時碳酸鈉全部反應成碳酸氫鈉:
HCl(aq)+Na2CO3(aq)→ NaHCO3(aq)+NaCl(aq)
當加入鹽酸50.00 mL時為第二當量點,此時碳酸氫鈉全部反應成碳 酸:
HCl(aq)+NaHCO3(aq)→ H2CO3(aq)+NaCl(aq) 3 滴定曲線上各點的組成如下表:
b:乙 ∼ 辛的溶液中均含有NaCl,表中未列出。
圖3
加入鹽酸體積(mL) 溶液中溶質組成
甲 0 Na2CO3
乙 10.00 Na2CO3+NaHCO3
丙 25.00 NaHCO3
丁 40.00 NaHCO3+H2CO3
戊、己 48.00 NaHCO3(極少)+H2CO3
庚 50.00 H2CO3
辛 55.00 HCl
難 易 度 難
類 似 題 《指考關鍵60天.化學》第64頁範例1。
《指考週複習.化學》第6頁第9題、第70頁第21題、
第82頁非選第2題。
t 在密閉容器中,某氣體X可分解成氣體Y和氣體 Z。此一可逆反應如下:
mX(g)nY(g)+pZ(g) ΔH=q kJ/mol
反應式中的m、n、p為係數。假設X、Y、Z均為理想氣體,反應的濃度平衡 常數為Kc,而以分壓表示的平衡常數為Kp。若 Kc等於 Kp,且溫度上升時平衡 常數也會增大,則下列敘述,哪一項正確?
A q<0 B m<n+p
C反應達平衡後,定溫下若容器體積加倍,則平衡會向左移動 D反應達平衡後,定溫、定容下加入Ar(g),則平衡會向右移動
E 反應達平衡後,定溫、定容下若加入Y氣體,則當系統達到新的平衡時,Z 氣體的分壓會降低
E
基礎化學(三)第3章 化學平衡
測驗學生是否了解平衡常數Kp與Kc的數學關係式,以及勒沙特列原理 的應用
A 因溫度上升時,平衡向吸熱方向移動,又由題意可知平衡常數會增 大,即正向(向右)反應為吸熱,故ΔH為正值,q>0
B 因 Kp=K(c RT)Δn,Δn=產物氣體係數和-反應物氣體係數和,由題 意可知 Kp=Kc,即Δn=0,故 m=n+p
C 反應達平衡後,定溫下若容器體積加倍,因反應前、後氣體係數和 相等,故平衡不移動。
D 反應達平衡後,定溫、定容下加入Ar(g),則因平衡系各物種濃度均 不變,正、逆反應速率均未改變,故平衡不移動。
E 反應達平衡後,定溫、定容下若加入 Y 氣體,因平衡會向左移動,
故當系統達到新的平衡時,Z 氣體的分壓會降低。
難 易 度 中
類 似 題 《指考關鍵60天.化學》第60頁範例1。
命 中 題 《指考週複習.化學》第57頁第6、7、8題。
命中
化學考科
y 黑巧克力中有豐富的兒茶素。兒茶素有降血壓、改善血液循環、防止心血管疾 病等功效。另外,兒茶素也是茶葉具苦澀味的原因之一。某一兒茶素之結構如 圖4。
下列關於此兒茶素的敘述,哪一項不正確?
A可溶於水
B可形成分子間氫鍵 C含有二級醇的結構 D結構中含有羥基與醚基
E與斐林試劑作用,會產生紅色沉澱
E
基礎化學(二)第2章 有機化合物 選修化學(上)第2章 化學鍵結 選修化學(下)第7章 有機化學
測驗學生是否了解氫鍵、有機化合物的水溶性、官能基與斐林試劑的性 質
A 從題圖4的結構上來看,雖然兒茶素有5個羥基,但其碳數亦有15 個,故推論兒茶素微溶於水。
B 兒茶素結構中含有羥基,故可形成分子間氫鍵。
C 兒茶素結構中含有二級醇的結構。
D 一分子兒茶素結構中含有 5 個羥基與 1 個醚基。
E 兒茶素結構中並沒有醛基,故不與斐林試劑作用,不會產生紅色 Cu2O沉澱。
b:由於A兒茶素對水的溶解度並無實際的數據,而E為明顯的錯誤,
故選E。
難 易 度 中
圖4
二、多選題(占 36 分)
說明:第u題至第g題,每題有5個選項,其中至少有一個是正確的選項。請將 正確選項畫記在答案卡之「選擇題答案區」。各題之選項獨立判定,所有 選項均答對者,得4分;答錯1個選項者,得2.4分;答錯2個選項者,
得0.8分;答錯多於2個選項或所有選項均未作答者,該題以零分計算。
u 下列有關二硫化碳、新戊烷、對苯二甲酸、乙酸乙酯、反丁烯二酸、異丙醇等 六個物質的敘述,哪些正確?
A有三個物質具有π鍵
B對苯二甲酸在六個物質中,沸點最高 C在液態時,有四個物質具分子間氫鍵 D有四個物質的路易斯結構具有孤電子對
E在液態時,有兩個物質分子間作用力主要為分散力
BE
基礎化學(二)第1章 物質的構造與特性 選修化學(上)第2章 化學鍵結
選修化學(下)第7章 有機化學
測驗學生是否了解π鍵、路易斯結構式、孤電子對、氫鍵和分散力,以 及分子化合物沸點的判斷
此六種分子的結構式、形狀與沸點或熔點如下表所示:
化合物 結構式 沸點或熔點
二硫化碳 沸點:46.3nC
新戊烷 沸點:10.0nC
對苯二甲酸 熔點:300nC
昇華:402nC
化學考科
化合物 結構式 沸點或熔點
乙酸乙酯 沸點:77.1nC
反丁烯二酸 熔點:299nC
異丙醇 沸點:82.6nC
故:
A 具有π鍵的物質有四個:二硫化碳、對苯二甲酸、乙酸乙酯和反丁 烯二酸。
B 在六個物質中,對苯二甲酸具氫鍵,且分子量最大,故沸點最高。
b:此選項有爭議,對苯二甲酸和反丁烯二酸均會昇華,無沸點資料。
C 在液態時,具分子間氫鍵的物質有三個:對苯二甲酸、反丁烯二酸 和異丙醇。
D 路易斯結構具有孤電子對的物質有五個:二硫化碳、對苯二甲酸、
乙酸乙酯、反丁烯二酸和異丙醇。
E 在液態時,分子間作用力主要為分散力的物質有兩個:二硫化碳和 新戊烷。
難 易 度 難
類 似 題 《指考關鍵60天.化學》第39頁範例5。
《指考週複習.化學》第 109頁第23題。
命 中 題 《指考週複習.化學》第28頁第22題。
i 胃酸的pH值約為1.5。下列與此胃酸有關的敘述,哪些正確?
A其pOH約為12.5 B氫離子的濃度約為1.5 M
C氫離子的濃度約為1.5 ppm D氫離子的濃度約為0.03 M E氫氧離子的濃度約為0.003 M
命中
A 若在 25nC時,水的離子積常數 Kw=1.00*10-14,pKw=14=pH+ pOH,則pOH值約為12.5為正確;但若在37nC時,水的離子積常 數Kw=2.40*10-14,pKw=13.62=pH+pOH,則pOH值約為12.1。 BCD 胃酸的pH 值約為1.5,則 [H+] 約為0.03 M,相當於30 ppm。 E 由Kw=[H+][OH-],則[OH-]= Kw
[H+],若在25nC時,[OH-] 約為 3.33*10-13 M;但若在37nC時,[OH-] 約為8.00*10-13 M。
難 易 度 中
類 似 題 《指考關鍵60天.化學》第147頁第6題。
命 中 題 《指考週複習.化學》第5頁第4題、第12頁第16題、
第38頁第3題、第107頁第13題。
o 化學鍵結對於分子的物理或化學性質有決定性的影響,而混成軌域是解釋化學 鍵最常用的理論之一。下列關於混成軌域的敘述,哪些正確?
A乙炔的參鍵包含2個σ鍵與 1個π鍵
B乙烯中的π鍵是由2個碳原子的sp2混成軌域重疊而形成 C乙炔中的碳原子有2個sp混成軌域,其分子形狀為直線
D 水分子的形狀為彎曲形,其氧原子的4個 sp3混成軌域中,有2個具有孤電 子對
E 三氯化硼中,硼原子有3個能量相同的sp2混成軌域,分別與3個氯的3p 軌 域鍵結,形成3個σ 鍵
CDE
基礎化學(二)第1章 物質的構造與特性 選修化學(上)第2章 化學鍵結
測驗學生是否了解 σ 鍵與π鍵如何形成、混成軌域與分子形狀,以及 結構式與孤電子對
此四種分子的結構式、混成軌域與形狀如下表所示:
C2H2 C2H4 H2O BCl3
sp sp2 sp3 sp2
直線形 平面形 彎曲形 平面三角形
故:
A 乙炔的參鍵包含 1 個 σ 鍵與 2 個 π 鍵。
B 乙烯中的 π 鍵是由 2 個碳原子的 p 軌域平行重疊而形成。
命中