IRNI MAHAGIANI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Aplikasinya pada Kutu Kebul. Dibimbing oleh NISA RACHMANIA MUBARIK dan SUGENG SANTOSO.
Plant Growth Promoting Rhizobacteria (PGPR) merupakan bakteri perakaran yang dapat memacu pertumbuhan tanaman dan menginduksi ketahanan tanaman terhadap patogen. Beberapa jenis PGPR juga diketahui mampu menghasilkan enzim kitinase. Tujuan penelitian ini ialah menapis PGPR penghasil enzim kitinase yang berasal dari perakaran tanaman cabai serta melakukan uji aktivitas kitinolitiknya terhadap kitin kutu kebul (Bemisia tabaci). Di antara 25 isolat kitinolitik yang berhasil diisolasi, isolat I.5 dan I.21 memiliki indeks kitinolitik tertinggi. Indeks kitinolitik dan aktivitas spesifik tertinggi isolat I.5 masing-masing sebesar 0,94 dan 0,11 U/mg protein. Produksi maksimum kitinase isolat I.5 terjadi pada jam ke-36 kultivasi pada suhu 30oC dan pH 7. Sedangkan indeks kitinolitik dan aktivitas spesifik tertinggi isolat I.21 masing-masing 0,75 dan 0,114 U/mg protein. Produksi maksimum kitinase isolat I.21 terjadi pada jam ke-36 kultivasi pada suhu 55oC dan pH 7. Berdasarkan morfologi sel dan sifat Gram-nya, kedua isolat diidentifikasi sebagai genus Bacillus. Eksoskeleton kutu kebul yang diberi perlakuan dengan kultur sel maupun enzim kitinase dari isolat I.21 mengalami degradasi.
ABSTACT
IRNI MAHAGIANI. Isolation of Chitinase from Pepper Rhizosphere and Its Application on Whitefly. Supervised by NISA RACHMANIA MUBARIK and SUGENG SANTOSO.
IRNI MAHAGIANI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Nama : Irni Mahagiani
NIM : G34103040
Menyetujui:
Pembimbing I, Pembimbing II,
Dr. Nisa Rachmania Mubarik, M.Si Dr. Ir. Sugeng Santoso, M.Agr NIP 132045531 NIP 131841757
Mengetahui:
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor
Dr. Drh. Hasim, DEA NIP 131578806
tiga bersaudara dari pasangan Masdalena dan Irwan Dhani.
Setelah menyelesaikan pendidikan di SMUN 1 Bogor pada tahun 2003, penulis melanjutkan pendidikan di Institut Pertanian Bogor melalui jalur USMI pada Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam.
menyelesaikan laporan karya ilmiah dengan judul Isolasi Enzim Kitinase dari Bakteri Perakaran Tanaman Cabai dan Aplikasinya pada Kutu Kebul. Penelitian ini berlangsung sejak Pebruari hingga Oktober 2007 di Laboratorium Mikrobiologi dan Laboratorium Zoologi, departemen Biologi, FMIPA IPB. Topik penelitian ini didanai oleh Direktorat Pendidikan Tinggi (DIKTI) melalui Program Kreativitas Mahasiswa bidang Penelitian (PKMP) yang diketuai oleh penulis dan telah memperoleh penghargaan sebagai juara II dalam Pekan Ilmiah Mahasiswa Nasional (PIMNAS) tahun 2007.
Ucapan terima kasih penulis sampaikan kepada Ibu Dr. Nisa Rachmania Mubarik, M.Si. dan Dr. Ir. Sugeng Santoso, M.Agr. selaku pembimbing atas bimbingan, informasi dan fasilitas yang telah diberikan selama penelitian. Terima kasih disampaikan Ibu Dra. Taruni atas informasi dan fasilitas pengerjaan mikroteknik yang diberikan. Terima kasih juga disampaikan kepada Dr. Dedi Duryadi Solihin, DEA. selaku penguji dan wakil komisi pendidikan atas saran dan diskusi yang diberikan.
Penulis juga mengucapkan terima kasih kepada para laboran yang telah memberikan bantuan selama penelitian, rekan - rekan di laboratorium mikrobiologi atas kebersamaannya, dan teman - teman Biologi atas dukungannya. Ungkapan terima kasih yang sangat dalam untuk Umi, Abi, Udo, Uyung dan keluarga atas do’a dan pengertiannya.
Semoga karya ilmiah ini bermanfaat.
Bogor, 14 Januari 2008
Irni Mahagiani
DAFTAR GAMBAR... ... vii
DAFTAR LAMPIRAN... vii
PENDAHULUAN Latar Belakang... 1
Tujuan... ... 1
Waktu dan Tempat ... ... 1
BAHAN DAN METODE Alat dan Bahan ... 2
Metode... 2
Peremajaan Isolat ... 2
Penapisan Isolat Kitinolitik ... 2
Penentuan Kurva Tumbuh dan Produksi Enzim... 2
Uji Aktivitas Kitinase dan Penentuan Kadar Protein ... 2
Karakterisasi Kitinase... 2
Uji Kitinase terhadap Kutu Kebul ... 2
HASIL DAN PEMBAHASAN Hasil Indeks Proteolitik dan Indeks Kitinolitik... 3
Penentuan Kurva Tumbuh dan Uji Aktivitas Enzim ... 3
Karakterisasi Kitinase ... 4
Uji Kitinase terhadap Kutu Kebul ... 4
Pembahasan ... 4
SIMPULAN ... 6
SARAN ... ... 6
DAFTAR PUSTAKA ... 6
1 Hasil pewarnaan Gram isolat I.5 (a) dan I.21 (b) masing – masing dengan perbesaran
mikroskop 1000x ... 3
2 Pertumbuhan dan aktivitas spesifik enzim isolat I.5 pada medium produksi pH 7 dan suhu 37oC yang disuplementasi dengan koloidal kitin... 3
3 Pertumbuhan dan aktivitas spesifik enzim isolat I.21 pada medium produksi pH 7 dan suhu 37oC yang disuplementasi dengan koloidal kitin... 3
4 Pengaruh suhu terhadap aktivitas kitinase isolat I.5 pada pH 7 ... 4
5 Pengaruh suhu terhadap aktivitas kitinase isolat I.21 pada pH 7 ... 4
6 Pengaruh pH terhadap aktivitas kitinase isolat I.5 pada suhu 30oC ... 4
7 Pengaruh pH terhadap aktivitas kitinase isolat I.21 pada suhu 55oC ... 4
8 Pengamatan mikroskopik preparat kutu kebul kontrol/tanpa perlakuan (a), dengan pemberian kultur sel I.5 (b), enzim I.5 (c), kultur sel I.21 (d), dan enzim I.21 (e) (perbesaran mikroskop 100X). Waktu inkubasi selama 3 hari, perlakuan pada suhu ruang (± 26oC) ... 5
DAFTAR LAMPIRAN Halaman 1 Media – media yang digunakan dalam penelitian ini ... 8
2 Data isolat bakteri yang tumbuh pada media agar – agar kitin... 9
3 Metode pengukuran aktivitas kitinase (Spindler 1997) ... 10
4 Metode pengukuran kadar protein (Bradford 1976)... 12
5 Pembentukan zona kitinolitik (a) dan zona proteolitik (b) ... 13
6 Data pengukuran absorbansi sel ( 600 nm ) dan aktivitas kitinase pada pH 7... 13
7 Data pengaruh suhu terhadap aktivitas kitinase pada pH 7 ... 14
Di Indonesia buah cabai (Capsicum annuum L.) merupakan salah satu komoditas pertanian yang penting dan bernilai ekonomi tinggi. Produktivitas cabai di Indonesia mencapai 5.79 ton/ha dan pada tahun yang sama harga jualnya mencapai Rp. 12.000 per kg (Deptan 2006). Namun angka produktivitas cabai ini bersifat fluktuatif, salah satunya diakibatkan oleh serangan hama dan penyakit. Berbagai hama dari golongan serangga dan tungau diketahui banyak menyebabkan kerugian. Berbagai jenis patogen, antara lain virus, cendawan, dan bakteri juga diketahui menyerang dan menimbulkan kerugian ekonomi pada tanaman cabai. Serangan penyakit virus kuning keriting per Desember 2004 terjadi
pada luas lahan ± 984.6 ha (Sukamto 2005).
Kemampuan berbagai jenis PGPR untuk menginduksi ketahanan tanaman terhadap serangan patogen, dan juga kemampuannya untuk menghasilkan enzim kitinase memberikan peluang bagi kita untuk menjadikan PGPR sebagai salah satu alternatif untuk mengurangi kerugian akibat hama dan penyakit tanaman. Penggunaan PGPR tidak akan menimbulkan pengaruh negatif sebagaimana yang ditimbulkan oleh penggunaan pestisida yang tidak bijaksana, seperti arsenat, sulfur, dan dikloro-difeniltrikloretan (DDT) yang seringkali meninggalkan residu berbahaya yang mencemari lingkungan dan merupakan ancaman bagi konsumen.
Salah satu jenis hama yang paling merugikan pada tanaman cabai ialah kutu kebul Bemisia tabaci (Homoptera: Aleyrodidae). Kutu kebul merupakan hama yang dapat menyebabkan kerugian secara langsung serta menjadi vektor virus kuning keriting yang merupakan patogen tanaman cabai.
Plant Growth Promoting Rhizobacteria
(PGPR) merupakan rhizobakteri yang dapat meningkatkan pertumbuhan tanaman. PGPR telah diketahui berasosiasi dengan berbagai jenis tanaman. Pardede (2006) berhasil mengisolasi beberapa isolat PGPR dari perakaran tanaman cabai. Organisme ini juga dilaporkan dapat menginduksi ketahanan tanaman. Antibiotik yang diproduksi oleh PGPR mampu mencegah perkembangan patogen yang menyerang tanaman cabai (Tenuta 2005). Perlakuan PGPR pada cabai dapat meningkatkan kemampuan tanaman yang terinfeksi dalam mempertahankan bobot buah yang dihasilkan (Taufik et al. 2005). Samiyyapan (2003) melaporkan bahwa PGPR dapat menghasilkan senyawa antibiotik, asam sianida (HCN), siderofor dan enzim litik seperti kitinase.
Genus Pseudomonas, Bacillus,
Streptomyces, dan Agrobacterium adalah bakteri yang telah banyak diteliti dan dikembangkan sebagai biokontrol terhadap patogen tanaman (Samiyyapan 2003). Genus ini selain mampu menghambat perkembangan penyakit tanaman dengan menginduksi sistem resistensi, juga mampu memproduksi enzim kitinase. Kitinase yang dihasilkan mampu mengonversi kitin menjadi monomer atau
gen chi dari Aeromonas caviae dan ekspresinya pada tanaman kentang varietas Desiree sebagai usaha merakit tanaman yang resisten terhadap cendawan dan nematoda patogen. Ajit (2006) melaporkan bahwa
Pseudomonas fluoresens memiliki kemampuan menghasilkan kitinase ekstraseluler yang berperan sebagai
anti-Fusarium oxysporum, penyebab penyakit layu jaringan.
Kemampuan PGPR dalam memproduksi kitinase memberi peluang untuk dijadikan sebagai biokontrol, karena kitinase yang merupakan enzim pendegradasi kitin [polimer dari β(1,4)-N-asetil-D-glukosamin] berpotensi dalam menekan pertumbuhan dan perkembangan serangga. Pechenik (2005) melaporkan bahwa sebagian besar komponen eksoskeleton serangga merupakan polisakarida kitin yang berasosiasi dengan protein. Sampai saat ini, pemanfaatan kitinase dari PGPR untuk diaplikasikan secara langsung pada serangga belum pernah dilakukan.
Tujuan
Penelitian ini bertujuan untuk menapis PGPR kitinolitik yang berasal dari perakaran tanaman cabai dan menguji aktivitas hidrolisisnya terhadap kitin kutu kebul (Bemisia tabaci).
Waktu dan Tempat
BAHAN DAN METODE
Alat dan Bahan
Alat yang digunakan ialah spektrofotometer (Spectronic 20), alat sentrifugasi, inkubator, penangas air, mikroskop, kamera digital dan peralatan umum laboratorium mikrobiologi.
Bahan yang digunakan ialah isolat Plant Growth Promoting Rhizobacteria (PGPR) yang merupakan koleksi bersama laboratorium Mikrobiologi, Departemen Biologi, FMIPA dan laboratorium Proteksi Tanaman, Departemen Proteksi Tanaman, FAPERTA, IPB.
Metode
Peremajaan Isolat. Isolat yang berasal dari stok medium gliserol diremajakan dengan cara digores kuadran pada media nutrient agar (NA) dan diinkubasi pada suhu 37oC selama 2 hari. Koloni yang tumbuh diinokulasi pada medium agar – agar susu skim dan diinkubasi pada suhu 37oC selama 18 jam (Lampiran 1). Hal ini dilakukan untuk melihat zona bening yang terbentuk dan mengukur indeks proteolitik (IP). Indeks proteolitik diukur dengan cara mengukur diameter zona bening dikurangi diameter koloni, kemudian hasil yang diperoleh dibagi dengan diameter koloni. Setelah itu, koloni yang terbentuk digores kembali pada agar - agar miring NA untuk penyiapan inokulum.
Penapisan Isolat Kitinolitik. Sebanyak 49 isolat bakteri PGPR asal perakaran tanaman cabai ditumbuhkan secara serentak dengan metode gores kuadran pada media agar – agar kitin (Lampiran 1). Setelah diinkubasi selama 48 jam pada suhu 37oC, isolat yang dikelilingi oleh zona bening merupakan isolat yang menghasilkan enzim kitinase ekstraseluler (Lampiran 2).
Isolat yang mampu tumbuh pada media agar – agar kitin tersebut lalu diremajakan pada media baru dengan cara ditotol untuk diukur indeks kitinolitiknya (IK). Pengukuran IK sama seperti menghitung nilai IP. Dua isolat yang memiliki nilai tertinggi ditetapkan sebagai isolat terpilih untuk dikarakterisasi lebih lanjut produksi dan aktivitas enzim kitinasenya.
Penentuan Kurva Tumbuh dan Produksi Enzim. Dua isolat terpilih pada media produksi (Lampiran 1) dan diinkubasi pada suhu 37oC sambil dikocok dengan kecepatan 120 rpm. Setiap 12 jam dilakukan pengambilan kultur untuk dilakukan pengukuran absorbansi sel pada panjang
gelombang 600 nm yang berlangsung sampai dengan 96 jam. Kultur yang sama kemudian disentrifus selama 10 menit dengan kecepatan 8400 g (gravitasi). Supernatan mengandung enzim kitinase ekstrak kasarnya.
Uji Aktivitas Kitinase dan Penentuan Kadar Protein. Uji aktivitas kitinase dilakukan dengan metode Spindler (1997) (Lampiran 3). Sebanyak 300 l 0.3% koloidal kitin, 150 l bufer fosfat pH 7 (0.02 M) dan 150 l filtrat enzim dihomogenasi dalam tabung reaksi dan diinkubasi pada suhu 55oC selama 30 menit. Sedangkan pada kontrol, filtrat enzim dipisahkan dari substrat pada saat inkubasi. Setelah inkubasi, filtrat enzim yang terpisah disatukan, kemudian disentrifus selama 5 menit dengan kecepatan 8400 g (gravitasi). Filtrat yang diperoleh kemudian direaksikan dengan 500 l akuades dan 1000
l reagen Schales. Selanjutnya, campuran tersebut dipanaskan pada suhu 100oC dan diukur absorbansinya pada panjang gelombang 420 nm. Konsentrasi N-asetil glukosamin (GlcNac) dihitung berdasarkan kurva standar yang disiapkan dari larutan stok GlcNac 1000 ppm dengan konsentrasi larutan standar pada selang 0-500 ppm. Satu unit aktivitas enzim kitinase didefinisikan sebagai jumlah enzim yang membebaskan GlcNac sebesar 1 mol per menit pada kondisi analisis yang disebutkan.
Pengukuran kadar protein dilakukan dengan metode Bradford (1976) dengan menggunakan bovin serum albumin (BSA) sebagai standar (Lampiran 4).
Hasil perlakuan diinkubasi selama 3 hari pada suhu kamar (26oC). Selanjutnya dilakukan pengamatan mikroskopik dengan metode whole mount (preparat sediaan utuh) terhadap kemungkinan perubahan struktur morfologi eksoskeleton kutu kebul akibat perlakuan.
HASIL DAN PEMBAHASAN
Hasil
Indeks Proteolitik dan Indeks Kitinolitik. Peremajaan isolat pada media NA dilakukan terlebih dahulu agar diperoleh inokulum yang baik. Dari 49 isolat yang tersedia, dua puluh lima isolat diantaranya memiliki kemampuan kitinolitik (Lampiran 2). Dari 25 isolat kitinolitik diseleksi lima isolat yang memiliki kemampuan kitinolitik dan proteolitik paling baik secara kualitatif (Lampiran 5). Dua dari lima isolat kitinolitik yang memiliki IP dan IK paling besar yaitu isolat I.5 masing– masing sebesar 1.0 dan 0.94, sedangkan pada isolat I.21 masing– masing sebesar 1.21 dan 0.75 (Tabel 1).
Tabel 1 Indeks kitinolitik dan proteolitik dari lima isolat uji
Berdasarkan hasil pewarnaan Gram, kedua isolat kitinolitik memiliki ciri morfologi yang sama. Keduanya merupakan bakteri gram positif, batang dan membentuk endospora (Gambar 1). Ciri – ciri yang ada menunjukkan bahwa kedua isolat termasuk ke dalam genus
Bacillus.
Gambar 1 Hasil pewarnaan Gram isolat I.5 (a) dan I.21 (b) masing – masing dengan perbesaran mikroskop 1000x.
Penentuan Kurva Tumbuh dan Uji Aktivitas Enzim. Penentuan kurva tumbuh kedua isolat dan pengujian aktivitas kitinase dilakukan setiap 12 jam selama 96 jam. Pertumbuhan kedua isolat I.5 dan I.21 pada medium produksi pH 7, suhu 37oC menunjukkan bahwa pada jam ke-12 terjadi kenaikan angka rapat optis yang diukur pada panjang gelambang 600 nm.
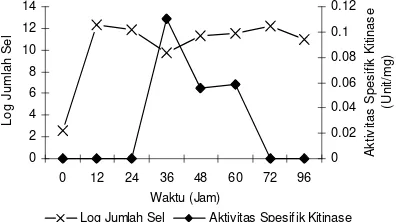
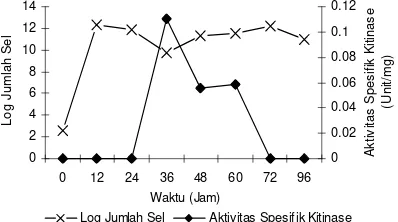
Nilai log jumlah sel dari isolat I.5 tertinggi pada waktu inkubasi 12 jam sebesar 12.326 sel/ml dan mengalami fase stasioner pada jam ke-36, sedangkan aktivitas kitinase maksimum terjadi pada jam ke-36 yaitu sebesar 0.4785 U/ml dan aktivitas spesifiknya sebesar 0.110 U/mg protein kemudian menjadi tidak ada aktivitasnya setelah 72 jam (Gambar 2, Lampiran 6).
Log Jumlah Sel Aktivitas Spesifik Kitinase
Gambar 2 Pertumbuhan dan aktivitas spesifik enzim isolat I.5 pada medium produksi pH 7 dan suhu 37oC yang disuplementasi dengan koloidal kitin.
Nilai log jumlah sel isolat I.21 tertinggi pada waktu inkubasi 12 jam yaitu sebesar 14.409 sel/ml kemudian menurun menjadi 12.933 sel/ml setelah 96 jam.
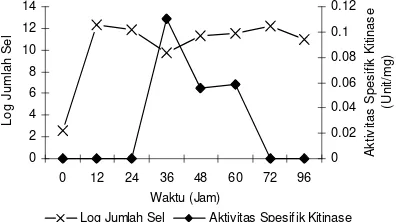
Sedangkan nilai unit aktivitas enzim maksimum terjadi pada jam ke-36 sebesar 0.481 U/ml, aktivitas spesifik sebesar 0.114 U/mg protein dan mulai menurun setelah jam ke-60 (Gambar 3, Lampiran 6).
Log Jumlah Sel Aktivitas Spesifik Kitinase
Karakterisasi Kitinase. Kitinase ekstrak kasar dikarakterisasi berdasarkan pengaruh suhu dan pH (Lampiran 7 & 8). Kitinase isolat I.5 menunjukkan aktivitas tertinggi pada suhu 30oC sebesar 0.489 U/ml dengan aktivitas spesifik 0.113 U/mg protein (Gambar 4, Lampiran 7).
Gambar 4 Pengaruh suhu terhadap aktivitas kitinase isolat I.5 pada pH 7. Gambar 4 Pengaruh suhu terhadap aktivitas
kitinase isolat I.5 pada pH 7.
Kitinase isolat I.21 menunjukkan aktivitas tertinggi pada suhu 55oC yaitu sebesar 0.489 U/ml dengan aktivitas spesifik 0.116 U/mg protein (Gambar 5, Lampiran 7).
Kitinase isolat I.21 menunjukkan aktivitas tertinggi pada suhu 55
nase isolat I.5 memiliki aktivitas Kitinase isolat I.5 memiliki aktivitas Kiti
Gambar 5 Pengaruh suhu terhadap aktivitas kitinase isolat I.21 pada pH 7. Gambar 5 Pengaruh suhu terhadap aktivitas
kitinase isolat I.21 pada pH 7.
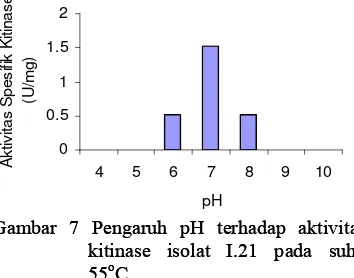
Kitinase isolat I.5 memiliki aktivitas tertinggi pada pH 7 dengan nilai 0.489 U/ml (0.113 U/mg) dan pH 6 dengan nilai 0.474 U/ml (0.082 U/mg) (Gambar 6, Lampiran 8). Kitinase isolat I.21 memiliki aktivitas tertinggi pada pH 7 dengan nilai sebesar 0.364 U/ml dan aktivitas spesifik 0.086 U/mg protein (Gambar 7, Lampiran 8).
Kitinase isolat I.5 memiliki aktivitas tertinggi pada pH 7 dengan nilai 0.489 U/ml (0.113 U/mg) dan pH 6 dengan nilai 0.474 U/ml (0.082 U/mg) (Gambar 6, Lampiran 8). Kitinase isolat I.21 memiliki aktivitas tertinggi pada pH 7 dengan nilai sebesar 0.364 U/ml dan aktivitas spesifik 0.086 U/mg protein (Gambar 7, Lampiran 8).
Gambar 6 Pengaruh pH terhadap aktivitas kitinase isolat I.5 pada suhu 30oC. Gambar 6 Pengaruh pH terhadap aktivitas
kitinase isolat I.5 pada suhu 30
Gambar 7 Pengaruh pH terhadap aktivitas kitinase isolat I.21 pada suhu 55oC.
Gambar 7 Pengaruh pH terhadap aktivitas kitinase isolat I.21 pada suhu 55
Uji Kitinase terhadap Kutu Kebul. Aplikasi kultur isolat dan kitinase ekstrak kasar pada kutu kebul menunjukkan adanya perbedaan apabila dibandingkan antara sampel kutu kebul yang diberi perlakuan dengan kontrol (tanpa perlakuan).
Uji Kitinase terhadap Kutu Kebul. Aplikasi kultur isolat dan kitinase ekstrak kasar pada kutu kebul menunjukkan adanya perbedaan apabila dibandingkan antara sampel kutu kebul yang diberi perlakuan dengan kontrol (tanpa perlakuan).
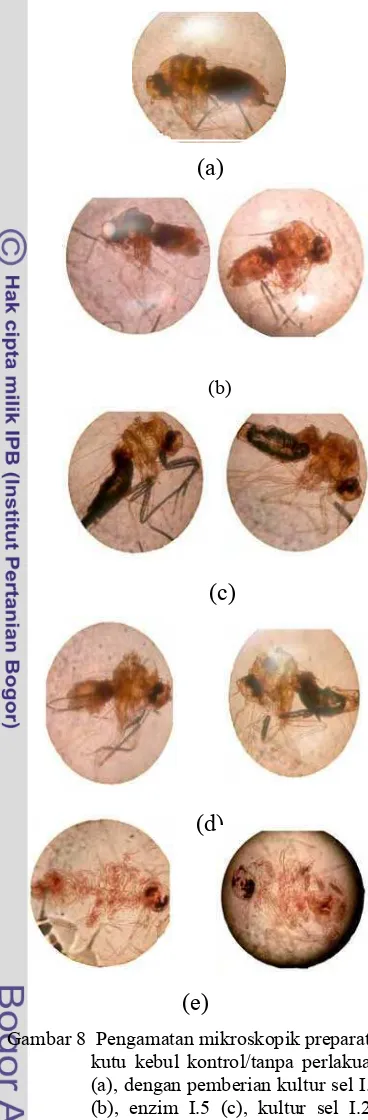
Perubahan struktur segmen – segmen bagian tubuh kutu kebul yang telah mendapat perlakuan dengan kitinase I.21 tampak tidak jelas (kabur), bahkan bagian abdomen kutu terlihat transparan yang menandakan bahwa isi dari abdomen kutu kebul telah keluar akibat rusaknya eksoskeleton serangga tersebut (Gambar 8). Demikian pula dengan segmen kutu kebul yang telah ditetesi kultur isolat I.5, I.21 dan enzim I.5 memperlihatkan jumlah segmen pada toraks dan abdomen yang kurang terlihat jelas bila dibandingkan dengan kontrol. Hal tersebut menunjukkan bahwa kultur sel maupun enzim ekstrak kasar dari isolat I.5 dan I.21 memiliki kemampuan dalam mendegradasi eksoskeleton kutu kebul (Bemisia tabaci) pada konsentrasi 0.001 mg/ml) dengan masa inkubasi tiga hari pada suhu kamar (26oC).
Perubahan struktur segmen – segmen bagian tubuh kutu kebul yang telah mendapat perlakuan dengan kitinase I.21 tampak tidak jelas (kabur), bahkan bagian abdomen kutu terlihat transparan yang menandakan bahwa isi dari abdomen kutu kebul telah keluar akibat rusaknya eksoskeleton serangga tersebut (Gambar 8). Demikian pula dengan segmen kutu kebul yang telah ditetesi kultur isolat I.5, I.21 dan enzim I.5 memperlihatkan jumlah segmen pada toraks dan abdomen yang kurang terlihat jelas bila dibandingkan dengan kontrol. Hal tersebut menunjukkan bahwa kultur sel maupun enzim ekstrak kasar dari isolat I.5 dan I.21 memiliki kemampuan dalam mendegradasi eksoskeleton kutu kebul (Bemisia tabaci) pada konsentrasi 0.001 mg/ml) dengan masa inkubasi tiga hari pada suhu kamar (26
Pembahasan Pembahasan
Isolat PGPR sebelum diinolkulasi ke dalam medium produksi, ditumbuhkan pada medium agar – agar susu skim dan agar - agar kitin untuk penghitungan indeks proteolitik dan kitinolitiknya. Isolat I.5 memiliki IP sebesar 1.0 dan I.21 sebesar 1.21. Perolehan nilai IP yang cukup tinggi memberikan informasi bahwa kedua isolat ini memiliki peluang dalam mendegradasi berbagai substrat yang mengandung protein. Indeks kitinolitik dari kedua isolat ini pun merupakan yang tertinggi daripada isolat lainnya dengan nilai IK I.5 sebesar 0.94 dan I.21 sebesar 0.75. Isolat PGPR sebelum diinolkulasi ke dalam medium produksi, ditumbuhkan pada medium agar – agar susu skim dan agar - agar kitin untuk penghitungan indeks proteolitik dan kitinolitiknya. Isolat I.5 memiliki IP sebesar 1.0 dan I.21 sebesar 1.21. Perolehan nilai IP yang cukup tinggi memberikan informasi bahwa kedua isolat ini memiliki peluang dalam mendegradasi berbagai substrat yang mengandung protein. Indeks kitinolitik dari kedua isolat ini pun merupakan yang tertinggi daripada isolat lainnya dengan nilai IK I.5 sebesar 0.94 dan I.21 sebesar 0.75.
o
C yaitu sebesar 0.489 U/ml dengan aktivitas spesifik 0.116 U/mg protein (Gambar 5, Lampiran 7).
Gambar 8 Pengamatan mikroskopik preparat kutu kebul kontrol/tanpa perlakuan (a), dengan pemberian kultur sel I.5 (b), enzim I.5 (c), kultur sel I.21 (d), dan enzim I.21 (e). Waktu inkubasi selama 3 hari, perlakuan pada suhu ruang (± 26oC) (perbesaran mikroskop 100X).
Meskipun IP dan IK dari kedua isolat merupakan nilai tertinggi, namun tidak selalu ada korelasi korelasi antara diameter zona bening pada medium agar – agar dengan
kemampuan mikroorganisme dalam memproduksi enzim dalam kultur cair. Hal ini disebabkan setiap enzim hanya dapat teraktivasi oleh adanya substrat yang spesifik (Lehninger 1994).
(a)
Berdasarkan hasil pewarnaan Gram, kedua isolat pilihan tersebut termasuk ke dalam genus Bacillus. Taufik et al. (2005) melaporkan adanya galur bakteri yang berasal dari genus Bacillus dan Pseudomonas yang biasa dimanfaatkan sebagai agen kontrol biologi karena kemampuannya dalam menghambat pertumbuhan penyakit tanaman dengan menginduksi sistem resistensi.
Aeromonas caviae WS7b dilaporkan mampu menghasilkan kitinase yang mampu menghambat perkembangan Fusarium oxysporum sehingga berpotensi sebagai antifungi (Wiendi et al. 2005).
(b)
(c)
Pada medium yang disuplementasi dengan koloidal kitin, kedua isolat mensekresikan protein yang memiliki aktivitas kitinase. Aktivitas kitinase isolat I.5 tertinggi diperoleh pada waktu produksi jam ke-36 yaitu pada saat densitas sel kedua isolat mengalami penurunan.
Suhu optimum aktivitas enzim I.5 yaitu pada 30oC dengan pH 7. Pada waktu produksi yang sama, aktivitas kitinase isolat I.21 juga mencapai nilai tertinggi dari hasil inkubasi enzim pada suhu 55oC dengan pH 7 selama 30 menit. Purwani (2002) melaporkan bahwa kitinase dari mikrob termofilik mempunyai ketahanan terhadap panas yang baik yaitu dari suhu 20-80oC. Barboza - Corona et al. (2003) melaporkan bahwa enzim kitinase asal B. thuringiensis memiliki kisaran pH optimum 4 – 9 serta suhu optimum 57.2oC saat diinkubasi pada pH 6. Selain itu, telah dilakukan pula purifikasi dan karakterisasi termostabil kitinase dari B. licheniformis yang memiliki kisaran pH luas dan stabil pada suhu tinggi (Toharisman 2004).
(d)
(e)
Eksoskeleton serangga tersusun atas tigalapisan meliputi lapisan pelindung yang
Kitinase adalah enzim yang menghidrolisis ikatan glikosidik β-1,4 senyawa kitin sehingga terbentuk oligomer kitin yang lebih sederhana dan lebih mudah didegradasi. Berdasarkan aktivitasnya kitinase dibedakan menjadi endokitinase dan eksokitinase. Sedangkan eksokitinase terbagi menjadi dua golongan, yaitu kitobiosidase dengan hasil potongan berupa dimer dan β-N-asetilglukosaminidase dengan hasil pemotongan berupa monomer N-asetil glukosamin (Cohen-Kupiec 1998).
Pengamatan mikroskopis terhadap sampel kutu kebul dewasa yang telah diberi perlakuan enzim dan kultur sel isolat yang dilakukan setelah hari ke-3 inkubasi menunjukkan adanya kerusakan pada bagian eksoskeletonnya. Hal ini menimbulkan dugaan bahwa enzim dan kultur sel bakteri isolat I.5 dan I.21 memiliki aktivitas kitinolitik yang mampu mendegradasi senyawa kitin penyusun eksoskeleton. Hasil degradasi eksoskeleton kutu kebul yang paling optimal teramati pada preparat kutu kebul yang telah diberi perlakuan enzim I.21. Hal ini menunjukkan bahwa kitin pada kutu kebul merupakan substrat yang dapat dihidrolisi oleh enzim I.21. Selain itu, aktivitas spesifik kitinase I.21 pada substrat koloidal kitin pun lebih tinggi dibandingkan kitinase 1.5 pada waktu inkubasi 36 jam.
s
Kutu kebul yang telah diinkubasi dengan diberi perlakuan kitinase pada suhu kamar (±26oC) menunjukkan adanya degradasi eksoskeleton kutu kebul. Kemampuan enzim I.21 dalam menghidrolisis kitin kutu kebul ini terjadi bukan pada suhu optimalnya (55oC), melainkan pada suhu kamar. Hal ini terjadi karena enzim kitinase I.21 dapat menghidrolisis kitin kutu kebul sebagai substrat yang spesifik pada suhu kamar. Vaaje-Kolstad (2005) melaporkan bahwa situs aktif pengikat protein pada polimer kitin (chitin-binding protein) mempengaruhi perubahan struktur kitin dan mampu meningkatkan penggunaan kitin sebagai substrat. Hal ini menguatkan alasan bahwa efektivitas kitinase dari kedua isolat dalam mendegradasi kitin kutu kebul terkait pada non-katalitik chitin- binding protein pada kutikula kutu kebul.
Aplikasi kitinase dalam pengendalian serangga dapat dilakukan dengan beberapa cara, diantaranya melalui kloning gen kitinase. Barboza-Corona et al. (2003) melaporkan kloning gen chi asal Bacillus thuringiensis
pada genom Eschericia coli, dapat mengekspresikan kitinase dengan aktivitas enzim dua kali lebih tinggi akibat adanya
sinergisme antara kitinase dengan endotoksin. Aplikasi kitinase juga dapat dilakukan secara tidak langsung melalui penaburan kitin ke tanah sekitar tanaman untuk menginduksi disekresikannya kitinase oleh mikrob kitinolitik (Metcalfe et al. 2002). Efektivitas pengendalian hama tanaman menggunakan gen kitinase akan sangat bergantung pada kesesuaian substrat yang akan didegradasi (Leger et al. 1996).
SIMPULAN
Isolat bakteri PGPR yang berasal dari perakaran cabai (isolat I.5 dan I.21) menghasilkan enzim kitinase ekstraseluler. Aktivitas enzim kitinase dari isolat bakteri I.5 optimum pada suhu 30oC dan pH 7, dan mampu bekerja pada kisaran pH 4–10. Sedangkan yang berasal dari isolat I.21 menunjukkan aktivitas optimum pada suhu 55oC dan pH 7, dan mampu bekerja pada kisaran pH 6–8. Enzim kitinase dari kedua isolat PGPR tersebut memiliki kemampuan merusak eksoskeleton kutu kebul.
SARAN
Perlu dilakukan penelitian lanjutan mengenai waktu inkubasi optimum saat kitinase maupun kultur sel I.21 mulai menguraikan kitin kutu kebul.
DAFTAR PUSTAKA
Ajit NS, Verma R, Shanmugam V. 2006. Extracellular chitinases of flourescent
Pseudomonads antifungal to Fusarium oxysporum f. sp. Dianthi causing carnation wilt. Curr Microbiol 52 (4): 310-6.
Barboza-Corona JE et al. 2003. Cloning, sequencing, and expression of the chitinase gene chi A74 from Bacillus thuringiensis. Appl Environ Microbiol 69: 1023-1029.
Bashan Y, De-Bashan LE. 2002. Protection of tomato seedlings against infection by
Pseudomonas syringae pv. tomato by using the plant growth-promoting bacterium Azospirillum brasilense. Appl Environ Microbiol 68(6):2637-43.
Cohen-Kupiec R, Chet I. 1998. The molecular Biology of chitin digestion. Curr Opinion Biotechnol 9: 270-277.
[Deptan] Departemen Pertanian. 2006. Produktivitas cabe menurut provinsi tahun 2002 – 2006. http://setjen.deptan.go.id/deptan/infoekse
kutif/horti/EIS07/Produktivitas%20Cabe4 .htm [26 Des 2007].
Harman GE, Broadway RM, Tronsmo A, dan Lorito M, penemu. 1992. Purified chitinases and use thereof. US Patent 5 173 419.
Leger RJST, Joshi L, Bidochka MJ, Rizzo NW, Roberts DW. 1996. Characterization and ultrastructural localization of chitinases from Metharizium anisopliae,
M. flavoviride and Beauveria bassiana
during fungal invasion of a host (manduca sexta) cuticle. Appl Environ Microbiol 62: 907-912.
Lehninger A. 1994. Dasar-Dasar BiokimiaI. Thenawidjaja M, penerjemah. Jakarta: Erlangga. Terjemahan dari : Principles of Biochemistry.
Manti I. 2006. Ancaman penyakit virus pada usaha tani cabe di Sumbar http://sumbar.litbang.deptan.go.id.html [26 Jun 2006].
Metcalfe AC, Krsek M, Gooday GW, Prosser J, Wellington EMH. 2002. Molecular analysis of a bacterial chitinolytic community in an upland pasture. Appl Environ Microbiol 68:5042-5050. Moussian B, Christof S, Ursula M, Jurgen B,
Heinz S. 2006. Cuticle differentiation during Drosophila embryogenesia.
Matrix Biol 26:337-347.
Nugroho et al. 2003. Isolasi dan karakterisasi sebagian kitinase Trichoderma viridae
TNJ63. J Nat Indonese 5(2):101-106. Pardede H. 2006. Penggunaan rhizobakteri
untuk proteksi cabai keriting terhadap infeksi CMV dan Chi VMV: pengaruh infeksi tunggal dan ganda terhadap komponen hasil cabai [skripsi]. Bogor: Institut Pertanian Bogor.
Pechenik JA. 2005. Biology of the Invertebrates. Edisi ke - 5. New York: McGraw-Hill.
Purwani EY. 2002. Karakteristik enzim kitinase termostabil dari bakteri termofilik Bacillus sp. 13.26 [tesis]. Bogor: Institut Pertanian Bogor.
Samiyappan R. 2003. Molecular mechanism involved in the PGPR mediated suppression of insect pests and plant pathogens attacking major agricultural
and horticultural crops in India. 6th International PGPR Workshop. Calcuta, [5-10 Oktober 2003].
Spindler KD. 1997. Chitinase and chitosanase assays from Muzarelli RAA and MG Peter, editor. Chitin Handbook. Grottammare: Alda Tecnografica p.229-235.
Sukamto. 2005. Mengenali virus tanaman cabai. http://www.beritaiptek.com/2berita -berita iptek-2005-07-13- Mengenali-
Virus- Tanaman-Cabai. Shtml[18 Jan 2008].
Taufik M, Hidayat SH, Suastika G, Sumawar SM, dan Sujiprihati S. 2005. Kajian Plant Growth Promoting Rhizobacteria sebagai agen proteksi cucumber mosaic virus dan chilli veinal mottle virus pada cabai. Hayati 12: 139-144.
Tenuta M. 2005. Plant growth promoting rhizobacteria: prospects for increasing nutrient acquisition and disease control. [terhubungberkala]
www.umanitoba.ca/afs/agronomists_conf /2003/pdf/tenuta_rhizobacteria.pdf[3Okto ber 2006].
Toharisman A. 2004. Purification and characterization of thermostable chitinases from Bacillus licheniformis
MS-2 [disertasi]. Bogor: Institut Pertanian Bogor.
Vaaje-Kolstad G, Svein JH, Daan MF, Bjornar S, Vincent GH. 2005. The non-catalitic chitin-binding protein CBP21 from Serratia marcescens is essential for chitin degradation. Biol Chem 280:28492-28497.
Wang SL, Chang WT. 1996. Purification and characterization of two bifunctional chitinases/lysozimes extracellularly produce by Pseudomonas aeruginosa K-187 in a shrimp and crab shellpowder medium. Appl Environ Microbiol 63:380-386.
Wiendi NM. 2005. Konstruksi fusi transkripsi gen kitinase asal Aeromonas caviae
Lampiran 1 Media – media yang digunakan dalam penelitian ini • Media peremajaan
Nutrient Agar (Difco) 2.8 g dalam 100 ml aquades • Media agar – agar susu skim (100 ml)
Komposisi:
Susu skim 0.5 g Nutrient agar (Difco) 2.8 g
• Media agar – agar kitin (100 ml) Komposisi:
MgSO4.7H2O 0.01g
K2HPO4 0.1 g
NaCl 0.1 g Ekstrak khamir 0.7 g Agar Bacto 1.5 g Koloidal kitin 1.0 g
• Media produksi kitinase (100 ml) Komposisi:
MgSO4.7H2O 0.01g
K2HPO4 0.1 g
NaCl 0.1 g Ekstrak khamir 0.7 g Agar Bacto 1.5 g Koloidal kitin 0.3 g
Lampiran 2 Data isolat bakteri yang tumbuh pada media agar - agar kitin
Tepian : bergerigi Elevasi: datar
4 II.7 + Warna :
kekuningan Tepian : bergerigi Elevasi: datar
Tepian : bergerigi Elevasi: rata Tepian : cembung Elevasi: bergelombang
15 II.15 + Warna :
kekuningan Tepian : bergerigi Elevasi: datar
16 II.14 + Warna : putih keruh
Tepian : bergerigi Elevasi: datar
17 II.13 + Warna : putih keruh
Tepian : licin Elevasi: datar
18 II.12 + Warna : putih
Tepian : bergerigi Elevasi: datar Tepian : bercabang Elevasi: datar
Tepian : bergerigi Elevasi: cembung
27 I.22 -
28 I.23 -
29 I.24 -
30 I.25 + Warna : Bening
Tepian : bercabang Elevasi: datar
31 I.26 + Warna :
kekuningan Tepian : bergerigi Elevasi: datar
32 I.27 -
33 I.28 + Warna : kecoklatan
Tepian : bergerigi kecil
Tepian : bercabang Elevasi: datar
38 I.2 + Warna : putih
Tepian : bercabang Elevasi: datar
39 I.3 + Warna : putih
Tepian : bercabang Elevasi: datar
40 I.4 + Warna : putih
Tepian :licin Elevasi: datar
41 I.5 + Warna : putih
Tepian : bercabang Elevasi: datar
Tepian : bergerigi Elevasi: cembung
48 I.15 + Warna : kecoklatan
Tepian : seperti bunga Elevasi: datar
49 I.16 -
Lampiran 3 Metode pengukuran aktivitas kitinase (Spindler 1997)
Sebanyak 5 ml kultur disentrifuse dengan kecepatan 10000 rpm selama 10 menit.
Bahan Sampel (µl) Kontrol (µl) Kont-E (µl) Substrat koloidal kitin 900 900 -
Bufer fosfat 450 450 -
Enzim 450 - 450
diinkubasi pada suhu 55oC selama 30 menit, reaksi dihentikan pada suhu 100oC selama 5 menit,
campuran didinginkan selama 10 menit, kemudian Kont-E dicampurkan pada kontrol.
disentrifuse pada 10000 rpm (8400 g), selama 5 menit.
Bahan Sampel (µl) Kontrol (µl) Blanko (µl)
Campuran enzim 600 600 -
Akuades 1500 1500 2100
Reagen Schales 3000 3000 3000
direbus 10 menit, suhu 100oC. ukur pada = 420 nm
Rumus:
• Aktivitas enzim
Y (absorbansi) = (Ab-As)-(Ab-Ac) X = konsentrasi (ppm)
Unit/ml = ppm x fp BM x V x t
• Aktivitas spesifik
Unit/mg = Aktivitas enzim (U/ml) Kadar protein (mg/ml) Keterangan:
U : Unit aktivitas 1 ml enzim yang membebaskan GlcNac sebesar 1 mol/ menit As : Absorbansi sampel
Ab : Absorbansi blanko Ac : Absorbansi kontrol
• Data standar N-asetil glukosamin
Konsentrasi (ppm)
Absorbansi (420 nm)
0 0.495
100 0.456
200 0.415
300 0.365
400 0.319
• Kurva standar N- asetil glukosamin
y = -0.0005x + 0.5005 R2 = 0.9974
0 0.1 0.2 0.3 0.4 0.5 0.6
0 100 200 300 400 500 600
Konsentrasi N-Asetilglukosamin (ppm)
A
b
s
o
rb
an
si
(
420
n
m
Lampiran 4 Metode pengukuran kadar protein (Bradford 1976)
Pereaksi Blanko (ml) Standar (ml) Sampel (ml) Standar Protein (Tirosin 5 mM) 0 0.1 0
Akuades 0.1 0 0 Enzim 0 0 0.1 Reagen Bradford 5 5 5
Dikocok kuat dengan vortex, didiamkan selama 20 menit Campuran diukur pada 595 nm
• Reagen Bradford Komposisi
Comassie Blue G-250 10 mg Etanol 95% 5 ml H3PO4 10 ml
H2O 85 ml
disaring dengan kertas saring
diencerkan dengan H2O (1 : 5)
• Larutan Stok Protein
Bovin serum albumin 10 mg Akuades 10 ml
• Kurva standar protein
y = 0.356x + 0.026
R2 = 0.9684
0 0.05 0.1 0.15 0.2 0.25 0.3 0.35 0.4 0.45
0 0.2 0.4 0.6 0.8 1.0
Konsentrasi Protein (mg/ml)
Absorbansi (
Lampiran 5 Pembentukan zona kitinolitik (a) dan zona proteolitik (b)
a
b
Isolat pada media susu skim
Zona Bening
Isolat pada media agar kitin
Zona Bening
Lampiran 6 Data pengukuran absorbansi sel ( 600 nm ) dan aktivitas kitinase pada pH 7 • Isolat I.5
Waktu (jam) 0 12 24 36 48 60 72 96
Absorbansi 2.548 12.326 11.880 9.728 11.342 11.584 12.178 10.954
Aktivitas kitinase (U/ml) 0 0 0 0.479 0.242 0.238 0 0
Aktivitas spesifik (U/mg) 0 0 0 0.110 0.056 0.059 0 0
• Isolat I.21
Waktu (jam) 0 12 24 36 48 60 72 96
Absorbansi 12.540 14.409 14.060 13.626 13.369 13.335 13.644 12.933
Aktivitas kitinase (U/ml) 0 0.479 0.486 0.4805 0.232 0.244 0.238 0.228
Aktivitas spesifik (U/mg) 0 0.109 0.113 0.114 0.056 0.0585 0.058 0.050
Keterangan : Suhu inkubasi sel : 37oC Suhu inkubasi kitinase : 55oC
Data standar pertumbuhan sel • Isolat I.5
Rasio 1:1 1:2 1:4 1:8 1:16
Absorbansi 0.014 0.025 0.052 0.156 0.218
Log Jumlah Sel 9.792 10.093 10.394 10.635 10.996
• Kurva standar pertumbuhan sel isolat I.5
•
y = 0.0539x - 0.0687 R2 = 0.9039
-0.05 0 0.05 0.1 0.15 0.2 0.25
9.792 10.093 10.394 10.635 10.996
Log Jumlah sel
A
b
so
rb
an
s
i 60
0 n
• Isolat 1.21
Rasio 1:1 1:2 1:4 1:8 1:16
Absorbansi 0.022 0.044 0.083 0.254 0.366
Log Jumlah Sel 6.164 6.465 6.767 7.068 7.369
• Kurva standar pertumbuhan sel isolat 1.21
y = 0.298x - 1.8627 R2 = 0.9007
-0.05 0 0.05 0.1 0.15 0.2 0.25 0.3 0.35 0.4
6 6.2 6.4 6.6 6.8 7 7.2 7.4 7.6
Log Jumlah Sel
Ab
so
rb
an
si
6
0
0
n
m
Lampiran 7 Data pengaruh suhu terhadap aktivitas kitinase pada pH 7 • Isolat I.5
Suhu (oC) 25 30 35 40 45 50 55 60
Aktivitas kitinase (U/ml) 0 0.489±0 0 0 0 0 0.484±0.008 0.488±0.013
Aktivitas spesifik (U/mg) 0 0.113 0 0 0 0 0.111±0.001 0.112±0.001
• Isolat I.21
Suhu (oC) 25 30 35 40 45 50 55 60
Aktivitas kitinase (U/ml) 0 0 0 0 0 0.466±0.033 0.489±0 0
Aktivitas spesifik (U/mg) 0 0 0 0 0 0.111±0.004 0.116±0 0
Lampiran 8 Data pengaruh pH terhadap aktivitas kitinase • Isolat I.5
pH 4 5 6 7 8 9 10
Aktivitas kitinase (U/ml) 0.122±0.173 0.334±0.219 0.474±0.022 0.489±0 0.357±0.169 0.122±0.173 0.238±0
aktivitas spesifik (U/mg) 0.028±0.019 0.077±0.024 0.109±0.002 0.113±0 0.082±0.018 0.0281±0.019 0.055±0
• Isolat I.21
pH 4 5 6 7 8 9 10
Aktivitas kitinase (U/ml) 0 0 0.122 ±0.173 0.364±0.177 0.122±0.173 0 0
aktivitas spesifik (U/mg) 0 0 0.029±0.019 0.086±0.020 0.029±0.019 0 0
IRNI MAHAGIANI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Aplikasinya pada Kutu Kebul. Dibimbing oleh NISA RACHMANIA MUBARIK dan SUGENG SANTOSO.
Plant Growth Promoting Rhizobacteria (PGPR) merupakan bakteri perakaran yang dapat memacu pertumbuhan tanaman dan menginduksi ketahanan tanaman terhadap patogen. Beberapa jenis PGPR juga diketahui mampu menghasilkan enzim kitinase. Tujuan penelitian ini ialah menapis PGPR penghasil enzim kitinase yang berasal dari perakaran tanaman cabai serta
melakukan uji aktivitas kitinolitiknya terhadap kitin kutu kebul (Bemisia tabaci). Di antara 25
isolat kitinolitik yang berhasil diisolasi, isolat I.5 dan I.21 memiliki indeks kitinolitik tertinggi. Indeks kitinolitik dan aktivitas spesifik tertinggi isolat I.5 masing-masing sebesar 0,94 dan 0,11 U/mg protein. Produksi maksimum kitinase isolat I.5 terjadi pada jam ke-36 kultivasi pada suhu
30oC dan pH 7. Sedangkan indeks kitinolitik dan aktivitas spesifik tertinggi isolat I.21
masing-masing 0,75 dan 0,114 U/mg protein. Produksi maksimum kitinase isolat I.21 terjadi pada jam
ke-36 kultivasi pada suhu 55oC dan pH 7. Berdasarkan morfologi sel dan sifat Gram-nya, kedua
isolat diidentifikasi sebagai genus Bacillus. Eksoskeleton kutu kebul yang diberi perlakuan
dengan kultur sel maupun enzim kitinase dari isolat I.21 mengalami degradasi.
ABSTACT
IRNI MAHAGIANI. Isolation of Chitinase from Pepper Rhizosphere and Its Application on Whitefly. Supervised by NISA RACHMANIA MUBARIK and SUGENG SANTOSO.
Plant Growth Promoting Rhizobacteria (PGPR) is rhizobacteria which can promote plant growth. Several kinds of PGPR also have been known producing kitinase. The aims of this experiments were to screen PGPR which can produce chitinase from pepper rhizosphere and test
their chitinolytic activity to degrade exosceleton of whitefly (Bemisia tabaci). Among isolated 25
chitinolytic bacteria, strains I.5 and I.21 showed highest chitinolytic index. The highest chitinolytic index and specific activity of strain I.5 were 0.94 and 0.11 U/mg proteins, respectively. Maximum production of I.5 chitinase was occured after 36 hours cultivation under
30oC and pH 7. The highest chitinolytic index and specific activity of strain I.21 were 0.75 and
0.114 U/mg proteins, respectively. Maximum production of I.21 chitinase was occured after 36
hours cultivation under 55oC and pH 7. Based on their Gram and morphological properties, both
of them were identified as Bacillus. Exosceleton of whitefly treated either by cell culture or
Di Indonesia buah cabai (Capsicum annuum L.) merupakan salah satu komoditas pertanian yang penting dan bernilai ekonomi tinggi. Produktivitas cabai di Indonesia mencapai 5.79 ton/ha dan pada tahun yang sama harga jualnya mencapai Rp. 12.000 per kg (Deptan 2006). Namun angka produktivitas cabai ini bersifat fluktuatif, salah satunya diakibatkan oleh serangan hama dan penyakit. Berbagai hama dari golongan serangga dan tungau diketahui banyak menyebabkan kerugian. Berbagai jenis patogen, antara lain virus, cendawan, dan bakteri juga diketahui menyerang dan menimbulkan kerugian ekonomi pada tanaman cabai. Serangan penyakit virus kuning keriting per Desember 2004 terjadi
pada luas lahan ± 984.6 ha (Sukamto 2005).
Kemampuan berbagai jenis PGPR untuk menginduksi ketahanan tanaman terhadap serangan patogen, dan juga kemampuannya untuk menghasilkan enzim kitinase memberikan peluang bagi kita untuk menjadikan PGPR sebagai salah satu alternatif untuk mengurangi kerugian akibat hama dan penyakit tanaman. Penggunaan PGPR tidak akan menimbulkan pengaruh negatif sebagaimana yang ditimbulkan oleh penggunaan pestisida yang tidak bijaksana, seperti arsenat, sulfur, dan dikloro-difeniltrikloretan (DDT) yang seringkali meninggalkan residu berbahaya yang mencemari lingkungan dan merupakan ancaman bagi konsumen.
Salah satu jenis hama yang paling merugikan pada tanaman cabai ialah kutu kebul Bemisia tabaci (Homoptera: Aleyrodidae). Kutu kebul merupakan hama yang dapat menyebabkan kerugian secara langsung serta menjadi vektor virus kuning keriting yang merupakan patogen tanaman cabai.
Plant Growth Promoting Rhizobacteria
(PGPR) merupakan rhizobakteri yang dapat meningkatkan pertumbuhan tanaman. PGPR telah diketahui berasosiasi dengan berbagai jenis tanaman. Pardede (2006) berhasil mengisolasi beberapa isolat PGPR dari perakaran tanaman cabai. Organisme ini juga dilaporkan dapat menginduksi ketahanan tanaman. Antibiotik yang diproduksi oleh PGPR mampu mencegah perkembangan patogen yang menyerang tanaman cabai (Tenuta 2005). Perlakuan PGPR pada cabai dapat meningkatkan kemampuan tanaman yang terinfeksi dalam mempertahankan bobot buah yang dihasilkan (Taufik et al. 2005). Samiyyapan (2003) melaporkan bahwa PGPR dapat menghasilkan senyawa antibiotik, asam sianida (HCN), siderofor dan enzim litik seperti kitinase.
Genus Pseudomonas, Bacillus,
Streptomyces, dan Agrobacterium adalah bakteri yang telah banyak diteliti dan dikembangkan sebagai biokontrol terhadap patogen tanaman (Samiyyapan 2003). Genus ini selain mampu menghambat perkembangan penyakit tanaman dengan menginduksi sistem resistensi, juga mampu memproduksi enzim kitinase. Kitinase yang dihasilkan mampu mengonversi kitin menjadi monomer atau
gen chi dari Aeromonas caviae dan ekspresinya pada tanaman kentang varietas Desiree sebagai usaha merakit tanaman yang resisten terhadap cendawan dan nematoda patogen. Ajit (2006) melaporkan bahwa
Pseudomonas fluoresens memiliki kemampuan menghasilkan kitinase ekstraseluler yang berperan sebagai
anti-Fusarium oxysporum, penyebab penyakit layu jaringan.
Kemampuan PGPR dalam memproduksi kitinase memberi peluang untuk dijadikan sebagai biokontrol, karena kitinase yang merupakan enzim pendegradasi kitin [polimer dari β(1,4)-N-asetil-D-glukosamin] berpotensi dalam menekan pertumbuhan dan perkembangan serangga. Pechenik (2005) melaporkan bahwa sebagian besar komponen eksoskeleton serangga merupakan polisakarida kitin yang berasosiasi dengan protein. Sampai saat ini, pemanfaatan kitinase dari PGPR untuk diaplikasikan secara langsung pada serangga belum pernah dilakukan.
Tujuan
Penelitian ini bertujuan untuk menapis PGPR kitinolitik yang berasal dari perakaran tanaman cabai dan menguji aktivitas hidrolisisnya terhadap kitin kutu kebul (Bemisia tabaci).
Waktu dan Tempat
BAHAN DAN METODE
Alat dan Bahan
Alat yang digunakan ialah spektrofotometer (Spectronic 20), alat sentrifugasi, inkubator, penangas air, mikroskop, kamera digital dan peralatan umum laboratorium mikrobiologi.
Bahan yang digunakan ialah isolat Plant Growth Promoting Rhizobacteria (PGPR) yang merupakan koleksi bersama laboratorium Mikrobiologi, Departemen Biologi, FMIPA dan laboratorium Proteksi Tanaman, Departemen Proteksi Tanaman, FAPERTA, IPB.
Metode
Peremajaan Isolat. Isolat yang berasal dari stok medium gliserol diremajakan dengan cara digores kuadran pada media nutrient agar (NA) dan diinkubasi pada suhu 37oC selama 2 hari. Koloni yang tumbuh diinokulasi pada medium agar – agar susu skim dan diinkubasi pada suhu 37oC selama 18 jam (Lampiran 1). Hal ini dilakukan untuk melihat zona bening yang terbentuk dan mengukur indeks proteolitik (IP). Indeks proteolitik diukur dengan cara mengukur diameter zona bening dikurangi diameter koloni, kemudian hasil yang diperoleh dibagi dengan diameter koloni. Setelah itu, koloni yang terbentuk digores kembali pada agar - agar miring NA untuk penyiapan inokulum.
Penapisan Isolat Kitinolitik. Sebanyak 49 isolat bakteri PGPR asal perakaran tanaman cabai ditumbuhkan secara serentak dengan metode gores kuadran pada media agar – agar kitin (Lampiran 1). Setelah diinkubasi selama 48 jam pada suhu 37oC, isolat yang dikelilingi oleh zona bening merupakan isolat yang menghasilkan enzim kitinase ekstraseluler (Lampiran 2).
Isolat yang mampu tumbuh pada media agar – agar kitin tersebut lalu diremajakan pada media baru dengan cara ditotol untuk diukur indeks kitinolitiknya (IK). Pengukuran IK sama seperti menghitung nilai IP. Dua isolat yang memiliki nilai tertinggi ditetapkan sebagai isolat terpilih untuk dikarakterisasi lebih lanjut produksi dan aktivitas enzim kitinasenya.
Penentuan Kurva Tumbuh dan Produksi Enzim. Dua isolat terpilih pada media produksi (Lampiran 1) dan diinkubasi pada suhu 37oC sambil dikocok dengan kecepatan 120 rpm. Setiap 12 jam dilakukan pengambilan kultur untuk dilakukan pengukuran absorbansi sel pada panjang
gelombang 600 nm yang berlangsung sampai dengan 96 jam. Kultur yang sama kemudian disentrifus selama 10 menit dengan kecepatan 8400 g (gravitasi). Supernatan mengandung enzim kitinase ekstrak kasarnya.
Uji Aktivitas Kitinase dan Penentuan Kadar Protein. Uji aktivitas kitinase dilakukan dengan metode Spindler (1997) (Lampiran 3). Sebanyak 300 l 0.3% koloidal kitin, 150 l bufer fosfat pH 7 (0.02 M) dan 150 l filtrat enzim dihomogenasi dalam tabung reaksi dan diinkubasi pada suhu 55oC selama 30 menit. Sedangkan pada kontrol, filtrat enzim dipisahkan dari substrat pada saat inkubasi. Setelah inkubasi, filtrat enzim yang terpisah disatukan, kemudian disentrifus selama 5 menit dengan kecepatan 8400 g (gravitasi). Filtrat yang diperoleh kemudian direaksikan dengan 500 l akuades dan 1000
l reagen Schales. Selanjutnya, campuran tersebut dipanaskan pada suhu 100oC dan diukur absorbansinya pada panjang gelombang 420 nm. Konsentrasi N-asetil glukosamin (GlcNac) dihitung berdasarkan kurva standar yang disiapkan dari larutan stok GlcNac 1000 ppm dengan konsentrasi larutan standar pada selang 0-500 ppm. Satu unit aktivitas enzim kitinase didefinisikan sebagai jumlah enzim yang membebaskan GlcNac sebesar 1 mol per menit pada kondisi analisis yang disebutkan.
Pengukuran kadar protein dilakukan dengan metode Bradford (1976) dengan menggunakan bovin serum albumin (BSA) sebagai standar (Lampiran 4).
Hasil perlakuan diinkubasi selama 3 hari pada suhu kamar (26oC). Selanjutnya dilakukan pengamatan mikroskopik dengan metode whole mount (preparat sediaan utuh) terhadap kemungkinan perubahan struktur morfologi eksoskeleton kutu kebul akibat perlakuan.
HASIL DAN PEMBAHASAN
Hasil
Indeks Proteolitik dan Indeks Kitinolitik. Peremajaan isolat pada media NA dilakukan terlebih dahulu agar diperoleh inokulum yang baik. Dari 49 isolat yang tersedia, dua puluh lima isolat diantaranya memiliki kemampuan kitinolitik (Lampiran 2). Dari 25 isolat kitinolitik diseleksi lima isolat yang memiliki kemampuan kitinolitik dan proteolitik paling baik secara kualitatif (Lampiran 5). Dua dari lima isolat kitinolitik yang memiliki IP dan IK paling besar yaitu isolat I.5 masing– masing sebesar 1.0 dan 0.94, sedangkan pada isolat I.21 masing– masing sebesar 1.21 dan 0.75 (Tabel 1).
Tabel 1 Indeks kitinolitik dan proteolitik dari lima isolat uji
Berdasarkan hasil pewarnaan Gram, kedua isolat kitinolitik memiliki ciri morfologi yang sama. Keduanya merupakan bakteri gram positif, batang dan membentuk endospora (Gambar 1). Ciri – ciri yang ada menunjukkan bahwa kedua isolat termasuk ke dalam genus
Bacillus.
Gambar 1 Hasil pewarnaan Gram isolat I.5 (a) dan I.21 (b) masing – masing dengan perbesaran mikroskop 1000x.
Penentuan Kurva Tumbuh dan Uji Aktivitas Enzim. Penentuan kurva tumbuh kedua isolat dan pengujian aktivitas kitinase dilakukan setiap 12 jam selama 96 jam. Pertumbuhan kedua isolat I.5 dan I.21 pada medium produksi pH 7, suhu 37oC menunjukkan bahwa pada jam ke-12 terjadi kenaikan angka rapat optis yang diukur pada panjang gelambang 600 nm.
Nilai log jumlah sel dari isolat I.5 tertinggi pada waktu inkubasi 12 jam sebesar 12.326 sel/ml dan mengalami fase stasioner pada jam ke-36, sedangkan aktivitas kitinase maksimum terjadi pada jam ke-36 yaitu sebesar 0.4785 U/ml dan aktivitas spesifiknya sebesar 0.110 U/mg protein kemudian menjadi tidak ada aktivitasnya setelah 72 jam (Gambar 2, Lampiran 6).
Log Jumlah Sel Aktivitas Spesifik Kitinase
Gambar 2 Pertumbuhan dan aktivitas spesifik enzim isolat I.5 pada medium produksi pH 7 dan suhu 37oC yang disuplementasi dengan koloidal kitin.
Nilai log jumlah sel isolat I.21 tertinggi pada waktu inkubasi 12 jam yaitu sebesar 14.409 sel/ml kemudian menurun menjadi 12.933 sel/ml setelah 96 jam.
Sedangkan nilai unit aktivitas enzim maksimum terjadi pada jam ke-36 sebesar 0.481 U/ml, aktivitas spesifik sebesar 0.114 U/mg protein dan mulai menurun setelah jam ke-60 (Gambar 3, Lampiran 6).
Log Jumlah Sel Aktivitas Spesifik Kitinase
Hasil perlakuan diinkubasi selama 3 hari pada suhu kamar (26oC). Selanjutnya dilakukan pengamatan mikroskopik dengan metode whole mount (preparat sediaan utuh) terhadap kemungkinan perubahan struktur morfologi eksoskeleton kutu kebul akibat perlakuan.
HASIL DAN PEMBAHASAN
Hasil
Indeks Proteolitik dan Indeks Kitinolitik. Peremajaan isolat pada media NA dilakukan terlebih dahulu agar diperoleh inokulum yang baik. Dari 49 isolat yang tersedia, dua puluh lima isolat diantaranya memiliki kemampuan kitinolitik (Lampiran 2). Dari 25 isolat kitinolitik diseleksi lima isolat yang memiliki kemampuan kitinolitik dan proteolitik paling baik secara kualitatif (Lampiran 5). Dua dari lima isolat kitinolitik yang memiliki IP dan IK paling besar yaitu isolat I.5 masing– masing sebesar 1.0 dan 0.94, sedangkan pada isolat I.21 masing– masing sebesar 1.21 dan 0.75 (Tabel 1).
Tabel 1 Indeks kitinolitik dan proteolitik dari lima isolat uji
Berdasarkan hasil pewarnaan Gram, kedua isolat kitinolitik memiliki ciri morfologi yang sama. Keduanya merupakan bakteri gram positif, batang dan membentuk endospora (Gambar 1). Ciri – ciri yang ada menunjukkan bahwa kedua isolat termasuk ke dalam genus
Bacillus.
Gambar 1 Hasil pewarnaan Gram isolat I.5 (a) dan I.21 (b) masing – masing dengan perbesaran mikroskop 1000x.
Penentuan Kurva Tumbuh dan Uji Aktivitas Enzim. Penentuan kurva tumbuh kedua isolat dan pengujian aktivitas kitinase dilakukan setiap 12 jam selama 96 jam. Pertumbuhan kedua isolat I.5 dan I.21 pada medium produksi pH 7, suhu 37oC menunjukkan bahwa pada jam ke-12 terjadi kenaikan angka rapat optis yang diukur pada panjang gelambang 600 nm.
Nilai log jumlah sel dari isolat I.5 tertinggi pada waktu inkubasi 12 jam sebesar 12.326 sel/ml dan mengalami fase stasioner pada jam ke-36, sedangkan aktivitas kitinase maksimum terjadi pada jam ke-36 yaitu sebesar 0.4785 U/ml dan aktivitas spesifiknya sebesar 0.110 U/mg protein kemudian menjadi tidak ada aktivitasnya setelah 72 jam (Gambar 2, Lampiran 6).
Log Jumlah Sel Aktivitas Spesifik Kitinase
Gambar 2 Pertumbuhan dan aktivitas spesifik enzim isolat I.5 pada medium produksi pH 7 dan suhu 37oC yang disuplementasi dengan koloidal kitin.
Nilai log jumlah sel isolat I.21 tertinggi pada waktu inkubasi 12 jam yaitu sebesar 14.409 sel/ml kemudian menurun menjadi 12.933 sel/ml setelah 96 jam.
Sedangkan nilai unit aktivitas enzim maksimum terjadi pada jam ke-36 sebesar 0.481 U/ml, aktivitas spesifik sebesar 0.114 U/mg protein dan mulai menurun setelah jam ke-60 (Gambar 3, Lampiran 6).
Log Jumlah Sel Aktivitas Spesifik Kitinase
Karakterisasi Kitinase. Kitinase ekstrak kasar dikarakterisasi berdasarkan pengaruh suhu dan pH (Lampiran 7 & 8). Kitinase isolat I.5 menunjukkan aktivitas tertinggi pada suhu 30oC sebesar 0.489 U/ml dengan aktivitas spesifik 0.113 U/mg protein (Gambar 4, Lampiran 7).
Gambar 4 Pengaruh suhu terhadap aktivitas kitinase isolat I.5 pada pH 7. Gambar 4 Pengaruh suhu terhadap aktivitas
kitinase isolat I.5 pada pH 7.
Kitinase isolat I.21 menunjukkan aktivitas tertinggi pada suhu 55oC yaitu sebesar 0.489 U/ml dengan aktivitas spesifik 0.116 U/mg protein (Gambar 5, Lampiran 7).
Kitinase isolat I.21 menunjukkan aktivitas tertinggi pada suhu 55
nase isolat I.5 memiliki aktivitas Kitinase isolat I.5 memiliki aktivitas Kiti
Gambar 5 Pengaruh suhu terhadap aktivitas kitinase isolat I.21 pada pH 7. Gambar 5 Pengaruh suhu terhadap aktivitas
kitinase isolat I.21 pada pH 7.
Kitinase isolat I.5 memiliki aktivitas tertinggi pada pH 7 dengan nilai 0.489 U/ml (0.113 U/mg) dan pH 6 dengan nilai 0.474 U/ml (0.082 U/mg) (Gambar 6, Lampiran 8). Kitinase isolat I.21 memiliki aktivitas tertinggi pada pH 7 dengan nilai sebesar 0.364 U/ml dan aktivitas spesifik 0.086 U/mg protein (Gambar 7, Lampiran 8).
Kitinase isolat I.5 memiliki aktivitas tertinggi pada pH 7 dengan nilai 0.489 U/ml (0.113 U/mg) dan pH 6 dengan nilai 0.474 U/ml (0.082 U/mg) (Gambar 6, Lampiran 8). Kitinase isolat I.21 memiliki aktivitas tertinggi pada pH 7 dengan nilai sebesar 0.364 U/ml dan aktivitas spesifik 0.086 U/mg protein (Gambar 7, Lampiran 8).
Gambar 6 Pengaruh pH terhadap aktivitas kitinase isolat I.5 pada suhu 30oC. Gambar 6 Pengaruh pH terhadap aktivitas
kitinase isolat I.5 pada suhu 30
Gambar 7 Pengaruh pH terhadap aktivitas kitinase isolat I.21 pada suhu 55oC.
Gambar 7 Pengaruh pH terhadap aktivitas kitinase isolat I.21 pada suhu 55
Uji Kitinase terhadap Kutu Kebul. Aplikasi kultur isolat dan kitinase ekstrak kasar pada kutu kebul menunjukkan adanya perbedaan apabila dibandingkan antara sampel kutu kebul yang diberi perlakuan dengan kontrol (tanpa perlakuan).
Uji Kitinase terhadap Kutu Kebul. Aplikasi kultur isolat dan kitinase ekstrak kasar pada kutu kebul menunjukkan adanya perbedaan apabila dibandingkan antara sampel kutu kebul yang diberi perlakuan dengan kontrol (tanpa perlakuan).
Perubahan struktur segmen – segmen bagian tubuh kutu kebul yang telah mendapat perlakuan dengan kitinase I.21 tampak tidak jelas (kabur), bahkan bagian abdomen kutu terlihat transparan yang menandakan bahwa isi dari abdomen kutu kebul telah keluar akibat rusaknya eksoskeleton serangga tersebut (Gambar 8). Demikian pula dengan segmen kutu kebul yang telah ditetesi kultur isolat I.5, I.21 dan enzim I.5 memperlihatkan jumlah segmen pada toraks dan abdomen yang kurang terlihat jelas bila dibandingkan dengan kontrol. Hal tersebut menunjukkan bahwa kultur sel maupun enzim ekstrak kasar dari isolat I.5 dan I.21 memiliki kemampuan dalam mendegradasi eksoskeleton kutu kebul (Bemisia tabaci) pada konsentrasi 0.001 mg/ml) dengan masa inkubasi tiga hari pada suhu kamar (26oC).
Perubahan struktur segmen – segmen bagian tubuh kutu kebul yang telah mendapat perlakuan dengan kitinase I.21 tampak tidak jelas (kabur), bahkan bagian abdomen kutu terlihat transparan yang menandakan bahwa isi dari abdomen kutu kebul telah keluar akibat rusaknya eksoskeleton serangga tersebut (Gambar 8). Demikian pula dengan segmen kutu kebul yang telah ditetesi kultur isolat I.5, I.21 dan enzim I.5 memperlihatkan jumlah segmen pada toraks dan abdomen yang kurang terlihat jelas bila dibandingkan dengan kontrol. Hal tersebut menunjukkan bahwa kultur sel maupun enzim ekstrak kasar dari isolat I.5 dan I.21 memiliki kemampuan dalam mendegradasi eksoskeleton kutu kebul (Bemisia tabaci) pada konsentrasi 0.001 mg/ml) dengan masa inkubasi tiga hari pada suhu kamar (26
Pembahasan Pembahasan
Isolat PGPR sebelum diinolkulasi ke dalam medium produksi, ditumbuhkan pada medium agar – agar susu skim dan agar - agar kitin untuk penghitungan indeks proteolitik dan kitinolitiknya. Isolat I.5 memiliki IP sebesar 1.0 dan I.21 sebesar 1.21. Perolehan nilai IP yang cukup tinggi memberikan informasi bahwa kedua isolat ini memiliki peluang dalam mendegradasi berbagai substrat yang mengandung protein. Indeks kitinolitik dari kedua isolat ini pun merupakan yang tertinggi daripada isolat lainnya dengan nilai IK I.5 sebesar 0.94 dan I.21 sebesar 0.75. Isolat PGPR sebelum diinolkulasi ke dalam medium produksi, ditumbuhkan pada medium agar – agar susu skim dan agar - agar kitin untuk penghitungan indeks proteolitik dan kitinolitiknya. Isolat I.5 memiliki IP sebesar 1.0 dan I.21 sebesar 1.21. Perolehan nilai IP yang cukup tinggi memberikan informasi bahwa kedua isolat ini memiliki peluang dalam mendegradasi berbagai substrat yang mengandung protein. Indeks kitinolitik dari kedua isolat ini pun merupakan yang tertinggi daripada isolat lainnya dengan nilai IK I.5 sebesar 0.94 dan I.21 sebesar 0.75.
o
C yaitu sebesar 0.489 U/ml dengan aktivitas spesifik 0.116 U/mg protein (Gambar 5, Lampiran 7).
Gambar 8 Pengamatan mikroskopik preparat kutu kebul kontrol/tanpa perlakuan (a), dengan pemberian kultur sel I.5 (b), enzim I.5 (c), kultur sel I.21 (d), dan enzim I.21 (e). Waktu inkubasi selama 3 hari, perlakuan pada suhu ruang (± 26oC) (perbesaran mikroskop 100X).
Meskipun IP dan IK dari kedua isolat merupakan nilai tertinggi, namun tidak selalu ada korelasi korelasi antara diameter zona bening pada medium agar – agar dengan
kemampuan mikroorganisme dalam memproduksi enzim dalam kultur cair. Hal ini disebabkan setiap enzim hanya dapat teraktivasi oleh adanya substrat yang spesifik (Lehninger 1994).
(a)
Berdasarkan hasil pewarnaan Gram, kedua isolat pilihan tersebut termasuk ke dalam genus Bacillus. Taufik et al. (2005) melaporkan adanya galur bakteri yang berasal dari genus Bacillus dan Pseudomonas yang biasa dimanfaatkan sebagai agen kontrol biologi karena kemampuannya dalam menghambat pertumbuhan penyakit tanaman dengan menginduksi sistem resistensi.
Aeromonas caviae WS7b dilaporkan mampu menghasilkan kitinase yang mampu menghambat perkembangan Fusarium oxysporum sehingga berpotensi sebagai antifungi (Wiendi et al. 2005).
(b)
(c)
Pada medium yang disuplementasi dengan koloidal kitin, kedua isolat mensekresikan protein yang memiliki aktivitas kitinase. Aktivitas kitinase isolat I.5 tertinggi diperoleh pada waktu produksi jam ke-36 yaitu pada saat densitas sel kedua isolat mengalami penurunan.
Suhu optimum aktivitas enzim I.5 yaitu pada 30oC dengan pH 7. Pada waktu produksi yang sama, aktivitas kitinase isolat I.21 juga mencapai nilai tertinggi dari hasil inkubasi enzim pada suhu 55oC dengan pH 7 selama 30 menit. Purwani (2002) melaporkan bahwa kitinase dari mikrob termofilik mempunyai ketahanan terhadap panas yang baik yaitu dari suhu 20-80oC. Barboza - Corona et al. (2003) melaporkan bahwa enzim kitinase asal B. thuringiensis memiliki kisaran pH optimum 4 – 9 serta suhu optimum 57.2oC saat diinkubasi pada pH 6. Selain itu, telah dilakukan pula purifikasi dan karakterisasi termostabil kitinase dari B. licheniformis yang memiliki kisaran pH luas dan stabil pada suhu tinggi (Toharisman 2004).
(d)
(e)
Eksoskeleton serangga tersusun atas tigalapisan meliputi lapisan pelindung yang
Kitinase adalah enzim yang menghidrolisis ikatan glikosidik β-1,4 senyawa kitin sehingga terbentuk oligomer kitin yang lebih sederhana dan lebih mudah didegradasi. Berdasarkan aktivitasnya kitinase dibedakan menjadi endokitinase dan eksokitinase. Sedangkan eksokitinase terbagi menjadi dua golongan, yaitu kitobiosidase dengan hasil potongan berupa dimer dan β-N-asetilglukosaminidase dengan hasil pemotongan berupa monomer N-asetil glukosamin (Cohen-Kupiec 1998).
Pengamatan mikroskopis terhadap sampel kutu kebul dewasa yang telah diberi perlakuan enzim dan kultur sel isolat yang dilakukan setelah hari ke-3 inkubasi menunjukkan adanya kerusakan pada bagian eksoskeletonnya. Hal ini menimbulkan dugaan bahwa enzim dan kultur sel bakteri isolat I.5 dan I.21 memiliki aktivitas kitinolitik yang mampu mendegradasi senyawa kitin penyusun eksoskeleton. Hasil degradasi eksoskeleton kutu kebul yang paling optimal teramati pada preparat kutu kebul yang telah diberi perlakuan enzim I.21. Hal ini menunjukkan bahwa kitin pada kutu kebul merupakan substrat yang dapat dihidrolisi oleh enzim I.21. Selain itu, aktivitas spesifik kitinase I.21 pada substrat koloidal kitin pun lebih tinggi dibandingkan kitinase 1.5 pada waktu inkubasi 36 jam.
s
Kutu kebul yang telah diinkubasi dengan diberi perlakuan kitinase pada suhu kamar (±26oC) menunjukkan adanya degradasi eksoskeleton kutu kebul. Kemampuan enzim I.21 dalam menghidrolisis kitin kutu kebul ini terjadi bukan pada suhu optimalnya (55oC), melainkan pada suhu kamar. Hal ini terjadi karena enzim kitinase I.21 dapat menghidrolisis kitin kutu kebul sebagai substrat yang spesifik pada suhu kamar. Vaaje-Kolstad (2005) melaporkan bahwa situs aktif pengikat protein pada polimer kitin (chitin-binding protein) mempengaruhi perubahan struktur kitin dan mampu meningkatkan penggunaan kitin sebagai substrat. Hal ini menguatkan alasan bahwa efektivitas kitinase dari kedua isolat dalam mendegradasi kitin kutu kebul terkait pada non-katalitik chitin- binding protein pada kutikula kutu kebul.
Aplikasi kitinase dalam pengendalian serangga dapat dilakukan dengan beberapa cara, diantaranya melalui kloning gen kitinase. Barboza-Corona et al. (2003) melaporkan kloning gen chi asal Bacillus thuringiensis
pada genom Eschericia coli, dapat mengekspresikan kitinase dengan aktivitas enzim dua kali lebih tinggi akibat adanya
sinergisme antara kitinase dengan endotoksin. Aplikasi kitinase juga dapat dilakukan secara tidak langsung melalui penaburan kitin ke tanah sekitar tanaman untuk menginduksi disekresikannya kitinase oleh mikrob kitinolitik (Metcalfe et al. 2002). Efektivitas pengendalian hama tanaman menggunakan gen kitinase akan sangat bergantung pada kesesuaian substrat yang akan didegradasi (Leger et al. 1996).
SIMPULAN
Isolat bakteri PGPR yang berasal dari perakaran cabai (isolat I.5 dan I.21) menghasilkan enzim kitinase ekstraseluler. Aktivitas enzim kitinase dari isolat bakteri I.5 optimum pada suhu 30oC dan pH 7, dan mampu bekerja pada kisaran pH 4–10. Sedangkan yang berasal dari isolat I.21 menunjukkan aktivitas optimum pada suhu 55oC dan pH 7, dan mampu bekerja pada kisaran pH 6–8. Enzim kitinase dari kedua isolat PGPR tersebut memiliki kemampuan merusak eksoskeleton kutu kebul.
SARAN
Perlu dilakukan penelitian lanjutan mengenai waktu inkubasi optimum saat kitinase maupun kultur sel I.21 mulai menguraikan kitin kutu kebul.
DAFTAR PUSTAKA
Ajit NS, Verma R, Shanmugam V. 2006. Extracellular chitinases of flourescent
Pseudomonads antifungal to Fusarium oxysporum f. sp. Dianthi causing carnation wilt. Curr Microbiol 52 (4): 310-6.
Barboza-Corona JE et al. 2003. Cloning, sequencing, and expression of the chitinase gene chi A74 from Bacillus thuringiensis. Appl Environ Microbiol 69: 1023-1029.
Bashan Y, De-Bashan LE. 2002. Protection of tomato seedlings against infection by
Pseudomonas syringae pv. tomato by using the plant growth-promoting bacterium Azospirillum brasilense. Appl Environ Microbiol 68(6):2637-43.
Kitinase adalah enzim yang menghidrolisis ikatan glikosidik β-1,4 senyawa kitin sehingga terbentuk oligomer kitin yang lebih sederhana dan lebih mudah didegradasi. Berdasarkan aktivitasnya kitinase dibedakan menjadi endokitinase dan eksokitinase. Sedangkan eksokitinase terbagi menjadi dua golongan, yaitu kitobiosidase dengan hasil potongan berupa dimer dan β-N-asetilglukosaminidase dengan hasil pemotongan berupa monomer N-asetil glukosamin (Cohen-Kupiec 1998).
Pengamatan mikroskopis terhadap sampel kutu kebul dewasa yang telah diberi perlakuan enzim dan kultur sel isolat yang dilakukan setelah hari ke-3 inkubasi menunjukkan adanya kerusakan pada bagian eksoskeletonnya. Hal ini menimbulkan dugaan bahwa enzim dan kultur sel bakteri isolat I.5 dan I.21 memiliki aktivitas kitinolitik yang mampu mendegradasi senyawa kitin penyusun eksoskeleton. Hasil degradasi eksoskeleton kutu kebul yang paling optimal teramati pada preparat kutu kebul yang telah diberi perlakuan enzim I.21. Hal ini menunjukkan bahwa kitin pada kutu kebul merupakan substrat yang dapat dihidrolisi oleh enzim I.21. Selain itu, aktivitas spesifik kitinase I.21 pada substrat koloidal kitin pun lebih tinggi dibandingkan kitinase 1.5 pada waktu inkubasi 36 jam.
s
Kutu kebul yang telah diinkubasi dengan diberi perlakuan kitinase pada suhu kamar (±26oC) menunjukkan adanya degradasi eksoskeleton kutu kebul. Kemampuan enzim I.21 dalam menghidrolisis kitin kutu kebul ini terjadi bukan pada suhu optimalnya (55oC), melainkan pada suhu kamar. Hal ini terjadi karena enzim kitinase I.21 dapat menghidrolisis kitin kutu kebul sebagai substrat yang spesifik pada suhu kamar. Vaaje-Kolstad (2005) melaporkan bahwa situs aktif pengikat protein pada polimer kitin (chitin-binding protein) mempengaruhi perubahan struktur kitin dan mampu meningkatkan penggunaan kitin sebagai substrat. Hal ini menguatkan alasan bahwa efektivitas kitinase dari kedua isolat dalam mendegradasi kitin kutu kebul terkait pada non-katalitik chitin- binding protein pada kutikula kutu kebul.
Aplikasi kitinase dalam pengendalian serangga dapat dilakukan dengan beberapa cara, diantaranya melalui kloning gen kitinase. Barboza-Corona et al. (2003) melaporkan kloning gen chi asal Bacillus thuringiensis
pada genom Eschericia coli, dapat mengekspresikan kitinase dengan aktivitas enzim dua kali lebih tinggi akibat adanya
sinergisme antara kitinase dengan endotoksin. Aplikasi kitinase juga dapat dilakukan secara tidak langsung melalui penaburan kitin ke tanah sekitar tanaman untuk menginduksi disekresikannya kitinase oleh mikrob kitinolitik (Metcalfe et al. 2002). Efektivitas pengendalian hama tanaman menggunakan gen kitinase akan sangat bergantung pada kesesuaian substrat yang akan didegradasi (Leger et al. 1996).
SIMPULAN
Isolat bakteri PGPR yang berasal dari perakaran cabai (isolat I.5 dan I.21) menghasilkan enzim kitinase ekstraseluler. Aktivitas enzim kitinase dari isolat bakteri I.5 optimum pada suhu 30oC dan pH 7, dan mampu bekerja pada kisaran pH 4–10. Sedangkan yang berasal dari isolat I.21 menunjukkan aktivitas optimum pada suhu 55oC dan pH 7, dan mampu bekerja pada kisaran pH 6–8. Enzim kitinase dari kedua isolat PGPR tersebut memiliki kemampuan merusak eksoskeleton kutu kebul.
SARAN
Perlu dilakukan penelitian lanjutan mengenai waktu inkubasi optimum saat kitinase maupun kultur sel I.21 mulai menguraikan kitin kutu kebul.
DAFTAR PUSTAKA
Ajit NS, Verma R, Shanmugam V. 2006. Extracellular chitinases of flourescent
Pseudomonads antifungal to Fusarium oxysporum f. sp. Dianthi causing carnation wilt. Curr Microbiol 52 (4): 310-6.
Barboza-Corona JE et al. 2003. Cloning, sequencing, and expression of the chitinase gene chi A74 from Bacillus thuringiensis. Appl Environ Microbiol 69: 1023-1029.
Bashan Y, De-Bashan LE. 2002. Protection of tomato seedlings against infection by
Pseudomonas syringae pv. tomato by using the plant growth-promoting bacterium Azospirillum brasilense. Appl Environ Microbiol 68(6):2637-43.